Wärmelehre - TU Chemnitz
Werbung

Vorlesungsskript
GRUNDKURS EXPERIMENTALPHYSIK
Prof. Dr. Frank Richter
Skript angefertigt von cand. phys. Stefan Welzel
Technische Universität Chemnitz
Fakultät für Naturwissenschaften
Institut für Physik
Vorwort
VORWORT
Das vorliegende Skript basiert auf der Vorlesung in Experimentalphysik für Studenten des 1. und 2. Semesters des Diplomstudiengangs Physik. Die Vorlesung ist, anschließend an eine Einleitung, in vier große Teilbereiche gegliedert:
•
Mechanik
•
Thermodynamik
•
Elektrizitätslehre
•
Optik
Zur besseren Orientierung finden sich am Rand folgende Symbole:
!
Definitionen/Merksätze
n
Beispiele
u
Kommentare/Interpretationen/Diskussionen
SI
Definition von Einheiten nach dem SI-System
(..)
Gleichungsnummerierung
Nebenrechnung
Wird im Rahmen der Erläuterungen auf eine Gleichung aus einem vorangegangenen
Kapitel Bezug genommen, so geschieht dies durch Voranstellen der jeweiligen Kapitelnummer vor die entsprechende Gleichungsnummer (z.B. verweist die Angabe
„(11 - 6)“ auf Gl. (6) in Kapitel 11)
Desweiteren werden im Text wichtige physikalische Grundbegriffe gesondert hervorgehoben, die dann auch im Sachregister aufgelistet sind.
Weitere im Text verwendete Symbole sind:
⇒
<..>
{..}
Schlussfolgerungen
Verweis auf andere Kapitel
Quellenangabe
I
Inhaltsverzeichnis
INHALTSVERZEICHNIS
VORWORT .......................................................................................................... I
INHALTSVERZEICHNIS .......................................................................................II
C.
WÄRMELEHRE ......................................................................................... 1
19.
Wärme und Temperatur....................................................................................................2
19.1.
19.2.
19.3.
19.4.
Einleitung .............................................................................................................................2
Wärmeausdehnung...............................................................................................................2
Freiheitsgrade.......................................................................................................................3
Spezifische Wärmekapazität ................................................................................................4
20.
Kinetische Gastheorie ........................................................................................................6
20.1.
20.2.
20.3.
20.4.
20.5.
20.6.
Gasdruck und Zustandsgleichung.........................................................................................6
Innere Energie; Erster Hauptsatz der Wärmelehre...............................................................8
CV und CP bei Gasen............................................................................................................9
Adiabatische Zustandsänderungen.....................................................................................10
Die BOLTZMANNsche Energieverteilung ............................................................................12
Die MAXWELLsche Geschwindigkeitsverteilung................................................................13
21.
Wärmekraftmaschinen....................................................................................................15
21.1.
21.2.
21.3.
21.4.
Einleitung ...........................................................................................................................15
Der Wirkungsgrad ..............................................................................................................16
Der Heißluftmotor (STIRLING-Maschine)...........................................................................16
Die CARNOT-Maschine.......................................................................................................19
22.
Entropie; Zweiter Hauptsatz der Wärmelehre .............................................................21
22.1.
22.2.
22.3.
22.4.
Statistische Deutung der Entropie ......................................................................................21
Entropie und Wärmeenergie ...............................................................................................23
Der Zweite Hauptsatz der Wärmelehre ..............................................................................25
Das thermodynamische Gleichgewicht ..............................................................................26
23.
Aggregatzustände .............................................................................................................28
23.1. Flüssigkeit unf Dampf........................................................................................................28
23.2. Koexistenz dreier Phasen...................................................................................................31
23.3. Die VAN- DER-WAALS sche Gasgleichung...........................................................................33
24.
Transportprozesse............................................................................................................35
24.1. Diffusion.............................................................................................................................35
24.2. Wärmeleitung.....................................................................................................................36
24.3. Komplexe Wärmetransportprobleme .................................................................................37
II
Inhaltsverzeichnis
LITERATURLISTE ............................................................................................. IV
QUELLENVERZEICHNIS ......................................................................................V
SACHREGISTER................................................................................................ VI
III
Wärmelehre
C. WÄRMELEHRE
Wärmelehre – Wärme und Temperatur
19.
Wärme und Temperatur
19.1. Einleitung
−
Wärme ist die ungeordnete Bewegung der Teilchen (in Gasen, Flüssigkeiten
oder im Festkörper).
Je nach den gegebenen Bedingungen ist diese Bewegung mehr oder weniger
intensiv.
!
−
Wir beschreiben die „Intensität der ungeordneten Bewegung“ über die mittlere
Translationsenergie der Teilchen und definieren so die Temperatur:
!
m 2 3
v = k BT
2
2
kB ... BOLTZMANN-Konstante (kB = 1,381 ž 10-23 JžK-1)
Wkin =
(1)
Maßeinheit für die Temperatur ist das Kelvin: [T] = K
SI
−
Aus Gl. (1) folgt die Existenz eines nicht unterschreitbaren Nullpunkts der
Temperatur.
!
−
Stoffmengen ν werden meist in Mol gemessen: [ν] = Mol
SI
1 Mol ist die Menge eines Stoffes, die genau so viele Teilchen (Atome, Moleküle) enthält wie 12 g des Kohlenstoffnuklids 12 C. Dies sind:
!
NL = 6,022134 ž 1023 Teilchen
NL (N A) ist die LOSCHMIDT-Zahl (Avogadro’s number).
19.2. Wärmeausdehnung
−
Gase, Flüssigkeiten und Festkörper dehnen sich bei Temperaturerhöhung aus
bzw. es steigt der Druck, wenn das Volumen konstant gehalten wird.
−
Für Festkörper gilt näherungsweise lineare Ausdehnung:
l = l o (1 + α ⋅ ∆T)
mit
!
(2)
α ... linearer Ausdehnungskoeffizient
Beispiele: Glas
Eisen
Kupfer
α = (5 ... 10) ž 10-6 K-1
α=
12,0 ž 10-6 K-1
α=
16,7 ž 10-6 K-1
bei 100 °C
n
2
Wärmelehre – Wärme und Temperatur
u
Kommentar:
·
·
·
−
Streng genommen ist α = α(T), oft ist jedoch die lineare Näherung ganz gut.
10 ž 10-6 ist eine gute „Hausnummer“ für viele feste Stoffe ⇒ für ∆T = 100 K
∆l
beträgt
= 10 −3 ⇒ merkliche Ausdehnung ∆l von 1 cm pro l = 10 m
l
Beispiele: Bimetallstreifen, Bahnschienen, Dehnungsbogen
Für Flüssigkeiten gilt mit Gl. (2):
V = l (∆T) 3 = l 30 (1 + α ⋅ ∆T ) 3 ≈ l 30 (1 + 3α ⋅ ∆T)
(α 2 , α3 ≈ 0)
V = Vo (1 + γ ⋅ ∆T)
mit
(3)
γ = 3α ... Raumausdehnungskoeffizient
Beispiele: Wasser
Ethanol
γ = 207 ž 10-6 K-1
γ = 1100 ž 10-6 K-1
α ≈ 70 ž 10-6 K-1
α ≈ 370 ž 10-6 K-1
bei 18 °C
⇒ Wärmeausdehnung bei Flüssigkeiten ist um eine Größenordnung größer!
Beispiel: Flüssigkeitsthermometer ⇒ relativ großer Effekt der Flüssigkeitsausdehnung,
n
!
n
da die der Röhre viel geringer ist.
19.3. Freiheitsgrade
−
−
Moleküle können neben der Translationsenergie auch andere Formen der Bewegungsenergie haben:
·
Rotationsenergie
·
Schwingungsenergie
!
wichtig: 2-atomige Gase (H2 , O2 , N2 , ...) haben 5 Freiheitsgrade, und zwar
3 Freiheitsgrade der Translation + 2 Freiheitsgrade der Rotation.
3
Wärmelehre – Wärme und Temperatur
−
Gleichverteilungssatz: Auf jeden Freiheitsgrad eines Moleküls entfällt im thermischen Gleichgewicht im Mittel die gleiche Energie, und zwar
WFG
⇒
−
=
WTrans =
1
k BT
2
3
k B T , da 3 Freiheitsgrade der Translation
2
!
(4)
≡ Gl. (1)!
Die gesamte Bewegungsenergie eines 2-atomigen Moleküls (bei nicht zu hohen Tempe5
raturen, wenn noch keine Vibration angeregt wird) ist aber gleich k B T , da auch noch
2
zwei Freiheitsgrade der Rotation existieren! Wir werden darauf noch zurückkommen.
19.4. Spezifische Wärmekapazität
−
Erwärmung eines Körpers um ∆T erfordert die Zufuhr einer Energie ∆W
∆W
lt. Gl. (4)
Teilchen ⋅ Freiheitsg rad
ã
ä
M
1
∆W =
⋅ f ⋅ k B ⋅ ∆T
m
2
M ... Masse des Körpers,
m ... Masse eines Teilchens,
f ... Zahl der Freiheitsgrade.
Zahl der Teilchen N
mit
−
Wir definieren die Wärmekapazität des Körpers:
⇒
−
C =
∆W
1
M
1
= N ⋅ f ⋅ kB = ⋅ f ⋅ kB
∆T
2
m
2
(6)
spezifische Wärme(kapazität)
⇒
−
(5)
c ≡
C 1 f ⋅ kB
= ⋅
M 2 m
Kommentar:
·
C ist eine Eigenschaft des Körpers, also große Masse bedeutet große Wärmekapazität (Beispiel: thermische Trägheit).
·
c ist eine Materialeigenschaft. Materialien mit kleinen Atom- bzw. Molekülmassen haben großes c.
(„Weil es eben auf die Anzahl der Teilchen ankommt“)
·
In jedem Fall gilt: C, c ~ f!
·
Flüssiges Wasser hat hohe spezifische Wärme(kapazität) (großes f, kleines m)!
(7)
u
!
!
4
Wärmelehre – Wärme und Temperatur
−
Es ist zweckmäßig (erst recht bei Gasen!), C und c auf die Stoffmenge zu beziehen. Aus Gl. (6) folgt mit N = NL die molare Wärmekapazität
1
C mol = N L ⋅ f ⋅ k B
2
å
æ
[ C]
[Atome ]
Mol
Mol
⇒
(8)
−
Bei Gasen ist zu unterscheiden:
·
spezifische Wärmekapazität bei konstantem Volumen: cV
·
spezifische Wärmekapazität bei konstantem Druck:
cp
−
cV ist die bisher besprochene spezifische Wärmekapazität („Erhöhung der Energie der Einzelteilchen“).
−
cp enthält zusätzlich die vom Gas bei der Ausdehnung geleistete Arbeit.
⇒ cp > cV
!
−
Beispiele für θ = 0 °C (C in J ž (Mol ž K)-1):
n
f
Gas
Cmol, p
Cmol, V
3
He
Ar
O2
N2
H2
N2O
20,9
20,7
29,3
29,0
28,5
34,1
12,6
12,4
21,0
20,7
20,2
26,5
5
6
Cmol,p
C mol,V
1,66
1,67
1,40
1,40
1,41
1,29
1
C mol,V
2
f
4,2
4,1
4,2
4,1
4,0
4,4
Cmol, p - Cmol, V3
8,3
8,3
8,3
8,3
8,3
7,6
(Bei f wurde neben der Translation nur die Rotation berücksichtigt, da dort laut Quantenmechanik die typischen Anregungsenergien ∆E ≈ 0,001 eV sind. Die Anregungsenergien der
Schwingungszustände dagegen sind mit ∆E ≈ 0,1 eV so groß, dass sie bei 0 °C praktisch nicht
angeregt werden. Ebenso ist bei der Rotation um die Molekülachse das Trägheitsmoment so
klein, dass die Energie ∆E ~ J-1 viel zu groß ist, um angeregt zu werden. Daher haben die
zweiatomigen Moleküle nur zwei Rotationsfreiheitsgrade, das N2 O aber drei.)
1
2
3
Cmol, p /Cmol, V ist der später eingeführte Adiabatenexponent γ (vgl. <20.3.>).
Cmol, V ž f-1 = 1/2žNA žkB = 1/2žR (lt. Gl. (6) bzw. (8), vgl. <20.1.>)
Cmol, p - C mol, V ≈ R (vgl. <20.3.>)
5
Wärmelehre – Kinetische Gastheorie
20.
Kinetische Gastheorie
... behandelt ideale Gase, d.h., die Gasteilchen verhalten sich wie elastische Kugeln
mit vernachlässigbarem Eigenvolumen.
!
20.1. Gasdruck und Zustandsgleichung
−
Teilchen werden an den Wänden reflektiert:
−
Aus den beiden Gleichungen
∆p
∆t
F
p=
A
F=
(2. NEWTONsches Axiom)
(3 - 6)
(statischer Druck)
(12 - 1)
folgt für die physikalische Interpretation des Drucks:
⇒
−
Druck =
an die Wand abgegebene r Im puls
∆p
=
Zeit ⋅ Wandfläche
∆t ⋅ A
(1)
vereinfachte Herleitung von Gl. (1):
gegeben:
·
N Teilchen im Volumen V ⇒ Teilchenzahldichte n =
·
Teilchen haben mittlere Geschwindigkeit v
·
je
N
V
(2)
1
der Teilchen bewegt sich in jede "Hauptrichtung":
6
Wir betrachten das Volumen der Dicke v ž dt vor der Wandfläche A:
⇒ N = n ⋅ A ⋅ v ⋅ dt Teilchen sind im Volumen,
1
⋅ n ⋅ A ⋅ v ⋅ dt auf die Wand
6
zu und erreichen diese.
davon fliegen
⇒
1
nAvdt ⋅ 2mv
6
â
â
Teilchenzahl ∆p für ein Teilchen
dp =
(3)
6
Wärmelehre – Kinetische Gastheorie
Aus Gl. (3) folgt für den Druck p (Vorsicht, gleiches Symbol wie Impuls!):
⇒
−
1
⋅ n ⋅ A ⋅ v 2 ⋅ m ⋅ dt
dp
1
p=
=3
= nmv 2
A ⋅ dt
A ⋅ dt
3
Mit Gl. (19 - 1) können wir Gl. (4) auch schreiben als
p = n ⋅kB ⋅T
−
Jetzt führen wir wieder n =
(5)
N
ein und erhalten
V
p ⋅ V = N⋅ kB ⋅ T
−
(4)
(6)
Die Gasmenge N entspreche ν Mol: N = ν ⋅ N L ; damit folgt aus Gl. (6)
p ⋅ V = ν ⋅ NL ⋅ k B ⋅ T
−
Wir führen ein
R ≡ N L ⋅ k B = 8,31
J
K ⋅ Mol
und erhalten
mit
−
p ⋅ V = ν ⋅ R ⋅T
ν ... Stoffmenge und
R ... allgemeine Gaskonstante.
(7)
u
Kommentar:
·
Gl. (5) und Gl. (7) stellen die Zustandsgleichungen idealer Gase dar, in
atomistischer und in makroskopischer Form.
·
Daraus folgen das Gesetz von BOYLE-MARIOTTE (vgl. <13.1.>)
p ⋅ V = const .
( T = const . )
sowie die Gesetze von GAY-LUSSAC
bzw.
p~T
V~T
( V = const . )
( p = const . )
7
Wärmelehre – Kinetische Gastheorie
20.2. Innere Energie; Erster Hauptsatz der Wärmelehre
−
gegeben: thermodynamisches System
Kessel mit Inhalt (z.B. Wasser + Dampf)
−
Der Kessel hat als Ganzes bestimmte Energieanteile, z. B.
·
·
Epot
Ekin (infolge der Bewegung des Kessel als Ganzes!)
⇒ äußere Energien.
−
Wir betrachten nun die innere Energie U des Systems mit folgenden Anteilen:
·
·
(·
−
ungeordnete Bewegungsenergie der Teilchen (sogenannte thermische Energie)
entsprechend den gegebenen Freiheitsgraden (vgl. <19.1.> und <19.3.>)
Energieanteile, die mit der chemischen Bindung oder dem Aggregatzustand
zusammenhängen
Energie der Bindungen innerhalb der Atome und der Kerne)
Die innere Energie U kann sowohl durch den Austausch von Arbeit als auch
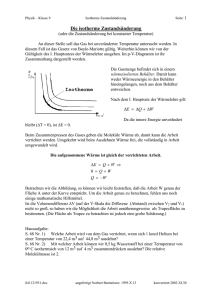
den von Wärme verändert werden:
∆U = ∆Q + ∆W
Also: Jede Zu-/Abfuhr von Arbeit oder Wärme findet sich entsprechend in U
wieder. Es wird keine Energie erzeugt oder vernichtet.
!
(8)
!
Dies ist der 1. Hauptsatz der Thermodynamik (Energieerhaltungssatz). Daraus
folgt die Unmöglichkeit des Perpetuum mobiles 1. Art.
−
U ist eine Zustandsgröße, d.h., wenn man einer bestimmten Stoffmenge (Kesselinhalt) ein bestimmtes Volumen V und eine bestimmte Temperatur T gibt, erhält man einen bestimmten Druck p und eine bestimmte innere Energie U.
Jeder Zustand {p, V, T} 1 hat eine eindeutig bestimmte innere Energie U, unabhängig davon, wie der Zustand erreicht wurde.
−
!
Anders verhält es sich bei ∆Q und ∆W: Dies sind lediglich „unterschiedliche
Wege, um die innere Energie U zu ändern“.
Illustration:
Es kann passieren, dass man Wärmeenergie in ein System steckt und sich dies
vollständig in einer Erhöhung des Wärmeinhaltes des Systems (d.h. in einer
Temperatur-Erhöhung) widerspiegelt → z.B. Topf mit Wasser, Fall a).
1
Von diesen Größen sind zwei unabhängig voneinander, die dritte ergibt sich durch die Zustandsgleichung.
8
Wärmelehre – Kinetische Gastheorie
Es ist aber auch möglich, dass man Wärmeenergie zuführt, ohne dass sich die
Temperatur des Systems erhöht → z.B. Topf mit Eiswasser, Fall b).
a)
b)
Deshalb ist die Wärme keine Zustandsgröße! Was sich in beiden Fällen geändert
hat, ist die innere Energie, entweder in Form von thermischer Energie (Fall a),
oder durch eine Änderung der Bindungsenergie (Schmelzen des Eises, Fall b).
−
Man weiß seit langem, dass Wärme kein Stoff ist. Oft geht man jedoch formal
so vor, als ob sie einer wäre, z. B. bei der Behandlung der Wärmeleitung. Dieses
Vorgehen ist streng genommen nicht korrekt, weil es nicht immer zulässig ist.
Dort, wo es zulässig ist, ist es aber sehr nützlich.
−
Wir betrachten Gl. (8) für den Fall des idealen Gases. Beim idealen Gas besteht
die einzige Möglichkeit, die innere Energie U zu beeinflussen, darin, die Bewegungsenergie der Gasteilchen zu verändern. Also gilt
∆U = C V ⋅ ∆T
Daraus folgt
C V ⋅ ∆ T = ∆ Q − p∆ V 1
(9)
20.3. CV und Cp bei Gasen
−
Wir betrachten ν Mol eines Gases. Diese haben eine Wärmekapazität CV von
C V = ν ⋅ C mol,V = ν ⋅
⇒
CV = ν ⋅ R ⋅
1
⋅ f ⋅ NA ⋅ k B
2
â
≡R
f
2
(19 - 8‘)
(10)
bei V = const. ergibt sich eine Erwärmungsarbeit ∆Qe von
⇒
1
∆Q e = ν ⋅ R ⋅
f
⋅ ∆T
2
(11)
Zum Vorzeichen: Bei Komprimierung ist ∆V < 0, entsprechend ∆W > 0 , d. h. zunehmendem U!
9
Wärmelehre – Kinetische Gastheorie
−
Wenn p = const. sein soll, muss neben der Erwärmungsarbeit noch die Druckarbeit durch Wärmezufuhr aufgebracht werden:
∆Q d = p ⋅ ∆V
Aus der Zustandsgleichung des idealen Gases (Gl. (7)) folgt:
⇒
⇒
dV
d νRT ν R V
=
=
=
dT
dT p p
T
∆V
V
=
∆T
T
V
∆V = ⋅ ∆T
T
Somit ergibt sich für die Druckarbeit:
∆Q d = p ⋅ V ⋅
∆T
∆T
= ν RT ⋅
T
T
∆Q d = νR∆T
−
(12)
Für die Gesamtarbeit erhält man mit Gl. (11) und (12):
= ∆Q e + ∆Q d
∆Q
f
C p ⋅ ∆T = ν R ⋅ ∆T + νR ⋅ ∆T
2
â
CV
−
(13)
Aus Gl. (13) folgt zweierlei:
a) Kürzen der ∆T
⇒
Cp − CV
= ν⋅R
(Betrachtung von ν Mol)
bzw.
C mol,p − C mol,V = R
(Betrachtung von 1 Mol)
b) Zusammenfassen der
rechten Seite der
Gleichung
−
⇒
f
C p = + 1 ⋅ νR
2
(14)
(15)
Mit Hilfe von Gl. (10) und (15) folgt die Definition des Adiabatenexponenten:
γ≡
Cp
CV
=
f+2
f
(16)
Gl. (16) wird von realen Gasen recht gut erfüllt (vgl. Tabelle in <19.4.>)!
10
Wärmelehre – Kinetische Gastheorie
20.4. Adiabatische Zustandsänderungen
−
!
... laufen ohne Wärmeaustausch mit der Umgebung ab (∆Q = 0)
damit folgt aus Gl. (9):
⇒
C V ⋅ ∆T
= − p∆V
Wird nun CV mittels Gl. (10) und p mit Gl. (7) ausgedrückt, so erhält man:
f
νRT
ν R ∆T = −
∆V
2
V
⇒
⇒
∆T
T
2 ∆V
=− ⋅
f V
dT
T
= −( γ − 1)∫
∫
2
= γ −1
f
(lt. Gl. (16))
dV
V
nach Integration ergibt sich:
ln T + ( γ − 1) ln V = const .
T ⋅ V γ −1
= const .
(17a)
Umformung mit Gl. (7) ergibt:
p ⋅Vγ
= const .
(17b)
Dies sind die POISSON-Gleichungen, die adiabatische Prozesse in idealen Gasen
beschreiben.
−
Zustandsänderungen im p-V-Diagramm:
a) Adiabate
(lt. Gl.(17))
b) Isothermen
(lt. Gl. (7))
c) Isobare
(p = const.)
d) Isochore
(V = const)
11
Wärmelehre – Kinetische Gastheorie
n
Beispiel:
Adiabatische Zustandsänderung (entlang der Kurve a)): Bei der Komprimierung von V2
auf V1 erwärmt sich das Gas wegen ∆Q = 0 von T2 auf T3 !
−
Adiabatische Vorgänge treten auf bei nicht ausreichender Wärmeleitfähigkeit der Luft,
·
z.B. beim Einströmen in ein Tiefdruckgebiet oder
·
bei der Schallausbreitung, wo die Wärmeabfuhr nicht schnell genug ist, so
dass die Zustandsänderungen praktisch adiabatisch verlaufen.
Deshalb muss Gl. (16 - 17‘) noch hinsichtlich des adiabatischen Charakters
der Zustandsänderung korrigiert werden. ⇒ Vollkommen exakt ist
v Ph =
γ ⋅p
,
ρ
(16 - 17‘‘)
anderenfalls beträgt die Abweichung in Luft
γ = 1,4 ≈ 1,18 , also 15 - 20 %!)
20.5. Die BOLTZMANNsche Energieverteilung
−
Die barometrische Höhenformel war
p (h ) = p o ⋅ e
−
ρ0
⋅g⋅h
po
(Die Verwendung des Ausdrucks
−
(13 - 6)
ρ0
po
in dieser Formel war nur ein Notbehelf!)
Wir nehmen jetzt die Zustandsgleichung des idealen Gases
p
= n ⋅ kB ⋅T
p
=
ρ
⋅ kB ⋅ T
m
m
ρ
=
k BT
p
n=
⋅
ρ
m
mit m...Masse eines Gasteilchens
(5)
m
pk B T
⋅g ⋅ h
Nach der Multiplikation mit g ž h erhält man einen allgemeingültigen Ausdruck
ρ
ρ
für , der natürlich auch an der Erdoberfläche, d. h. für 0 , gilt:
p0
p
ρ
m ⋅g ⋅ h
= 0 ⋅g ⋅ h
p0
k BT
(18)
12
Wärmelehre – Kinetische Gastheorie
−
Mit Gl. (18) können wir Gl. (13 - 6) umformen zu
p (h ) = p o ⋅ e
−
m⋅g ⋅h
k BT
= po ⋅e
−
E pot
k BT
Diskussion:
Die Drücke in verschiedenen Höhen - und damit wegen Gl. (5) auch die Teilchenzahldichten - hängen exponentiell von der potentiellen Energie Epot der Gasteilchen
in diesen Höhen ab!
−
Die barometrische Höhenformel ist ein Beispiel für das Wirken des Verteilungssatzes von BOLTZMANN:
Wenn ein System eine Reihe von Zuständen mit den Energien W1 , W2 , ... annehmen kann, dann ist die Wahrscheinlichkeit, dass sich das System im Zustand i befindet
−
mit
Wi
k BT
pi = gi ⋅ e
gi ... statistisches Gewicht des Zustandes i1
Diskussion:
Höherenergetische Zustände werden ungern eingenommen (exponentieller Abfall!), wobei eine Temperatur-Erhöhung dem entgegenwirkt.
(19)
u
!
!
(20)
u
!
Der BOLTZMANNsche Verteilungssatz ist eine sehr allgemeingültige Beziehung,
er gilt z.B. auch für die Besetzung von Energiezuständen in Atomen und Molekülen.
20.6. Die MAXWELLsche Geschwindigkeitsverteilung
−
1
... ist die Geschwindigkeitsverteilung der Teilchen eines idealen Gases. Sie ist
so beschaffen, dass hinsichtlich der Teilchenenergien - es gibt ja nur die kinetische Energie - die BOLTZMANN-Verteilung eingehalten wird.
!
Für die barometrische Höhenformel ist g i bedeutungslos!
13
Wärmelehre – Kinetische Gastheorie
Es ist:
dN( v1 ) = W ( v1 ) ⋅ N ⋅ dv
wobei dN(v1 ) den Bruchteil der Teilchen mit der Geschwindigkeit im Intervall
(v1 , v1 +dv) und W(v1 ) die Wahrscheinlichkeit, dass das Teilchen v = v1 besitzt,
darstellen.
−
Wie erhält man die Verteilung? Es gilt, wie gesagt, die BOLTZMANN-Verteilung:
−
dN( v) = N ⋅ c ⋅ e
m
v2
2
k BT
(21)
dv
wobei N die Gesamtzahl der Gasteilchen und c ⋅ e ... ≡ W ( v) ist.
Jedoch ist hier das statistische Gewicht der einzelnen v-Intervalle zu beachten:
Es lässt sich zeigen, dass es viel mehr Möglichkeiten gibt, eine höhere Geschwindigkeit einzunehmen, als eine niedrige:
!
⇒ In c steckt das statistische Gewicht des einzelnen Geschwindigkeitsintervalls. Es ist ~ 4πv2 , da das Intervall (v, v+dv) eine Kugelschale im dreid imensionalen v-Raum darstellt. Damit erhalten wir für die MAXWELLsche
Geschwindigkeitsverteilung
3
mv2
−
m 2
⋅ 4πv 2 ⋅ e 2 k B T ⋅ dv
dN( v) = N ⋅
2π k B T
(22)
14
Wärmelehre – Wärmekraftmaschinen
21.
Wärmekraftmaschinen
21.1. Einleitung
−
Wärmekraftmaschinen (Motoren, Gasturbinen) wandeln Wärmeenergie in mechanische Energie um. Analoge Maschinen („Kraftwärmemaschinen“) verwandeln mechanische Energie in Wärmeenergie.
Wärmekraftmaschine:
Kraftwärmemaschine:
Wärme wird dem
heißen Medium
entzogen
und
dem
kühleren
zugeführt.
Wärme wird dem
kalten Reservoir
entnommen und
dem heißen zugeführt.
Dabei wird mechanische Energie W abgegeben.
Dies
geschieht
unter
Aufwendung einer mechanischen oder
elektrischen Energiemenge W.
Definition des
Wirkungsgrads:
Definition der
Leistungszi ffern:1
W = η ⋅ ∆Q 2
(η ≤ 1)
(1)
η ... Wirkungsgrad
1
≡ ε′ ⋅ W
η
1
∆Q1 = W − 1 ≡ ε ⋅ W
η
∆Q 2 = W ⋅
1
(ε‘ ≥ 1)
(2)
(ε ≥ 1)
(3)
ε, ε‘ ... Leistungsziffern
n
Beispiele:
Kühlschrank
Wärmepumpe
T2 -Medium: Verbrennungs- Heißgas/
gemisch
-dampf
Wärmetauscher
Heizsystem
T1 -Medium: Auspuffgas
Kühlraum
Wasser/Luft/
Boden
Name
!
Verbrennungs- Gas-/Dampfmotor
turbine
Kaltgas/
-dampf
Gl. (2) und (3) ergeben sich durch einfache Umstellung von Gl. (1)
15
Wärmelehre – Wärmekraftmaschinen
21.2. Der Wirkungsgrad
−
Beispiel: Verbrennungsmotor
Bei T2 hat jedes Gasteilchen im Mittel eine Wärmeenergie
1
Wkin = f ⋅ ⋅ k B T2
2
n
(4)
Die als „Auspuffgas“ den Motor bei T1 verlassenden Teilchen haben eine Energie
1
Wkin = f ⋅ ⋅ k B T1
2
(5)
⇒ maximal in mechanische Arbeit umwandelbar ist
1
W = f ⋅ ⋅ k B ( T2 − T1 )
2
Damit ergibt sich der (ideale) Wirkungsgrad zu
⇒
ηid =
T
W T2 − T1
=
=1− 1
Q2
T2
T2
Diskussion:
·
·
·
(6)
u
T2
T
ist (da η = 1 − 1 gilt!)
T1
T2
es existieren technische Grenzen für ein maximales T2 und/oder minimales
T1 ⇒ Erhöhung des Gesamtwirkungsgrades durch z.B. „Abwärmenutzung“
zu Heizzwecken (⇒ T1 ≈ 40 ... 60 °C statt >> 100°C)
Wirkungsgrad ist umso höher, je größer
Bei realen Maschinen ist der Wirkungsgrad stets kleiner als der ideale Wirkungsgrad lt. Gl. (6).
!
21.3. Der Heißluftmotor (STIRLING-Maschine)
−
Bei Verbrennungsmotor oder Gasturbine wird das Gas durch Verbrennung erhitzt, ein „oberes Wärmereservoir“ existiert eigentlich körperlich nicht.
Im Gegensatz dazu arbeitet die STIRLING-Maschine wirklich zwischen zwei
Wärmereservoiren; die Gasfüllung bleibt drin! (Robert Stirling, 1816)
−
Die STIRLING-Maschine kann „nach oben“ und „nach unten“ arbeiten:
a) T2 (hoch): Flamme;
T1 (niedrig): Umgebung (≈ 20 °C)
b) T2 (hoch): Umgebung;
T1 (niedrig): Eis oder LN 2
Wichtig für das Funktionieren ist lediglich eine Temperaturdifferenz ∆T!
−
Die STIRLING-Maschine kann natürlich auch als Wärmepumpe betrieben werden.
16
Wärmelehre – Wärmekraftmaschinen
−
Arbeitsgas: Luft oder Helium (bessere Wärmeleitfähigkeit!)
−
Grundaufbau:
Die Bewegung des
Kolbens im Arbeitszylinder variiert das
Volumen V zwischen
V1 und V2 . Der obere
Teil des Arbeitszylinders ist offen.
Die
Kolbenbewegung im Verdränge rzylinder sorgt dafür,
dass das Gas einmal
mit T2 und dann
wieder mit T1 im
Kontakt ist.
Ein
Pleuelmechanismus sorgt für die
Kraftübertragung.
1
⋅ V ( Verdränger zylinder )
2
1
V2 = ⋅ V( Verdränger zylinder ) + V ( Arbeitszyl inder )
2
V1 =
−
Funktionsweise (Abbildung und Text entnommen aus {1}, S. 536):
17
Wärmelehre – Wärmekraftmaschinen
18
Wärmelehre – Wärmekraftmaschinen
... bei (1) → (2)
abgegebene Arbeit
... bei (3) → (4)
vom
Schwungrad
wieder zurückgegebene Arbeit
W ... mechanische
Nutzenergie
also:
Die Funktion einer Wärmekraftmaschine basiert auf der Temperaturdifferenz ∆T. Weder Explosion noch Gasaustausch sind notwendige Merkmale.
!
21.4. Die CARNOT-Maschine
−
Der ideale Temperatur-Austausch in den Takten (2) → (3) und (4)→ (1) funktioniert in praxi nicht. Im Takt (2) → (3) wird z. B. der Kolben bei der Wechselwirkung mit dem Arbeitsgas nicht ganz T2 erreichen, das Gas nicht ganz T1 , so dass
aus den Wärmereservoiren „nachgeho lfen“ werden muss.
⇒ ∆Qa und ∆Qa‘ kompensieren sich nicht völlig!
⇒ Auch der STIRLING-Motor erreicht den idealen Wirkungsgrad lt. Gl. (6) nicht:
ηStirling < 1 −
T1
T2
!
(7)
⇒ Die ideale Wärmekraftmaschine wird dadurch erreicht, dass entlang (2) → (3)
und (4) → (1) der Wärmeaustausch gleich ganz unterbunden wird. Dies bezeichnet man als CARNOT-Maschine.
Die CARNOT-Maschine
arbeitet
zwischen
zwei
Isothermen
(T2 ,
T1 )
und
zwei
Adiabaten
!
19
Wärmelehre – Wärmekraftmaschinen
(1) → (2):
(2) → (3):
(3) → (4):
(4) → (1):
−
Expansion im Kontakt mit T2 -Reservoir
weitere Expansion in thermischer Isolation; T2 → T1 1
Komprimierung im Kontakt mit T1 -Reservoir
weitere Komprimierung in thermischer Isolation; T1 → T2 1
Damit die CARNOT-Maschine wirklich ideal ist, muss man den Zyklus unendlich
langsam ablaufen lassen, so dass in jedem Punkt thermodynamisches Gleichgewicht herrscht. (Dies ist ein Widerspruch in sich!)
Dann könnte man auch jederzeit die Richtung des Prozesses umkehren, d.h., die
ideale CARNOT-Maschine arbeitet in reversibler Weise.
n
Veranschaulichung:
Rolle mit zwei gleich schweren Gewichten und einem sehr kleinen Zusatzgewicht, das
die Bewegungsrichtung bestimmt.
−
Natürlich sind alle realen Prozesse irreversibel. Aber in der Wärmelehre interessiert man sich für den „Grad der Irreversibilität“: Das Experiment mit Rolle
z.B. ist „fast reversibel“, andere Prozesse sind „e xtrem irreversibel“
Veranschaulichung: (extrem irreversibel) fallende Knetmasse
n
Die CARNOT-Maschine ist eine Idealisierung. Sie entspricht dem reversiblen
Grenzfall und hat den höchsten möglichen Wirkungsgrad bei gegebenen T1 , T2 :
!
Umwandlung Epot → Ekin → (Deformation) → Wärme in der Knete → Wärme im Raum
−
ηCarnot = ηid =
1
T2 − T1
T
=1− 1
T2
T2
(6‘)
vgl. hierzu Gl. (20 - 17a)!
20
Wärmelehre – Entropie; Zweiter Hauptsatz der Wärmelehre
22.
Entropie; Zweiter Hauptsatz der Wärmelehre
Nicht alle Prozesse, die dem Energiesatz genügen, finden auch wirklich statt!
Beispiel:
Um alle Energieprobleme zu lösen, brauchte man keine Energie aus dem Nichts zu
schaffen. Es würde genügen, wenn man sie unbegrenzt durch Umwandlung von
Wärmeenergie in mechanische Energie gewinnen könnte. Dem sind jedoch Grenzen
gesetzt, wie das vorige Kapitel zeigte (Wirkungsgrade).
n
22.1. Statistische Deutung der Entropie
−
gegeben: Volumen mit 4 Gasteilchen
−
Wir beobachten, ob sich die Teilchen in der linken oder rechten Hälfte des Volumens befinden.
Analyse des (Mikro-)Zustände des Systems:
({2}, S. 224)
Mögliche (Makro-)Zustände sind:
4/0
3/1
2/2
1/3
0/4
Die relative Häufigkeit bzw. die Wahrscheinlichkeit für das Auftreten des je weiligen Makrozustands ist:
1
16
4
16
6
16
4
16
1
16
6%
25%
38%
25%
6%
21
Wärmelehre – Entropie; Zweiter Hauptsatz der Wärmelehre
−
Ein bestimmter Makrozustand (den wir makroskopisch sehen; wir können ja die
individuellen Gasteilchen in der Regel nicht unterscheiden!) wird durch verschiedene Mikrozustände realisiert. Die Anzahl der gleichwertigen Mikrozustände bestimmt die Wahrscheinlichkeit für das Auftreten des Makrozustands.
−
Wenn P die Wahrscheinlichkeit für das Auftreten eines (Makro-)Zustandes ist,
erhalten wir mit
S = k B ⋅ ln P
(1)
die Entropie S dieses Zustandes.
−
Wenn sich ein System in einem weniger wahrscheinlichen Zustand befindet,
strebt es danach, einen Zustand größerer Wahrscheinlichkeit einzunehmen. In
der obigen Abbildung wird das dadurch deutlich, dass es stets mehr mögliche
Wege zum wahrscheinlicheren als zum weniger wahrscheinlichen Makrozustand
gibt.
Im Sinne einer Fluktuation kann aber auch kurzzeitig ein weniger wahrscheinlicher Zustand eingenommen werden:
⇒ Die Entropie eines Systems
kann, abgesehen von geringen Fluktuationen, nie abnehmen.
−
!
Bei Systemen „normaler Größe“ sind die Schwankungserscheinungen sehr gering:
Zahl der Teilchen
4
Zahl der Mikrozustände
24
=
16
Wahrscheinlichkeit für
„Grenzzustand“
1
≈ 0,060 (6 %)
16
1
≈ 0,001 (1 ‰)
1024
10
210 = 1024
20
220 ≈ 1 ž 10 6
≈ 1 ž 10 -6
2100 ≈ 1 ž 10 30 (!)
≈ 1 ž 10 -30 (!)
2N
=
100
N
!
2-N
22
Wärmelehre – Entropie; Zweiter Hauptsatz der Wärmelehre
−
Wir betrachten die Entropiezunahme beim Übergang von einem Grenzzustand in
den (im Rahmen der Fluktuation) gleichverteilten Zustand (für N >> 100):
Wahrscheinlichkeit P:
P ≈1
P = 2−N
Entropie S:
S = k B ⋅ ln P
−N
S = k B ⋅ ln 2
S = − k B N ⋅ ln 2
S = k B ⋅ ln P
S = k B ⋅ ln 1
S =0
Die Entropieänderung bei diesem Übergang beträgt also 1 :
∆S = k B N ⋅ ln 2
(2)
−
„Ein System versucht stets, zu Zuständen höherer Wahrscheinlichkeit überzugehen.“
!
−
„Ein System versucht, den Zustand maximaler Entropie einzunehmen.“
!
Dies sind zwei völlig gleichwertige Formulierungen!
22.2. Entropie und Wärmeenergie
−
Die klassische Definition der Entropie sagt:
Wenn man bei einer bestimmten Temperatur T einem System die Wärmemenge
∆Q reversibel zu- oder abführt, ändert sich die Entropie des Systems wie folgt:
∆S =
−
∆Qrev
T
Jedem Zustand eines Systems, der durch {p, V, T} charakterisiert ist, kann eindeutig ein ganz bestimmter Wert der Entropie zugeordnet werden:
S = S( p, V , T )
1
!
(3)
!
(4)
Dieses Ergebnis brauchen wir später noch!
23
Wärmelehre – Entropie; Zweiter Hauptsatz der Wärmelehre
−
Die Entropie beschreibt die Irreversibilität eines Prozesses. In jedem irreversiblen Prozess wird Entropie erzeugt, nur bei reversiblen Prozessen nicht:
∆Sirrev
erzeugt > 0
∆S rev
erzeugt
=0
!
(5)
(Gl. (3) widerspricht dem nicht. Dort handelt es sich um die transportierte Entropie.)
−
Verständnismäßig erscheint die Entropie vielen Leuten schwer, vielleicht, weil
sie etwas über die Irreversibilität aussagt, aber sich die Definitionsgleichung (3)
auf reversible Prozesse bezieht. Ist die statistische Deutung einsichtiger!?
−
Wir zeigen an einem Beispiel die Äquivalenz von statistischer Deutung (vgl.
<22.1.>) und klassischer („Wärme“-) Definition der Entropie:
Der Übergang muss reversibel erfolgen, damit Gl. (3) entsprochen wird ⇒ sehr
langsam zurückweichender Kolben
Das sich ausdehnende Gas leistet Arbeit:
dW = p ⋅ dV
(6)
Dies würde eigentlich zu Abkühlung führen, aber durch die reversible Prozessführung wird derselbe Energiebetrag gleich wieder als Wärme zugeführt:
dW = dQ = p ⋅ dV
⇒
dQ =
p ⋅ V = ν ⋅ R ⋅T
ν ⋅ R ⋅T
⋅ dV
V
lt. Gl. (20 - 7)
:T
dQ
dV
= dS = ν ⋅ R ⋅
T
V
V2
V2
V1
V1
∆S = ∫ dS = ν ⋅ R ⋅
∫
V
= ν ⋅ R ⋅ ln 2
V1
dV
V
V2 = 2V1
24
Wärmelehre – Entropie; Zweiter Hauptsatz der Wärmelehre
⇒
∆S = ν ⋅ R ⋅ ln 2
R = NL ⋅ k B ; ν =
N
NL
∆S = k B N ⋅ ln 2
(7)
Also sind Gl. (7) und Gl. (2) identisch, q.e.d.!
22.3. Der Zweite Hauptsatz der Wärmelehre
−
... ist ebenso wie der Erste Hauptsatz letztlich eine Erfahrungstatsache. Er sagt
etwas aus über die Richtung von Prozessen.
−
Es existieren verschiedene Formulierungen:
Wärme fließt von selbst immer vom wärmeren zum kälteren Körper.
!
oder etwas genauer:
Es ist unmöglich, eine periodisch arbeitende Maschine zu konstruieren, die
(während eines Durchlaufs) Energie als mechanische Arbeit abgibt und dafür
Wärme aus nur einem Wärmespeicher aufnimmt.
!
(Diese Formulierung beschreibt die Unmöglichkeit eines sog. Perpetuum Mobile
2. Art, d.h. die Unmöglichkeit der vollständigen Umwandlung von Wärmeenergie in
mechanische Energie.)
oder:
Die Entropie ist eine Zustandsgröße. (Diese Aussage ist identisch mit Gl. (4).)
!
oder:
Bei irreversiblen Zustandsänderungen im abgeschlossenen System gilt stets:
∆Sirrev
erzeugt
−
>0
!
(5)
n
Beispiel:
Wärmeaustausch zwischen zwei Körpern
Bedingung: T2 > T1
dQ
T2
dQ
dS 1 = +
T1
dS 2 = −
⇒
1
1
dS ges = dS1 + dS 2 = dQ − > 0
T1 T2
Innerhalb des Gesamtsystems, das beide Körper enthält, nimmt S zu!
25
Wärmelehre – Entropie; Zweiter Hauptsatz der Wärmelehre
22.4. Das thermodynamische Gleichgewicht
−
Ein Gleichgewicht liegt vor, wenn ein System sich zeitlich nicht ändert, 1 obwohl es durch kein äußeres Hemmnis daran gehindert wird.
!
−
mechanisches System:
Gleichgewicht wird beschrieben über potentielle Energie (Epot )
!
stabiles Gleichgewicht: E pot = Minimum
Eine gewaltsame Verschiebung ruft eine rücktreibende Kraft hervor.
−
In der Thermodynamik existieren verschiedene Größen, die (analog der potentiellen Energie Epot ) das Gleichgewicht charakterisieren. Welche Größe
jeweils zweckmäßig ist, hängt von den physikalischen Bedingungen ab:
−
adiabatisch - isochores System, also weder Wärme- noch Arbeitsaustausch zugelassen
!
∆Q = 0, ∆W = 0
⇒
−
S → Maximum bzw. U → Minimum
isotherm - isochor, also Wärmeaustausch zugelassen:
∆Q ≠ 0, ∆W = 0
⇒
F ≡ U - TS → Minimum
F ... freie Energie (HELMHOLTZ-Potential)
Illustration: Gas im Schwerefeld (vgl. <13.>, <20.5.>)
n
Es gibt zwei Grenzfälle:
a) Gasdichte unabhängig von der Höhe → S = Maximum
b) alle Gasteilchen befinden sich „am Boden“ → U = Minimum
Für alle Zwischenzustände liegt ein „Wettstreit zwischen U und S“ vor, der dem Minimum von F entspricht.
−
isotherm - isobar, also Wärmeaustausch und Volumenänderung zugelassen:
∆Q ≠ 0, ∆W ≠ 0
⇒
G ≡ U - TS + pV → Minimum
G ... freie Enthalpie (GIBBSsches-Potential)
1
System ändert sich zeitlich nicht, „obwohl es das könnte“!
26
Wärmelehre – Entropie; Zweiter Hauptsatz der Wärmelehre
−
adiabatisch - isobar, also kein Wärmeaustausch, jedoch Volumenänderung:
∆Q = 0, ∆W ≠ 0
⇒
H ≡ U + pV
→ Minimum
H ... Enthalpie
27
Wärmelehre – Aggregatzustände
23.
Aggregatzustände
23.1. Flüssigkeit und Dampf
Wir betrachten Flüssigkeit + „angrenzendes Volumen“:
−
Die Flüssigkeitsteilchen besitzen eine gewisse Verteilung der kinetischen Energie ⇒ Es kommt vor, dass ein einzelnes Teilchen genug Energie besitzt, um die
Flüssigkeit zu verlassen ⇒ Ausbildung eines Dampfes
−
Dynamisches Gleichgewicht an der Flüssigkeitsoberfläche: Auftreffende Damp fteilchen werden von der Flüssigkeit geschluckt und ständig treten welche aus.
!
⇒ Ausbildung eines bestimmten Dampfdruckes pD über der Oberfläche.
p D = f ( Art der Flüssigkei t, T )
(1)
pD heißt Sättigungsdampfdruck oder Gleichgewichtsdampfdruck.
−
Vorstellung:
Austritt aus der Flüssigkeit erfordert kinetische Energie Ekin ≥ Energiebarriere.
Diese Energiebarriere wird als Verdampfungsenergie EV interpretiert.
⇒ Im Mittel ist die Teilchenenergie im Dampf um die Verdampfungsenergie
EV höher als in der Flüssigkeit. Auch hier gilt das BOLTZMANN-Theorem:
!
EV
−
nD
= e k BT
n Fl
nD, nFl ... Teilchenzahldichte im Dampf und der Flüssigkeit
Mit
p = n D ⋅ kBT
(2)
(20 - 5)
folgt für den Sättigungsdampfdruck
p D = n Fl ⋅ k B T ⋅ e
−
−
EV
kBT
Kommentar:
·
Der Übergang flüssig - gasförmig (Verdampfung/Kondensation) ist ein
physikalisch einheitlicher Vorgang über einen großen Temperaturbereich.
Im Prinzip existiert auch kein großer Unterschied zum Übergang fest – ga sförmig (Sublimieren/Verfestigen).
(3)
u
!
28
Wärmelehre – Aggregatzustände
·
Bei pD = pUmgebung erfolgt ein qualitativer Sprung: Es kommt zur Dampfbildung auch im Innern der Flüssigkeit (Sieden).
n
Beispiel:
Entsprechend der Dampfdruckkurve des Wassers liegt bei einem Druck von
525 Torr = 0,7 bar, wie auf einem ca. 3000 m hohen Berg herrscht, der Siedepunkt
des Wassers bei nur noch 90 °C!
({2}, S. 239)
·
EV kann auch als Verdampfungswärme verstanden werden. Sie muss zugeführt werden, wenn die Verdampfung nicht durch Temperatur-Erniedrigung
zum Erliegen kommen soll („Verdunstungskälte“).
·
Bei überwiegender Kondensation (z.B. infolge Temperatur-Reduzierung) tritt
überwiegend „Kondensationswärme“ auf.
·
Nur im Gleichgewicht (wenn über der flüssigen Phase der Dampfdruck pD
herrscht) halten sich Verdampfung und Kondensation sowohl teilchen- als
auch energiemäßig die Waage.
!
−
Maßgeblich für den Austausch an der Flüssigkeitsoberfläche ist der sogenannte
Partialdruck pFl der Flüssigkeit, also derjenige Anteil am Gesamtdruck, der
durch die Teilchen der Flüssigkeit gebildet wird.
!
−
Das System versucht, den Partialdruck soweit zu erhöhen, bis der Sättigungsdampfdruck der Flüssigkeit pD, Fl erreicht ist.
!
29
Wärmelehre – Aggregatzustände
−
n
Beispiel: Wasser-Partialdruck und absolute Luftfeuchte
·
Für den Partialdruck p H2 O des Wassers gilt:
p H 2O = n H 2O ⋅ k B T
mit n H 2O =
(20 - 5‘)
ρ H2O
Gesamtmass e an H 2 O Volumen
=
Masse eines H 2 O − Moleküls
m H2 O
(4)
Dabei sind n H 2O die Teilchenzahldichte der Wassermoleküle und ρ H2 O die
absolute Luftfeuchte (gemessen z. B. in g ž m-3).
Einsetzen von Gl. (4) in Gl. (20 - 5‘) ergibt
p H2 O =
ρ H2O
m H2 O
⋅ k BT
(5)
Der Partialdruck kann maximal den Sättigungsdampfdruck erreichen, d.h. es
gilt p H2O ≤ p D, H 2O ... Sättigungs-/Gleichgewichts-Dampfdruck.
Analoges gilt lt. Gl. (5) für die absolute Luftfeuchte:
ρ H 2O ≤ ρ D , H 2O
(6)
mit ρ D, H2 O ... Sättigungsfeuchte
·
Das wirkliche Verhalten1 ist weniger von der absoluten Luftfeuchte als vom
Verhältnis der absoluten Luftfeuchte zur Sättigungsfeuchte bei gegebener
Temperatur T abhängig. Aus dieser Tatsache begründet sich die
relative Luftfeuchte =
ρ H 2O (T )
(7)
ρ D, H2O ( T)
Die Angabe der relativen Luftfeuchte erfolgt meist in Prozent.
·
Für Wasser:
θ in °C
0
10
20
30
40
50
1
p D, H2 O in Pa
610
1230
2330
4240
7370
12300
ρ D, H2 O in g ž m-3
4,9
9,5
17,3
29,9
51,2
82,8
sowohl der Ablauf physikalischer Vorgänge als auch das subjektive Empfinden des Menschen
30
Wärmelehre – Aggregatzustände
·
Kommentar:
∗
pD bzw. ρD zeigen exponentiellen Anstieg mit der Temperatur T lt. Gl. (3)!
∗
Es können dabei beträchtliche absolute Wassermengen erreicht werden,
z.B. „normaler“ Raum bei 20°C ⇒ ρ D, H2 O ž V ≈ 1 kg ⇒ 1 l Wasser!
∗
Normalerweise ist p < pD, z.B. relative (Luft-)Feuchte von 55 %
→ Bei 20 °C entspricht dies etwa 0,55 ž ρ D, H2 O ( 20°C) ≈ 9,5 g ž m-3.
→ Bei 10 °C entspricht diese Absolutmenge schon einer relativen
(Luft-) Feuchte von 100%!
Man sagt: „Luft mit 9,5 g ž m-3 absoluter (Luft-)Feuchte hat einen Ta upunkt von 10 °C“.
∗
Es können beträchtliche Partialdrücke p H2 O erreicht werden.
H2 O
N2
O2
Ar
Σ
78,1
20,9
0,9
99,9 (trockener Frost)
7,3
72,4
19,4
0,8
99,9 (Tropenklima, z. B. 40 °C,
100 % relative Feuchte)
⇒ Die Partialdrücke der anderen Gase sind merklich reduziert!
u
23.2. Koexistenz dreier Phasen
−
p-T-Diagramm einer realen Substanz:
A → B:
isothermes Verdichten: gasförmig → flüssig → fest
Das System versucht äußerem Zwang auszuweichen (= Prinzip von
LE CHATELIER )1
C → D:
1
!
isobares Erwärmen: fest → flüssig →gasförmig
Festkörper sind in der Regel dichter als Flüssigkeiten!
31
Wärmelehre – Aggregatzustände
−
Am Tripelpunkt herrscht Koexistenz aller drei Phasen.
!
−
Der kritische Punkt ist der Endpunkt der Dampfdruckkurve. Dort verschwindet
der Unterschied zwischen Flüssigkeit und Dampf, es bildet sich keine Grenzfläche mehr aus.
!
−
Für T > Tkrit sind Gase beliebig verdichtbar, ohne dass Verflüssigung auftritt.
Beispiel: Sauerstoff
Tkrit ≈ 155 K ≈ -118 °C ⇒ ρ krit ≈ 0,41 g ž cm . Es treten also durchaus hohe Dichten auf,
nur eben keine flüssige Phase!
n
-3
−
Für T < Tkrit verflüssigen sich Gase bei Druckerhöhung (vgl. A → B)
Beispiel: Propan (C3 H8 )
Tkrit ≈ 370 K ≈ 97 °C ⇒ Verflüssigung ohne Kühlung möglich.
−
n
Sonderfall: Wasser
u
Kommentar:
⋅
Die Schmelzkurve ist ungewöhnlicherweise
etwas nach links geneigt (TT r = Tm + 0,008 K!)
⇒ Verflüssigung durch Druck möglich
(Prinzip des kleinsten Zwanges bzw.
Prinzip von LE CHATELIER)
In Übereinstimmung damit ist ρEis(0 °C) ≈ 0,92 g ž cm-3.
32
Wärmelehre – Aggregatzustände
·
Anomalie des Wassers:1
Bei Erwärmung von 0 °C an tritt zunächst ein Dichteanstieg auf. Das
Dichtemaximum wird bei 4 °C erreicht, danach kommt es zum normalen
Dichteabfall infolge der thermischen Ausdehnung.
Quantitativ ist der Effekt eher gering:
θ in °C
0
4
10
20
30
∆ρ ž 106
0
+132
-140
-1640
-4200
!
(+0,01 %!)
(-0,40 %!)
Dennoch besitzt die Anomalie des Wassers große Bedeutung.
23.3. Die VAN-DER-WAALSsche Gasgleichung
−
−
Für ideales Gas galt:
(vgl. <20.1.>)
·
·
kein Eigenvolumen der Teilchen
nur elastische (abstoßende) Wechselwirkung
Die ideale Gasgleichung für ein Mol (ν = 1) war:
p ⋅ Vmol = R ⋅ T
−
Eine Korrektur der beim idealen Gas gemachten Näherungen erfolgt in der
VAN-DER-WAALSschen Gasgleichung:
a
p +
⋅ (Vmol − b) = R ⋅ T
2
V
mol
a, b ... gasspezifische Konstanten
Kommentar:
·
·
1
(20 - 7)
(Vmol − b )
(8)
u
berücksichtigt, dass nicht das gesamte Volumen für die Bewegung der Teilchen zur Verfügung steht (b beschreibt deren Eigenvolumen).
!
−2
a ⋅ Vmol
beschreibt den zusätzlichen Binnendruck infolge der Anziehung der
Moleküle bei großer Annäherung aneinander. Dies ist nur merklich für hohe
Verdichtungen, also kleine Vmol.
!
Neben dem Dichtesprung beim Schmelzen existiert diese weitere Besonderheit beim Wasser.
33
Wärmelehre – Aggregatzustände
−
Wie sehen die Isothermen in Gl. (8) aus? Beispiel 1 Mol Kohlendioxid CO2 (= 44 g):
Kommentar:
−
u
·
Wir komprimieren isotherm von 0 an. Bei A bewegt sich das System isobar
nach E, wobei das Gas allmählich verflüssigt. Bei E ist die Verflüssigung
vollendet. Danach folgt ein steiler Druckanstieg (Inkompressibilität!)
!
·
Mathematisch ergibt aus sich Gl. (8) die Kurve 0ABCDE. Die physikalische Kurve 0ACE ist dadurch charakterisiert, dass die Flächen ABC und
CDE gleich sind.
!
·
Mit zunehmender Temperatur T verengt sich der Koexistenzbereich von
flüssiger und gasförmiger Phase; bei T = Tk (≈ 31 °C für CO2 ) gibt es als
Grenzfall einen Wendepunkt K. Physikalisch ist das der kritische Punkt (K
(73 bar, 31 °C) für CO2 ).
!
·
Beim Fehlen von Kondensationskeimen kann sich das System von A aus
auch noch etwas in Richtung B bewegen (übersättigter Dampf).
oder:
Bei Expansion kann es passieren, dass bei E zunächst keine Dampfblasen gebildet werden, sondern sich das System entlang ED bewegt (Siedeverzug). Gegebenenfalls kann es zur explosionsartigen Dampfbildung kommen. (Verwendung von Glasperlen bei chemischen Experimenten, um dies zu verhindern!)
JOULE-THOMSON-Effekt
Bei der Entspannung eines realen Gases entfernen sich die Gasteilchen im Mittel
voneinander ⇒ die gegenseitige Anziehung (Binnendruck) wird überwunden.
Die dazu notwendige Energie wird aus dem Energievorrat der inneren Energie U
entnommen ⇒ Reduzierung der Translationsenergie ≡ T-Verringerung!
Beispiele:
·
·
n
Entleeren von CO2 - und N2 O-Patronen
Technische Anwendung: Gasverflüssigung (bei solchen Gasen, bei denen die Verflüssigung ohne Temperaturreduzierung nicht möglich ist, z.B. O2 )
34
Wärmelehre – Transportprozesse
24.
Transportprozesse
24.1. Diffusion
−
Gas- und Flüssigkeitsteilchen befinden sich in ständiger unregelmäßiger Bewegung (Gas: BROWNsche Bewegung).
!
⇒ „unwahrscheinliche“ Ausgangsverteilungen gleichen sich selbständig aus;
Übergang in wahrscheinlichen Zustand
n
Beispiele:
·
wassergefülltes Gefäß der Länge L
Im linken Teil existiert
bei t0 eine Ausgangskonzentration an Farbstoff, die sich allmählich
verteilt:
·
−
analoges Verhalten für Verunreinigungen im Festkörper (bei entsprechend hoher
Temperatur)
1. Ficksches Gesetz (eindimensional)
jn =
dN
dn
= D ⋅−
A ⋅ dt
dx
(1)
jn ... Diffusionsstromdichte
D ... Diffusionskoeffizient
Maßeinheit:
[ D] =
m2
s
SI
Dabei ist definiert
j=
Teilchenza hl
Zeit ⋅ Querschnit tsfläche A
mit der Teilchenzahldichte n
n=
dN
dV
35
Wärmelehre – Transportprozesse
n
Kommentar:
·
Die Diffusion erfolgt immer entgegen dem Gradienten der Konzentration
(„bergab“).
·
Der Diffusionskoeffizient D
∗ gilt für „Diffusion von A in B“, ist also materialspezifisch (z. B. O2 in
N2 , P-Atome in Si-Kristallen),
∗ ist stark temperaturabhängig,
∗ wird bei Festkörpern stark von der Realstruktur (Korngrenzen u.ä.) beeinflusst.
!
!
24.2. Wärmeleitung
−
Räumliche Ausbreitung des stärker angeregten Zustandes (= intensivere Wärmebewegung) infolge der Wechselwirkung zwischen den Teilchen.
−
Formeln völlig analog zur Diffusion, "gleiche Mathematik"
!
Definition: Wärmestromdichte
j=
Wärmeenerg ie
Zeit ⋅ Querschnit tsfläche A
damit folgt die Wärmeleitungsgleichung (eindimensional)
jW =
dQ
dT
= λ⋅−
A ⋅ dt
dx
(2)
λ ... Wärmeleitfähigkeit
Maßeinheit:
−
[ λ] =
W
K ⋅m
SI
Veranschaulichung: Wärmeleitung zwischen zwei Wärmereservoiren T1 , T2
36
Wärmelehre – Transportprozesse
−
n
Beispiele:
Substanz
λ in W ž (K žm)-1
H2
O2
0,17
0,025
H2 O Ethylen
Pb
Ag
0,54
36
420
0,18
Diamant
2000
(Angaben für θ = 0 °C)
u
Kommentar:
·
·
Flüssigkeiten und Gase besitzen eine geringe Wärmeleitfähigkeit. Metalle
sind gute Wärmeleiter, verschiedene Isolatoren (z.B. Al2 O3 ) sind noch besser. Extrem gute Wärmeleitfähigkeit besitzt Diamant.
Die Wärmeleitfähigkeit ist stark temperaturabhängig.
!
!
24.3. Komplexe Wärmetransportprobleme
−
Wärmeleitung in reiner Form lt. <24.2.> kommt eigentlich nur in Festkörpern
vor. Bei Gasen und Flüssigkeiten verhält es sich komplizierter.
!
24.3.1. Wärmeübergang
−
... zwischen Flüssigkeiten/Gasen und Festkörper ist nicht trivial. Wir betrachten
die Wechselwirkung eines Gasteilchens mit der Oberfläche. Es existieren zwei
Grenzfälle:
a) einfache Reflexion
(vgl. <20.1.>)
keine Geschwindigkeitsänderung des Teilchens!
b) Adsorption/thermische
Anpassung/Desorption
vollständige Anpassung
der Temperatur während
einer gewissen Verweilzeit
−
Die phänomenologische Beschreibung erfolgt mittels der Wärmestromdichte jÜ
jÜ =
dQ
= α ⋅ (T2 − T1 )
A ⋅ dt
mit
α ... Wärmeübergangskoeffizent
Maßeinheit:
[ α] =
W
K ⋅ m2
(2)
SI
Für viele Stoffe ist α ≈ 6 W ž K-1 žm-2.
37
Wärmelehre – Transportprozesse
In der Regel muss also die Reihenschaltung der thermischen Widerstände berücksichtigt werden, z.B. Übergang Heizwasser/Metall → Leitung im Metall →
Übergang Metall/Luft.
!
24.3.2. Wärmestrahlung
−
Warme/heiße Körper bzw. Flüssigkeiten/Gase senden elektromagnetische
Strahlung (sogenannte Wärmestrahlung) aus. Andere Körper können diese absorbieren und sich dadurch aufheizen.
!
⇒ Wärmetransport durch Strahlung
−
Strahlungsleistung ~ T4 (vgl. <40.3.>)
⇒ Bei hinreichend hoher Temperatur ist dies der dominierende Mechanismus.
!
24.3.3. Konvektion
−
Wärmeleitung in Gasen oder Flüssigkeiten ist problematisch. Da ρ = ρ(T) ist,
steigt das heiße Medium nach oben und eine es entsteht eine Strömung.
−
Konvektion ist ein Wärmetransport durch Strömung.
!
Es gibt 2 verschiedene Arten:
·
freie Konvektion:
Beispiele:
·
∗
Zimmerluft
∗
Konvektionszellen in
einem flachen Topf
erzwungene Konvektion:
Beispiele:
∗
Heizlüfter
∗
Umwälzung von Heizwasser
−
n
n
Konvektion ist schwierig ist zu behandeln, besonders wenn man das „technisch
intensiviert“ (Turbulenz!)
38
Wärmelehre – Transportprozesse
24.3.4. Wärmerohre (Heat pipes)
−
interessante Lösung unter Einbeziehung der Verdampfungs-/Kondensationswärme
Flüssigkeit mit Siedepunkt TS
T1 < TS
Kondensation;
EK wird frei
T2 > TS
EK = E V
Verdampfen; EV
wird aufgeno mmen
39
Literaturliste
LITERATURLISTE
Titel
Autoren
Verlag
ISBN
DM
Physik
Gerthsen; Vogel
Springer
3-540-65479-8
129,-
Physik in Experimenten
und Beispielen
Paus, Hans J.
Hanser
3-446-17371-4
98,-
Experimentalphysik 1
Mechanik und Wärme
Demtröder, W.
Springer
3-540-57095-0
64,-
Experimentalphysik 2
Elektrizität und Optik
Demtröder, W.
Springer
3-540-56543-4
64,-
Physics Principles & Applic ations
Harris; Hemmerling; Mallmann
McGraw-Hill
0-07-026851-7
Physik (Teil 1)
Halliday, David;
Resnick, Robert
de Gruyter
3-11-010640-X
98,-
Physik (Teil 2)
Halliday, David;
Resnick, Robert
de Gruyter
3-11-013897-2
128,-
Physik und ihre Anwendungen
in Technik und Umwelt
Leute, Ulrich
Hanser
3-446-17232-7
58,-
Physik
Tipler, Paul A.
Spektrum
3-86025-122-8
128,-
Physik für Ingenieure
Lindner, Helmut
Fachbuch-Verlag
3-343-00772-2
48,-
Physik für Ingenieure
Hering; Martin;
Stohrer
Springer
3-540-62442-2
78,-
Mechanik, Akustik, Wärme; Bd. 1
Bergmann; Schae- de Gruyter
fer
3-11-012870-5
148,-
CD-ROM: CliXX Physik
Bauer; Benenson;
Westfall
Harri Deutsch
3-8171-1553-9
ca. 50,-
Taschenbuch der Physik
Stöcker
Harri Deutsch
3-8171-1556-3
58,-
Taschenbuch der Physik
Kuchling, H.
Fachbuch-Verlag
3-446-21054-7
40,-
IV
Quellenverzeichnis
QUELLENVERZEICHNIS
{1}
Hans J. Paus, Physik in Experimenten und Beispielen, München; Wien (Carl Hanser), 1995
{2}
Christian Gerthsen, Helmut Vogel, Physik, Berlin; Heidelberg; New York; London;
Paris; Tokyo; Hong Kong; Barcelona; Budapest (Springer), 17. Auflage 1993
V
Sachregister
SACHREGISTER
A
Absorption 38
Adiabate 11
Adiabatenexponent 10
Adsorption 37
allgemeine Gaskonstante 7
Anomalie des Wassers 33
Ausdehnungskoeffizient
linearer 2
Raum- 3
B
BOLTZMANN-Konstante 2
BOLTZMANNsche Energieverteilung 13, 28
BROWNsche Bewegung 35
C
CARNOT -Maschine 19
D
Dampf 28
Dampfdruck siehe Sättigungsdampfdruck
Dampfdruckkurve 31
Desorption 37
Diffusion 35
Diffusionskoeffizient 35
Diffusionsstromdichte 35
dynamisches Gleichgewicht siehe Gleichgewicht
E
Energie
äußere 8
innere 8
thermische 8
Enthalpie 27
Entropie 22, 23
erzeugte 24
transportierte 24
F
FICKsches Gesetz
Erstes 35
freie Energie 26
freie Enthalpie 26
Freiheitsgrad 3
G
Gas
ideales 6, 33
ideales 9
Gesetz
von BOYLE-M ARIOTTE 7
von GAY-LUSSAC 7
Gleichgewicht 26
dynamisches 28
thermodynamisches 26
Gleichverteilungssatz 4
H
Hauptsatz der Thermodynamik
Erster 8
Zweiter 25
I
ideales Gas siehe Gas
irreversibler Prozess 20, 23
Isobare 11
Isochore 11
Isotherme 11
J
JOULE-THOMSON-Effekt 34
K
Kondensation 28
Konvektion 38
erzwungene 38
freie 38
Kraftwärmemaschinen 15
VI
Sachregister
kritischer Punkt 32, 34
Kühlschrank 15
L
Leistungskennziffer 15
linearer Ausdehnungskoeffizent siehe
Ausdehnungskoeffizent
LOSCHMIDT -Zahl 2
Luftfeuchte
absolute 30
relative 30
M
M AXWELLsche Geschwindigkeitsverteilung 13
molare Wärmekapazität siehe Wärmekapazität
P
Partialdruck 29
POISSON-Gleichung (= Adiabatengleichung) 11
Prinzip von LE CHATELIER-BRAUN 31, 32
Prozessgröße 8
R
Raumausdehnungskoeffizent siehe
Ausdehnungskoeffizent
Reflexion 37
reversibler Prozess 20, 23
S
Sättigungsdampfdruck 28
Sättigungsfeuchte 30
Schmelzkurve 31
Siedekurve 31
Sieden 29
spezifische Wärmekapazität siehe Wärmekapazität
STIRLING-Maschine 16
Stoffmenge 2
Sublimation 28
Sublimationskurve 31
T
Teilchenzahldichte 6, 35
Temperatur 2
thermodynamisches Gleichgewicht siehe
Gleichgewicht
thermodynamisches System 8
Tripelpunkt 32
V
VAN-DER-W AALSsche Gasgleichung siehe
Zustandsgleichung
Verbrennungsmotor 15
Verdampfung 28
W
Wärme 2, 9
Wärmekapazität 4
molare 5
spezifische 4, 5
Wärmekraftmaschinen 15, 19
Wärmeleitfähigkeit 36
Wärmeleitung 36, 37
Wärmeleitungsgleichung 36
Wärmepumpe 15
Wärmestrahlung 38
Wärmestromdichte 36, 37
Wärmeübergang 37
Wärmeübergangskoeffizient 37
Wirkungsgrad 15, 16
Z
Zustandsänderung
adiabatisch 11
isobar 11
isochor 11
isotherm 11
Zustandsgleichung
ideales Gas 7, 33
reales Gas 33
Zustandsgröße 8, 25
VII