Isomerie Diastereomere
Werbung
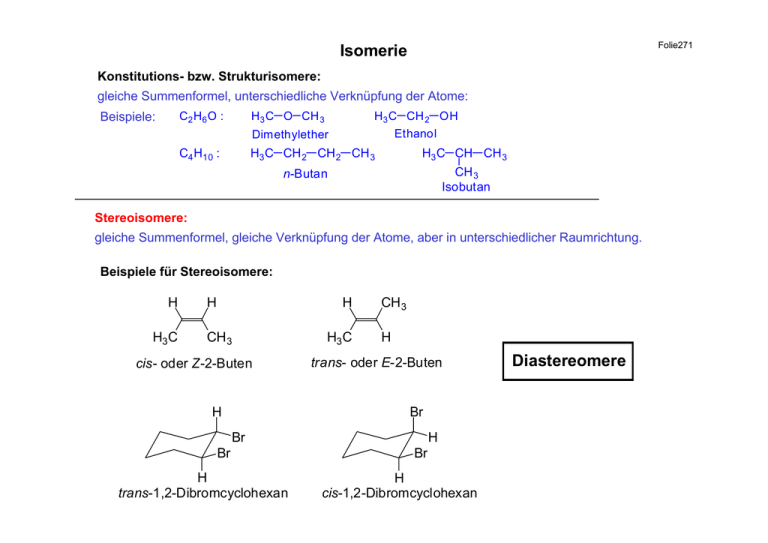
Folie271 Isomerie Konstitutions- bzw. Strukturisomere: gleiche Summenformel, unterschiedliche Verknüpfung der Atome: Beispiele: C2 H6 O : H3 C O CH 3 H3 C CH 2 OH Ethanol Dimethylether C4 H10 : H3 C CH 2 CH 2 CH 3 H3 C CH CH 3 CH 3 Isobutan n-Butan Stereoisomere: gleiche Summenformel, gleiche Verknüpfung der Atome, aber in unterschiedlicher Raumrichtung. Beispiele für Stereoisomere: H H3 C H H CH 3 cis- oder Z-2-Buten H H3 C CH 3 H trans- oder E-2-Buten Br Br Br H trans-1,2-Dibromcyclohexan H Br H cis-1,2-Dibromcyclohexan Diastereomere Folie272 Beispiele für Stereoisomere: H3 C CH 2 CH CH 3 Cl 2-Chlorbutan H3 C CH COOH OH Milchsäure H3 C CH 2 H H3 C H H C C Cl CH 3 H3 C Cl CH 2CH3 COOH COOH C C Bild OH HO H CH 3 Spiegelbild - stereogenes Zentrum nicht deckungsgleich Enantiomere Physikalische Eigenschaften von Enantiomeren Beispiel: 2-Methyl-1-butanol: CH 3 CH 2 Chiralitätszentrum H C CH 2 OH CH 3 H H C CH 3 CH 2 CH 2 OH HO CH 2 [α ]20 D [α ]20 D + 128.9°C 1.4107 0.8193 g/ml + 5.756° CH 2 CH 3 CH 3 CH 3 Sdp. nD d C + 128.9°C 1.4107 0.8193 g/ml - 5.756° ist die spezifische Drehung bei 20°C. D ist die Wellenlänge des bei der Messung verwendeten linear polarisierten Lichtes: Natrium-D-Linie bei 5893 Å. Chiralität – Optische Aktivität 1815 1848 Entdeckung der optischen Aktivität durch Biot Trennung der optisch inaktiven Traubensäure in die optisch aktive (+)- und (-)-Weinsäure durch Pasteur Folie273 Polarimeter (schematischer Aufbau) Folie274 Lichtquelle Polarisator (Nicol- Prisma oder Polaroid-Filter [α ]= Probenrohr α l⋅d [ °] [dm][g/ml] [α] - spezifische Drehung α - beobachtete Drehung l - Länge des Probenrohres in dm d - Dichte bei Messungen in Substanz Konzentration in g/ml bei Messungen in Lösung Analysator (Nicol-Prisma oder Polariod-Filter) Auge (oder Photozelle) Chirale Strukturen chiral (griechisch cheir – Hand bzw. Händigkeit) Folie275 Folie276 Chirale Strukturen normale Schnecke Bulismus perversus (tropische Landschnecke) 1, links gewundenes Gehäuse, 2, rechts gewundenes Gehäuse Folie277 O O H2 N OH NH 2 HO H NH 2 O O H2 N H S bitter Asparagin süß O H S N O N O n-C4H 9 CH 3 H3 C O C6 H5 O Krampfanfall O O Barbitursäure-Der. H O N S R O O C6 H5 n-C4H 9 R narkotisch H H O N N Contergan H N O N H extrem teratogen N O R O keine Mißbildungen CH 3 CH 3 S R H3 C CH 2 Geruch nach Zitrone H2 C Limonen CH 3 Geruch nach Orange H3 C SS OH H N HO CH 3 N H OH Tubercolostaticum H3 C N H Ethambutol H3 C CH 3 HO 2C SH NH 2 Antiarthriticum Penicillamin S CO 2H NH 2 I HO 2C O H2 N I I OH R I I Schilddrüsen-Hormon Thyroxin O OH β-Blocker N H Antihypocholesterinicum H3 C CH 3 S R I O HO RR extrem toxisch I I CH 3 HO Blindheit H3 C CH 3 CO 2H HS NH 2 S Folie278 H N CH 3 H3 C Propranolol N H O OH Contraceptivum R Folie279 Enantiomere Übergangszustände H H C C2 H5 CH 3 CH 2 OH (+) H2 C C2 H5 OH CH 3 (-) H+ X H+ X δ− X C H H C C2 H5 CH 3 CH 2 HOH δ+ H2 C HOH δ+ C δ− X Die Übergangszustände der beiden Eliminierungsreaktionen sind wie die Grundzustände enantiomer zueinander und damit identisch in allen physikalischen und chemischen Eigenschaften mit Ausnahme der optischen Aktivität. C2 H5 CH 3 X (-) Bild A (+) A Spiegelbild Enantiomere Ü.Z. energiegleich CH 3 CH 2 H3 C C CH 2 + H2 O CH 2 CH 3 H2 C C + H2 O CH 3 2-Methyl-1-buten X Folie280 Das Racemat ist das (50:50)-Gemisch von zwei Enantiomeren. Racemat-Bildung: CH 3 CH 2 CH 2 CH 3 hν Cl2 - HCl CH 3 CH 2 CH CH 3 + CH 3 CH 2 CH 2 CH 2 Cl Cl n-Butylchlorid sec.-Butylchlorid Cl a) Cl a) Cl b) Cl H C C2 H 5 H Cl (-) C2 H 5 CH 3 50 C 2 H5 CH 3 50 C CH 3 H b) (+) C Cl Enantioselektive Synthese (bevorzugte Bildung eines Enantiomeren) Diastereomere Übergangszustände sind energieungleich und besitzen unterschiedliche Eigenschaften, so dass eine Reaktion bevorzugt sein kann. [(+) – X (-) – A] [(+) – A (+) – X] chiral Diastereomere Übergangszustände chiral [(+) – A (-) – X] Enantiomer Folie281 Folie282 Racemat-Trennung Beispiele für Racemat-Trennung: OH CH 3 C COOH H (±) - Milchsäure H3 C CH 2 CH COOH (±) - 2-Phenylbutansäure chirale Hilfsreagenzien: (-)-Brucin, (-)-Strychnin, (-)-Chinin, (+)-Cinchonin (Alkaloid-Basen) für die Trennung von chiralen Säuren. (±) R NH 2 racemische Amine lassen sich z. B. m it optisch aktiver (-)-Apfelsäure trennen HO OC CH 2 CH CO OH OH Allgemeine Regel: Ein Racemat wird durch ein optisch aktives Hilfsreagenz in ein Gemisch von Diastereomeren umgewandelt, bei dem eine Trennung möglich ist. Sequenzregeln zur Bezeichnung der absoluten Konfiguration nach Cahn, Ingold und Prelog R, S-Nomenklatur Folie283 b b d d C c c a C a "S" "R" (Rectus-Rechts) im Uhrzeigersinn (Sinister-Links) im Gegenuhrzeigersinn 1) Ist das Chiralitätszentrum mit vier verschiedenen Atomen verknüpft, so hängt die Reihenfolge von der Atomnummer ab. Dabei hat das Atom mit der höchsten Atomnummer den Vorrang, bei Isotopen das Atom mit der höheren Massenzahl. b Cl Beispiele: dH dH C a I C SO 3H c cD > 17Cl > Br a "S" "R" 53 I b CH 3 16 S > 1H 35 Br > 6C > 2 1H (=D) > 1 1H 2) Wenn die Rangordnung nicht nach Regel 1) entschieden werden kann, werden die Atomnummern der folgenden Atome verglichen, in dem man immer weiter vom Chiralitätszentrum weggeht bis eine Entscheidung möglich ist. Cl > C, C > H d H b c Cl > CHH > HHH > H CH3 CH2 C CH2 H Cl a b CH3 d CH3 H c CH C CH2 CH3 Cl a Folie284 Cl > CCH > CHH > H 3) Die Atome einer Doppel- und Dreifachbindung werden wie zwei bzw. drei einfach gebundene Atome gewertet. C A = C A = C A A C A C C A A C CH 3 z. B. CH CH 2 > CH CH 3 CH CH 2 C C H b C d H O OH a CH 2OH c O H b CH O C dH H C C OH HO CH 2 OH > CH=O > CH 2OH > H HO a c CH 2OH "R" CH O CH O O C Folie285 D und L – Reihe D CH=O dH OH a CH O H HO CH 2OH c C CH 3 c CH O COOH C OH HO CH 2OH b CH O a HO dH H CH 2OH O CH S-(-) H COOH C CH 3 dH CH 2OH NH 2 CH 3 NH 2 H CH 2OH c R-(+)-Glycerinaldehyd H a H2N C CO 2H C OH C L NH 2 a dH CH 2OH CH O H D b COOH L b b COOH C CH 3 c R- Alanin NH 2 H CH 3 a NH 2 b HOOC C CH 3 c S-Alanin H Relative Konfigurationszuordnung COOH COOH Oxidation CHO H OH H OH Reduktion CH 2OH D-(-)-Glycerinsäure CH 2OH CH 3 D-(-)-Milchsäure CH 3 CH 3 D-(+)-Glycerinaldehyd Reduktion H HO OH OH H Oxidation OH H CH 2OH COOH CH 2OH COOH H CH 3 L-(+)-Propandiol H HO CH 3 L-(+)-Milchsäure Folie286 Folie287 Zwei und mehrere Chiralitätszentren (Maximalzahl der Stereoisomeren: 2n n – Zahl der Chiralitätszentren ery thro CHO R OH H R H OH Di aste reom ere CHO HO S HO S H H D-(-)-Erythrose L-(+) CHO CHO HO H CH 2OH CH 2OH thr eo S H H R S R OH HO CH 2 OH [O] COOH COOH HO S R HO H H COOH Bild und Spiegelbild identisch: achiral HO H COOH S H H R S R OH HO COOH (-)-Weinsäure OH H COOH (+) Enantiomere meso-Weinsäure nicht optisch aktiv meso: Schmp. 146-148°C L-(+) Enantiomere [O] COOH n = 2: 22 = 4 CH 2OH D-(-)-Threose Enantiomere COOH R OH H S H OH OH H Diastereomere Racemat: Schmp. 168-170°C (1:1)-Mischung Folie288 Nucleophile Substitution Nu + geladenes Nucleophil R X Alkylhalogenid R Nu + X (X = Cl, Br, I) HO R OH Alkohol R O R O R Ether R S R S R Thioalkohol I X H Nu + neutrales Nucleophil H O H R O - Halogenid R X R I R Nu H X Alkyliodid -H X R X - Alkylhalogenid R Nu R OH R O R H H3 N R NH 2 prim. RNH2 R NHR sec. R2 N R NR 2 tert. Amine H R3 N R NR 3 X quartäres Ammoniumsalz Nucleophile Substitution SN2-Reaktion: bimolekulare Reaktion Kinetik 2. Ordnung H3 C Br + Methylbromid k2 OH H3 C OH + Br Methanol Reaktionsgeschwindigkeit: R.G. = - d[CH3 Br] = k2 [CH3 Br] [ OH] dt SN1-Reaktion: monomolekulare Reaktion Kinetik 1. Ordnung (H 3C) 3C Br + t-Butylbromid OH k1 Reaktionsgeschwindigkeit: R.G. = - (H 3C) 3C OH + Br t-Butanol d[(H3C)3C-Br] = k1 [(H3C)3-Br] dt Folie289 Folie290 Mechanismus der SN2 - Reaktion C6 H13 CH Br CH 3 2-Bromoctan chiral + k2 OH C6 H13 CH OH + Br CH 3 2-Octanol chiral Konfigurationszuordnung H3 C H H3 C C Br H C6 H13 R-(-)-2-Bromoctan 25 C6 H13 R C6 H13 R-(-)-2-Octanol R-(-)-2-Bromoctan H3 C H gleiche relative Konfigurationen [α ] D = -9.9° Experiment: C OH 25 [α ] D = -34.6° HO C Br δHO OH + - Br CH 3 C S-(+)-2-Octanol δBr CH 3 HO H C6 H13 pentavalenter Übergangszustand C + H C6 H13 S Br SN2 - Reaktion: konzentierter Prozess unter Umkehr (Inversion) der Konfiguration am Reaktionszentrum. Reaktivität: H3 C Br > R CH 2 Br > R2 CH Br > R3 C Br prim. sec. tert. zunehmende, sterische Abstoßung im pentavalenten Übergangszustand. Mechanismus der SN1 - Reaktion (CH3) 3C Br (CH3) 3C + k1 (CH3) 3C + Br Heterolyse langsam Carbeniumion: reaktive Zwischenstufe geschwindigkeitsbestimmender Schritt OH schnell (CH3) 3C OH Reaktivität: wird bestimmt durch die Stabilität der Carbeniumionen R3 C tert. > R 2 CH sec. > R-CH 2 prim. > CH 3 Methylkation abnehmende Reaktivität Vergleich von SN2- und SN1-Reaktionen Methyl- und primäre Alkylhalogenide: meist SN2 tertiäre Alkylhalogenide: meist SN1 sekundäre Alkylhalogenide: SN1 und SN2 meist konkurrierend Folie291 Energiediagramm einer SN2- Reaktion (A) und einer SN1-Reaktion (B) Folie292