Genitaler Herpes simplex
Werbung
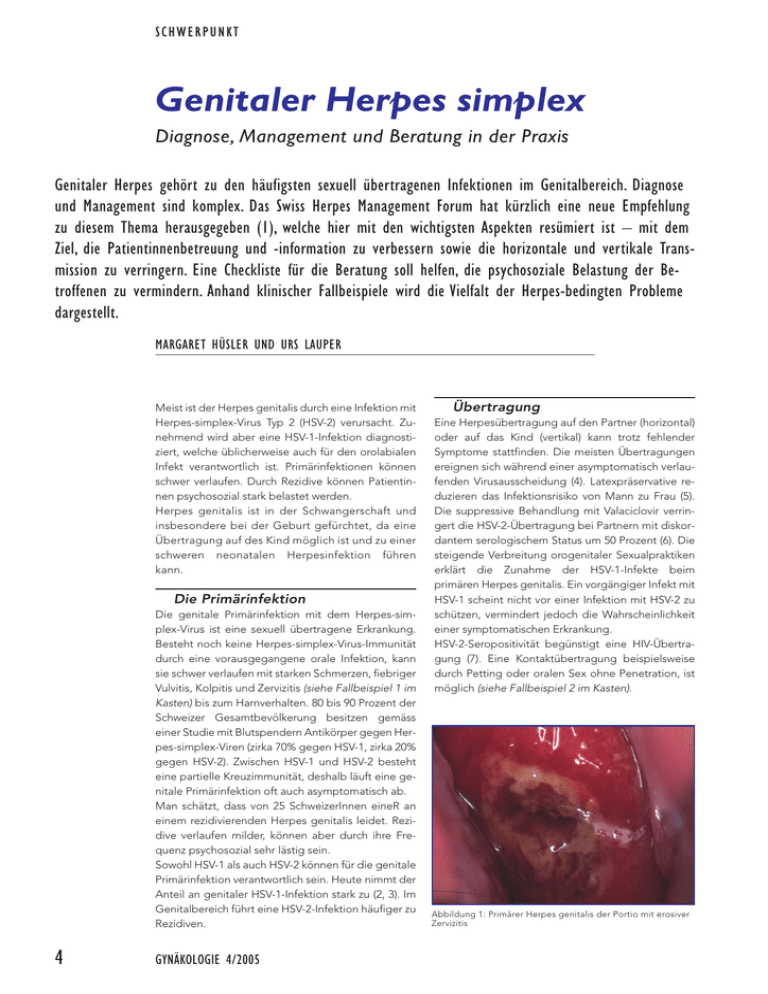
SCHWERPUNKT Genitaler Herpes simplex Diagnose, Management und Beratung in der Praxis Genitaler Herpes gehört zu den häufigsten sexuell übertragenen Infektionen im Genitalbereich. Diagnose und Management sind komplex. Das Swiss Herpes Management Forum hat kürzlich eine neue Empfehlung zu diesem Thema herausgegeben (1), welche hier mit den wichtigsten Aspekten resümiert ist – mit dem Ziel, die Patientinnenbetreuung und -information zu verbessern sowie die horizontale und vertikale Transmission zu verringern. Eine Checkliste für die Beratung soll helfen, die psychosoziale Belastung der Betroffenen zu vermindern. Anhand klinischer Fallbeispiele wird die Vielfalt der Herpes-bedingten Probleme dargestellt. MARGARET HÜSLER UND URS LAUPER Meist ist der Herpes genitalis durch eine Infektion mit Herpes-simplex-Virus Typ 2 (HSV-2) verursacht. Zunehmend wird aber eine HSV-1-Infektion diagnostiziert, welche üblicherweise auch für den orolabialen Infekt verantwortlich ist. Primärinfektionen können schwer verlaufen. Durch Rezidive können Patientinnen psychosozial stark belastet werden. Herpes genitalis ist in der Schwangerschaft und insbesondere bei der Geburt gefürchtet, da eine Übertragung auf des Kind möglich ist und zu einer schweren neonatalen Herpesinfektion führen kann. Die Primärinfektion Die genitale Primärinfektion mit dem Herpes-simplex-Virus ist eine sexuell übertragene Erkrankung. Besteht noch keine Herpes-simplex-Virus-Immunität durch eine vorausgegangene orale Infektion, kann sie schwer verlaufen mit starken Schmerzen, fiebriger Vulvitis, Kolpitis und Zervizitis (siehe Fallbeispiel 1 im Kasten) bis zum Harnverhalten. 80 bis 90 Prozent der Schweizer Gesamtbevölkerung besitzen gemäss einer Studie mit Blutspendern Antikörper gegen Herpes-simplex-Viren (zirka 70% gegen HSV-1, zirka 20% gegen HSV-2). Zwischen HSV-1 und HSV-2 besteht eine partielle Kreuzimmunität, deshalb läuft eine genitale Primärinfektion oft auch asymptomatisch ab. Man schätzt, dass von 25 SchweizerInnen eineR an einem rezidivierenden Herpes genitalis leidet. Rezidive verlaufen milder, können aber durch ihre Frequenz psychosozial sehr lästig sein. Sowohl HSV-1 als auch HSV-2 können für die genitale Primärinfektion verantwortlich sein. Heute nimmt der Anteil an genitaler HSV-1-Infektion stark zu (2, 3). Im Genitalbereich führt eine HSV-2-Infektion häufiger zu Rezidiven. 4 GYNÄKOLOGIE 4/2005 Übertragung Eine Herpesübertragung auf den Partner (horizontal) oder auf das Kind (vertikal) kann trotz fehlender Symptome stattfinden. Die meisten Übertragungen ereignen sich während einer asymptomatisch verlaufenden Virusausscheidung (4). Latexpräservative reduzieren das Infektionsrisiko von Mann zu Frau (5). Die suppressive Behandlung mit Valaciclovir verringert die HSV-2-Übertragung bei Partnern mit diskordantem serologischem Status um 50 Prozent (6). Die steigende Verbreitung orogenitaler Sexualpraktiken erklärt die Zunahme der HSV-1-Infekte beim primären Herpes genitalis. Ein vorgängiger Infekt mit HSV-1 scheint nicht vor einer Infektion mit HSV-2 zu schützen, vermindert jedoch die Wahrscheinlichkeit einer symptomatischen Erkrankung. HSV-2-Seropositivität begünstigt eine HIV-Übertragung (7). Eine Kontaktübertragung beispielsweise durch Petting oder oralen Sex ohne Penetration, ist möglich (siehe Fallbeispiel 2 im Kasten). Abbildung 1: Primärer Herpes genitalis der Portio mit erosiver Zervizitis SCHWERPUNKT Klinische Fallbeispiele: vielfältige Probleme bei Herpes genitalis Fallbeispiel 1 Eine 21-jährige Portugiesin meldet sich mit Unterbauchschmerzen. Das Abdomen ist im Unterbauchbereich dolent, weich, ohne peritonitische Zeichen. Inguinal zeigt sich eine dolente Lymphknotenschwellung beidseits. Die Vulva ist unauffällig ohne Hautveränderungen. In der Spekulumeinstellung zeigt sich eine stark gerötete, erosive Portio (Abbildung 1). Im Abstrich dieser Läsion kann ein Herpes genitalis nachgewiesen werden. Beurteilung: Erstmanifestation einer genitalen Herpesinfektion mit dem klinischen Leitsymptom Unterbauchschmerz ohne Vulvabefund. Fallbeispiel 2 Eine 18-jährige Frau, anamnestisch Virgo, meldet sich wegen starker Schmerzen im Vulvabereich und Harnverhalten. Die Patientin wird von der sehr besorgten Familie begleitet. Klinisch bestätigt sich die Virginität mit dem Nachweis eines intakten Hymens. Es zeigen sich eine schmerzhafte, massiv gerötete, ödematöse Vulva mit konfluierenden Ulzerationen und geschwollene, dolente inguinale Lymphknoten. Klinisch weist dies eindeutig auf eine Primärinfektion mit Herpes hin. Es kann eine HSV-1-Infektion nachgewiesen werden. Um einen Dauerkatheter zu legen, ist eine Kurznarkose nötig. Da der Urethraeingang relativ unaffektiert ist, wird ein urethraler Dauerkatheter gelegt. Dieser Fall zeigt, dass Petting oder Kissing für eine schwere HSV-Primärinfektion reicht und dass gegebenenfalls eine Kurznarkose für die Kathetereinlage notwendig ist. Es soll zwischen urethralem Dauerkatheter und suprapubischem Katheter abgewogen werden. a Fallbeispiel 3 Eine 33-jährige Zweitgebärende mit positiver Herpesanamnese und bisher 2 bis 3 Rezidiven: In dieser Schwangerschaft traten bis anhin keine Rezidive auf. Die Patientin wünscht sich eine Spontangeburt. Sie hat ab der 34. SSW prodromale Symptome ohne Hautläsionen. Deshalb wird sie ab der 36. SSW mit Valaciclovir (2 x 250 mg/Tag) suppressiv behandelt. In der 39. SSW wird ein gesundes Kind durch eine vaginale Geburt geboren. b Fallbeispiel 4 Junge Primipara mit Herpes-genitalis-Rezidiv im ersten Trimenon und bis anhin unauffälligem Schwangerschaftsverlauf: In der Spontangeburt am Termin wird ein 3450 g schweres Mädchen geboren. Beim Kind fallen an den oberen Extremitäten und im Gesicht multiple, teils verkrustete Vesikel mit gerötetem Grund auf (Abbildung 2a und 2b). Das Kind ist sonst klinisch und neurologisch unauffällig. Mittels PCR kann ein HSV-Typ 2 aus dem Bläscheninhalt nachgewiesen werden. Differenzialdiagnostisch kommt eine in der Spätschwangerschaft erworbene, auf die Haut lokalisierte Infektion in Frage. Dieses Kind zeigt im MRI ausgedehnte Hirnläsionen. Es kann aufgrund der Ausdehnung des Befundes auf eine Infektion des Kindes am Ende des zweiten Trimenons geschlossen werden mit einem kutanen Rezidiv bei der Geburt. Das Kind wird hospitalisiert und für drei Wochen mit Aciclovir, 30 mg/kg/Tag, behandelt. Es kann mit abgeheilten Hautläsionen, neurologisch unauffällig, entlassen werden. Aufgrund der Hirnläsionen ist aber eine psychomotorische Entwicklungsstörung zu erwarten. Diagnose Klinik Bei über der Hälfte der Infizierten bleibt der Primärinfekt asymptomatisch. Bei symptomatischen Patienten können drei Tage bis zwei Wochen nach Kontakt gruppierte, schmerzhafte Bläschen auftreten, die nach mehreren Tagen in Ulzerationen übergehen. Zudem besteht eine schmerzhafte, inguinale Lymphknotenschwellung. Bis zu 20 Prozent der Betroffenen weisen eine Dysurie auf, die im schlimmsten Falle zu einem akuten Harnverhalt führen kann (Fallbeispiel 2 im Kasten). Mehr als die Hälfte der Patienten leidet an Allgemeinsymptomen. Bis zu ein Drittel der Frauen weist eine aseptische Meningitis auf (8). Beide HSV-Typen zeigen ein identisches klinisches Bild. GYNÄKOLOGIE 4/2005 Rezidivierenden Herpes-genitalis-Infektionen geht oft ein Jucken oder Brennen an der Ausbruchsstelle und/oder neuralgiforme Schmerzen voraus. Danach folgen die klassischen Symptome mit gruppierten, dolenten Bläschen, die in Ulzerationen übergehen. Die Symptome sind milder als bei der Primärinfektion, und Allgemeinsymptome sind seltener. Ein Rezidiv kann auch an atypischen Lokalisationen, wie im Gesäss-, im Anal- oder im Oberschenkelbereich erfolgen, vor allem, wenn eine Immunschwäche besteht. Meistens bestehen Rezidive auf dem Grund einer HSV-2-Infektion. Virusnachweis im Abstrich Es gibt drei Grundprinzipien des Virusnachweises (vgl. Tabelle 1): Abbildung 2: a) Multiple, teils verkrustete Vesikel mit gerötetem Grund auf Gesicht und oberer Extremität b) Verkrustete Vesikel auf der Handfläche (Bilder freundlicherweise von Dr. U. Zimmermann zur Verfügung gestellt) 1. Zellkultur 2. Virusantigennachweis (Enzymimmunoassay oder Immunofluoreszenz) 3. Polymerasen-Kettenreaktion (PCR) mit Nachweis von Teilen des Virusgenoms. Antikörpernachweis im Blut Mit dem Nachweis von typenspezifischen IgG gegen das Glykoprotein von HSV-1 (gG-1) oder das Glykoprotein von HSV-2 (gG-2) kann die Diagnose einer Infektion mit HSV-1 oder HSV-2 in Abwesenheit von Läsionen gestellt werden. Sofern sich im Abstrich Herpesviren nachweisen lassen, in der Serologie aber der Herpes-IgG-Wert negativ ist, besteht in der Regel eine Primärinfektion. Es muss aber hinzugefügt werden, dass es nach einer HSV-Primärinfektion Wochen bis Monate dauern kann, bis die typenspezifische Immunantwort ausgebildet ist. Eine antivirale Medikation kann zusätzlich die Serokonversion verzögern. Bei längerer rezidivfreier Zeit ohne zusätzliche Exposition können die IgG allmählich wieder verschwinden. In sehr seltenen Fällen ist die humorale Immunantwort nicht gegen das in den Tests verwendete gG-2 gerichtet. 5 SCHWERPUNKT Tabelle 1: Virusnachweis Methode Entnahmeort Virusnachweis mittels Zellkultur Preis: 80 Taxpunkte Hautläsionen (Stadium) – Bläscheninhalt – Ulzera – Krusten – ohne Läsionen Biopsien Konjunktivalabstrich bei Neugeborenen Abstriche von Läsionen, Bläscheninhalt mit Bläschengrund Ausstriche, Gewebeschnitte Abstriche von Bläschengrund Antigennachweis mittels ELISA Preis: 35 Taxpunkte Immunfluoreszenz (Nachweis von infizierten Zellen) Preis: 25 Taxpunkte «Polymerase chain reaction» (PCR) Preis: 170 Taxpunkte Sensitivität (17–19) Spezifität Vorteile Nachteile > 95% – Einfache Entnahme – Typisierung möglich – Resistenzphänotyp möglich – Virustransportmedium notwendig – Transport schnell, gekühlt, lichtgeschützt – Resultat nach 2–7 Tagen verfügbar – Absprache mit Labor sinnvoll 41–80% 80% – Nur für frische Läsionen 41–70% > 95% – Einfache Entnahme – Schnell (< 4 h möglich) – Typisierung möglich – Anspruchsvoll – Schnell (< 4 h möglich) – Typisierung möglich > 90% 80% 40% < 40% 40–80% Liquor 98% Kammerwasser (Hautläsionen und Bläscheninhalt * möglich, aber nicht empfohlen) > 95% > 99% – Empfindlichste Methode – Typisierung möglich – Resistenz Genotyp möglich – Liquor als Probe validiert! – Nur für frische Läsionen – – – – Nur in spezialisierten Labors Nicht standardisiert Kontaminationsrisiko Nicht für alle Proben validiert *etwa 20% sensitiver als Zellkultur Tabelle 2: Behandlung immunkompetenter Patienten mit Herpes genitalis Gilt für Registrierungen in der Schweiz Episodische Therapie Suppressive Terapie (bei >6 x/Jahr od. starker Auswirkung auf Lebensqualität) Schwangerschaft Episodische Therapie Suppressive Terapie (ab der 36. SSW bis zur Entbindung) Sectio caesarea Erstepisode Aciclovir oral 5 x 200mg/d x 5–10d Valaciclovir 2 x 500mg/d x 5–10d p.o. Famciclovir 3 x 250mg/d x 5–10d p.o. Aciclovir iv. 3 x 5mg/kg/d x 5d Aciclovir oral 2 x 400mg/d Valaciclovir 2 x 250mg/d (>10 Rezidive/Jahr) Valaciclovir 1 x 500mg/d (<10 Rezidive/Jahr) Famciclovir 2 x 250mg/d Aciclovir oral 5 x 200mg/d x 10d Valaciclovir 2 x 500mg/d x 10d Aciclovir oral 3 x 400mg/d Valaciclovir 2 x 250mg/d Aciclovir oral 5 x 200mg/d x 5d Valaciclovir 2 x 500mg/d x 5d Aciclovir oral 3 x 400mg/d Valaciclovir 2 x 250mg/d Wenn klinische Episode innerhalb der Wenn Rezidive ≤ 7 Tage vor Entbindung letzten 4 Wochen vor Entbindung oder jederzeit, wenn eine oder jederzeit, wenn eine Genitalläsion Genitalläsion bei Geburtsbeginn vorliegt. bei Geburtsbeginn vorliegt. Therapie Systemische antivirale Therapien vermindern und verkürzen die Symptome; dies gilt in der Behandlung der Erstepisode und zu einem geringen Grad auch in der Rezidivbehandlung. Als suppressive Therapie eingesetzt kann sie die Rezidivhäufigkeit signifikant senken. Nach dem Absetzen der suppressiven Therapie kehren 6 Rezidiv Aciclovir oral 5 x 200mg/d x 5d Valaciclovir 2 x 500mg/d x 3–5d Famciclovir 2 x 125mg/d x 5d GYNÄKOLOGIE 4/2005 die Rezidive mit gleicher Häufigkeit und Stärke wieder zurück. Die latente Infektion kann nicht eradiziert werden. Aciclovir, Valciclovir und Famciclovir zeigen in randomisierten Studien eine vergleichbare klinische Wirkung auf Herpes genitalis. Valciclovir und Famciclovir weisen allerdings eine höhere Bioverfügbarkeit als Aciclovir auf, sodass die Einnah- mehäufigkeit im Vergleich zu Aciclovir reduziert werden kann (9). Die Wahl des Medikamentes richtet sich nach Aspekten der Verträglichkeit, der Compliance und der Kosten. Topische antivirale Therapeutika zeigen in Studien keinen klinischen Nutzen und werden nicht empfohlen (10). Therapie der Erstperiode Die antivirale Therapie soll wegen möglicher schwerer Symptome möglichst früh begonnen werden. Laborresultate müssen nicht abgewartet werden. Die empfohlenen Therapien sind in Tabelle 2 zusammengefasst. Bei persistierenden Symptomen und insbesondere bei immunsupprimierten Patienten beträgt die Behandlungsdauer mindestens 14 Tage. Die Behandlung der Erstepisode beeinflusst die Rezidivrate nicht. Folgende Komplikationen erfordern eine Hospitalisation: Harnverhalten, Meningismus, schwere Allgemeinsymptome, Unmöglichkeit einer oralen Medikamenteneinnahme. Bei Harnverhalt muss ein Dauerkatheter gelegt werden, wobei zwischen einer suprapubischen und urethralen Ableitung abgewogen werden muss (siehe Fallbeispiel 2 im Kasten). Zusätzlich zur antiviralen Therapie müssen Analgetika und Antiphlogistika ein- SCHWERPUNKT gesetzt werden. Lokalanästhetika sollen aufgrund einer Sensibilisierungsgefahr nur mit Zurückhaltung benützt werden. Empfohlen wird eine lokale antiseptische und antiphlogistische Behandlung mit iodhaltigen oder adstringierenden Lösungen (Gerbstoffe) mittels Sitzbädern oder Kompressen. Rezidivtherapie Je nach Ausprägung der Rezidive wird zusammen mit der Patientin/dem Patienten entschieden, ob eine episodische oder eine suppressive Therapie erfolgen soll. Eine episodische Behandlung soll innerhalb von 24 Stunden nach Eintreten der Symptome begonnen werden. Sie dauert drei bis fünf Tage. Die Dauer einer Episode kann so um ein bis zwei Tage verkürzt werden. Damit die Therapie von der Patientin selber sobald als möglich eingeleitet werden kann, benötigt sie ein Rezept oder eine Starterpackung. Die suppressive Behandlung unterdrückt rund 80 Prozent der Rezidive und ist besonders geeignet für Patientinnen mit mehr als sechs Rezidiven pro Jahr. Da mit der Zeit die Rezidivrate spontan abnimmt, kann die suppressive Behandlung nach sechs bis zwölf Monaten probeweise abgesetzt werden. Treten weiterhin häufige Rezidive auf, kann die suppressive Therapie wieder aufgenommen werden. Sonderfall: immunsupprimierte Patienten Insbesondere bei fortgeschrittener HIVInfektion beobachtet man chronische oder schwere Herpes-genitalis-Verläufe. Es empfiehlt sich eine episodische oder suppressive HSV-Therapie. Schwere Fälle können eine intravenöse Verabreichung notwendig machen. Die Wahrscheinlichkeit der Selektion resistenter Stämme steigt mit dem Grad der Immunsuppression und der Anzahl der antiviralen Behandlungen. Ein Spezialist muss frühzeitig hinzugezogen werden. Sonderfall: Herpes genitalis in der Schwangerschaft HSV-1 oder HSV-2 werden sehr selten von der Mutter auf das Neugeborene übertragen; sofern aber geschehen, kann die Infektion das Kind schwer schädigen (11). Dabei bergen mütterliche 8 GYNÄKOLOGIE 4/2005 Tabelle 3: Checkliste für die Beratung betroffener Patientinnen (revidiert nach Swiss Herpes Management Forum) ● Verursachende Viren ● Übertragung ● Vermeidung einer Übertragung ● Verlauf und Formen der Erkrankung ● Information der Sexualpartner ● Schwangerschaft ● Neonataler Herpes ● Therapieoptionen ● Suppressionstherapie HPV 1 und 2 HPV 2 mit Rezidivpotenzial, wird häufiger asymptomatisch ausgeschieden – Durch sexuellen Kontakt – Kontaktübertragung z.B. durch Petting, ohne Penetration, ist möglich – Orogenital – Meistens erfolgt die Übertragung bei asymptomatischer Virusausscheidung – Häufiger bei Immunsupprimierten – Häufiger bei Patienten mit > 12 Rezidiven/Jahr – Kondome verringern die Übertragung einer Infektion vom Mann auf die Frau – Bei Prodromen oder Läsionen soll auf Sex mit Nichtinfizierten verzichtet werden (deshalb serologische Abklärung des Partners hilfreich) – Rezidivpotenzial (HPV 2) – Asymptomatische Virusausscheidung, 80 Prozent der Infektionen asymptomatisch, eine von 6 Personen weltweit infiziert – Atypische Symptome (serologisch HSV nachgewiesen) – Motivation der Patientin, gegenwärtige und zukünftige Sexualpartner über ihren Infektionsstatus zu informieren – Sexualpartner sollen aufgeklärt werden, dass sie infiziert sein können, ohne je Symptome gehabt zu haben – Die typspezifische Serologie beim Partner ist wichtig für notwendige Vorsichtsmassnahmen – Information des betreuenden Arztes, Geburtshelfers und Pädiaters bei HSV-2 – Nichtinfizierte Schwangere sollen keinen ungeschützten Sexualkontakt (oral, genital) mit infizierten Partnern haben – Schwer wiegende Komplikation – Selten – Episodische antivirale Therapie – Suppressionstherapie – Unspezifische Lokaltherapie – Vereinzelt trotzdem Rezidive (kürzer, weniger schwer) Medikamentendosis kann vorübergehend erhöht werden – Keine Änderung des Krankheitsverlaufs nach Absetzen der Therapie – Mit der Zeit weniger Rezidive, Absetzversuche – Signifikante Wirkung auf die Virusausscheidung, Übertragungsrisiko reduziert – Nebenwirkungen selten – Keine Resistenzprobleme bei Immunkompetenten Primärinfekte ein höheres Risiko als Rezidive und HSV-1- ein grösseres als HSV-2Infektionen. Bei einem positiven Virusnachweis zum Zeitpunkt der Geburt liegt das Risiko einer Primärinfektion des Neugeborenen um 30 Prozent; besteht bei der Mutter ein Rezidiv, liegt das Infektionsrisiko des Neugeborenen unter 1 Prozent. Die primäre Sectio caesarea reduziert das Übertragungsrisiko signifikant (12a und 12b). Zudem gilt: Die klinische Unterscheidung zwischen Primärinfektion und Reaktivierung in der Schwangerschaft ist nicht möglich. Die meisten Primärinfektionen sind asymptomatisch. Weder ein serologisches noch ein virologisches Screening vor der Geburt erlauben eine zuverlässige Erfassung der von einer Herpesinfektion bedrohten Neugeborenen. SCHWERPUNKT Management bei Schwangeren Schwangere mit einer ersten klinischen Episode oder einem Rezidiv können mit Aciclovir oder Valaciclovir in den empfohlenen Dosen behandelt werden (vgl. Tabelle 2). Eine suppressive Therapie ab der 36. Schwangerschaftswoche bis zur Entbindung reduziert die Häufigkeit klinischer Manifestationen sowie die Virusausscheidung bei der Geburt, sodass gegebenenfalls eine vaginale Geburt erlaubt ist (siehe Fallbeispiel 3 im Kasten [13]). Eine positive Anamnese ohne klinische Symptome zum Geburtsbeginn ist keine Indikation für eine Sectio caesarea. Bestehen bei Geburtsbeginn Symptome (Läsionen oder prodromale Schmerzen oder Brennen) und/oder ein positiver Virusnachweis, ist ein Kaiserschnitt indiziert. Bei Blasensprung und anzunehmender fötaler Lungenreife ist ein Kaiserschnitt möglichst rasch durchzuführen, spätestens innert vier bis sechs Stunden. Bei unreifer Lunge gibt es keine gesicherten Entscheidungsgrundlagen. Das Frühgeburtsrisiko muss gegen ein geringes vertikales Übertragungsrisiko trotz antiviraler Therapie abgewogen werden. Das Risiko eines expektativen Vorgehens bei Schwangeren mit rezidivierendem Herpes genitalis und vorzeitigem Blasensprung scheint gering zu sein. In diesen komplexen Fällen ist die sofortige Verlegung in ein Perinatalzentrum zu empfehlen (14). Nach einem klinischen Rezidiv während der Schwangerschaft ist eine vaginale Geburt möglich, solange keine klinischen Symptome mehr vorhanden sind. Für den Fall einer Primärinfektion oder einer Initialinfektion mit dem anderen HSV-Typ ist die optimale Vorgehensweise momentan noch nicht definiert. Die meisten Guidelines empfehlen eine Sectio caesarea bei allen Frauen, die vier bis sechs Wochen vor der Geburt eine klinische Erstmanifestation aufweisen (15). Einige Experten denken jedoch, dass der Fötus bei einer vaginalen Geburt bis zum Erscheinen von typspezifischen Antikörpern einem Risiko ausgesetzt ist, das noch acht bis zwölf Wochen postpartal erhöht sein kann. Seronegative Patientinnen mit einem seropositiven Partner (HSV-1 oder HSV-2) sollen während der Schwangerschaft mit Kondomen verhüten. 10 GYNÄKOLOGIE 4/2005 Die neonatale Infektion mit Herpes simplex In der Hälfte der Fälle manifestiert sich die kindliche Infektion lokalisiert auf Haut, Augen und/oder auf den Mundbereich (siehe Fallbeispiel 4 im Kasten). In 33 Prozent liegt vorwiegend ein ZNS-Befall vor mit einer neonatalen Herpesenzephalitis. Diese führt häufig zu bleibenden Schäden. In 17 Prozent zeigt sich die disseminierte Form, welche mit einer Hepatitis, Pneumonie und einer disseminierten intravasalen Gerinnung und Schock einhergeht, was eine hohe Letalität zur Folge hat. Da der grösste Teil der neonatalen Herpesinfektionen nach negativer mütterlicher Anamnese auftritt, muss an eine neonatale Herpesinfektion gedacht werden, wenn beim Neugeborenen folgende Symptome auffallen: ■ Charakteristische Haut- oder Schleimhautläsionen ■ Konjunktivitis (insbesondere bei Injektion der Conjunctiva bulbi) bzw. Keratitis ■ Krämpfe und/oder Lethargie ohne andere Erklärung ■ Fieber ■ Andere systemische Symptome ohne andere Erklärung. Beratung der Patientin und ihres Partners Die psychosoziale Belastung insbesondere des rezidivierenden Herpes genitalis muss ernst genommen werden. Auch der Sexualpartner soll einbezogen und bei Symptomen behandelt werden. Als Informationsquelle für die Betroffenen können zusätzlich zu Drucksachen auch folgende Internetsites nützlich sein: ■ www.herpes-help.ch ■ www.herpesalliance.org. Auf welche Aspekte in der Beratung speziell eingegangen werden soll, ist in Ta■ belle 3 zusammengefasst. Dr. med. Margaret Hüsler und Dr. med. Urs Lauper Geburtshilfliche Klinik UniversitätsSpital Zürich Frauenklinikstrasse 10 8091 Zürich E-Mail: [email protected] Quellen: 1. Büchner, S., Garweg, S., Gerber, S.,. Hirsch, H.H., Kempf, W., Lauper, U., Lautenschlager, S., Meylan, P., Nadal, D., Reusser, P., Wunderli, W.: Swiss recom- mendations for the managemnent of genital herpes and herpes simplex virus infection of the neonate. Swiss Med Wkly 2004; 134: 205–214. 2. Lowhagen, G., Tunback, P., Bergstrom, T.: Proportion of herpes simplex virus (HSV) type 1 and type 2 among genital and extragenital HSV isolates. Acta Derm Venereol. 2002; 82(2): 118–20. 3. Roberts, CM., Pfister, JR., Spear, SJ.: Increasing proportion of herpes simplex virus type 1 as a cause of genital herpes infection in college students. Sex Transm Dis. 2003; 30(10): 797–800. 4. Brown, Z.A. et. al.: The acquisition of herpes simplex virus during pregnancy. N. Engl. J. Med. 1997; 21, 337(8): 509–15. 5. Wald, A. et al.: Effect of condoms on reducing the transmission of herpes simplex virus type 2 from men to women. JAMA 2001; 27, 285(24): 3100–3106. 6. Corey, L. et al.: Valacyclovir HSV Transmission Study Group. Once-daily valacyclovir to reduce the risk of transmission of genital herpes. N. Engl. J. Med. 2004; 350(1): 11–20. 7. Wald, A. et al.: Risk of human immunodeficiency virus infection in herpes simplex virus type 2seropositive persons: a meta-analysis. J Infect Dis. 2002; 185(1): 45–52. (Epub 2001 Dec 14) 8. Corey, L. et al.: Genital herpes simplex virus infections: clinical manifestations, course, and complications. Ann Intern Med. 1983; 98(6): 958–972. Review. 9. Fife, K.H. et al.: Valaciclovir versus acyclovir in the treatment of first-episode genital herpes infection. Results of an international, multicenter, double-blind, randomized clinical trial. The Valaciclovir International Herpes Simplex Virus Study Group. Sex Transm Dis. 1997 24(8): 481–486. 10. Corey, L. et al.: A trial of topical acyclovir in genital herpes simplex virus infections. N. Engl. J. Med. 1982; 306(22): 1313–1319. 11. Meylan, P.: Neonataler Herpes. In: SPSU-Jahresbericht 2002. BAG Bulletin 2003; 37: 643. 12a. Brown, Z.A. et al.: Neonatal herpes simplex virus infection in relation to asymptomatic maternal infection at the time of labor. N. Engl. J. Med. 1991; 324(18): 1247–1252. 12b.Brown, Z.A. et al.: Effect of serologic status and cesarean delivery on transmission rates of herpes simplex virus from mother to infant. JAMA 2003; 289(2): 203–209. 13. Sheffield, J.S. et al.: Acyclovir prophylaxis to prevent herpes simplex virus recurrence at delivery: a systematic review. Obstet Gynecol. 200; 102(6): 1396–1403. 14. Major, C.A. et al.: Expectant management of preterm premature rupture of membranes complicated by active recurrent genital herpes. Am J Obstet Gynecol. 2003; 188(6): 1551–1554. 15. Watts, D.H. et al.: A double-blind, randomized, placebo-controlled trial of acyclovir in late pregnancy for the reduction of herpes simplex virus shedding and cesarean delivery. Am J Obstet Gynecol. 2003; 188(3): 836–843.











