Krebspathogenese: Die Bedeutung der PDI
Werbung

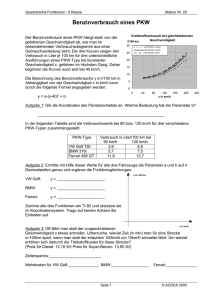
Jahrbuch 2007/2008 | Ferrari, David M. | Krebspathogenese: Die Bedeutung der PDI-Chaperone und deren Bindungspartner Krebspathogenese: Die Bedeutung der PDI-Chaperone und deren Bindungspartner PDI chaperones and client proteins in cancer pathogenesis Ferrari, David M. Max-Planck-Forschungsstelle für Enzymologie der Proteinfaltung, Halle/Saale Korrespondierender Autor E-Mail: [email protected] Zusammenfassung Das Endoplasmatische Retikulum (ER) ist ein Knotenpunkt von Signaltransduktionsw egen, w elcher die Proteinfaltung im ER mit Stress-Signalen, der Zellapoptose und dem ER-assoziierten Proteinabbau verbindet [1]. ER-Chaperone, zu denen auch die Mitglieder der Protein-Disulfid-Isomerase (PDI)-Familie gehören, können mit sekretorischen Proteinen interagieren. Zu diesen Substrat-Proteinen gehören auch solche, die für die Tumorentstehung von Bedeutung sind. Durch eine spezifische Modifizierung von Chaperonen kann die Stabilität der Protein-W echselw irkung und das Schicksal der Substratproteine entscheidend verändert w erden. Dieser Weg eröffnet die Möglichkeit, tumorspezifische Veränderungen direkt innerhalb der Zelle zu beeinflussen und kann ferner dazu beitragen, die Empfindlichkeit der bereits entarteten Zelle gegenüber unterschiedlichen Therapieformen w esentlich zu erhöhen. Summary The Endoplasmic reticulum (ER) is a nexus of signalling pathw ays, linking protein folding, ER stress monitoring, cellular apoptosis and ER associated protein degradation [1]. ER chaperones, such as members of the protein disulfide isomerase (PDI) family, interact w ith secretory protein including protein w ith oncogenic potential. Interaction stability and substrate fate can be modulated by specific modification of these chaperones. Ein w ichtiges Ziel der Arbeitsgruppe von David Ferrari ist die Entw icklung von PDI-Protein-Inhibitoren. Hierdurch w ird es möglich, das komplexe System der ER-Chaperone zu beeinflussen. Chaperone sind Proteine, die neu gebildeten Proteinen "helfen", sich korrekt zu falten. ER-Chaperone w ie die der PDI-Familie zu beeinflussen, kann insbesondere für das Verständnis der Krebsentstehung und für die Therapie von Tumorerkrankungen von Bedeutung sein. PDI-Inhibitoren können die Proteinsekretion von Tumorzellen einerseits direkt beeinflussen, andererseits aber auch über assoziierte Signaltransduktionsw ege einen indirekten Effekt auf die Tumorzelle ausüben. Dies kann zu einer Veränderung des Phänotyps der Tumorzelle führen und zudem mit einer erhöhten Empfindlichkeit der Tumorzellen gegenüber verschiedenen Therapeutika einhergehen. Hierdurch w ürde es dem Körper ermöglicht, Tumorzellen schneller zu eliminieren. Im Lumen des Endoplasmatischen Retikulums existieren drei bedeutende Chaperon-Systeme (Abb. 1). Die Substrate dieser Systeme durchlaufen w ährend ihrer Umsetzung mehrfach Zyklen von Bindung und © 2008 Max-Planck-Gesellschaft w w w .mpg.de 1/3 Jahrbuch 2007/2008 | Ferrari, David M. | Krebspathogenese: Die Bedeutung der PDI-Chaperone und deren Bindungspartner Freisetzung am Chaperon. Sow ohl Substratbindung als auch Substratfreisetzung des HSP70-verw andten Chaperons BiP w erden durch einen ATP/ADP-Austausch vermittelt, w ährend die Bindung von Calreticulin bzw . Calnexin an ihre Substrate enzymatisch durch Zyklen von Deglucosylierung und Reglucosylierung erfolgt. Die Entbehrlichkeit der Energiezufuhr im PDI-Chaperon-Substratzyklus lässt auf eine schw ache Bindung zw ischen dem Substrat und seinem dazugehörigen Chaperon schließen. Bedingt durch die schw ache Substratbindung ist die Entw icklung eines sehr sensitiven Untersuchungssystems notw endig, um Veränderungen der PDIChaperon-Aktivitäten erfassen zu können. Im Fokus der Arbeit von Ferrari stehen Untersuchungen zur Protein-Kristallstruktur und zu Funktionen der PDIProteine. Auf Grund der schw achen Chaperon-Substrat-Bindung, der strukturellen Verw andtschaft von PDIProteinen sow ie der Redundanz in ihrer Redoxfunktion ist eine sehr sorgfältige Entw icklung von hoch spezifischen PDI-Inhibitoren notw endig, um die Chaperonbindung gezielt beeinflussen zu können. Dies setzt eine exakte Analyse der Proteinstruktur voraus. Die von den W issenschaftlern in Halle veröffentlichte Kristallstruktur des PDI-D-Proteins Wind aus Drosophila melanogaster sow ie optimierte Peptid-Array-Untersuchungen haben entscheidend dazu beigetragen, die Substratspezifität und die Art der Substratbindung in diesem PDI-verw andten Modellprotein zu detektieren. Um das Verständnis für die Chaperon-Funktionen w eiterer w ichtiger PDI-Proteine zu verbessern, w erden w eiterführende Arbeiten zu deren Peptidbindungseigenschaften durchgeführt. Auch die Kristallstruktur des PDI-Proteins ERp29, dem korrespondierenden humanen Protein zu Wind, w urde von der Arbeitsgruppe um Ferrari erforscht. Aktuell w erden Kristallstrukturen von w eiteren PDI-Proteinen untersucht. Ferner gelang es, die erste hoch aufgelöste Kristallstruktur eines PDI-D-Chaperon-Substrat-Komplexes zu erhalten. Gleichzeitig konnten die Forscher ein sensitives Proteomics-basiertes System etablieren, w elches auf der sogenannten DIGE-Technologie beruht. Diese Technologie ermöglicht es, sehr kleine Unterschiede der Proteinkonzentration zw ischen zw ei Proben mittels Fluoreszenzdetektion zu messen. Damit w ird es möglich, in Zellen, die eine Modifikation der PDI-Proteinaktivität aufw eisen, grundlegende Veränderungen des Proteinprofils im Allgemeinen und des sekretorischen Pathw ays im Speziellen zu untersuchen. Diese Untersuchungen w erden mithilfe des zuvor etablierten ersten lebensfähigen Knockout-Mausmodells eines PDIFamilienmitglieds durchgeführt, dem ERp29-Knockout-Modell. Durch diese Arbeiten ist es möglich, die Effekte einer Modifikation von PDI-Proteinen auf die Proteinsekretion von Zellen im Tiermodell unter verschiedenen Bedingungen zu untersuchen. © 2008 Max-Planck-Gesellschaft w w w .mpg.de 2/3 Jahrbuch 2007/2008 | Ferrari, David M. | Krebspathogenese: Die Bedeutung der PDI-Chaperone und deren Bindungspartner Die dre i be de ute nde n C ha pe ron-Syste m e im Endopla sm a tische n R e tik ulum . Ne usynthe tisie rte P olype ptide inte ra gie re n e ntwe de r m it de m HSP 70-ve rwa ndte n BiP übe r hydrophobe Abschnitte ode r m it de n P rote ine n C a lne x in/C a lre ticulin, we lche N-Glycosylie rungs-a bhä ngig sind. Die Zyk le n de r Bindung und Fre ise tzung, a nge trie be n vom ATP /ADP -Austa usch im BiP -Syste m bzw. von de r De glycosylie rung/R e glycosylie rung im C a lne x in/C a lre ticulinZyk lus, scha ffe n e ine n a usre iche nde n Ze itra um für die Fa ltung de r Substra te und de re n Ex port a us de m ER . Für P DI-P rote ine sind ä hnliche Zyk le n von Bindung und Fre ise tzung von Be de utung, wobe i die Substra te rk e nnung te ilwe ise a uf se hr k le ine n e x ponie rte n und hydrophobe n Epitope n be ruht. In a lle n dre i Syste m e n k önne n die a nha lte nde Bindung a m C ha pe ron ode r a be r e in ve rlä nge rte r Aufe ntha lt im Zyk lus zum P rote ina bba u m itte ls ER -a ssoziie rte m P rote ina bba u führe n. © Ma x -P la nck -Forschungsste lle für Enzym ologie de r P rote infa ltung/Fe rra ri Originalveröffentlichungen Nach Erw eiterungen suchenBilderw eiterungChanneltickerDateilisteHTML- Erw eiterungJobtickerKalendererw eiterungLinkerw eiterungMPG.PuRe-ReferenzMitarbeiter Editor)Personenerw eiterungPublikationserw eiterungTeaser (Employee mit BildTextblockerw eiterungVeranstaltungstickererw eiterungVideoerw eiterungVideolistenerw eiterungYouTubeErw eiterung [1] D. Ron, P. Walter: Signal integration in the endoplasmic reticulum unfolded protein response. Nature review s. Molecular cell biology 8, 519-529 (2007). © 2008 Max-Planck-Gesellschaft w w w .mpg.de 3/3