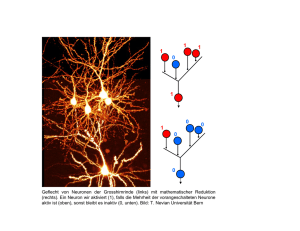
Mitochondrien und oxidativer Stress in nozizeptiven Prozessen
Werbung

5. Zusammenfassung 5. Zusammenfassung Ziel der hier präsentierten Arbeit war es, Erkenntnisse über die Bedeutung von reaktiven Sauerstoffspezies (ROS) in Interaktion mit Mitochondrien in der Pathophysiologie des peripheren Nervensystems (PNS) zu gewinnen. Als methodischer Ansatzpunkt wurde die Photodynamische Therapie von Hauttumoren gewählt. Diese moderne Therapieform beruht auf der gezielten Induktion von ROS in erkrankten epidermalen Zellen durch die Kombination eines photoaktivierbaren Moleküls (Photosensitizer) und Licht einer geeigneten Wellenlänge, mit dem Ziel erkrankte epidermale Zellen abzutöten. Die hier im Speziellen untersuchte Variante der PDT nutzt als Photosensitizer das Protoporphyrin IX (PpIX), welches von den behandelten Zellen aus δ-Aminolevulinsäure (5-ALA) oder deren Methylester (MAL) intramitochondrial synthetisiert wird. Diese Therapie stellt ein Bindeglied zwischen oxidativem Stress und der Aktivierung von Schmerz-sensitiven Nervenzellen dar, da die Erzeugung von ROS ihr zentraler Mechanismus ist und sie in ihrer klinischen Anwendung häufig von Schmerzen begleitet wird. Die für diese Nebenwirkung verantwortlichen zellulären und molekularen Mechanismen sind bisher noch nicht experimentell untersucht worden Um den Fragestellungen zu begegnen, wie mitochondrial erzeugte ROS in sensorischen Neuronen wirken, und wie dies im Fall der PDT zu Schmerzen führt, wurde sowohl eine direkte Aktivierung sensorischer Neurone aus dem Hinterwurzelganglion (DRG) der Ratte als auch die Interaktion solcher Neurone mit Keratinozyten in Betracht gezogen. Im ersten Schritt wurden die direkten Konsequenzen der ROS-Entstehung in kultivieren peripheren Neuronen nach Behandlung mit 5-ALA und MAL untersucht. Dabei konnte herausgearbeitet werden, dass 5-ALA und MAL in diese Zellen aufgenommen werden und die Synthese des Photosensitizers PpIX in Neuronen induziert wird. Mit pharmakologischen und molekularbiologischen Methoden wurden MembrantransportMoleküle identifiziert, die für den Aufnahmeschritt von 5-ALA und MAL in sensorische Neurone verantwortlich sind. Den Transportern für den Neurotransmitter γ-Aminobuttersäure (GABA), insbesondere dem GABA-Transporter 3 (GAT-3), ist hierbei eine zentrale Rolle zuzuschreiben. Ein Unterschied zwischen der Aufnahme von 5-ALA und MAL wurde nicht gefunden. Ein solcher hätte einen Unterschied in der Schmerzintensität während der PDT mit diesen beiden PpIX-Vorläufern möglich gemacht. Weiterhin wurde gezeigt, dass die Erzeugung von oxidativem Stress durch die PDT in kultivierten sensorischen Neuronen in vitro möglich ist. Hierzu wurden Neurone, die PpIX aus 5-ALA synthetisiert hatten, mit einer entsprechenden Lichtquelle bestrahlt. An diesen Zellkulturen wurden zunächst Parameter der mitochondrialen Funktion nach der PDT 125 5. Zusammenfassung analysiert. Dabei konnte eine sehr starke Korrelation zwischen der Stärke der induzierten ROS, definiert über die PDT-Dosis, sowie einer strukturellen wie funktionellen mitochondrialen Dysfunktion gefunden werden. Je nach eingesetzter PDT-Dosis konnte der Grad an oxidativem Stress variiert werden. Dies führte zu einer transienten Störung der mitochondrialen Funktion unter geringen Stressbedingungen, zu Apoptose bei moderatem und zu Nekrose bei maximalem oxidativem Stress. Zudem korrelierte die Degeneration neuronaler Fortsätze signifikant mit der Stärke der erzeugten ROS. Es ist folglich gelungen ein neues in vitro Testsystem zu generieren, in dem oxidativer Stress auf regulierte Weise erzeugt werden kann. Ein solches System eignet sich einerseits, um Antioxidantien und neuroprotektive Pharmaka zu untersuchen, andererseits wurde hiermit der Einfluss der Photodynamischen Therapie mit PpIX auf sensorische Neurone erstmals detailliert in vitro charakterisiert. In funktionellen Analysen zur neuronalen Aktivität konnte gezeigt werden, dass die in vitro PDT einen Anstieg des zytosolischen Kalziums in sensorischen Neuronen bewirkt. Dieser Anstieg ist maßgeblich von spannungsgesteuerten Kalziumkanälen (VGCCs) abhängig, allerdings konnte auch eine vorgeschaltete Beteiligung von Natriumkanälen gezeigt werden. Intrazelluläre Kalziumspeicher wie die Mitochondrien oder das Endoplasmatische Retikulum sind hieran nur geringfügig beteiligt. Diese Ergebnisse weisen auf die direkte Aktivierung freier Nervenendigungen in der Haut als wichtigen Mechanismus der Schmerzentstehung nach der PDT hin, und zeigen zudem, dass den ROS im peripheren Nervensystem eine wichtige Rolle in der Erregung von Nervenfasern zukommt. Werden epidermale Keratinozyten mit der PDT behandelt, sekretieren sie Adenosintriphosphat (ATP), welches als pro-nozizeptiver Botenstoff im PNS bekannt ist. Da die ATP–Freisetzung bereits ohne erkennbare Zellschädigungen auftrat, liegt offenbar ein aktiver Prozess zugrunde. Dies könnte einen weiteren Anhaltspunkt für die Entstehung der Schmerzreaktion bei der PDT darstellen. Die Menge des von Keratinozyten bei der PDT abgegebenen ATPs sollte zur Aktivierung der Neuronen ausreichen. Somit scheint eine ROS-induzierte Kommunikation von Keratinozyten und Nervenfasern in der Haut vorzuliegen. Darüber hinaus spricht diese Erkenntnis dafür, dass oxidativer Stress von den Zellen des sensorischen Systems, zu denen inzwischen auch die Keratinozyten gezählt werden sollten, wahrgenommen werden kann. Es konnten somit im Rahmen dieser Arbeit zwei Wege gefunden werden, über die reaktive Sauerstoffspezies auf die sensorische Schnittstelle aus Keratinozyten und intraepidermalen, nozizeptiven Nervenfasern des PNS wirken. Beide Wege liefern nicht nur Anhaltspunkte zum Verständnis der Schmerzentstehung während der PDT, sondern weisen auch auf die Rolle 126 5. Zusammenfassung der ROS als Aktivatoren des peripheren Nervensystems hin. Zusammenfassend betrachtet lässt dies oxidativen Stress in der Epidermis als eine Modalität erscheinen, die von den sensorischen Strukturen der Haut erfasst und kommuniziert werden kann. Dies bekommt besondere Relevanz, wenn man berücksichtigt, dass 5-ALA und PpIX in jeder Zelle in kleinen Mengen vorkommen. Daher liegen die bei der PDT ablaufenden Prozesse in geringer Menge in jeder Zelle vor und bei starker Lichtbelastung der Haut kann der PDTSchmerz schützende Funktion haben. 127