Musterseite 31 - 38
Werbung

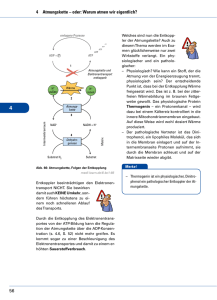
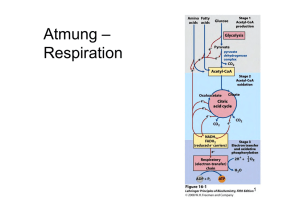
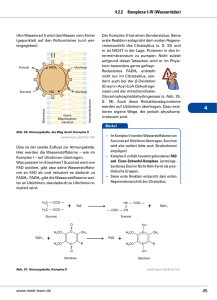
L E R NPAK E T 2 2.3 Atmungskette (oxidative Phosphorylierung) Die Funktion der Atmungskette besteht darin, ATP zu erzeugen, das dann energetisch ungünstige Reaktionen antreiben kann. Die chemiosmotische Hypothese von Mitchell aus dem Jahr 1961 besagt, dass Energie in einem Protonengradienten (H+-Gradient) gespeichert wird, der über die innere Mitochondrienmembran aufgebaut wird. Die Energie zum Aufbau dieses Gradienten stammt von den reduzierten Coenzymen. Die wichtigsten Lieferanten von Reduktionsäquivalenten für die Atmungskette sind NADH + H+ und FADH2. Diese reduzierten Coenzyme entstehen hauptsächlich im Citratzyklus (s. o.) und bei der β-Oxidation (Abb. 3.14). Zwei NADH + H+ liefert die Glykolyse beim Abbau eines Hexosemoleküls zu Pyruvat (Abb. 2.6). Freigesetzt wird die Energie, indem die H-Atome unter Bildung von H2O auf Sauerstoff übertragen werden. Der Protonengradient dient dazu, mithilfe einer ATPSynthase die „Energiewährung“ des Körpers, ATP, zu bilden. Abb. 2.6 Herkunft der reduzierten Coenzyme NADH + H+ und FADH2 für die Atmungskette. aus: Endspurt Vorklinik – Biochemie 1 (ISBN 9783131534132) © 2015 Georg Thieme Verlag KG 31 L E R NPAK E T 2 © Mopic/fotolia.com 2.3 Atmungskette (oxidative Phosphorylierung) 32 Biochemie 1 | 2 Endoxidation 2.3.1 Atmungskette als Elektronentransportkette Die chemische Reaktion, die der Wasserbildung in der Atmungskette zugrunde liegt, ist die Knallgasreaktion: H2 + ½ O2 → H2O ΔG0 = –235 kJ · mol–1 Diese Reaktion ist stark exergon. In der Atmungskette wird die Energie aber nicht auf einmal, sondern in mehreren kleinen Paketen freigesetzt. Das wird dadurch erreicht, dass die Elektronen, die bei dieser Reaktion vom Wasserstoff auf den Sauerstoff übertragen werden, schrittweise durch mehrere Redoxsysteme fließen, bevor sie mit dem Sauerstoff reagieren. APROPOS Ein Redoxsystem ist eine Verbindung, die durch Elektronenabgabe bzw. Elektronenaufnahme vom reduzierten in den oxidierten Zustand übergehen kann und umgekehrt. Die Atmungskette enthält 4 solcher Redoxsysteme (Komplex I–IV), die unterschiedliche Redoxpotenziale, d. h. eine andere Affinität zu Elektronen, besitzen. Stehen mehrere solcher Redoxsysteme untereinander in Verbindung, fließen die Elektronen von dem System mit dem negativsten Redoxpotenzial zu demjenigen mit dem positivsten Redoxpotenzial. In der Atmungskette werden die Elektronen der reduzierten Coenzyme auf diese Weise von Komplex I zu Komplex IV transportiert (Abb. 2.7). Besonders wichtig ist dabei, dass die bei den einzelnen Elektronenübergängen frei werdende Energie genutzt wird, um Protonen durch eine Membran zu pumpen und so einen elektrochemischen Gradienten zu generieren. Das geschieht allerdings nur durch die Komplexe I, III und IV, Komplex II transportiert keine Protonen (Abb. 2.8). 2.3.2 Lokalisation der Atmungskette Die Atmungskette ist in den Mitochondrien lokalisiert. Sie sind aus einer äußeren und einer inneren Membran aufgebaut, zwischen denen sich der Intermembranraum befindet. In der Matrix befinden sich vor allem die Enzyme und die Substrate des oxidativen Stoffwechsels. Alle fünf Komplexe der Atmungskette (vier Redoxsysteme und die ATP-Synthase) sitzen in der stark gefalteten inneren Mitochondrienmembran. Diese Membran dient dem Aufbau des elektrochemischen Protonengradienten (s. u.). Der pH-Wert im Matrixraum beträgt etwa 8, gegenüber 7,2 im Zytosol (und auch im Intermembranraum), sodass sich ein deutliches Membranpotenzial ergibt. 2.3.3 Transport der reduzierten Coenzyme Die reduzierten Coenzyme, die z. B. im Citratzyklus, der β-Oxidation oder durch den PDH-Komplex entstehen, können direkt in die Atmungskette eingeschleust werden. NADH + H+, das in der Glykolyse gebildet wird, muss dagegen die Mitochondrienmembranen passieren, um in die Matrix zu gelangen, da die glykolytischen Enzyme im Zytosol der Zelle lokalisiert sind. Die äußere Mitochondrienmembran enthält viele sogenannte Porine und ist dadurch durchlässig für viele kleine Moleküle. Im Gegensatz dazu stellt die innere Mitochondrienmembran eine fast unüberwindbare Hürde dar. Das gilt auch für das zytosolisch gebildete Abb. 2.7 Übersicht über den Protonen- und Elektronenfluss durch die Atmungskette. (Q = Coenzym Q = Ubichinon). NADH + H+. Die Säugetierzelle besitzt jedoch mehrere Mechanismen, um Reduktionsäquivalente vom Zytosol in die Matrix zu transportieren. Malat-Aspartat-Shuttle. Beim Malat-Aspartat-Shuttle (Abb. 2.9) wird das NADH + H+ über Malat und Aspartat vom Zytosol über die innere Mitochondrienmembran in die Mitochondrienmatrix transportiert. 1. Im ersten Schritt wird durch die Aspartattransaminase AST (S. 68) aus Aspartat Oxalacetat gebildet. Gleichzeitig wird α-Ketoglutarat in Glutamat umgewandelt. 2. Danach überträgt das NADH + H+ seine Protonen auf Oxalacetat. Dabei entsteht Malat. 3. Malat wird nun im Austausch gegen α-Ketoglutarat vom Zytosol in den Matrixraum des Mitochondriums transportiert. 4. Dort wird das Malat unter Regenerierung von NADH + H+ mithilfe der Malatdehydrogenase wieder in Oxalacetat rückverwandelt. 5. Dieses wird wiederum durch die AST zu Aspartat transaminiert, wobei aus Glutamat wieder α-Ketoglutarat entsteht. 6. Das Aspartat wird nun im Austausch gegen Glutamat ins Zytosol transportiert und steht für einen weiteren Transportzyklus zur Verfügung. Glycerophosphat-Shuttle. Beim Glycerophosphat-Shuttle (Abb. 2.10) wird Dihydroxyacetonphosphat (DHAP) durch die Glycerophosphat-Dehydrogenase unter Verbrauch des NADH + H+ zu α-Glycerophosphat reduziert. Dieses überträgt die Elektronen unter Bildung von enzymgebundenem FADH2 auf die Glycerophosphatoxidase oder Flavoproteindehydrogenase. Das FADH2 schleust Elektronen über Ubichinon in die Elektronentransportkette ein. aus: Endspurt Vorklinik – Biochemie 1 (ISBN 9783131534132) © 2015 Georg Thieme Verlag KG 2.3 Atmungskette (oxidative Phosphorylierung) 33 Glykolyse NADH + H+ tr ta pa s -A lat ttle Ma Shu L E R NPAK E T 2 I 4H+ FMNH2 NADH + H+ FMN Fe-S NAD+ QH2 4H+ NADH + H+ DHAP Q FADH2 Cyt b II α-Glycerophosphat FAD Fe-S NAD+ GPOX FADH2 Cyt b FAD Fumarat 4H+ III Succinat Intermembranraum Cyt c1 Fe-S tc Cy äußere Mitochondrienmembran 4H+ 2H+ Cyt a Cua IV ETF 1 β-Oxidation Citratzyklus Cyt a3 Cub 2H+ /2 O2 H+ + P + 2H H2O ⊕ H PDH Matrix F1 H+ F0 H+ H+ + H H H+ + H+ H + P ATP rt H+ + ADP + P ~ 2,5 ATP pro NADH + H+ ~ 1,5 ATP pro FADH2 -/ P o nsp tra o C - V innere Mitochondrienmembran Abb. 2.8 Übersicht über die Atmungskette und die oxidative Phosphorylierung. aus: Endspurt Vorklinik – Biochemie 1 (ISBN 9783131534132) © 2015 Georg Thieme Verlag KG 34 Biochemie 1 | 2 Endoxidation 3 4 2 1 5 6 Abb. 2.9 Malat-Aspartat-Shuttle zum Transport von NADH + H+ vom Zytosol in das Mitochondrium (zu den Schritten 1–6 siehe Text). NAD+ NADH + H+ FAZIT – DAS MÜSSEN SIE WISSEN – ! Beim vollständigen oxidativen Abbau von Pyruvat entstehen 3 CO2, 4 NADH, 1 FADH2 und 1 GTP. – ! In der Mitochondrienmatrix wird das Malat unter Regenerierung des NADH + H+ wieder in Oxalacetat zurückverwandelt. GlycerophosphatDH H2C OH H2C OH HO C H C O H2C OPO32 α-Glycerophosphat Elektronentransportkette QH2 Komplex I: NADH-Ubichinon-Reduktase Dihydroxyacetonphosphat GPOX FAD 2.3.4 Komplexe der Atmungskette H2C OPO23 zytosolisch FADH2 Q innere Mitochondrienmembran Matrix Abb. 2.10 Glycerophosphatzyklus (DH = Dehydrogenase, GPOX = Glycerophosphatoxidase, Q = Ubichinon, QH2 = Ubichinol). In Komplex I findet die Elektronenübertragung von NADH + H+ auf Ubichinon statt, das auch Coenzym Q genannt wird. Das geschieht über zwei Zwischenschritte. Komplex I enthält als prosthetische Gruppe Flavinmononucleotid (FMN, Abb. 2.11). Im ersten Schritt überträgt NADH + H+ seine beiden Elektronen auf FMN. Das dabei reduzierte FMNH2 gibt diese Elektronen dann an sog. Eisen-Schwefel-Cluster weiter, von denen sich mindestens sechs in Komplex I befinden. Von diesen erfolgt die Übertragung auf Ubichinon, das dadurch zu Ubichinol reduziert wird. Die Energie, die bei diesem Prozess frei wird, treibt vier Protonen von der Matrix in den Intermembranraum. APROPOS Eisen-Schwefel-Cluster kommen in unterschiedlichen Varianten vor. Als prosthetische Gruppen sind sie an verschiedene Cysteinreste eines Proteins koordiniert. Je nach Anzahl von Eisen- und Schwefelatomen gibt es z. B. [1Fe-0S]-Cluster (Abb. 2.12), die ein Eisen- und kein Schwefelatom besitzen. Andere Möglichkeiten sind die [2Fe-2S]-, die [3Fe-4S]- oder die [4Fe-4S]-Cluster. Herausragendes Merkmal dieser Cluster ist, dass sie durch die zwei möglichen Oxidationsstufen von Eisen (+2 und +3) Elektronen aufnehmen bzw. wieder abgeben können. aus: Endspurt Vorklinik – Biochemie 1 (ISBN 9783131534132) © 2015 Georg Thieme Verlag KG 2.3 Atmungskette (oxidative Phosphorylierung) O O H3 C H 3C N N 35 Coenzym Q = Ubichinon NH N O H 3CO CH3 H 3CO (C H 2 C H C O CH3 C H 2 ) 10 H CH2 HC OH N N HC OH H2 C O H + + e– NH2 P P Riboflavinmonophosphat = FMN = Flavinmononucleotid O CH2 H N O O H 3CO H H HO N H CH3 Ubisemichinon H 3CO OH Flavinadenindinucleotid = FAD R OH H + + e– Abb. 2.11 Flavinmononucleotid, ein Bestandteil der NADH-UbichinonReduktase. OH Coenzym QH2 = Ubichinol =Ubihydrochinon H 3CO H 3CO CH3 R OH Abb. 2.13 Reduktion von Ubichinon zu Ubichinol. Abb. 2.12 Eisen-Schwefel-Cluster [1Fe-0S]. Das Eisen ist an vier Cysteylreste (gelbe Schwefelatome) seines Trägerproteins koordiniert. Die Schwefelatome aus den Cysteylresten werden nicht zum FeS-Cluster gerechnet (deshalb [1Fe-0S]). Komplex II: Succinat-Ubichinon-Reduktase Komplex II der Atmungskette ist gleichzeitig ein Enzym des Citratzyklus, nämlich die Succinatdehydrogenase. Es ist das einzige Enzym des Citratzyklus, das membrangebunden vorliegt. Die Aufgabe von Komplex II besteht darin, Wasserstoff von Succinat auf Ubichinon zu übertragen; es werden keine Protonen in den Intermembranraum transloziert. Auch diese Übertragung verläuft über eine Zwischenstufe, in diesem Fall über FADH2. Weiterhin sind auch hier Eisen-Schwefel-Cluster am Elektronentransport beteiligt. Außerdem ist Cytochrom b560 im Komplex enthalten. Am Protonentransport ist Komplex II nicht beteiligt. Das ist auch der Grund dafür, dass FADH2 in der Atmungskette nur ~1,5 ATP liefert, während die Ausbeute von NADH + H+ bei ~2,5 ATP liegt. Ubichinon-Ubichinol-System Ubichinon oder Coenzym Q ist aus einem Chinon und einer Isoprenseitenkette aufgebaut. Strukturell hat es Ähnlichkeit mit den fettlöslichen Vitaminen E und K. Wegen des lipophilen Schwanzes kann es sich frei in der inneren Mitochondrienmembran bewegen. Nach Aufnahme von Reduktionsäquivalenten (2 Protonen und 2 Elektronen) von Komplex I bzw. Komplex II wird Ubichinon zu Ubichinol reduziert (Abb. 2.13), das auch als Ubihydrochinon oder reduziertes Coenzym Q (QH2) bezeichnet wird. Daneben gibt es noch eine dritte Möglichkeit, Ubichinol zu gewinnen. Im ersten Schritt eines Zyklus in der β-Oxidation (S. 44) wird das Acyl-CoA zu Enoyl-CoA dehydriert. Dabei entsteht eine Doppelbindung. Die beiden Wasserstoffatome werden in dieser Reaktion an FAD abgegeben. Das dadurch gebildete FADH2 kann seine Wasserstoffatome ebenfalls an Ubichinon weiterleiten. Dazu ist jedoch kein eigener Komplex notwendig. Das FADH2 gibt seine beiden Wasserstoffatome an ein elektronenübertragendes Flavoprotein (ETF = electrontransfer flavoprotein) ab. Dieses ETF reicht die Elektronen an die ETF-Ubichinon-Reduktase weiter, die sie schließlich auf Ubichinon überträgt. Komplex III: Ubichinol-Cytochrom-c-Reduktase Die Aufgabe von Komplex III besteht nun darin, die Elektronen von Ubichinol an Cytochrom c weiterzuleiten. Cytochrom c befindet sich im Intermembranraum und ist dort locker an die Außenseite der inneren Mitochondrienmembran gebunden. Ein reduziertes Cytochrom-c-Molekül transportiert ein Elektron von Komplex III zu Komplex IV (Cytochrom-c-Oxidase, s. u.). Wie Komplex I ist auch Komplex III eine Protonenpumpe. Bei der Übertragung eines Elektronenpaars auf zwei Moleküle Cytochrom c werden insgesamt vier Protonen in den Intermembranraum befördert. Cytochrome Cytochrome sind hämhaltige Proteine. Im sichtbaren Licht weisen die Absorptionsspektren der reduzierten Hämgruppen drei Peaks (α, β und γ) auf. Der α-Peak ist jeweils charakteristisch für eine Gruppe von Cytochromen. Sie werden aufgrund der verschiedenen α-Peaks in die Cytochrome a, b und c eingeteilt. Die drei Gruppen unterscheiden sich neben unterschiedlichen Absorptionsspektren auch darin, dass der Porphyrinring jeweils anders substituiert ist. ▪ Cytochrome vom b-Typ beispielsweise enthalten einen Hämanteil, der dem des Hämoglobins entspricht. ▪ In Cytochromen vom a-Typ enthält der Porphyrinring noch einen hydrophoben Isoprenschwanz, und ▪ Cytochrome vom c-Typ sind über zwei Cysteinreste an ein Protein gebunden. Die wichtigste Eigenschaft der Cytochrome besteht darin, dass ihre prosthetischen Gruppen, die Hämgruppen, ein zentrales Eisenatom enthalten. Es kann in der dreiwertigen (Fe3+ ) oder zweiwertigen (Fe2+) Form vorliegen. Dadurch können Cytochrome am Elektronentransport der Atmungskette teilnehmen. Sie nehmen jedoch nur ein Elektron auf. aus: Endspurt Vorklinik – Biochemie 1 (ISBN 9783131534132) © 2015 Georg Thieme Verlag KG L E R NPAK E T 2 HC OH 36 Biochemie 1 | 2 Endoxidation Komplex IV: Cytochrom-c-Oxidase Aufgabe von Komplex IV ist es, die Elektronen von Cytochrom c auf molekularen Sauerstoff zu übertragen. Wie in allen anderen Komplexen geschieht dies nicht direkt. Komplex IV enthält im Gegensatz zu den Komplexen I–III keine Eisen-Schwefel-Cluster. Stattdessen sind zwei Cytochrome, nämlich Cytochrom a und Cytochrom a3, sowie die beiden Kupferatome Cua und Cub am Elektronentransport beteiligt. Letztlich werden im Komplex IV nacheinander 2 Elektronen von Cytochrom c auf 1 Sauerstoffatom übertragen: 2 Cytochrom c2+ + ½ O2 → 2 Cytochrom c3+ + ½ O2 2 . Gleichzeitig werden dem Matrixraum vier Protonen entnommen. Zwei dieser Protonen verbinden sich mit dem zweifach negativ geladenen Sauerstoff zu Wasser („Oxidationswasser“): + ½ O2 2 + 2 H → H2O. Die anderen beiden Protonen werden in den Intermembranraum befördert. APROPOS Die Leber’sche Optikusneuropathie beruht auf Punktmutationen der mitochondrialen DNA, die zu Veränderungen von Untereinheiten von Komplex I oder manchmal Komplex IV der Atmungskette führen. Das mittlere Erkrankungsalter dieser erblichen Störung liegt bei 23 Jahren, wobei Männer drei- bis viermal häufiger betroffen sind als Frauen. Sie äußert sich durch Störungen des Farbsehens und einen schmerzlosen Verlust des Sehvermögens. Komplex V: ATP-Synthase Komplex I, III und IV tragen zum Aufbau eines Protonengradienten über die innere Mitochondrienmembran bei. Die (F1-F0-) ATP-Synthase (Komplex V) nutzt diesen Gradienten, um im Rahmen der oxidativen Phosphorylierung ADP und Phosphat in ATP und H2O umzuwandeln. Der Komplex V der Atmungskette ist aus zwei verschiedenen Untereinheiten aufgebaut, dem F0- und dem F1-Anteil (Abb. 2.14). ▪ F0 ist ein Protonenkanal, durch den die Protonen aus dem Intermembranraum in die Matrix zurückfließen können. ▪ Der F1-Anteil ist die eigentliche katalytische Einheit von Komplex V. Er besteht aus einer γ-Untereinheit und einem α3β3-Hexamer. Der Protonenfluss durch den F0-Teil der ATP-Synthase führt zu einer Drehbewegung im F1-Teil, und gebundenes ATP wird freigesetzt. Im F1-Teil rotiert die γ-Untereinheit relativ zum α3β3Hexamer. FAZIT – DAS MÜSSEN SIE WISSEN – ! Im Komplex I werden Elektronen auf Ubichinon übertragen. – ! Ubichinon nimmt aus Komplex I und Komplex II Reduktionsäquivalente (Elektronen) auf. – ! Komplex I enthält ein Flavinmononucleotid. – ! Sie sollten die Strukturformel des Flavinmononucleotids erkennen. – ! Cytochrom c befindet sich im Intermembranraum und ist dort locker an die Außenseite der inneren Mitochondrienmembran gebunden. – !! Ein reduziertes Cytochrom-c-Molekül transportiert jeweils ein Elektron von Komplex III zu Komplex IV (Cytochrom-cOxidase). – ! Cytochrom c enthält eine Häm-Gruppe. – ! Komplex IV überträgt Elektronen von Cytochrom c auf molekularen Sauerstoff. – ! Die Aktivität der Cytochrom-c-Oxidase ist vom Vorhandensein des Spurenelements Kupfer abhängig. – ! Die (F1-F0-)ATP-Synthase nutzt den Protonengradienten, um in der oxidativen Phosphorylierung ADP und Pi in ATP und H2O umzuwandeln. – ! Im F1-Teil der ATP-Synthase rotiert die γ-Untereinheit relativ zum α3β3-Hexamer. Protonenausbeute der Atmungskette Am Protonentransport der Atmungskette sind folgende Komplexe beteiligt: ▪ Komplex I: Pro NADH + H+ werden 4 H+ befördert. ▪ Komplex III: Pro Ubichinol werden ebenfalls 4 H+ in den Intermembranraum transportiert. ▪ Komplex IV: Pro entstandenem Wassermolekül werden 2 H+ aus dem Matrixraum verbraucht. Zusätzlich werden 2 H+ in den Intermembranraum gepumpt. Die Transportleistung von Komplex IV beträgt also 2 H+. Insgesamt sind also die Komplexe I, III und IV an einer Verschiebung von 10 H+ in den Intermembranraum beteiligt. LERNTIPP Komplex II nimmt nicht am Protonentransport teil! ADP + Pi ATP Abb. 2.14 Komplex V der Atmungskette (ATP-Synthase). F0 = Protonenkanal, F1 = katalytische Einheit. Der Protonentransport über die innere Mitochondrienmembran lässt sich folgendermaßen zusammenfassen: Pro NADH + H+, das am Komplex I in die Atmungskette eintritt, werden im Verlauf der Atmungskette 10 H+ in den Intermembranraum befördert. Da FADH2 Komplex I umgeht, kann es den Transport von maximal 6 H+ antreiben. Um 1 ATP aufzubauen, müssen etwa 3 H+ durch Komplex V hindurchfließen. Bei 10 H+, die durch Komplex V fließen, würde man einen Gewinn von 3,3 ATP erwarten. Tatsächlich ist dieser Wert jedoch niedriger. Der Grund dafür ist der Cotransport von Pi und H+ in das Mitochondrium. Dabei wird pro Pi, das für die ATP-Synthese in die Matrix befördert wird, auch 1 H+ transportiert. Aus den verbliebenen 7,5 H+ entstehen daher nur 2,5 ATP. Werden die H+ auf der Stufe des Ubichinons (nach Komplex I) eingeschleust, liegt der Gewinn sogar nur bei 1,5 ATP. aus: Endspurt Vorklinik – Biochemie 1 (ISBN 9783131534132) © 2015 Georg Thieme Verlag KG 2.3 Atmungskette (oxidative Phosphorylierung) Transport von ATP aus dem Mitochondrium in das Zytosol Bei der oxidativen Phosphorylierung entsteht viel ATP. Dieses ATP muss nun der gesamten Zelle zur Verfügung gestellt werden, d. h., es muss aus dem Mitochondrium ins Zytosol transportiert werden. Dazu gibt es in der inneren Mitochondrienmembran den ATP-ADP-Translokator. Bei diesem Transport wird ATP, das vier negative Ladungen besitzt, gegen ADP mit drei negativen Ladungen ausgetauscht. Mit jedem Transportvorgang wird daher eine negative Ladung aus dem Mitochondrium herausgeschafft. Angetrieben wird dieser Transport durch das Membranpotenzial der inneren Mitochondrienmembran. Da die Membran außen positiv geladen ist, erfolgt der Transport negativer Ladungen von innen nach außen entlang des elektrischen Gefälles über der Membran (entsprechend dem Streben nach Ladungsausgleich). Hemmung der Atmungskette Verschiedene Substanzen sind in der Lage, die Atmungskette zu hemmen. Tab. 2.2 führt die wichtigsten Hemmstoffe sowie ihren Angriffspunkt auf. Wird der ATP-ADP-Translokator inhibiert (z. B. durch Atractylosid), gelangt nicht genügend ADP ins Mitochondrium, und die Oxidation der reduzierten Coenzyme kommt zum Erliegen. Tab. 2.2 Hemmstoffe der Atmungskette. Substanz Wirkort/Mechanismus Entkopplung der oxidativen Phosphorylierung im braunen Fettgewebe Braunes Fettgewebe kommt typischerweise bei winterschlafenden Tieren, aber auch bei Neugeborenen vor, Erwachsene besitzen nur noch Reste. Im Vergleich zum weißen Fettgewebe enthält es sehr viele Mitochondrien, deren Cytochrome die makroskopisch sichtbare braune Farbe bedingen. Die wichtigste Aufgabe des braunen Fettgewebes ist, den Körper mit Wärme zu versorgen. Dazu wird ein spezielles Kanalprotein – Thermogenin – exprimiert. Es durchspannt die innere Mitochondrienmembran. Da es für Protonen durchlässig ist, bricht der durch die Atmungskette aufgebaute Protonengradient zusammen, wodurch die ATP-Synthese nur noch eingeschränkt möglich ist. Stattdessen wird Wärme erzeugt. ATP-Ausbeute bei vollständiger Oxidation von Glucose Am Beispiel des vollständigen Abbaus eines Moleküls Glucose zu H2O und CO2 soll gezeigt werden, in wie viele Moleküle der allgemeingültigen „Energiewährung“ ATP der Körper die in einem Molekül Glucose steckende Energie umtauschen kann. Die vollständige Oxidation der Glucose über Glykolyse, PDH, Citratzyklus und Atmungskette erfolgt nach folgender Gleichung: C6H12O6 + 6 O2 → 6 CO2 + 6 H2O Die dabei frei werdende Energie wird zu einem kleinen Teil bereits im Verlauf von Glykolyse und Citratzyklus direkt in ATP bzw. GTP konserviert. Der größte Anteil der ATP-Ausbeute stammt jedoch aus den reduzierten Coenzymen, die im Citratzyklus gebildet werden und in denen die Energie sozusagen zwischengespeichert wird. Sie werden in der Atmungskette wieder oxidiert, und die dabei freigesetzte Energie wird in der oxidativen Phosphorylierung dazu verwendet, ATP zu synthetisieren. Insgesamt entstehen beim vollständigen Abbau eines Glucosemoleküls 32 ATP (Tab. 2.3). Barbiturate, Rotenon Hemmung der Atmungskette in Komplex I zwischen FMN und Ubichinon Antimycin A Hemmung der Atmungskette in Komplex III zwischen Cytochrom b und Cytochrom c Glykolyse (Zytosol) HCN, CO, H2S Hemmung der Atmungskette in Komplex IV (Cytochrom-c-Oxidase) zwischen Cytochrom a und Sauerstoff durch die Bindung von HCN (CO, H2S) an das Häm-Eisen des Enzyms Glucose → Glucose-6-phosphat Fructose-6-P → Fructose-1,6-bisphosphat 2 · 1,3-BPG → 2 · 3-Phosphoglycerat 2 · PEP → 2 · Pyruvat Glycerinaldehyd-3-P → 1,3-BPG: 2 · NADH + H+ Oligomycin Hemmung der ATP-Synthase (Komplex V) Entkoppler (2,4-Dinitrophenol, Transport von Protonen durch die Chlorcarbonylcyanidphenylhy- innere Mitochondrienmembran, dadrazon [CCCP]) durch bricht das über die innere Mitochondrienmembran aufgebaute Potenzial zusammen. Der Elektronentransport vom NADH + H+ zum O2 läuft normal. Da der Protonengradient jedoch zusammenbricht, wird kein ATP erzeugt. Stattdessen wird die Energie als Wärme frei. Atractylosid ATP-ADP-Translokator, Hemmung durch Festhalten in einer Konformation Tab. 2.3 ATP-Ausbeute beim vollständigen Glucoseabbau. Reaktion ATP-Ausbeute –1 ATP –1 ATP +2 ATP +2 ATP Pyruvatdehydrogenase (Mitochondrium) I 2 NADH + 2 H+ Citratzyklus (Mitochondrium) II 2 · Succinyl-CoA → 2 Succinat insgesamt 2 · 3, also 6 NADH + H+ insgesamt 2 · 1, also 2 FADH2 +2 GTP (energetisch gleich 2 ATP) Atmungskette und oxidative Phosphorylierung (Mitochondrium) 2 NADH + 2 H+ aus Glykolyse, jeweils 2,5 ATP (bei Transport durch Malat-Aspartat-Shuttle) 2 NADH + 2 H+aus PDH, jeweils 2,5 ATP 6 NADH + 6 H+ aus Citratzyklus, jeweils 2,5 ATP 2 FADH2 aus Citratzyklus, jeweils 1,5 ATP +5 ATP Gesamtausbeute pro Glucose +32 ATP aus: Endspurt Vorklinik – Biochemie 1 (ISBN 9783131534132) © 2015 Georg Thieme Verlag KG +5 ATP +15 ATP +3 ATP L E R NPAK E T 2 APROPOS Als Maß für den Energiegewinn wurde der P/O-Quotient eingeführt. Er beschreibt, wie viele ATP-Moleküle pro Sauerstoffmolekül – damit pro gebildetem Wassermolekül (H2O) – aus ADP und Pi gebildet werden. Für NADH + H+ liegt der P/O-Quotient bei 2,5, für FADH2 beträgt er etwa 1,5. 37 38 Biochemie 1 | 3 Lipide und ihr Stoffwechsel RECHENBEISPIEL RECHENBEISPIEL Das Gehirn wird täglich mit etwa 120 g Glucose versorgt. Wie viel O2 (M = 32 g · mol–1) braucht der Organismus, um 120 g Glucose (M = 180 g · mol–1) zu CO2 und H2O zu oxidieren? Angenommen, es liegt am Anfang einer Ausdauerleistung ein Glykogenvorrat von etwa 100 mmol Glucose pro Liter Muskel vor. Wenn 1 Liter Muskelgewebe etwa 50 mmol ATP pro Minute verbraucht und wenn man annimmt, dass nur aerober Abbau aus Glykogen erfolgt, wie lange wird dann der Glykogenvorrat des Muskels ausreichen? Lösungsweg: Wie viel Mol sind 120 g Glucose? 120 g : 180 g · mol–1 = 0,67 mol. Aus der Reaktionsgleichung für die Glucoseoxidation geht hervor, dass 6 Mol O2 benötigt werden, um 1 Mol Glucose zu oxidieren. Daher ergibt sich hier: 0,67 mol · 6 = 4 mol O2. Lösung: 60 min Wie viel g sind 4 mol O2? 4 mol O2 · 32 g · mol–1 = 128 g Lösungsweg: 1 mmol Glucose ergeben beim Abbau 32 mmol ATP, 100 mmol ergeben dann 3 200 mmol ATP. Da der Muskel pro Minute 50 mmol ATP verbraucht, reichen die Reserven für 3 200 mmol/50 mmol pro min, also für ca. 60 Minuten. O2. Lösung: 128 g O2 Alternativer Lösungsweg: Um sich das Rechnen mit Dezimalzahlen möglicherweise zu ersparen, gehen Sie nicht, wie oben zum Verständnis dargestellt, Schritt für Schritt vor, sondern setzen Sie zunächst alle Werte in die Formel ein. Sie können dann strategisch geschickt multiplizieren und dividieren. Mit den angegebenen Werten ergibt sich: (120 g · 32 g · mol–1 · 6) : 180 g · mol–1 = (720 g · 32 g · mol–1) : 180 g · mol–1 = 4 · 32 g = 128 g O2 3 Lipide und ihr Stoffwechsel 3.1 Grundlagen und Chemie Lipide erfüllen im Körper vielfältige Aufgaben. Sie ▪ werden vom Organismus gespeichert und dienen der Energiegewinnung, ▪ sind wichtige Bestandteile der Phospholipidmembran, ▪ dienen als Vorstufe für die Synthese von Steroidhormonen und Gallensäuren. Prinzipiell kann man drei Gruppen von Lipiden unterscheiden (Abb. 3.1). Lipide sind lipophil (fettliebend) und damit hydrophob (wasserabweisend). Sie lösen sich gut in organischen Lösungsmitteln wie Benzol oder Ether, sind aber schlecht wasserlöslich und müssen im wässrigen Medium wie Blut mithilfe von Proteinen transportiert werden. 3.1.1 Fettsäuren Fettsäuren sind Monocarbonsäuren, enthalten also eine Carboxylgruppe (–COOH) und einen Kohlenstoff„schwanz“, der bei den einzelnen Fettsäuren unterschiedlich lang ist. Die meisten Fettsäuren haben eine gerade Anzahl von Kohlenstoffatomen. Man unterteilt Fettsäuren in verschiedene Gruppen: ▪ gesättigte Fettsäuren: ohne Doppelbindung ▪ ungesättigte Fettsäuren: mit einer oder mehreren Doppelbindungen – nicht essenzielle Fettsäuren (z. B. Ölsäure): werden vom Körper synthetisiert, FAZIT – DAS MÜSSEN SIE WISSEN – ! Blausäure (HCN) hemmt im Komplex IV (Cytochrom-c-Oxidase) der Atmungskette die Übertragung von Elektrionen auf den Sauerstoff. – !! Entkoppler vermindern die ATP-Synthese, indem sie Protonen durch die innere Mitochondrienmembran transportieren und den H+-Gradienten zusammenbrechen lassen. – !! Üben Sie das Rechnen mit Stoffmengen in Stoffwechselbilanzen: – Insgesamt entstehen beim vollständigen Abbau eines Glucosemoleküls 32 ATP. – Um 1 mol Glucose vollständig zu CO2 und H2O zu oxidieren, sind 6 mol O2 notwendig, wie aus der Reaktionsgleichung C6H12O6 + 6 O2 → 6 CO2 + 6 H2O hervorgeht. – essenzielle Fettsäuren (z. B. Linolensäure): müssen vom Körper aufgenommen werden. Die Doppelbindungen von mehrfach ungesättigten Fettsäuren sind fast nie konjugiert (Einfach- und Doppelbindungen wechseln sich ab), sondern nahezu immer isoliert (durch eine Methylengruppe getrennt; z. B. bei Linolensäure). Je nachdem, ob die Wasserstoffatome bei ungesättigten Fettsäuren auf der gleichen oder auf verschiedenen Seiten der Doppelbindung stehen, ist die Doppelbindung cis(Z)- bzw. trans(E)-konfiguriert. Die Doppelbindungen der essenziellen ungesättigten Fettsäuren besitzen eine cis-(Z-)Konfiguration. Wichtige Fettsäuren sind in Tab. 3.1 zusammengestellt. 3.1.2 Aufbau von Lipiden Lipide lassen sich, je nachdem, ob sie sich von Glycerin oder vom Sphingosin (Abb. 3.2) ableiten, in 2 Gruppen aufteilen: ▪ Glycerolipide: Grundbaustein Glycerin; einfache und komplexe Lipide ▪ Sphingolipide: Grundbaustein Sphingosin; komplexe Lipide. Die einzelnen Fettsäuren sind mit Glycerin bzw. Sphingosin verestert. 3.1.3 Triacylglycerine Die einfachsten aus Fettsäuren aufgebauten Lipide sind Triacylglycerine (Triglyceride, Neutralfette; Abb. 3.3). Die Hydroxylgruppen des Glycerinmoleküls sind mit drei Fettsäuren verestert; aus: Endspurt Vorklinik – Biochemie 1 (ISBN 9783131534132) © 2015 Georg Thieme Verlag KG