Vorlesung 39
Werbung

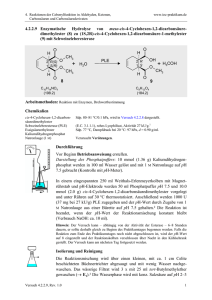
Vorlesung 39 Carbonsäuren (Vollhardt, 3. Aufl., S. 893 ff, 4. Aufl., S. 967 ff; Hart, S. 345 ff; Buddrus, S. 501 ff) Die funktionelle Gruppe der Carbonsäuren (= Fettsäuren) ist die Carboxyl- (bzw. Carboxy-) Gruppe. In ihr sind Carbonylgruppe und Hydroxylgruppe enthalten. ..O.. C .. .O. H Carboxyl-Gruppe R ..O. . C .. .O . H bzw. RCOOH bzw. RCO2H Schreibweisen für Carbonsäuren Die systematische Nomenklatur hängt an den Namen des entsprechenden Alkans die Endung „-säure“ an. Systematisch Methansäure Trivial Ameisensäure Ethansäure Essigsäure Propansäure Propionsäure Butansäure Buttersäure Cyclische Derivate werden als Cycloalkancarbonsäuren bezeichnet (Beachten Sie , dass die Bezeichnung „....carbonsäure“ ein C-Atom impliziert). Cyclohexancarbonsäure Benzolcarbonsäure Benzoesäure Naphthalin-2-carbonsäure Carbonsäuren haben höhere Priorität als Carbonylverbindungen und Alkohole. Wie bei Aldehyden können zur Positionsbezeichnung Ziffern oder griechische Buchstaben verwendet werden. β 3 α 2 1 H3C CH CO2H Br 2-Brompropansäure α-Brompropionsäure 4-Oxo-pentansäure Experimentalchemie, Prof. H. Mayr Achtung Lückentext. Nur als Begleittext zur Vorlesung geeignet. Propensäure (Acrylsäure) 230 2-Hydroxybenzoesäure (Salicylsäure) 5-Butyl-hept-6-en-säure (IUPAC) 5-Vinyl-nonansäure (Autonom) 5-Butyl-6-oxo-heptansäure (IUPAC) 5-Acetyl-nonansäure (Autonom) Carbonsäuren liegen als Dimere vor. O R H O C C O H R O Ihre Siedepunkte und Schmelzpunkte sind daher höher als bei vergleichbaren Alkoholen und Aldehyden. Kurzkettige Carbonsäuren (bis C4) sind vollständig mit Wasser mischbar. Versuch: Essigsäure erstarrt im Kühlschrank. Siedepunkt Schmelzpunkt CH3CH2OH 78.5 °C -114.7 °C CH3CHO 20.8 °C -121.0 °C CH3CO2H 118.2°C 16.7 °C CH3CH2CH2OH 97.4 °C -126.5 °C CH3CH2CHO 48.8 °C -81.0 °C CH3CH2CO2H 141.8 °C -20.8 °C R .O. .. C .. .O. X.. E H + Reaktionsmöglichkeiten der Carbonsäuren Experimentalchemie, Prof. H. Mayr Achtung Lückentext. Nur als Begleittext zur Vorlesung geeignet. 231 Die Acidität der Carbonsäuren ist durch die Resonanzstabilisierung der CarboxylatIonen bedingt. Elektronenziehende Substituenten erhöhen die Acidität (Vollhardt, 3. Aufl., S. 900/901, 4. Aufl., S. 974-975). O R C OH + + H2O H3O + Vergleich der Acidität von Salzsäure, Essigsäure und Trichloressigsäure mit Hilfe von Thymolblau als Indikator Versuch: pKa pKa H H H HCO2H 3.75 H C C C CO2H 4.82 H H H H H H Cl H C CO2H H C C C CO2H H H H H Cl H Cl H H C CO2H Cl 4.76 2.87 H C C C CO2H H H H H Cl Cl H H C CO2H 1.25 H H C C C CO2H 2.89 4.06 4.52 H H H Cl Cl C CO2H 0.65 Cl Aus dem pKa-Wert der Essigsäure ergibt sich, dass eine wässrige Lösung von Natriumacetat alkalisch reagiert. Versuch: Zugabe von Natriumacetat zu einer schwach sauren roten LackmusLösung führt zu Blaufärbung Übung A39-1. Ordnen Sie die pKa-Werte 3.41, 4.19 und 4.46 den folgenden Verbindungen zu: Benzoesäure, p-Methoxybenzoesäure, p-Nitrobenzoesäure. Begründen Sie die getroffene Reihung! Experimentalchemie, Prof. H. Mayr Achtung Lückentext. Nur als Begleittext zur Vorlesung geeignet. 232 Herstellung von Carbonsäuren Die Oxidation von primären Alkoholen und Aldehyden zu Carbonsäuren wurde bereits besprochen (vgl. Vorlesung 35). Aldehyde werden durch Luftsauerstoff zu Carbonsäuren oxidiert (Autoxidation). Versuch: Autoxidation des Benzaldehyds. Ein auf einem Uhrglas ausgestrichener Tropfen Benzaldehyd beginnt bereits nach einigen Minuten zu kristallisieren (→ Bildung von Benzoesäure) Versuch: Nachweis der bei der Autoxidation von Acetaldehyd intermediär gebildeten Persäure durch Oxidation von KI. Start: Kette: CH3 C O O2 H [Schwermetallion] Acetyl-Radikal CH3 C . O + O O Peroxid-Radikal O CH3 C + CH3 C O O. O + H Peressigsäure Ende: O CH3 C O OH + CH3 C Acetyl-Radikal O H Essigsäure Experimentalchemie, Prof. H. Mayr Achtung Lückentext. Nur als Begleittext zur Vorlesung geeignet. 233 Die radikalische Seitenkettenhalogenierung von Toluol (SSS) führt über Benzylchlorid und Benzalchlorid zu Benzotrichlorid. Ph CH3 Cl2 Cl2 Cl2 -HCl -HCl -HCl Benzylchlorid Benzalchlorid H2O[OH-] H2O[OH-] Benzylalkohol Benzaldehyd Benzotrichlorid H2O[OH-] Benzoesäure Technische Verfahren: Ameisensäure aus CO und Natronlauge; Essigsäure durch Oxidation von Acetaldehyd oder Carbonylierung von Methanol Synthese von Ameisensäure (aus Kohlenmonoxid und Natronlauge) + NaOH + IC OI H3O + 150 °C Druck Synthese von Essigsäure (Oxidation von Acetaldehyd) H2C CH2 O2/H2O/Pd-Cu-Kat O2/Co 3+ Wacker-Prozess Aromatische Carbonsäuren durch Oxidation der Methylderivate Ph CH3 O2 Co2+ Experimentalchemie, Prof. H. Mayr Achtung Lückentext. Nur als Begleittext zur Vorlesung geeignet. 234 Reaktionen der Carbonsäuren Decarboxylierung von Carbonsäuresalzen beim Erhitzen mit Natriumhydroxid – + + H3C CO2 Na + Na OH – 500 - 600°C Na2CO3 + CH4 Versuch: Nachweis des beim Erhitzen von Natriumacetat mit Natriumhydroxid entstehenden Gases. Versuch: Kolbe-Elektrolyse einer wässrigen Natriumacetat-Lösung. Nachweis, dass an beiden Elektroden brennbare Gase entwickelt wurden. Anode . – + e CH3 CO2 Acetoxy-Radikal 2x Kathode + H3O + e– H2O + H. 2x H2 Übung A39-2. Der Kohlenwasserstoff CH3(CH2)32CH3 steht als isomerenreine Verbindung im Chemikalienhandel zur Verfügung. Schlagen Sie eine Synthese aus einem preiswert verfügbaren Ausgangsmaterial vor! Experimentalchemie, Prof. H. Mayr Achtung Lückentext. Nur als Begleittext zur Vorlesung geeignet. 235