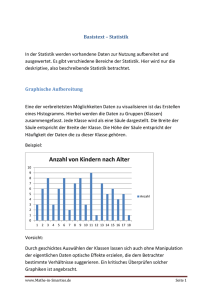
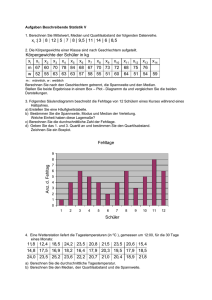
Immunhistochemische Parameter und deren prognostische
Werbung

Aus der Klinik für Urologie an der Universität zu Lübeck Direktor: Prof. Dr. med. D. Jocham Immunhistochemische Parameter und deren prognostische Bedeutung beim Nierenzellkarzinom im Stadium T3 Inauguraldissertation Zur Erlangung der Doktorwürde der Universität zu Lübeck ~ Aus der Sektion Medizin ~ vorgelegt von Philippe Niels Korn aus Nancy Lübeck 2012 1. Berichterstatter: Prof. Dr. Christian Doehn 2. Berichterstatter: Prof. Dr. Lutz Fricke Tag der mündlichen Prüfung: 12.09.2012 Zum Druck genehmigt. Lübeck, den 12.09.2012 Promotionskommission der Sektion Medizin I 1 Einleitung ................................................................................................. 1 1.1 Historisches ...................................................................................................................................... 1 1.2 Epidemiologie .................................................................................................................................. 1 1.3 Ätiologie ............................................................................................................................................. 2 1.4 Klassifikation ................................................................................................................................... 5 1.5 Staging ................................................................................................................................................ 8 1.6 Grading ............................................................................................................................................ 10 1.7 Prognose und Prognosefaktoren ............................................................................................ 10 1.8 Die Marker ..................................................................................................................................... 13 1.8.1 CD44 ............................................................................................................................................................. 13 1.8.2 Cadherine ................................................................................................................................................... 14 1.8.2.1 E-­‐Cadherin .......................................................................................................................................................... 15 1.8.2.2 N-­‐Cadherin ......................................................................................................................................................... 15 1.8.2.3 K-­‐Cadherin .......................................................................................................................................................... 16 1.8.3 Ki-­‐67 ............................................................................................................................................................. 16 1.8.4 p16 ................................................................................................................................................................ 18 1.8.5 PTEN ............................................................................................................................................................ 18 1.9 Ziele der Arbeit ............................................................................................................................. 20 2 Material und Methoden ......................................................................... 21 2.1 Das Patientenkollektiv ............................................................................................................... 21 2.2 Datenerhebung ............................................................................................................................. 21 2.3 Immunhistochemie ..................................................................................................................... 22 2.4 Tumormaterial/ Zuschnitt ....................................................................................................... 23 2.5 Antigendemaskierung ................................................................................................................ 24 2.6 Färbeprozedur .............................................................................................................................. 24 2.7 Färbeprotokoll .............................................................................................................................. 25 2.8 Materialien und Reagentien ..................................................................................................... 26 2.9 Auswertung der immunhistochemischen Färbungen ..................................................... 27 2.10 Statistische Auswertung ......................................................................................................... 32 II 3 Ergebnisse .............................................................................................. 33 3.1 Das Patientenkollektiv ............................................................................................................... 33 3.2 Etablierte Prognosefaktoren ................................................................................................... 36 3.2.1 Tumorstadium ......................................................................................................................................... 36 3.2.2 Nodalstatus ............................................................................................................................................... 37 3.2.3 Metastasen ................................................................................................................................................ 38 3.2.4 Grading ........................................................................................................................................................ 39 3.2.5 Tumorgröße .............................................................................................................................................. 40 3.2.6 Histologie ................................................................................................................................................... 42 3.2.7 Alter .............................................................................................................................................................. 43 3.2.8 Geschlecht .................................................................................................................................................. 44 3.3 Immunhistochemische Marker ............................................................................................... 45 3.3.1 CD44 ............................................................................................................................................................. 45 3.3.2 E-­‐Cadherin ................................................................................................................................................. 48 3.3.3 N-­‐Cadherin ................................................................................................................................................ 50 3.3.4 K-­‐Cadherin ................................................................................................................................................ 52 3.3.5 Ki-­‐67 ............................................................................................................................................................. 54 3.3.6 p16 ................................................................................................................................................................ 55 3.3.7 PTEN ............................................................................................................................................................ 58 3.4 Kreuztabellen ................................................................................................................................ 59 3.4.1 CD44 ............................................................................................................................................................. 59 3.4.2 E-­‐Cadherin ................................................................................................................................................. 62 3.4.3 N-­‐Cadherin ................................................................................................................................................ 63 3.4.4 K-­‐Cadherin ................................................................................................................................................ 64 3.4.5 Ki-­‐67: ........................................................................................................................................................... 64 3.4.6 p16 ................................................................................................................................................................ 65 3.4.7 PTEN ............................................................................................................................................................ 66 III 4 Diskussion .............................................................................................. 67 5 Zusammenfassung .................................................................................. 81 6 Quellenverzeichnis ................................................................................. 82 7 Abbildungsverzeichnis .......................................................................... 100 8 Anhang: ................................................................................................ 103 8.1 Einverständniserklärung der Patienten: ........................................................................... 103 8.2 Anschreiben Patienten ............................................................................................................. 104 8.3 Anschreiben Einwohnermeldeamt ...................................................................................... 106 8.4 Anschreiben Krankenkasse ................................................................................................... 107 8.5 Anschreiben Ärzte ..................................................................................................................... 108 8.6 Anschreiben Vertrauensstelle des Krebsregisters ......................................................... 109 8.7 Genetische Aberrationen ........................................................................................................ 110 8.8 Nicht signifikante Kreuztabellen: ........................................................................................ 110 9 Danksagungen ...................................................................................... 141 10 Lebenslauf .......................................................................................... 142 IV Abkürzungsverzeichnis: ADPKD Autosomal dominant polycystic kidney disease AJCC American Joint Committee on Cancer ca. Circa CDH1 Cadherin 1 CD44 Cluster of differentation 44 CDK Cyclin-­‐dependent Kinases CDKN2A Cyclin-­‐dependent Kinase Inhibitor 2A DAB 3,3'-­‐Diaminobenzidin E2F Transcription factor 1 HAV Histidin-­‐Alanin-­‐Valin HE Hämatoxylin-­‐Eosin HRP Horseradish peroxidasae HRPCC Hereditary papillary renal cell cancer IgG Immunglobulin G INK4a Inhibitor of kinase 4 IMBS Institut für medizinische Biometrie und Statistik kD Kilodalton LCAM Liver cell adhesion molecule MIB-­‐1 Molecular Immunology Borstel 1 MMAC1 Mutated in Multiple Advanced Cancers mRNA Messenger ribonucleic acid Ms/Rb/Rt Mouse/Rabbit/Rat mTOR Mammalian target of rapamycin pgp1 Phosphoglycoprotein 1 PIP2 Phosphatidylinositol-­‐4,5-­‐bisphosphate PIP3 Phosphatidylinositol-­‐3,4,5-­‐triphosphate PI3K Phosphatidylinositol-­‐3-­‐Kinase PKB/AKT Proteinkinase B pRB Retinoblastom-­‐Protein PTEN Phosphatase and Tensin homolog deleted on chromosome Ten V p16 Protein 16 QAI Histidin-­‐Alanin-­‐Valin RKI Robert Koch-­‐Institut TBS Tris-­‐bufferd-­‐saline TEP1 TGF-­‐β-­‐regulated and epithelial cell-­‐enriched phosphatase TNM Tumor Nodes Metastasen UICC Union internationale contre le cancer UVO Uvomorulin VEGF Vascular Endothelial Growth Factor VHL Von Hippel-­‐Lindau-­‐Syndrom VI 1 Einleitung 1.1 Historisches Bereits vor über 140 Jahren beschrieb Virchow in seinem Werk „Die krankhaften Geschwülste“ Tumoren der Niere [Virchow, 1863]. Aufgrund ihres makroskopischen Aussehens zählte er sie zu den Lipomen. Einer seiner Schüler, Paul Grawitz, glaubte aufgrund des histologischen Aussehens den Ursprung des Tumors in „versprengten Keimen der Nebennierenrinde“ erkannt zu haben [Grawitz, 1883]. Aus diesem Grund entwickelte sich der Begriff des Hypernephroms, der, neben der Bezeichnung Grawitz-­‐ Tumor, fälschlicherweise zum Teil als Synonym des Nierenzellkarzinoms gebraucht wird. Erst spät konnte die Abstammung dieser Tumoren von Tubuluszellen nachgewiesen werden. Von der Bezeichnung Hypernephrom oder hypernephroides Karzinom muss seit diesen Erkenntnissen abgesehen werden [Oberling et al., 1960; Nizze et al., 2004]. Der heute u.a. auch von der WHO verwendete allgemein gehaltene Begriff Nierenzellkarzinom berücksichtigt zusätzlich auch die Heterogenität dieser Neoplasie. 1.2 Epidemiologie Bösartige Neubildungen der Niere stellen etwa 3,1% der Krebserkrankungen in Europa bei Männern und 2,3% bei Frauen dar [Ferlay et al., 2007]. In Deutschland wird dieser Anteil etwas höher mit 4,7% und 3,2% angegeben, was einer jährlichen Rate von 10.750 männlichen und 6.650 weiblichen Neuerkrankten entspricht. Trotz ihres geringen Anteils an bösartigen Neoplasien stehen sie an sechster beziehungsweise elfter Stelle der Krebstodesursachen in Deutschland [www.rki.de, 2010]. Die Inzidenz wird mit ungefähr 20 pro 100.000 für Männer und zwischen 10 bis 14 pro 100.000 für Frauen angegeben [Schubert-­‐Fritschle et al., 2002]. Jedoch wurde zwischen 1980 und 2004 eine Verdopplung dieser Rate beobachtet, was zum Teil auf die verbesserte Qualität sowie bessere 1 Verfügbarkeit bildgebender Verfahren zurückzuführen ist, da hierdurch die Diagnose einfacher gestellt werden konnte [www.rki.de, 2010]. Das Nierenzellkarzinom ist nach dem Harnblasen-­‐ und Prostatakarzinom der dritthäufigste urologische Tumor sowie das häufigste Malignom der Niere [Boeckmann und Jakse, 1993; Decker J, 2002]. Es kann grundsätzlich in jedem Lebensalter auftreten, bevorzugt jedoch im siebten und achten Dezennium. Allgemein erkranken Männer im Mittel mit 67 Jahren, Frauen hingegen etwas später mit 71 Jahren. Bei einem Geschlechterverhältnis von 3:2 bis 2:1 sind Frauen außerdem seltener betroffen [Pascual und Borque, 2008; www.rki.de, 2010; Bretheau et al., 1998]. Auch konnten unterschiedliche geographische und ethnische Häufigkeitsverteilungen aufgezeigt werden [Pantuck et al., 2001]. Des Weiteren wird die Diagnose Nierenzellkarzinom häufiger bei Patienten aus urbanen Ballungsräumen als bei Patienten aus ländlicherem Raum gestellt, wobei ein genauer Grund hierfür nicht genannt wird [Stafford et al., 2008]. Betrachtet man die Überlebenswahrscheinlichkeit der urologischen Tumorentitäten, ist das Nierenzellkarzinom mit Abstand dasjenige mit der schlechtesten Prognose [Brenner, 2002]. 1.3 Ätiologie Die genaue Ätiologie des Nierenzellkarzinoms ist nicht vollständig geklärt. Es wurden jedoch einige Risikofaktoren für das Auftreten dieser Krankheit erkannt. Rauchen ist der stärkste beeinflussbare Risikofaktor des Nierenzellkarzinoms, wobei das Risiko proportional zur Anzahl der gerauchten Zigaretten pro Tag sowie der „pack-­‐years“, also der Anzahl täglich gerauchter Schachteln mal Raucherjahre, ansteigt [McLaughlin et al., 1995]. Adipositas gilt als ein weiterer gesicherter Faktor, der das Erkrankungsrisiko erhöht. Auch eine ungünstige Fettverteilung, eine hohe so genannte „waist-­‐to-­‐hip-­‐ratio“, vermag eine Rolle zu spielen, wohingegen körperliche Aktivität das Risiko zu mindern scheint [Adams et al., 2008; Menezes et al., 2003]. 2 Der arterielle Hypertonus ist ebenfalls als gesicherter Risikofaktor anzusehen [Weikert et al., 2008]. Inwieweit die antihypertensive Medikation allgemein und die Einnahme von Diuretika im Besonderen ein unabhängiges Risiko darstellen ist Gegenstand von Diskussionen [Grossman et al., 1999]. Für Analgetika gilt gleiches. Hier ist die Datenlage am deutlichsten für Phenacetin, welches jedoch 1986 vom deutschen Markt genommen wurde und somit -­‐ auch bei einer Tumorinduktionszeit von 20-­‐30 Jahren -­‐ mittlerweile zu vernachlässigen ist. Einige Autoren sehen hingegen keinen Zusammenhang zwischen Analgetika und einem erhöhten Auftreten des Nierenzellkarzinoms [Lipworth et al., 2006; McCredie et al., 1995; Gago-­‐Dominguez et al., 1999]. Diabetes mellitus wird als weitere Allgemeinerkrankung mit erhöhter Erkrankungswahrscheinlichkeit für ein Nierenzellkarzinom genannt, wobei dies ebenfalls nicht abschließend geklärt ist [Lindblad et al., 1999; Zucchetto et al., 2007]. Inwieweit weitere hormonelle Einflussfaktoren wie Schwangerschaft, die Einnahme von Kontrazeptiva, Hormonsubstitution oder Alter bei Menarche beziehungsweise Menopause die Ereigniswahrscheinlichkeit beeinflussen, wird kontrovers diskutiert [Lee et al., 2009; Zucchetto et al., 2008; Kabat et al., 2007]. Die meisten Tumoren der Niere treten sporadisch auf, es konnte aber ein erhöhtes Erkrankungsrisiko bei positiver Familienanamnese aufgezeigt werden [Gago-­‐Dominguez et al., 2001; Hung et al., 2007]. Des Weiteren sind zurzeit ca. zehn genetische Erkrankungen, die mit einer erhöhten Neigung zu Nierenzellkarzinomen einhergehen, bekannt [Kopper und Timar, 2006]. Die bekanntesten unter ihnen sind das von Hippel-­‐ Lindau-­‐Syndrom, die autosomal dominant vererbte polyzystische Nierenerkrankung (ADPKD), die familiäre Form des papillären Nierenzellkarzinoms (HPRCC), das Birt-­‐Hogg-­‐ Dube-­‐Syndrom sowie die tuberöse Sklerose. Diese erblichen Tumorfälle belaufen sich jedoch nur auf etwa 3 bis 5 % aller Fälle und manifestieren sich meist in einem früheren Alter als das sporadische Nierenzellkarzinom [Coleman und Russo, 2009; Hajj et al., 2009]. 3 Nicht nur hereditäre sondern auch andere sporadische Erkrankungen prädisponieren für die Entwicklung eines Nierentumors. So gelten sowohl das dialysepflichtige chronische Nierenversagen wie auch die längerfristige Hämodialyse selbst als Risikofaktor [Nouh et al., 2009; Vamvakas et al., 1998; Kojima et al., 2006]. Die Art der Ernährung scheint im Gegensatz zu früheren Meinungen keine Rolle in der Entwicklung des Nierenzellkarzinoms zu spielen [Lee et al., 2008]. Es zeigte sich hingegen, dass moderater Alkoholkonsum die Erkrankungswahrscheinlichkeit sogar zu senken vermag [Lee et al., 2007; Pelucchi et al., 2008]. Auch sozioökonomische Faktoren beeinflussen die Erkrankungsrate. So stehen die Schwermetallverarbeitung, die Petrochemie oder die Arbeit mit Lösungsmitteln -­‐ wie etwa in chemischen Reinigungen -­‐ und noch viele weitere gewerblich genutzte Stoffe im Verdacht diese zu erhöhen [Mandel et al., 1995; Heck et al., 2009]. Die berufliche Exposition gegenüber Metallen wie Cadmiumverbindungen oder Blei sowie zu Stoffen wie Asbest oder Trichlorethylen scheint nephrokanzerogen zu sein [Chow und Devesa, 2008; Pesch et al., 2000]. Das Entstehen eines Sekundärkarzinoms durch ionisierende Strahlen, beispielsweise bei Behandlung aufgrund eines Zervixkarzinoms oder Spondylitis ankylosans, kann nicht ausgeschlossen werden [Pascual und Borque, 2008; Lipworth et al., 2006]. Für einen Zusammenhang zwischen oberen Harnwegsinfekten und einem daraus folgendem erhöhten Risiko besteht eine nur dürftige Datenlage [Parker et al., 2004]. Als weitere Infektionskrankheit geht eine HIV-­‐Infektion mit einer bis zu 8,5fach erhöhten Prävalenz des Nierenzellkarzinoms einher [Pascual und Borque, 2008]. 4 1.4 Klassifikation So wie das Nierenzellkarzinom makroskopisch aufgrund von Nekrosen, Hämorrhagien und Zysten ein „buntes“ Bild aufweist [Nizze et al., 2004], ist es auch histopathologisch eine heterogene Entität. Aus diesem Grund stehen verschiedene Klassifikationen zur Auswahl. Der vorliegenden Arbeit dienen die Heidelberg-­‐Klassifikation und die Klassifikation der UICC und AJCC als Grundlage, welche sich im Wesentlichen decken und auf welchen die noch weiter unterteilten Klassifikationen der WHO von 1998 und 2004 aufbauen [Storkel et al., 1997; Kovacs et al., 1997; Montironi et al., 1999]. In beiden Klassifikationen werden die benignen parenchymatösen Neoplasien von den malignen getrennt. Innerhalb der Malignome werden im Einzelnen das klarzellige Nierenzellkarzinom, das papilläre Nierenzellkarzinom, das chromophobe Nierenzellkarzinom sowie das Sammelrohrkarzinom (Ductus-­‐Bellini-­‐Karzinom) mit dessen Variante, dem medullären Nierenzellkarzinom, unterschieden. Eine weitere Gruppe stellen die nicht klassifizierbaren Nierenzellkarzinome dar (siehe Tabelle 1). Die häufigste Entität ist mit mindestens 80% das klarzellige Nierenzellkarzinom, gefolgt vom papillären Nierenzellkarzinom mit circa 10%. Chromophobe Nierenzellkarzinome belaufen sich auf maximal 5%. Gerade 1% aller Nierenzellkarzinome sind Ductus-­‐Bellini-­‐Karzinome. Die übrigen Karzinome lasen sich nicht klassifizieren [Capitanio et al., 2009; Moch et al., 2000; Patard et al., 2005]. 5 Heidelberg 1997 UICC/AJCC 1997 Benign Metanephric adenoma and adenofibroma Papillary renal cell adenoma Renal oncocytoma Malignant Common or conventional renal c ell carcinoma Papillary renal cell carcinoma Chromophobe renal cell carcinoma Collecting duct carcinoma (variant: medullary carcinoma) Renal cell carcinoma, unclassified Benign Metanephric adenoma and adenofibroma Papillary renal cell adenoma Renal oncocytoma Malignant Conventional (clear cell ) renal c arcinoma Papillary renal cell carcinoma Chromophobe renal cell carcinoma Collecting duct carcinoma (variant: medullary carcinoma) Renal cell carcinoma, unclassified Tabelle 1: Klassifikation des Nierenzellkarzinoms, nach [Montironi et al., 1999] Das klarzellige Nierenzellkarzinom erscheint aufgrund des hohen Glykogen-­‐ und Lipidanteils im HE gefärbten Schnitt farblos beziehungsweise hell weshalb z. T. auch der Begriff hellzelliges Nierenzellkarzinom benutzt wird. Als Ausgangsgewebe wird der proximale Tubulus angenommen (siehe Abbildung 1) [Decker J, 2002; Nizze et al., 2004]. Mutationen im VHL-­‐Gen auf dem kurzen Arm von Chromosom 3 sind der Auslöser des gleichnamigen Syndroms. Bei diesem Syndrom ist das klarzellige Nierenzellkarzinom die häufigste Todesursache. Auch in circa 80% der sporadischen Fälle finden sich Veränderungen in diesem Gen [Decker J, 2002; Latif et al., 1993; Whaley et al., 1994; Brauch et al., 2000; Nickerson et al., 2008]. Weitere genetische Aberrationen können Tabelle 24 im Anhang entnommen werden. 6 Abb. 1: Ursprungsorte des Nierenzellkarzinoms, aus [Decker J, 2002] Das papilläre Nierenzellkarzinom entstammt ebenfalls dem proximalen Tubulus. Es wurde aufgrund seines Wachstumsmusters benannt und wird in Typ I und II, welche unterschiedliche Eigenschaften und Prognosen haben, eingeteilt [Delahunt und Eble, 1997; Decker J, 2002]. Sie werden in anderen Klassifikationen der Histologie wegen auch als eosinophil und basophil bezeichnet. Verschiedene Trisomien sowie der Verlust des Y-­‐ Chromosoms scheinen mit dem papillären Karzinom assoziiert [Lopez-­‐Beltran et al., 2009]. Des Weiteren kann sowohl bei der sporadischen als auch bei der familiären Form (HPRCC) des papillären Nierenzellkarzinoms eine Aktivierung des c-­‐Met-­‐Onkogens auf dem langen Arm des Chromosoms 7 gefunden werden [Coleman und Russo, 2009]. Die Zellen des chromophoben Karzinoms stammen aus distalen Nephronabschnitten [Storkel et al., 1989; Decker J, 2002]. Das Birt-­‐Hogg-­‐Dube-­‐Syndrom kann mit mehreren Formen des Nierenzellkarzinoms einhergehen, manifestiert sich jedoch in über 80% der Fälle als chromophobes Karzinom oder als Mischform mit chromophoben und onkozytären Anteilen. Ein weiterer Tumor des distalen Nephronabschnittes ist das eher seltene Sammelrohr-­‐ oder Ductus-­‐Bellini-­‐Karzinom. Auch diesem Tumor konnten, wie Tabelle 24 im Anhang zeigt, genetische Veränderungen zugeordnet werden. Jedoch ist diese Entität aufgrund 7 ihrer niedrigen Inzidenz insgesamt wenig erforscht und verstanden [Chao et al., 2002; Polascik et al., 2002]. 1.5 Staging Alternativ zur histologischen Klassifikationen lassen sich Nierenzellkarzinome anhand ihrer Ausdehnung einteilen. Hierfür wird die von der UICC herausgegebene so genannte TNM-­‐Klassifikation benutzt, welche Tumoren nach Tumorausdehnung beziehungsweise Größe, Lymphknotenbefall sowie Metastasierungsstatus beschreibt. Die Tumoren werden hiernach in Gruppen eingeteilt, sodass sich aufgrund statistischer Untersuchungen Aussagen über das biologische Verhalten in einzelnen Stadien treffen lassen. Dieses histologische Staging wird laufend aktualisiert. Im Zeitraum der Datenerhebung sind mehrere Auflagen dieser Klassifikation erschienen (siehe Tabelle 2). Was das Stadium T3 betrifft, welches Gegenstand der vorliegenden Arbeit ist, wurde in den neueren Versionen eine weitere Untergruppe hinzugefügt. Dieses Stadium T3c war im Patientenkollektiv dieser Arbeit jedoch nicht vertreten [UICC, 1998, 2002, 2010]. 8 TNM 1997 TNM 2002 TNM 2010 Tx Primärtumor kann nicht beurteilt werden T0 Kein Anhalt für Primärtumor T1 Tumor 7 cm oder weniger in größter Ausdehnung, begrenzt auf die Niere T1a T1b Tumor 4 cm oder weniger in größter Ausdehnung, begrenzt auf die Niere Tumor mehr als 4 cm, aber nicht mehr als 7 cm in größter Ausdehnung, begrenzt auf die Niere T2 T2a Tumor mehr als 7 cm in größter Ausdehnung, begrenzt auf die Niere Tumor mehr als 7 cm, aber nicht mehr als 10 cm in größter Ausdehnung T2b Tumor mehr als 10 cm in größter Ausdehnung T3 Tumor breitet sich in größere Venen aus, oder infiltriert Nebenniere oder Tumor breitet sich in größere Venen perirenales Gewebe, jedoch nicht jenseits der Gerota-­‐Faszie aus oder infiltriert direkt perirenales Gewebe, jedoch nicht in die ipsilaterale Nebenniere und nicht über die Gerota-­‐Faszie hinaus T3a Tumor infiltriert Nebenniere oder perirenales Gewebe, aber nicht jenseits Tumor der Gerota-­‐Faszie mit makroskopischer Ausbreitung in die Nierenvene oder ihre segmentalen Äste (mit muskulärer Wand) oder Infiltration des perirenalen und/oder peripelvinen Fettgewebes, aber nicht über die Gerota-­‐Faszie hinaus T3b Tumor infiltriert Nierenvene oder Tumor infiltriert Nierenvene oder Tumor Hohlvene Hohlvene unterhalb Zwerchfells T3c makroskopischer des Ausdehnung in die Vena cava unterhalb des Zwerchfells Tumorausdehnung in Hohlvene Tumor oberhalb des Zwerchfells mit mit makroskopischer Ausdehnung in die Vena cava oberhalb des Zwerchfells oder mit Infiltration der Wand der Vena cava T4 Tumorausdehnung über Gerota-­‐Faszie hinaus Tumor infiltriert über Gerota-­‐Faszie hinaus oder die kontinuierliche Ausbreitung in die ipsilaterale Nebenniere 9 Nx regionäre Lymphknoten nicht beurteilbar N0 Kein Anhalt für regionäre Lymphknotenmetastasen N1 Metastase in einem benachbarten Lymphknoten N2 Metastase in mehr als einem benachbarten Lymphknoten Mx Vorliegen von Fernmetastasen kann nicht beurteilt werden M0 Kein Anhalt für Fernmetastasen M1 Fernmetastasen Tabelle 2: Modifikationen der TNM Stadien, eigene Grafik 1.6 Grading Nierenzellkarzinome werden auch nach ihrem histologischen Malignitätsgrad beurteilt. Dieses als Grading bezeichnete Differenzierungsmerkmal beurteilt Tumorzellen anhand zytoplasmatischer und architektonischer Merkmale. Das im angloamerikanischen Sprachraum etablierte vierstufige Grading nach Fuhrman ist nur eines von vielen vorgeschlagenen Systemen [Fuhrman et al., 1982; Novara et al., 2007]. In der vorliegenden Arbeit wird wie auch bei der Klassifikation, in Anlehnung an die UICC, ein dreistufiges Grading benutzt. Dieses beurteilt die Abweichung der Tumorzellen vom Normalgewebe. Die Einteilung unterscheidet gut (G1) von mäßig (G2) und schlecht (G3) differenzierten Tumoren. Als Gx werden nicht beurteilbare Tumoren bezeichnet. 1.7 Prognose und Prognosefaktoren Wie bereits erwähnt ist das Nierenzellkarzinom der Tumor mit der schlechtesten Prognose unter den urologischen Malignomen [Brenner, 2002]. Die 5-­‐Jahres-­‐ Überlebensrate aller Nierenzellkarzinome liegt bei 66% [www.rki.de, 2010]. Das Überleben in organbegrenzten Stadien (T1, T2) ohne Lymphknotenbefall (N0), die mit einer 5 Jahres-­‐Überlebensrate von 85% angegeben werden, ist im Vergleich zum organübergreifenden Stadium (ab T3) deutlich besser. Im Stadium T3 weist die Erkrankung eine 5-­‐Jahres-­‐Überlebensrate von nur noch etwa 53% auf. Diese sinkt in 10 einem bereits metastasierten Stadium auf gerade 10% [www.rki.de, 2010; Bukowski, 2009; Eggener et al., 2006]. Angesichts der Tatsache, dass bei bereits 20-­‐30% der Patienten bei Diagnose Fernmetastasen bestehen sowie nochmals ca. 20-­‐30% nach Nephrektomie Fernmetastasen entwickeln, sind besonders in diesen höheren Stadien weitere prognostische Unterteilungshilfen erforderlich [Bukowski, 2009; Ljungberg, 2007]. Die verschiedenen Prognosefaktoren lassen sich in anatomische, histologische, klinische und molekulare Kategorien einteilen [Ljungberg et al., 2007]. Weiterhin stehen mehrere Prognosescores zur Auswahl. Die anatomischen Faktoren, welche die Prognose bestimmen, werden weitestgehend in der TNM-­‐Klassifikation zusammengefasst (s. oben). Deren prognostische Aussagekraft wurde in zahlreichen Studien belegt [Gettman et al., 2001; Kanao et al., 2009]. Unabhängig von anderen Parametern besitzt die Tumorgröße eine Aussage über das Überleben. Die kritische Größe, ab welcher die Prognose signifikant schlechter wird, ist hingegen Gegenstand von Diskussionen [Miyagawa et al., 2007; Lam et al., 2005; Ficarra et al., 2005]. Aus diesem Grund wurden in der aktuellen Version der TNM-­‐Klassifikation die Stadieneinteilungen hinsichtlich der Tumorgröße verändert. Auch die Tumorausdehnung bestimmt je nach Infiltration von Nachbargeweben wie Venensystem, Nebenniere oder perirenalem Fett das Überleben und fließt hier mit ein [Lam et al., 2005]. Nicht berücksichtigt wurde hingegen eine Beteiligung der ableitenden Harnwege, die mit einer schlechteren Prognose assoziiert sein soll [Verhoest et al., 2009]. Des Weiteren wird der Lymphknotenstatus berücksichtigt, welcher auch beim bereits metastasierten Nierenzellkarzinom zusätzliche Informationskraft zu besitzen scheint [Lughezzani et al., 2009]. Das Vorhandensein von Fernmetastasen stellt unter den anatomische Prognosefaktoren den wichtigsten dar und entscheidet, wie oben verdeutlicht, wesentlich das Überleben [www.rki.de, 2010]. Im Falle eines metastasierten Nierenzellkarzinoms spielen die übrigen anatomischen Prognosefaktoren eine nur noch untergeordnete Rolle [Neuzillet et al., 2009]. 11 Beim Vergleich der einzelnen histologischen Subtypen fallen unterschiedliche Prognosen auf. Es wurde gezeigt, dass die 5-­‐Jahres-­‐Überlebensrate des klarzelligen Nierenzellkarzinoms mit annähernd 70% im Vergleich zu der der papillären und chromophoben Form mit ca. 85% deutlich schlechter ist [Cheville et al., 2003]. Bezieht man jedoch weitere Prognosefaktoren wie das TNM Stadium oder das Grading mit ein, verliert diese Aussage an Bedeutung [Capitanio et al., 2009]. Als weiterem histologischen Merkmal kommt dem Vorhandensein von Nekrosezonen innerhalb des Tumors unabhängige prognostische Bedeutung zu [Sengupta et al., 2005]. Eine sarkomatoide Differenzierung des Tumorgewebes sowie positive Schnittränder nach Tumornephrektomie gehen ebenfalls mit einer eingeschränkten Prognose einher [Coons et al., 2009]. Auch das klinische Bild des Patienten kann weiteren Aufschluss über die zu erwartende Überlebensdauer geben. Allgemeinzustand, Alter, Geschlecht, Kachexie, Anämie sowie eine erhöhte Thrombozytenzahl scheinen sich auf die Prognose auszuwirken [Kim et al., 2003; Erdemir et al., 2007; Yasunaga et al., 1998; Sunela et al., 2009]. Es wurden verschiedenste molekulare Marker beschrieben, die eine prognostische Aussage besitzen sollen. Die prominentesten unter ihnen sind die Carboanhydrase IX und der vaskuläre endotheliale Wachstumsfaktor (VEGF, vascular endothelial growth factor). Die Datenlage bei einer Vielzahl weiterer Biomarker ist vielversprechend. Jedoch ist noch keiner von ihnen im allgemeinen Gebrauch [McGuire und Fitzpatrick, 2009; Ljungberg et al., 2007]. Im Folgenden werden jedoch nur diejenigen Biomarker, die in dieser Arbeit verwendet werden, ausführlich erläutert. 12 1.8 Die Marker 1.8.1 CD44 CD44 (cluster of differentation 44) charakterisiert eine heterogene Gruppe von Adhäsionsmolekülen. Dies sind verschiedene Glykoproteine, die integraler Bestandteil der Zellmembran sind [Aruffo et al., 1990]. Sie sind die Endprodukte eines ca. 50 Kilobasen großen DNA-­‐Abschnittes auf dem kurzen Arm von Chromosom 11, der mindestens 20 Exons umfasst. Für die von diesen Genen kodierten Produkte wurde zunächst ein Protein mit einem Molekulargewicht von 85 kD identifiziert. Diese Standardform CD44s wird aufgrund der Erstbeschreibung auf hämatopetischen Zellen auch CD44h genannt. Durch alternatives Spleißen und posttranslationale Modifikation, wie beispielsweise Glykosylierung, können ca. 10 verschiedene Isoformen generiert werden. Diese Varianten werden mit CD44v 1 bis 10 bezeichnet und unterscheiden sich in der Länge ihrer extrazellulären Domäne. Dies findet einerseits Ausdruck im Molekulargewicht (85 bis 200 kD), andererseits äußert es sich in der Funktion [Rudzki und Jothy, 1997; Tolg et al., 1993; Borland et al., 1998]. Der Hauptligand von CD44 ist das Matrixprotein Hyaluronsäure, was der Adhäsion an die extrazelluläre Matrix dient. Weitere Liganden sind unter anderem Kollagen Typ 1, Laminin und Fibronektin. CD44 ist jedoch nicht nur mit dem Extrazellularraum, sondern auch mit dem Zytoskelett verbunden, vermittelt hierdurch Zell-­‐Zell-­‐Kontakte und scheint auch an der Signaltransduktion beteiligt zu sein [Isacke, 1994]. Eine weitere Rolle spielt das auch Hermes Antigen oder pgp1 genannte Molekül in der Lymphopoese, der Hämatopoese sowie dem Lymphozyten-­‐Homing, einem Rezirkulationsprozess der Lymphozyten zwischen Blutgefäßsystem und lymphatischen Organen [Underhill, 1992; Aruffo et al., 1990; Rudzki und Jothy, 1997; Isacke und Yarwood, 2002]. Im Ausblick auf die hier behandelte Fragestellung steht jedoch die Rolle von CD44 bei der Entstehung von Neoplasien beziehungsweise Metastasen sowie dem biologischen Verhalten von Tumoren im Vordergrund. Dieses biologische Verhalten zeigte sich bei einer Vielzahl von Tumoren mit abweichender CD44 Expression im Vergleich zum Normalgewebe verändert, wie beispielsweise bei Tumoren der Lunge, des Ovars, des 13 Darmes, der Harnblase, der weiblichen Brust sowie bei neuroendokrinen Tumoren und hämatoonkologischen Erkrankungen [Du et al., 2008; Cho et al., 2006; Liu und Jiang, 2006; Lai et al., 2005; Le et al., 2006; Muramaki et al., 2004; Abraham et al., 2005]. 1.8.2 Cadherine Die Gruppe der Cadherine gehört, wie auch CD44, zu den Adhäsionsmolekülen. Es handelt sich um transmembranöse Glykoproteine, die zunächst dadurch charakterisiert wurden kalziumabhängig Zellkontakte zu vermitteln [Takeichi, 1990]. Der Name leitet sich vom englischen „calcium adhering“ (Kalzium anheftend) ab. Man findet diese Proteine in verschiedenen Zellkontakten, unter anderem in Desmosomen [Pokutta und Weis, 2007]. Die Cadherinfamilie umfasst mittlerweile über 100 Moleküle, die in 6 Unterfamilien eingeteilt werden [Nollet et al., 2000]. Die in dieser Arbeit untersuchten Cadherine E, N und K gehören zu den so genannten klassischen Cadherinen, welche strukturell 5 Ectodomänen besitzten. Diese auch Cadherindomänen oder Cadherinmotive genannten Abfolgen von ca. 110 Aminosäureresten sind für die unterschiedlichen Cadherine jeweils charakteristisch. Unter ihnen richtet sich besonderes Augenmerk auf die Ectodomäne 1, da sie hauptsächlich für die Interaktion zwischen den Cadherinen verantwortlich ist. Gemeinsam sind den Catherinen eine einzelne transmembranöse Domäne sowie die intrazelluläre Interaktion mit Cateninen [Shapiro und Weis, 2009]. Die klassischen Cadherine werden aufgrund ihrer extrazellulären, N-­‐terminalen Aminosäuresequenz in zwei Untergruppen eingeteilt. E-­‐Cadherin und N-­‐Cadherin gehören zu Typ I, welcher sich durch das so genannte HAV-­‐Motiv (Histidin-­‐Alanin-­‐Valin) auszeichnet. K-­‐Cadherin besitzt zwar ebenfalls 5 Ectodomänen und interagiert intrazellulär mit Cateninen, zeigt jedoch die Abfolge QAI (Glutamin-­‐Alanin-­‐Isoleucin), weshalb es zu den Cadherinen des Typs II gezählt wird [Stemmler, 2008]. In den unterschiedlichen Gewebearten werden verschiedene Cadherinexpressionsmuster gefunden, was bereits darauf hinweist, dass Catherine außer der mechanischen Verbindung von Zellen untereinander noch weitere, spezifische Funktionen besitzen [Halbleib und Nelson, 2006]. Sie spielen eine essentielle Rolle in der Gewebedifferenzierung sowie der Aufrechterhaltung der Zellpolarität 14 innerhalb eines Gewebeverbandes. Auch beispielsweise an der Neuroplastizität von Synapsen scheinen sie beteiligt zu sein [Halbleib und Nelson, 2006; Gumbiner, 2005; Stepniak et al., 2009]. 1.8.2.1 E-­‐Cadherin E-­‐Cadherin gilt als Prototyp der gesamten Cadherinfamilie und wurde innerhalb dieser Familie am besten untersucht. Es handelt sich hierbei um ein Glykoprotein mit einem Molekulargewicht von 120 kD, welches von einem Gen namens CDH1 (Synonyme: UVO, LCAM) auf dem langen Arm von Chromosom 16 kodiert wird [Berx et al., 1995]. E steht für epithelial, da E-­‐Cadherin auf allen Epithelien nachgewiesen werden kann [Jiang, 1996]. Es spielt eine essentielle Rolle bei der Stabilität eines Zellverbandes. So ist E-­‐Cadherin beispielsweise Bestandteil von Desmosomen. Hauptsächlich vermittelt E-­‐Cadherin homotype Bindungen; es verbindet also Zellen miteinander, die beide dieses Cadherin exprimieren. Jedoch wurden auch heterotype Bindungen beschrieben [Stemmler, 2008]. Für die Stabilität dieser Verbindungen wird ionisiertes Kalzium benötigt [Pokutta und Weis, 2007]. 1.8.2.2 N-­‐Cadherin Wie E-­‐Cadherin gehört auch N-­‐Cadherin zur Gruppe der klassischen Cadherine. Zunächst wurde N-­‐Cadherin auf neuronalem Gewebe beschrieben, woraus später der Name resultierte. Es handelt sich um ein Protein mit einer Molekülmasse von 130 kD, welches von einem 16 Exons umfassenden Gen auf dem langen Arm von Chromosom 18 kodiert wird [Gumbiner, 2005; Grunwald et al., 1982; Wallis et al., 1994]. Als Adhäsionsmolekül vermittelt auch N-­‐Cadherin in der Hauptsache homotype Bindungen, wenngleich auch Heterodimere nachgewiesen wurden [Shan et al., 2000]. Wie auch andere Mitglieder seiner Familie spielt N-­‐Cadherin eine bedeutende Rolle in der Embryonalentwicklung 15 sowie der Aufrechterhaltung von Gewebearchitektur und Zellmorphologie. Hierbei ist hervorzuheben, dass N-­‐Cadherin diese Aufgaben nicht ausschließlich in neuronalem Gewebe wahrnimmt, sondern beispielsweise auch für die Organogenese des Herzens unerlässlich ist [Kadowaki et al., 2007; Derycke und Bracke, 2004; Redies und Takeichi, 1996]. 1.8.2.3 K-­‐Cadherin K-­‐Cadherin (Kidney-­‐Cadherin) wurde erstmals in Nieren und Gehirn von Ratten gefunden. Ein erhöhtes Maß an dieses Protein kodierende mRNA konnte in Tumoren der Rattenniere nachgewiesen werden. Kurz darauf fand man in Cadherin 6 das humane Gegenstück, welches in der menschlichen Niere und auch in menschlichen Tumoren, insbesondere solcher der Niere, exprimiert wird [Xiang et al., 1994; Shimoyama et al., 1995]. K-­‐Cadherin und Cadherin 6 werden synonym benutzt und von einem Gen auf dem kurzen Arm von Chromosom 5 kodiert [Chalmers et al., 1999]. Es handelt sich um ein 790 Aminosäuren umfassendes Molekül, welches in der gesunden Niere nur im proximalen Tubulus nachweisbar ist und zu den klassische Cadherinen vom Typ II gezählt wird [Paul et al., 1997; Shimoyama et al., 1995; Stemmler, 2008]. 1.8.3 Ki-­‐67 Das Ki-­‐67 Antigen ist ein so genannter Proliferationsmarker. Gerdes et al. entdeckten bei der Forschung mit Hodgkin-­‐ und Sternberg-­‐Reed-­‐Zellen durch den Ki-­‐67-­‐Antikörper markierte nukleäre Proteine, die nur in proliferierenden Zellen, d.h. in Zellen, die sich in den Phasen G1,S,G2 und der Mitose befinden, vorhanden waren [Gerdes et al., 1983; Gerdes et al., 1984]. Über zwanzig Jahre hatte diese Aussage Bestand. Heute ist bekannt, dass auch ruhende Zellen in der G0 Phase dieses Protein, wenngleich in minimaler Weise, exprimieren, was die Aussagekraft dieses Moleküls jedoch nicht schmälert [Bullwinkel et 16 al., 2006]. Der Name setzt sich aus dem Entdeckungsort Kiel sowie der Nummer des Zellklons, welcher diesen Antikörper produzierte, zusammen [Scholzen und Gerdes, 2000]. Zwar wurde bewiesen, dass Ki-­‐67 essentiell für die Proliferation von Zellen ist und es liegen zwar genaue Erkenntnisse über Menge und Lokalisation des Proteins während des Zellzyklus vor. Trotz all dem ist jedoch über die genaue Funktion des Proteins wenig bekannt [Kausch et al., 2003; Schluter et al., 1993]. Das kodierende Gen befindet sich auf dem langen Arm von Chromosom 10 und setzt sich aus 15 Exons zusammen [Schonk et al., 1989; Fonatsch et al., 1991]. Durch alternatives Spleißen entstehen zwei Isoformen, die sich in ihren Molekülmassen von 345 bzw. 395 kD unterscheiden [Gerdes et al., 1991]. Gemeinsam haben die Isoformen eine Abfolge von 22 Aminosäuren, die von einem als „Ki-­‐67 motif“ bezeichnetem Genlocus kodiert wird. Diese Abfolge enthält das Epitop, welches von dem in dieser Arbeit verwendeten Antikörper MIB-­‐1 (Molecular Immunology Borstel) markiert wird [Schluter et al., 1993]. 17 1.8.4 p16 P16 ist eines von zwei Produkten, die durch Verschiebung des Leserasters aus einem Gen namens INK4A oder auch CDKN2A auf dem kurzen Arm von Chromosom 9 hervorgehen können [Robertson und Jones, 1999]. P16 ist ein Inhibitor so genannter Cyklin-­‐abhängiger Kinasen (CDKs, Cyclin-­‐dependent Kinases) [Serrano et al., 1993]. Diese Kinasen kontrollieren die verschiedenen Abschnitte des Zellzyklus und stehen ihrerseits unter der Kontrolle der regulatorischen Cykline. P16 greift in den Retinoblastom-­‐Signalweg ein, in welchem CDKs in Anwesenheit von Cyklinen das Produkt des Retinoblastomgens (pRB) phosphorylieren. Durch den hierdurch losgetretenen Signalweg kommt es zur Freisetzung von Transkriptionsfaktoren, insbesondere von E2F, welcher maßgeblich am Übergang der G1-­‐ zur S-­‐Phase des Zellzyklus beteiligt ist [Sherr, 2000]. Durch die Inhibierung der Phosphorylierung von pRB durch p16 ist ein Fortschreiten des Zellzyklus nicht möglich und es kommt zum Arrest in der G1 Phase [Sherr, 1996]. 1.8.5 PTEN PTEN (Phosphatase and Tensin homolog deleted on chromosome Ten) ist ein Tumorsupressorgen, das auf dem langen Arm von Chromosom 10 (10q23.3) lokalisiert ist. Es umfasst neun Exons mit einem variablen Exon 5b. 1997 wurde PTEN von gleich drei Forschungsgruppen unter unterschiedlichen Namen beschrieben, weshalb auch die Synonyme MMAC1 (Mutated in Multiple Advanced Cancers) und TEP1 (TGF-­‐β-­‐regulated and epithelial cell-­‐enriched phosphatase) verwendet werden. Das Transskript ist eine aus 403 Aminosäuren bestehende Phosphatase, die eine Sequenzhomologie zu Tensin besitzt; einem aktinbindenden Protein, das beispielsweise in Zell-­‐Zell-­‐Kontakten vorkommt [Li et al., 1997; Sharrard und Maitland, 2000; Steck et al., 1997; Li und Sun, 1997]. Neben einer essentiellen Funktion während der Embriogenese und Zellmigration greift PTEN in wichtige Signalwege des Zellzyklus ein [Yamada und Araki, 2001]. 18 Einer unter ihnen ist der Phosphatidyl-­‐Inositol-­‐3-­‐Kinase (PI3K)-­‐Signalweg. Bereits zu Beginn dieses Signalweges wird Phosphatidylinositol-­‐4,5-­‐Bisphosphat (PIP2) zu Phosphatidylinositol-­‐3,4,5-­‐Trisphosphat (PIP3) phosphoryliert. PIP3 bringt im Rahmen eines second messenger Signals weitere Signalkaskaden wie den Proteinkinase-­‐B-­‐ Singnalweg (PKB/AKT) in Gang, welcher wiederum vielschichtige Auswirkungen auf die Zellregulation besitzt. Unter anderem aktiviert PKB/AKT die Kinase mTOR, dem Angriffspunkt von Temsirolimus, einem Immunsuppressivum, welches beim bereits metastasierten Nierenzellkarzinom Verwendung findet. Im Zellkern kommt es über weitere Zwischenschritte durch den PI3K Signalweg beispielweise zur Aktivierung von proapoptotischen Genen [Cully et al., 2006; Leslie und Downes, 2004; Di Cristofano und Pandolfi, 2000; Dahia et al., 1999; Nakamura et al., 2000]. Die Phosphatase PTEN unterbricht diese Signalkaskade, indem PIP3 an Position 3 dephosphoryliert wird. Ein Mangel an PTEN kann also zu verminderter Apoptose sowie gesteigerter Proliferation und Angioneogenese in Tumoren führen und scheint über seinen Einfluss im PI3K Signalweg an der Entstehung von Tumoren mitbeteiligt zu sein [Hamada et al., 2005; Blanco-­‐Aparicio et al., 2007]. 19 1.9 Ziele der Arbeit Die bekannten klinischen und histopatholgischen Parameter Staging und Grading können die Prognose gerade in den höheren Tumorstadien nur unzureichend und undifferenziert wiedergeben. Wie oben beschrieben sind bei Diagnose jedoch viele Tumoren bereits in fortgeschrittenem Stadium. Da gerade diese Stadien schlechte Therapiemöglichkeiten und eine ungünstige Prognose besitzen, besteht großes Interesse weitere, sichere Unterscheidungsmerkmale hinsichtlich des Überlebens sowie potentielle Angriffspunkte neuer, zielgerichteter Therapien ausfindig zu machen. Ziel dieser Arbeit ist es, die beschriebenen immunhistochemischen Marker auf eine mögliche Korrelation mit dem Überleben von an einem Nierenzellkarzinom im Stadium T3 erkrankten Patienten zu überprüfen und hinsichtlich ihrer Tauglichkeit als Prognosefaktor zu erörtern. Des Weiteren werden bereits etablierte histopathologische Parameter am vorliegenden Kollektiv verifiziert und auf einen Zusammenhang mit den verwendeten Biomarkern untersucht. 20 2 Material und Methoden 2.1 Das Patientenkollektiv Das Kollektiv umfasste zunächst alle 122 an einem Nierenzellkarzinom im Stadium T3 erkrankten Patienten, die im Zeitraum von 1993 bis 2002 in der Klinik für Urologie des Universitätsklinikums der Universität zu Lübeck operativ versorgt wurden. Bei Proben von lebenden Patienten bedurfte es laut Ethikkommission (Antragnummer 06-­‐134 vom 21.7.2008) zur Verwendung des Tumormaterials einer Einwilligungserklärung. Um die Einwilligung beziehungsweise Informationen über den Verbleib oder das mögliche Ableben der Patienten zu erhalten, wurden verschiedene Stellen angeschrieben. Nachdem die Eigenauskunft der Patienten sowie die Informationen von Angehörigen, des Einwohnermeldeamtes, der zuletzt behandelnden Ärzte, der Vertrauensstelle des Krebsregisters sowie der Krankenkassen zusammengetragen wurden, konnten 96 Proben verwendet werden. (Fragebögen/ Anschreiben siehe Anhang) Zu einer weiteren Reduktion des Kollektivs kam es, da 3 Gewebeproben nicht auffindbar waren oder durch vorherige Untersuchungen nicht ausreichend repräsentatives Material vorhanden war. Im Verlauf wurde eine weitere Probe als Urothelkarzinom identifiziert und deshalb nicht in die Studie aufgenommen. Das Kollektiv setzte sich somit aus 92 Patienten zusammen. 2.2 Datenerhebung Die Datenerhebung erfolgte retrospektiv und die erforderlichen Parameter wurden den Krankenakten bzw. den Datenbanken der Klinik für Urologie und dem Institut für Pathologie der Universität zu Lübeck entnommen. Gegebenenfalls mussten sie durch Auskünfte der Patienten, deren Angehörigen oder durch die behandelnden Hausärzte 21 ergänzt werden. Das Follow-­‐up der Patienten endete bei einer mittleren Nachbeobachtungszeit von 129,2 Monaten am 12.11.2008. 2.3 Immunhistochemie Antikörper binden spezifisch und mit hoher Affinität an einen bestimmten Molekülabschnitt eines Antigens, einem sogenannten Epitop. Diese Eigenschaft macht sich die Immunhistochemie zu Nutze. Das gewünschte Antigen wird nicht selbst angefärbt, sondern durch einen markierten Antikörper, der an seinem entsprechenden Epitop bindet, sichtbar gemacht. Wird der Antikörper zuvor mit einem fluoreszierenden Stoff verbunden, kann der Antikörper, und damit auch das Antigen, im Fluoreszenzmikroskop detektiert werden. Um dies auch im Lichtmikroskop zu erreichen müssen andere Markermoleküle verwendet werden. Hierbei wird der Antikörper zuvor mit einem Enzym verbunden, das eine Reaktion katalysiert. So entsteht unter Zugabe eines Chromogens ein Farbstoff, welcher die Lokalisation des Antigens sichtbar macht. Dies wird als direkte Methode bezeichnet. Wird jedoch nicht der Antikörper (=Primärantikörper) mit einem Enzym konjugiert, sondern in einem zweiten Schritt ein (mehrfach) enzymmarkierter Sekundärantikörper (Enhancer) mit dem primären verbunden, spricht man von indirekter Immunhistochemie. Diese Technik wurde in der vorliegenden Arbeit verwendet und hat den Vorteil, das Farbsignal zu verstärken. Als Sekundärantikörper wurden von der Ziege stammende Immunglobuline verwendet, die gegen Immunglobuline der Gruppe G von Maus, Kaninchen und Ratte gerichtet waren (PowerVision +Poly-­‐Hrp-­‐Anti Ms/Rb/Rt IgG Biotn-­‐ free, Ready-­‐to-­‐use, ImmunoLogic). Dieser Sekundärantikörper war mit Meerrettichperoxidase (HRP, horseradish peroxidase) konjugiert. Diese katalysiert unter Zugabe von Wasserstoffperoxid eine Reaktion, bei der Protonen frei werden. Die freigewordenen Protonen oxidieren das Chromogen 3,3'-­‐Diaminobenzidin (DAB). Das zuvor farblose Substrat wird hierdurch in ein braunes Produkt umgewandelt. Um eine unspezifische Hintergrundfärbung zu verhindern wird die endogene Peroxidase mit Wasserstoffperoxid (H2O2) blockiert und somit der Kontrast verstärkt. 22 2.4 Tumormaterial/ Zuschnitt Das operativ gewonnene Tumormaterial stand formalinfixiert und in Paraffin eingebetteten Gewebeblöcken im Archiv des Institutes für Pathologie der Universität zu Lübeck zur Verfügung. Anhand der jedem Paraffinblock zugeordneten HE gefärbten Testschnitte wurde zunächst jeweils derjenige Paraffinblock mit dem repräsentativsten Tumoranteil ausgewählt. Die Blöcke wurden nach vorheriger Kühlung mit einem Mikrotom in ca. 5µm dicke Scheiben geschnitten. In einem erwärmten Wasserbad wurden diese gestreckt und auf sialinierte Objektträger aufgebracht. Nach dem Trocknen konnten die Schnitte durch Xylol und eine absteigende Alkoholreihe entparaffiniert und dehydriert werden. Ein Schnitt jedes Blockes wurde mit Hämatoxylin-­‐Eosin gefärbt, um das Vorhandensein von Tumorgewebe nochmals zu verifizieren. Ein Beispiel zeigt Abbildung 2. Abbildung 2: HE Färbung Nierenzellkarzinom 23 2.5 Antigendemaskierung Durch die Fixierung der Gewebeproben mit Formalin werden Proteine miteinander vernetzt [Werner et al., 2000]. Deshalb können die Antikörper teilweise nicht mehr an die passenden Epitope binden. Man spricht hierbei von Maskierung des Antigens. Um dies zumindest teilweise rückgängig zu machen, müssen die einzelnen Schnitte zur Antigendemaskierung in einer Pufferlösung erhitzt beziehungsweise enzymatisch behandelt werden. In dieser Arbeit wurden zur Demaskierung ein Dampfgarer und ein Dampftopf benutzt. Anschließend konnte mit der Färbung begonnen werden. 2.6 Färbeprozedur Die optimale Verdünnung der Marker, die Verweildauer im Dampfgarer bzw. Dampftopf sowie die jeweilig optimale Pufferlösung wurden vorangehend an Testschnitten ermittelt. Es ergaben sich die in Tabelle 3 angegebenen Werte: Marker Vorbehandlung Verdünnung Puffer Zeit CD44 Dampfgarer 1:50 pH 9,0 40 min E-­‐Cadherin Dampfgarer 1:5000 pH 9,0 40 min N-­‐Cadherin Dampfgarer 1:100 pH 9,0 40 min K-­‐Cadherin Dampfgarer 1:25 pH 9,0 40 min Ki-­‐67 Dampftopf 1:100 pH 6,1 15 min PTEN Dampfgarer 1:30 pH 6,1 40 min P16 Dampfgarer 1:50 pH 6,1 40 min Tabelle 3: Antigendemaskierung, eigene Grafik 24 2.7 Färbeprotokoll 2 x 5 min Xylol (Entparaffinieren) Absteigende Alkoholreihe (Rehydrieren) 5 min TBS (Tris-­‐buffered-­‐saline) 10 min H2O2 (Blockierung) 30 min Primärantikörper 5 min TBS 15 min Post-­‐antibody Blocking 5 min TBS 15 min Sekundärantikörper (Enhancer) 3 x 5 min TBS 8-­‐10 min DAB (Diaminobenzidin) Spülen in Leitungswasser 3 min Gegenfärbung mit Hämatoxylin Fließend bläuen in Leitungswasser Aufsteigende Alkoholreihe (3 x Xylol) Eindecken der Objektträger 25 2.8 Materialien und Reagenzien Geräte/ Materialien: Microtom Reichelt & Jung Tube cooler Wendt Maschinenbau Wasserbad Medax Dampfgarer Miele Dampftopf Braun Mikroskop Olympus Objektträger DAKO Thermo Fisher Scientific Hämatoxylin Dako TBS-­‐Puffer Eigenherstellung Xylol Abbott CD44 Millipore E-­‐Cadherin Zytomed N-­‐Cadherin Thermo Scientific K-­‐Cadherin Dianova Ki-­‐67 (MIB-­‐1) DAKO P16 Chemikalien: DAB Antikörper: DAKO PTEN DAKO Poly-­‐HRP-­‐Anti-­‐mouse/rabbit/rat IgG ImmunoLogic 26 2.9 Auswertung der immunhistochemischen Färbungen Die einzelnen gefärbten Schnitte wurden im Rahmen einer Konsensusentscheidung durch drei Personen, D.F., P.K. und einem erfahrenem Facharzt für Pathologie Prof. Dr. C.T., der keine Kenntnis über die klinischen Parameter der individuellen Fälle hatte, ausgewertet. Mit dem Mehrkopfmikroskop wurde zunächst der repräsentativste Bereich des Tumors aufgesucht und die durch die Färbung dunkelbraun markierten Zellbestandteile in verschiedenen Vergrößerungen evaluiert. Da die jeweiligen Marker unterschiedliche Färbeverhalten zeigten und da in der Literatur keine einheitlichen Bewertungsmodalitäten vorliegen, wurden je nach Marker verschiedene Merkmale beurteilt. Ausgewählte Schnitte wurden fotografisch dokumentiert. Ein Negativbeispiel ohne immunhistochemische Anfärbung zeigt Abbildung 3 (Vergrößerung stets x200). Da einzelne Schnitte nicht auswertbar waren, kommt es im Vergleich der Marker untereinander zu leicht divergierenden Fallzahlen. Abb. 3: negative Färbung 27 Für Ki-­‐67 und PTEN wurde der prozentuale Anteil der immunhistochemisch angefärbten Kerne in 10% Schritten von 0 bis 100 ausgewertet. (siehe Abbildungen 4 und 5) Abb. 4: Immunhistochemische Färbung Ki-­‐67 Abb. 5: Immunhistochemische Färbung PTEN 28 Bei den Cadherinen wurde ebenfalls der prozentuale Anteil angefärbter Zellen evaluiert. Diese wurden hier jedoch durch eine Markierung der Zellmembran gekennzeichnet. Zusätzlich wurde die Intensität der Färbung in drei semiquantitative Kategorien bewertet: 0 – keine Anfärbbarkeit, 1 – schwache Anfärbbarkeit, 2 – starke Anfärbbarkeit (s. Abbildungen 6-­‐8). Abb. 6: Immunhistochemische Färbung K-­‐Cadherin 29 Abb. 7: Immunhistochemische Färbung E-­‐Cadherin Abb. 8: Immunhistochemische Färbung N-­‐Cadherin 30 Bei der Färbung von CD44 wurde ebenfalls hauptsächlich die Zellmembran markiert und der prozentuale Anteil der so farblich gekennzeichneten Tumorzellen in 10 % Schritten eingeteilt. Analog zu den Cadherinen wurde die Färbeintensität beurteilt. Des Weiteren wurde, da teilweise das Zytoplasma ebenfalls angefärbt wurde, dieses semiquantitativ in 3 Untergruppen eingeteilt: 0 – keine Anfärbung, 1 – weniger als 50% der Zytoplasmen färbbar, 2 – mehr als 50% der Zytoplasmen färbbar. Ein Beispiel zeigt Abbildung 9. Abb. 9: Immunhistochemische Färbung CD44 Da die Färbung für p16 diffus mehrere Kompartimente der Tumorzellen anfärbt, wurden sowohl braun markierte Zellkerne als auch angefärbte Zytoplasmen in 10% Schritten ausgewertet. Zusätzlich wurde die Färbeintensität analog zu den Cadherinen beurteilt (siehe Abbildung 10). 31 Abb. 10: Immunhistochemische Färbung p16 2.10 Statistische Auswertung Im Rahmen der Vorbereitung wurde das Kooperationsangebot des Institutes für Medizinische Biometrie und Statistik der Universität zu Lübeck (IMBS) in Anspruch genommen. Nach Auswertung wurden die Daten erneut dem IMBS vorgestellt. Die Datenerfassung erfolgte mittels Microsoft Office Excel, die statistische Auswertung mit SPSS Statistics für Windows Version 16. Zur Darstellung der Überlebenszeitanalyse wurden Kaplan-­‐Meier-­‐Kurven verwendet. Gruppenvergleiche wurden mit Hilfe des Log-­‐ Rank Tests mit einem Signifikanzniveau von p ≤ 0,05 ausgewertet. Assoziative Beziehungen zwischen den verschiedenen Parametern wurden anhand zuvor stets nach Median dichotomisierten Datensätzen mittels Mehrfeldertafeln getestet. Sie wurden mit Fishers exaktem Test und einem Signifikanzniveau von ebenfalls p ≤ 0,05 überprüft. Ab einem Signifikanzwert von p ≤ 0,1 wurde von einem Trend gesprochen, die maximale Irrtumswahrscheinlichkeit beträgt hierbei jedoch 10%. 32 3 Ergebnisse 3.1 Das Patientenkollektiv Das untersuchte Kollektiv setzte sich aus 92 Patienten zusammen. Das Verhältnis der Geschlechter betrug 63 männliche zu 29 weiblichen Probanden und damit nahezu 2:1. Im Mittel waren die Patienten bei Operation 64,8 Jahre alt (Spannweite 34 bis 87 Jahre). Abbildung 11 zeigt die Altersverteilung der Patienten. Der Mittelwert der Nachbeobachtungszeit betrug 129,2 Monate, bei einer Spannweite von 114 Monaten (range 72-­‐186). Am Ende der Datenerhebung waren 76 Patienten bereits verstorben (82,6%). Abbildung 12 zeigt dies als Kaplan-­‐Meier-­‐Kurve. 82 der beobachteten Tumoren waren klarzellige Karzinome, jeweils 3 zeigten chromophobe und spindelzellige Differenzierung und jeweils ein Karzinom war von chromophiler, onkozytärer, sarkomatöser und tubulopapillärer Gestalt. Somit waren 89,9% der Proben klarzellige Nierenzellkarzinome und 10,9 % andere Subtypen. Histopathologisch wurden 42 der Proben dem Stadium T3a, und 50 dem Stadium T3b zugeordnet. In 6 Fällen war ein Lymphknoten, in 9 Fällen bereits mehrere befallen. In 46 Proben wurden die untersuchten Lymphknoten als tumorfrei bewertet und im Rest der Fälle konnten die Lymphknoten nicht beurteilt werden. 12 Tumoren waren zum Operationszeitpunkt bereits fernmetastasiert, 22 zeigten keine Fernmetastasen und in 58 Fällen konnte das M-­‐ Stadium nicht sicher beurteilt werden. Hinsichtlich des histopathologischen Gradings zeigten sich 10 Tumore als gut, 60 als mäßig und 22 als schlecht differenziert. Die Größe der Tumoren betrug im Mittel 7,94 Zentimeter, schwankte jedoch deutlich von 2,2 bis 17,0 cm. Tabelle 4 zeigt die verschiedenen Parameter im Überblick. 33 Variable Geschlecht m w n % 92 63 68,5 29 31,5 < 60 22 23,9 > 60 70 76,1 kleinzellig 82 89,1 andere 10 10,9 <4cm 10 10,9 4-­‐7cm 34 37 >7cm 48 52,2 T3a 42 45,7 T3b 50 54,3 N0/Nx 77 83,7 N1/N2 15 16,3 M0/Mx 80 86,9 M1 12 13 G1 10 10,9 G2 60 65,2 G3 22 23,9 Alter Histologie Tumorgröße T-­‐Stadium N-­‐Stadium M-­‐Stadium Grading Mittelwert Range Tabelle 4: Überblick über die erhobenen Daten Median 64,8 65 34-­‐87 7,94 7,5 2,2-­‐17,0 34 Abb. 11: Alter der Patienten bei Operation in Dekaden. Abb. 12: Kaplan-­‐Meier-­‐Kurve Gesamtüberleben des Patientenkollektives. 35 3.2 Etablierte Prognosefaktoren 3.2.1 Tumorstadium Das untersuchte Patientenkollektiv bestand aus 42 Patienten mit Nierenzellkarzinom im Stadium T3a und 50 Patienten im Stadium T3b. Hinsichtlich des Gesamtüberlebens zeigte sich kein signifikanter Unterschied zwischen diesen beiden Subgruppen (Log-­‐Rank-­‐Test: p=0,968). Abbildung 13 stellt als Kaplan-­‐Meier-­‐Kurve das Gesamtüberleben der Patienten im Stadium T3a versus T3b dar. Abb. 13: Kaplan-­‐Meier-­‐Kurve T3a vs. T3b 36 3.2.2 Nodalstatus Bei 15 Patienten konnten lokale Lymphknotenmetastasen des Primärtumors nachgewiesen werden. In 31 Fällen konnte der Lymphknotenstatus nicht sicher beurteilt werden. Da jedoch das sichere Vorhandensein von Lymphknotenabsiedlungen die Prognose entscheidend verschlechtert, wurde das Stadium Nx zur lymphatisch nicht metastasierten Subgruppe hinzugefügt. Abbildung 14 zeigt als Kaplan-­‐Meier-­‐Kurve das Gesamtüberleben hinsichtlich des Nodalstatus unterteilt in sicher positiv (N>0) und negativ bzw. nicht sicher positiv (N0/Nx). Jedoch bestand kein signifikanter Unterschied hinsichtlich des Überlebens beider Untergruppen (Log-­‐Rank-­‐Test: p=0,791). Abb. 14: Kaplan-­‐Meier-­‐Kurve Nodalstatus 37 3.2.3 Metastasen 12 Tumoren zeigten zum Operationszeitpunkt bereits Fernmetastasen (M1). Da der sichere Nachweis von Metastasen die Prognose wesentlich beeinflusst, wurde analog zum Nodalstatus das Mx Stadium der metastasenfreien Subgruppe hinzugerechnet (M0/Mx). Abbildung 15 zeigt die Kaplan-­‐Meier-­‐Kurven dieser beiden Untergruppen. Das Gesamtüberleben der Patienten mit bereits metastasierten Karzinom zeigte sich im Vergleich zum Rest des Patientenkollektiv signifikant vermindert (Log-­‐Rank-­‐Test: p=0,016). Abb. 15: Kaplan-­‐Meier-­‐Kurve Metastasen 38 3.2.4 Grading Abbildung 16 zeigt die Kaplan-­‐Meier-­‐Kurve der drei durch Grading determinierten Untergruppen. Das Gesamtüberleben unterschied sich bei diesen drei Subgruppen signifikant und verminderte sich bei erhöhtem Grading (Log-­‐Rank-­‐Test: p=0,02). Abb. 16: Kaplan-­‐Meier-­‐Kurve Grading 39 3.2.5 Tumorgröße Die absolute Größe des Primärtumors hingegen hatte in der untersuchten Kohorte keinen Einfluss auf das Gesamtüberleben. Weder dichotomisiert nach Median noch in drei Subgruppen in Anlehnung der Unterscheidungsgröße im Stadium T1 der TNM Klassifikation unterteilt, wurden signifikante Unterschiede hinsichtlich des Gesamtüberlebens gefunden (Log-­‐Rank-­‐Test: p=0,568 und 0,446). Die Abbildungen 17 und 18 zeigen dies dargestellt als Kaplan-­‐Meier-­‐Kurven. Abb. 17: Kaplan-­‐Meier-­‐Kurve Größe (dichotomisiert nach Median) 40 Abb. 18: Kaplan-­‐Meier-­‐Kurve Größe (gruppiert nach TNM) 41 3.2.6 Histologie Aufgeteilt nach Histologie in klarzellige versus andere Nierenzellkarzinome fand sich im Kaplan-­‐Meier-­‐Diagramm (Abbildung 19) kein signifikanter Unterschied bezüglich des Gesamtüberlebens. (Log-­‐Rank-­‐Test: p=0,189) Abb. 19: Kaplan-­‐Meier-­‐Kurve Histologie 42 3.2.7 Alter Auch beim Vergleich des Alters bei Operation dichotomisiert nach dem Median (65 Jahre) zeigte sich kein signifikanter Unterschied hinsichtlich des Gesamtüberlebens. Der p-­‐Wert nach Log-­‐Rank-­‐Test betrug 0,381. Siehe Abbildung 20. Abb. 20: Kaplan-­‐Meier-­‐Kurve Histologie 43 3.2.8 Geschlecht Gemessen an der Überlebenswahrscheinlichkeit hatte das Geschlecht des Patienten im untersuchten Kollektiv keine Bedeutung. Die Kaplan-­‐Meier-­‐Kurven in Abbildung 21 verlaufen nahezu gleich. Der p-­‐Wert beträgt 0,870. Abb. 21: Kaplan-­‐Meier-­‐Kurve Geschlecht 44 3.3 Immunhistochemische Marker 3.3.1 CD44 Für diesen Marker wurden 3 Parameter, die Färbeintensität, die Anzahl der gefärbten Zellen und die Zytoplasmafärbung, ausgewertet. Für die Anzahl markierter Zellen wurden die Daten nach Median (0%) zuvor dichotomisiert. Analog hierzu wurde bei der Färbung des Zytoplasmas verfahren, welches bei nur etwas über 20 % der Proben mit CD44 positiv gefärbt war. Die Abbildungen 22 bis 24 zeigen die Kaplan-­‐Meier-­‐Kurven für diese Merkmale. Für keine dieser Parameter wurde das Signifikanzniveau von p=0,05 unterschritten. Abb. 22: Kaplan-­‐Meier-­‐Kurve CD44 Färbeintensität 45 Abb. 23: Kaplan-­‐Meier-­‐Kurve CD44 % gefärbte Zellen 46 Abb. 24: Kaplan-­‐Meier-­‐Kurve CD44 Zytoplasmafärbung 47 3.3.2 E-­‐Cadherin Analog zu CD44 wurde auch hier die Färbeintensität und zusätzlich der prozentuale Anzahl der membranständig gefärbten Zellen beurteilt. Abbildung 25 zeigt die Kaplan-­‐ Meier-­‐Kurven der drei verschiedenen Färbeintensitäten, Abbildung 26 die Kaplan-­‐Meier-­‐ Kurve der zuvor nach Median (0%) dichotomisierten Daten für den prozentualen Anzahl der gefärbten Zellen. Für keine der beiden Merkmale wurde das Signifikanzniveau unterschritten, jedoch wurde für die Anzahl der gefärbten Zellen mit einem nach Log-­‐ Rank-­‐Test bestimmten p=0,108 der Grenzwert zu einem Trend nur leicht überschritten. Abb. 25: Kaplan-­‐Meier-­‐Kurve Färbeintensität E-­‐Cadherin 48 Abb. 26: Kaplan-­‐Meier-­‐Kurve Anzahl gefärbter Zellen E-­‐Cadherin 49 3.3.3 N-­‐Cadherin Wie auch bei E-­‐Cadherin wurden für N-­‐Cadherin Kaplan-­‐Meier-­‐Kurven für Intensität und prozentualen Anteil der angefärbten Zellen erstellt. (Siehe Abbildungen 27 und 28) Der p-­‐ Wert für die Anzahl der gefärbten Zellen lag mit 0,092 unter dem Trendniveau von 0,1. Abb. 27: Kaplan-­‐Meier-­‐Kurve Färbeintensität N-­‐Cadherin 50 Abb. 28: Kaplan-­‐Meier-­‐Kurve N-­‐Cadherin % gefärbte Zellen 51 3.3.4 K-­‐Cadherin Analog zu den vorherigen Cadherinen zeigen die Abbildungen 29 und 30 Kaplan-­‐Meier-­‐ Kurven der beiden bestimmten Färbemerkmale. Für diesen Marker wurde das Signifikanzniveau nicht unterschritten. Abb. 29: Kaplan-­‐Meier-­‐Kurve Färbeintensität K-­‐Cadherin 52 Abb. 30: Kaplan-­‐Meier-­‐Kurve % gefärbter Zellen K-­‐Cadherin 53 3.3.5 Ki-­‐67 Für Ki-­‐67 wurde die Anzahl der gefärbten Zellkerne in 10% Schritten bestimmt. Abbildung 31 zeigt die Kaplan-­‐Meier-­‐Kurve der zuvor nach Median (10%) dichotomisierten Daten. Nach dem Log-­‐Rank-­‐Test wurde mit einem p-­‐Wert von 0,098 das Trendniveau knapp unterschritten. Abb. 31: Kaplan-­‐Meier-­‐Kurve % gefärbter Zellen Ki-­‐67 54 3.3.6 p16 Für diesen Marker wurden sowohl die Anzahl der membranständig gefärbten als auch zytoplasmatisch markierten Zellen getrennt voneinander in 10% Schritten ausgewertet. Zusätzlich wurde die Färbeintensität bewertet. Die Abbildungen 32 bis 34 zeigen die Kaplan-­‐Meier-­‐Kurven der einzelnen Färbemerkmale. Einen signifikanten Unterschied zeigte keiner dieser Parameter. Abb. 32: Kaplan-­‐Meier-­‐Kurve % gefärbter Zelle p16 55 Abb. 33: Kaplan-­‐Meier-­‐Kurve % gefärbte Zytoplasmen p16 56 Abb. 34: Kaplan-­‐Meier-­‐Kurve Färbeintensität p16 57 3.3.7 PTEN Wie bei Ki-­‐67 wurde für diesen Marker ausschließlich die Kernfärbung in 10% Schritten beurteilt. Abbildung 35 die Kaplan-­‐Meier-­‐Kurve mit dem nach Median (10%) dichotomisierten Datensatz. Es bestand kein signifikanter Unterschied der beiden Subgruppen. Abb. 35: Kaplan-­‐Meier-­‐Kurve % gefärbter Zellen PTEN 58 3.4 Kreuztabellen Die verschiedenen immunhistochemischen Marker wurden mittels Kreuztabellen und Fishers exaktem Test auf Korrelationen mit den bereits etablierten prognostischen Faktoren und den weiteren erhobenen Merkmalen überprüft. Aufgrund der Datenmenge werden hier nur die Tabellen mit signifikanten Ergebnissen bzw. Trends, also Ergebnisse mit einem p-­‐Wert < 0,1 abgebildet. Die übrigen Vier-­‐ bzw. Mehrfeldertafeln finden sich im Anhang. Die leicht unterschiedlichen Fallzahlen ergeben sich aus einzelnen nicht auswertbaren Proben. 3.4.1 CD44 Je nach Färbemerkmal zeigte dieser Marker unterschiedliche Korrelationen mit weiteren Parametern. Alle Färbemerkmale zeigten eine signifikante Korrelation mit dem histologischen Grading (siehe Tabellen 5 bis 7). Des Weiteren waren Wechselbeziehungen zwischen Färbeintensität und Anzahl der gefärbten Zellen mit der Tumorgröße festzustellen (Abbildungen 8 und 9). Trends konnten für die Anzahl gefärbter Zellen mit dem Metastasierungsstatus (Tabelle 10) sowie für die zytoplasmatische Färbung mit der histologische Entität ermittelt werden (Tabelle 11). p=0,023 Grading 1 CD44 Intensität dichotomisiert nach Median (=0) 2 3 Gesamt Intensität = 0 8 33 7 48 Intensität > 0 1 21 13 35 Gesamt 54 20 83 9 Tabelle 5: Korrelation der Färbeintensität von CD44 mit dem Grading 59 p=0,017 Grading 1 2 3 Gesamt CD44 % Zellen 0 % 8 34 7 49 dichotomisiert nach > 0 % 1 20 13 34 Gesamt 9 54 20 83 Median (=0%) Tabelle 6: Korrelation der Anzahl der CD44 markierten Zellen und Grading p=0,007 Grading 1 2 3 Gesamt 8 46 10 64 Färbung 1 bis 2 1 8 10 19 Gesamt 54 20 83 CD44 Zytoplasmafärbung Färbung 0 dichotomisiert nach Median (=0) 9 Tabelle 7: Korrelation der CD44 Zytoplasmafärbung und Grading p=0,039 Größe nach TNM Einteilung <4 cm CD44 Intensität dichotomisiert nach Median (=0) 4-­‐7 cm >7 cm Gesamt Intensität = 0 2 21 25 48 Intensität > 0 7 9 19 35 Gesamt 30 44 83 9 Tabelle 8: Korrelation der Färbeintensität von CD44 mit der Tumorgröße 60 p=0,042 Größe nach TNM Einteilung <4 cm 4-­‐7 cm >7 cm Gesamt CD44 % Zellen 0 % 2 21 26 49 dichotomisiert nach > 0 % 7 9 18 34 30 44 83 Median (=0%) Gesamt 9 Tabelle 9: Korrelation der Anzahl der CD44 markierten Zellen und Tumorgröße p=0,087 Metastasen 0 1 x Gesamt CD44 % Zellen 0 % 7 8 34 49 dichotomisiert nach > 0 % 12 3 19 34 11 53 83 Median (=0%) Gesamt 19 Tabelle 10: Korrelation der Anzahl der CD44 markierten Zellen und Metastasen p=0,076 Histo dichotomisiert klarzellig andere Gesamt 60 4 64 Färbung 1 bis 2 15 4 19 Gesamt 8 83 CD44 Zytoplasmafärbung Färbung 0 dichotomisiert nach Median (=0) 75 Tabelle 11: Korrelation von CD44 Zytoplasmafärbung und Histologie 61 3.4.2 E-­‐Cadherin Für diesen Marker zeigte sich ein Trend für eine Korrelation der beiden erhobenen Färbemerkmale Intensität und Anzahl gefärbter Zellen mit dem histologischen Grading. Der p-­‐Wert betrug jeweils 0,074 (Siehe Tabellen 12 und 13). p=0,074 Grading 1 2 3 Gesamt E-­‐Cadherin Intensität Intensität 0 4 40 9 53 dichotomisiert nach Intensität 1 bis 2 6 20 12 38 Gesamt 60 21 91 Median (=0) 10 Tabelle 12: Korrelation von E-­‐Cadherin Färbeintensität und Grading p=0,074 Grading 1 2 3 Gesamt E-­‐Cadherin % Zellen 0% 4 40 9 53 dichotomisiert nach 10-­‐100% 6 20 12 38 Gesamt 60 21 91 Median (=0%) 10 Tabelle 13: Korrelation von Anzahl E-­‐Cadherin markierten Zellen und Grading 62 3.4.3 N-­‐Cadherin Wie die Tabellen 14 und 15 verdeutlichen, bestanden bei diesem Marker Wechselbeziehungen zwischen der Histologie und beiden Färbemerkmalen (p=0,019 bzw. 0,019). Des Weiteren wurde für die Korrelation von Färbeintensität mit Geschlecht das Signifikanzniveau für einen Trend mit p=0,093 leicht unterschritten (Tabelle 16). p=0,018 Histo dichotomisiert klarzellig andere Gesamt N-­‐Cadherin Intensität Intensität = 0 40 8 48 dichotomisiert nach Intensität = 1 bis 2 34 0 34 Gesamt 8 82 Median (=0) 74 Tabelle 14: Korrelation von N-­‐Cadherin Färbeintensität und Histologie p=0,019 Histo dichotomisiert klarzellig andere Gesamt N-­‐Cadherin % Zellen 0 % 41 8 49 dichotomisiert nach > 0 % 33 0 33 Gesamt 74 8 82 Median (=0%) Tabelle 15: Korrelation Anzahl N-­‐Cadherin markierten Zellen in Histologie p=0,093 Geschlecht m w Gesamt N-­‐Cadherin Intensität Intensität = 0 29 19 48 dichotomisiert nach Intensität = 1 bis 2 27 7 34 Gesamt 26 82 Median (=0) 56 Tabelle 16: Korrelation von N-­‐Cadherin Färbeintensität und Geschlecht 63 3.4.4 K-­‐Cadherin Hier wurde mit einem p-­‐Wert von 0,054 das Signifikanzniveau für eine Korrelation der Anzahl der angefärbten Zellen mit dem histologischen Grading leicht überschritten (Tabelle 17). p=0,054 Grading 1 2 3 Gesamt K-­‐Cadherin % Zellen 0-­‐60% 6 27 16 49 dichotomisiert nach 70-­‐100% 4 28 4 36 Gesamt 55 20 85 Median (=60%) 10 Tabelle 17: Korrelation der Anzahl K-­‐Cadherin markierter Zellen und Grading 3.4.5 Ki-­‐67: Auch für Ki-­‐67 zeigte sich, wie Tabelle 18 veranschaulicht, mit einem p-­‐Wert von 0,08 ein Trend für eine Korrelation mit dem histologischen Grading. p=0,080 Grading 1 2 3 Gesamt Ki67 % Zellen 0-­‐10% 6 34 9 49 dichotomisiert nach 20-­‐100% 1 12 10 23 Gesamt 46 19 72 Median (=10%) 7 Tabelle 18: Korrelation der Anzahl Ki-­‐67 markierter Zellen und Grading 64 3.4.6 p16 Bei diesem Marker korrelierte die Anzahl der angefärbten Zellen wie auch die zytoplasmatische Färbung mit dem histologischen Grading. Einmal ist dies statistisch signifikant und einmal als Trend erkennbar (p=0,021; p=0,099) (Tabellen 19 und 20). Des Weiteren bestanden Trends zu einer Assoziation der Färbeintensität mit der Tumorgröße und der Anzahl gefärbter Zellen mit dem Geschlecht (Tabellen 21 und 22). p=0,021 Grading 1 2 3 Gesamt p16 % Zellen 0% 6 39 7 52 dichotomisiert nach 10-­‐100% 4 18 14 36 Gesamt 57 21 88 Median (=0%) 10 Tabelle 19: Korrelation der Anzahl p16 membranös markierter Zellen und Grading p=0,099 Grading 1 2 3 Gesamt p16 % Zytopl. 0% 8 32 8 48 dichotomisiert nach 10-­‐100% 2 25 13 40 Gesamt 57 21 88 Median (=0%) 10 Tabelle 20: Korrelation der Anzahl p16 zytoplasmatisch markierter Zellen und Grading p=0,057 Geschlecht M w Gesamt p16 % Zellen 0% 41 11 52 dichotomisiert nach 10-­‐100% 21 15 36 Gesamt 26 88 Median (=0%) 62 Tabelle 21: Korrelation der Anzahl p16 membranös markierter Zellen mit Geschlecht 65 p=0,069 Größe dichotomisiert nach Median bis 8cm p16 Intensität dichotomisiert nach Median (=1) <8cm Gesamt Intensität 0 bis 1 38 31 69 Intensität = 2 15 4 19 Gesamt 53 35 88 Tabelle 22: Korrelation der p16 Färbeintensität und Tumorgröße 3.4.7 PTEN Hier zeigte sich mit einem p-­‐Wert von 0,076 ein Trend für eine Wechselbeziehung zwischen der Anzahl der angefärbten Zellkerne und dem Tumorstadium (siehe Tabelle 23). p=0,076 Unterteilung des T3 Stadiums A b Gesamt Zellen 0-­‐10% 29 27 56 nach 10-­‐100% 10 22 32 Gesamt 49 88 PTEN % dichotomisiert Median (=10%) 39 Tabelle 23: Korrelation der Anzahl PTEN markierten Zellen mit Tumorstadium 66 4 Diskussion In Deutschland erkranken jährlich mehr als 17.000 Menschen an einem Nierenzellkarzinom. Im Vergleich zu anderen urologischen Tumoren ist die Prognose ungünstig [Brenner, 2002]. In der Statistik der Todesursachen in Deutschland ist das Nierenzellkarzinom gemessen an der Häufigkeit des Auftretens deutlich überrepräsentiert [www.rki.de, 2010]. Umso wichtiger erscheint es die Prognose einzelner Patienten genauer abschätzen zu können. Welches biologische Verhalten ein Tumor zeigen wird, lässt sich anhand der etablierten Prognosefaktoren nur unzureichend vorherzusagen. Ziel dieser Arbeit ist es, dies mittels immunhistochemischer Parameter zu untersuchen und mit den etablierten Faktoren zu vergleichen. Im untersuchten Patientenkollektiv betrug das Geschlechterverhältnis mit 63 männlichen und 29 weiblichen Patienten 2,17:1, was in etwa dem in der Literatur angegebenen Verteilungsmuster entspricht [Bretheau et al., 1998]. Ein Grund für dieses Missverhältnis könnte das im Vergleich häufigere Vorkommen vermeidbarer Risiokofaktoren wie Rauchen oder Adipositas sein [McLaughlin et al., 1995; Mensink et al., 2005]. Auch die Verteilung des Erkrankungsalters, gemessen zum Zeitpunkt der Nephrektomie, deckt sich im Wesentlichen mit den Angaben aus der Literatur [www.rki.de, 2010]. Mit einem Anteil von 89,9% klarzelligen Nierenzellkarzinomen repräsentiert das untersuchte Kollektiv auch in diesem Punkt die Angaben anderer Autoren [Patard et al., 2005]. Die Verteilung der Tumorstadien T3a zu T3b war mit 45,7% zu 54,3% annähernd gleich. 67 Das Tumorstadium (T-­‐Stadium) stellt einen der wichtigsten bekannten Prognoseparameter dar. Jedoch wurden gerade im Hinblick auf höhere Stadien Modifikationen notwendig, da sie die Prognose nur unzureichend wiedergaben [Ficarra et al., 2007; Leibovich et al., 2005]. Im untersuchten Kollektiv fand sich hinsichtlich des Gesamtüberlebens kein Unterschied zwischen den Stadien T3a und T3b (p=0,968). Diese von der Vergleichsliteratur teilweise abweichenden Ergebnisse mögen einerseits der Größe des Kollektivs geschuldet sein, spiegeln jedoch andererseits, da das Kollektiv hinsichtlich der Zusammensetzung derjenigen der Vergleichsliteratur gleicht, die Notwendigkeit genauerer Klassifikationen wieder. Der Nodalstatus vermag ebenfalls die Prognose abzubilden [Volpe und Patard, 2010]. In der untersuchten Kohorte war dieser Unterschied jedoch nicht signifikant (p=0,791). Dies mag zwei Ursachen haben: Zum einen, dass in 31 Fällen der Lymphknotenstatus mit Nx nur unsicher bewertet wurde, zum anderen wurde in der vorliegenden Arbeit, im Gegensatz zum in anderen Arbeiten verwendeten tumorspezifischen Überleben, das Gesamtüberleben als Endpunkt erhoben. Beide Punkte spielten jedoch beim Metastasierungsstatus keine Rolle. Obwohl in der vorliegenden Arbeit ein Großteil der Patienten als Mx klassifiziert wurde und mit 13% im Vergleich zur Literatur weniger Patienten bei Diagnose gesichert Fernmetastasen aufwiesen, war das Gesamtüberleben der Patienten mit nachgewiesenen Metastasen mit einem p-­‐Wert von 0,016 signifikant reduziert [Bukowski, 2009]. Dies deckt sich mit Angaben aus der Literatur, wo Metastasen die Prognose ebenfalls am stärksten limitieren [www.rki.de, 2010; Lughezzani et al., 2009]. Auch das histopathologische Grading hat Einfluss auf die Prognose. Im untersuchten Kollektiv war ein schlechteres Grading signifikant mit einem reduzierten Gesamtüberleben assoziiert (p=0,02). Dies spiegelt die Ergebnisse anderer Autoren, wenngleich mit unterschiedlichen Gradingsystemen oder Abstufungsgraden, wieder [Novara et al., 2007; Karakiewicz et al., 2007]. Die histologische Subklassifizierung wird in der Literatur ebenfalls als prognostischer Parameter erwähnt. Das klarzellige Nierenzellkarzinom soll mit einer schlechteren Prognose einhergehen [Cheville et al., 2003]. Dies konnte im untersuchten 68 Patientenkollektiv nicht bestätigt werden. Es zeigte sich kein signifikanter Unterschied zwischen klarzelligen und anderen Nierenzellkarzinomen (p=0,186). Da sich die Gruppe der nicht klarzelligen Karzinome jedoch nur aus 10 Patienten zusammensetzt, ist diese Aussage nur eingeschränkt beurteilbar. Die Größe des Tumors ist noch immer Gegenstand von Diskussionen und, wie bereits beschrieben, Grund für Änderungen der Klassifikationen [Lam et al., 2005; Miyagawa et al., 2007]. In der vorliegenden Studie war die absolute Größe des Tumors weder nach Median dichotomisiert noch in Anlehnung an die TNM Klassifikation unterteilt für die Prognose ausschlaggebend. Dies veranschaulicht, dass in höheren T-­‐Stadien die Tumorausdehnung über die Organgrenzen hinaus eher als die absolute Tumorgröße die Prognose bestimmt [Siddiqui et al., 2007]. Weitere Unterscheidungsmerkmale wie Alter oder Geschlecht werden in einigen Publikationen, jedoch insgesamt sehr uneinheitlich, als Prognoseindikatoren genannt [Sunela et al., 2009]. Bei den hier untersuchten Patienten fand sich kein signifikanter Unterschied bezüglich dieser Faktoren. Dies überrascht zumindest beim Alter, da in dieser Studie das Gesamtüberleben als Endpunkt gewählt wurde und sich somit weitere, im Alter häufigere, Erkrankungen hier hätten widerspiegeln können. Wie bereits in der Einleitung beschrieben wurde eine Assoziation von veränderten Expressionsmustern des Adhäsionsmoleküls CD44 mit Veränderungen des biologischen Verhaltens von Tumoren in einer Vielzahl von neoplastischen Erkrankungen beschrieben. Die Datenlage beim Nierenzellkarzinom ist jedoch heterogen. Hinsichtlich der Prognose schwanken die Aussagen von keiner Assoziation einer erhöhten Expression von CD44 mit der Überlebenswahrscheinlichkeit bis hin zur Postulierung dieses Markers als unabhängigem Prognosefaktor [Bamias et al., 2003; Gilcrease et al., 1999; Lim et al., 2008; Rioux-­‐Leclercq et al., 2001; Lucin et al., 2004; Paradis et al., 1999; Tawfik et al., 2007; Yildiz et al., 2004]. Auch schwanken die Aussagen hinsichtlich der Isoform mit dem größten prädiktiven Wert. Ein Autor berichtet, eine geringe (!) Expression der Isoform CD44v5 gehe mit erhöhter Mortalität einher [Wu et al., 2003]. Bei vielen dieser Studien wurde jedoch, unabhängig von der prognostischen Bedeutung des Markers, eine signifikante Korrelation mit klinischen Prognoseparametern wie Staging und Grading 69 festgestellt. Altinel et al. berichten über eine Korrelation erhöhter CD44 Expression mit dem Vorhandensein von Tumorthromben, einem wichtigen Unterscheidungsmerkmal des in der vorliegenden Arbeit untersuchten Tumorstadiums T3 [Altinel et al., 2008]. Um das Färbeverhalten zu beurteilen wurden in den Vergleichsarbeiten unterschiedliche Parameter gewählt. In der vorliegenden Arbeit wurden die drei in der Literatur am häufigsten verwendeten Färbeparameter (Färbeintensität, membranständige und zytoplasmatische Färbung) bestimmt. Es fand sich jedoch bei keinem dieser Parameter ein signifikanter Unterschied des Gesamtüberlebens nach der Kaplan-­‐Meier-­‐Methode. Dies deckt sich mit den Beobachtungen einiger Autoren, könnte jedoch auch durch unterschiedliche Endpunkte (tumorspezifisches Überleben versus Gesamtüberleben) und durch die uneinheitliche Methodik bedingt sein. So wurde in dieser Arbeit für alle immunhistochemischen Marker die prozentuale Anzahl der gefärbten Zellen in 10% Schritten bewertet und anschließend nach Median in zwei Subgruppen dichotomisiert. Weitere Autoren unterteilen z.T. in mehr Gruppen oder verwenden andere cut-­‐off-­‐Werte. Eine Korrelation der CD44 Expression mit anderen histopathologischen Parametern wurde mittels Vier-­‐ bzw. Mehrfeldertafeln untersucht. Hierbei fand sich eine Assoziation sämtlicher Färbemerkmale mit dem Grading (nach Fishers exaktem Test p=0,023; 0,017; 0,007). Dies deckt sich mit den Aussagen der Vergleichsliteratur [Gilcrease et al., 1999; Lucin et al., 2004; Paradis et al., 1999; Tawfik et al., 2007; Terpe et al., 1996]. Des Weiteren fand sich eine Korrelation von den Merkmalen Färbeintensität und Anzahl gefärbter Zellen mit der Tumorgröße (p=0,039; 0,042). In der Literatur ist dies von Paradis et al. ähnlich beschrieben [Paradis et al., 1999]. Weiterhin zeigte sich ein Trend für eine Assoziation der Anzahl CD44 positiver Zellen und dem Vorhandensein von Metastasen (p=0,087). Auch dies wurde bereits in der Literatur erwähnt [Lim et al., 2008]. Außerdem war ein Trend (p=0,076) für eine Korrelation einer zytoplasmatischen Anfärbung von CD44 mit der histologischen Form des Nierenzellkarzinoms erkennbar. Hierfür finden sich in der Literatur keine ähnlichen Aussagen. Ein Grund für konträre Aussagen anderer Autoren zur Prognose könnten die auch in der vorliegenden Arbeit gesehenen Korrelationen mit den weiteren histopathologischen Parametern sein. Über diese Korrelation könnte CD44 zu einer indirekten prognostischen Bedeutung gelangt sein. Weitere Unterschiede bestehen in den betrachteten 70 Patientenkollektiven. In den meisten anderen Studien wurde eine kleinere Patientengruppe untersucht und im Gegensatz zu dieser Arbeit sämtliche Tumorstadien eingeschlossen. Darüber hinaus unterscheidet sich, wie schon erläutert, die Methodik einzelner Studien deutlich. Zusammenfassend lässt sich sagen, dass trotz umfangreicher Studienlage eine eventuelle prognostische Bedeutung dieses Markers nicht abschließend geklärt ist. Hierfür wäre zunächst die Etablierung einer einheitlichen Auswertung der Färbung notwendig sowie eine hierauf folgende prospektive Studie. Durch die Funktionen der verschiedenen Cadherine wie beispielsweise Zell-­‐Zell-­‐Kontakte, Aufrechterhaltung der Zellpolarität sowie Gewebedifferenzierung wird deutlich, weshalb quantitative oder auch qualitative Veränderungen in der Expression dieser Moleküle Einfluss auf die Entstehung, die Progression oder das biologische Verhalten von Tumoren haben können [Stemmler, 2008; Jeanes et al., 2008; Takeichi, 1993]. Morphologische und molekulare Veränderungen gehen mit einem solchen veränderten biologischen Verhalten einher. So wird aus einer hochdifferenzierten Tumorzelle mit epithelialem Phänotyp eine Zelle eher mesenchymaler Morphe. Man spricht hierbei von epithelial-­‐mesenchymaler Transition. Im Zuge dessen kann es auch zu einem verändertem Cadherinexpressionsmuster, dem so genannten Cadherin-­‐switch, kommen. Dabei kommt es beispielsweise zu einer verminderten Expression von E-­‐Cadherin bei im Gegenzug gesteigerter Expression von N-­‐Cadherin, was mit einer erhöhten Invasionfähigkeit sowie gesteigerter metastatischer Aussaat einhergehen soll [Christofori, 2006]. Oftmals werden in Karzinomen veränderte Cadherinexpressionsmuster gefunden. Eine verminderte Expression von E-­‐Cadherin geht hierbei sowohl mit einer gesteigerten Invasionsfähigkeit als auch einer schnelleren Progression des Tumors einher. Auch ist eine erhöhte Fähigkeit zur Metastasierung in diesem Zusammenhang beschrieben [Jeanes et al., 2008; Hirohashi und Kanai, 2003]. Des Weiteren sind Keimzellmutationen des CDH1 Gens, beispielsweise in Familien mit gehäuftem Vorkommen von Magenkarzinomen, bekannt [Guilford et al., 1998]. Dies ist der Grund, weshalb E-­‐Cadherin nicht nur als Invasionssuppressor sondern auch als klassischer Tumorsuppressor bezeichnet wird. In einer Vielzahl verschiedener Malignome wurde E-­‐Cadherin untersucht. So ist eine erhöhte 71 Mortalität beim Mammakarzinom mit verminderter oder fehlender Expression von E-­‐ Cadherin belegt [Gould Rothberg und Bracken, 2006]. Auch bei verschieden Tumoren des Gastrointestinaltraktes wie kolorektalen Karzinomen, Adenokarzinomen des Ösophagus sowie Tumoren von Magen oder Pankreas ist eine solche Veränderung beschrieben [Falkenback et al., 2008; Natalwala et al., 2008; Kwak et al., 2007; Shimada et al., 2004; Shin et al., 2005]. In all diesen Fällen korreliert eine reduzierte Expression von E-­‐Cadherin mit einer schlechteren Prognose. Teilweise ist eine Assoziation dieses Markers mit anderen prognostischen Merkmalen wie einer geringeren Differenzierung beschrieben. Auch bei urologischen Tumoren wie Harnblase und Prostata ist dies der Fall [Eltz et al., 2008; Musial et al., 2007]. Beim Nierenzellkarzinom wurde bereits früh ein Zusammenhang zwischen der Expression von E-­‐Cadherin und der Aggressivität des Tumors beschrieben [Katagiri et al., 1995]. Jedoch ist die Studienlage hinsichtlich der Prognose sehr heterogen. Zwar wird teilweise ein solcher direkter Zusammenhang postuliert, in anderen Studien kann dies aber nicht oder nur indirekt über eine Korrelation mit einem weiteren Marker aufrechterhalten werden [Ronkainen et al., 2010; Shimazui et al., 1998; Langner et al., 2004; Katagiri et al., 1995; Gervais et al., 2007]. In der vorliegenden Studie wurde kein signifikanter Unterschied bei verschiedener Expression von E-­‐Cadherin gefunden. Die p-­‐Werte überschritten nach Log-­‐Rank-­‐Test das Trendniveau jedoch nur knapp (p=0,108; 0,121). Eine gewisse Tendenz für eine größere Überlebenswahrscheinlichkeit bei Patienten mit positivem E-­‐Cadherin Nachweis kann in Zusammenschau anderer Studien trotzdem erkannt werden. Diese Tendenz folgt den Ergebnissen von Katagiri mit einer ähnlich großen Patientengruppe, die sich jedoch aus sämtlichen Tumorstadien zusammensetzte [Katagiri et al., 1995]. Weitere Autoren sehen in einem kleineren Kollektiv (n=46) einen ähnlichen Trend, benutzen jedoch eine andere Methodik und unterteilen in normales versus abnormales Färbeverhalten [Shimazui et al., 1998]. Ferner wurden Korrelationen des Stagings mit der Expression von E-­‐Cadherin beschrieben [Katagiri et al., 1995]. Dies bestätigte sich in den hier untersuchten, ausschließlich aus Tumoren im Studium T3 bestehenden Proben, wo zusätzliche prognostische Unterscheidungsmerkmale besonders sinnvoll erscheinen, nicht. Weitere, von einzelnen Autoren beschriebene, Assoziationen wie dem histologischen Subtyp oder dem 72 Vorhandensein von Metastasen konnten in der vorliegenden Arbeit nicht erkannt werden [Ronkainen et al., 2010; Katagiri et al., 1995]. Mit Hilfe von Vier-­‐ bzw. Mehrfeldertafeln konnte eine Assoziation von beiden Färbemerkmalen E-­‐Cadherins mit dem histopathologischen Grading gezeigt werden. Dies wurde bereits in der Arbeit von Langner beschrieben [Langner et al., 2004]. Zusammenfassend kann, aufgrund der unterschiedlichen Ergebnisse in der Literatur und den nicht signifikanten Werten in der vorliegenden Arbeit, die prognostische Bedeutung E-­‐Cadherins nicht abschließend bewertet werden. Analog zu CD44 ist dies möglicherweise in unterschiedlicher Methodik begründet, wie beispielsweise der Auswertung der Färbungen oder den untersuchten Tumorstadien. N-­‐Cadherin spielt wie die anderen Mitglieder der Cadherinfamilie im Rahmen des Cadherin-­‐Switches eine Rolle im biologischen Verhalten von Tumoren. So ist bei verschiedenen Tumorentitäten ein Zusammenhang mit veränderter Expression von N-­‐ Cadherin beschrieben. Beim Prostatakarzinom wird beispielsweise dem Cadherin-­‐Switch eine Aussagekraft hinsichtlich der Progression des Tumors und der Prognose des Patienten konstatiert [Gravdal et al., 2007]. Auch bei anderen urologischen Malignomen wie beispielsweise dem invasiven Harnblasenkarzinom, scheint N-­‐Cadherin prognostische Aussagekraft zu besitzen [Wallerand et al., 2008]. Beim Mammakarzinom soll eine erhöhte Expression dieses Markers mit erhöhter Invasions-­‐ und Migrationsfähigkeit der Tumorzellen einherzugehen [Nieman et al., 1999; Hazan et al., 2000]. In der gesunden Niere wird N-­‐Cadherin von Zellen des proximalen Tubulussystems exprimiert. E-­‐Cadherin wird hier im Gegensatz dazu nicht gefunden [Nouwen et al., 1993]. Da das Nierenzellkarzinom zumeist aus dem proximalen Tubulussystem hervorgeht, überrascht die dürftige Datenlage über die Expression von N-­‐Cadherin im Nierenzellkarzinom und über deren Bedeutung. Shimanzui et al. beobachteten bei Patienten mit einer abnormalen Expression von N-­‐Cadherin eine bessere Prognose. Erklärt wurde dies mit der Vorstellung, N-­‐Cadherin würde Invasion und Metastasierung erleichtern [Shimazui et al., 2006]. Die geringe Fallzahl der genannten Studie (n=46) erfordert jedoch weitere Untersuchungen über die prognostische Aussagekraft N-­‐ Cadherins. 73 In der vorliegenden Studie zeigte sich ein Trend (p=0,092) für ein besseres Überleben der Patientengruppe mit positiver Expression von N-­‐Cadherin. Dies deckt sich in Teilen mit der Vergleichsstudie, wo fehlende Anfärbbarkeit als abnormal gewertet wurde und somit derselbe Cut-­‐off benutzt wurde. Überdies sind jedoch methodische Unterschiede vor allem hinsichtlich der Auswertung der Färbungen erkennbar. Des Weiteren fand sich in der vorliegenden Studie eine signifikante Korrelation beider Färbemerkmale von N-­‐ Cadherin mit dem histologischen Subtyp (p=0,018 bzw.0,019). So konnte N-­‐Cadherin nur in klarzelligen Karzinomen nachgewiesen werden, jedoch in keiner der anderen Subentitäten, was so in der Literatur nicht vorbeschrieben ist. Eine Assoziation von weiblichem Geschlecht und verminderter N-­‐Cadherinexpression unterschritt das Trendniveau von p=0,1 knapp. Abschließend lässt sich sagen, da sowohl die Studie von Shimanzui N-­‐Cadherin eine prognostische Bedeutung zuschreibt und, trotz unterschiedlicher Methodik, auch in der vorliegenden Arbeit ein solcher Trend erkennbar ist, N-­‐Cadherin eingehender untersucht werden sollte. Prospektive Studien sollten die Tauglichkeit von N-­‐Cadherin als prognostischer Biomarker verifizieren. In der gesunden menschlichen Niere wird K-­‐Cadherin ausschließlich im proximalen Tubulus gefunden. Dies ist besonders interessant, da dies der Ursprungsort der meisten renalen Malignome ist [Paul et al., 1997]. Die Studienlage für diesen Marker beim Nierenzellkarzinom ist dürftig und hinsichtlich der prognostischen Aussagekraft sowie der Korrelation mit etablierten prognostischen Faktoren uneinheitlich. Jedoch wird eine veränderte Expression mit einer Verschlechterung der Prognose in den wenigen verfügbaren Studien in Zusammenhang gebracht [Shimazui et al., 1998; Shimazui et al., 2006; Paul et al., 2004]. Auch scheint im Blut zirkulierende K-­‐Cadherin-­‐mRNA beim Nierenzellkarzinom ein Indikator für das Vorliegen beziehungsweise zukünftige Entstehen von Metastasen zu sein [Shimazui et al., 2004]. Im Gegensatz zu den Ergebnissen von Paul et al. und Shimazui et al. konnte in der vorliegenden Studie keine Korrelation des Expressionsmusters von K-­‐Cadherin und der Prognose festgestellt werden. Das Signifikanzniveau für eine Korrelation mit dem Grading 74 wurde nur leicht überschritten, in den genannten Studien bestand jedoch in diesem Punkt kein signifikanter Zusammenhang. Eine Erklärung für diese abweichenden Ergebnisse ist abermals in der Methodik zu suchen. Paul et al. benutzten kryokonservierte und nicht wie in der vorliegenden Studie in Paraffin eingebettete Präparate und das begrenzte Follow-­‐up ließ dort keine Auswertung nach der Kaplan-­‐Meier-­‐Methode zu. Zum anderen unterscheiden sich die Studien hinsichtlich der Evaluation der Färbungen. Durch die dürftige Datenlage und aufgrund der divergierenden Ergebnisse muss gesagt werden, dass sich seine Nutzbarkeit dieses Markers als Prognoseindikator nicht abschließend beurteilen lässt. Aufgrund des Vorhandenseins von Ki-­‐67 in sämtlichen menschlichen Geweben, insbesondere in Tumoren, hat dieser Marker breite Anwendung in der Bestimmung von Proliferationsrate bzw. -­‐index gefunden. Diese auch als Wachstumsrate oder im Englischen als Growth-­‐ oder Labeling Index bezeichnete Rate zeigt den durch Anfärbung von Ki-­‐67 markierten Anteil sich in Teilung befindlicher Zellen an. Hierdurch konnten bei verschiedensten Neoplasien wie beispielsweise Brust-­‐, Prostata-­‐ und Harnblasenkrebs oder Urothelkarzinomen Aussagen hinsichtlich deren Prognose oder hinsichtlich des Behandlungserfolgs getroffen werden [Halvorsen, 2008; Scholzen und Gerdes, 2000; Dowsett und Dunbier, 2008; Habuchi et al., 2005; Eltz et al., 2008]. Auch beim Nierenzellkarzinom postulieren viele Studien einen signifikanten Zusammenhang zwischen erhöhter Anfärbbarkeit des Tumorgewebes mit MIB-­‐1 und einer verschlechterten Prognose. Insbesondere hinsichtlich der Entwicklung von Metastasen wird Ki-­‐67 prognostische Aussagekraft zugeschrieben. Auch besteht in vielen Studien ein direkter Zusammenhang mit bereits etablierten Prognosefaktoren [McGuire und Fitzpatrick, 2009; Visapaa et al., 2003; Rioux-­‐Leclercq et al., 2000; Jochum et al., 1996; Delahunt et al., 1995; Pertia et al., 2009; Kankuri et al., 2006]. In der vorliegenden Studie sind die Ergebnisse nicht signifikant, jedoch zeigte sich für eine hohe Expression von Ki-­‐67 ein Trend zu einer schlechteren Überlebensrate, was in dieselbe Richtung wie die Vergleichsarbeiten zeigt. Auch war mit einem p-­‐Wert von 0,08 ein Trend für eine Korrelation von Ki-­‐67 mit dem Grading zu sehen. 75 Da in den zitierten Arbeiten stets alle Stadien des Nierenzellkarzinoms eingeschlossen waren und in der vorliegenden Arbeit das Signifikanzniveau nicht unterschritten wurde, sollte die Bedeutung von Ki-­‐67 gerade in den hier untersuchten höheren Stadien weiter evaluiert werden. Analog zu den zuvor diskutierten Biomarkern sind auch bei Ki-­‐67 methodische Unterschiede bezüglich der Auswertung der immunhistochemischen Färbungen zu sehen und die cut-­‐off Werte schwanken beträchtlich. Auch hier sollte eine einheitliche Methodik Auswertung der Immunhistochemien gefunden werden. Aufgrund der Pförtnerfunktion der Zellteilung, im englischen Sprachgebrauch als gatekeeper bezeichnet, wird die wichtige Bedeutung der Funktion von p16 im Zellzyklus ersichtlich. P16 wird auch als Tumorsuppressor bezeichnet, da der Verlust dieses Proteins das Tumorwachstum begünstigen kann [Serrano et al., 1996]. Die Phosphorylierung von pRB erfolgt durch einen Komplex von CDK4, CDK6 und Cyklin D, welcher bei Vorhandensein von p16 nicht gebildet werden kann. Durch eine allosterische Bindung von p16 an den Komplex aus CDK 4 und 6 kommt es zu einer Konformationsänderung, im Zuge welcher einerseits die Bindung zu Cyklin D verhindert und andererseits die Affinität zu ATP im katalytischen Zentrum verringert wird [Pavletich, 1999]. Ohne die Phosphorylierung von pRB ist ein Fortschreiten des Zellzyklus nicht möglich. Es erstaunt nicht, dass über Veränderungen innerhalb dieses Regelkreises in 80 % der menschlichen Neoplasien berichtet wurde [Ortega et al., 2002]. Auch bei urologischen Malignomen ist dies der Fall. Ein signifikanter Zusammenhang zwischen erniedrigter Expression von p16 und der Progression der Erkrankung wurde für Tumoren der Harnblase in mehreren Studien beschrieben [Hitchings et al., 2004; Shariat et al., 2004]. Ähnliches gilt für Prostatakarzinome, für welche eine Korrelation von niedrigen p16 Niveaus und häufigerem Vorkommen von Fernmetastasen gezeigt wurde. In einigen Studien geht jedoch im Gegensatz hierzu eine erhöhte Rate von p16 mit einer schlechteren Prognose einher [Chakravarti et al., 2007; Lee et al., 1999]. Auch beim Nierenzellkarzinom konnte ein Zusammenhang von unterschiedlicher immunhistochemischer Anfärbbarkeit von p16 und der Prognose aufgezeigt werden. Hierbei korrelierte der Grad der Anfärbbarkeit positiv mit der Prognose. Assoziationen mit weiteren klinisch pathologischen Parametern bestanden jedoch nicht [Ikuerowo et al., 2007]. Andere Autoren wiederum sehen einen schwachen Zusammenhang zwischen einer 76 geringeren Expression von p16 und einem erhöhten Auftreten von Metastasen. Einen Unterschied hinsichtlich des Gesamtüberlebens konstatieren sie jedoch nicht [Maruschke et al., 2011]. Ein signifikant unterschiedliches Überleben je nach Expression von p16 konnte auch in der vorliegenden Studie nicht festgestellt werden, jedoch bestand ein signifikanter Zusammenhang der Membrananfärbbarkeit mit dem histopathologischen Grading. Des Weiteren war ein Trend zu einer Korrelation der Membranfärbung mit dem weiblichen Geschlecht sowie der Färbeintensität mit der Tumorgröße erkennbar. Bei ähnlicher methodischer Vorgehensweise decken sich die Ergebnisse von Maruschke et al. bezüglich des Überlebens mit der vorliegenden Arbeit, jedoch wurden dort sämtliche Tumorstadien einbezogen. Die Studie von Ikuerowo et al. umfasst ein größeres Kollektiv ebenfalls sämtlicher Stadien, jedoch wurde dort mit Tissue mikroarrays gearbeitet und die prognostischen Unterschiede waren nur im kleinen Subkollektiv der hochpositiv gefärbten Proben signifikant, was die Vergleichbarkeit der Studien einschränkt. Zusammenfassend lässt sich sagen, dass zumindest nach der in der vorliegenden Arbeit und der Studie von Maruschke et al. angewandten Methodik sich p16 auch für das Stadium T3 nicht als prognostischer Marker zu eignen scheint. Wie der Alternative Name MMAC1 (Mutated in Multiple Advanced Cancers 1) bereits vermuten lässt, können Mutationen von PTEN in zahlreichen Tumorentitäten nachgewiesen werden. Nach Mutationen von p53 finden sich auf diesem Genlocus die häufigsten nachgewiesenen Mutationen in menschlichen Malignomen, weshalb bereits PTEN wie p53 als Wächter des Genoms bezeichnet wurde [Phillips et al., 2009; Yin und Shen, 2008]. Des Weiteren sind Keimbahnmutationen dieses Genlocus mit einer Gruppe von Krankheiten assoziiert, die unter PHTS (PTEN hamartoma tumour syndrom) zusammengefasst werden und mit einer unregulierten Zellproliferation einhergehen, die zur Bildung von Hamartomen führt. Im Einzelnen umfasst diese Gruppe die Krankheitsbilder des Cowden-­‐Syndroms, des Bannayan-­‐Riley-­‐Ruvalcava-­‐Syndroms, des Proteus-­‐Syndroms sowie des Proteus-­‐Like-­‐Syndroms. Das Cowden-­‐Syndrom geht überdies mit einem erhöhten Risiko für die Entwicklung von malignen Tumoren einher [Hobert und Eng, 2009]. 77 Auch bei Nierenzellkarzinomen wurden Mutationen dieses Gens gefunden und die Tumoren mit Veränderungen von PTEN unter den Verdacht gestellt, eine besonders invasive Untergruppe zu bilden beziehungsweise eine erhöhte Tumorprogression zu zeigen [Kondo et al., 2001; Velickovic et al., 2002]. Einige Studien berichten über eine ungünstige Prognose bei Minderexpression von PTEN sowie von Korrelationen mit weiteren prognostischen Parametern wie beispielsweise dem T-­‐Stadium [Kondo et al., 2001; Velickovic et al., 2002; Pantuck et al., 2007]. Doch die Studienlage ist nicht einheitlich. So berichten Hager et al. Gegenteiliges: Zwar würde in den meisten Nierentumoren vermindert PTEN nachgewiesen, jedoch habe dies keine Auswirkung auf die Prognose der Patienten [Hager et al., 2007]. Weitere Autoren hingegen schreiben PTEN unabhängige Prognosekraft zu [Kim et al., 2005]. In der vorliegenden Studie konnte wie bei Hager et al. kein Zusammenhang zwischen veränderter Expression von PTEN und dem Überleben mittels der Kaplan-­‐Meier-­‐Methode festgestellt werden. Auch bei diesem Biomarker unterscheiden sich die Auswertmodalitäten zwischen den einzelnen Studien gravierend. So haben Pantuck et al. den cut-­‐off bei 75% festgelegt und beschreiben so einen signifikanten Einfluss auf das Überleben. In der vorliegenden Studie wurden die Gruppen nach dem Median von 10% getrennt und hierunter kein solcher Einfluss gesehen. Andererseits ähneln sich die Ergebnisse hinsichtlich einer Korrelation mit dem T-­‐Stadium. In der Vergleichsstudie von Pantuck et al. wird berichtet, eine geringere Expression von PTEN korreliere mit einem geringeren T-­‐Stadium. Auch bei der in der vorliegenden Arbeit untersuchten Subgruppe T3 scheint dies der Fall zu sein und es zeigte sich ein Trend für eine Korrelation von dem höheren Stadium T3b mit einer erhöhten Expression von PTEN. Die Ursache dieser teilweise gegensätzlichen Ergebnisse ist abermals in den verwendeten Methoden zu suchen. Einheitliche Modalitäten sollten auch hier diskutiert werden. Eine endgültige Aussage zur prognostischen Bedeutung von PTEN kann aktuell nicht getroffen werden. 78 Limitationen und Stärken der Arbeit Wie zuvor bei einzelnen Markern beschrieben, limitiert vor allem die unterschiedliche Methodik einzelner Studien deren direkten Vergleich. So ist zum einen das Auszählen der positiv angefärbten Zellen auf den jeweiligen Schnitten selbst sehr subjektiv. In dieser Arbeit wurde versucht, dem durch eine Konsensusentscheidung teilweise entgegen zu wirken. Zum anderen divergieren die festgelegten Werte (Cut-­‐off), ab welchen zwischen hoher und niedriger Expression beziehungsweise normalem und normabweichendem Färbemuster unterschieden wird, in der Literatur beträchtlich. Analog zu dem in der Gynäkologie etablierten Rezeptor HER2neu, bei welchem definierte Auswertkriterien bestehen, sollte dies für andere immunhistochemische Marker gelten. In der vorliegenden Arbeit wurde diesem Punkt Rechnung getragen, indem stets nach identischer Methodik verfahren wurde und zunächst der Median der ausgewerteten Parameter bestimmt wurde, wonach in zwei Gruppen dichotomisiert wurde. Für das verwendete Kollektiv wurde somit ein Referenzwert generiert über welchem die Färbung als ungewöhnlich stark definiert wurde. Ein weiterer Kritikpunkt der Immunhistochemie ist der Gebrauch unterschiedlicher Antikörper gegen dasselbe Epitop, wodurch es zu abweichenden Färbeergebnissen kommen könnte. Unterschiede ergeben sich ebenfalls in den verwendeten Patientenkollektiven. In der vorliegenden Arbeit wurde ausschließlich das Stadium T3 untersucht, da gerade in höheren Stadien mit entsprechend schlechterer Prognose ein weiteres prognosebestimmendes Kriterium sinnvoll erscheint. Die meisten zitierten Vergleichsarbeiten umfassen sämtliche Stadien, weshalb auch hier ein direkter Vergleich der Ergebnisse nur unzureichend möglich ist. 79 Ausblick In zahlreichen Studien über das Nierenzellkarzinom wurden immunhistochemische Parameter und deren prognostische Bedeutung analysiert. Keiner von ihnen ist bisher allgemein anerkannt oder in regelhaftem Gebrauch. Auch in dieser Arbeit kann kein Marker abschließend als prognostisch relevant beurteilt werden. Die Erfolge bei anderen Tumorerkrankungen, gerade auch im Hinblick auf die targeted therapy, ermutigen jedoch zu weiteren Untersuchungen. In Zukunft könnte auch beim Nierenzellkarzinom ein solcher Marker oder eine Kombination mehrerer gravierende therapeutische Veränderungen nach sich ziehen. Hierbei wäre zum Beispiel das Patientenkollektiv mit einem mutmaßlich tumorfreien Status nach erfolgter Therapie zu nennen. Trotz des Erreichens dieses Primärziels werden 50% dieser Patienten ein Rezidiv erleiden und daran höchstwahrscheinlich auch versterben. Insofern wäre die Kenntnis desjenigen Patienten, welcher ein Rezidiv erfährt -­‐ bei Verfügbarkeit einer adjuvanten Therapie – von erheblicher Bedeutung [Doehn et al., 2007]. Bei wahrscheinlichem Vorliegen von Metastasen eines Nierenzellkarzinoms kann die targeted therapy (beispielsweise mit Tyrosinkinaseinhibitoren oder Inhibtoren des mamallian targed of rapamycin) effektiv sein. Jedoch sind bislang weiterhin keine prädiktiven Marker verfügbar [Doehn, 2008]. 80 5 Zusammenfassung Auf das Nierenzellkarzinom entfallen zwischen 2 und 5% aller Krebserkrankungen. In Deutschland steht es an 6. Stelle der Todesursache dieser Erkrankungsgruppe beim Mann. Hieraus wird ersichtlich, dass es sich bei dieser Erkrankung um einen Tumor mit nur eingeschränkter Prognose handelt. Etablierte Prognoseindikatoren wie das TNM-­‐ Stadium oder histopathologische Parameter wie das Grading können den Krankheitsverlauf gerade in höheren Stadien nur unbefriedigend vorhersagen. Ziel der vorliegenden retrospektiven Arbeit war es, anhand von 92 Nierenzellkarzinomen des Stadiums T3 verschiedene immunhistochemische Biomarker (CD44; E-­‐Cadherin; N-­‐ Kadherin; K-­‐Cadherin; Ki-­‐67; p16; PTEN) auf ihre prognostische Bedeutung zu überprüfen. Hierfür wurden zunächst die klinisch-­‐pathologischen Daten der Patienten erfasst und Schnitte der in Paraffin eingebetteten Proben angefertigt und immunhistochemisch gefärbt. Nach der mikroskopischen Auswertung erfolgte eine Überlebenszeitanalyse mittels der Kaplan-­‐Meier-­‐Methode und Gruppenvergleiche durch den Log-­‐Rank Test. Des Weiteren wurde Assoziationen zu bereits etablierten Prognosefaktoren mittels Vier-­‐ beziehungsweise Mehrfeldertalfeln untersucht und durch Fishers exakten Test auf Signifikanz beurteilt. Die Ergebnisse zeigten hinsichtlich der Prognose keine hochsignifikanten Korrelationen des Gesamtüberlebens mit einer Markerexpression. Jedoch konnte ein statistischer Trend für eine Korrelation der Marker N-­‐Cadherin und Ki-­‐67 mit der Prognose gesehen werden. Eine Tendenz in diese Richtung zeigt auch E-­‐Cadherin. Außerdem wurden zahlreiche Assoziationen der Expressionsmuster der Biomarker mit den weiteren untersuchten Parametern gefunden, die zum Teil so nicht vorbeschrieben waren. Zwar konnte in dieser Studie kein eindeutig prognostisch relevanter Biomarker aufgezeigt werden, jedoch weisen Teile der Ergebnisse auf eine solche potentielle Bedeutung einiger Marker hin, weshalb diese eingehender untersucht werden sollten. 81 6 Quellenverzeichnis Abraham B K, Fritz P, McClellan M, Hauptvogel P, Athelogou M und Brauch H: Prevalence of CD44+/CD24-­‐/low cells in breast cancer may not be associated with clinical outcome but may favor distant metastasis. Clin Cancer Res 11, 1154-­‐1159 (2005) Adams K F, Leitzmann M F, Albanes D, Kipnis V, Moore S C, Schatzkin A und Chow W H: Body size and renal cell cancer incidence in a large US cohort study. Am J Epidemiol 168, 268-­‐277 (2008) Altinel M, Arpali E, Turhan N, Gonenc F und Yazicioglu A: Increased expression of CD44s in conventional renal cell carcinomas with renal vein or vena cava thrombosis. a retrospective evaluation of the expression of CD44s by immunohistochemical analysis in conventional RCC patients and in conventional RCC patients with renal vein or vena cava thrombosis. Urol Int 81, 452-­‐455 (2008) Aruffo A, Stamenkovic I, Melnick M, Underhill C B und Seed B: CD44 is the principal cell surface receptor for hyaluronate. Cell 61, 1303-­‐1313 (1990) Bamias A, Chorti M, Deliveliotis C, Trakas N, Skolarikos A, Protogerou B, Legaki S, Tsakalou G, Tamvakis N und Dimopoulos M A: Prognostic significance of CA 125, CD44, and epithelial membrane antigen in renal cell carcinoma. Urology 62, 368-­‐373 (2003) Berx G, Staes K, van Hengel J, Molemans F, Bussemakers M J, van Bokhoven A und van Roy F: Cloning and characterization of the human invasion suppressor gene E-­‐cadherin (CDH1). Genomics 26, 281-­‐289 (1995) Blanco-­‐Aparicio C, Renner O, Leal J F und Carnero A: PTEN, more than the AKT pathway. Carcinogenesis 28, 1379-­‐1386 (2007) Boeckmann W und Jakse G: Nierenzellkarzinome; in Rübben H: Uroonkologie. 3. Aufl., 23–51, Springer, Berlin,. (1993) Borland G, Ross J A und Guy K: Forms and functions of CD44. Immunology 93, 139-­‐148 (1998) Brauch H, Weirich G, Brieger J, Glavac D, Rodl H, Eichinger M, Feurer M, Weidt E, Puranakanitstha C, Neuhaus C, Pomer S, Brenner W, Schirmacher P, Storkel S, Rotter M, Masera A, Gugeler N und Decker H J: VHL alterations in human clear cell renal cell carcinoma: association with advanced tumor stage and a novel hot spot mutation. Cancer Res 60, 1942-­‐1948 (2000) Brenner H: Long-­‐term survival rates of cancer patients achieved by the end of the 20th century: a period analysis. Lancet 360, 1131-­‐1135 (2002) 82 Bretheau D, Koutani A, Lechevallier E und Coulange C: A French national epidemiologic survey on renal cell carcinoma. Oncology Committee of the Association Francaise d'Urologie. Cancer 82, 538-­‐544 (1998) Bukowski R M: Prognostic factors for survival in metastatic renal cell carcinoma: update 2008. Cancer 115, 2273-­‐2281 (2009) Bullwinkel J, Baron-­‐Luhr B, Ludemann A, Wohlenberg C, Gerdes J und Scholzen T: Ki-­‐67 protein is associated with ribosomal RNA transcription in quiescent and proliferating cells. J Cell Physiol 206, 624-­‐635 (2006) Capitanio U, Cloutier V, Zini L, Isbarn H, Jeldres C, Shariat S F, Perrotte P, Antebi E, Patard J J, Montorsi F und Karakiewicz P I: A critical assessment of the prognostic value of clear cell, papillary and chromophobe histological subtypes in renal cell carcinoma: a population-­‐based study. BJU Int 103, 1496-­‐1500 (2009) Chakravarti A, DeSilvio M, Zhang M, Grignon D, Rosenthal S, Asbell S O, Hanks G, Sandler H M, Khor L Y, Pollack A und Shipley W: Prognostic value of p16 in locally advanced prostate cancer: a study based on Radiation Therapy Oncology Group Protocol 9202. J Clin Oncol 25, 3082-­‐3089 (2007) Chalmers I J, Hofler H und Atkinson M J: Mapping of a cadherin gene cluster to a region of chromosome 5 subject to frequent allelic loss in carcinoma. Genomics 57, 160-­‐163 (1999) Chao D, Zisman A, Pantuck A J, Gitlitz B J, Freedland S J, Said J W, Figlin R A und Belldegrun A S: Collecting duct renal cell carcinoma: clinical study of a rare tumor. J Urol 167, 71-­‐74 (2002) Cheville J C, Lohse C M, Zincke H, Weaver A L und Blute M L: Comparisons of outcome and prognostic features among histologic subtypes of renal cell carcinoma. Am J Surg Pathol 27, 612-­‐624 (2003) Cho E Y, Choi Y, Chae S W, Sohn J H und Ahn G H: Immunohistochemical study of the expression of adhesion molecules in ovarian serous neoplasms. Pathol Int 56, 62-­‐70 (2006) Chow W H und Devesa S S: Contemporary epidemiology of renal cell cancer. Cancer J 14, 288-­‐301 (2008) Christofori G: New signals from the invasive front. Nature 441, 444-­‐450 (2006) Coleman J A und Russo P: Hereditary and familial kidney cancer. Curr Opin Urol 19, 478-­‐ 485 (2009) Coons B J, Stec A A, Stratton K L, Chang S S, Cookson M S, Duke Herrell S, Smith J A, Jr. und Clark P E: Prognostic factors in T3b renal cell carcinoma. World J Urol 27, 75-­‐79 (2009) 83 Cully M, You H, Levine A J und Mak T W: Beyond PTEN mutations: the PI3K pathway as an integrator of multiple inputs during tumorigenesis. Nat Rev Cancer 6, 184-­‐192 (2006) Dahia P L, Aguiar R C, Alberta J, Kum J B, Caron S, Sill H, Marsh D J, Ritz J, Freedman A, Stiles C und Eng C: PTEN is inversely correlated with the cell survival factor Akt/PKB and is inactivated via multiple mechanismsin haematological malignancies. Hum Mol Genet 8, 185-­‐193 (1999) Decker J B H: Nierenzellkarzinome in: Ganten D, Ruckpaul K, Hahn S, Schmiegel W: Molekularmedizinische Grundlagen von nicht-­‐hereditäre Tumorerkrankungen. 1. Aufl., 257-­‐288, Springer, Berlin,. (2002) Delahunt B, Bethwaite P B, Thornton A und Ribas J L: Proliferation of renal cell carcinoma assessed by fixation-­‐resistant polyclonal Ki-­‐67 antibody labeling. Correlation with clinical outcome. Cancer 75, 2714-­‐2719 (1995) Delahunt B und Eble J N: de. Mod Pathol 10, 537-­‐544 (1997) Derycke L D und Bracke M E: N-­‐cadherin in the spotlight of cell-­‐cell adhesion, differentiation, embryogenesis, invasion and signalling. Int J Dev Biol 48, 463-­‐476 (2004) Di Cristofano A und Pandolfi P P: The multiple roles of PTEN in tumor suppression. Cell 100, 387-­‐390 (2000) Doehn C: [New drugs for metastatic kidney cancer]. Aktuelle Urol 39, 41-­‐52 (2008) Doehn C, Merseburger A S, Jocham D und Kuczyk M A: [Is there an indication for neoadjuvant or adjuvant systemic therapy in renal cell cancer?]. Der Urologe. Ausg. A 46, 1371-­‐1372, 1374, 1376-­‐1378 (2007) Dowsett M und Dunbier A K: Emerging biomarkers and new understanding of traditional markers in personalized therapy for breast cancer. Clin Cancer Res 14, 8019-­‐8026 (2008) Du L, Wang H, He L, Zhang J, Ni B, Wang X, Jin H, Cahuzac N, Mehrpour M, Lu Y und Chen Q: CD44 is of functional importance for colorectal cancer stem cells. Clin Cancer Res 14, 6751-­‐6760 (2008) Eggener S E, Yossepowitch O, Pettus J A, Snyder M E, Motzer R J und Russo P: Renal cell carcinoma recurrence after nephrectomy for localized disease: predicting survival from time of recurrence. J Clin Oncol 24, 3101-­‐3106 (2006) Eltz S, Comperat E, Cussenot O und Roupret M: Molecular and histological markers in urothelial carcinomas of the upper urinary tract. BJU Int 102, 532-­‐535 (2008) Erdemir F, Kilciler M, Bedir S, Ozgok Y, Coban H und Erten K: Clinical significance of platelet count in patients with renal cell carcinoma. Urol Int 79, 111-­‐116 (2007) 84 Falkenback D, Nilbert M, Oberg S und Johansson J: Prognostic value of cell adhesion in esophageal adenocarcinomas. Dis Esophagus 21, 97-­‐102 (2008) Ferlay J, Autier P, Boniol M, Heanue M, Colombet M und Boyle P: Estimates of the cancer incidence and mortality in Europe in 2006. Ann Oncol 18, 581-­‐592 (2007) Ficarra V, Guille F, Schips L, de la Taille A, Prayer Galetti T, Tostain J, Cindolo L, Novara G, Zigeuner R, Bratti E, Li G, Altieri V, Abbou C C, Zanolla L, Artibani W und Patard J J: Proposal for revision of the TNM classification system for renal cell carcinoma. Cancer 104, 2116-­‐2123 (2005) Ficarra V, Novara G, Iafrate M, Cappellaro L, Bratti E, Zattoni F und Artibani W: Proposal for reclassification of the TNM staging system in patients with locally advanced (pT3-­‐4) renal cell carcinoma according to the cancer-­‐related outcome. Eur Urol 51, 722-­‐729; discussion 729-­‐731 (2007) Fonatsch C, Duchrow M, Rieder H, Schluter C und Gerdes J: Assignment of the human Ki-­‐ 67 gene (MK167) to 10q25-­‐qter. Genomics 11, 476-­‐477 (1991) Fuhrman S A, Lasky L C und Limas C: Prognostic significance of morphologic parameters in renal cell carcinoma. Am J Surg Pathol 6, 655-­‐663 (1982) Gago-­‐Dominguez M, Yuan J M, Castelao J E, Ross R K und Yu M C: Regular use of analgesics is a risk factor for renal cell carcinoma. Br J Cancer 81, 542-­‐548 (1999) Gago-­‐Dominguez M, Yuan J M, Castelao J E, Ross R K und Yu M C: Family history and risk of renal cell carcinoma. Cancer Epidemiol Biomarkers Prev 10, 1001-­‐1004 (2001) Gerdes J, Lemke H, Baisch H, Wacker H H, Schwab U und Stein H: Cell cycle analysis of a cell proliferation-­‐associated human nuclear antigen defined by the monoclonal antibody Ki-­‐67. J Immunol 133, 1710-­‐1715 (1984) Gerdes J, Li L, Schlueter C, Duchrow M, Wohlenberg C, Gerlach C, Stahmer I, Kloth S, Brandt E und Flad H D: Immunobiochemical and molecular biologic characterization of the cell proliferation-­‐associated nuclear antigen that is defined by monoclonal antibody Ki-­‐67. Am J Pathol 138, 867-­‐873 (1991) Gerdes J, Schwab U, Lemke H und Stein H: Production of a mouse monoclonal antibody reactive with a human nuclear antigen associated with cell proliferation. Int J Cancer 31, 13-­‐20 (1983) Gervais M L, Henry P C, Saravanan A, Burry T N, Gallie B L, Jewett M A, Hill R P, Evans A J und Ohh M: Nuclear E-­‐cadherin and VHL immunoreactivity are prognostic indicators of clear-­‐cell renal cell carcinoma. Lab Invest 87, 1252-­‐1264 (2007) Gettman M T, Blute M L, Spotts B, Bryant S C und Zincke H: Pathologic staging of renal cell carcinoma: significance of tumor classification with the 1997 TNM staging system. Cancer 91, 354-­‐361 (2001) 85 Gilcrease M Z, Guzman-­‐Paz M, Niehans G, Cherwitz D, McCarthy J B und Albores-­‐ Saavedra J: Correlation of CD44S expression in renal clear cell carcinomas with subsequent tumor progression or recurrence. Cancer 86, 2320-­‐2326 (1999) Gould Rothberg B E und Bracken M B: E-­‐cadherin immunohistochemical expression as a prognostic factor in infiltrating ductal carcinoma of the breast: a systematic review and meta-­‐analysis. Breast Cancer Res Treat 100, 139-­‐148 (2006) Gravdal K, Halvorsen O J, Haukaas S A und Akslen L A: A switch from E-­‐cadherin to N-­‐ cadherin expression indicates epithelial to mesenchymal transition and is of strong and independent importance for the progress of prostate cancer. Clin Cancer Res 13, 7003-­‐ 7011 (2007) Grawitz P: Die sogenannten Lipome der Niere, Virchows Arch. Pathol. Anat, 93: 39 – 62. (1883) Grossman E, Messerli F H und Goldbourt U: Does diuretic therapy increase the risk of renal cell carcinoma? Am J Cardiol 83, 1090-­‐1093 (1999) Grunwald G B, Pratt R S und Lilien J: Enzymic dissection of embryonic cell adhesive mechanisms. III. Immunological identification of a component of the calcium-­‐dependent adhesive system of embryonic chick neural retina cells. J Cell Sci 55, 69-­‐83 (1982) Guilford P, Hopkins J, Harraway J, McLeod M, McLeod N, Harawira P, Taite H, Scoular R, Miller A und Reeve A E: E-­‐cadherin germline mutations in familial gastric cancer. Nature 392, 402-­‐405 (1998) Gumbiner B M: Regulation of cadherin-­‐mediated adhesion in morphogenesis. Nat Rev Mol Cell Biol 6, 622-­‐634 (2005) Habuchi T, Marberger M, Droller M J, Hemstreet G P, 3rd, Grossman H B, Schalken J A, Schmitz-­‐Drager B J, Murphy W M, Bono A V, Goebell P, Getzenberg R H, Hautmann S H, Messing E, Fradet Y und Lokeshwar V B: Prognostic markers for bladder cancer: International Consensus Panel on bladder tumor markers. Urology 66, 64-­‐74 (2005) Hager M, Haufe H, Kemmerling R, Mikuz G, Kolbitsch C und Moser P L: PTEN expression in renal cell carcinoma and oncocytoma and prognosis. Pathology 39, 482-­‐485 (2007) Hajj P, Ferlicot S, Massoud W, Awad A, Hammoudi Y, Charpentier B, Durrbach A, Droupy S und Benoit G: Prevalence of renal cell carcinoma in patients with autosomal dominant polycystic kidney disease and chronic renal failure. Urology 74, 631-­‐634 (2009) Halbleib J M und Nelson W J: Cadherins in development: cell adhesion, sorting, and tissue morphogenesis. Genes Dev 20, 3199-­‐3214 (2006) Halvorsen O J: Molecular and prognostic markers in prostate cancer. A study of cell-­‐cycle regulators, angiogenesis and candidate markers. APMIS Suppl 5-­‐62 (2008) 86 Hamada K, Sasaki T, Koni P A, Natsui M, Kishimoto H, Sasaki J, Yajima N, Horie Y, Hasegawa G, Naito M, Miyazaki J, Suda T, Itoh H, Nakao K, Mak T W, Nakano T und Suzuki A: The PTEN/PI3K pathway governs normal vascular development and tumor angiogenesis. Genes Dev 19, 2054-­‐2065 (2005) Hazan R B, Phillips G R, Qiao R F, Norton L und Aaronson S A: Exogenous expression of N-­‐ cadherin in breast cancer cells induces cell migration, invasion, and metastasis. J Cell Biol 148, 779-­‐790 (2000) Heck J E, Charbotel B, Moore L E, Karami S, Zaridze D G, Matveev V, Janout V, Kollarova H, Foretova L, Bencko V, Szeszenia-­‐Dabrowska N, Lissowska J, Mates D, Ferro G, Chow W H, Rothman N, Stewart P, Brennan P und Boffetta P: Occupation and renal cell cancer in Central and Eastern Europe. Occup Environ Med (2009) Hirohashi S und Kanai Y: Cell adhesion system and human cancer morphogenesis. Cancer Sci 94, 575-­‐581 (2003) Hitchings A W, Kumar M, Jordan S, Nargund V, Martin J und Berney D M: Prediction of progression in pTa and pT1 bladder carcinomas with p53, p16 and pRb. Br J Cancer 91, 552-­‐557 (2004) Hobert J A und Eng C: PTEN hamartoma tumor syndrome: an overview. Genet Med 11, 687-­‐694 (2009) Hung R J, Moore L, Boffetta P, Feng B J, Toro J R, Rothman N, Zaridze D, Navratilova M, Bencko V, Janout V, Kollarova H, Szeszenia-­‐Dabrowska N, Mates D, Chow W H und Brennan P: Family history and the risk of kidney cancer: a multicenter case-­‐control study in Central Europe. Cancer Epidemiol Biomarkers Prev 16, 1287-­‐1290 (2007) Ikuerowo S O, Kuczyk M A, von Wasielewski R, Shittu O B, Jonas U, Machtens S und Serth J: p16INK4a expression and clinicopathologic parameters in renal cell carcinoma. Eur Urol 51, 732-­‐737; discussion 738 (2007) Isacke C M: The role of the cytoplasmic domain in regulating CD44 function. J Cell Sci 107 ( Pt 9), 2353-­‐2359 (1994) Isacke C M und Yarwood H: The hyaluronan receptor, CD44. Int J Biochem Cell Biol 34, 718-­‐721 (2002) Jeanes A, Gottardi C J und Yap A S: Cadherins and cancer: how does cadherin dysfunction promote tumor progression? Oncogene 27, 6920-­‐6929 (2008) Jiang W G: E-­‐cadherin and its associated protein catenins, cancer invasion and metastasis. Br J Surg 83, 437-­‐446 (1996) Jochum W, Schroder S, al-­‐Taha R, August C, Gross A J, Berger J und Padberg B C: Prognostic significance of nuclear DNA content and proliferative activity in renal cell 87 carcinomas. A clinicopathologic study of 58 patients using mitotic count, MIB-­‐1 staining, and DNA cytophotometry. Cancer 77, 514-­‐521 (1996) Kabat G C, Silvera S A, Miller A B und Rohan T E: A cohort study of reproductive and hormonal factors and renal cell cancer risk in women. Br J Cancer 96, 845-­‐849 (2007) Kadowaki M, Nakamura S, Machon O, Krauss S, Radice G L und Takeichi M: N-­‐cadherin mediates cortical organization in the mouse brain. Dev Biol 304, 22-­‐33 (2007) Kanao K, Mizuno R, Kikuchi E, Miyajima A, Nakagawa K, Ohigashi T, Nakashima J und Oya M: Preoperative prognostic nomogram (probability table) for renal cell carcinoma based on TNM classification. J Urol 181, 480-­‐485; discussion 485 (2009) Kankuri M, Soderstrom K O, Pelliniemi T T, Vahlberg T, Pyrhonen S und Salminen E: The association of immunoreactive p53 and Ki-­‐67 with T-­‐stage, grade, occurrence of metastases and survival in renal cell carcinoma. Anticancer Res 26, 3825-­‐3833 (2006) Karakiewicz P I, Briganti A, Chun F K, Trinh Q D, Perrotte P, Ficarra V, Cindolo L, De la Taille A, Tostain J, Mulders P F, Salomon L, Zigeuner R, Prayer-­‐Galetti T, Chautard D, Valeri A, Lechevallier E, Descotes J L, Lang H, Mejean A und Patard J J: Multi-­‐institutional validation of a new renal cancer-­‐specific survival nomogram. J Clin Oncol 25, 1316-­‐1322 (2007) Katagiri A, Watanabe R und Tomita Y: E-­‐cadherin expression in renal cell cancer and its significance in metastasis and survival. Br J Cancer 71, 376-­‐379 (1995) Kausch I, Lingnau A, Endl E, Sellmann K, Deinert I, Ratliff T L, Jocham D, Sczakiel G, Gerdes J und Bohle A: Antisense treatment against Ki-­‐67 mRNA inhibits proliferation and tumor growth in vitro and in vivo. Int J Cancer 105, 710-­‐716 (2003) Kim H L, Belldegrun A S, Freitas D G, Bui M H, Han K R, Dorey F J und Figlin R A: Paraneoplastic signs and symptoms of renal cell carcinoma: implications for prognosis. J Urol 170, 1742-­‐1746 (2003) Kim H L, Seligson D, Liu X, Janzen N, Bui M H, Yu H, Shi T, Belldegrun A S, Horvath S und Figlin R A: Using tumor markers to predict the survival of patients with metastatic renal cell carcinoma. J Urol 173, 1496-­‐1501 (2005) Kojima Y, Takahara S, Miyake O, Nonomura N, Morimoto A und Mori H: Renal cell carcinoma in dialysis patients: a single center experience. Int J Urol 13, 1045-­‐1048 (2006) Kondo K, Yao M, Kobayashi K, Ota S, Yoshida M, Kaneko S, Baba M, Sakai N, Kishida T, Kawakami S, Uemura H, Nagashima Y, Nakatani Y und Hosaka M: PTEN/MMAC1/TEP1 mutations in human primary renal-­‐cell carcinomas and renal carcinoma cell lines. Int J Cancer 91, 219-­‐224 (2001) Kopper L und Timar J: Genomics of renal cell cancer-­‐-­‐ does it provide breakthrough? Pathol Oncol Res 12, 5-­‐11 (2006) 88 Kovacs G, Akhtar M, Beckwith B J, Bugert P, Cooper C S, Delahunt B, Eble J N, Fleming S, Ljungberg B, Medeiros L J, Moch H, Reuter V E, Ritz E, Roos G, Schmidt D, Srigley J R, Storkel S, van den Berg E und Zbar B: The Heidelberg classification of renal cell tumours. J Pathol 183, 131-­‐133 (1997) Kwak J M, Min B W, Lee J H, Choi J S, Lee S I, Park S S, Kim J, Um J W, Kim S H und Moon H Y: The prognostic significance of E-­‐cadherin and liver intestine-­‐cadherin expression in colorectal cancer. Dis Colon Rectum 50, 1873-­‐1880 (2007) Lai C H, Shan Y S, Sy E D, Hsieh Y H, Tsai H W, Lee J C und Lin P W: The significance of CD44 expression in gastrointestinal neuroendocrine tumors. Hepatogastroenterology 52, 1071-­‐1076 (2005) Lam J S, Shvarts O, Leppert J T, Figlin R A und Belldegrun A S: Renal cell carcinoma 2005: new frontiers in staging, prognostication and targeted molecular therapy. J Urol 173, 1853-­‐1862 (2005) Langner C, Ratschek M, Rehak P, Schips L und Zigeuner R: Expression of MUC1 (EMA) and E-­‐cadherin in renal cell carcinoma: a systematic immunohistochemical analysis of 188 cases. Mod Pathol 17, 180-­‐188 (2004) Latif F, Tory K, Gnarra J, Yao M, Duh F M, Orcutt M L, Stackhouse T, Kuzmin I, Modi W, Geil L und et al.: Identification of the von Hippel-­‐Lindau disease tumor suppressor gene. Science 260, 1317-­‐1320 (1993) Le Q T, Chen E, Salim A, Cao H, Kong C S, Whyte R, Donington J, Cannon W, Wakelee H, Tibshirani R, Mitchell J D, Richardson D, O'Byrne K J, Koong A C und Giaccia A J: An evaluation of tumor oxygenation and gene expression in patients with early stage non-­‐ small cell lung cancers. Clin Cancer Res 12, 1507-­‐1514 (2006) Lee C T, Capodieci P, Osman I, Fazzari M, Ferrara J, Scher H I und Cordon-­‐Cardo C: Overexpression of the cyclin-­‐dependent kinase inhibitor p16 is associated with tumor recurrence in human prostate cancer. Clin Cancer Res 5, 977-­‐983 (1999) Lee J E, Hankinson S E und Cho E: Reproductive factors and risk of renal cell cancer: the Nurses' Health Study. Am J Epidemiol 169, 1243-­‐1250 (2009) Lee J E, Hunter D J, Spiegelman D, Adami H O, Albanes D, Bernstein L, van den Brandt P A, Buring J E, Cho E, Folsom A R, Freudenheim J L, Giovannucci E, Graham S, Horn-­‐Ross P L, Leitzmann M F, McCullough M L, Miller A B, Parker A S, Rodriguez C, Rohan T E, Schatzkin A, Schouten L J, Virtanen M, Willett W C, Wolk A, Zhang S M und Smith-­‐Warner S A: Alcohol intake and renal cell cancer in a pooled analysis of 12 prospective studies. J Natl Cancer Inst 99, 801-­‐810 (2007) Lee J E, Spiegelman D, Hunter D J, Albanes D, Bernstein L, van den Brandt P A, Buring J E, Cho E, English D R, Freudenheim J L, Giles G G, Graham S, Horn-­‐Ross P L, Hakansson N, Leitzmann M F, Mannisto S, McCullough M L, Miller A B, Parker A S, Rohan T E, Schatzkin 89 A, Schouten L J, Sweeney C, Willett W C, Wolk A, Zhang S M und Smith-­‐Warner S A: Fat, protein, and meat consumption and renal cell cancer risk: a pooled analysis of 13 prospective studies. J Natl Cancer Inst 100, 1695-­‐1706 (2008) Leibovich B C, Cheville J C, Lohse C M, Zincke H, Kwon E D, Frank I, Thompson R H und Blute M L: Cancer specific survival for patients with pT3 renal cell carcinoma-­‐can the 2002 primary tumor classification be improved? J Urol 173, 716-­‐719 (2005) Leslie N R und Downes C P: PTEN function: how normal cells control it and tumour cells lose it. Biochem J 382, 1-­‐11 (2004) Li D M und Sun H: TEP1, encoded by a candidate tumor suppressor locus, is a novel protein tyrosine phosphatase regulated by transforming growth factor beta. Cancer Res 57, 2124-­‐2129 (1997) Li J, Yen C, Liaw D, Podsypanina K, Bose S, Wang S I, Puc J, Miliaresis C, Rodgers L, McCombie R, Bigner S H, Giovanella B C, Ittmann M, Tycko B, Hibshoosh H, Wigler M H und Parsons R: PTEN, a putative protein tyrosine phosphatase gene mutated in human brain, breast, and prostate cancer. Science 275, 1943-­‐1947 (1997) Lim S D, Young A N, Paner G P und Amin M B: Prognostic role of CD44 cell adhesion molecule expression in primary and metastatic renal cell carcinoma: a clinicopathologic study of 125 cases. Virchows Arch 452, 49-­‐55 (2008) Lindblad P, Chow W H, Chan J, Bergstrom A, Wolk A, Gridley G, McLaughlin J K, Nyren O und Adami H O: The role of diabetes mellitus in the aetiology of renal cell cancer. Diabetologia 42, 107-­‐112 (1999) Lipworth L, Tarone R E und McLaughlin J K: The epidemiology of renal cell carcinoma. J Urol 176, 2353-­‐2358 (2006) Liu J und Jiang G: CD44 and hematologic malignancies. Cell Mol Immunol 3, 359-­‐365 (2006) Ljungberg B: Prognostic markers in renal cell carcinoma. Curr Opin Urol 17, 303-­‐308 (2007) Ljungberg B, Hanbury D C, Kuczyk M A, Merseburger A S, Mulders P F A, Patard J-­‐J und Sinescu I C: www.uroweb.org (Tag des Zugriifs: 14.10.2009): Guidelines on Renal Cell Carcinoma, 8-­‐10. (2007) Lopez-­‐Beltran A, Carrasco J C, Cheng L, Scarpelli M, Kirkali Z und Montironi R: 2009 update on the classification of renal epithelial tumors in adults. Int J Urol 16, 432-­‐443 (2009) Lucin K, Matusan K, Dordevic G und Stipic D: Prognostic significance of CD44 molecule in renal cell carcinoma. Croat Med J 45, 703-­‐708 (2004) 90 Lughezzani G, Capitanio U, Jeldres C, Isbarn H, Shariat S F, Arjane P, Widmer H, Perrotte P, Montorsi F und Karakiewicz P I: Prognostic significance of lymph node invasion in patients with metastatic renal cell carcinoma: a population-­‐based perspective. Cancer (2009) Mandel J S, McLaughlin J K, Schlehofer B, Mellemgaard A, Helmert U, Lindblad P, McCredie M und Adami H O: International renal-­‐cell cancer study. IV. Occupation. Int J Cancer 61, 601-­‐605 (1995) Maruschke M, Thur S, Kundt G, Nizze H und Hakenberg O W: Immunohistochemical expression of retinoblastoma protein and p16 in renal cell carcinoma. Urologia internationalis 86, 60-­‐67 (2011) McCredie M, Pommer W, McLaughlin J K, Stewart J H, Lindblad P, Mandel J S, Mellemgaard A, Schlehofer B und Niwa S: International renal-­‐cell cancer study. II. Analgesics. Int J Cancer 60, 345-­‐349 (1995) McGuire B B und Fitzpatrick J M: Biomarkers in renal cell carcinoma. Curr Opin Urol 19, 441-­‐446 (2009) McLaughlin J K, Lindblad P, Mellemgaard A, McCredie M, Mandel J S, Schlehofer B, Pommer W und Adami H O: International renal-­‐cell cancer study. I. Tobacco use. Int J Cancer 60, 194-­‐198 (1995) Menezes R J, Tomlinson G und Kreiger N: Physical activity and risk of renal cell carcinoma. Int J Cancer 107, 642-­‐646 (2003) Mensink G B, Lampert T und Bergmann E: [Overweight and obesity in Germany 1984-­‐ 2003]. Bundesgesundheitsblatt Gesundheitsforschung Gesundheitsschutz 48, 1348-­‐1356 (2005) Miyagawa T, Shimazui T, Hinotsu S, Oikawa T, Sekido N, Miyanaga N, Kawai K und Akaza H: Does tumor size or microvascular invasion affect prognosis in patients with renal cell carcinoma? Jpn J Clin Oncol 37, 197-­‐200 (2007) Moch H, Gasser T, Amin M B, Torhorst J, Sauter G und Mihatsch M J: Prognostic utility of the recently recommended histologic classification and revised TNM staging system of renal cell carcinoma: a Swiss experience with 588 tumors. Cancer 89, 604-­‐614 (2000) Montironi R, Mikuz G, Algaba F, Lopez-­‐Beltran A, Hamilton P W und Parkinson C: Epithelial tumours of the adult kidney. Virchows Arch 434, 281-­‐290 (1999) Muramaki M, Miyake H, Kamidono S und Hara I: Over expression of CD44V8-­‐10 in human bladder cancer cells decreases their interaction with hyaluronic acid and potentiates their malignant progression. J Urol 171, 426-­‐430 (2004) Musial J, Sporny S und Nowicki A: Prognostic significance of E-­‐cadherin and ezrin immunohistochemical expression in prostate cancer. Pol J Pathol 58, 235-­‐243 (2007) 91 Nakamura N, Ramaswamy S, Vazquez F, Signoretti S, Loda M und Sellers W R: Forkhead transcription factors are critical effectors of cell death and cell cycle arrest downstream of PTEN. Mol Cell Biol 20, 8969-­‐8982 (2000) Natalwala A, Spychal R und Tselepis C: Epithelial-­‐mesenchymal transition mediated tumourigenesis in the gastrointestinal tract. World J Gastroenterol 14, 3792-­‐3797 (2008) Neuzillet Y, Culine S und Patard J J: Prognostic factors for cases with metastatic renal cell carcinoma in the era of targeted medicine. Int J Urol 16, 855-­‐861 (2009) Nickerson M L, Jaeger E, Shi Y, Durocher J A, Mahurkar S, Zaridze D, Matveev V, Janout V, Kollarova H, Bencko V, Navratilova M, Szeszenia-­‐Dabrowska N, Mates D, Mukeria A, Holcatova I, Schmidt L S, Toro J R, Karami S, Hung R, Gerard G F, Linehan W M, Merino M, Zbar B, Boffetta P, Brennan P, Rothman N, Chow W H, Waldman F M und Moore L E: Improved identification of von Hippel-­‐Lindau gene alterations in clear cell renal tumors. Clin Cancer Res 14, 4726-­‐4734 (2008) Nieman M T, Prudoff R S, Johnson K R und Wheelock M J: N-­‐cadherin promotes motility in human breast cancer cells regardless of their E-­‐cadherin expression. J Cell Biol 147, 631-­‐644 (1999) Nizze H, Kerjaschki D und Moch H: Nierenzellkarzinom. In: Böcker W, Denk H, Heitz Ph U: Pathologie. 3. Aufl., 860-­‐863, Urban und Fischer, München. 3, (2004) Nollet F, Kools P und van Roy F: Phylogenetic analysis of the cadherin superfamily allows identification of six major subfamilies besides several solitary members. J Mol Biol 299, 551-­‐572 (2000) Nouh M A, Kuroda N, Yamashita M, Hayashida Y, Yano T, Minakuchi J, Taniguchi S, Nomura I, Inui M, Sugimoto M und Kakehi Y: Renal cell carcinoma in patients with end-­‐ stage renal disease: relationship between histological type and duration of dialysis. BJU Int (2009) Nouwen E J, Dauwe S, van der Biest I und De Broe M E: Stage-­‐ and segment-­‐specific expression of cell-­‐adhesion molecules N-­‐CAM, A-­‐CAM, and L-­‐CAM in the kidney. Kidney Int 44, 147-­‐158 (1993) Novara G, Martignoni G, Artibani W und Ficarra V: Grading systems in renal cell carcinoma. J Urol 177, 430-­‐436 (2007) Oberling C, Riviere M und Haguenau F: Ultrastructure of the clear cells in renal carcinomas and its importance for the demonstration of their renal origin. Nature 186, 402-­‐403 (1960) Ortega S, Malumbres M und Barbacid M: Cyclin D-­‐dependent kinases, INK4 inhibitors and cancer. Biochim Biophys Acta 1602, 73-­‐87 (2002) 92 Pantuck A J, Seligson D B, Klatte T, Yu H, Leppert J T, Moore L, O'Toole T, Gibbons J, Belldegrun A S und Figlin R A: Prognostic relevance of the mTOR pathway in renal cell carcinoma: implications for molecular patient selection for targeted therapy. Cancer 109, 2257-­‐2267 (2007) Pantuck A J, Zisman A und Belldegrun A S: The changing natural history of renal cell carcinoma. J Urol 166, 1611-­‐1623 (2001) Paradis V, Ferlicot S, Ghannam E, Zeimoura L, Blanchet P, Eschwege P, Jardin A, Benoit G und Bedossa P: CD44 is an independent prognostic factor in conventional renal cell carcinomas. J Urol 161, 1984-­‐1987 (1999) Parker A S, Cerhan J R, Lynch C F, Leibovich B C und Cantor K P: History of urinary tract infection and risk of renal cell carcinoma. Am J Epidemiol 159, 42-­‐48 (2004) Pascual D und Borque A: Epidemiology of kidney cancer. Adv Urol 782381 (2008) Patard J J, Leray E, Rioux-­‐Leclercq N, Cindolo L, Ficarra V, Zisman A, De La Taille A, Tostain J, Artibani W, Abbou C C, Lobel B, Guille F, Chopin D K, Mulders P F, Wood C G, Swanson D A, Figlin R A, Belldegrun A S und Pantuck A J: Prognostic value of histologic subtypes in renal cell carcinoma: a multicenter experience. J Clin Oncol 23, 2763-­‐2771 (2005) Paul R, Ewing C M, Robinson J C, Marshall F F, Johnson K R, Wheelock M J und Isaacs W B: Cadherin-­‐6, a cell adhesion molecule specifically expressed in the proximal renal tubule and renal cell carcinoma. Cancer Res 57, 2741-­‐2748 (1997) Paul R, Necknig U, Busch R, Ewing C M, Hartung R und Isaacs W B: Cadherin-­‐6: a new prognostic marker for renal cell carcinoma. J Urol 171, 97-­‐101 (2004) Pavletich N P: Mechanisms of cyclin-­‐dependent kinase regulation: structures of Cdks, their cyclin activators, and Cip and INK4 inhibitors. J Mol Biol 287, 821-­‐828 (1999) Pelucchi C, Galeone C, Montella M, Polesel J, Crispo A, Talamini R, Negri E, Ramazzotti V, Grimaldi M, Franceschi S und La Vecchia C: Alcohol consumption and renal cell cancer risk in two Italian case-­‐control studies. Ann Oncol 19, 1003-­‐1008 (2008) Pertia A, Nikoleishvili D, Trsintsadze O, Gogokhia N, Managadze L und Chkhotua A: Immunoreactivity of p27(Kip1), cyclin D3, and Ki67 in conventional renal cell carcinoma. Int Urol Nephrol 41, 243-­‐249 (2009) Pesch B, Haerting J, Ranft U, Klimpel A, Oelschlagel B und Schill W: Occupational risk factors for renal cell carcinoma: agent-­‐specific results from a case-­‐control study in Germany. MURC Study Group. Multicenter urothelial and renal cancer study. Int J Epidemiol 29, 1014-­‐1024 (2000) Phillips L S, Thompson C L, Merkulova A, Plummer S J, Tucker T C, Casey G und Li L: No association between phosphatase and tensin homolog genetic polymorphisms and colon cancer. World J Gastroenterol 15, 3771-­‐3775 (2009) 93 Pokutta S und Weis W I: Structure and mechanism of cadherins and catenins in cell-­‐cell contacts. Annu Rev Cell Dev Biol 23, 237-­‐261 (2007) Polascik T J, Bostwick D G und Cairns P: Molecular genetics and histopathologic features of adult distal nephron tumors. Urology 60, 941-­‐946 (2002) Redies C und Takeichi M: Cadherins in the developing central nervous system: an adhesive code for segmental and functional subdivisions. Dev Biol 180, 413-­‐423 (1996) Rioux-­‐Leclercq N, Epstein J I, Bansard J Y, Turlin B, Patard J J, Manunta A, Chan T, Ramee M P, Lobel B und Moulinoux J P: Clinical significance of cell proliferation, microvessel density, and CD44 adhesion molecule expression in renal cell carcinoma. Hum Pathol 32, 1209-­‐1215 (2001) Rioux-­‐Leclercq N, Turlin B, Bansard J, Patard J, Manunta A, Moulinoux J P, Guille F, Ramee M P und Lobel B: Value of immunohistochemical Ki-­‐67 and p53 determinations as predictive factors of outcome in renal cell carcinoma. Urology 55, 501-­‐505 (2000) Robertson K D und Jones P A: Tissue-­‐specific alternative splicing in the human INK4a/ARF cell cycle regulatory locus. Oncogene 18, 3810-­‐3820 (1999) Ronkainen H, Kauppila S, Hirvikoski P und Vaarala M H: Evaluation of myosin VI, E-­‐ cadherin and beta-­‐catenin immunostaining in renal cell carcinoma. J Exp Clin Cancer Res 29, 2 (2010) Rudzki Z und Jothy S: CD44 and the adhesion of neoplastic cells. Mol Pathol 50, 57-­‐71 (1997) Schluter C, Duchrow M, Wohlenberg C, Becker M H, Key G, Flad H D und Gerdes J: The cell proliferation-­‐associated antigen of antibody Ki-­‐67: a very large, ubiquitous nuclear protein with numerous repeated elements, representing a new kind of cell cycle-­‐ maintaining proteins. J Cell Biol 123, 513-­‐522 (1993) Scholzen T und Gerdes J: The Ki-­‐67 protein: from the known and the unknown. J Cell Physiol 182, 311-­‐322 (2000) Schonk D M, Kuijpers H J, van Drunen E, van Dalen C H, Geurts van Kessel A H, Verheijen R und Ramaekers F C: Assignment of the gene(s) involved in the expression of the proliferation-­‐related Ki-­‐67 antigen to human chromosome 10. Hum Genet 83, 297-­‐299 (1989) Schubert-­‐Fritschle G, Hölscher G, Schmidt M, Eckel R, Engel J, Tretter W und Hölzel D: Jahresbericht 2001/2002 des klinisch-­‐epidemiologischen Krebsregisters am Tumorzentrum München Schwerpunkt: Larynx, Lunge, Niere, 95-­‐114 W. Zuckschwerdt Verlag, München. (2002) 94 Sengupta S, Lohse C M, Leibovich B C, Frank I, Thompson R H, Webster W S, Zincke H, Blute M L, Cheville J C und Kwon E D: Histologic coagulative tumor necrosis as a prognostic indicator of renal cell carcinoma aggressiveness. Cancer 104, 511-­‐520 (2005) Serrano M, Hannon G J und Beach D: A new regulatory motif in cell-­‐cycle control causing specific inhibition of cyclin D/CDK4. Nature 366, 704-­‐707 (1993) Serrano M, Lee H, Chin L, Cordon-­‐Cardo C, Beach D und DePinho R A: Role of the INK4a locus in tumor suppression and cell mortality. Cell 85, 27-­‐37 (1996) Shan W S, Tanaka H, Phillips G R, Arndt K, Yoshida M, Colman D R und Shapiro L: Functional cis-­‐heterodimers of N-­‐ and R-­‐cadherins. J Cell Biol 148, 579-­‐590 (2000) Shapiro L und Weis W I: Structure and biochemistry of cadherins and catenins. Cold Spring Harbor Perspect Biol 1, a003053 (2009) Shariat S F, Tokunaga H, Zhou J, Kim J, Ayala G E, Benedict W F und Lerner S P: p53, p21, pRB, and p16 expression predict clinical outcome in cystectomy with bladder cancer. J Clin Oncol 22, 1014-­‐1024 (2004) Sharrard R M und Maitland N J: Alternative splicing of the human PTEN/MMAC1/TEP1 gene. Biochim Biophys Acta 1494, 282-­‐285 (2000) Sherr C J: Cancer cell cycles. Science 274, 1672-­‐1677 (1996) Sherr C J: The Pezcoller lecture: cancer cell cycles revisited. Cancer Res 60, 3689-­‐3695 (2000) Shimada Y, Yamasaki S, Hashimoto Y, Ito T, Kawamura J, Soma T, Ino Y, Nakanishi Y, Sakamoto M, Hirohashi S und Imamura M: Clinical significance of dysadherin expression in gastric cancer patients. Clin Cancer Res 10, 2818-­‐2823 (2004) Shimazui T, Kojima T, Onozawa M, Suzuki M, Asano T und Akaza H: Expression profile of N-­‐cadherin differs from other classical cadherins as a prognostic marker in renal cell carcinoma. Oncol Rep 15, 1181-­‐1184 (2006) Shimazui T, Oosterwijk E, Akaza H, Bringuier P, Ruijter E, van Berkel H, Wakka J O, van Bokhoven A, Debruyne F M und Schalken J A: Expression of cadherin-­‐6 as a novel diagnostic tool to predict prognosis of patients with E-­‐cadherin-­‐absent renal cell carcinoma. Clin Cancer Res 4, 2419-­‐2424 (1998) Shimazui T, Yoshikawa K, Uemura H, Hirao Y, Saga S und Akaza H: The level of cadherin-­‐6 mRNA in peripheral blood is associated with the site of metastasis and with the subsequent occurrence of metastases in renal cell carcinoma. Cancer 101, 963-­‐968 (2004) Shimoyama Y, Gotoh M, Terasaki T, Kitajima M und Hirohashi S: Isolation and sequence analysis of human cadherin-­‐6 complementary DNA for the full coding sequence and its expression in human carcinoma cells. Cancer Res 55, 2206-­‐2211 (1995) 95 Shin S J, Kim K O, Kim M K, Lee K H, Hyun M S, Kim K J, Choi J H und Song H S: Expression of E-­‐cadherin and uPA and their association with the prognosis of pancreatic cancer. Jpn J Clin Oncol 35, 342-­‐348 (2005) Siddiqui S A, Frank I, Leibovich B C, Cheville J C, Lohse C M, Zincke H und Blute M L: Impact of tumor size on the predictive ability of the pT3a primary tumor classification for renal cell carcinoma. The Journal of urology 177, 59-­‐62 (2007) Stafford H S, Saltzstein S L, Shimasaki S, Sanders C, Downs T M und Sadler G R: Racial/ethnic and gender disparities in renal cell carcinoma incidence and survival. J Urol 179, 1704-­‐1708 (2008) Steck P A, Pershouse M A, Jasser S A, Yung W K, Lin H, Ligon A H, Langford L A, Baumgard M L, Hattier T, Davis T, Frye C, Hu R, Swedlund B, Teng D H und Tavtigian S V: Identification of a candidate tumour suppressor gene, MMAC1, at chromosome 10q23.3 that is mutated in multiple advanced cancers. Nat Genet 15, 356-­‐362 (1997) Stemmler M P: Cadherins in development and cancer. Mol Biosyst 4, 835-­‐850 (2008) Stepniak E, Radice G L und Vasioukhin V: Adhesive and signaling functions of cadherins and catenins in vertebrate development. Cold Spring Harbor Perspect Biol 1, a002949 (2009) Storkel S, Eble J N, Adlakha K, Amin M, Blute M L, Bostwick D G, Darson M, Delahunt B und Iczkowski K: Classification of renal cell carcinoma: Workgroup No. 1. Union Internationale Contre le Cancer (UICC) and the American Joint Committee on Cancer (AJCC). Cancer 80, 987-­‐989 (1997) Storkel S, Steart P V, Drenckhahn D und Thoenes W: The human chromophobe cell renal carcinoma: its probable relation to intercalated cells of the collecting duct. Virchows Arch B Cell Pathol Incl Mol Pathol 56, 237-­‐245 (1989) Sunela K L, Kataja M J, Lehtinen E T, Salminen T K, Kujala P M, Virman J P und Kellokumpu-­‐Lehtinen P L: Prognostic factors and long-­‐term survival in renal cell cancer patients. Scand J Urol Nephrol 43, 454-­‐460 (2009) Takeichi M: Cadherins: a molecular family important in selective cell-­‐cell adhesion. Annu Rev Biochem 59, 237-­‐252 (1990) Takeichi M: Cadherins in cancer: implications for invasion and metastasis. Curr Opin Cell Biol 5, 806-­‐811 (1993) Tawfik O W, Kramer B, Shideler B, Danley M, Kimler B F und Holzbeierlein J: Prognostic significance of CD44, platelet-­‐derived growth factor receptor alpha, and cyclooxygenase 2 expression in renal cell carcinoma. Arch Pathol Lab Med 131, 261-­‐267 (2007) 96 Terpe H J, Storkel S, Zimmer U, Anquez V, Fischer C, Pantel K und Gunthert U: Expression of CD44 isoforms in renal cell tumors. Positive correlation to tumor differentiation. Am J Pathol 148, 453-­‐463 (1996) Tolg C, Hofmann M, Herrlich P und Ponta H: Splicing choice from ten variant exons establishes CD44 variability. Nucleic Acids Res 21, 1225-­‐1229 (1993) UICC: Niere. In: Wittekind C, Klinmpfinger M, Sobin L H: TNM Atlas, 5.Auflage, 307-­‐315, Springer, Berlin. (1998) UICC: Niere. In: Wittekind C, Meyer, H-­‐J, Bootz F: TNM Klassifikation maligner Tumore., 6. Aufl., 181-­‐184, Springer, Berlin. (2002) UICC: Niere. In: Wittekind C, Meyer H-­‐J, Gospodarowicz M K: TNM Klassifikation maligner Tumore. 7. Aufl., 239-­‐242, WILEY-­‐VCH, Weinheim. (2010) Underhill C: CD44: the hyaluronan receptor. J Cell Sci 103 ( Pt 2), 293-­‐298 (1992) Vamvakas S, Bahner U und Heidland A: Cancer in end-­‐stage renal disease: potential factors involved -­‐editorial. Am J Nephrol 18, 89-­‐95 (1998) Velickovic M, Delahunt B, McIver B und Grebe S K: Intragenic PTEN/MMAC1 loss of heterozygosity in conventional (clear-­‐cell) renal cell carcinoma is associated with poor patient prognosis. Mod Pathol 15, 479-­‐485 (2002) Verhoest G, Avakian R, Bensalah K, Thuret R, Ficarra V, Artibani W, Tostain J, Guille F, Cindolo L, De La Taille A, Abbou C C, Salomon L, Rioux-­‐Leclercq N und Patard J J: Urinary collecting system invasion is an independent prognostic factor of organ confined renal cell carcinoma. J Urol 182, 854-­‐859 (2009) Virchow R: Lipome. In: Die krankhaften Geschwülste: dreissig Vorlesungen, gehalten während des Wintersemesters 1862 -­‐ 1863 an der Universität zu Berlin, Band 1, 364-­‐395, Hirschwanld, Berlin. (1863) Visapaa H, Bui M, Huang Y, Seligson D, Tsai H, Pantuck A, Figlin R, Rao J Y, Belldegrun A, Horvath S und Palotie A: Correlation of Ki-­‐67 and gelsolin expression to clinical outcome in renal clear cell carcinoma. Urology 61, 845-­‐850 (2003) Volpe A und Patard J J: Prognostic factors in renal cell carcinoma. World J Urol 28, 319-­‐ 327 (2010) Wallerand H, Cai Y, Wainberg Z A, Garraway I, Lascombe I, Nicolle G, Thiery J P, Bittard H, Radvanyi F und Reiter R R: Phospho-­‐Akt pathway activation and inhibition depends on N-­‐ cadherin or phospho-­‐EGFR expression in invasive human bladder cancer cell lines(). Urol Oncol (2008) Wallis J, Fox M F und Walsh F S: Structure of the human N-­‐cadherin gene: YAC analysis and fine chromosomal mapping to 18q11.2. Genomics 22, 172-­‐179 (1994) 97 Weikert S, Boeing H, Pischon T, Weikert C, Olsen A, Tjonneland A, Overvad K, Becker N, Linseisen J, Trichopoulou A, Mountokalakis T, Trichopoulos D, Sieri S, Palli D, Vineis P, Panico S, Peeters P H, Bueno-­‐de-­‐Mesquita H B, Verschuren W M, Ljungberg B, Hallmans G, Berglund G, Gonzalez C A, Dorronsoro M, Barricarte A, Tormo M J, Allen N, Roddam A, Bingham S, Khaw K T, Rinaldi S, Ferrari P, Norat T und Riboli E: Blood pressure and risk of renal cell carcinoma in the European prospective investigation into cancer and nutrition. Am J Epidemiol 167, 438-­‐446 (2008) Werner M, Chott A, Fabiano A und Battifora H: Effect of formalin tissue fixation and processing on immunohistochemistry. The American journal of surgical pathology 24, 1016-­‐1019 (2000) Whaley J M, Naglich J, Gelbert L, Hsia Y E, Lamiell J M, Green J S, Collins D, Neumann H P, Laidlaw J, Li F P und et al.: Germ-­‐line mutations in the von Hippel-­‐Lindau tumor-­‐ suppressor gene are similar to somatic von Hippel-­‐Lindau aberrations in sporadic renal cell carcinoma. Am J Hum Genet 55, 1092-­‐1102 (1994) Wu S T, Sun G H, Hsieh D S, Chen A, Chen H I, Chang S Y und Yu D: Correlation of CD44v5 expression with invasiveness and prognosis in renal cell carcinoma. J Formos Med Assoc 102, 229-­‐233 (2003) www.rki.de (Tag des Zugriffs 27.09.2010): Krebs in Deutschland 2005 – 2006. Häufigkeiten und Trends. (2010) Xiang Y Y, Tanaka M, Suzuki M, Igarashi H, Kiyokawa E, Naito Y, Ohtawara Y, Shen Q, Sugimura H und Kino I: Isolation of complementary DNA encoding K-­‐cadherin, a novel rat cadherin preferentially expressed in fetal kidney and kidney carcinoma. Cancer Res 54, 3034-­‐3041 (1994) Yamada K M und Araki M: Tumor suppressor PTEN: modulator of cell signaling, growth, migration and apoptosis. J Cell Sci 114, 2375-­‐2382 (2001) Yasunaga Y, Shin M, Miki T, Okuyama A und Aozasa K: Prognostic factors of renal cell carcinoma: a multivariate analysis. J Surg Oncol 68, 11-­‐18 (1998) Yildiz E, Gokce G, Kilicarslan H, Ayan S, Goze O F und Gultekin E Y: Prognostic value of the expression of Ki-­‐67, CD44 and vascular endothelial growth factor, and microvessel invasion, in renal cell carcinoma. BJU Int 93, 1087-­‐1093 (2004) Yin Y und Shen W H: PTEN: a new guardian of the genome. Oncogene 27, 5443-­‐5453 (2008) Zucchetto A, Dal Maso L, Tavani A, Montella M, Ramazzotti V, Talamini R, Canzonieri V, Garbeglio A, Negri E, Franceschi S und La Vecchia C: History of treated hypertension and diabetes mellitus and risk of renal cell cancer. Ann Oncol 18, 596-­‐600 (2007) 98 Zucchetto A, Talamini R, Dal Maso L, Negri E, Polesel J, Ramazzotti V, Montella M, Canzonieri V, Serraino D, La Vecchia C und Franceschi S: Reproductive, menstrual, and other hormone-­‐related factors and risk of renal cell cancer. Int J Cancer 123, 2213-­‐2216 (2008) 99 7 Abbildungsverzeichnis Tabellen: 1: Klassifikation des Nierenzellkarzinoms 2: Modifikationen der TNM Stadien 3: Antigendemaskierung 4. Überblick über die erhobenen Daten 5: Korrelation der Färbeintensität von CD44 mit dem Grading 6: Korrelation der Anzahl der CD44 markierten Zellen und Grading 7: Korrelation der CD44 Zytoplasmafärbung und Grading 8: Korrelation der Färbeintensität von CD44 mit der Tumorgröße 9: Korrelation der Anzahl der CD44 markierten Zellen und Tumorgröße 10: Korrelation der Anzahl der CD44 markierten Zellen und Metastasen 11: Korrelation von CD44 Zytoplasmafärbung und Histologie 12: Korrelation von E-­‐Cadherin Färbeintensität und Grading 13: Korrelation von Anzahl E-­‐Cadherin markierten Zellen und Grading 14: Korrelation von N-­‐Cadherin Färbeintensität und Histologie 15: Korrelation Anzahl N-­‐Cadherin markierten Zellen in Histologie 16: Korrelation von N-­‐Cadherin Färbeintensität und Geschlecht 17: Korrelation der Anzahl K-­‐Cadherin markierter Zellen und Grading 18: Korrelation der Anzahl Ki-­‐67 markierter Zellen und Grading 19: Korrelation der Anzahl p16 membranös markierter Zellen und Grading 20: Korrelation der Anzahl p16 zytoplasmatisch markierter Zellen und Grading 21: Korrelation der Anzahl p16 membranös markierter Zellen und dem Geschlecht 22: Korrelation der p16 Färbeintensität und Tumorgröße 23: Korrelation der Anzahl PTEN markierten Zellen mit Tumorstadium 24: Genetische Aberrationen 100 Abbildungen: 1: Ursprungsorte des Nierenzellkarzinoms, 2: HE Färbung Nierenzellkarzinom 3: Negative Färbung 4: Immunhistochemische Färbung Ki-­‐67 5: Immunhistochemische Färbung PTEN 6: Immunhistochemische Färbung K-­‐Cadherin 7: Immunhistochemische Färbung E-­‐Cadherin 8. Immunhistochemische Färbung N-­‐Cadherin 9: Immunhistochemische Färbung CD44 10: Immunhistochemische Färbung p16 11: Alter der Patienten bei Operation in Dekaden 12: Kaplan-­‐Meier-­‐Kurve Gesamtüberleben des Patientenkollektives 13: Kaplan-­‐Meier-­‐Kurve T3a vs. T3b 14: Kaplan-­‐Meier-­‐Kurve Nodalstatus 15: Kaplan-­‐Meier-­‐Kurve Metastasen 16: Kaplan-­‐Meier-­‐Kurve Grading 17: Kaplan-­‐Meier-­‐Kurve Größe (dichotomisiert nach Median 18: Kaplan-­‐Meier-­‐Kurve Größe (gruppiert nach TNM) 19: Kaplan-­‐Meier-­‐Kurve Histologie 20: Kaplan-­‐Meier-­‐Kurve Histologie 21: Kaplan-­‐Meier-­‐Kurve Geschlecht 22: Kaplan-­‐Meier-­‐Kurve CD44 Färbeintensität 23: Kaplan-­‐Meier-­‐Kurve CD44 % gefärbte Zellen 24: Kaplan-­‐Meier-­‐Kurve CD44 Zytoplasmafärbung 25: Kaplan-­‐Meier-­‐Kurve Färbeintensität E-­‐Cadherin 26: Kaplan-­‐Meier-­‐Kurve Anzahl gefärbter Zellen E-­‐Cadherin 27: Kaplan-­‐Meier-­‐Kurve Färbeintensität N-­‐Cadherin 28: Kaplan-­‐Meier-­‐Kurve N-­‐Cadherin % gefärbte Zellen 29: Kaplan-­‐Meier-­‐Kurve Färbeintensität K-­‐Cadherin 30: Kaplan-­‐Meier-­‐Kurve % gefärbter Zellen K-­‐Cadherin 31: Kaplan-­‐Meier-­‐Kurve % gefärbter Zellen Ki-­‐67 101 32: Kaplan-­‐Meier-­‐Kurve % gefärbter Zelle p16 33: Kaplan-­‐Meier-­‐Kurve % gefärbte Zytoplasmen p16 34: Kaplan-­‐Meier-­‐Kurve Färbeintensität p16 35: Kaplan-­‐Meier-­‐Kurve % gefärbter Zellen PTEN 102 8 Anhang: 8.1 Einverständniserklärung der Patienten: Erklärung Ich bin damit einverstanden, dass die Gewebeprobe unter der Verantwortung der Klinik & Poliklinik für Urologie des Universitätsklinikums Schleswig-Holstein für Studien mit den wissenschaftlich in Betracht kommenden Fragestellungen in verschlüsselter Form (Persönliche Daten wie Namen und Anschrift werden durch eine Codenummer ersetzt, die nur über eine Referenzliste zugeordnet werden kann) verwendet wird. Ich bin damit einverstanden, dass ich keine Rückinformationen über die getätigte Forschung erhalte. Widerruf der Zustimmung zur Probenverwendung: Ich weiß, dass ich meine Zustimmung zur Verwendung meiner Gewebeprobe jederzeit und ohne Angaben von Gründen gegenüber der oben genannten Institution widerrufen kann und das dies keinen Einfluss auf meine etwaige weitere ärztliche Behandlung hat. Ich stimme zu, dass Krankheitsdaten aus meinen Krankenunterlagen unter der Verantwortung der oben genannten Institution für diese Studie in pseudonymisierter Form gespeichert und verarbeitet werden. Widerruf der Zustimmung zur Datenverwendung: Ich weiß, dass meine Zustimmung zur Verwendung meiner Daten jederzeit und ohne Angaben von Gründen gegenüber der einleitend genannten Institution widerrufen kann und dass dies keinen Einfluss auf meine etwaige ärztliche Behandlung hat. Im Falle eines Widerrufes bin ich einverstanden, dass meine Daten zu Kontrollzwecken gespeichert bleiben. Ich habe jedoch das Recht, deren Löschung zu verlangen, sofern gesetzliche Bestimmungen der Löschung nicht entgegenstehen. ------------------------------------------Ort, Datum ------------------------------------------Name in Druckschrift ------------------------------------------Unterschrift 103 8.2 Anschreiben Patienten UNIVERSITÄTSKLINIKUM Schleswig-Holstein Campus Lübeck Ratzeburger Allee 160 23538 Lübeck UNIVERSITÄTSKLINIKUM Schleswig-Holstein Campus Lübeck Abteilung Herr Mustermann Tel: 0451 / 500-0 Internet: www.uk-s-h.de Datum: / Sehr geehrte(r) Frau/ Herr … Bei ihnen wurde einen operative Entfernung der Niere bei einem Nierenzellkarzinom vorgenommen. Wir interessieren uns für die Langzeitergebnisse bei diesen Operationen allgemein, die Abhängigkeit der Prognose von bestimmten molekularen Markern und ihrem persönlichen Behandlungserfolg. Zu diesem Zweck verschicken wir an alle Patienten, die aufgrund eines Nierentumors im sogenannten T3-Stadium zwischen 1993 und 2002 operiert worden sind, dieses Anschreiben sowie eine Einwilligungserklärung zu folgenden Untersuchungen: Die Gewebeproben die von ihrer Operation stammen und in der Pathologie archiviert sind, sollen von der Klinik für Urologie und dem Institut für Pathologie des UK S-H nachuntersucht werden. Hier sollen verschiedene „Marker“ durch Immunfärbung (Immunhistochemie) bestimmt werden, um neue Erkenntnisse und möglicherweise verbesserte Diagnosemöglichkeiten für zukünftige Patienten mit Nierentumoren zu gewinnen. Diese Untersuchungen unterliegen hinsichtlich der Archivierung bzw. späteren Vernichtung den üblichen pathologischen Richtlinien (Archivierung in dem Institut für Pathologie über 10 Jahre, nachfolgend Verbrennung durch autorisierte Firmen). Die Untersuchungen sind zweckgebunden an die Bestimmung immunhistochemischer Marker. Eine Erweiterung der Untersuchung findet nicht statt. Hiermit bitte wir sie um ihr Einverständnis zur wissenschaftlichen Verwendung der Gewebeproben und Ihrer personenbezogenen Daten. Das verwendete Material ist zur weiteren Diagnostik ihrer Erkrankung nicht erforderlich. Für sie entstehen somit weder in der Erkennung noch in der Behandlung irgendwelche Nachteile. Wir möchten Sie freundlich bitten, die unterschriebene Erklärung in dem beiliegenden Freiumschlag zurückzusenden und bedanken uns schon im Vorwege für ihre Mithilfe. Mit freundlichen Grüßen ______________________ Priv.-Doz. Dr. med I Kausch Oberarzt der Klinik _________ Daniel Foss Doktorand 104 UNIVERSITÄTSKLINIKUM Schleswig-Holstein UNIVERSITÄTSKLINIKUM Schleswig-Holstein Campus Lübeck Ratzeburger Allee 160 23538 Lübeck Campus Lübeck Klinik und Poliklinik für Urologie Direktor: Univ.-Prof. Dr. med. D. Jocham Tel: 0451 / 500-2271 Fax 500-3338 (Klinikdirektion) 0451 / 500-6113 Fax 500-4666 (Sekr. Oberärzte) 0451 / 500-2102 Fax 500-6066 (Poliklinik) 0451 / 500-2042 Fax 500-6223 (Station 17) 0451 / 500-2484 Fax 500-6066 (Lithotripsie) Internet: www.urologie.uni-luebeck.de Datum: / Sehr geehrte Frau ...., nachdem wir sie in der Vergangenheit angeschrieben haben um eine Einverständiniss erklärung von ihnen zu bekommen, geht es nun um die Aufstellung einer retrospektiven Studie wofür wir gerne noch einige Daten zu ihrem Krankheitsverlauf haben würden. bei Ihnen wurde eine operative Entfernung der Niere bei einem Nierengeschwulst vorgenommen. Wir interessieren uns für die Langzeitergebnisse bei diesen Operationen allgemein, die Abhängigkeit der Prognose von bestimmten molekularen Markern und Ihrem persönlichen Behandlungserfolg. Zu diesem Zweck verschicken wir an alle Patienten, welche aufgrund eines Nierentumors im sogenannten Stadium T3 zwischen 1993 und 2002 operiert worden sind, einen Fragebogen zu diesen Untersuchungen. Wir möchten Sie freundlich bitten, den Fragebogen in dem beiliegenden Briefumschlag portofrei zurückzusenden. Hierfür bedanken wir uns im Vorwege. Mit freundlichen Grüßen. PD Dr. med. I. Kausch (Oberarzt der Klinik) Universitätsklinikum Schleswig-Holstein Anstalt des öffentlichen Rechts Vorstandsmitglieder: Prof. Dr. Jens Scholz (Vorsitzender) Peter Pansegrau Christa Meyer D.Foss (Doktorand) P. Korn (Doktorand) Bankverbindungen: Förde Sparkasse Kto.-Nr. 100 206, BLZ 210 501 70 Commerzbank AG (vormals Dresdner Bank) Kto.-Nr. 300 041 200, BLZ 230 800 40 105 8.3 Anschreiben Einwohnermeldeamt Sehr geehrte(r) Frau /Herr..., Im Rahmen einer Doktorarbeit wollen wir bei Patienten mit Nierenzellkarzinom die alten histologischen Schnitte der Niere verwenden. Wir wollen dabei herausfinden ob es Parameter gibt, welche die Prognose beeinflussen. Dafür müssen bestimmte Färbungsverfahren an den histologischen Schnitten durchgeführt werden. Hierfür brauchen wir die Einwilligung der Patienten. Die Patienten sollen nun angeschrieben werden. Um zu vermeiden, dass schon verstorbene Patienten angeschrieben werden, bitten wir Sie um ihre Mithilfe. Wir würden von Ihnen gerne wissen, welche Patienten noch leben und wenn es möglich ist, eine Überprüfung unserer Adressen bekommen. Anbei liegt unsere Patientenliste. Vielen Dank für ihre Mithilfe im Voraus. Mit freundlichen Grüßen _________________________ Prof. Dr. Jocham Doktorand Daniel Foss __________________ 106 8.4 Anschreiben Krankenkasse UNIVERSITÄTSKLINIKUM Schleswig-Holstein UNIVERSITÄTSKLINIKUM Schleswig-Holstein Campus Lübeck Ratzeburger Allee 160 23538 Lübeck Campus Lübeck Abteilung Herr Mustermann Tel: 0451 / 500-0 Internet: www.uk-s-h.de Datum: 21. 04. 2009 Sehr geehrter Damen und Herren, Im Rahmen einer Doktorarbeit wollen wir bei Patienten, welche an der Universitätsklinik zu Lübeck an einem Nierentumor operiert wurden, heraus finden wie die Langzeitprognose dieser Patienten ist. Um eine Aussage darüber machen zu können, müssen wir wissen, ob die Patienten verstorben sind und wenn ja wann. Daher bitten wir sie um ihre Mithilfe und übersenden ihnen im Anhang die Daten der Patienten. Vielen Dank für ihre Mithilfe im Voraus Mit freundlichen Grüßen _________________________ __________________ PD. Dr. med. I. Kausch Doktorand Daniel Foss 107 8.5 Anschreiben Ärzte UNIVERSITÄTSKLINIKUM Schleswig-Holstein UNIVERSITÄTSKLINIKUM Schleswig-Holstein Campus Lübeck Ratzeburger Allee 160 23538 Lübeck Campus Lübeck Abteilung Ansprechpartner: Priv. Doz. Dr. med. C. Doehn Telefon: 0451 / 500-6113 Telefax: 0451 / 500-4666 e-mail: [email protected] Internet: www.uk-s-h.de Datum: 21.07.2008 • «AnredePat» «NamePat», «VornamePat» geb. am «Gebdatum» Sehr geehrte(r) Frau/Herr im Rahmen einer retrospektiven Studie bezgl. des Nierenzellkarzinoms reevaluieren wir Patienten, die an unserer Klinik operiert worden sind. Wir möchten Sie höflichst bitten, in Bezug auf oben genannte/n Patient/en freundlicherweise die im anliegenden Fragebogen aufgeführten Fragen zu beantworten und diesen an uns zurückzusenden (gern auch per Fax). Für Ihre Mitarbeit möchten wir uns schon im voraus ganz herzlich bedanken und verbleiben Mit freundlichen Grüßen PD Dr. med. C. Doehn PD Dr. med.I. Kausch D. Foss P. Korn Ltd. Oberarzt der Klinik Oberarzt der Klinik Doktorand Doktorand 108 8.6 Anschreiben Vertrauensstelle des Krebsregisters UNIVERSITÄTSKLINIKUM Schleswig-Holstein Campus Lübeck Ratzeburger Allee 160 23538 Lübeck UNIVERSITÄTSKLINIKUM Schleswig-Holstein Campus Lübeck Abteilung Herr Mustermann Tel: 0451 / 500-0 Internet: www.uk-s-h.de Datum: / Sehr geehrte Frau …, im Rahmen einer Doktorarbeit wollen wir Patienten mit Nierenzellkarzinom die alten histologischen Schnitte der Niere verwenden. Wir wollen dabei herausfinden ob es Parameter gibt, welche die Prognose beeinflussen. Dafür müssen bestimmte Färbungsverfahren an den histologischen Schnitten durchgeführt werden. Hierfür brauchen wir die Einwilligung der Patienten. Die Patienten sollen nun angeschrieben werden. Um zu vermeiden, dass schon verstorbene Patienten angeschrieben werden, bitten wir sie um ihre Mithilfe. Wir würden von ihnen gerne wissen, welche Patienten noch leben und wenn es möglich ist, eine Überprüfung unserer Adressen bekommen. Anbei liegt unsere Patientenliste. Vielen Dank für ihre Mithilfe im Voraus. Mit freundlichen Grüßen _____________ __________________ Prof. Dr. Jocham Doktorand Daniel Foss 109 8.7 Genetische Aberrationen Subtyp Genetische Aberration Klarzelliges NZK -­‐3p, +5q22, -­‐6q, -­‐8p, -­‐9p, -­‐14q Papilläres NZK +3q, +7, +8, +12, +16, +17, +20, -­‐Y Chromophobes NZK -­‐1, -­‐2, -­‐6, -­‐10, -­‐17, -­‐21, Hypoploidität Sammelrohrkarzinom -­‐1q, -­‐6p, -­‐8p, -­‐13q, -­‐21q, -­‐3p (selten) Tabelle 24: Genetische Aberrationen, nach [Lopez-­‐Beltran et al., 2009] 8.8 Nicht signifikante Kreuztabellen: p=0,826 Unterteilung des T3 Stadiums a CD44 Intensität dichotomisiert nach b Gesamt Intensität = 0 22 26 48 Intensität > 0 15 20 35 Gesamt 37 46 83 p=0,196 Nodalstatus 0 CD44 Intensität dichotomisiert nach Median (=0) Median (=0) 1 2 x Gesamt Intensität = 0 27 1 5 15 48 Intensität > 0 15 5 3 12 35 Gesamt 6 8 27 83 42 110 p=0,246 N0/Nx vs N>0 N0/Nx CD44 Intensität dichotomisiert nach Median (=0) >N0 Gesamt Intensität = 0 42 6 48 Intensität > 0 27 8 35 Gesamt 14 83 69 p=0,102 Metastasen 0 1 x Gesamt CD44 Intensität Intensität = 0 7 8 33 48 dichotomisiert nach Intensität > 0 12 3 20 35 Gesamt 19 11 53 83 p=0,342 M0/Mx vs M1 M0/Mx CD44 Intensität dichotomisiert nach Median (=0) M1 Gesamt Intensität = 0 40 8 48 Intensität > 0 32 3 35 Gesamt 72 11 83 p=0,716 Histo dichotomisiert klarzellig andere CD44 Intensität Intensität = 0 44 4 48 dichotomisiert nach Intensität > 0 31 4 35 Gesamt 8 83 Median (=0) Median (=0) 75 Gesamt 111 p=0,824 Größe dichotomisiert nach Median <8cm CD44 Intensität dichotomisiert nach >8cm Gesamt Intensität = 0 30 18 48 Intensität > 0 21 14 35 Gesamt 51 32 83 p=0,473 Geschlecht m w Gesamt CD44 Intensität Intensität = 0 31 17 48 dichotomisiert nach Intensität > 0 26 9 35 Gesamt 26 83 Median (=0) Median (=0) 57 p=1,0 Unterteilung des T3 Stadiums a b Gesamt CD44 % Zellen 0 % 22 27 49 dichotomisiert nach > 0 % 15 19 34 Gesamt 37 46 83 Median (=0%) p=0,548 Nodalstatus 0 1 2 x Gesamt CD44 % Zellen 0 % 27 2 5 15 49 dichotomisiert nach > 0 % 15 4 3 12 34 Gesamt 42 6 8 27 83 Median (=0%) 112 p=0,555 N0/Nx vs N>0 N0/Nx >N0 Gesamt CD44 % Zellen 0 % 42 7 49 dichotomisiert nach > 0 % 27 7 34 14 83 Median (=0%) Gesamt 69 p=0,258 M0/Mx vs M1 M0/Mx M1 Gesamt CD44 % Zellen 0 % 41 8 49 dichotomisiert nach > 0 % 31 3 34 11 83 Median (=0%) Gesamt 72 p=0,711 Histo dichotomisiert klarzellig andere Gesamt CD44 % Zellen 0 % 45 4 49 dichotomisiert nach > 0 % 30 4 34 Gesamt 75 8 83 Median (=0%) p=1,0 Größe dichotomisiert nach Median >8cm >8cm Gesamt CD44 % Zellen 0 % 30 19 49 dichotomisiert nach > 0 % 21 13 34 Gesamt 51 32 83 Median (=0%) 113 p=0,478 Geschlecht m w Gesamt CD44 % Zellen 0 % 32 17 49 dichotomisiert nach > 0 % 25 9 34 26 83 Median (=0%) Gesamt 57 p=0,201 Unterteilung des T3 Stadiums a b Gesamt 26 38 64 8 19 46 83 CD44 Zytoplasmafärbung Färbung 0 dichotomisiert Median (=0) nach Färbung 1 bis 2 11 Gesamt 37 p=0,373 Nodalstatus 0 1 2 x Gesamt 34 3 6 21 64 3 2 6 19 6 8 27 83 CD44 Zytoplasmafärbung Färbung 0 dichotomisiert Median (=0) nach Färbung 1 bis 2 8 Gesamt 42 p=0,293 N0/Nx vs N>0 N0/Nx >N0 Gesamt 55 9 64 Färbung 1 bis 2 14 5 19 Gesamt 14 83 CD44 Zytoplasmafärbung Färbung 0 dichotomisiert nach Median (=0) 69 114 p=0,472 Metastasen 0 1 x Gesamt 13 8 43 64 Färbung 1 bis 2 6 3 10 19 Gesamt 19 11 53 83 p=0,708 M0/Mx vs M1 M0/Mx M1 Gesamt 56 8 64 Färbung 1 bis 2 16 3 19 Gesamt 72 11 83 p=0,426 Größe dichotomisiert nach Median 1 2 Gesamt 41 23 64 Färbung 1 bis 2 10 9 19 Gesamt 51 32 83 p=0,929 Größe nach TNM Einteilung <4 cm 4-­‐7 cm >7 cm Gesamt 7 24 33 64 Färbung 1 bis 2 2 6 11 19 Gesamt 30 44 83 CD44 Zytoplasmafärbung Färbung 0 dichotomisiert nach Median (=0) CD44 Zytoplasmafärbung Färbung 0 dichotomisiert nach Median (=0) CD44 Zytoplasmafärbung Färbung 0 dichotomisiert nach Median (=0) CD44 Zytoplasmafärbung Färbung 0 dichotomisiert nach Median (=0) 9 115 p=0,581 Geschlecht m w Gesamt 45 19 64 Färbung 1 bis 2 12 7 19 Gesamt 57 26 83 p=0,835 Unterteilung des T3 Stadiums a b Gesamt E-­‐Cadherin Intensität Intensität 0 25 28 53 dichotomisiert nach Intensität 1 bis 2 17 21 38 Gesamt 42 49 91 p=0,470 Nodalstatus 0 1 2 x Gesamt E-­‐Cadherin Intensität Intensität 0 23 4 6 20 53 dichotomisiert nach Intensität 1 bis 2 23 2 3 10 38 Gesamt 46 6 9 30 91 p=0,573 N0/Nx vs N>0 N0/Nx >N0 Gesamt E-­‐Cadherin Intensität Intensität 0 43 10 53 dichotomisiert nach Intensität 1 bis 2 33 5 38 Gesamt 15 91 CD44 Zytoplasmafärbung Färbung 0 dichotomisiert nach Median (=0) Median (=0) Median (=0) Median (=0) 76 116 p=0,137 Metastasen 0 1 x Gesamt E-­‐Cadherin Intensität Intensität 0 11 4 38 53 dichotomisiert nach Intensität 1 bis 2 11 7 20 38 Gesamt 22 11 58 91 p=0,108 M0/Mx vs M1 M0/Mx M1 Gesamt E-­‐Cadherin Intensität Intensität 0 49 4 53 dichotomisiert nach Intensität 1 bis 2 31 7 38 Gesamt 11 91 Median (=0) Median (=0) 80 p=0,730 Histo dichotomisiert klarzellig andere Gesamt E-­‐Cadherin Intensität Intensität 0 47 6 53 dichotomisiert nach Intensität 1 bis 2 35 3 38 Gesamt 82 9 91 p=0,190 Größe dichotomisiert nach Median <8cm >8cm Gesamt E-­‐Cadherin Intensität Intensität 0 36 17 53 dichotomisiert nach Intensität 1 bis 2 20 18 38 Gesamt 35 91 Median (=0) Median (=0) 56 117 p=0,787 Größe nach TNM Einteilung <4 cm 4-­‐7 cm >7 cm Gesamt E-­‐Cadherin Intensität Intensität 0 7 19 27 53 dichotomisiert nach Intensität 1 bis 2 3 14 21 38 Gesamt 10 33 48 91 p=0,646 Geschlecht m w Gesamt E-­‐Cadherin Intensität Intensität 0 38 15 53 dichotomisiert nach Intensität 1 bis 2 25 13 38 Gesamt 28 91 Median (=0) Median (=0) 63 p=0,835 Unterteilung des T3 Stadiums a b Gesamt E-­‐Cadherin % Zellen 0% 25 28 53 dichotomisiert nach 10-­‐100% 17 21 38 Gesamt 42 49 91 p=0,470 Nodalstatus 0 1 2 x Gesamt E-­‐Cadherin % Zellen 0% 23 4 6 20 53 dichotomisiert nach 10-­‐100% 23 2 3 10 38 Gesamt 6 9 30 91 Median (=0%) Median (=0%) 46 118 p=0,573 N0/Nx vs N>0 N0/Nx >N0 Gesamt E-­‐Cadherin % Zellen 0% 43 10 53 dichotomisiert nach 10-­‐100% 33 5 38 Gesamt 76 15 91 p=0,137 Metastasen 0 1 x Gesamt E-­‐Cadherin % Zellen 0% 11 4 38 53 dichotomisiert nach 10-­‐100% 11 7 20 38 Gesamt 22 11 58 91 p=0,191 M0/Mx vs M1 M0/Mx M1 Gesamt E-­‐Cadherin % Zellen 0% 49 4 53 dichotomisiert nach 10-­‐100% 31 7 38 Gesamt 80 11 91 p=0,730 Histo dichotomisiert klarzellig andere Gesamt E-­‐Cadherin % Zellen 0% 47 6 53 dichotomisiert nach 10-­‐100% 35 3 38 Gesamt 9 91 Median (=0%) Median (=0%) Median (=0%) Median (=0%) 82 119 p=0,190 Größe dichotomisiert nach Median <8cm >8cm Gesamt E-­‐Cadherin % Zellen 0% 36 17 53 dichotomisiert nach 10-­‐100% 20 18 38 Gesamt 56 35 91 p=0,787 Größe nach TNM Einteilung <4 cm 4-­‐7 cm >7 cm Gesamt E-­‐Cadherin % Zellen 0% 7 19 27 53 dichotomisiert nach 10-­‐100% 3 14 21 38 Gesamt 10 33 48 91 p=0,646 Geschlecht m w Gesamt E-­‐Cadherin % Zellen 0% 38 15 53 dichotomisiert nach 10-­‐100% 25 13 38 Gesamt 28 91 Median (=0%) Median (=0%) Median (=0%) 63 P=0,177 Unterteilung des T3 Stadiums a b Gesamt N-­‐Cadherin Intensität Intensität = 0 25 23 48 dichotomisiert nach Intensität = 1 bis 2 12 22 34 Gesamt 45 82 Median (=0) 37 120 p=0,558 Nodalstatus 0 1 2 x Gesamt N-­‐Cadherin Intensität Intensität = 0 23 2 6 17 48 dichotomisiert nach Intensität = 1 bis 2 19 3 2 10 34 Gesamt 42 5 8 27 82 p=1,0 N0/Nx vs N>0 N0/Nx >N0 Gesamt N-­‐Cadherin Intensität Intensität = 0 40 8 48 dichotomisiert nach Intensität = 1 bis 2 29 5 34 Gesamt 69 13 82 p=0,802 Metastasen 0 1 x Gesamt N-­‐Cadherin Intensität Intensität = 0 10 7 31 48 dichotomisiert nach Intensität = 1 bis 2 9 4 21 34 Gesamt 19 11 52 82 p=1,0 M0/Mx vs M1 M0/Mx M1 Gesamt N-­‐Cadherin Intensität Intensität = 0 41 7 48 dichotomisiert nach Intensität = 1 bis 2 30 4 34 Gesamt 11 82 Median (=0) Median (=0) Median (=0) Median (=0) 71 121 p=0,414 Grading 1 2 3 Gesamt N-­‐Cadherin Intensität Intensität = 0 4 30 14 48 dichotomisiert nach Intensität = 1 bis 2 5 23 6 34 Gesamt 9 53 20 82 p=0,361 Größe dichotomisiert nach Median <8cm >8cm Gesamt N-­‐Cadherin Intensität Intensität = 0 32 16 48 dichotomisiert nach Intensität = 1 bis 2 19 15 34 Gesamt 51 31 82 p=0,321 Größe nach TNM Einteilung <4 cm 4-­‐7 cm >7 cm Gesamt N-­‐Cadherin Intensität Intensität = 0 7 19 22 48 dichotomisiert nach Intensität = 1 bis 2 2 11 21 34 Gesamt 30 43 82 Median (=0) Median (=0) Median (=0) 9 p=0,258 Unterteilung des T3 Stadiums a b Gesamt N-­‐Cadherin % Zellen 0 % 25 24 49 dichotomisiert nach > 0 % 12 21 33 Gesamt 37 45 82 Median (=0%) 122 p=0,633 Nodalstatus 0 1 2 x Gesamt N-­‐Cadherin % Zellen 0 % 24 2 6 17 49 dichotomisiert nach > 0 % 18 3 2 10 33 Gesamt 42 5 8 27 82 Median (=0%) p=1,0 N0/Nx vs N>0 N0/Nx >N0 Gesamt N-­‐Cadherin % Zellen 0 % 41 8 49 dichotomisiert nach > 0 % 28 5 33 13 82 Median (=0%) Gesamt 69 p=1,0 Metastasen 0 1 x Gesamt N-­‐Cadherin % Zellen 0 % 11 7 31 49 dichotomisiert nach > 0 % 8 4 21 33 11 52 82 Median (=0%) Gesamt 19 p=1,0 M0/Mx vs M1 M0/Mx M1 Gesamt N-­‐Cadherin % Zellen 0 % 42 7 49 dichotomisiert nach > 0 % 29 4 33 11 82 Median (=0%) Gesamt 71 123 p=0,408 Grading 1 2 3 Gesamt N-­‐Cadherin % Zellen 0 % 4 31 14 49 dichotomisiert nach > 0 % 5 22 6 33 Gesamt 9 53 20 82 Median (=0%) p=0,496 Größe dichotomisiert nach Median <8cm >8cm Gesamt N-­‐Cadherin % Zellen 0 % 32 17 49 dichotomisiert nach > 0 % 19 14 33 Gesamt 51 31 82 Median (=0%) p=0,375 Größe nach TNM Einteilung <4 cm 4-­‐7 cm >7 cm Gesamt N-­‐Cadherin % Zellen 0 % 7 19 23 49 dichotomisiert nach > 0 % 2 11 20 33 Gesamt 9 30 43 82 Median (=0%) p=0,146 Geschlecht m w Gesamt N-­‐Cadherin % Zellen 0 % 30 19 49 dichotomisiert nach > 0 % 26 7 33 26 82 Median (=0%) Gesamt 56 124 p=1,0 Unterteilung des T3 Stadiums a K-­‐Cadherin Intensität dichotomisiert nach b Gesamt Intensität 0 bis 1 30 39 69 Intensität = 2 7 9 16 Gesamt 37 48 85 p=0,258 Nodalstatus 0 K-­‐Cadherin Intensität dichotomisiert nach Median (=1) 1 2 x Gesamt Intensität 0 bis 1 37 3 7 22 69 Intensität = 2 7 3 1 5 16 Gesamt 44 6 8 27 85 p=0,453 N0/Nx vs N>0 N0/Nx K-­‐Cadherin Intensität dichotomisiert nach Median (=1) >N0 Gesamt Intensität 0 bis 1 59 10 69 Intensität = 2 12 4 16 Gesamt 71 14 85 p=0,434 Metastasen 0 K-­‐Cadherin Intensität dichotomisiert nach Median (=1) Median (=1) 1 x Gesamt Intensität 0 bis 1 16 10 43 69 Intensität = 2 6 1 9 16 Gesamt 22 11 52 85 125 p=0,681 M0/Mx vs M1 M0/Mx K-­‐Cadherin Intensität dichotomisiert nach M1 Gesamt Intensität 0 bis 1 59 10 69 Intensität = 2 15 1 16 Gesamt 74 11 85 p=0,919 Grading 1 2 3 Gesamt K-­‐Cadherin Intensität Intensität 0 bis 1 8 44 17 69 dichotomisiert nach Intensität = 2 2 11 3 16 Gesamt 10 55 20 85 p=0,338 Histo dichotomisiert klarzellig andere K-­‐Cadherin Intensität Intensität 0 bis 1 62 7 69 dichotomisiert nach Intensität = 2 16 0 16 Gesamt 78 7 85 0,269 Größe dichotomisiert nach Median <8cm K-­‐Cadherin Intensität dichotomisiert nach Median (=1) Median (=1) Median (=1) Gesamt Median (=1) >8cm Gesamt Intensität 0 bis 1 45 24 69 Intensität = 2 8 8 16 Gesamt 53 32 85 126 p=0,345 Größe nach TNM Einteilung <4 cm K-­‐Cadherin Intensität dichotomisiert nach 4-­‐7 cm >7 cm Gesamt Intensität 0 bis 1 9 26 34 69 Intensität = 2 0 6 10 16 Gesamt 9 32 44 85 p=0,251 Geschlecht m w Gesamt K-­‐Cadherin Intensität Intensität 0 bis 1 45 24 69 dichotomisiert nach Intensität = 2 13 3 16 Gesamt 58 27 85 Median (=1) Median (=1) p=0,512 Unterteilung des T3 Stadiums a b Gesamt K-­‐Cadherin % Zellen 0-­‐60% 23 26 49 dichotomisiert nach 70-­‐100% 14 22 36 Gesamt 37 48 85 p=0,341 Nodalstatus 0 1 2 x Gesamt K-­‐Cadherin % Zellen 0-­‐60% 22 5 6 16 49 dichotomisiert nach 70-­‐100% 22 1 2 11 36 Gesamt 6 8 27 85 Median (=60%) Median (=60%) 44 127 p=0,137 N0/Nx vs N>0 N0/Nx >N0 Gesamt K-­‐Cadherin % Zellen 0-­‐60% 38 11 49 dichotomisiert nach 70-­‐100% 33 3 36 Gesamt 71 14 85 p=0,133 Metastasen 0 1 x Gesamt K-­‐Cadherin % Zellen 0-­‐60% 10 9 30 49 dichotomisiert nach 70-­‐100% 12 2 22 36 Gesamt 22 11 52 85 p=0,108 M0/Mx vs M1 M0/Mx M1 Gesamt K-­‐Cadherin % Zellen 0-­‐60% 40 9 49 dichotomisiert nach 70-­‐100% 34 2 36 Gesamt 74 11 85 p=0,230 Histo dichotomisiert klarzellig andere Gesamt K-­‐Cadherin % Zellen 0-­‐60% 43 6 49 dichotomisiert nach 70-­‐100% 35 1 36 Gesamt 7 85 Median (=60%) Median (=60%) Median (=60%) Median (=60%) 78 128 p=0,506 Größe dichotomisiert nach Median <8cm >8cm Gesamt K-­‐Cadherin % Zellen 0-­‐60% 29 20 49 dichotomisiert nach 70-­‐100% 24 12 36 Gesamt 53 32 85 p=0,565 Größe nach TNM Einteilung <4 cm 4-­‐7 cm >7 cm Gesamt K-­‐Cadherin % Zellen 0-­‐60% 6 16 27 49 dichotomisiert nach 70-­‐100% 3 16 17 36 Gesamt 9 32 44 85 p=1,0 Geschlecht m w Gesamt K-­‐Cadherin % Zellen 0-­‐60% 33 16 49 dichotomisiert nach 70-­‐100% 25 11 36 Gesamt 58 27 85 p=0,619 Unterteilung des T3 Stadiums a b Gesamt Ki67 % Zellen 0-­‐10% 22 27 49 dichotomisiert nach 20-­‐100% 12 11 23 Gesamt 38 72 Median (=60%) Median (=60%) Median (=60%) Median (=10%) 34 129 p=0,606 Nodalstatus 0 1 2 x Gesamt Ki67 % Zellen 0-­‐10% 27 2 4 16 49 dichotomisiert nach 20-­‐100% 13 2 3 5 23 Gesamt 40 4 7 21 72 p=0,312 N0/Nx vs N>0 N0/Nx >N0 Gesamt Ki67 % Zellen 0-­‐10% 43 6 49 dichotomisiert nach 20-­‐100% 18 5 23 Gesamt 61 11 72 p=0,434 Metastasen 0 1 x Gesamt Ki67 % Zellen 0-­‐10% 14 4 31 49 dichotomisiert nach 20-­‐100% 7 4 12 23 Gesamt 21 8 43 72 p=0,257 M0/Mx vs M1 M0/Mx M1 Gesamt Ki67 % Zellen 0-­‐10% 45 4 49 dichotomisiert nach 20-­‐100% 19 4 23 Gesamt 8 72 Median (=10%) Median (=10%) Median (=10%) Median (=10%) 64 130 p=0,673 Histo dichotomisiert klarzellig andere Gesamt Ki67 % Zellen 0-­‐10% 45 4 49 dichotomisiert nach 20-­‐100% 20 3 23 Gesamt 65 7 72 p=1,0 Größe dichotomisiert nach Median <8cm >8cm Gesamt Ki67 % Zellen 0-­‐10% 29 20 49 dichotomisiert nach 20-­‐100% 14 9 23 Gesamt 43 29 72 p=0,932 Größe nach TNM Einteilung <4 cm 4-­‐7 cm >7 cm Gesamt Ki67 % Zellen 0-­‐10% 5 17 27 49 dichotomisiert nach 20-­‐100% 2 9 12 23 Gesamt 7 26 39 72 p=0,789 Geschlecht m w Gesamt Ki67 % Zellen 0-­‐10% 34 15 49 dichotomisiert nach 20-­‐100% 15 8 23 Gesamt 23 72 Median (=10%) Median (=10%) Median (=10%) Median (=10%) 49 131 p=0,299 Unterteilung des T3 Stadiums a p16 Intensität dichotomisiert nach b Gesamt Intensität 0 bis 1 29 40 69 Intensität = 2 11 8 19 Gesamt 40 48 88 p=0,855 Nodalstatus 0 p16 Intensität dichotomisiert nach Median (=1) 1 2 x Gesamt Intensität 0 bis 1 37 4 7 21 69 Intensität = 2 9 2 2 6 19 Gesamt 46 6 9 27 88 p=0,713 N0/Nx vs N>0 N0/Nx p16 Intensität dichotomisiert nach Median (=1) >N0 Gesamt Intensität 0 bis 1 58 11 69 Intensität = 2 15 4 19 Gesamt 73 15 88 p=0,480 Metastasen 0 p16 Intensität dichotomisiert nach Median (=1) Median (=1) 1 x Gesamt Intensität 0 bis 1 18 10 41 69 Intensität = 2 4 1 14 19 Gesamt 22 11 55 88 132 p=0,444 M0/Mx vs M1 M0/Mx p16 Intensität dichotomisiert nach M1 Gesamt Intensität 0 bis 1 59 10 69 Intensität = 2 18 1 19 Gesamt 77 11 88 p=0,374 Grading 1 2 3 Gesamt p16 Intensität Intensität 0 bis 1 8 42 19 69 dichotomisiert nach Intensität = 2 2 15 2 19 Gesamt 10 57 21 88 p=0,362 Histo dichotomisiert klarzellig andere p16 Intensität Intensität 0 bis 1 64 5 69 dichotomisiert nach Intensität = 2 16 3 19 Gesamt 80 8 88 p=1,0 Größe nach TNM Einteilung <4 cm p16 Intensität dichotomisiert nach Median (=1) Median (=1) Median (=1) Gesamt Median (=1) 4-­‐7 cm >7 cm Gesamt Intensität 0 bis 1 7 24 38 69 Intensität = 2 2 7 10 19 Gesamt 9 31 48 88 133 p=0,411 Geschlecht m w Gesamt p16 Intensität Intensität 0 bis 1 47 22 69 dichotomisiert nach Intensität = 2 15 4 19 Gesamt 62 26 88 Median (=1) p=0,830 Unterteilung des T3 Stadiums a b Gesamt p16 % Zellen 0% 23 29 52 dichotomisiert nach 10-­‐100% 17 19 36 Gesamt 40 48 88 p=0,105 Nodalstatus 0 1 2 x Gesamt p16 % Zellen 0% 32 4 5 11 52 dichotomisiert nach 10-­‐100% 14 2 4 16 36 Gesamt 46 6 9 27 88 p=1,0 N0/Nx vs N>0 N0/Nx >N0 Gesamt p16 % Zellen 0% 43 9 52 dichotomisiert nach 10-­‐100% 30 6 36 Gesamt 15 88 Median (=0%) Median (=0%) Median (=0%) 73 134 p=0,813 Metastasen 0 1 x Gesamt p16 % Zellen 0% 14 7 31 52 dichotomisiert nach 10-­‐100% 8 4 24 36 Gesamt 22 11 55 88 p=1,0 M0/Mx vs M1 M0/Mx M1 Gesamt p16 % Zellen 0% 45 7 52 dichotomisiert nach 10-­‐100% 32 4 36 Gesamt 77 11 88 p=0,264 Histo dichotomisiert klarzellig andere Gesamt p16 % Zellen 0% 49 3 52 dichotomisiert nach 10-­‐100% 31 5 36 Gesamt 80 8 88 p=0,659 Größe dichotomisiert nach Median <8cm >8cm Gesamt p16 % Zellen 0% 30 22 52 dichotomisiert nach 10-­‐100% 23 13 36 Gesamt 35 88 Median (=0%) Median (=0%) Median (=0%) Median (=0%) 53 135 p=0,856 Größe nach TNM Einteilung <4 cm 4-­‐7 cm >7 cm Gesamt p16 % Zellen 0% 6 19 27 52 dichotomisiert nach 10-­‐100% 3 12 21 36 Gesamt 9 31 48 88 p=0,520 Unterteilung des T3 Stadiums a b Gesamt p16 % Zytopl. 0% 20 28 48 dichotomisiert nach 10-­‐100% 20 20 40 Gesamt 40 48 88 p=0,714 Nodalstatus 0 1 2 x Gesamt p16 % Zytopl. 0% 24 3 4 17 48 dichotomisiert nach 10-­‐100% 22 3 5 10 40 Gesamt 46 6 9 27 88 p=0,575 N0/Nx vs N>0 N0/Nx >N0 Gesamt p16 % Zytopl. 0% 41 7 48 dichotomisiert nach 10-­‐100% 32 8 40 Gesamt 15 88 Median (=0%) Median (=0%) Median (=0%) Median (=0%) 73 136 p=0,819 Metastasen 0 1 x Gesamt p16 % Zytopl. 0% 12 5 31 48 dichotomisiert nach 10-­‐100% 10 6 24 40 Gesamt 22 11 55 88 p=0,537 M0/Mx vs M1 M0/Mx M1 Gesamt p16 % Zytopl. 0% 43 5 48 dichotomisiert nach 10-­‐100% 34 6 40 Gesamt 77 11 88 p=0,723 Histo dichotomisiert klarzellig andere Gesamt p16 % Zytopl. 0% 43 5 48 dichotomisiert nach 10-­‐100% 37 3 40 Gesamt 80 8 88 Größe dichotomisiert nach Median Median (=0%) Median (=0%) Median (=0%) p=0,512 (8cm) <8cm >8cm Gesamt p16 % Zytopl. 0% 27 21 48 dichotomisiert nach 10-­‐100% 26 14 40 Gesamt 35 88 Median (=0%) 53 137 p=0,819 Größe nach TNM Einteilung <4 cm 4-­‐7 cm >7 cm Gesamt p16 % Zytopl. 0% 4 18 26 48 dichotomisiert nach 10-­‐100% 5 13 22 40 Gesamt 9 31 48 88 p=0,242 Geschlecht m w Gesamt p16 % Zytopl. 0% 31 17 48 dichotomisiert nach 10-­‐100% 31 9 40 Gesamt 62 26 88 p=0,916 Nodalstatus 0 1 2 x Gesamt pTen % Zellen 0-­‐10% 27 4 5 20 56 dichotomisiert nach 10-­‐100% 18 2 3 9 32 Gesamt 45 6 8 29 88 p=1,0 N0/Nx vs N>0 N0/Nx >N0 Gesamt pTen % Zellen 0-­‐10% 47 9 56 dichotomisiert nach 10-­‐100% 27 5 32 Gesamt 14 88 Median (=0%) Median (=0%) Median (=10%) Median (=10%) 74 138 p=0,247 Metastasen 0 1 x Gesamt pTen % Zellen 0-­‐10% 12 5 39 56 dichotomisiert nach 10-­‐100% 9 6 17 32 Gesamt 21 11 56 88 p=0,198 M0/Mx vs M1 M0/Mx M1 Gesamt pTen % Zellen 0-­‐10% 51 5 56 dichotomisiert nach 10-­‐100% 26 6 32 Gesamt 77 11 88 p=0,392 Grading 1 2 3 Gesamt pTen % Zellen 0-­‐10% 8 34 14 56 dichotomisiert nach 10-­‐100% 2 24 6 32 Gesamt 10 58 20 88 p=0,147 Histo dichotomisiert klarzellig andere Gesamt pTen % Zellen 0-­‐10% 48 8 56 dichotomisiert nach 10-­‐100% 31 1 32 Gesamt 9 88 Median (=10%) Median (=10%) Median (=10%) Median (=10%) 79 139 p=1,0 Größe dichotomisiert nach Median <8cm >8cm Gesamt pTen % Zellen 0-­‐10% 34 22 56 dichotomisiert nach 10-­‐100% 20 12 32 Gesamt 54 34 88 p=0,401 Größe nach TNM Einteilung <4 cm 4-­‐7 cm >7 cm Gesamt pTen % Zellen 0-­‐10% 4 22 30 56 dichotomisiert nach 10-­‐100% 5 10 17 32 Gesamt 9 32 47 88 p=0,341 Geschlecht m w Gesamt pTen % Zellen 0-­‐10% 41 15 56 dichotomisiert nach 10-­‐100% 20 12 32 Gesamt 27 88 Median (=10%) Median (=10%) Median (=10%) 61 140 9 Danksagungen (gekürzt) 141 10 11 Lebenslauf (gekürzt) Persönliche Daten: Geburtsdatum: 22.05.1984 Name: Philippe Niels Korn Geburtsort: Nancy (Frankreich) Ausbildung: 06/2011: Approbation als Arzt 05/2011: Zweiter Abschnitt der Ärztlichen Prüfung 2008-­‐2012: Dissertation zum Thema immunhistochemische Parameter und deren prognostische Bedeutung beim Nierenzellkarzinom im Stadium T3 Erster Abschnitt der Ärztlichen Prüfung 09/2006: 2004-­‐2011: Studium der Humanmedizin an der Universität zu Lübeck 142