3 Pathologie benigner und maligner
Werbung
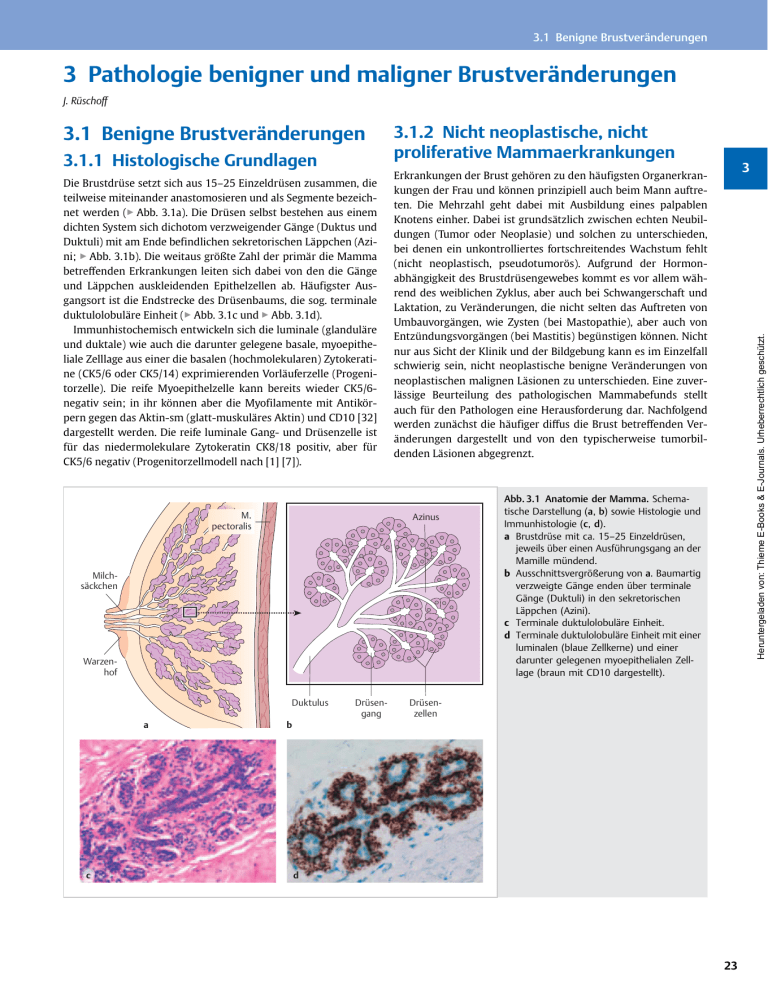
3.1 Benigne Brustveränderungen 3 Pathologie benigner und maligner Brustveränderungen J. Rüschoff 3.1.1 Histologische Grundlagen Die Brustdrüse setzt sich aus 15–25 Einzeldrüsen zusammen, die teilweise miteinander anastomosieren und als Segmente bezeichnet werden (▶ Abb. 3.1a). Die Drüsen selbst bestehen aus einem dichten System sich dichotom verzweigender Gänge (Duktus und Duktuli) mit am Ende befindlichen sekretorischen Läppchen (Azini; ▶ Abb. 3.1b). Die weitaus größte Zahl der primär die Mamma betreffenden Erkrankungen leiten sich dabei von den die Gänge und Läppchen auskleidenden Epithelzellen ab. Häufigster Ausgangsort ist die Endstrecke des Drüsenbaums, die sog. terminale duktulolobuläre Einheit (▶ Abb. 3.1c und ▶ Abb. 3.1d). Immunhistochemisch entwickeln sich die luminale (glanduläre und duktale) wie auch die darunter gelegene basale, myoepitheliale Zelllage aus einer die basalen (hochmolekularen) Zytokeratine (CK5/6 oder CK5/14) exprimierenden Vorläuferzelle (Progenitorzelle). Die reife Myoepithelzelle kann bereits wieder CK5/6negativ sein; in ihr können aber die Myofilamente mit Antikörpern gegen das Aktin-sm (glatt-muskuläres Aktin) und CD10 [32] dargestellt werden. Die reife luminale Gang- und Drüsenzelle ist für das niedermolekulare Zytokeratin CK8/18 positiv, aber für CK5/6 negativ (Progenitorzellmodell nach [1] [7]). M. pectoralis 3.1.2 Nicht neoplastische, nicht proliferative Mammaerkrankungen Azinus Milchsäckchen Warzenhof Duktulus a c Drüsengang 3 Erkrankungen der Brust gehören zu den häufigsten Organerkrankungen der Frau und können prinzipiell auch beim Mann auftreten. Die Mehrzahl geht dabei mit Ausbildung eines palpablen Knotens einher. Dabei ist grundsätzlich zwischen echten Neubildungen (Tumor oder Neoplasie) und solchen zu unterschieden, bei denen ein unkontrolliertes fortschreitendes Wachstum fehlt (nicht neoplastisch, pseudotumorös). Aufgrund der Hormonabhängigkeit des Brustdrüsengewebes kommt es vor allem während des weiblichen Zyklus, aber auch bei Schwangerschaft und Laktation, zu Veränderungen, die nicht selten das Auftreten von Umbauvorgängen, wie Zysten (bei Mastopathie), aber auch von Entzündungsvorgängen (bei Mastitis) begünstigen können. Nicht nur aus Sicht der Klinik und der Bildgebung kann es im Einzelfall schwierig sein, nicht neoplastische benigne Veränderungen von neoplastischen malignen Läsionen zu unterschieden. Eine zuverlässige Beurteilung des pathologischen Mammabefunds stellt auch für den Pathologen eine Herausforderung dar. Nachfolgend werden zunächst die häufiger diffus die Brust betreffenden Veränderungen dargestellt und von den typischerweise tumorbildenden Läsionen abgegrenzt. Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. 3.1 Benigne Brustveränderungen Abb. 3.1 Anatomie der Mamma. Schematische Darstellung (a, b) sowie Histologie und Immunhistologie (c, d). a Brustdrüse mit ca. 15–25 Einzeldrüsen, jeweils über einen Ausführungsgang an der Mamille mündend. b Ausschnittsvergrößerung von a. Baumartig verzweigte Gänge enden über terminale Gänge (Duktuli) in den sekretorischen Läppchen (Azini). c Terminale duktulolobuläre Einheit. d Terminale duktulolobuläre Einheit mit einer luminalen (blaue Zellkerne) und einer darunter gelegenen myoepithelialen Zelllage (braun mit CD10 dargestellt). Drüsenzellen b d 23 3 Defekt- und Überschussbildungen Fibrozystische Mastopathie Anlagestörungen der Brustdrüse sind relativ selten und werden in Defekt- und Überschussbildungen eingeteilt: ● Defektbildungen: Diese reichen vom vollständigen Fehlen des Drüsenkörpers und der Mamille (Amastie) über isolierte Bildungsstörungen der Brustwarze (Athelie, Mikrothelie) oder des Drüsenkörpers (Amazie, Aplasie) bis zu beidseitig oder einseitig unterentwickelten Brüsten (Mikromastie, Anisomastie). ● Überschussbildungen: Überschussbildungen der Brustwarzen (Polythelie) und/oder des Drüsenkörpers (Polymastie) entstehen im Bereich der Milchleiste; sie werden bei etwa 3 % der Bevölkerung ohne Geschlechtspräferenz angetroffen. Häufigste Lokalisation ist die Axilla (45 % der Fälle), die unmittelbare Umgebung der Mamma (25 %) sowie die Thoraxwand im Bereich der Medioklavikularlinie (12 %). Karzinome in einer Mamma aberrata (dystope Karzinome) sind selten und prognostisch ungünstig [40]. Morphologische Veränderungen, bei denen die Fibrose des mammären Gewebes mit Gangektasie, aber ohne Epithelvermehrung im Vordergrund steht, kennzeichnen die einfache fibrozystische Brusterkrankung. Sie ist bei ca. 50 % der Frauen nach dem 30. Lebensjahr nachweisbar und wird von einigen Autoren auch als Variation der Norm ohne Krankheitswert interpretiert. Ein erhöhtes Krebsrisiko besteht nicht [1]. Histologisch zählen folgende Veränderungen zu den typischen feingeweblichen Befunden: ● Zysten und duktale Ektasien: Die Ausführungsgänge sind deutlich ausgeweitet, weisen aber in der Regel eine erhaltene Epithelauskleidung auf (▶ Abb. 3.2), wobei sich auch solitäre Zysten (größer als 1 cm) ausbilden können. ● Fibrose: Dies ist eine intra- oder perilobuläre Kollagenfaservermehrung im Mammastroma. ● Metaplasie: Meist handelt es sich um eine apokrine, d. h. schweißdrüsenähnliche Metaplasie mit zylindrischen eosinroten Epithelien. Makromastie Unter dem Begriff „Makromastie“ (benigne diffuse Mammahypertrophie) werden sowohl das vorzeitige (infantile) als auch das über die Altersnorm hinausgehende exzessive Wachstum der Brustdrüse subsumiert. Am häufigsten treten Makromastien in der Adoleszenz auf. Histologisch stehen die Proliferation des Gangepithels und die Fibrose des Drüsenkörpers im Vordergrund; am häufigsten findet sich eine Fettgewebevermehrung (lipomatöse Makromastie). Differenzialdiagnostisch müssen sekundäre Formen abgegrenzt werden, z. B.: ● paraneoplastisch: bei endokrin aktiven Tumoren (Hypophysenadenom, kleinzelliges Bronchialkarzinom, Morbus Cushing, Akromegalie, Dysgerminom) ● medikamentös (Digitalis) ● tumorbedingt: durch Infiltration des Drüsenkörpers (maligne Lymphome) a Mastitis Entzündungen treten in der Mamma entweder akut (meist bakteriell) oder primär chronisch (meist infolge von Sekretretention) auf. Spezifische und granulomatöse Entzündungsreaktionen sind selten [2]. Akute Mastitis Akute Entzündungen (Thelitis, Areolitis) treten vor allem durch Kontaktinfektion während des Stillens auf und können zu einer kanalikulär in das Drüsengewebe fortgeleiteten Entzündung (Mastitis puerperalis) führen. Häufigster Erreger (95 % der Fälle) ist Staphylococcus aureus haemolyticus aus dem Nasen-RachenRaum des Kindes, der Mutter oder des Pflegepersonals. Außerhalb des Wochenbetts sind eitrige Brustdrüsenentzündungen (eitrige nonpuerperale Mastitis) selten. Diese entstehen durch b Abb. 3.2 Fibrozystische Mastopathie. (aus Bock K, Ramaswamy A, Köhler H. Fortbildungskurs zur Aufrechterhaltung und Weiterentwicklung der fachlichen Befähigung für Pathologen [6.10.2012] – Referenzzentrum Mammographie Südwest am Universitätsklinikum Gießen-Marburg am Standort Marburg [Kursskript]) a Zystische Gangektasie. b Fibrozystischer Gewebeumbau mit erweiterten Duktuli, teilweise von (rötlichem) aprokrin-metaplastischem Epithel ausgekleidet (A), und herdförmig beginnende Läppchensklerose (S). 24 Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. Pathologie benigner und maligner Brustveränderungen 3.1 Benigne Brustveränderungen 3 a b Verlegungen des Ductus excretorius mit Hornpfröpfen, Narben oder Tumoren und konsekutiver Sekretretention. Infolge sekundärer Keimbesiedlung kann es dann zur eitrigen Einschmelzung kommen. Histologisch besteht eine leukozytäre Infiltration von Milchgängen und Drüsenläppchen mit Übergreifen auf das Mantel- und Stützgewebe. Abszesse und Fistelbildungen können schließlich narbig mit Deformierung des Drüsenkörpers ausheilen. Chronische periduktale Mastitis (Retentionssyndrom) Etwa ⅓ der nonpuerperalen Mastitiden sind abakterielle, chemisch induzierte Entzündungen, die durch intraduktale Sekretretention hervorgerufen werden (▶ Abb. 3.3a). Histologisch finden sich ausgeweitete, mit eingedicktem Sekret und Schaumzellen gefüllte Gänge (Galaktostase) sowie periduktal Lymphozyten und Plasmazellen (periduktale Mastitis). Das Gangepithel ist zumeist abgeflacht oder durch Granulationsgewebe ersetzt. Periduktale Fibrose und narbige Gangobliteration kennzeichnen das Endstadium, die Galactophoritis obliterans. Gelegentlich können auch granulomatöse Entzündungsreaktionen auftreten, die dann von einer nicht erregerbedingten idiopathischen, granulomatösen Mastitis (histologisch: lobulozentrische, nicht verkäsende Granulome) und von der spezifischen Mastitis abzugrenzen sind. Spezifische Mastitis Spezifische erregerbedingte Entzündungen der Mamma sind selten und umfassen die Mastitis tuberculosa (hämatogen), die Lues (Primäraffekt der Mamille) und sehr selten die Aktinomykose oder andere mykotische Pseudotumoren (Blastomykose, Kryptokokkose). Histologisch findet sich typischerweise eine mit zentraler azellulärer („verkäsender“) Nekrose einhergehende Entzündungsreaktion; der mikroskopische, bakteriologische oder molekulargenetische Erregernachweis ist beweisend. Eine Mitbeteiligung der Mamma im Rahmen einer Sarkoidose ist eine Rarität, der histomorphologische Befund nicht verkäsender Granulome im Rahmen des meist bekannten Krankheitsbilds zu interpretieren. Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. Abb. 3.3 Entzündungen der Mamma. a Galactophoritis obliterans mit zystischer Gangektasie (Z) und Wandverdickung bei einem durch ein drüsenreiches Papillom verlegten Milchgang (P; sog. Retentionssyndrom). b Fettnekrose mit narbig-zystischem Abbau des nekrotischen Fettgewebes (sog. Ölzyste; rechts unten: reguläre Fettzellen). Nekrosen des Pannikulitisfettgewebes Nekrosen des mammären Fettgewebes treten zumeist als tumorartige Veränderungen im 5.–6. Dezennium auf; eine Traumaanamnese, wie ein Zustand nach operativem Eingriff (etwa 1:200 Eingriffe), besteht in bis zu 50 % der Fälle. Klinisch findet sich ein umschriebener, schmerzhafter Knoten, der auch mammografisch nur schwer vom Karzinom zu unterscheiden ist. Mikroskopisch finden sich Fettgewebenekrosen mit lipophager Entzündungsreaktion (Schaumzellen, Touton-Riesenzellen) und teilweise zystenartig konfluierten Fettzellnekrosen (Ölzysten; ▶ Abb. 3.3b). Ausgeprägte begleitende Hämorrhagien kommen bei Marcumartherapie vor. Differenzialdiagnostisch sind vor allem ein Abszess oder ein Karzinom abzugrenzen. Entzündungsreaktion auf Brustimplantate Schaumzellreiche und vernarbende Entzündungsreaktionen können schließlich auch als Reaktion auf Prothesen (Brustimplantate) auftreten (in 22–58 % der Fälle nach 3–9 Monaten). In 4–6 % der Fälle kann es zur Implantatruptur kommen, mit Ausbildung tumorartiger Silikongranulome, die nicht doppeltbrechende Silikonbestandteile, umgeben von Histiozyten und Riesenzellen, enthalten [1]. 3.1.3 Benigne tumorbildende Erkrankungen Die sich typischerweise mit einem umschriebenen, ggf. palpablen Tumor manifestierenden Läsionen der Mamma werden nach aktueller WHO-Klassifikation (World Health Organisation) in epitheliale, mesenchymale und fibroepitheliale Tumoren sowie in Neubildungen der Brustwarze, maligne Lymphome, metastatische Tumoren und Tumoren der männlichen Brust eingeteilt [24]. In diesem Abschnitt werden die primär benignen, nicht karzinomatösen Läsionen abgehandelt (▶ Tab. 3.1; maligne Läsionen s. Kap. 3.2). Epitheliale Proliferationen Im Bereich der Läppchen werden verschiedene Formen proliferativer Epithelläsionen voneinander unterschieden, die im Einzelfall radiologisch und auch histologisch Schwierigkeiten bei der Abgrenzung gegenüber einem Karzinom bereiten. Diese Läsionen 25 Pathologie benigner und maligner Brustveränderungen Tumorgruppen Entitäten epitheliale Tumoren benigne epitheliale Proliferationen (sklerosierende) Adenosen und Varianten radiäre Narbe und komplexe sklerosierende Läsion Adenome der Brust intraduktale proliferative Läsionen UDH Kolumnarzellläsionen FEA ADH epithelial-myoepitheliale Tumoren pleomorphes Adenom Adenomyoepitheliom (mit/ohne Karzinom) 3 fibroepitheliale Tumoren Fibroadenom Phyllodestumor Hamartom mesenchymale Tumoren noduläre Fasziitis Myofibroblastom desmoidartige Fibromatose inflammatorischer myofibroblastischer Tumor benigne vaskuläre Läsionen (Hämangiom, Angiomatose) pseudoangiomatöse Stromahyperplasie Granularzelltumor benigne periphere Nervenscheidentumoren (Neurofibrom, Schwannom) Lipom und Angiolipom Leiomyom Tumoren der Brustwarze Adenom syringomatöser Tumor Tumoren der männlichen Brust Gynäkomastie ADH = atypische Gangepithelhyperplasie FEA = flache epitheliale Atypie UDH = gewöhnliche, einfache duktale Hyperplasie gehen aber nicht mit einem erhöhten Karzinomrisiko einher. Eine Ausnahme bilden die seltenen Formen einer mikroglandulären Adenose und die komplexe sklerosierende Läsion (radiäre Narbe), die häufiger mit In-Situ- oder invasivem, meist lobulärem Karzinom verbunden sein können [4]. Adenosis Eine Adenose geht mit vermehrten und vergrößerten Drüsenläppchen einher, die mikroskopisch umschrieben und selten tumorförmig (Adenosistumor) als ein meist weniger als 2 cm großer Herd in Erscheinung treten. Bei apokriner Epithelmetaplasie und bei deutlicher Zellhyperplasie (floride Adenose), in der Schwangerschaft und während der Stillzeit können gewisse nukleäre Atypien auftreten, die nicht als neoplastische In-Situ-Läsion fehlinterpretiert werden dürfen. In der PAS-Färbung (mit Perjodsäure-Schiff-Reagens) finden sich typischerweise Sekretablagerungen im Drüsenlumen (▶ Abb. 3.4a), dies im Gegensatz zu lobulären Neoplasien, bei denen diese wie bei Siegelringzellen intrazellulär im Zytoplasma gelegen sind. Sklerosierende Adenose Dabei handelt es sich um eine kompakte Proliferation von Drüsen- und vor allem Myoepithelien mit erhaltener Basalmembran in läppchenförmiger Anordnung (▶ Abb. 3.4b), häufig mit Mikro- 26 kalzifikationen im Drüsenlumen. Zwischen den Drüsen finden sich Aktin-sm- oder CK5/6-positive Myoepithelien (wichtiges differenzialdiagnostisches Kriterium gegenüber dem szirrhösen und tubulären Karzinom). Eine Nervenscheiden- oder Gefäßinvasion ist gelegentlich (in bis zu 2 % der Fälle) zu finden, aber nicht als Malignitätszeichen zu werten. Radiäre Narbe Die radiäre Narbe ist eine Sonderform der Adenose mit zentraler hyalin-elastotischer Narbe, die einzelne Drüsen einschließt und strahlenförmig nach peripher in eine Adenose übergeht (▶ Abb. 3.4c). Größere Läsionen (größer als 0,5 cm) mit Gangektasie, Metaplasie und Epithelhyperplasie werden auch als komplexe sklerosierende Läsion bezeichnet. Fehlende Fettgewebeinfiltration und zumeist zweireihige Tubuli mit erhaltenem Epithel und Myoepithel gelten als Ausschlusskriterien eines Karzinoms (▶ Abb. 3.4d). Dies kann im Zweifel immunhistochemisch abgesichert werden (CK5/6-, Aktin-sm-positiv). Mikroglanduläre Adenose Unregelmäßig und unscharf begrenzte Gruppen von proliferierten, relativ gleichförmigen Drüsentubuli, die von kubischem Epithel ausgekleidet werden und im Gegensatz zu den übrigen Adenoseformen kein Myoepithel aufweisen (d. h. Aktin-sm-negativ sind), sind Zeichen einer mikroglandulären Adenose. Im Lumen findet sich häufig eosinophiles, PAS-positives Sekret. Klinisch und histologisch imponieren diese Läsionen wie ein tubuläres Karzinom. Im Unterschied dazu exprimieren die Zellen der mikroglandulären Adenose S 100 aber keine Hormonrezeptoren und sind stets EMA- (epitheliales Membranantigen) und auch GCDFP-15-negativ (Gross cystic Disease fluid Protein). Die Basalmembran ist um die neugebildeten Drüsen erhalten [5]. Adenome der Brust Adenome sind in der Regel umschriebene, rundlich geformte und gut abgegrenzte Knoten in der Brust, die aus tubulären Proliferationen mit 2-lagigem Drüsen- und Myoepithel bestehen (tubuläres Adenom oder Adenoma purum). Sie machen etwa 1 % aller benignen Brustläsionen aus und betreffen typischerweise junge Frauen nach der Menarche. Radiologisch imponieren sie wie Fibroadenome. Während der Schwangerschaft treten Zeichen der Sekretion hinzu (laktierendes Adenom). Es können des Weiteren apokrine Epithelmetaplasien vorkommen (apokrines Adenom) oder auch Adenome polypoid in ausgeweitete Gänge hinein vorgewölbt sein (duktales Adenom). Eine seltene Adenomform bildet das pleomorphe Adenom mit einer den entsprechenden Speicheldrüsentumoren vergleichbaren Morphologie, bestehend aus epithelialen und hellzellig-myoepithelialen Proliferationen, vermischt mit chondroiden Anteilen. Alle diese Läsionen sind benigne, zeigen nach vollständiger Entfernung kein Rezidiv und sind in keiner Form mit einem erhöhten Karzinomrisiko verbunden. Davon abzugrenzen sind die sehr seltenen myoepithelialen und epithelial-myoepithelialen Läsionen, die dem tubulären Adenom ähneln und mit Atypien verbunden sein können [24] [25]. Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. Tab. 3.1 WHO-Systematik der Mammatumoren, Teil 1 (primär benigne Läsionen; nach [24]). 3.1 Benigne Brustveränderungen a b c d Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. 3 Abb. 3.4 Formen der Adenose. (Abb. c und d aus Bock K, Ramaswamy A, Köhler H. Fortbildungskurs zur Aufrechterhaltung und Weiterentwicklung der fachlichen Befähigung für Pathologen [6.10.2012] – Referenzzentrum Mammographie Südwest am Universitätsklinikum Gießen-Marburg am Standort Marburg [Kursskript]) a Duktale Adenose (sog. Blunt Duct Adenosis, A) mit leicht ausgeweitetem Läppchen, von einlagigem Zylinderepithel (Kolumnarzellmetaplasie) ausgekleidet und mit granulärem (oft verkalktem) Sekret im Lumen (N = normales Läppchen). b Sklerosierte Adenose mit tumorartig proliferierten Drüsen und typischerweise erhaltener Myoepithelschicht. Insert: luminale (blaue) Drüsenepithelkerne, von (braunem) p63-positivem Myoepithel umsäumt. c Radiäre Narbe; von einem hyalin-elastotischen Zentrum (*) strahlenförmig ausgehende Drüsen- und Gangproliferaten, außen in Adenose übergehend. d Wichtigste Differenzialdiagnose ist das tubuläre Karzinom mit vergleichbarer zentraler elastotischer Fibrose (*); im Unterschied zur radiären Narbe fehlt den Drüsen eine Myoepithelschicht (vgl. Insert: Myoepitheldarstellung mittels Zytokeratin CK5, in c positiv, in d negativ). Intraduktale proliferative Läsionen und Vorläuferläsionen des invasiven Mammakarzinoms Intraduktale epitheliale Zellproliferationen umfassen folgende Erscheinungsformen: ● UDH: gewöhnliche, einfache duktale Hyperplasie ● FEA: flache epitheliale Atypie (hervorgehend aus einer Kolumnarzellläsion) ● ADH: atypische Gangepithelhyperplasie ● DCIS: duktales Carcinoma in situ Diese Läsionen zeichnen sich durch ein vom Grad der Atypie und Ausdehnung im Brustgewebe abhängiges Entartungsrisiko aus. In der aktuellen WHO-Klassifikation wird die ursprünglich vom AFIP (Armed Forces Institute of Pathology) eingeführte Klassifikation intraduktaler proliferativer Läsionen nach der sog. DIN-Terminologie (duktale intraepitheliale Neoplasie) nicht weiter verfolgt [43]. Gewöhnliche duktale Hyperplasie Benigne proliferative Läsionen des duktalen Gangepithels ohne morphologische Zeichen der Atypie werden als gewöhnliche oder einfache duktale Hyperplasie bezeichnet (▶ Abb. 3.5a). Histopathologisch imponieren vor allem in den terminalen Gängen der terminalen duktulolobulären Einheit die Ganglumina ausfüllende, mehr als 4 Zelllagen breite Epithelproliferationen. Diese bilden unregelmäßige, meist schlitzförmig an die Gänge angepasste Lumina (periphere Fenestrierungen) mit dünnen Epithelbrücken aus. Die Zellen sind oft in Zügen angeordnet (Streaming) und morphologisch aus unterschiedlichen Zelltypen, teils länglichen und entrundeten Zellkernen sowie herdförmiger apokriner Metaplasie, zusammengesetzt. Die basale Myoepithelschicht ist typischerweise erhalten. Im Unterschied zum DCIS exprimieren die Zellen der UDH überwiegend das Zytokeratin CK5/6 (▶ Abb. 3.5c), weshalb sie auch als Progenitor- oder Stammzellläsion bezeichnet wird [5]. Frauen mit UDH haben ein gering erhöhtes Risiko (1,5- bis 2,0-fach erhöht), im weiteren Verlauf ein Mammakarzinom zu entwickeln. 27 Pathologie benigner und maligner Brustveränderungen a b c d Abb. 3.5 Intraduktale proliferative Läsionen. (Abb. a und b aus Bock K, Ramaswamy A, Köhler H. Fortbildungskurs zur Aufrechterhaltung und Weiterentwicklung der fachlichen Befähigung für Pathologen [6.10.2012] – Referenzzentrum Mammographie Südwest am Universitätsklinikum Gießen-Marburg am Standort Marburg [Kursskript]) a UDH mit nur noch schlitzförmigen Restlumina in einem Gang (rechts unten; H) und Auskleidung eines weiteren Ganges (links oben; K) durch einreihiges Zylinderepithel (Kolumnarzellmetaplasie; beides B2-Läsionen). b FEA: Auskleidung einer Drüse durch teilweise übereinander gelagerte Epithelien mit vergrößerten Kernen und teilweise sichtbaren Kernkörperchen (Nukleolen); zwischen 1 und 2 h 1 Mitose (B3-Läsion). c Immunhistochemisch zeigt die UDH mosaikartig im Epithel verteilte CK5/6-positive Myoepithelien. d Diese CK5/6-positiven Myoepithelien fehlen bei der ADH weitgehend oder vollständig. Kolumnarzellläsionen und flache epitheliale Atypie Mit Einführung des systematischen Screenings auf Mammakarzinome mittels Röntgenreihenuntersuchung haben Befunde an Bedeutung gewonnen, die als Kolumnar- oder Zylinderzellläsionen bezeichnet werden. Histopathologisch sind folgende Formen abzugrenzen: ● Kolumnarzellmetaplasie: Ersatz des meist zweireihigen Epithels der Läppchen und terminalen intraazinären Gänge durch ein einreihiges Zylinderepithel mit apokrinen apikalen Zytoplasmaabschnürungen (Snouts). Als Folge der apokrinen abnormen Sekretion sind die Läppchenlumina ausgeweitet und zeigen nicht selten Sekretverkalkungen, die radiologisch in der Mammografie als gering polymorphe, gruppierte Verkalkungen auffallen können. Eine Form der Kolumnarzellmetaplasie ist die Blunt Duct Adenosis, bei der mehrere Läppchen von gangähnlichen Kolumnarzellen ausgekleidet sind. 28 ● ● Kolumnarzellhyperplasie: Diese Form ist durch das herdförmige Übereinanderliegen der Zylinderzellen (Crowding), aber ohne zytologische Atypie, gekennzeichnet. FEA: Die Auskleidung der Läppchen durch eine relativ gleichförmige Zellpopulation mit monotonen vergrößerten und abgerundeten Kernen, deren Chromatin meist zentral aufgehellt ist und 1–2 prominente Nukleolen aufweist, ist Zeichen der FEA (▶ Abb. 3.5b). Die Epithelien sind oft einlagig der Gangkontur angepasst und entsprechen bei Überschreiten der Läppchengrenzen mit Ausdehnung auf die interlobulären Gänge dem Clinging Carcinoma vom monomorphen Typ (DCIS niedrigen Malignitätsgrads). Das mit Kolumnarzellläsionen assoziierte Krebsrisiko ist eher als gering anzusehen und wurde auch bei Nachweis einer FEA (in kleineren Studien) überschätzt. Ein gesichert erhöhtes Risiko ergibt sich erst ab der ADH. Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. 3 3.1 Benigne Brustveränderungen a b c d Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. 3 Abb. 3.6 Formen der lobulären Neoplasie. (aus Bock K, Ramaswamy A, Köhler H. Fortbildungskurs zur Aufrechterhaltung und Weiterentwicklung der fachlichen Befähigung für Pathologen [6.10.2012] – Referenzzentrum Mammographie Südwest am Universitätsklinikum Gießen-Marburg am Standort Marburg [Kursskript]) a ALH mit von gleichförmigen atypischen Zellen ausgefüllten Läppchen, ohne diese nennenswert auszuweiten; die Drüsenlumina teilweise noch sichtbar und die Myoepithelschicht weitgehend erhalten (Zytokeratin-CK5/6-Immunfärbung). b Klassisches LCIS mit ausgeweiteten und deformierten Drüsenendsprossen bzw. Azini. c Pleomorphes lobuläres Karzinom mit deutlich ausgeweiteten Drüsen, von atypischen pleomorphen Tumorzellen und zentralen Nekrosen ausgefüllt. d Ausdehnung des LCIS in benachbarte Gänge (unten), teilweise mit sog. pagetoidem, wenig- und einzelzellig das Gangepithel durchsetzendem Wachstum (Pfeile). Darstellung mittels Immunfärbung gegen das Zelladhäsionsmolekül E-Cadherin, das im Unterschied zu duktalen Epithelien (stark braun angefärbt) in der lobulären Neoplasie fehlt (Tumorzellen nur blau mittels Hämalaun als Gegenfärbung dargestellt). Atypische duktale Hyperplasie Lobuläre Neoplasie Charakteristikum der ADH ist die im Unterschied zur FEA nachweisbare Ausbildung von Mikropapillen und Zellbrücken (sog. Sekundärarchitekturen; ▶ Abb. 3.5d). Die Abgrenzung gegenüber dem DCIS Grad 1 erfolgt durch metrische Angaben: entweder maximal 2 betroffene Gänge (nach Page) oder eine weniger als 2 mm große Läsion (nach Tavassoli). Streng genommen ist dabei die Läsion auf 1 Läppchen begrenzt. Der Befall mehrerer Läppchen, insbesondere aber das Übergreifen der Atypien auf interlobuläre Gänge, zeigt den Übergang in ein DCIS an. Das Risiko für die Entwicklung eines Mammakarzinoms wird mit 3- bis 5-fach erhöht angegeben [46]. In den terminalen Läppchen auftretende Zellproliferationen (▶ Abb. 3.6 und ▶ Tab. 3.2) werden als lobuläre Neoplasie bezeichnet und umfassen die ALH (atypische lobuläre Hyperplasie) und das LCIS (Carcinoma lobulare in situ). Analog zu den intraduktalen Neoplasien werden diese Läsionen auch als LIN (lobuläre intraepitheliale Neoplasie) zusammengefasst. Sie werden meist zufällig bei etwa 0,5–5 % der Fälle von im Übrigen histologisch benignem Brustbefund gefunden. Die Läsionen sind meistens (85 % der Fälle) multizentrisch und auch bilateral (30–67 %) nachweisbar. Von wenigen Ausnahmen abgesehen besteht kein typischer klinischer oder mammografischer Befund [26]. Histologisch findet sich eine von den Drüsenläppchen ausgehende, solide Epithelproliferation mit relativ kleinen, mono- 29 Pathologie benigner und maligner Brustveränderungen Tab. 3.2 Systematik der lobulären Neoplasien (nach [26] und [48]). LIN-Systematik (WHO 2003) Definition Assoziiertes DCIS Assoziiertes IDC (NST) Assoziiertes ILC ALH LIN 1 TDLU zu weniger als 50 % ausgefüllt, nicht distendiert bei 7,7 % bei 12,3 % bei 1,5 % LCIS LIN 2 TDLU zu mehr als 50 % befallen, distendiert bei 14,7 % bei 9,4 % bei 8,2 % pleomorphes LCIS LIN 3 TDLU maximal distendiert, pleomorph mit Nekrosen bei 18,5 % bei 3,3 % bei 19,6 % IDC ILC NST TDLU = = = = invasiv-duktales Karzinom invasiv-lobuläres Karzinom nicht spezieller Typ terminale duktulolobuläre Einheit morphen Zellen und Zellkernen ohne Prominenz der Nukleolen, bei denen die Läppchen ausgeweitet sind, die Architektur jedoch erhalten bleibt. Fehlt die Ausweitung der Läppchen oder sind nur einzelne Azini (weniger als 50 %) von soliden atypischen Zellproliferaten ausgefüllt, liegt eine ALH vor. Charakteristisch für eine lobuläre Neoplasie ist das nicht selten anzutreffende pagetoide Wachstum in die terminalen Duktuli mit einem die noch intakte luminale, duktale Zelllage unterminierenden Wachstum. Vom klassischen Zelltyp (A) mit nur geringer Zellatypie kann ein Zelltyp B mit prominenten Nukleolen und grobem Chromatin abgegrenzt werden. Bei Überwiegen des letzteren Zelltyps liegt eine pleomorphe lobuläre Neoplasie vor, die mit Nekrosen und vermehrt Mitosen einhergehen kann (auch als LIN 3 bezeichnet). Zur sicheren Abgrenzung gerade solcher Läsionen gegenüber einer Läppchenkanzerisierung durch ein DCIS kann die Immunhistochemie eingesetzt werden: Lobuläre Neoplasien sind im Unterschied zum DCIS in den meisten Fällen E-Cadherin-negativ [26]. Merke H ● Bei lobulärer Neoplasie ist das Krebsrisiko um den Faktor 7–12 erhöht, wobei sie nicht als obligate Präkanzerose eingestuft wird. Das Risiko eines nachfolgenden invasiven Karzinoms liegt bei etwa 20 % in 10 Jahren (20 % ipsilateral, 10 % kontralateral); bei mehr als 5 befallenen Lobuli oder familiärer Belastung liegen die Werte noch höher. Nach 35 Jahren entwickeln etwa 35 % der Frauen ein invasives Karzinom. Eine lebenslange überwachende Nachsorge mit und ohne Tamoxifengabe wird empfohlen. Bei LIN 3 ist das Karzinomrisiko wahrscheinlich deutlicher erhöht, sodass bei diesen Läsionen eine operative Entfernung im Gesunden anzustreben ist [5]. Fibroepitheliale Tumoren Biphasische Tumoren, bestehend aus einer epithelialen und einer dominierenden mesenchymalen (stromalen) Komponente, bilden das Fibroadenom und den Phyllodestumor. Als Pseudotumor wird in dieser Kategorie auch das Hamartom der Mamma subsumiert. Fibroadenom Das Fibroadenom ist nach der Mastopathie und dem Karzinom die dritthäufigste Erkrankung der Mamma (ca. 20 % der Fälle). Es 30 tritt meist zwischen dem 20. und 40. Lebensjahr auf (Häufigkeitsgipfel: 20–24 Jahre). Die meisten Fibroadenome kommen solitär und bevorzugt im oberen äußeren Quadranten vor; etwa 20 % sind multipel und 3–5 % bilaterale Neubildungen. Die meisten Fibroadenome (ca. 90 %) sind kleiner als 4 cm und imponieren als grau-weiße, gut gegen das übrige Drüsengewebe abgegrenzte Geschwülste (▶ Abb. 3.7a). Histologisch findet sich ein zellarmes, myxoides Stroma mit eingeschlossenen spaltförmigen Lumina, die von einem flachen, zweireihigen Epithel ausgekleidet werden (▶ Abb. 3.7b). Abzugrenzen ist das juvenile Fibroadenom, das in der Adoleszenz (12.–19. Lebensjahr) auftritt und durch eine pseudopapilläre Epithelproliferation mit zellreichem dichtem Stroma gekennzeichnet ist. Das rasche Tumorwachstum kann zu sog. Riesenfibroadenomen führen. Fibroadenome können in einen Phyllodestumor und in ein Stromasarkom übergehen. Bei 1–2 % der Fälle sind atypische Epithelproliferationen nachweisbar, in ca. 70 % der Fälle vom Typ eines LCIS (zumeist bei Frauen über 40 Jahren) [40]. Phyllodestumor Der Phyllodestumor (Bezeichnung gemäß WHO [24]) oder das Cystosarcoma phylloides (ältere Nomenklatur) ist ein sich aller Wahrscheinlichkeit nach aus dem Fibroadenom entwickelnder, stromareicher Tumor, der durch weite Spalten sowie epitheliale und mesenchymale Metaplasien gekennzeichnet ist (▶ Abb. 3.8a). Das mittlere Erkrankungsalter liegt etwa 10–20 Jahre nach dem des Fibroadenoms; allerdings können bereits in der Pubertät und noch in der Postmenopause Phyllodestumoren auftreten. Es sind Phyllodestumoren mit einem Durchmesser von 30 cm und 5 000 g Gewicht beschrieben worden. Histologisch findet sich ein zellreiches, oft aus Spindelzellen aufgebautes Stroma mit myxoider Grundsubstanz. Knorpel-, Knochen-, Fettgewebe- und Plattenepithelmetaplasien sind häufig. Wenige Mitosen (weniger als 4/10 HPF [High Power Fields = Gesichtsfelder bei großer Vergrößerung]) ohne Zellatypien und scharfe Tumorbegrenzung sprechen für Benignität; dies trifft auf etwa 65 % der Tumoren zu. Bei etwa 15 % der Phyllodestumoren handelt es sich um eine maligne Geschwulst (Stromasarkom), die vor allem hämatogene Metastasen setzt. Als sichere Kriterien der Malignität gelten der kombinierte Nachweis von erhöhter Mitoserate (über 10/10 HPF), atypischem zellreichem Stroma und invasivem Wachstum am Tumorrand (▶ Abb. 3.8b). Die Rezidivrate dieser Neubildungen ist mit ca. 30 % sehr hoch. Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. 3 Spektrum der lobulären Neoplasien (WHO 2012) 3.1 Benigne Brustveränderungen Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. 3 a a b b Abb. 3.8 Phyllodestumor. a Phyllodestumor mit kleeblattartig gelapptem Aufbau. b Der Phyllodestumor weist ein verbreitertes, hier pleomorphkerniges Epithel und eine zellreiche Stromaunterlage auf (Nachweis vermehrter Mitosen, Nekrosen und invasives Wachstum sind Indikatoren der Malignität). Abb. 3.7 Fibroadenom. a Scharf begrenzter, ca. 2,2 cm großer, prall-elastischer Tumorknoten mit grau-weißer, wirbelartiger Schnittfläche. b Histologisch spaltförmig von aufgequollenem Mantelgewebe komprimierte Gänge. Das Epithel ist abgeflacht (druckatroph). Hamartom der Mamma Als Hamartome (Synonym: Fibroadenolipom) werden durch eine bindegewebige Pseudokapsel gut begrenzte, 1–20 cm große Pseudotumoren der Mamma bezeichnet, die sich histologisch aus allen Gewebekomponenten der Brust zusammensetzen und Lobuli und reichlich fibrolipomatöses Zwischengewebe aufweisen. Ma- kroskopisch imponieren diese leicht enukleierbaren Knoten meist wie normales Brustgewebe (Brust-in-Brust-Eindruck) oder wie ein Lipom. Diese durch lokale Fehldifferenzierung entstandene hamartomatöse Neubildung ist selten (0,16 % aller mammografisch auffälligen Knoten) und zeigt weder eine Altersbevorzugung noch ein malignes Potenzial. 31 Pathologie benigner und maligner Brustveränderungen Die vom Mesenchym der Mamma ausgehenden Veränderungen entsprechen im Prinzip denen im extramammären Weichgewebe; sie werden hier deshalb nur kursorisch aufgeführt. 3 Hämangiom Das Hämangiom ist ein umschriebener Tumor (0,6–2,5 cm Durchmesser) mit gruppierten, dilatierten (kavernösen) oder englumigen (kapillären), blutgefüllten Gefäßen (▶ Abb. 3.9a); zur sicheren Abgrenzung gegenüber einem Angiosarkom wird die komplette Exzision empfohlen [6]. Diffuse Angiomatosen sind eine Rarität. Pseudoangiomatöse Stromahyperplasie Die PASH (pseudoangiomatöse Stromahyperplasie) ist eine relativ häufige, angiomartige Bindgewebereaktion (CD34-positiv, CD31negativ), die mikroskopisch klein (bei bis zu 25 % der Mamma- biopsien) oder tumorartig imponieren kann (▶ Abb. 3.9b). Die Läsion kann rezidivieren, ist aber benigne. Die Pubertätsgynäkomastie ist relativ häufig (50–70 % der Männer im Adoleszentenalter), beginnt einseitig betont und bildet sich innerhalb von 2–3 Jahren spontan zurück. Lipom Auf benigne Proliferationen des Fettgewebes sind Lipome zurückzuführen, die als umschriebene, meist bekapselte, asymptomatische Knoten von 2–10 cm Durchmesser zwischen dem 40. und 60. Lebensjahr manifest werden und stets benigne sind. Fibromatose (extraabdomineller Desmoidtumor) Hierbei handelt es sich um eine lokal aggressive Läsion aus Myofibroblasten, die in Faserzügen angeordnet in das umgebende Fett- und Läppchengewebe ausstrahlen. Die Läsion nimmt häufig von der Pektoralisfaszie ihren Ausgang und ist unscharf begrenzt a b c d Abb. 3.9 Benigne mesenchymale Tumoren. (Abb. c und d aus Bock K, Ramaswamy A, Köhler H. Fortbildungskurs zur Aufrechterhaltung und Weiterentwicklung der fachlichen Befähigung für Pathologen [6.10.2012] – Referenzzentrum Mammographie Südwest am Universitätsklinikum Gießen-Marburg am Standort Marburg [Kursskript]) a Hämangiom mit gruppierten blutgefüllten Kapillarsprossen im mammären Stroma (rechts im Bild), zwischen den normalen Drüsen (links im Bild) gelegen. b PASH (Erläuterung der Abkürzung s. Text) mit spaltförmiger, angiomartiger Bindegewebereaktion (im Unterschied zum Hämangiom CD31-negativ). c Fibromatose (extraabdomineller Desmoidtumor) mit in Zügen angeordneten, spindelförmigen Fibroblasten, am Rand typischerweise unscharf begrenzt (hohe Rezidivrate). Im Unterschied zu Narben positive nukleäre β-Catenin-Färbung (Insert). d Granularzelltumor mit granulärer schaumzelliger Proliferation S 100-positiver (Schwann-)Zellen (Insert). 32 Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. Mesenchymale (nicht sarkomatöse) Tumoren 3.1 Benigne Brustveränderungen Differenzialdiagnosen Abzugrenzen sind folgende Läsionen: ● Narben (Makrophagen und Siderineinschlüsse, Fehlen der bei Desmoidtumoren typischen, nukleären β-Catenin-Färbung [12]) ● Spindelzellkarzinom (Zytokeratin-positiv) ● noduläre Fasziitis (schnell subkutan wachsend, spontan heilend) ● Myofibroblastom (CD34-, Desmin-positiv) ● inflammatorischer myofibroblastischer Tumor (eingestreut Plasmazellen, 50 % positiv für die alkalische Phosphatase) ● benigne Tumoren aus Zellen der peripheren Nervenscheiden: ○ Granularzelltumor (PAS- und S 100-positive, schaumzellartige Schwann-Zellen; ▶ Abb. 3.9d) ○ Schwannom ○ Neurofibrom ● benigne Tumoren aus glatten Muskelzellen: Leiomyom (macht deutlich weniger als 1 % der Mammatumoren aus) Tumoren der Brustwarze (Mamillenadenom) Tumoren der männlichen Brust Als Gynäkomastie wird die ein- oder beidseitige Größenzunahme der männlichen Brust durch abnormes Wachstum des Drüsenkörpers bezeichnet. Sie tritt gehäuft während der Pubertät und im 6.–7. Dezennium auf und ist von der Pseudogynäkomastie durch vermehrte Fettzelleinlagerung abzugrenzen. Merke H ● 3 Im Alter sollten bei Patienten mit Gynäkomastie neben dem Climacterium virile mit relativer Östrogenvermehrung ein sezernierender testikulärer (Leydig-Zell-)Tumor oder eine Leberzirrhose ausgeschlossen werden. Die Gynäkomastie kann ferner medikamentös (Östrogentherapie, Kortikoide, Digitalis, Spironolacton, Cimetidin u. a.) bedingt oder paraneoplastisch ausgelöst sein. Makroskopisch sind die Brüste auf im Durchmesser 2–4 cm vergrößert. Histologisch finden sich bei etwa 70 % der Fälle intraduktale, pseudopapilläre Epithelproliferationen (Gynaecomastia tubularis; ▶ Abb. 3.10). Sekretbildung und Ausbildung typischer Drüsenläppchen kennzeichnen das Bild einer Gynaecomastia lobularis (10–50 % der Fälle). Präkanzeröse Epithelhyperplasien sind selten; das morphologische Bild entspricht dann weitgehend dem des Carcinoma in situ und schließlich dem invasiven Karzinom (s. Kap. 3.2) [37] [40]. Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. (▶ Abb. 3.9c). Ursächlich kommen vorausgegangene Traumata (Operation), aber auch eine familiäre Adenomatosis coli infrage. Rezidive treten bei inkompletter Entfernung auf. Benigne drüsenartige Neubildungen (Adenome) sind in der Mamma selten. Es wird zwischen drüsenartig-papillären Neubildungen der Ductus lactiferi (Brustwarzenadenom, subareoläre Gangpapillomatose) und den rein drüsenartigen Neubildungen der übrigen Brust (Adenoma purum) unterschieden. Das Erkrankungsalter liegt beim Mamillenadenom bei 45 Jahren. Das histologische Bild ähnelt dem eines Milchgangpapilloms, wobei Infiltrationen in das Mamillenstroma nicht als Zeichen der Malignität fehlinterpretiert werden dürfen. Es werden solide, papilläre und/oder tubuläre Formationen beobachtet; dabei lässt das Epithel in der Regel eine erhaltene Zweireihigkeit erkennen. Apokrine Metaplasien kommen vor, Nekrosen und Mitosen fehlen. Klinisch findet sich eine vorgewölbte, sezernierende und druckschmerzhafte Mamille, die bei Berührung leicht blutet [40]. a b Abb. 3.10 Gynäkomastie. a In myxoid aufgelockertem Stroma eingebettete, proliferierte Gangstrukturen ohne Epithelatypien. b Ausschnittsvergrößerung aus a. 33 3.2 Maligne Brustveränderungen 3.2.1 Systematik maligner Mammatumoren (WHO-Klassifikation, B-Kategorien) Mit Veröffentlichung der neuen WHO-Klassifikation für Tumoren der Brust in einem eigenen Band [24] sind einige Neuheiten sowohl hinsichtlich der Klassifikation bestimmter Läsionen als auch im Hinblick auf deren Namensgebung zu beachten (▶ Tab. 3.3). 3 H ● Merke Das DCIS wird nicht mehr unter den proliferativen Läsionen geführt, sondern den Vorläuferläsionen mit DCIS, LCIS und ALH zugeordnet. Ferner wird das duktale Mammakarzinom nunmehr als invasives Mammakarzinom NST (vom nicht speziellen Typ) bezeichnet. So soll verdeutlicht werden, dass nicht alle sog. duktalen Karzinome auch wirklich duktalen Ursprungs sind. Ausgangspunkt ist meistens die terminale duktulolobuläre Einheit, aus der sich letztlich unterschiedlich differenzierte Karzinome mit verschiedenen Phäno- und Genotypen entwickeln können. Termini, wie duktales Karzinom NST oder NOS (Not otherwise specified) oder auch IDC (invasiv-duktales Karzinom), werden aber weiterhin als Alternativbegriffe akzeptiert [15]. Mit Einführung des Mammakarzinom-Screenings mittels Mammografie (in Deutschland seit 1. Januar 2004) hat sich die (Früh-)Diagnostik des Mammakarzinoms immer mehr auf die minimalinvasive Biopsiediagnostik verlagert. In diesem Rahmen werden die Stanzbiopsie (bei Herdbefunden) und die Vakuumbiopsie (bei unscharf begrenzten Mikrokalzifikationen) eingesetzt. Die Beurteilung solcher kleiner Stanzzylinder erfordert spezielle Kenntnisse und meist langjährige Erfahrung in der Mammapathologie; d. h., für die Tätigkeit im Rahmen des Mammografie-Screenings müssen entsprechende Grund- und regelmäßige Refresher-Kurse seitens des Pathologen nachgewiesen werden. Da am Biopsatmaterial die diagnostische Sicherheit eingeschränkt sein kann (in etwa 10 % der Fälle keine definitive Diagnose möglich), wurden zur Festlegung des weiteren diagnostischen und therapeutischen Vorgehens sog. B-Kategorien der mi- Tab. 3.3 WHO-Systematik der Mammatumoren, Teil 2 (maligne und potenziell maligne Läsionen; nach [24]). Tumorgruppen epitheliale Tumoren Entitäten ICD-O-Code papilläre Läsionen: intraduktales Papillom mit und ohne Atypien ● intraduktales papilläres Karzinom ● gekapseltes papilläres Karzinom ● solides papilläres Karzinom 8503/0(2) 8503/2 8504/2 (13) 8509/2 (13) ● Häufigkeit (%) intraduktale Proliferationen: ● UDH ● Kolumnarzellläsionen ● FEA ● ADH Vorläuferläsionen des invasiven Mammakarzinoms1): ● DCIS 8500/2 ≤ 35 ● lobuläre Neoplasie: ○ LCIS ○ ALH 8520/2 ≤5 8500/3 60–75 8520/3 8211/3 8480/3 8510/3 8575/3 8507/3 10–15 2 2 <1 1 4 1 invasives Mammakarzinom2): ● invasive Karzinome (NST); ggf. gemischt mit pleomorphen, osteoklastischen, choriokarzinomatösen oder melanozytären Anteilen ● spezielle Subtypen: ○ lobuläres Karzinom ○ tubuläres Karzinom (+ kribriformes Karzinom) ○ muzinöses Karzinom ○ Karzinom mit medullären Merkmalen (klassisch) ○ metaplastisches Karzinom (NOS) ○ Karzinom mit apokriner Differenzierung (oft + NST) ○ mikropapilläres Karzinom ● ● seltene Subtypen: ○ Karzinom mit neuroendokrinen Eigenschaften ○ inflammatorisches Karzinom Morbus Paget der Mamille maligne mesenchymale Tumoren und Lymphome Leiomyosarkom, Liposarkom, Angiosarkom, Rhabdomyosarkom, Osteosarkom, Morbus Hodgkin und Non-Hodgkin-Lymphome metastatische Tumoren 2) 34 <1 1–10 8540/3 1–4 sehr selten: adenoidzystisches, sekretorisches, onkozytäres, sebazeisches, lipid- und glykogenreiches, Azinuszell-, Mukoepidermoid- und polymorphes Karzinom, schweißdrüsenartige Tumoren Tumoren der Brustwarze 1) 8530/3 Häufigkeit beim Mamma-Screening relative Häufigkeit invasiver Mammakarzinome Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. Pathologie benigner und maligner Brustveränderungen 3.2 Maligne Brustveränderungen Tab. 3.4 Histologische Befundklassifikation (B-Klassifikation nach perkutan-bioptischer Gewebeentnahme; nach [33]). Kategorie Relative Häufigkeit1) (%) Befunde Empfehlung2) B1 7 normales Gewebe bzw. nicht interpretierbar: Befunde, die die Bildgebung nicht erklären oder die mit Bildgebung nicht erfassbar sind (z. B. Mikrokalk < 100 μm); nicht beurteilbare Proben Rebiopsie B2 34 benigne Läsionen: histologisch sicher benigner Befund, der die Bildgebung erklärt: benigne Tumoren, nicht tumoröse proliferative Läsionen, entzündliche u. a. reaktive Prozesse normale Screening-Intervalle B3 12 Läsionen mit unsicherem malignem Potenzial: Befunde mit erhöhtem Risiko für synchrones Malignom; Verdacht auf inadäquate Biopsie begründend: heterogene Läsionen mit nur benignem Anteil in der Biopsie (papilläre, komplexsklerosierende Läsionen, Phyllodestumor); Läsionen mit gehäufter Karzinomassoziation (lobuläre Neoplasien, atypische Kolumnarzellläsionen (FEA), atypische duktale Proliferation im Sinne einer ADH) weitere Abklärung (chirurgische Biopsie) B4 1 (dringend) malignitätsverdächtige Läsionen: einzelne sicher atypische Zellen (im Stroma, im Gangteil); Non-high-Grade-DCIS versus UDH; Komedomaterial und atypische Zellen außerhalb von Gängen (lobuläre Neoplasien nicht als B4 klassifizieren) offene Biopsie B5 47 maligne Läsionen: Operation ● B5a intraduktale Karzinome (einschließlich Morbus Paget, LCIS pleomorpher Subtyp mit intraduktaler Ausbreitung und Nekrosen) ● B5b invasive Karzinome ● B5c unsichere Invasion ● B5d nicht epitheliale Malignome, Metastasen 1) relative Häufigkeit im Screening (NRW) [13] keine eigenständige Handlungsanweisung, sondern Diskussionsgrundlage für die interdisziplinäre Planung des weiteren Vorgehens 2) nimalinvasiven Mammadiagnostik eingeführt (▶ Tab. 3.4). Die abschließende Interpretation aller Befunde (Klinik, Radiologie, Pathologie) für das weitere therapeutische Vorgehen wird heute in der interdisziplinären Fallkonferenz getroffen. 3.2.2 Prognostische und prädiktive Faktoren Das Tumorstadium (nach UICC [Union internationale contre le Cancer]), basierend auf Tumorgröße und Lymphknotenstatus, sowie der histologische Differenzierungsgrad gelten als die stärksten prognostischen Faktoren beim Mammakarzinom, aus denen sich das Rezidiv- und Sterberisiko (d. h. die Prognose) ableiten lassen (▶ Tab. 3.5) [3] [13]. Der histologische Differenzierungsgrad wird in 3 Grade (G1, G2, G3) eingeteilt und basiert auf 3 histologischen Kriterien: ● Prozentsatz des drüsenartig bzw. tubulär differenzierten Tumoranteils ● Grad der Kernpleomorphie ● Mitoserate Je nach Ausprägung wird jeweils ein Score (1–3) vergeben und daraus die Summe ermittelt. G1 entspricht einer Score-Summe von 3–5, G2 einer Summe von 6 oder 7 und G3 von 8 oder 9. Der so bestimmte Tumorgrad stellt einen weiteren, prognostisch sehr relevanten Parameter dar [16]. Für die weitere Therapieentscheidung ist darüber hinaus die Bestimmung von Hormon- und HER2-Rezeptorstatus unverzichtbar (HER = Human epidermal Growth Factor Receptor). Sie sind wesentlich für die Indikationsstellung zur Hormontherapie wie auch für zielgerichtete Therapien gegen den HER2/neuWachstumsfaktorrezeptor [41]. Basierend auf diesen Markern wurde auf der 12. internationalen St. Gallen Breast Cancer Con- Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. 3 ference (2011) eine neue molekulare Subtypisierung des Mammakarzinoms empfohlen, auf der künftig die Therapieentscheidungen beim Mammakarzinom fußen [18]. Grundlage ist das Progenitor- oder Stammzellkonzept der Mammakarzinomentstehung [7] [23], das sich auf die unterschiedlichen Zytokeratinmuster der basalen und luminalen Epithelschicht bezieht (s. ▶ Abb. 3.1). Merke H ● Perou und Mitarbeiter [35] konnten mittels Genexpressionsprofilen und Cluster-Analyse zeigen, dass es 4 molekulare Subtypen des Mammakarzinoms gibt, die sich im Verlauf (Auftreten von Metastasen) hochsignifikant unterschieden: ● luminal A ● luminal B ● ErbB2 + (HER2) ● basaler Subtyp Auf dem Expertentreffen in St. Gallen wurde festgelegt, anhand von Rezeptor- und HER2-Expressionsbefund und der immunhistochemischen Ki-67/Mib-1-Proliferationsrate die Mammakarzinome analog zum Genexpressionsprofil in die entsprechenden 4 molekularen Subtypen einzuteilen; diese bilden die Grundlage für die weitere Therapieentscheidung des frühen, nicht fernmetastasierten Mammakarzinoms (▶ Abb. 3.11 und ▶ Abb. 3.12). Inwieweit künftig die Erstellung von Genexpressionsprofilen selbst Eingang in die alltägliche Diagnostik am Tumorgewebe finden wird, hängt sicher auch vom Ergebnis entsprechender randomisierter klinischer Studien ab. Dabei wird es am Ende auch darauf ankommen, dass der Informationszuwachs den zum Teil erheblichen Mehrkostenaufwand auch wirklich rechtfertigt [13]. 35 Pathologie benigner und maligner Brustveränderungen Tab. 3.5 TNM-Klassifikation und UICC-Stadieneinteilung (nach [52]). T-Kategorie N-Kategorie M-Kategorie 0 Tis (in situ) N0 M0 IA T12) N0 M0 IB T0, T1 N1mic (0,2–2 mm) M0 IIA T0, T1 N13) (1–3 Lymphknoten) M0 T2 (> 2–5 cm) N0 M0 T2 N1 M0 T3 (> 5 cm) N0 M0 T0, T1, T2 N24) T3 N1, N2 M0 T45) N0, N1, N2 M0 IIIC jedes T N36) IV jedes T jedes N IIB IIIA IIIB 1) 2) 3) 4) 5) 6) (≤ 2 cm) (4–9 Lymphknoten) (≥ 10 Lymphknoten) 10-Jahres-Überlebensrate1) (%) 90 70 M0 40 M0 M1 10 nach Krebsregister des Saarlands (im Internet: http://www.krebsregister.saarland.de; Stand: 23.04.2013) T 1mic ≤ 0,1 cm; T 1a > 0,1–0,5 cm; T 1b > 0,5–1 cm; T 1c > 1–2 cm N1a: 1–3 Lymphknoten (1 Lymphknoten > 2 mm); N1b: an A. mammaria interna; N1c: N1a + N1b N2a: 4–9 Lymphknoten (1 Lymphknoten > 2 mm); N2b: an A. mammaria interna ohne axilläre Lymphknoten T 4a: Brustwand/Haut;T 4b: Hautödem/Ulzeration, Satellitenknoten der Haut; T 4c: T 4a + T 4b; T 4d: entzündliches Karzinom N3a: ≥ 10 Lymphknoten (> 2 mm) oder ipsilateral infraklavikulär; N3b: an A. mammaria interna mit ≥ 1 axillärem Lymphknoten oder > 3 axilläre Lymphknoten und an A. mammaria interna; N3c: Lymphknotenmetastasen in ipsilateralen supraklavikulären Lymphknoten molekulare Subtypen des Mammakarzinoms Progenitor/ Stammzelle EGFR-Amplifikation p53 mut, BRCA-Defekt Triplenegativ (HER 2-/ER-/PR-) BasalProgramm (15%) CK 5/14 WHO-Subtypen Prognose und Therapie •(adeno-)myoepitheliales Karzinom • metaplastisches Karzinom • BRCA1-assoziiertes Karzinom • Karzinom mit medullären Eigenschaften schlecht: Chemotherapie (ggf. Ausnahmen bei speziellen Subtypen) intermediäre Zelle HER2Amplifikation 50 % ER-/PRnegativ HER2Programm (15%) (•HER 2/ER+ oder PR+ •ER+ oder PR+ und Ki67 erhöht) glanduläre Zelle 16q-Verlust ER-/PRpositiv (B) mäßig: endokrin + Chemotherapie + anti HER2 B LuminalProgramm (70%) CK 8/18 (ER+/PR+ und Ki67 < 14 %) • invasives (duktales) Karzinom NST G3 mäßig/schlecht: Chemotherapie + anti-HER2 • invasives (duktales) Karzinom NST G2–3 • invasives (lobuläres) Karzinom G2 • NST Karzinom G1 • tubuläres Karzinom G2 (B) gut/mäßig: endokrin + Chemotherapie (A) sehr gut: alleinig endokrin A Abb. 3.11 Molekulare und histologische Klassifikation des Mammakarzinoms. Prognostische und therapeutische Bedeutung. 16q = Chromosom BRCA = Brustkrebsgen CK = Zytokeratin EGFR = Epidermal Growth Factor Receptor ER = Östrogenrezeptor HER2 = Human epidermal Growth Factor Receptor 2 Ki67 = Proliferation Antigen P53 = Protein PR = Progesteronrezeptor 36 Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. 3 Stadium 3.2 Maligne Brustveränderungen 3 Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. a d b c e Abb. 3.12 Biomarkerbefunde beim invasiven Mammakarzinom (NST). a Positiver ER-Befund (Östrogenrezeptorbefund) mit intensiver (brauner) Immunreaktion in fast allen Tumorzellkernen (Test ist ab 1 % immunreaktiver Tumorzellkerne positiv [19]). b NST-Karzinom mit ca. 10 % Ki67-positiven Tumorzellkernen, entsprechend einer niedrigen Proliferationsaktivität (der Grenzwert von < 14 % nach St. Gallen Consensus [18] wird allerdings aufgrund eingeschränkter Reproduzierbarkeit infrage gestellt [14]). c HER2-positives Mammakarzinom mit intensiver, ringförmiger Darstellung der Tumorzellmembranen (Immuno-Score 3 +). d Nachweis der HER2-Genamplifikation mittels SISH (Silber-in-Situ-Hybridisierung; multiple, silberfarbig-schwarze Signale in den Tumorzellkernen, die roten Chromsom-17-Signale deutlich übersteigend: Ratio > 2,2, entsprechend SISH-positiv [53]). e Nicht amplifizierter Normalbefund mit etwa gleich vielen schwarzen Gen- und roten Chromsom-17-Signalen. 37 Pathologie benigner und maligner Brustveränderungen Grad Histologischer Befund 0 kein Effekt 1 vermehrte Tumorsklerose mit herdförmiger resorptiver Entzündung und/oder deutliche zytopathische Effekte 2 weitgehende Tumorsklerose mit nur noch fokal nachweisbarem, evtl. multifokalem, minimalinvasivem Tumorrest (≤ 0,5 cm); oft ausgedehntes DCIS 3 kein invasiver Tumorrest 4 kein Resttumor (weder invasiv noch in situ) 3 In den letzten Jahren werden vor allem lokal fortgeschrittene, primär inoperable und inflammatorische Mammakarzinome präoperativ (neoadjuvant) primär systemisch, d. h. chemotherapeutisch, endokrin und/oder mit zielgerichteten Medikamenten, vorbehandelt [28]. Gutes Ansprechen auf die Therapie kann so auch bei großen Tumoren ein brusterhaltendes Vorgehen ermöglichen. Ferner haben Patienten mit pCR (pathologisch nachgewiesene Komplettremission) eine signifikant bessere Prognose (Gesamtüberleben) [22]. pCR meint dabei ein Fehlen invasiver Tumorresiduen in Mamma und Lymphknoten; DCIS-Reste haben offenbar keinen Einfluss auf das Langzeitüberleben. Grundsätzlich sprechen gering differenzierte Karzinome (G3, ER- bzw. PgR- [Östrogenrezeptor- bzw. Progesteronrezeptor-] und/oder triple-negativ) besser auf Chemotherapie an; im Falle einer HER2-Positivität besteht zusätzlich die Option einer zielgerichteten Therapie [50]. Bei Patientinnen nach neoadjuvanter Vorbehandlung stellt somit der Nachweis einer pCR einen eigenständigen Prognosefaktor dar. Das Ausmaß der Tumorregression wird in Deutschland zumeist mithilfe des Grading nach Sinn erfasst (▶ Tab. 3.6). 3.2.3 Papilläre Läsionen In der Mamma treten eine Reihe unterschiedlicher Läsionen auf, die allesamt als papillär bezeichnet werden und von benigne (Papillom; M8 503/0) über benigne mit Atypien (DCIS/LCIS M8503/ 2) zum intraduktalen (M8503/2), bekapselten (M8504/2 und M8504/3 bei fokaler Invasion) und schließlich (grob-)invasiven papillären Karzinom (M8503/3) reichen. Davon abzugrenzen sind das invasiv-mikropapilläre Karzinom (M8507/3) und das solidepapilläre Karzinom (M8509/2 und M8509/3). a Aufgrund der zum Teil überlappenden Begrifflichkeit stehen exakte Häufigkeitsangaben der Einzelläsionen nicht zur Verfügung. Insgesamt aber sind Papillome mit etwa 5 % der benignen Mammaläsionen deutlich häufiger als papilläre Karzinome (ca. 1–2 % der Mammakarzinome). Intraduktales Papillom mit und ohne Atypien Formalpathologisch ist eine papilläre Proliferation durch fingerförmige Epithelprotrusionen auf einem bindegewebigen Kern gekennzeichnet. Bei benignen Läsionen ist im Deckepithel die typische Zweischichtung mit erhaltener Basalzellschicht (S 100-, CK5/6-positiv) nachweisbar (▶ Abb. 3.13). Die Läsionen sind zumeist zentral als isolierte Tumoren in den sekundär zystisch ausgeweiteten, retromamillären Ausführungsgängen nachweisbar [34]. Problematischer sind die mehr peripher gelegenen papillären Läsionen, mit denen in bis zu 43 % der Fälle atypische epitheliale Proliferationen assoziiert sein können, in der papillären Läsion selbst oder in ihrer Umgebung. Aufgrund dieser Heterogenität von Papillomen werden auch die in der Stanzbiopsie benigne imponierenden Läsionen als B3 (unsicheres malignes Potenzial) klassifiziert (s. ▶ Tab. 3.4). Intraduktales, bekapseltes und invasives papilläres Karzinom Es findet sich eine auf die Milchgänge begrenzte papilläre Läsion, die im Unterschied zum Papillom durch eine monomorphe („klonale“) Zellpopulation gekennzeichnet ist; d. h., die typische Zweischichtung mit basalem Myoepithel ist verloren gegangen (CK5/6negativ [▶ Abb. 3.14]). Eine Variante ist das intrazytische papilläre Karzinom, bei dem die papilläre Wucherung in bis zu 10 cm großen Zysten ausgebildet sein kann. Die Prognose dieser Läsion ist vergleichbar mit der eines DCIS (s. Kap. 3.2.4), sofern ein invasives Wachstum ausgeschlossen ist [29]. Eine ähnlich günstige Prognose besteht auch beim sog. bekapselten papillären Karzinom, das durch eine dicke fibröse Wandung vom umgebenden Gewebe abgegrenzt ist [11]. Im Unterschied dazu handelt es sich beim IPC (invasives papilläres Karzinom) um eine grob-invasive Neoplasie mit dominanter (mehr als 90 %iger) papillärer Architektur. Die Prognose entspricht der der invasiven Karzinome (NST). b Abb. 3.13 Milchgangpapillom. a Die Epithelproliferation füllt den Milchgang aus und sitzt auf fingerförmig verzweigten Stromapapillen auf. b Die Epithelproliferation zeigt – wie das normale Milchgangepithel – eine unter dem luminalen Epithel gelegene, braun dargestellte Myoepithelschicht (CK5/6-positiv). 38 Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. Tab. 3.6 Grading der Tumorregression nach Sinn [47]. 3.2 Maligne Brustveränderungen 3.2.4 Duktale Carcinomata in situ b Abb. 3.14 Intraduktales papilläres Karzinom. a Auf den Milchgang beschränkte atypische Epithelproliferation (entspricht einem solitären papillären DCIS). b Die Myoepithelschicht ist – im Unterschied zum benignen Papillom – durch den neoplastischen Prozess verdrängt (immunhistochemisch negative Zytokeratin-CK5/6-Färbung). Mikropapilläres und solide-papilläres Karzinom Diese stellen 2 seltene Formen des invasiven Karzinoms dar (weniger als 1–2 % der Fälle): ● Mikropapilläres Karzinom: So werden Tumoren bezeichnet, bei denen die Tumorzellen scheinbar in Hohlräumen (meist Schrumpfartefakte) gelegen sind und die aus kleinen, teilweise zentral lumenbildenden Zellproliferaten bestehen (Mikropapillen ohne bindegewebiges Stroma). Diese Tumoren weisen häufiger Lymphknotenmetastasen auf und sind gegenüber Metastasen anderer mikropapillär wachsender Karzinome (Ovar, Harnblase, Lunge) abzugrenzen [38]. ● Solides papilläres Karzinom: Dabei handelt es sich um ein häufig neuroendokrin differenziertes Karzinom (Chromogranin-/Synpatophysin-positiv, ER- und PgR-positiv, HER2-negativ), das zumeist ein intraduktales Wachstumsmuster (umschriebene Nester) aufweist und dann als In-Situ-Karzinom klassifiziert wird. Schließlich sind die Läsionen von invasiven Karzinomen NST mit neuroendokriner Differenzierung und auch von Metastasen extramammärer neuroendokriner Tumoren bzw. Karzinome abzugrenzen. Intraduktale In-Situ-Anteile sprechen eher für eine intramammäre Genese [8]. 3 Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. a Das DCIS ist durch eine gleichartige („klonale“) neoplastische Epithelproliferation in den kleinen Drüsen- und größeren Milchgängen gekennzeichnet. Mit Einführung des Mammografie-Screenings ist die Inzidenz von DCIS bei Frauen über 50 Jahren um über 500 % von 2,4 auf 15,8 pro 100 000 Frauen angestiegen [42]. Gleichzeitig hat sich der Anteil von niedriggradigem DCIS (Grad 1 oder 2) von etwa 10 auf über 60 % erhöht. Die Risikofaktoren für das Auftreten von DCIS entsprechen weitgehend denjenigen des Mammakarzinoms. Die meisten Fälle von DCIS (mehr als 85 %) werden ohne jegliche klinische Symptomatik durch bildgebende Verfahren diagnostiziert (Indexbefund: Mikrokalk); nur etwa 10 % manifestieren sich in Form eines tastbaren Knotens, einer pathologischen Mamillensekretion oder eines Morbus Paget. Die Klassifikation des DCIS erfolgt vor allem nach dem Ausmaß der Kernatypie und dem Vorhandensein von Nekrosen. Kern-Grading (▶ Abb. 3.15 und ▶ Abb. 3.16): ● Grad 1: Kerndurchmesser kleiner als 2 Erythrozyten ● Grad 2: Kerndurchmesser gleich 2–3 Erythrozyten ● Grad 3: Kerndurchmesser größer als 3 Erythrozyten In Abhängigkeit vom Wachstumsmuster der die Gänge auskleidenden Zellen können solide (meist Grad 2 und 3), papilläre, mikropapilläre oder kribriforme Formen (meist Grad 1) mit und ohne Komedonekrosen (bei Grad 2–3) unterschieden werden. Neben der Größe ist in jedem Fall der Bezug zum Absetzungsrand (R-Status) anzugeben. Bei einem Abstand vom Resektionsrand von 5–10 mm liegt die Lokalrezidivrate zwischen 0 und 6 %. Diese Rate kann durch Nachbestrahlung um bis zu 50 % reduziert werden [51]. Mit zunehmender Größe (über 2,5 cm), Manifestation als Tumor und hochgradigem DCIS (Grad 3 mit Komedonekrosen) besteht ein erhöhtes Risiko, dass bereits Herde einer Mikroinvasion und damit auch Lymphknotenmetastasen vorliegen. Deshalb wird bei solchen Läsionen sicherheitshalber eine SLNUntersuchung (Sentinel-Node-Untersuchung) empfohlen [42]. Praxistipp Z ● Für die Einschätzung des Rezidivrisikos eines DCIS kann als Orientierungshilfe der Van-Nuys-Prognoseindex herangezogen werden, bei dem die Größe des DCIS, der Abstand vom Resektionsrand und der DCIS-Kernmalignitätsgrad herangezogen werden [45]. Die Prognose des DCIS ist mit 1–2 % karzinombedingten Todesfällen innerhalb von 10 Jahren nach Therapie günstig, wobei sich für brusterhaltendes und abladierendes Vorgehen identische Werte ergeben. Das Risiko, dass in der kontralateralen Brust ein Karzinom nach DCIS-Diagnose auftritt, wird mit 0,5–1 % pro Jahr angegeben und entspricht damit den Risikowerten bei manifestem Karzinom. 39 Pathologie benigner und maligner Brustveränderungen 3 a b 3.2.5 Mikroinvasive und invasive Mammakarzinome a Das Mammakarzinom ist der häufigste maligne Organtumor der Frau in Europa und Nordamerika. Das Robert Koch-Institut geht von fast 60 000 Neuerkrankungen in der Bundesrepublik aus [39]; dies macht etwa 29 % aller Malignome bei Frauen aus. Etwa jede 8. Frau (12 % aller Frauen) erkrankt im Lauf ihres Lebens an einem Mammakarzinom. Das durchschnittliche Erkrankungsalter liegt bei ca. 64 Jahren mit einem 1. Häufigkeitsgipfel zwischen dem 40. und 45. Lebensjahr (prämenopausaler Typ) und einem 2. nach der Menopause (postmenopausaler Typ). Etwa 80 % aller Mammakarzinome treten zwischen dem 35. und 75. Lebensjahr auf; nur 2 % der Frauen sind jünger als 35 Jahre. Männer erkranken etwa 100-mal seltener als Frauen (etwa 1 % der Malignome beim Mann entfallen auf das Mammakarzinom). Bei Frauen im Alter zwischen 35 und 60 Jahren ist jeder 2. Todesfall durch das Mammakarzinom bedingt. Nach Tumordiagnose beträgt die tumorbedingte 5-Jahres-Überlebensrate ca. 87 % [31]. Bei Männern ist die Prognose aufgrund der häufiger fortgeschrittenen Stadien bei Diagnosestellung insgesamt ungünstiger [37]. Das Mammakarzinom ist multifaktoriell bedingt, wobei hormonelle Einflüsse, Umweltfaktoren und der familiäre Hintergrund eine Rolle spielen [10]. Bis heute sind etwa 11 Gene identifiziert, die durch Mutation mit einem erhöhten Brustkrebsrisiko einhergehen. Die wichtigsten Mutationen betreffen BRCA1 und BRAC 2; bis zum 70. Lebensjahr erkranken etwa 70 % der BRCA1und 40 % der BRCA2-Mutationsträgerinnen an Brustkrebs [17]. Merke b Abb. 3.16 DCIS mit hohem Kern-Grading (Kerndurchmesser > Durchmesser von 3 Erythrozyten). a Zentrale Tumorzellnekrose. b Etwa 60–70 % dieser DCIS-high-Grade-Formen sind HER2-positiv. Im vorliegenden Fall zeigt sich in einem Gang (Pfeil) eine beginnende Mikroinvasion. 40 H ● Formalpathologisch entwickelt sich das Mammakarzinom vor allem aus dem DCIS, aus papillären Neoplasien mit Atypien und aus dem LCIS. Etwa 50 % aller Mammakarzinome entstehen auf dem Boden einer Präkanzerose (▶ Tab. 3.7). Das Mammakarzinom tritt bevorzugt im oberen äußeren Quadranten der Brust auf. Prozentualer Anteil in den verschiedenen Sektoren: ● 50 % im oberen äußeren Quadranten ● 15 % im oberen inneren Quadranten Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. Abb. 3.15 DCIS mit niedrigem Kern-Grading (Kerndurchmesser < Durchmesser von 2 Erythrozyten). a Das DCIS zeigt ein mikropapilläres Wachstumsmuster (links angrenzend: normaler Gang). b Im Unterschied zum normalen Gang mit stark CK5/6-positiven, braun angefärbten Myoepithelien fehlen diese im DCIS (rechts im Bild). 3.2 Maligne Brustveränderungen Tab. 3.7 Brustdrüsenerkrankungen und Brustkrebsrisiko (nach [7]). ● ● ● Befund Relatives Risiko (%) fibrozystische Mastopathie 0,9 duktale Hyperplasie 1,5–2,4 sklerosierende Adenose 1,7 radiäre Narbe < 4,5 (abhängig von Zahl und Größe der Läsionen) ALH 4,0 LCIS 8,0 DCIS 10,0–12,0 6 % im unteren inneren Quadranten 11 % im unteren äußeren Quadranten 17 % submamillär 3 a Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. In etwa 10–20 % der Fälle finden sich multiple Tumorherde in einer Brust, wobei es sich um 2 oder mehrere Herde in verschiedenen Quadranten (multizentrisches Karzinom) oder um Satellitenknoten in unmittelbarer Tumornachbarschaft (multifokales Karzinom) handeln kann. In 4 % der Fälle treten in beiden Brüsten Karzinome auf (bilaterales Karzinom). Die Tumorausbreitung erfolgt bevorzugt lymphogen und wird nach dem pTNM-System dokumentiert (s. ▶ Tab. 3.5). Die hämatogene Ausbreitung betrifft vor allem das Knochensystem (60–70 % der Fälle); es folgen Lunge und Pleura (60–70 %), Leber (50 %), Nebennieren und Perikard (je 30 %) sowie Ovarien (20 %). Andere Organe sind seltener befallen. Invasives Mammakarzinom (nicht spezieller Typ) Die Mehrzahl aller Mammakarzinome (60–75 %) entspricht dem invasiven Karzinom ohne spezifische Merkmale (NST). Diese Entität ist mit dem invasiv-duktalen Karzinom (NOS) der früheren WHO-Terminologie gleichzusetzen. Der invasive NST-Anteil sollte bei mindestens 50 % liegen; bewegt er sich zwischen 10–49 %, wird der Tumor als gemischtes Karzinom (NST + weiterer spezieller Typanteil) bezeichnet. Bei einem NST-Anteil von weniger als 10 % wird der Tumor nach der dominierenden Histologie entsprechend dem speziellen Subtyp klassifiziert. Makroskopisch handelt es sich um derbe, polyzyklische, grauweiße Knoten mit radiären Ausläufern (▶ Abb. 3.17a). Mikroskopisch finden sich ein oft faserreiches, tumorzellarmes Zentrum und eine tumorzellreiche Infiltrationszone. Etwa ⅓ der Tumoren zeigt ein szirrhöses und solides Wachstumsmuster. Besser differenzierte Tumorbereiche weisen tubuläre und glanduläre Abschnitte auf. In etwa 40 % der Tumoren finden sich gemischte Wachstumsmuster (solid-szirrhös-tubulär-medullär). Bei etwa 80 % der NST-Karzinome sind zusätzlich Herde eines DCIS ausgebildet [15]. Die aktuelle WHO-Klassifikation grenzt vom invasiven NSTKarzinom eigens das „mikroinvasive Karzinom“ ab. Typischerweise sind vor dem Hintergrund einer ausgedehnten DCIS-high-Grade-Läsion einzelne Herde eines eben (1 mm und weniger) infiltrierenden Karzinoms zu finden. b Abb. 3.17 Invasives Mammakarzinom. a Schnittfläche einer Mammatumorexzision mit zentral grau-weißem, unscharf begrenztem Tumorherd (T) und zentraler Einblutung nach Biopsie. Absetzungsränder farbig markiert (b = basal, v = ventral, m = medial, l = lateral). b Histologie des Stichkanals mit einzelnen verschleppten Tumorzellgruppen, im Unterschied zur echten Tumorzellinvasion von Granulationsgewebe umgeben; dies ist häufiger bei papillären intraduktalen Neoplasien zu beobachten und darf auf keinen Fall als Invasion fehlgedeutet werden. Cave: fehlerhaftes Staging! Merke H ● Bei vorausgegangener Biopsie kann die Diagnose der Invasion eines Mammakarzinoms schwierig sein und sollte vor allem dann zurückhaltend gestellt werden, wenn z. B. die vermeintlichen Tumorzellen von Granulationsgewebe umgeben sind (▶ Abb. 3.17b). 41 Pathologie benigner und maligner Brustveränderungen Invasives lobuläres Mammakarzinom Das ILC (invasiv-lobuläres Karzinom; ▶ Abb. 3.18) ist durch nicht kohäsiv wachsende, relativ kleine, runde Zellen mit bestimmtem Infiltrationsmuster (Gänsemarschformation) gekennzeichnet. Die Häufigkeit liegt bei 10–15 % der invasiven Mammakarzinome, das mittlere Alter der Patienten bei 63 Jahren. Makroskopisch sind lobuläre Karzinome oft besser zu tasten als zu sehen. Mikroskopisch handelt es sich um ein kleinzelliges stromareiches Karzinom. Die häufig PAS-positiven Zellen bilden Reihen im dichten Stroma (sog. Indian File Pattern) oder Ringe um erhaltene Milchgänge (sog. Targetoid Pattern). In bis zu 80 % der Fälle finden sich auch Areale mit einem LCIS. Im Unterschied zum IDC treten lobuläre Karzinome häufiger multizentrisch und bila- 3 teral auf (8–19 % der Fälle). Zusätzlich zum klassischen Typ lassen sich Varianten (tubulolobulär, alveolär, solide, pleomorph, Siegelringzelltyp u. a.) abgrenzen, mit im Vergleich zum klassischen Typ zum Teil unterschiedlichem Verlauf [20]. HER2-Positivität ist im typischen ILC eine Rarität, beim pleomorphen Typ jedoch in bis zu 30 % der Fälle nachweisbar. Für die Abgrenzung z. B. eines HER2-positiven NST von einem HER2-positiven pleomorphen ILC eignet sich der immunhistochemische Nachweis von E-Cadherin, das bei ca. 90 % der lobulären Neoplasien und ILC komplett ausgefallen ist, während die NST es typischerweise exprimieren. Die Prognose des ILC ist in den ersten 10 Jahren wohl etwas günstiger als die des invasiven (duktalen) NST-Karzinoms. Der Langzeitverlauf ist dann aber aufgrund der vom NST abweichenden Fernmetastasierung (Knochen, Gastrointestinaltrakt, Uterus, Meningen, Ovarien, serosal) eher ungünstiger [24]. a b Abb. 3.18 Gemischtes invasives Mammakarzinom. a Duktaler (rechts: E-Cadherin-positiv) und lobulärer Anteil (links: ECadherin-negativ). b Histologisch unterschiedliches Wachstumsmuster: rechts duktaler Typ bzw. NST mit kleinen kohäsiven Zellnestern in fibrösem Stroma (Malignitätsgrad 2); links lobuläres Karzinom mit kleinen, gleichförmigen Kernen im „Gänsemarsch“ (sog. Indian File Pattern) angeordnet (ebenfalls Malignitätsgrad 2). 42 Dies ist ein meist kleiner (0,2–2 cm), aus tubulären offenen Drüsen aufgebauter, hochdifferenzierter invasiver Tumor mit besonders günstiger Prognose (5-Jahres-Überlebensrate 90–100 %). Dem einreihigen Epithel fehlt eine Myoepithelschicht im Unterschied zur sklerosierenden Adenose und der radiären Narbe (jeweils CK5/6-positiv; ▶ Abb. 3.19). Die mikroglanduläre Adenose allerdings ist auch CK5/6-negativ, aber im Unterschied zum tubulären Karzinom S 100-positiv (s. Kap. 3.1.3). Eine weitere hochdifferenzierte Neoplasie mit siebartig formierten Zellnestern, die nur eine geringe Zellpleomorphie und kaum Mitosen zeigen, ist das kribriforme Karzinom. Die Prognose beider Tumoren ist exzellent (10-Jahres-Überlebensrate 90–100 %) [36]. Abb. 3.19 Tubuläres Mammakarzinom (G1). Unscharf begrenzte Tumordrüsen (Tubuli), die aus einlagigem, kaum atypischem Epithel aufgebaut sind (Inset); im Unterschied zur radiären Narbe fehlt beim tubulären Karzinom die Myoepithelschicht (vgl. ▶ Abb. 3.4d). (aus Bock K, Ramaswamy A, Köhler H. Fortbildungskurs zur Aufrechterhaltung und Weiterentwicklung der fachlichen Befähigung für Pathologen [6.10.2012] – Referenzzentrum Mammographie Südwest am Universitätsklinikum Gießen-Marburg am Standort Marburg [Kursskript]) Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. Tubuläres und kribriformes Karzinom 3.2 Maligne Brustveränderungen Karzinom mit medullären Merkmalen Diese Tumorgruppe setzt sich aus folgenden Entitäten zusammen: ● medulläres Karzinom (M8510/3) ● atypisches medulläres Karzinom (M8513/3) ● invasives Karzinom NST mit medullären Merkmalen (M8500/3) 3 Abb. 3.20 Medulläres Karzinom. Deutlich atypische, unscharf begrenzte Tumorzellen und zahlreiche Mitosen (entsprechend G3). Am rechten Bildrand typisches lymphozytäres Stromainfiltrat. Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. Diese Tumoren sind insbesondere in der typischen medullären Form durch scharfe Begrenzung und relativ weiche Konsistenz gekennzeichnet; sie können initial mit benignen Läsionen verwechselt werden. In typischen Fällen dominieren synzytiale (mehr als 75 % der Fälle), deutlich atypische Zellverbände mit dichter, lymphoplasmazellulärer Stromainfiltration (▶ Abb. 3.20); angrenzende intraduktale Tumoranteile sind nicht nachweisbar. Der Altersgipfel liegt bei 55 Jahren. Obwohl das Biomarkerprofil sich typischerweise als triple-negativ (ER-, PgR- und HER2-negativ) und hochproliferativ (Ki67 über 50 %) erweist, ist die Prognose günstig (10-Jahres-Überlebensrate über 80 %): Dies wird vor allem dem Entzündungszellinfiltrat zugeschrieben (bessere Immunabwehr?). Abweichende morphologische Befunde mit nur geringer Entzündungszellreaktion und intraduktaler Ausbreitung am Rand werden als atypische medulläre Karzinome bezeichnet. Die Prognose liegt zwischen der des typischen medullären Karzinoms und derjenigen des NST-Karzinoms [21]. Erwähnenswert ist auch, dass Frauen mit BRCA1-assoziierter Krebsdisposition deutlich häufiger Karzinome mit medullären Merkmalen aufweisen (13 versus 2 %) [27]. Muzinöses Karzinom Muzinproduzierende Karzinome sind gut abgegrenzte Tumoren mit gallertiger Schnittfläche und ausgedehnter extra- oder intrazellulärer Schleimbildung (▶ Abb. 3.21). Sie treten bevorzugt im höheren Lebensalter (über 55–68 Jahren) auf. Die Prognose ist günstiger als beim NST-Karzinom. Siegelringzellkarzinome können als Variante sowohl des lobulären als auch des duktalen NSTKarzinoms auftreten. Die Prognose ist dementsprechend variabel. a Metaplastisches Karzinom Metaplastische Karzinome stellen eine heterogene Karzinomgruppe dar, bei der eine Mischung eines Adenokarzinoms mit wechselnden Anteilen von spindelartigen, plattenepithelialen oder auch mesenchymalen (chondroiden und knöchernen) Bestandteilen vorliegt. Plattenepithelmetaplasien kommen bei 5 % der Mammakarzinome vor. Reine Plattenepithelkarzinome sind eine Rarität. Sarkomatoide, spindelzellförmige Wachstumsformen (Spindelzellkarzinom) sind von Karzinosarkomen mit atypischer epithelialer (Keratin-positiv) und atypischer mesenchymaler Komponente (Vimentin-positiv) abzugrenzen. Die Prognose ist insbesondere bei Karzinosarkomen ungünstig. Inflammatorisches Mammakarzinom Beim inflammatorischen Karzinom (Häufigkeit: zwischen 1 und 10 % aller Mammakarzinome) liegt eine besonders ausgeprägte Lymphangiosis carcinomatosa vor, die mit lokalen Entzündungszeichen (Rötung, Wärme und Schmerz) einhergeht. Diese Tumoren zeigten bislang eine besonders ungünstige Prognose. Mit Einführung neoadjuvanter Therapien und dem Nachweis von HER2- b Abb. 3.21 Muzinöses Mammakarzinom. (aus Bock K, Ramaswamy A, Köhler H. Fortbildungskurs zur Aufrechterhaltung und Weiterentwicklung der fachlichen Befähigung für Pathologen [6.10.2012] – Referenzzentrum Mammographie Südwest am Universitätsklinikum Gießen-Marburg am Standort Marburg [Kursskript]) a Glasige Schnittfläche aufgrund starker Schleimbildung. b Histologisch in Schleimseen (zellfrei durchscheinend) eingebettete Tumorzellgruppen (blaue Zellnester). 43 Pathologie benigner und maligner Brustveränderungen Positivität in ca. 40 % der Fälle haben sich neue, zielgerichtete Therapieoptionen ergeben und damit auch eine verbesserte Überlebensrate von 25–50 %. Neuerdings wurden auch Amplifikationen des Gens der alkalischen Phosphatase nachgewiesen, was wiederum die Therapieoptionen erweitern dürfte [9]. 3.2.6 Tumoren der Brustwarze Die metastatische intraepidermale Ausbreitung von großen, hellen Zellen eines Milchgangkarzinoms in der Mamillenregion wird als Morbus Paget oder Paget-Karzinom bezeichnet (▶ Abb. 3.22). Sie tritt bei etwa 1–4 % der Milchgangkarzinome auf; in ca. 40 % der Fälle liegt ein intraduktales, in 60 % ein invasives Mammakarzinom NST mit meist hochgradigem Malignitätsgrad zugrunde. Mikroskopisch lassen sich vom Stratum germinativum aufsteigende, meist einzeln oder in kleinen Gruppen liegende, große Zellen mit hellem Zytoplasma (Paget-Zellen) nachweisen. Diese reagieren intensiv positiv mit dem Zytokeratin CK7 und sind meistens (90 % der Fälle) HER2-positiv. Klinisch kommt es zu einer sich langsam ausbreitenden, ekzemartigen Mamilleneffloreszenz mit Ulzeration (Krebsekzem) [44]. a 3.2.7 Maligne mesenchymale Tumoren und Lymphome der Mamma Primäre Sarkome (▶ Abb. 3.23) entsprechen histopathologisch im Prinzip den extramammären Tumoren, leiten sich aber zum Teil von mammaeigenen Läsionen (z. B. Phyllodestumor) ab und können sich sekundär nach Strahlenbehandlung eines Mammakarzinoms (Angiosarkom) entwickeln. Etwa 1 % der malignen Neoplasien der Brust sind Sarkome. Ihre genaue Diagnose und Klassifikation erfordert den Einsatz von Zusatzmethoden (Immunhis- b b c a c Abb. 3.22 Morbus Paget der Mamille. a Morbus Paget der Mamille, hier assoziiert mit High-Grade-DCIS in einzelnen retromamillären Gängen (unterer Bildrand). b Das Plattenepithel der Mamillenhaut ist mit hellen, atypischen Paget-Zellen durchsetzt. c Die Paget-Zellen sind typischerweise HER2-positiv. 44 Abb. 3.23 Sarkome. (aus Bock K, Ramaswamy A, Köhler H. Fortbildungskurs zur Aufrechterhaltung und Weiterentwicklung der fachlichen Befähigung für Pathologen [6.10.2012] – Referenzzentrum Mammographie Südwest am Universitätsklinikum Gießen-Marburg am Standort Marburg [Kursskript]) a Histologisches Bild eines Angiosarkoms mit unregelmäßigen, teils spaltförmigen, blutgefüllten, atypisch verzweigten Gefäßen. Diese typischerweise sekundär nach Bestrahlung eines Mammakarzinoms auftretenden Tumoren sind durch Amplifikation des c-myc-Onkogens gekennzeichnet [30]. b Schnittfläche eines Leiomyosarkoms der Mamma mit Ausbildung von Nekrosehöhlen (grün markiertes Areal). c Histologisch aus Spindelzellen aufgebauter, mitosereicher Tumor (Pfeile). Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. 3 3.2 Maligne Brustveränderungen tochemie, Molekularpathologie). Die Prognose ist selbst bei hochdifferenzierten Neubildungen (z. B. Liposarkom) schlechter als bei Karzinomen. Merke ● H Maligne Lymphome betreffen die Mamma meist sekundär. Primäre lymphoide Proliferationen sind selten und gegenüber Pseudolymphomen (Lymphadenosis benigna cutis Bäfverstedt) abzugrenzen [49]. [13] Decker T, Böcker W. Prognostische und prädiktive Faktoren. In: Dietel M, Klöppel G, Hrsg. Pathologie: Mamma, weibliches Genitale, Schwangerschaft und Kindererkrankungen. 3. Aufl. Berlin: Springer; 2013: 184–201 [14] Dowsett M, Nielsen TO, A’Hern R et al.; International Ki-67 in Breast Cancer Working Group. Assessment of Ki67 in breast cancer: recommendations from the International Ki67 in Breast Cancer Working Group. J Natl Cancer Inst 2011; 103: 1056–1064 [15] Ellis IO, Collins L, Ichihara S et al. Invasive carcinoma of no special type. In: 3 Lakhani SR, Ellis IO, Schnitt SJ et al., eds. WHO classification of tumours of the breast. 4th ed. Lyon: International Agency for Research on Cancer (IARC); 2012: 34–38 [16] Elston CW, Ellis IO. Pathological prognostic factors in breast cancer. I. The value of histological grade in breast cancer: experience from a large study with long-term follow-up. Histopathology 1991; 19: 403–410 Bei etwa 0,3–1,3 % der Malignome in der Brust handelt es sich um sekundär in die Mamma metastasierte Neoplasien. Dies sind vor allem maligne Lymphome und Hämoblastosen, die das Organ im Rahmen einer Generalisation infiltrieren; des Weiteren zählen dazu das maligne Melanom, das Bronchialkarzinom, Karzinome von Niere und Magen u. a. Die Prognose ist durch das jeweilige Grundleiden bestimmt. Schnitt SJ et al., eds. WHO classification of tumors oft he breast. 4th ed. Lyon: IARC; 2012: 176–178 [18] Goldhirsch A, Wood WC, Coates AS et al. Strategies for subtypes – dealing with the diversity of breast cancer: highlights of the St. Gallen International Expert Consensus on the Primary Therapy of Early Breast Cancer 2011. Ann Oncol 2011; 22: 1736–1747 [19] Hammond ME, Hayes DF, Dowsett M et al. American Society of Clinical Onco- Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. 3.2.8 Metastatische Tumoren [17] Goldgar D, Devilee P. BRCA1 and BRCA2 syndromes. In: Lakhani SR, Ellis IO, logy/College of American Pathologists guideline recommendations for immunohistochemical testing of estrogen and progesterone receptors in breast cancer. Arch Pathol Lab Med 2010; 134: 907–922 [20] Iorfida M, Maiorano E, Orvieto E et al. Invasive lobular breast cancer: subtypes Literatur [1] Böcker W. Histologie, fibrozystische Mastopathie und seltene benigne Läsionen. In: Dietel M, Klöppel G, Hrsg. Pathologie: Mamma, weibliches Genitale, Schwangerschaft und Kindererkrankungen. 3. Aufl. Berlin: Springer; 2013: 4– 22 [2] Böcker W. Entzündungen. In: Dietel M, Klöppel G, Hrsg. Pathologie: Mamma, weibliches Genitale, Schwangerschaft und Kindererkrankungen. 3. Aufl. Berlin: Springer; 2013: 24–32 and outcome. Breast Cancer Res Treat 2012; 133: 713–723 [21] Jacquemier J, Bertucci F, Finetti P et al. High expression of indoleamine 2,3dioxygenase in the tumour is associated with medullary features and favourable outcome in basal-like breast carcinoma. Int J Cancer 2012; 130: 96–104 [22] Kong X, Moran MS, Zhang N et al. Meta-analysis confirms achieving pathological complete response after neoadjuvant chemotherapy predicts favourable prognosis for breast cancer patients. Eur J Cancer 2011; 47: 2084–2090 [23] Korsching E, Jeffrey SS, Meinerz W et al. Basal carcinoma of the breast revisited: an old entity with new interpretations. J Clin Pathol 2008; 61: 553–560 [3] Böcker W. Aufarbeitung und Beurteilung von Biopsien, Operationspräparaten [24] Lakhani SR, Ellis IO, Schnitt SJ et al., eds. WHO classification of tumours of the und axillären Lymphknoten. In: Dietel M, Klöppel G, Hrsg. Pathologie: Mam- breast. 4th ed. Lyon: International Agency for Research on Cancer (IARC); ma, weibliches Genitale, Schwangerschaft und Kindererkrankungen. 3. Aufl. Berlin: Springer; 2013: 240–250 2012 [25] Lakhani SR, Hayes M, Eusebi V. Adenomyoepithelioma and adenomyoepithe- [4] Böcker W, Decker T. Benigne proliferative Erkrankungen. In: Dietel M, Klöppel lioma with carcinoma. In: Lakhani SR, Ellis IO, Schnitt SJ et al., eds. WHO clas- G, Hrsg. Pathologie: Mamma, weibliches Genitale, Schwangerschaft und Kin- sification of tumours of the breast. 4th ed. Lyon: International Agency for Re- dererkrankungen. 3. Aufl. Berlin: Springer; 2013: 34–65 search on Cancer (IARC); 2012: 122–123 [5] Böcker W, Decker T. Intraepitheliale Neoplasien. In: Dietel M, Klöppel G, Hrsg. [26] Lakhani SR, Schnitt SJ, O’Malley F et al. Lobular neoplasia. In: Lakhani SR, Ellis Pathologie: Mamma, weibliches Genitale, Schwangerschaft und Kinder- IO, Schnitt SJ et al., eds. WHO classification of tumours of the breast. 4th ed. erkrankungen. 3. Aufl. Berlin: Springer; 2013: 94–124 Lyon: International Agency for Research on Cancer (IARC); 2012: 78–80 [6] Böcker W, Tiemann M. Mesenchymale Tumoren und maligne Lymphome. In: [27] Lakhani SR, van de Vijver MJ, Jacquemier J et al. Histopathological features of Dietel M, Klöppel G, Hrsg. Pathologie: Mamma, weibliches Genitale, Schwan- BRCA1- and BRCA2-associated breast cancers. In: Lakhani SR, Ellis IO, Schnitt gerschaft und Kindererkrankungen. 3. Aufl. Berlin: Springer; 2013: 212–226 SJ et al., eds. WHO classification of tumours of the breast. 4th ed. Lyon: Inter- [7] Bürger H, Böcker W. Karzinogenese der Mammakarzinome. In: Dietel M, Klöppel G, Hrsg. Pathologie: Mamma, weibliches Genitale, Schwangerschaft und Kindererkrankungen. 3. Aufl. Berlin: Springer; 2013: 73–88 [8] Bussolati G, Badve S. Carcinomas with neuroendocrine features. In: Lakhani SR, Ellis IO, Schnitt SJ et al., eds. WHO classification of tumours of the breast. 4th ed. Lyon: International Agency for Research on Cancer (IARC); 2012: 62– 63 [9] Charafe-Jauffret E, Tsuda H, Rutgers E. Inflammatory carcinoma. In: Lakhani SR, Ellis IO, Schnitt SJ et al., eds. WHO classification of tumours of the breast. 4th ed. Lyon: International Agency for Research on Cancer (IARC); 2012: 67– 68 national Agency for Research on Cancer (IARC); 2012: 180–181 [28] Leitlinienprogramm Onkologie der AWMF, Deutschen Krebsgesellschaft e.V und Deutschen Krebshilfe e. V. Leitlinienreport der S 3-Leitlinie fur die Diagnostik, Therapie und Nachsorge des Mammakarzinoms. AWMF RegisterNr. 032–045OL. München: W. Zuckschwerdt; 2012 [29] MacGrogan G, Tse G, Collins L et al. Intraductal papillary carcinoma. In: Lakhani SR, Ellis IO, Schnitt SJ et al., eds. WHO classification of tumours of the breast. 4th ed. Lyon: International Agency for Research on Cancer (IARC); 2012: 103–105 [30] Mentzel T, Schildhaus HU, Palmedo G et al. Postradiation cutaneous angiosarcoma after treatment of breast carcinoma is characterized by MYC amplifi- [10] Colditz G, Chia KS. Invasive breast cancer: introduction and general features. cation in contrast to atypical vascular lesions after radiotherapy and control In: Lakhani SR, Ellis IO, Schnitt SJ et al., eds. WHO classification of tumours of cases: clinicopathological, immunohistochemical and molecular analysis of the breast. 4th ed. Lyon: International Agency for Research on Cancer (IARC); 2012: 14–17 [11] Collins L, O’Malley F, Visscher D et al. Encapsulated papillary carcinoma. In: Lakhani SR, Ellis IO, Schnitt SJ et al., eds. WHO classification of tumours of the breast. 4th ed. Lyon: International Agency for Research on Cancer (IARC); 2012: 106–107 [12] Colombo C, Foo WC, Whiting D et al. FAP-related desmoid tumors: a series of 44 patients evaluated in a cancer referral center. Histol Histopathol 2012; 27: 641–649 66 cases. Mod Pathol 2012; 25: 75–85 [31] Ministerium für Gesundheit und Verbraucherschutz Saarland. Epidemiologisches Krebsregister Saarlands. Im Internet: http://www.krebsregister.saarland.de/datenbank/datenbank.html; Stand: 27.02.2013 [32] Moritani S, Kushima R, Sugihara H et al. Availability of CD10 immunohistochemistry as a marker of breast myoepithelial cells on paraffin sections. Mod Pathol 2002; 15: 397–405 [33] Non-operative diagnosis subgroup of the National Coordinating Group for Breast Screening Pathology (NSHBSP). Guidelines for non-operative diagnos- 45 Pathologie benigner und maligner Brustveränderungen programmes: NHSBSP publication No. 50; 2001 [34] O’Malley F, Visscher D, MacGrogan G et al. Intraductal Papilloma. In: Lakhani noma in situ: fine tuning the University of Southern California/Van Nuys Prognostic Index. J Natl Cancer Inst Monog 2010; 41: 193–196 SR, Ellis IO, Schnitt SJ et al., eds. WHO classification of tumours of the breast. [46] Simpson JF, Schnitt DJ, Visscher D et al. Atypical ductal hyperplasia. In: Lakha- 4th ed. Lyon: International Agency for Research on Cancer (IARC); 2012: 100– ni SR, Ellis IO, Schnitt SJ et al., eds. WHO classification of tumours of the bre- 102 ast. 4th ed. Lyon: International Agency for Research on Cancer (IARC); 2012: [35] Perou CM, Sorlie T, Eisen MB et al. Molecular portraits of human breast tumours. Nature 2000; 406: 747–752 3 [45] Silverstein MJ, Lagios MD. Choosing treatment for patients with ductal carci- [36] Rakha E, Pinder SE, Shin SJ et al. Tubular carcinoma and cribriform carcinoma. In: Lakhani SR, Ellis IO, Schnitt SJ et al., eds. WHO classification of tumours of the breast. 4th ed. Lyon: International Agency for Research on Cancer (IARC); 2012: 43–45 [37] Reiner A, Badve S. Carcinoma of the male breast. In: Lakhani SR, Ellis IO, Schnitt SJ et al., eds. WHO classification of tumours of the breast. 4th ed. Lyon: International Agency for Research on Cancer (IARC); 2012: 168–169 [38] Reis-Filho JS, Ellis OI. Invasive micropapillary carcinoma. In: Lakhani SR, Ellis IO, Schnitt SJ et al., eds. WHO classification of tumours of the breast. 4th ed. Lyon: International Agency for Research on Cancer (IARC); 2012: 65–66 [39] Robert Koch-Institut. Krebs in Deutschland 2005/2006. Häufigkeiten und Trends. 7. Ausg. Berlin: GEK/D; 2010 [40] Rüschoff J, Emons G, Gebert G et al. Weibliches Genitale. In: Thomas C, Hrsg. Grundlagen der klinischen Medizin. Bd 7. Stuttgart: Schattauer; 1993: 137– 151 [41] Rüschoff J, Böcker W. Östrogen- und Progesteronrezeptoren sowie Her2. In: Dietel M, Klöppel G, Hrsg. Pathologie: Mamma, weibliches Genitale, Schwan- 88–89 [47] Sinn HP, Schmid H, Junkermann H et al. Histologic regression of breast cancer after primary (neoadjuvant) chemotherapy. Geburtshilfe Frauenheilkd 1994; 54: 552–558 [48] Sinn HP, Helmchen B, Aulmann S. Konzept und Problematik der lobulären Neoplasie. Pathologe 2006; 27: 373–380 [49] Tavassoli FA, Eusebi V. Tumors of the mammary gland. AFIP Atlas of tumor pathology. Fouth Series, Fascicle 10. Washington DC: ARP; 2009 [50] von Minckwitz G. Neoadjuvant chemotherapy in breast cancer-insights from the German experience. Breast Cancer 2012; 19: 282–288 [51] Wapnir IL, Dignam JJ, Fisher B et al. Long-term outcomes of invasive ipsilateral breast tumor recurrences after lumpectomy in NSABP B-17 and B-24 randomized clinical trials for DCIS. J Natl Cancer Inst 2011; 103: 478–488 [52] Wittekind C, Meyer H-J, Hrsg. TNM Klassifikation maligner Tumoren. 7. Aufl. Weinheim: Wiley-VCH; 2010 [53] Wolff AC, Hammond ME, Schwartz JN et al. American Society of Clinical Oncology/College of American Pathologists guideline recommendations for human epidermal growth factor receptor 2 testing in breast cancer. Arch Pathol Lab Med 2007; 131: 18–43 gerschaft und Kindererkrankungen. 3. Aufl. Berlin: Springer; 2013: 168–181 [42] Schnitt SJ, Allred C, Britton P et al. Ductal carcinoma in situ. In: Lakhani SR, Ellis IO, Schnitt SJ et al., eds. WHO classification of tumours of the breast. 4th Danksagung ed. Lyon: International Agency for Research on Cancer (IARC); 2012: 90–94 [43] Schnitt SJ, Ellis IO, van de Vijver MJ et al. Intraductal proliferative lesions: introduction and overview. In: Lakhani SR, Ellis IO, Schnitt SJ et al., eds. WHO classification of tumours of the breast. 4th ed. Lyon: International Agency for Research on Cancer (IARC); 2012: 82–83 [44] Shousha S, Eusebi V, Lester S. Paget disease of the nipple. In: Lakhani SR, Ellis IO, Schnitt SJ et al., eds. WHO classification of tumours of the breast. 4th ed. Lyon: International Agency for Research on Cancer (IARC); 2012: 152–153 46 Für die großzügige Überlassung der Abbildungen 3.2, 3.4c und d, 3.5a und b, 3.6, 3.9c und d, 3.19, 3.21 und 3.23 aus dem Mammografie-Fortbildungskurs 10/1012 (Referenzzentrum Mammografie Südwest) sei Frau Dr. A. Ramaswamy (Inst. für Pathologie, Universität Marburg) und Herrn Dr. H. Köhler (Gemeinschaftspraxis für Pathologie, Marburg) ausdrücklich gedankt. Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. tic procedures and reporting in breast cancer screening. NHS cancer screening Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. II Mammadiagnostik











