Atom-, Molekül- und Festkörperphysik
Werbung

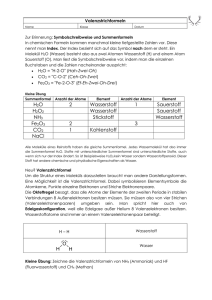
Atom-, Molekül- und Festkörperphysik für LAK, SS 2014 – Peter Puschnig basierend auf Unterlagen von Prof. Ulrich Hohenester 4. Vorlesung, 27. 3. 2014 Molekülbindung, H2+ - Molekülion, Hybridisierung, Kohlenstoffverbindungen Warum binden Moleküle ? Warum binden Moleküle ? Kovalente versus ionische Bindung Kovalent … Zwei Atome teilen sich ein Elektron Ionisch … Ein Elektron wechselt von einem Atom zum anderen Wasserstoff-Brücken Wasserstoffbrückenbindungen sind Bindungen elektrostatischer Natur. Ihre Stärke liegt unter denen der kovalenten Atombindung und der ionischen Bindungen. Sie beruht im Wasser darauf, dass die elektrischen Ladungen auf H- und O-Atomen asymmetrisch verteilt sind: am Sauerstoffatom negativ, an den Wasserstoffatomen positiv. Diese Ladungen benachbarter Moleküle ziehen sich gegenseitig an und so bilden sich Ketten und größere Gruppen (Cluster). Die einzelnen Wassermoleküle sind somit nicht frei beweglich und benötigen z. B. zum Übergang in den gasförmigen Zustand viel Energie, d. h., der Siedepunkt des Wassers liegt verhältnismäßig hoch. Van-der-Waals Wechselwirkungen 1. Wechselwirkung zwischen zwei Dipolen: 2. Wechselwirkung zwischen einem Dipol und einem polarisierbaren Molekül (oder Atom) Ar 3. Wechselwirkung zwischen zwei polarisierbaren Molekülen (=London-Dispersionswechselwirkung) + Ar – Stärke von Bindungen Bindungsart Typische Bindungs-Dissoziierungsenergie (eV) kovalent H-H (4.52 eV) H-Brücken O-H … O (ca. 0.15 eV) Dipol-Dipol ca. 0.005 – 0.020 eV London (van-der-Waals) < 0.010 eV C-H (4.25 eV) N-N (9.7 eV) Das Wasserstoff – Molekülion H2+ Das Wasserstoff – Molekülion H2+ Das Wasserstoff – Molekülion H2+ Ansatz für Wellenfunktion Überlappen der Wellenfunktionen Das Wasserstoff – Molekülion H2+ Ansatz für Wellenfunktion Schrödingergleichung für H – Atom Bindungsenergie Überlappintegral Coulombsche Wecheslwirkungsenergie Austauschintegral … hat nichts mit Fermionen zu tun ! Das Wasserstoff – Molekülion H2+ Coulombsche Matrixelemente Überlappintegral Coulombsche Wecheslwirkungsenergie Austauschintegral … hat nichts mit Fermionen zu tun ! Das Wasserstoff – Molekülion H2+ Schrödingergleichung Schrödingergleichung für Koeffizienten Matrixgleichung Wie sehen Lösungen aus ? Das Wasserstoff – Molekülion H2+ Determinante Eigenenergie Koeffizienten symmetrisch Eigenfunktionen antisymmetrisch Das Wasserstoff – Molekülion H2+ symmetrisch antisymmetrisch Das Wasserstoff – Molekülion H2+ symmetrisch antisymmetrisch • S nicht entscheidend • C wird durch Kernabstoßung kompensiert • Bindung aufgrund von D: Elektron springt zwischen a und b hin und her, und profitiert von der Anziehung beider Kerne Das Wasserstoff – Molekülion H2+ Abstandsabhängigkeit des Molekülions H2+ Starke Kernabstoßung für kleine Rab Energieaufspaltung 2 x D H2+ : EBindung ~ 1.7 eV (experimentell 2.6 eV) LCAO - Verfahren Linear Combination of Atomic Orbitals Wellenfunktion wird als Linearkombination von Atomorbitalen angeschrieben Beispiel: CH – Verbindungen aus der organische Chemie C – Atom 1s2 2s2 2p2 (6 Elektronen) Hybridisierung Idee: es sollen solche Linearkombinationen der s – und p – Orbitale gewählt werden, die die chemischen Bindungen besonders gut beschreiben Vier zueinander orthogonale Wellenfunktionen, die bereits die richtige Symmetrie besitzen Hybridisierung Idee: es sollen solche Linearkombinationen der s – und p – Orbitale gewählt werden, die die chemischen Bindungen besonders gut beschreiben Bestimmung der Koeffizienten c1, c2, … aus Variationsverfahren Vorteil der Hybridisierung: kleiner Basissatz, einfaches physikalisches (chemisches) Verständnis Hybridisierung Trigonale Hybridisierung Ethylen (Ethen) … zusätzliche Bindung der freien pz – Orbitale liefern Doppelbindung Kohlenstoff – sp3: Diamant, Methan Kohlenstoff – sp2: Graphit, Ethen Ethen (auch Äthen, Ethylen oder Äthylen) ist eine gasförmige, farblose, brennbare, süßlich riechende organische Verbindung mit der Summenformel C2H4. Kohlenstoff – sp2: C60, Nanoröhrchen Kohlenstoff – sp1: Ethin Ethin (Trivialname: Acetylen) ist ein farbloses Gas mit der Summenformel C2H2. Es ist der einfachste Vertreter aus der homologen Reihe der Alkine. Ethin ist von großer industrieller Bedeutung. Es dient in großen Mengen als Ausgangsverbindung bei der großtechnischen Herstellung von wichtigen Grundchemikalien. Darüber hinaus hat es eine Bedeutung als Dissousgas beim autogenen Schweißen und Schneiden.