V12 - EBV,HHV8 für Handout - UK
Werbung

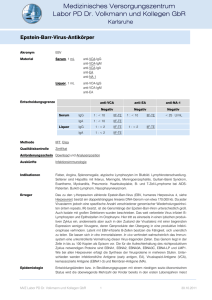
Phylogenetische Beziehungen der Herpesviren !-Herpesviren Herpesviren und Tumoren HHV-8 "-Herpesviren H. Pfister #-Herpesviren • EBV kommt weltweit vor, der einzige bekannte natürliche Wirt ist der Mensch • EBV führt zu einer fast vollständigen Durchseuchung • die Durchseuchung verläuft in drei Stufen: Kleinkinder etwas langsamer bei älteren Kindern Zunahme der Infektionen bei Erreichen der Pubertät (Kissing Disease) Prävalenz von EBV in Deutschland EBV-positiv (%) Epidemiologie der EpsteinBarr-Virus (EBV)-Infektion 100 90 80 70 60 50 40 30 20 10 0 0 2 4 6 8 10 12 14 16 18 2020 30 40 50 Alter in Jahren 3254 Seren aus der Uniklinik Homburg 60 Epstein-Barr-Virus (EBV) Pathogenese der EBV Erkrankung bei der primären Virämie Eintrittspforte: Oropharynx Lytische Infektion von Epithelzellen der Schleimhäute und Speicheldrüsen Virämie: Es kommt sehr schnell zu einer Generalisierung mit Virämie, EBV infiziert B-Zellen. EBV verursacht entweder den Tod der infizierten Zellen oder es kommt zu einer Zelltransformation mit Ausbildung einer latenten Infektion (in unreifen B-Zellen) Zelle B T Mononukleose Klinik der EBV-Infektion Unter 4 Jahren selten klinisch apparent Bei jungen Erwachsenen in ca. 50% Manifestation als infektiöse Mononukleose (Pfeiffersches Drüsenfieber) Fieber 80-90% Pharyngitis 75-90% Lymphadenopathie 80-90% Splenomegalie 40-70% Hepatomegalie 10% Exanthem (Ampicillin oder Amoxicillin-Gabe) Unspezifische Symptome: Abgeschlagenheit, Kopfschmerzen, Schwindel, Erbrechen, Muskel-, Abdominalschmerzen Komplikationen der EBVInfektion • Milzruptur • aplastische Anämie, Panzytopenie, hämolytische Anämie, behandlungsbedürftige Thrombozytopenie • Enzephalitis, Cerebellitis • Krampfanfälle • Meningitis • Facialis-Parese, Guillain-Barre-Syndrom • Pneumonie • Myokarditis • schwere Hepatitis, Leberkoma, Reye-Syndrom • Orchitis EBV Antigene Lytisches Stadium Latentes Stadium Antikörpernachweis während der Primärinfektion Zelle Symptome B Infektion VCA-IgM Virus-Capsid-Antigen (VCA) Early Antigen (EA) VCA-IgG EBNA-1-IgG EBV nukleäre Antigene (EBNA) EBV als kausale Ursache des Burkitt-Lymphoms? Pro: • Isolation von EBV aus Zellen eines Burkitt-Lymphoms • hohe Antikörper-Titer gegen EBV bei Patienten mit Burkitt-Lymphom • Nachweis von EBV-DNA in Lymphomzellen oder Biopsien • Induktion von Lymphomen bei Neuweltprimaten nach Infektion mit EBV Contra: Expression viraler Proteine und RNA nach der Immortalisierung von B-Lymphozyten EBNA (Epstein-Barr Nuclear Antigen) 1 EBNA2: Transkriptionsfaktor EBNA3A, B, C EBNA-LP (Leader-Protein) LMP (latente Membranproteine) 1, 2A, 2B Onkogene/immortalisierende Aktivität unstrittig bei LMP1 (Hauptonkogen), LMP2A, EBNA1, 2, 3C, LP • EBV ist weltweit verbreitet - ca. 90% aller Menschen sind seropositiv • Sporadische Form des Burkitt-Lymphoms - nur sehr selten Nachweis von EBV • Bei ca. 5% des endemischen Burkitt-Lymphoms - kein EBV - Nachweis möglich • Chromosomale Translokationen bei allen Burkitt-Lymphomen Chromosom 14 (2,12) —> Immunglobulin-Gene —> Chromosom 8 c-myc-Gen EBER1/2 RNA: anti-apoptotische Effekte BARTs, miRNAs: zielen auf Regulatoren der Zellproliferation und Apoptose Kriterien für eine kausale Rolle von EBV bei Tumoren Epstein-Barr-Virus assoziierte Tumoren Tumor(en) • Anteil EBV-positiver Fälle einer Tumorentität • Anteil EBV-positiver Tumorzellen • Monoklonalität von EBV im Tumor. Hinweis auf Etablierung der latenten Infektion vor Expansion des malignen Klons. • Expression von EBV Proteinen. IARC Monographs, Vol. 70, 1997 % Virus-positiv 1. Burkitt‘s Lymphom endemisch in Afrika sporadisch in der westl. Welt 2. Immunoblastische B-Zell-Lymphome 3. Morbus Hodgkin 4. T-Zell-Lymphome 5. Nasopharynxkarzinom 6. Magenkarzinome >95 20 ! 100 ! 40 variabel 100 ca.10 IARC- Einstufung: Hinreichende Evidenz für die Karzinogenität von EBV bei 1, 2, 3, 5 und aus 4 sinonasale, angiozentrische T-Zell-L. IARC Monographs, Vol. 70, 1997 Posttransplantation Lymphoproliferative Disease (PTLD) • • • • Therapeutische Strategien Definition: Poly-, Oligo- oder monoklonale Lymphoproliferation nach Transplantation Auswachsen EBV-transformierter Lymphozyten bei fehlender effektiver T-Zell Überwachung Mortalität hoch: 50-90% Symptome: Lymphadenopathie • Reduktion der Immunsuppression – Wenn möglich (Problem: Abstoßung) • Anti-B-Zell Antikörper (Rituximab) • Chirurgische Entfernung – Bei lokalisiertem Auftreten – Zervikal, Tonsillen, Darm (70% extranodal) • Charakteristika der PTLD • Adoptiver T-Zell-Transfer (autolog und allogen) – ~90% EBV positiv – ~95% B Zellen (5% T Zellen oder NK Zellen) – Haque, Blood 2007 • Klassische Chemotherapie – Bei Rezidiv 50% Ansprechen, aber hohe Toxizität • Ähnlich AIDS-Lymphome Kaposi-Sarkom Humanes Herpesvirus 8 (HHV-8) (Gamma 2 - Herpesvirus, Rhadinoviren) = Kaposi-Sarkom-assoziiertes Herpesvirus (KSHV) ursprünglich identifiziert über die Präsenz des viralen Genoms in Kaposi-Sarkomen • Seit Anfang der 80er Jahre Häufung des Kaposi-Sarkoms bei HIV+ homosexuellen Männern • Ausgang von lymphatischen Endothelzellen (Spindelzellen) Makroskopisch: Fleckige oder knotige Erhebungen mit Hämosiderineinlagerung (bläulich - dunkelrot) - Haut Schleimhaut Lymphknoten Viszerale Dissemination (bes. Lunge, GI-Trakt) Klinische Formen des Kaposi-Sarkoms 1. Klassisches KS = mediterrane Form Ältere Männer aus Mittelmeerländern, osteuropäische Juden 1872 Moriz Kaposi , Wiener Dermatologe 2. Afrikanisches KS = endemische Form alle Altersgruppen (auch Kinder) vermutlich bei Malaria-bedingter Immunsuppression Charakteristika der verschiedenen Formen des Kaposi-Sarkoms KS-Form m:w Alter Lokalisation Verlauf Klassisch 15 : 1 > 50 untere Extemität langsam 24 - 45 untere Extemität auch aggressive Endemisch 17 : 1 3. HIV-assoziiertes KS = epidemische Form ursprünglich häufigster Krebs bei HIV+ MSM Iatrogen 15 : 1 4. Iatrogenes KS = sporadische Form nach Transplantation AIDS 20 : 1 Gene, im Lauf der Evolution von den Wirtszellen übernommen, kodieren für die Onkogenese relevante Funktionen • Inhibition der Apoptose (vbcl-2, vFLIP) • Schutz der Wirtszelle vor dem Angriff des Immunsystems (vIRF-1 und -3) > Immunevasion 25 - 50 untere Extemität oft aggressiv disseminiert oft visz. Organe aggressiv HHV8/KSHV und Kaposi‘s Sarkom • In nodulären Läsionen aller Formen sind nahezu alle Spindelzellen latent infiziert. In KS Tumoren beobachtet man aber auch lytische Replikation auf niedrigem Niveau. KS wurde nie ohne HHV8-Infektion beobachtet. • Niedrige Prävalenz in der Allgemeinbevölkerung! • Stimulation der Zellproliferation (vIL-8R: konstitutiv aktiver Chemokinrezeptor, exprimiert von lytisch infizierten Zellen > VEGF-Sekretion, paraendokrine Wirkung auf umliegende Zellen) Formen selten Kinder Deutschland, Frankreich, UK Geographisch korreliert HHV8 Prävalenz mit KS Risiko: Italien Ost- u. Zentralafrika Hohe Prävalenz in Risikogruppen: MSM in W-Europa und Nordamerika: • Stimulation der Angiogenese (vIL-8R: konstitutiv aktiver Chemokinrezeptor > VEGF-Sekretion) 2 - 6% 24% > 50% (bis zu 80%) 15% - 30% Primäres Effusionslymphom (PEL) HHV8 ist notwendig für KS-Entwicklung aber nicht hinreichend. • • • • Im Engl. auch Body cavity-based lymphoma (BCBL) Kofaktoren sind nötig! An erster Stelle Immunsuppression, iatrogen oder HIV-bedingt. • Auftreten vor allem bei Immunsuppression. • Hochmaligne, monoklonale Neoplasie Mit Beendigung iatrogener IS verschwindet meist das KS oder bildet sich stark zurück. In Südeuropa mit hoher HHV8 Prävalenz erkranken bis zu 5% der Transplantatempfänger an KS. • Aszites, Pleura- oder Perikarderguß aber auch solider Tumor in lymphatischen Organen. • PEL-Zellen zu 100% mit HHV8 infiziert (5-20 Genomkopien). In 50 - 60% der Fälle Coinfektion mit EBV. Unter hoch aktiver antiretroviraler Therapie (HAART) HIV-Infizierter bildet sich ein KS meist zurück. Die Inzidenz des KS ging seit HAART um 95% zurück. • Für die Proliferation von PEL-Zellen hauptsächlich erforderlich HHV8 vFLIP und vIRF-3. • Meist keine Remission bei Beginn von HAART. Multizentrische Castleman Erkrankung (MCD) • Der Plasmazell-Typ ist zu etwa 50% mit HHV8 assoziiert. • Polyklonale B-Lymphozyten-Proliferation, überwiegend latent HHV8-infiziert. • Generalisierte Lymphadenopathie, Hypergammaglobulinämie, Fieber • Häufig resistent gegen Zytostatika und nicht selten letal. • Von besonderer pathogenetischer Relevanz: das HHV8 vIL-6. vIL-6 induziert in HHV8-negativen Zellen IL-6 in Einklang mit der bekannten Überexpression von IL-6 bei MCD. • Man kann MCD mit neutralisierenden Antikörpern gegen IL-6 oder seinen Rezeptor behandeln.