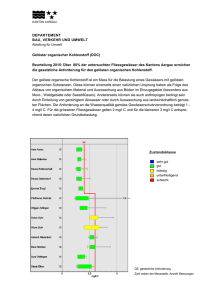
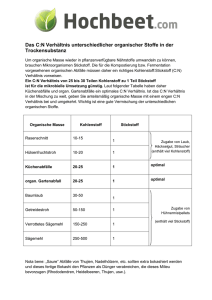
28.3 Vorkommen, Gewinnung und Verwendung
Werbung

28.3 Vorkommen, Gewinnung und Verwendung von Kohlenstoff und Silicium Abb. 28.7 Bündel von mehrwandigen Kohlenstoff-Nanoröhren (Rasterelektronenmikroskopische Aufnahmen; A. Greiner, H. Hou u. A. Schaper, Universität Marburg). Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. Germanium hat ebenfalls Diamant-Struktur und ist ein Halbleiter. Zinn hat bei Temperaturen über 13 °C eine Metallstruktur (weißes Zinn oder β-Zinn), unterhalb von 13 °C wandelt es sich sehr langsam in eine halbmetallische Modifikation mit Diamant-Struktur um (graues Zinn, a-Zinn). Zinngegenstände können deshalb bei anhaltender Kälte im Winter zu einem grauen Staub von a-Zinn zerfallen („Zinnpest“). Blei kristallisiert mit der für Metalle typischen, kubisch-dichtesten Kugelpackung. 28.3 Vorkommen, Gewinnung und Verwendung von Kohlenstoff und Silicium Kohlenstoff hat einen Massenanteil von etwa 0,03 % in der Erdkruste. Zusätzlich enthält die Atmosphäre etwa 0,040 Volumen-% Kohlendioxid, welches auch im Meerwasser gelöst vorkommt (0,005 Massen-%). Kohlenstoff ist wesentlicher Bestandteil der organischen Verbindungen im Pflanzen- und Tierreich. Elementarer Kohlenstoff kommt als Graphit und als Diamant sowie stark verunreinigt in Form von verschiedenen Kohlesorten vor; man unterscheidet zwischen Anthrazit (> 90 % C), Steinkohle (75 – 90 % C) und Braunkohle (< 75 % C). Kohlenwasserstoffe sind Verbindungen aus Kohlenstoff und Wasserstoff, die im Erdöl und Erdgas enthalten sind. Im Mineralreich (Lithosphäre) findet sich Kohlenstoff in Form von Carbonaten wie zum Beispiel: Kalkstein CaCO3 Marmor CaCO3 Dolomit CaMg(CO3)2 Witherit BaCO3 Siderit FeCO3 Malachit Cu2CO3(OH)2 Die Gesamtmasse des Kohlenstoffs auf der Erde macht etwa 1012 kg in der Tierwelt, 1018 kg in der Pflanzenwelt und organischen Materie in Böden, über 1015 kg in der Atmosphäre, 1018 kg im Meerwasser und über 1019 kg in der Lithosphäre aus. Zu etwa 98 % reiner Kohlenstoff wird in Form von Koks aus Steinkohle und aus den Rückständen der Erdölraffination gewonnen. Dies geschieht durch Erhitzen unter Luftausschluss, wobei sich die in der Kohle enthaltenen organischen Verbindungen verflüchtigen und das Kokereigas und den Steinkohlenteer bilden (vgl. S. 504). Künstlicher Graphit wird durch ein- bis dreiwöchiges Erhitzen von Koks auf 2600 – 3000 °C in inerter Atmosphäre hergestellt; Silicium dient als Katalysator. 28 Abb. 28.6 Zwei Modelle von KohlenstoffNanoröhren. Die oben abgebildete Sorte hat metallische Leitfähigkeit, die andere ist halbleitend. 429 . Definition CVD-Verfahren (chemical vapor deposition): Abscheidung eines Feststoffs aus der Gasphase durch eine chemische Reaktion CH4 + H2 28 Glühdrahtheizung Vakuum Diamantschicht Siliciumscheibe Abb. 28.8 Herstellung eines Diamanten nach dem CVD-Verfahren. 430 Bei der hohen Temperatur kristallisiert der Kohlenstoff besser. Natürlicher und künstlicher Graphit findet vielfache Anwendung als Material für Elektroden (Elektrolyse, Elektroöfen in der Stahlindustrie u. a.), für Bürsten in Elektromotoren, für chemische Apparate und für Metallgießformen. Pyrokohlenstoff ist ein weiterer temperaturbeständiger Werkstoff, der durch Zersetzung von Kohlenwasserstoffen bei hohen Temperaturen unter Luftausschluss erhalten wird. Ähnlich erfolgt auch die Herstellung von Kohlenstoff-Fasern, indem unter Zug stehende Fasern aus organischen Verbindungen erhitzt werden. In den Fasern sind die Ebenen der Graphit-Struktur parallel zur Faser ausgerichtet, so dass die kovalente Verknüpfung der C-Atome in Faserrichtung verläuft und die Fasern eine hervorragende Zugfestigkeit und Elastizität aufweisen. In Kunststoff eingelagerte Kohlenstoff-Fasern dienen zur Herstellung von mechanisch stark beanspruchten Gegenständen wie Tennisschlägern und Turbinenschaufeln für Flugzeuge. Aktivkohle ist ein sehr poröser Kohlenstoff mit einer außerordentlich großen Oberfläche. Sie entsteht beim Erhitzen von Holz, Torf und anderen organischen Materialien unter Luftausschluss im Beisein von Phosphorsäure oder Zinkchlorid. Diese Zusätze sorgen für die Bildung zahlreicher Poren. Wegen ihrer großen Oberfläche vermag Aktivkohle andere Stoffe physikalisch zu adsorbieren (vgl. S. 263) und dient deshalb zur Entfernung von Verunreinigungen aus Lösungen und als Filtermaterial in Gasmasken. Ruß wird technisch durch unvollständige Verbrennung (begrenzter Luftzutritt) von Erdöl, Erdgas oder Acetylen hergestellt. Die Hauptmenge wird als Füllstoff im Gummi für Autoreifen verarbeitet. Außerdem dient er als Pigment in Lacken, Tinten und Druckerschwärze. Diamant kommt in der Natur relativ selten vor. Er entsteht aus Graphit bei hoher Temperatur und hohem Druck (> 1400 °C, > 5 GPa). Die Hauptmenge wird synthetisch in geschmolzenem Eisen oder Nickel unter Druck hergestellt. In dem flüssigen Metall ist Graphit etwas löslich; aus der gesättigten Lösung scheidet sich dann Diamant aus. Das Metall wird danach mit einer Säure aufgelöst. Ein anderes Verfahren ist die Abscheidung aus der Gasphase (CVD = chemical vapor deposition), indem ein Gemisch aus Wasserstoff und wenig Methan (CH4) auf 850 – 2000 °C erhitzt wird. Diamant scheidet sich auf einem Diamant-Impfkristall als Einkristall ab oder auf der Oberfläche von Silicium, Wolfram oder Wolframcarbid als dünne, polykristalline Schicht (Abb. 28.8). Mitausgeschiedener Graphit verflüchtigt sich wieder durch Reaktion mit dem Wasserstoff. Wegen seiner einmaligen Eigenschaften ist Diamant ein ganz besonderer Werkstoff. Zu diesen Eigenschaften zählen: die größte Härte und größte Wärmeleitfähigkeit aller bekannten Materialien, optische Transparenz von infrarot bis ultraviolett bei einem hohen Brechungsindex und hohe chemische Resistenz. Zur Herstellung von Kohlenstoff-Nanoröhren wird Graphit unter ähnlichen Bedingungen wie bei der Fulleren-Gewinnung in einer Helium-Atmosphäre unter vermindertem Druck verdampft, entweder aus Graphit-Elektroden in einem Lichtbogen oder durch Aufheizen mit einem Laser. Eine andere Möglichkeit ist die thermische Zersetzung von gasförmigen organischen Verbindungen oder von Kohlenmonoxid bei 500 – 1000 °C (CVD-Verfahren). Nach Abscheidung auf einer gekühlten Fläche werden lösliche Nebenprodukte (wie Fullerene) herausgelöst; mitentstandener Ruß kann aus einer Wasser-Tensid-Suspension abzentrifugiert werden. Sind bei der Herstellung Metalle wie Fe, Co oder Ni als Katalysator anwesend, erhält man einwandige Röhren, anderenfalls mehrwandige. Dank einer Zugfestigkeit, die 50-mal größer als die von Stahl ist, haben leichte Verbundwerkstoffe aus Kunststoff mit eingelagerten mehrwandigen Kohlenstoff-Nanoröhren großes Anwendungspotenzial (z. B. für Rotorblätter von Windkraftanlagen). Die 2009 aufgenommene industrielle Herstellung von Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. 28 Kohlenstoff, Silicium und Bor 28.4 Carbide, Silicide und Silane Kohlenstoff-Nanoröhren ist jedoch nicht richtig in Gang gekommen, nicht zuletzt wegen der Produktionskosten und ungeklärter gesundheitlicher Risiken (sind Nanoröhren krebserzeugend?). Herstellung von Silicium SiO2(l) + 2 C(s) → Si(l) + 2 CO(g) SiO2(s) + 2 Mg(s) → Si(l) + 2 MgO(s) 3 SiO2(s) + 4 Al(s) → 3 Si(l) + 2 Al2O3(s) Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. Silicium ist nach Sauerstoff das zweithäufigste Element in der Erdkruste (Massenanteil ca. 26 %). Es kommt nur in gebundener Form im Mineralreich vor. Siliciumdioxid, SiO2, ist der Bestandteil von Sand, Quarz und einigen damit verwandten Mineralien. Silicate bilden eine enorme Vielzahl von Mineralien (s. Abschnitt 28.6, S. 434). Silicium wird technisch durch Reduktion von Quarz mit Koks bei Temperaturen über 2000 °C im elektrischen Ofen (elektrischer Lichtbogen zwischen Graphitelektroden) hergestellt. Die eingesetzte Koksmenge muss genau berechnet werden; mit einem Überschuss von Kohlenstoff entsteht nicht Silicium, sondern Siliciumcarbid (SiC). Im Laboratoriumsmaßstab lässt sich Silicium durch Reduktion von SiO2 mit Magnesium oder Aluminium herstellen. Silicium ist der Grundstoff der Halbleitertechnik, aus dem Transistoren, integrierte Schaltkreise und Solarzellen hergestellt werden (Abschnitt 9.10, S. 149). Für diese Zwecke wird Silicium mit höchster Reinheit benötigt (weniger als 1 ng/g an Verunreinigungen); es wird aus Rohsilicium in einer Reihe von Schritten gewonnen. Zuerst wird das Silicium mit Chlorwasserstoff zu Trichlorsilan (HSiCl3) umgesetzt. Trichlorsilan ist eine Flüssigkeit (Sdp. 32 °C), die durch Destillation gereinigt wird und dann mit Wasserstoff zu reinem Silicium reduziert wird. Eine weitere Reinigung erfolgt durch Zonenschmelzen Abb. 29.10, S. 454). Bei diesem Prozess wird eine schmale Zone eines Siliciumstabs aufgeschmolzen, wobei die Schmelze in Kontakt zu den beiden festen Enden des Stabs bleibt. Die geschmolzene Zone lässt man durch Bewegung der elektrischen Heizvorrichtung langsam von einem zum anderen Ende des Stabs wandern. Aus der Schmelze kristallisiert reinstes Silicium, während die Verunreinigungen in der geschmolzenen Zone gelöst bleiben und sich am Schluss in einem Ende des Stabs befinden; dieses Ende wird abgesägt und nicht verwertet. Der erhaltene Siliciumstab besteht aus einem einzigen Kristall. Zur Herstellung von Halbleitern wird der Stab mit Edelstahldrähten in dünne Scheiben zersägt („Wafer“, ca. 1 mm dick), auf die dann in zahlreichen Einzelschritten mikroelektronische Schaltkreise aufgebracht werden. Reinigung von Silicium 300 C Si(s) + 3 HCl(g) ! HSiCl3 (g) + H2 (g) 1000 C HSiCl3 (g) + H2 (g) ! Si(s) + 3 HCl(g) 28.4 Carbide, Silicide und Silane Zahlreiche Carbide sind bekannt. Sie werden durch Erhitzen eines Metalls oder Metalloxids mit Kohlenstoff, Kohlenmonoxid oder einem Kohlenwasserstoff hergestellt. Salzartige Carbide bestehen aus Metall-Kationen und Anionen, die nur Kohlenstoff enthalten. Die Metalle der ersten und zweiten Hauptgruppe und der ersten, zweiten und dritten Nebengruppe bilden eine Art von Carbiden, die Acetylide genannt werden, weil sie das Acetylid-Ion C22– enthalten. Bei der Hydrolyse von Acetyliden entsteht Acetylen, C2H2 (vgl. Abschnitt 31.3, S. 502); die Hydrolyse von Calciumacetylid (Calciumcarbid) dient zur technischen Herstellung von Acetylen. Berylliumcarbid, Be2C, und Aluminiumcarbid, Al4C3, werden auch Methanide genannt, weil bei ihrer Hydrolyse Methan (CH4) entsteht. Aufgrund ihrer Kristallstrukturen kann auf einen ionischen Aufbau mit dem Methanid-Ion C4– geschlossen werden. So hat Be2C die Antifluorit-Struktur Abb. 12.20, S. 191) mit Koordinationszahl 8 für die C-Atome. Wegen der hohen Ionenladungen erscheint eine rein ionische Bindung allerdings unwahrscheinlich. 28 CaO(s) + 3 C(s) → CaC2(s) + CO(g) CaC2 (s) + 2 H2 O → Ca2+ (aq) + 2 OH– (aq) + C2 H2 (g) Al4 C3 (s) + 12 H2 O → 4 Al(OH)3 (s) + 3 CH4 (g) 431