Musterlösung 8.1.2002 (download pdf)
Werbung
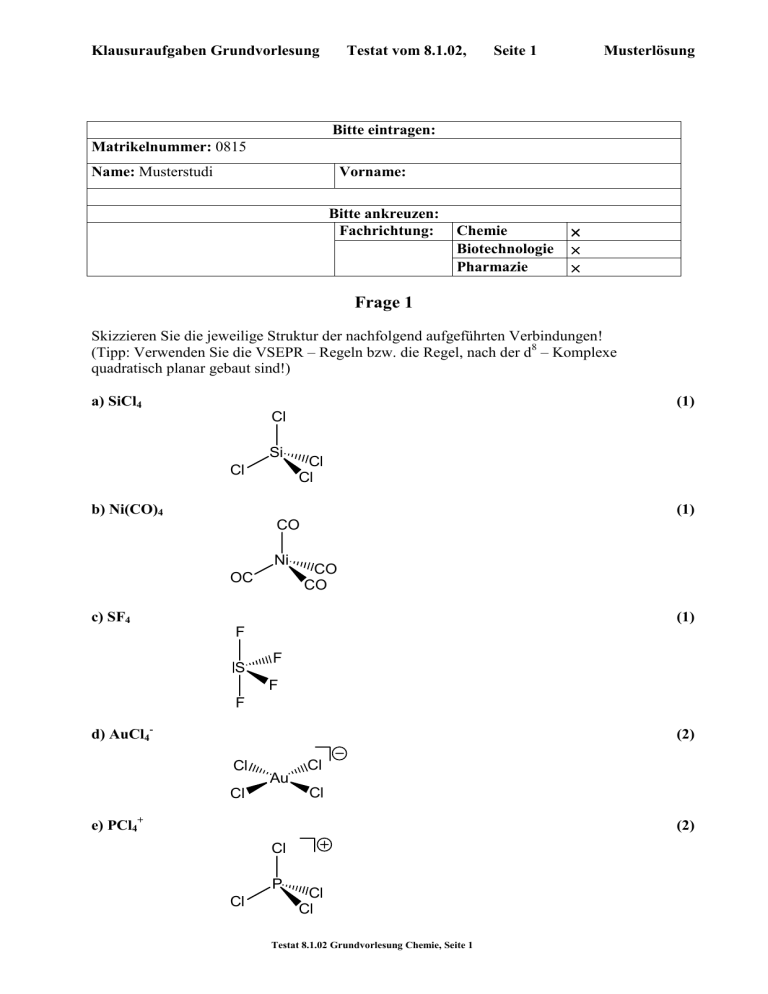
Klausuraufgaben Grundvorlesung Testat vom 8.1.02, Seite 1 Musterlösung Bitte eintragen: Matrikelnummer: 0815 Name: Musterstudi Vorname: Bitte ankreuzen: Fachrichtung: Chemie Biotechnologie Pharmazie × × × Frage 1 Skizzieren Sie die jeweilige Struktur der nachfolgend aufgeführten Verbindungen! (Tipp: Verwenden Sie die VSEPR – Regeln bzw. die Regel, nach der d8 – Komplexe quadratisch planar gebaut sind!) a) SiCl4 Si Cl b) Ni(CO)4 Cl Cl (1) CO Ni OC c) SF4 (1) Cl CO CO (1) F S F F F d) AuCl4- (2) Cl Cl Au Cl Cl e) PCl4+ (2) Cl P Cl Cl Cl Testat 8.1.02 Grundvorlesung Chemie, Seite 1 Klausuraufgaben Grundvorlesung Testat vom 8.1.02, Seite 2 Musterlösung Frage 2 Schreiben Sie chemische Gleichungen für die nachfolgenden Umsetzungen an. Falls erforderlich, ergänzen Sie die Angaben zu Ausgangsstoffen und Produkten. Schreiben Sie den Reaktionstyp an, wenn danach gefragt wird. a) Ausgangsstoffe: H2S, SO2 Produkte: S8, H2O Gleichung: 2 H2S + SO2 → 3/8 S8 + 2 H2O (2) Reaktionstyp: Redoxreaktion oder Redoxkonproportionierung (1) b) Ausgangsstoffe: Cu, HNO3 Produkte: Cu2+, NO2 Teilgleichung (Cu): (1) Cu → Cu2+ + 2 e- Teilgleichung (HNO3): (2) HNO3 + H+ + e- → NO2 + H2O Gesamtgleichung: |x2 Cu + 2 HNO3 + 2 H+ → Cu2+ + 2 NO2 + 2 H2O c) Ausgangsstoffe: MnO4-, H2O2 , H+ (2) Produkte: O2, Mn2+ Teilgleichung (H2O2): (2) H2O2 → O2 + 2 H+ + 2 e- |x5 Teilgleichung (MnO4-): (3) MnO4- + 5 e- + 8 H+ → Mn2+ + 4 H2O Gesamtgleichung: |x2 5 H2O2 + 2 MnO4- + 6 H+ → 5 O2 + 2 Mn2+ + 8 H2O Testat 8.1.02 Grundvorlesung Chemie, Seite 2 (2) Klausuraufgaben Grundvorlesung Testat vom 8.1.02, Seite 3 Musterlösung Frage 3 a) Schreiben Sie die Valenzstrichformel für HNO3 an. Tragen Sie die formalen Ladungen ein, wenn diese nicht gleich Null sind. Geben Sie, wenn erforderlich, die mesomeren Formeln an. Geben Sie das Symbol für die Beziehung zwischen diesen Formeln gegebenenfalls durch den „Mesomeriepfeil“ an! Formelbilder: (3) O O N N HO O HO O b) Welche Oxidationsstufe haben folgende Elemente in HNO3 N: +V O: -II (2) Frage 4 Im Diagramm ist die Elementarzelle einer Verbindung gezeigt, die Ca, F und Rb enthält. a) Geben Sie die Formel der Verbindung an: CaRbF3 (3) b) Welche Koordinationszahl hat das Rb? 8 bzw. 12 (2) c) Welches Koordinationspolyeder beschreibt die Koordination von Rb durch F? Antwort:. Würfel (2) d) Welche Koordinationszahl hat Ca? 6 (1) e) Welches Kooordinationspolyeder beschreibt die Koordination von Ca durch F? Antwort: Oktaeder (2) Testat 8.1.02 Grundvorlesung Chemie, Seite 3 Klausuraufgaben Grundvorlesung Testat vom 8.1.02, Seite 4 Musterlösung Frage 5 31 15 P ist ein „Reinisotop“, d.h. es ist zu 100% in natürlichem Phosphor enthalten. a) Durch welche Kernreaktion stellt man Antwort: b) 32 15 P 31 15 P + 01 n → 32 15 P her? 32 15 P (2) zerfällt mit einer Halbwertszeit von 14 Tagen in Werden beim Zerfall α- oder β-Teilchen abgegeben? 32 16 S . β-Teilchen (2) 32 32 c) Wenn der Gehalt an 15 P einer Probe von mit 15 P markiertem Adenosintriphosphat zum Zeitpunkt t = 0 x Einheiten beträgt, wie viel Einheiten an radioaktivem Phosphor sind nach einer Zeit von 56 Tagen noch vorhanden? Antwort: x / 16 (1) Frage 6 Geben Sie die Valenzelektronenkonfiguration des elektronischen Grundzustandes folgender Atome bzw. Ionen an: a) Kohlenstoff 2s2 2p2 (1) b) Fluor 2s2 2p5 (1) c) Calcium 4s2 (1) d) Cer(III) 4f1 (1) e) Mangan(II) 3d5 (1) Testat 8.1.02 Grundvorlesung Chemie, Seite 4 Klausuraufgaben Grundvorlesung Testat vom 8.1.02, Seite 5 Musterlösung Frage 7 Berechnen Sie den pH-Wert der nachfolgend angegebenen Puffergemische: a) NH3 und NH4Cl im Konzentrationsverhältnis 1:1 (pKs(NH4+) = 9.3) (2) pH = 9.3 b) CH3COOH und NaOOCCH3 im Konzentrationsverhältnis 1 : 1 (pKs(CH3COOH) = 4.7) (2) pH = 4.7 Frage 8 Schreiben Sie die Gleichungen für folgende Beziehungen auf: a) Kraft F = Funktion von Ladung q, Abstand r und Dielektrizitätskonstante ε: (2) F = 1/ε q1 q2 / r2 b) Freie Energie ∆G = Funktion der Gleichgewichtskonstanten K: (2) ∆G = - RT ln K c) Enthalpie ∆H = Funktion von ∆G , Entropie ∆S und Temperatur T: ∆G = ∆H - T ∆S (2) ∆H = ∆G + T ∆S d) Dipolmoment µ = Funktion von Ladung q und Abstand r: (2) µ=qr e) Geschwindigkeitskonstante k = Funktion von Aktivierungsenergie Ea und Temperatur T: (2) k ∝ exp(-Ea/RT) Testat 8.1.02 Grundvorlesung Chemie, Seite 5 Klausuraufgaben Grundvorlesung Testat vom 8.1.02, Seite 6 Musterlösung Frage 9 a) Schreiben Sie die Definitionsgleichung für die Säurekonstante der Säure HA an! (2) HA → H+ + AKs = [H+][A-] / [HA] b) Welche Protonenkonzentration hat eine wässrige Lösung, die 10-1 Mol einer Säure HA vom pKs-Wert 5 je Liter enthält? (2) Ks = 10-pKs = 10-5 mol l-1 c = 10-1 mol l-1 [H+] = (Ks c)1/2 = (10-5 10-1)1/2 = (10-6)1/2 = 10-3 mol l-1 c) Welchen pH-Wert hat eine Lösung, die 10-1 Mol l-1 des Natrium-Salzes NaA dieser Säure vom pKs-Wert 5 enthält? (3) A- + H2O → OH- + HA KB = [OH-][HA] / [A-] KB = 10(14-pKs) = 10-9 mol l-1 c = 10-1 mol l-1 [OH-] = (KB c)1/2 = (10-9 10-1)1/2 = (10-10)1/2 = 10-5 mol l-1 p[OH-] = 5 pH = p[OH-] = 14-5 = 9 d) Bei welchem pH-Wert muß ein Indikator umschlagen, damit er bei der Titration der Säure HA mit Natronlauge zur Endpunktsanzeige eingesetzt werden kann? (2) pH ≈ 9 e) Eine Indikatorsäure HInd hat den pKs-Wert von pKs = 8. Berechnen Sie den pH-Wert, bei (2) dem Hind zu 90% in Ind- übergegangen ist! HInd → H+ + IndKs = [H+][Ind-] / [HInd] = 10-8 mol l-1 [Ind-] / [HInd] = 90 / 10 = 9 [H+] = [Ind-] / [HInd] = 10-8 mol l-1 / 9 ≈ 1.1 10-9 mol l-1 pH ≈ 9 Testat 8.1.02 Grundvorlesung Chemie, Seite 6 Klausuraufgaben Grundvorlesung Testat vom 8.1.02, Seite 7 Musterlösung Frage 10 Skizzieren Sie die Strukturen von CO2 und von SiO2! O C (4) O O Si O Si O O O O O Si O O O O Si O O O O Si O Frage 11 Zeichnen Sie die Valenzstrichformeln der Verbindungen XO4n- für die nachfolgend aufgeführten Elemente X an. Geben Sie jeweils die Ladung der Anionen an. Tragen Sie formale Ladungen in ihre Formeln ein, wenn diese nicht gleich Null sind. Zeichnen Sie, wo dies erforderlich ist, eine weitere der mesomeren Formeln (eine weitere Formel genügt!) und geben Sie die Beziehung zwischen diesen Formeln durch den „Mesomeriepfeil“ an! Zeichnen Sie ihre Formeln so, dass man erkennen kann, ob Sie der Verbindung eine tetraedrische oder eine planare Geometrie zuordnen (Gegebenenfalls schreiben Sie dazu ob Ihre Skizze ein Tetraeder oder ein Quadrat andeuten soll!). a) X = Si (2) O Si O O O b) X = P (2) O O P O P O O O O O c) X = S (2) O S O O O O 2 S O O O d) X = Cl (2) O O Cl O O O Cl O O O Testat 8.1.02 Grundvorlesung Chemie, Seite 7 Klausuraufgaben Grundvorlesung Testat vom 8.1.02, Seite 8 Musterlösung Frage 12 10 g Zink (MZn = 65 u) werden mit 3 Mol NaOH in Wasser zur Reaktion gebracht und dabei aufgelöst. a) Schreiben Sie die stöchiometrische Gleichung für den Prozess an! (2) 2 OH- + Zn + 2 H2O → Zn(OH)42- + 2 H2 b) Wie viele Liter H2 entstehen dabei unter Normalbedingungen? (2) Antwort: 10 g / 65 g mol-1 = 10/65 mol = 0.15 mol H2 V = 22.4 l mol-1 V = 22.4 l mol-1 0.15 mol = 3.4 l Frage 13 Die drei abgebildeten Diagramme stellen drei unterschiedliche Fälle der Wechselwirkung zwischen dem HOMO einer Lewis-Base und dem LUMO einer Lewis-Säure dar. Markieren Sie dasjenige Diagramm, das nach Ihrer Meinung zur Bildung des stabilsten Säure-Base-Addukts führt, wobei für alle drei Fälle gleiche Überlappung zwischen HOMO und LUMO vorausgesetzt wird. (2) Testat 8.1.02 Grundvorlesung Chemie, Seite 8 Klausuraufgaben Grundvorlesung Testat vom 8.1.02, Seite 9 Musterlösung Frage 14 Für einen oktaedrisch gebauten Eisen(III)-Komplex wird ein magnetisches Moment µ von 1.73 µ B (Bohr’schen Magnetonen) gemessen. a) Zeichnen Sie das Schema der energetischen Aufspaltung der d-Orbitale im oktaedrischen Feld! (2) E b) Die Formel für die Berechnung des magnetischen Moments ist µ = n(n + 2) µ B, wobei n die Anzahl der ungepaarten Elektronen bedeutet. Hat der angegebene Eisen(III)-Komplex eine high-spin oder eine low-spin-Elektronenkonfiguration? Antwort: low-spin (2) Frage 15 Bezeichnen Sie die nachfolgend durch Formeln angegebenen Verbindungen durch Namen, die den Nomenklatur-Regeln entsprechen, und zeichnen Sie die Strukturen! a) cis-(NH3)2PtCl2 (2) Cl Cl Pt NH3 H3N cis-Diammino-dichloro-platin(II) b) fac-(NH3)3CrCl3 (2) NH3 Cl Cl Cr NH3 NH3 Cl fac-Triammin-trichloro-chrom(III) c) Ag(CN)2- (2) NC Ag CN Dicyanoargentat(-1) Testat 8.1.02 Grundvorlesung Chemie, Seite 9

