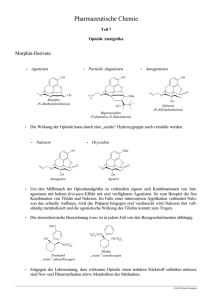
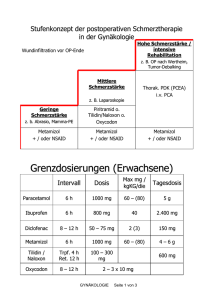
1. BEZEICHNUNG DES ARZNEIMITTELS Codidol retar
Werbung

153-CD6-07/04-FI/ 1 209-CD9-07/04-FI/ 1 212-CD12-07/04-FI/ 1 2007-04-18 UR/cg FACHINFORMATION (Zusammenfassung der Merkmale des Arzneimittels) 1. BEZEICHNUNG DES ARZNEIMITTELS Codidol retard 60 mg-Filmtabletten Codidol retard 90 mg-Filmtabletten Codidol retard 120 mg-Filmtabletten 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG Je 1 Filmtablette enthält: 60 mg Dihydrocodein-hydrogen-tartrat entspr. 40 mg Dihydrocodein, 90 mg Dihydrocodein-hydrogen-tartrat entspr. 60 mg Dihydrocodein, 120 mg Dihydrocodein-hydrogen-tartrat entspr. 80 mg Dihydrocodein. Sonstige Bestandteile: Lactose wasserfrei, 58,4 mg (in der 60 mg Filmtablette), 40,5 mg (in der 90 mg Filmtablette), 54 mg (in der 120 mg Filmtablette). Die vollständige Auflistung der sonstigen Bestandteile siehe Abschnitt 6.1. 3. DARREICHUNGSFORM Längliche Retardtabletten, weiß mit Bruchrille auf einer Seite, auf der anderen Seite mit Prägung 60 mg: DHC 60, 90 mg: DHC 90, 120 mg: DHC 120. Die Filmtablette kann in gleiche Hälften geteilt werden. 4. KLINISCHE ANGABEN 4.1 Anwendungsgebiete Mäßig starke bis starke Schmerzen. 4.2 Dosierung, Art und Dauer der Anwendung Die Filmtabletten können unabhängig von der Nahrungsaufnahme und müssen mit ausreichend Wasser eingenommen werden. Die Retardtabletten dürfen nicht zerkaut oder zerstoßen werden, weil dadurch eine potentiell letale CDFI 07-04-19.doc927807_F_FI_07-04-19_Codidol ret 60mgFT F&B final 1 153-CD6-07/04-FI/ 2 209-CD9-07/04-FI/ 2 212-CD12-07/04-FI/ 2 Dosis frei gesetzt werden kann. Sie können allerdings bei Bedarf bei der Bruchrille halbiert werden. Dosierung Codidol retard soll so kurz wie möglich und in der niedrigsten wirksamen Dosis angewendet werden. Die Dosierung ist abhängig von der Stärke der Schmerzen, dem Alter des Patienten und dem vorhergehenden Analgetikagebrauch. Codidol retard steht in drei Stärken 60 mg, 90 mg und 120 mg zur Verfügung. Erwachsene und Jugendliche über 12 Jahre Die übliche Initialdosis Codidol retard beträgt 60 mg alle 12 Stunden. Bei nicht ausreichender Analgesie oder Zunahme der Schmerzen soll die Dosis auf 90 mg bis maximal 120 mg alle 12 Stunden erhöht werden. Die Verabreichung soll nach fixem Zeitschema (alle 12 Stunden) erfolgen. Die Zeitspanne zwischen zwei Einzelgaben soll 8 Stunden nicht unterschreiten. Besondere Patientengruppen: Kinder unter 12 Jahren Bei Kindern unter 12 Jahren wurden mit Codidol retard-Filmtabletten keine klinischen Studien durchgeführt; es kann daher keine Dosisempfehlung für diese Patientengruppe gegeben werden. Ältere Patienten, Patienten mit Leberfunktionsstörungen, Patienten mit Nierenfunktionsstörungen, Patienten mit Hypothyreose: Es liegen keine Studien zur Dosierung bei diesen Patientengruppen vor. Bei diesen Patientengruppen sollte die Dosis mit Codidol retard-Filmtabletten titriert werden, bis eine adäquate Analgesie erreicht wird. Es sollte beachtet werden, dass bei diesen Patienten ev. mit einer niedrigeren Dosis eine ausreichende Analgesie erzielt wird (siehe auch 4.4). 4.3 Gegenanzeigen • Überempfindlichkeit gegenüber Dihydrocodein oder einem der sonstigen Bestandteile von Codidol retard-Filmtabletten • Ateminsuffizienz mit Hypoxie (z.B. bei obstruktiven Atemwegserkrankungen) • Akuter Asthmaanfall • Atemdepression • Koma • Begleittherapie mit Monoaminooxidase-Hemmern (z. B. Moclobemid) oder innerhalb zwei Wochen nach deren Absetzen (s. 4.5 Wechselwirkungen) • Schwangerschaft (unmittelbar vor oder während der Geburt) • Stillzeit CDFI 07-04-19.doc927807_F_FI_07-04-19_Codidol ret 60mgFT F&B final 2 153-CD6-07/04-FI/ 3 209-CD9-07/04-FI/ 3 212-CD12-07/04-FI/ 3 4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung Das Hauptrisiko einer Opioidüberdosierung ist Atemdepression. Codidol retard Filmtabletten dürfen nur nach strenger Nutzen-Risiko-Abwägung und entsprechenden Vorsichtsmaßnahmen (z.B. Dosisreduktion, Überwachung) angewendet werden bei: • Störungen des Atemzentrums oder der Atemfunktion (z.B. bei chronisch obstruktiven Atemwegserkrankungen und bei Patienten mit Asthma), • bestehender Abhängigkeit von Opioiden, • Patienten mit anamnestischen Alkohol- und Drogenproblemen, • Zuständen mit erhöhtem Hirndruck, • schwerem Cor pulmonale, • Hypothyreose, • obstruktiven Darmerkrankungen oder chronischer Obstipation, • Pankreatitis, • Gallenwegserkrankungen, • schwere Lebererkrankungen, • schwerer Nierenfunktionsstörung, • Prostatahypertrophie, • älteren Patienten. Missbrauch, Abhängigkeit und Toleranz Dihydrocodein hat ein ähnliches Missbrauchprofil wie andere Opioide und kann von latent oder manifest Suchterkrankten bewusst missbraucht werden. Bei Missbrauch von oralen Arzneiformen durch parenterale Verabreichung können ernste, möglicherweise letale Gesundheitsschäden auftreten. Eine entsprechende Kontrolle bzw. Überwachung muss daher bei der Behandlung von Patienten mit Alkohol- oder Drogenproblemen in der Anamnese gewährleistet sein. Die Entwicklung einer psychischen Abhängigkeit (Sucht) von Opioid-Analgetika bei bestimmungsgemäßer Anwendung bei Schmerzpatienten ist selten. Es liegen jedoch keine gesicherten Daten bezüglich psychischer Abhängigkeit bei chronischen Schmerzpatienten vor. Bei Langzeitanwendung kann sich Toleranz entwickeln, die immer höhere Dosen zur Schmerzkontrolle erfordert. Es kann auch Kreuztoleranz mit anderen Opioiden bestehen. Physische Abhängigkeit kann unter Dihydrocodein auftreten und abruptes Absetzen kann ein Entzugssyndrom hervorrufen. Langsames Ausschleichen zur Vermeidung ist deshalb angezeigt. Toleranzentwicklung und psychische Abhängigkeit können durch Gabe nach fixem Zeitschema deutlich reduziert werden. Dosistitration bei Umstieg auf ein anderes Opioid Patienten, die auf eine wirksame Dosis eines bestimmten Opioids eingestellt sind, sollen nicht ohne klinische Beurteilung und neuerliche sorgfältige Titration auf ein anderes Opioid umgestellt werden. Eine kontinuierliche Analgesie ist sonst nicht gewährleistet. CDFI 07-04-19.doc927807_F_FI_07-04-19_Codidol ret 60mgFT F&B final 3 153-CD6-07/04-FI/ 4 209-CD9-07/04-FI/ 4 212-CD12-07/04-FI/ 4 Lactose Dieses Arzneimittel enthält Lactose: Für Patienten mit seltener, erblich bedingter Galaktoseintoleranz, ethnisch bedingter Lapp-Lactase-Defizienz oder Glucose/Galactose-Malabsorptionssyndrom sind Codidol retard-Filmtabletten nicht geeignet. 4.5. Wechselwirkungen Wechselwirkungen mit anderen Arzneimitteln und sonstige Die gleichzeitige Gabe von Dihydrocodein und zentraldämpfenden Arzneimitteln kann zu einer gegenseitigen Verstärkung der sedierenden und atemdepressiven Wirkung führen. Bei Kombination mit folgenden Substanzen, müssen die Patienten entsprechend überwacht werden, da Dosisreduktionen notwendig sein können: • • • • • • • • Sedativa, Hypnotika Neuroleptika (Phenothiazine, z.B. Perphenacin) Anästhetika (z.B. Barbiturate) Antidepressiva (z.B. Imipramin, Amitriptylin, Citalopram) Tranquilizer Antihistaminika (z.B. Meclozin) andere zentral dämpfende Arzneimittel Alkohol (Kombination ist zu vermeiden) Paroxetin, Fluoxetin, Gleichzeitige Anwendung von Monoaminooxidase-Hemmern (z.B. Moclobemid) bzw. Anwendung innerhalb zwei Wochen nach deren Absetzen ist zu vermeiden (siehe auch Abschnitt 4.3 Gegenanzeigen). Gleichzeitige Anwendung von Sekretolytika oder Expektoranzien kann zu einer Wirkungsabschwächung mit ev. Sekretstau führen und sollten nur unter Überwachung erfolgen. Gleichzeitige Anwendung von Antitussiva führt zu einer Wirkungsverstärkung. 4.6 Schwangerschaft und Stillzeit Es liegen keine Daten bezüglich Exposition in der Schwangerschaft und Stillzeit vor. Die Verabreichung von Dihydrocodein während der Schwangerschaft und Stillzeit wird nicht empfohlen. Codidol retard-Filmtabletten dürfen nicht während der Geburt verwendet werden, da das Risiko einer Atemdepression beim Neugeborenen besteht. 4.7 Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen Dihydrocodein hat großen Einfluss auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen. CDFI 07-04-19.doc927807_F_FI_07-04-19_Codidol ret 60mgFT F&B final 4 153-CD6-07/04-FI/ 5 209-CD9-07/04-FI/ 5 212-CD12-07/04-FI/ 5 Das kann insbesondere zu Behandlungsbeginn mit Dihydrocodein, nach Dosiserhöhung oder bei Opioidrotation der Fall sein oder wenn Dihydrocodein gemeinsam mit Alkohol oder anderen ZNS-gängigen Substanzen verabreicht wird. Patienten mit stabiler Dosierung müssen nicht unbedingt beeinträchtigt sein. 4.8 Nebenwirkungen Die am häufigsten berichteten Nebenwirkungen von Dihydrocodein sind Obstipation und Übelkeit. Obstipation soll präventiv mit einem Laxans behandelt werden. Gegen Übelkeit und Erbrechen können Antiemetika verabreicht werden. Bei der Bewertung von Nebenwirkungen werden folgende Häufigkeitsangaben zugrunde gelegt: Sehr häufig (≥ 1/10) Häufig: (≥ 1/100 - < 1/10) Gelegentlich: (≥ 1/1.000, < 1/100) Selten: (≥ 1/10.000, < 1/1.000) Sehr selten: (< 1/10.000), Häufigkeit nicht bekannt (auf Grundlage der verfügbaren Daten nicht abschätzbar). Erkrankungen des Nervensystems Sehr häufig: Sedierung (Müdigkeit bis Benommenheit) Häufig: Kopfschmerzen, Schwindel Augenerkrankungen Selten: Sehstörungen (bedingt durch Wirkung auf das Nervensystem) Erkrankungen der Atemwege, des Brustraums und Mediastinums Selten: Atemdepression (bedingt durch Wirkung auf das Nervensystem) Erkrankungen des Gastrointestinaltraktes Sehr häufig: Obstipation Häufig: Übelkeit, Erbrechen, Magenbeschwerden Sehr selten: paralytischer Ileus Erkrankungen der Nieren- und Harnwege Gelegentlich: Harnverhalten Erkrankungen der Haut und des Unterhautzellgewebes Gelegentlich: Pruritus, Ausschlag, Urticaria Gefäßerkrankungen Selten: Hypotonie Erkrankungen des Immunsystems Gelegentlich: Histaminfreisetzung mit allergischen Reaktionen (z.B. ist bei Patienten mit Asthma ein Asthmaanfall möglich) CDFI 07-04-19.doc927807_F_FI_07-04-19_Codidol ret 60mgFT F&B final 5 153-CD6-07/04-FI/ 6 209-CD9-07/04-FI/ 6 212-CD12-07/04-FI/ 6 Leber- und Gallenerkrankungen Gelegentlich: Druckanstieg in den Gallenwegen Selten: Leberenzymerhöhungen (SGPT, SGOT) Psychiatrische Erkrankungen Selten: Halluzinationen, Verwirrtheit Sehr selten/nicht bekannt: Abhängigkeit Toleranz und Abhängigkeit können sich, insbesondere durch regelmäßige, missbräuchliche Anwendung, entwickeln. Bei bestimmungsgemäßer Anwendung bei Schmerzpatienten stellt das jedoch kein besonderes Problem dar. Entzugserscheinungen können auftreten und sich in gesteigerter Erregbarkeit, Angst, Nervosität, Schlaflosigkeit, Hyperkinesien, Tremor und gastrointestinalen Symptomen äußern. Langsames Ausschleichen zur Vermeidung von Entzugssymptomen ist deshalb angezeigt. 4.9 Überdosierung Zeichen von Dihydrocodein-Intoxikation und Überdosierung sind stecknadelkopfgroße Pupillen, Ataxie, Erbrechen, Atemdepression und Somnolenz bis hin zu Stupor oder Koma, Bradykardie, Apnoe, Kreislaufversagen, Hypotonie und Koma mit letalem Ausgang. Behandlung der Dihydrocodein-Überdosierung: Die Atemwege müssen frei sein und eine Überwachung der Atmung oder künstliche Beatmung sind erforderlich. Eine Magenspülung kann besonders nach der Gabe von Retard-Präparaten angezeigt sein, um den nicht resorbierten Medikamentenanteil zu entfernen. Allgemeine Maßnahmen (z.B. Überwachung des Wasserund Elektrolythaushaltes und des Kreislaufs) sind angezeigt. Bei massiver Überdosierung ist die i.v.-Gabe von 0,4 mg Naloxon angezeigt. In 2 bis 3 minütigen Abständen muss diese Einzeldosis solange wie nötig wiederholt werden. Naloxon kann auch mittels Infusion von 2 mg in 500 ml Kochsalzlösung oder 5 %iger Glucose (0,004 mg/ml) verabreicht werden. Die Infusionsgeschwindigkeit sollte auf die vorhergehende Bolusverabreichung und auf das Ansprechen des Patienten abgestimmt sein. Da die Wirkdauer von Naloxon relativ kurz ist, muss der Patient sorgfältig bis zum zuverlässigen Wiedereintritt der spontanen Atmung überwacht werden. Bei der weiteren Behandlung der Überdosierung ist zu beachten, dass aus Codidol retard-Filmtabletten bis zu 12 Stunden Dihydrocodein freigesetzt wird. Bei weniger schweren Überdosierungen soll 0,2 mg Naloxon i.v. verabreicht werden, gefolgt von 0,1 mg alle 2 Minuten nach Bedarf. Naloxon sollte nicht verabreicht werden, wenn keine signifikanten klinischen Zeichen einer Atem- oder Kreislaufdepression vorliegen. Naloxon soll bei Patienten, von denen bekannt oder anzunehmen ist, dass sie physisch von CDFI 07-04-19.doc927807_F_FI_07-04-19_Codidol ret 60mgFT F&B final 6 153-CD6-07/04-FI/ 7 209-CD9-07/04-FI/ 7 212-CD12-07/04-FI/ 7 Dihydrocodein abhängig sind, mit Vorsicht verabreicht werden. Abrupte oder völlige Aufhebung der Dihydrocodein-Wirkung kann ein akutes Entzugssyndrom bewirken. 5. PHARMAKOLOGISCHE EIGENSCHAFTEN 5.1 Pharmakodynamische Eigenschaften Pharmakotherapeutische Gruppe: halbsynthetisches Opium-Alkaloid. ATCCode: N02AA08. Dihydrocodein ist ein reiner Opioid-Agonist. Dihydrocodein und verwandte Opioide wirken hauptsächlich auf das ZNS und den Darm. Die therapeutischen Wirkungen sind vornehmlich analgetisch, anxiolytisch, antitussiv und sedativ, einschließlich Atemdepression, verminderte gastrointestinale Motilität, Übelkeit, Erbrechen und Veränderungen des endokrinen und autonomen Nervensystems. Klinische Langzeitstudien mit Codidol retard-Filmtabletten wurden nicht durchgeführt. 5.2 Pharmakokinetische Eigenschaften Absorption und Distribution Dihydrocodein wird aus dem Gastrointestinaltrakt resorbiert und unterliegt einem stark ausgeprägten First-pass-Effekt, der zu einer ca. 20 %igen oralen Bioverfügbarkeit führt. Die maximale Plasmakonzentration wird nach ca. 3,5 (60 mg) bzw. 4,8 Stunden (120 mg) erreicht. Metabolisierung und Elimination Dihydrocodein wird hauptsächlich in der Leber metabolisiert und zum überwiegenden Teil mit dem Harn ausgeschieden. Der Metabolismus von Dihydrocodein ist nicht völlig geklärt. Es wird angenommen, dass er jenem von Codein ähnlich ist (N-Demethylierung, ODemethylierung und Glukuronidierung). Als Hauptmetabolit entsteht Dihydrocodein-6-Glucuronid. Es gibt Hinweise, dass der Metabolit Dihydromorphin zur analgetischen Wirkung beiträgt. Bei älteren Patienten und bei Patienten mit Nieren- und Leberinsuffizienz ist mit einer verstärkten und verlängerten Wirksamkeit zu rechnen. Die Formulierung von Codidol retard-Filmtabletten gewährleistet therapeutische Plasmaspiegel über 12 Stunden. 5.3. Präklinische Daten zur Sicherheit Es gibt keine präklinischen Daten, die über die in anderen Abschnitten der Fachinformation hinausgehende zusätzliche relevante Informationen für den verschreibenden Arzt bieten. 6. PHARMAZEUTISCHE ANGABEN 6.1 Liste der sonstigen Bestandteile CDFI 07-04-19.doc927807_F_FI_07-04-19_Codidol ret 60mgFT F&B final 7 153-CD6-07/04-FI/ 8 209-CD9-07/04-FI/ 8 212-CD12-07/04-FI/ 8 Lactose wasserfrei, Hydroxyethylcellulose, Cetylstearylalkohol, Magnesiumstearat, Talkum. Filmüberzug: Opadry OY-GM-29000 clear (bestehend aus: Hypromellose, Polydextrose, Macrogol). 6.2 Inkompatibilitäten Nicht zutreffend. 6.3 Dauer der Haltbarkeit 3 Jahre 6.4 Besondere Vorsichtsmaßnahmen für die Aufbewahrung Lichtschutz erforderlich. 6.5 Art und Inhalt des Behältnisses Verpackungsart: Durchdrückpackung aus PVC/PVdC und Aluminiumfolie Packungsgrößen: 10 und 20 Stück 6.6. Besondere Vorsichtsmaßnahmen für die Beseitigung und sonstige Hinweise zur Handhabung Die Retardtabletten müssen sicher und außerhalb der Sicht- und Reichweite von Kindern entsorgt werden. Nicht verwendetes Arzneimittel oder Abfallmaterial ist entsprechend den nationalen Anforderungen zu entsorgen. 7. INHABER DER ZULASSUNG Mundipharma Ges.m.b.H, Wien 8. ZULASSUNGSNUMMERN 60 mg: 1-19119 90 mg: 1-19121 120 mg: 1-19120 9. DATUM DER ERTEILUNG DER ZULASSUNG/VERLÄNGERUNG DER ZULASSUNG 9.10.1990/5.1.2006 10. STAND DER INFORMATION April 2007 11. VERSCHREIBUNGSPFLICHT/APOTHEKENPFLICHT S1, apothekenpflichtig CDFI 07-04-19.doc927807_F_FI_07-04-19_Codidol ret 60mgFT F&B final 8