Das Zytoskelett - Uni
Werbung

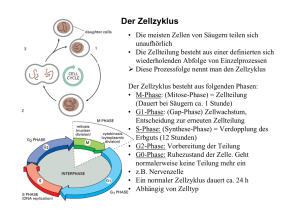
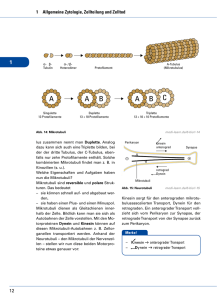
Das Zytoskelett • Einteilung der Zytoskelettkomponenten • Morphologie der Zytoskelettkomponenten • Mikrotubuli Wie können Zellen ihre Form kontrollieren? Filamente des Zytoskeletts halten Zellen in Form Filamente des Zytoskeletts halten Zellen in Form Filamente des Zytoskeletts halten Zellen in Form Tubulin Aktin DNA Filamente des Zytoskeletts halten Zellen in Form 3 verschiedene Filamentvarianten bilden das Zytoskelett Einteilung der Zytoskelettsysteme Einteilung der Zytoskelettsysteme Immunfluoreszenzmarkierung von Aktin-Mikrofilamenten Einteilung der Zytoskelettsysteme Immunfluoreszenzmarkierung von Mikrotubuli-Filamenten Einteilung der Zytoskelettsysteme Immunfluoreszenzmarkierung von Keratin-Intermediärfilamenten Einteilung der Zytoskelettsysteme Aktin-Mikrofilamente 7 nm Mikrotubuli 24 nm Intermediärfilamente 8-12 nm F-Aktin MreB Einteilung der Zytoskelettsysteme F-Aktin MreB • MreB ist das Aktinhomologe Protein in Bakterien • FtsZ ist das Tubulinhomologe Protein in Bakterien, bildet Septum bei der Zellteilung Einteilung der Zytoskelettsysteme • MreB ist das Aktinhomologe Protein in Bakterien • FtsZ ist das Tubulinhomologe Protein in Bakterien, bildet Septum bei der Zellteilung B. subtilis Mutanten zeigen morphologissche Veränderungen nach MreB-Disruption A: WT B-D: Stamm mit Xyluloseinduzierbarer MreB-Expression + inducer - inducer (5 Verdopplungszeiten) - inducer (6 Verdopplungszeiten) FtsZ Lokalisation von FtsZ in E. coli Modell der bakteriellen Zellteilung FtsZ befindet sich im dynamischen Gleichgewicht Zelluläres FtsZ im Ring wird kontinuierlich mit dem cytoplsamatischen Pool ausgetauscht „Fluorescence recovery“ nach Ausbleichen-Analyse (FRAP) von FtsZ FtsZ Mikrotubuli Mikrotubuliaufbau α-Tubulin β-Tubulin Mikrotubuliaufbau Mikrotubuliaufbau alpha Tubulin GTP beta Tubulin Taxol GDP Mikrotubuliaufbau alpha Tubulin GTP beta Tubulin Taxol GDP Mikrotubuliaufbau • jedes Nukleotid in dem Protofilament liegt an der α-β Grenzschicht • die Dissoziation des α-Tubulin gebundenen GTPs wird durch eine Schleife des assoziierten β-Tubulins verhindert • in einem Protofilament wird auch der GDP/ GTP-Austausch am β-Tubulin durch eine Schleife verhindert Mikrotubuliaufbau • die Nukleotid-Bindestelle des Tubulins ist strukturell ähnlich aufgebaut wie die der GTP-bindenden Ras-Proteine • GTP bindet in der Nähe einer β-Faltblatt Struktur (hier in rot) • auch die Motorproteine Myosin und Kinesin haben eine ähnliche Konformation Mikrotubuliaufbau β-Tubulin FtsZ • die Nukleotid-Bindestelle des Tubulins trägt die hoch konservierte Sequenzabfolge GGGTG(T/S)G (in schwarz) • diese Sequenz ist Teil einer Schleife, die von einem β-Faltblattstrang zum GTP reicht Mikrotubuliaufbau • Heterodimere können sich in vitro an ein Ende anfügen oder von einem Ende abdissoziieren • das Anfügen an das exponierte β-Tubulin am Plus-Ende findet deutlich häufiger statt • dabei entsteht eine neue α-β-Verbindung • gleichzeitig wird die Hydrolyse des GTP am nun innen liegenden βTubulin gefördert • nach Freisetzung von Pi verbleibt das GDP im Filament gebunden • das GTP des α-Tubulins wird nicht hydrolysiert! Mikrotubuliaufbau Mikrotubuliaufbau Mikrotubuliaufbau GMPCPP Mikrotubuli • Mikrotubuli sind für die Kern-nahe Lokalisation des GolgiApparates verantwortlich • In Anwesenheit von Nocodazol zerfällt der Golgi-Apparat in einzelne vesikuläre Strukturen (rechts) Taxol Taxol Kontrolle Taxol Taxol Dynamische Instabilität Dynamische Instabilität Wachsen Schrumpfen Dynamische Instabilität Dynamische Instabilität Dynamische Instabilität Microtubule „treadmilling“ Dynamische Instabilität Mikrotubuliaufbau • in doppel oder dreifach Mikrotubuli besteht die Wand eines Mikrotubulus zum Teil aus der Wand eines angefügten • Tubulus A ist ein kompletter Zylinder aus 13 Protofilamenten • Die angefügten Tubuli B oder C bestehen aus weniger als 13 Protofilamenten (meistens 10)