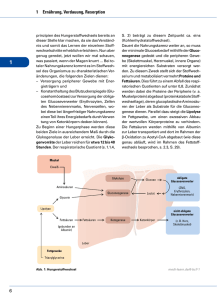
Morbidität und Mortalität nach Eingriffen an der Leber
Werbung

Ruhr-Universität Bochum Prof. Dr. med. M. Büsing Dienstort: Knappschaftskrankenhaus Recklinghausen Abteilung für Allgemein- und Unfallchirurgie Morbidität und Mortalität nach Eingriffen an der Leber Inaugural-Dissertation zur Erlangung des Doktorgrades der Medizin einer Hohen Medizinischen Fakultät der Ruhr-Universität Bochum vorgelegt von Anita Ide aus Bochum 2002 Dekan: Prof. Dr. med. G. Muhr Referent: Prof. Dr. med. M. Büsing Korreferent: Prof. Dr. med. G. Hohlbach Tag der Mündlichen Prüfung: 27.05.2003 1 Inhaltsverzeichnis 1. Abkürzungsverzeichnis……………………………………………………………… 3 2. Einleitung / Ziel der Arbeit ………………………………………………………….. 5 3. Allgemeiner Teil 3.1. Historische Entwicklung der Leberchirurgie...................................................…. 7 3.2. Präoperative Diagnostik..................................................................................... 12 3.3. Behandlungsstrategie........................................................................................ 13 3.4. Chirurgische Therapie........................................................................................ 16 3.4.1. Resektionsverfahren.......................................................................................... 21 3.4.1.1. Lagerung und Zugangswege..........................................................................… 24 3.4.1.2. Linksseitige bzw. rechtsseitige Hemihepatektomie.......................................…. 25 3.4.1.3. Erweiterte linksseitige bzw. rechtsseitige Hemihepatektomie........................... 31 3.4.1.4. Segmentresektion............................................................................................. 37 3.4.1.5. Atypische Segmentresektion.........................................................................… 41 3.4.1.6. Zystektomie....................................................................................................... 42 3.4.1.7. Leberabszess.................................................................................................... 42 3.5. Postoperative Phase.....................................................................................…. 43 4. Spezieller Teil 4.1. Patienten und Methoden................................................................................… 45 4.2. Ergebnisse…………………………………………………………………………… 61 5. Diskussion…………………………………………………………………………… 72 6. Zusammenfassung…………………………………………………………………. 77 7. Literaturverzeichnis…………………………………………………………………. 78 8. Danksagung…………………………………………………………………………. 9. Lebenslauf……………………………………………………………………………. 89 88 2 1. Abkürzungen A. ……………………………………… Arteria Abb. ……………………………………… Abbildung anatom. ……………………………………… anatomisch aPTT ……………………………………… aktivierte partielle Thromboplastinzeit AT III ……………………………………… Antithrombin III atyp. ……………………………………… atypisch bzgl. ……………………………………… bezüglich bzw. ……………………………………… beziehungsweise Ca. ……………………………………… Carcinom CT ……………………………………… Computertomographie D. ……………………………………… Ductus D-Bili ……………………………………… Direktes Bilirubin EK ……………………………………… Erythrozytenkonzentrat erw. ……………………………………… erweitert evtl. ……………………………………… eventuell FFP ……………………………………… Fresh Frozen Plasma GB ……………………………………… Gallenblase G-Bili ……………………………………… Gesamt-Bilirubin ggf. ……………………………………… gegebenenfalls GGT ……………………………………… Gamma-Glutamyl-Transferase GOT ……………………………………… Glutamat-Oxalacetat-Transaminase GPT ……………………………………… Glutamat-Pyruvat-Transaminase HCC ……………………………………… Hepatozelluläres Karzinom Hemi. ……………………………………… Hemihepatektomie i.d.R. ……………………………………… in der Regel Lig. ……………………………………… Ligamentum Ligg. ……………………………………… Liggamenta max. ……………………………………… maximal min. ……………………………………… Minuten mind. ……………………………………… mindestens MRT ……………………………………… Magnetresonanztomographie OP ……………………………………… Operation PHR ……………………………………… percent hepatic replacement by tumor R. ……………………………………… Ramus sec. ……………………………………… Sekunden 3 Seg. ……………………………………… Segmentresektion Tab. ……………………………………… Tabelle TK ……………………………………… Thrombozytenkonzentrat u. a. ……………………………………… unter anderen UICC ……………………………………… Union International Contre le Cancer V. ……………………………………… Vena v.a. ……………………………………… vor allem v. Chr. ……………………………………… vor Christus vs. ……………………………………… versus z.B. ……………………………………… zum Beispiel 4 2. Einleitung / Ziel der Arbeit Die Leberchirurgie stellt heute mit ihren Möglichkeiten einen Gewinn hinsichtlich der Behandlungen von benignen und insbesondere malignen Lebertumoren dar. Die letzten 2030 Jahre sind geprägt von einer zunehmenden Bedeutung der Leberresektionen, welche ohne Zweifel auch heute noch zu den anspruchsvollen Operationen in der Abdominalchirurgie gehören. Durch Kenntnis und Berücksichtigung des segmentalen anatomischen Aufbaus des Organs und Anwendung adäquater chirurgischer Techniken, sowie wachsender individueller und allgemeiner Erfahrung, ist die Leberresektion inzwischen, von einer sehr riskanten, anfangs eher experimentellen Operation, an den entsprechenden erfahrenen Zentren zu einem standardisierten Eingriff geworden. [9,53] Auf der Basis der erforderlichen chirurgischen, anästhesiologischen und intensivmedizinischen Erfahrung und nicht zuletzt aufgrund der hohen funktionellen Reservekapazität einerseits und der ausgeprägten Regenerationsfähigkeit andererseits können auch, ohne dass daraus dauerhafte funktionelle Einschränkungen resultieren, ausgedehnte Leberresektionen unter kurativer Zielsetzung mit einer postoperativen Mortalität von etwa 5% vorgenommen werden. Die meisten Erfahrungen liegen bisher mit den Metastasen kolorektaler Karzinome vor, welche die größte Gruppe sekundärer Malignome der Leber bilden (80-90%). Die verbleibenden Fälle verteilen sich auf Lebermetastasen bei Karzinomen anderen Ursprungs (Pankreas-, Magen-, Mamma-, Nasopharynx-Ca. u.a.), cholangiozelluläres Karzinom oder benignen Veränderungen wie den Leberzysten, der FNH, dem Leberhämangiom, dem Leberzelladenom und der Histoplasmose. [9] Die chirurgischen Resektionen bieten als einziges Behandlungsverfahren die Möglichkeit einer kurativen Behandlung mit der Chance eines längerfristigen tumorfreien Überlebens (2Jahresüberlebensrate Jahresüberlebensrate von etwa von etwa 70% (in der 25-30%), Literatur während stark im variierend) und Spontanverlauf 5kein Langzeitüberleben beobachtet werden kann. Trotz zahlreicher Studien, die den Einfluss der Leberresektion auf die Überlebensrate bei Patienten mit Metastasen kolorektaler Karzinome untersuchten, wird der Stellenwert einzelner prognostischer Faktoren kontrovers diskutiert. Die nach wie vor begrenzten Kenntnisse über tatsächlich relevante Prognosefaktoren unterstreichen somit die Notwendigkeit zusätzlicher kritischer Analysen. 5 Der Ansatzpunkt der vorliegenden Arbeit war, anhand einer retrospektiven Untersuchung, hierzu einen Beitrag zu leisten, mit dem Ziel, hierbei einerseits die Gesamtergebnisse einer einzigen Institution über einen Zeitraum von etwa drei Jahren darzustellen, andererseits evtl. bedeutsame Prognosekriterien herauszuarbeiten und mit den vorliegenden Ergebnissen anderer Arbeitsgruppen zu vergleichen. Zusätzlich wurde nicht nur der Frage bezüglich der Operationsmorbidität und –mortalität nach reserzierenden und ablativen (kryothrapeutischen) Eingriffen an der Leber bei malignen Leberveränderungen (wie bereits erwähnt insbesondere Lebermetastasen kolorektaler Karzinome) nachgegangen, sondern auch benigne Leberveränderungen unter diesem Aspekt analysiert und ein Vergleich hinsichtlich gutartiger und bösartiger Lebererkrankungen unter Berücksichtigung verschiedener Kriterien (Geschlecht, Alter, OP-Technik u.a.) aufgestellt. Für diese Untersuchungen wurden im Zeitraum von Mai 1998 bis Januar 2001 in der chirurgischen Abteilung des Knappschaftskrankenhauses Recklinghausen unter der Leitung von Professor Büsing 94 Patienten mit benignen und malignen Erkrankungen bzw. Tumoren an der Leber behandelt, wobei 89 Patienten unter kurativer Zielsetzung an der Leber operiert wurden. 72 Patienten unterzogen sich einer Leberresektion. Die restlichen 17 Patienten wurden einer anderen chirurgischen Therapie zugeführt. Bei 5 Patienten kam aufgrund der intrahepatischen Tumorausdehnung keine Leberresektion oder andere chirurgische Therapie zur Anwendung. Der Eingriff wurde bei diesen als explorative Laparotomie beendet. Die weitere Behandlung erfolgte dann unter palliativen Aspekt. 6 3.1. Historische Entwicklung der Leberchirurgie Die Leber- und Pfortaderchirurgie ist zwar mit ihrem heutigen Facettenreichtum ein neuzeitliches Phänomen und auch die Erkenntnisse und daraus resultierenden Entwicklungen erfuhren erst im letzten Jahrhundert einen explosionsartigen Anstieg, jedoch beschäftigten sich die Menschen schon seit Jahrhunderten mit der größten Drüse und mit einem Gewicht von etwa einem Kilogramm schwersten Organ unseres Körpers. Die Entwicklungsgeschichte der Leberchirurgie war in den frühen Anfängen von vielen Mythen und Spekulationen geprägt. Erste Hinweise zur Leberanatomie fanden sich in Dokumenten um 3500 v. Chr., in denen die Leber als das „schicksalstragende Organ“ herausgestellt wurde. Aber nicht nur die schicksalstragende Funktion, sondern auch der Glaube, die Leber sei Sitz der Organseele (Platon 427-347 v. Chr.) spiegeln die Bedeutung wieder [73]. In weiteren alten Schriften ließen sich immer wieder verschiedenartige Kenntnisse über einzelne Lebercharakteristika finden, wie z.B. die Regenerationsfähigkeit der Leber (Prometheussage, 4. Jh. v. Chr.) [29]; die Leber als blutreiches Organ (Homer, um 800 v. Chr.) [26]; die Größe, die Lage, die Konturen und die Blutversorgung der Leber (Herophilos 334-280 v. Chr.) [73]; die Leber als Ort der Blutbildung und der Verlauf der Pfortader (Galenus 129-199 v. Chr.) [19,40]. Galenus schuf mit seinen anatomischen Untersuchungen und Beobachtungen an verschiedenen Spezies ein umfassendes System der Medizin, den Galenismus, welches mehrere Jahrhunderte die Heilkunde und das medizinische Denken und Handeln bestimmte (Abb. 1). Detailreichere Aufschlüsse über die Anatomie der Leber gaben Capri (1470-1530) [14], Vesal (1514-1564) [69], Hildanus (1560-1643), Harvey (1578-1656) [30], Glisson (1592-1656) [26] und Ruysch. Vesal veröffentlichte 1543 sein Buch „De humani corporis fabrica libri septem“ und läutete damit den Beginn der wissenschaftlichen Anatomie der Neuzeit ein [69]. Der Name Hildanus wird im Zusammenhang mit einer um 1600 durchgeführten Exzision eines Leberstücks nach einem aufgetretenen Trauma genannt. Der Patient überlebte den Eingriff. Harvey entdeckte den großen Blutkreislauf und die Funktion des Herzens als dessen Antriebspumpe, wodurch die Heilung vieler Krankheiten und die Verlängerung der mittleren Lebenserwartung begründet wurde [30]. Glisson postulierte 1654 nach Eingriffen an der Leber mit Präparation der Lebergefäße die Verbindung zwischen Vena portae und Lebervenen [26]. Ruysch gab 1732 erste Hinweise bezüglich portaler Injektionsräume. 7 In Dokumenten des 17.,18. und 19. Jahrhunderts fanden sich vermehrt Hinweise über verschiedene Eingriffe an der Leber, die mit dem Überleben der Patienten einhergingen. MacPerson (1688) und Berta (1716) berichteten über Entfernungen von prolabierten Teilen der Leber nach Verletzungen im Abdominalbereich [6,47]. Ähnliches dokumentierte auch Garre´ 1889 mit Bezug auf den von Paul von Bruns durchgeführten Lebereingriffen während des Krieges 1871/1872 [23]. Thompson dokumentierte zwölf Leberverletzungen gründend auf die Schlacht von Waterloo und berichtete davon, dass einige Patienten den Eingriff an der Leber überlebten (1815). Morton (1846) und Lister (1865) nahmen eine gewisse Schlüsselposition im weiteren Verlauf der Leberchirurgie ein. Die sogenannten Urväter in den Bereichen Anästhesie und Antisepsis gaben mit ihren Entdeckungen die Möglichkeit, die Eingriffe an der Leber zu erweitern, zu präzisieren und in die Richtung der zukünftigen modernen Chirurgie zu lenken [29]. Abb. 1. Galen C. Stich nach Rubens [Deutsche Fotothek Dresden, Kramer] [73] Abb. 2. Langenbuch Karl J. A. [73] Die ersten Schritte im Bereich der Pfortaderchirurgie setzte von Eck 1877 mit einer im Tierexperiment durchgeführten laterolateralen portokavalen Anastomose [17]. Der Franzose Lenoir nahm diese Operation erstmalig am Menschen (1901), Rosenstein erstmalig erfolgreich bei einer Patientin mit Leberzirrhose und Aszites vor (1912). Eine Weiterentwicklung dieses Verfahrens u.a. in Form porto-systemischer Shunts erfolgten erst nach 1945 durch die Amerikaner Linton und Warren. Der Name Langenbuch (1846-1901) steht für die erste geplante und erfolgreiche Linksresektion der Leber beim Menschen (1888). Langenbuch entfernte einen sogenannten 8 Schnürlappen mittels Durchstichligaturen und behandelte eine postoperativ aufgetretene Nachblutung mit Umstechungen [41] (Abb. 2). William Williams Keen führte 1891 die erste Leberresektion in den USA durch. Er entfernte erfolgreich ein gestieltes Lebercystadenom. Eine Erweiterung der Kenntnisse auf dem Gebiet der Leberchirurgie erlangte man auch durch Ponfick, Tillmanns [28], Gluck und Meister, welche zum einen eine Resektionsfähigkeit von bis zu 70-80% zeigten, zum anderen die enorme Regenerationsfähigkeit der Leber nahezu bis zu ihrem Ausgangsgewicht herausstellten (1889). Mit ihren tierexperimentellen Studien hatten sie die Prinzipien der Leberresektion etabliert. Weitere Erungenschaften auf dem Weg zur heute existierenden modernen Leberchirurgie waren die von Kousnetzoff mit stumpfer Nadel ausgeführten Matratzennähte zur Blutstillung (1896), die Markierung der Grenzebene zwischen rechter und linker Leber durch Gallenblase und V. cava inferior (Cantlie 1898) [13], die weiterführende Kenntnis der Leberanatomie bezüglich der Aufteilung in einzelne Lappen und deren Blutversorgung (Cantlie 1898 und Rex 1888) [13,55], die experimentelle Unterbindung der Leberarterie von Haberer (1903) [28] und die stumpfe Parenchymdissektion der Leber von Anschütz (1903) [3]. 1886 beschrieb Lius die Entfernung eines kindskopfgroßen Lebertumors (1886) [45]. Aufgrund einer schwerwiegenden Nachblutung verstarb jedoch der Patient sechs Stunden nach dem Eingriff. Zwar berichteten Tiffany (1890) und Lucke (1891) über die ersten erfolgreichen Tumorresektionen, die Komplikation der intra- und postoperativ auftretenen Blutungen blieb aber bestehen. Ein Name drängt sich hierbei in den Vordergrund, durch dem der weitere Schritt in die heutige Richtung gebahnt wurde. Es war „Pringle“ (1908) und dessen herausragende Leistung der temporären Blutungskontrolle durch Okklusion des Ligamentum hepatoduodenale, durch welche Blutungen verringert und somit die Versorgung erleichtert wurde [52]. Das Prinzip der normothermen Lebereinflussstauung findet noch heute als sogenanntes Pringle-Manöver Anwendung. Auch Fortner und Huguet trugen zur Erweiterung der Erfahrungen auf diesem Gebiet bei: Fortner 1975 mit der IsolationsPerfusions-Technik der Leber-Teilresektion, Huguet 1978 mit der normothermen vaskulären Exklusion der Leber. Weitere Erkenntnisse auf dem Gebiet der Leberchirurgie errang James Israel (1848-1926). Ihm gelang mittels besonderer Abschnürligatur die Exstirpation eines Leberkavernoms (1911). Er begann die Resektion an der Grenzlinie zwischen beiden Lappen mit sukzessiv angelegten großen Umstechungsnähten [36]. 9 Die erste erfolgreiche Hemihepatektomie rechts gelang Walter Wendel 1911 durch Ligatur des rechten Astes der A. hepatica propria nach Abgang der A. cystica bei Leberzellkarzinom mit Unterlassen der zentralen Unterbindung des rechten Pfortaderastes und Anlegen von Durchstichligaturen mit Hilfe einer Öhrsonde im Bereich der Resektionsfläche [71] (Abb. 3). Die erste erfolgreiche Resektion einer kolorektalen Lebermetastase publizierte Cattell 1940. Die 50er Jahre des 20. Jahrhunderts spiegelten zusammen mit Hjortsjös Topographie der intrahepatischen Gallenwege (1951), Healeys anatomischen Erkenntinssen der Leberarterie (1953) und Couinauds anatomischer Darstellung der Leber in acht Segmenten (1954) den Durchbruch in der Leberchirurgie wieder [15] (Abb. 4). Abb. 3. Wendel W. [73] Abb. 4. Couinaud C. [73] Die Erweiterung der anatomischen und topographischen Kenntnisse, die Verbesserung der operativen Technik, die Kenntnisse zur Leberischämie und der Einsatz protektiver Maßnahmen sowie die Erfahrungen auf den Gebieten der Narkose und Intensivtherapie ebneten den Weg zur heute existierenden modernen Leberchirurgie. Jedoch blieb ein weiteres Problem gerade im Bereich der Resektion maligner Tumoren bestehen. Für die operative Verfahrenswahl waren und sind auch heute noch in der Leberchirurgie zwei gegensätzliche Aspekte bedeutsam: die onkologische Radikalität und die postoperative Leberfunktion bzw. funktionelle hepatische Reserve. Bei einer gesunden Leber sind im Extremfall Resektionen von bis zu 80% durchaus vertretbar, aber bei einer kranken Leber bzw. einer Leber, bei der die postoperative Leberfunktion nicht gewährleistet bzw. die funktionelle hepatische Reserve erschöpft ist, ist die Grenze der operativen Therapie erreicht. Erst durch Tom E. Starzl wurde diese Grenze überwunden (Abb. 5). Er führte 1963 die erste orthotope Lebertransplantation und 1968 die erste erfolgreiche orthotope Lebertransplantation durch [67]. Daraufhin folgten die erste Lebertransplantation in Deutschland von Gütgemann (1968) [27] und die Trisegmentektomie und Transplantation einer größenreduzierten Leber von Starzl (1975) [67]. Eine Zunahme der 10 Lebertransplantationen zeigte sich mit der erheblichen Verbesserung der Immunsuppression durch Cyclosporin, welche auf die Arbeit von Calne zurückging (1980) [12]. Die Transplantationen in den 80er Jahren wurden geprägt von der Split-liver Transplantation von Pichlmayr und Bismuth (1984), der ex situ / ante situm Resektion von Pichlmayr (1988) (Abb. 6) und der Leber-Lebendspende von Raia (1989) [51,59,72]. Abb. 5. Starzl T [73] Abb. 6. Pichlmayr R [73 Letztendlich waren die exakten Kenntinsse der Leberanatomie, die Möglichkeit der Blutungskontrolle, das Wissen über die Leberischämie, der Einsatz protektiver Maßnahmen, ein optimiertes Regime bei Narkose und Intensivtherapie sowie die Verbesserungen in der operativen Technik die Wegbereiter für die moderne Leberchirurgie mit ihrem Facettenreichtum und Möglichkeiten. Auf dieser Grundlage und immer wieder angeregt durch klinische Erfordernisse konnten weitere zahlreiche chirurgisch-technische Innovationen entwickelt werden, deren Idee und Ausführung inzwischen von vielen übernommen worden ist. Gerade das Streben die Morbidität und Mortalität nach Eingriffen an der Leber, welche schon im Verlauf der Geschichte einen enormen Rückgang verzeichneten (anfangs lag die Operationsletalität nur unwesentlich unter 100%, heute ist eine Letalität von 5% und darunter zu verzeichnen), weiterhin zu senken wird den Ehrgeiz weitere gezieltere Therapien zu erforschen aufrecht erhalten. Aber nicht nur im makroskopischen Bereich werden die Forschungen weitergehen, auch zukünftige Bestrebungen lassen Möglichkeiten auf dem Gebiet der Mikroskopie verbunden mit Erkenntinssen auf subzellulärer Ebene deutlich werden. Eine Optimierung der Leberzellisolierung, -kultivierung und -transplantation ist anzustreben. Auch die Idee der sogenannten Entwicklung einer „künstlichen Leber“ ist heute keine Utopie, sondern ein Gebiet reger medizinischer Forschung. 11 3.2. Präoperative Diagnostik Die Wahl der Untersuchungsverfahren und die Reihenfolge ihres Einsatzes hängen im Einzelfall von der klinischen Fragestellung ab. Dabei können zwei Ausganssituationen unterschieden werden, zum einen die Charakterisierung eines bekannten Herdes mit bekannter oder unbekannter Ätiologie, zum anderen die Detektion fokaler Läsionen bei bekannten oder Anforderungen vermutetem an die Tumorleiden. Beide Untersuchungstechnik, Fragen welche sich stellen nach unterschiedliche dem jeweiligen Ausgangsbefund richtet. Die diagnostischen Anforderungen bei Tumoren, deren Ätiologie unbekannt ist erstrecken sich zunächst auf die Charakterisierung und Dignitätsabschätzung, die bei denen die Ätiologie bekannt ist auf Staging und Monitoring. Steht jedoch die Suche nach dem Primärtumor und/oder den Metastasen im Vordergrund zentriert sich die diagnostische Anforderung auf die Detektion. Die in die Studie aufgenommenen Patienten lassen sich in zwei Gruppen einteilen: Zum einen stellten sich Patienten mit bekanntem oder vermutetem Tumorleiden vor, bei denen dann die Detektion fokaler Läsion im Vordergrund stand; zum anderen stellten sich Patienten vor, bei denen im Rahmen einer ungezielten Leberuntersuchung (meist durch Sonographie oder Computertomographie) eine herdförmige Läsion entdeckt wurde. Bei der Frage nach der Dignität konnte bei einem Teil der Patienten schon aus der Erstuntersuchung anhand des sonographischen bzw. computertomographischen Befundes eine definitive Diagnose gestellt werden (dies betraf vor allem die zystischen Lebererkrankungen, die Leberhämangiome und die fokalen nodulären Hyperplasien), so dass hier keine weitere Diagnostik erforderlich war. Bestand jedoch noch eine Unsicherheit bezüglich der Diagnose wurde eine erweiterte Diagnostik (MRT/Szintigraphie) durchgeführt; in Verbindung mit der führenden Klinik konnten so vor allem das hepatozelluläre Karzinom, Metastasen bei bekanntem Tumorleiden und Leberabszesse diagnostiziert werden. Konnte auch aufgrund der erweiterten Diagnostik keine definitive Diagnose gestellt werden stand die Biopsie oder Resektion als Verfahren der Wahl im Vordergrund, wodurch letztendlich auf bioptisch histologischem Weg die Diagnose gesichert werden konnte. Unabhängig von der erst erzielten Tumordiagnose oder einem schon bekannten Tumorleiden hängt die angestrebte diagnostische Strategie und Wahl des Untersuchungsverfahrens in erster Linie von den therapeutischen Konsequenzen ab. Besteht schon bei der Eingansuntersuchung Irresektabilität erübrigt sich die weitere 12 Diagnostik. Ist die Frage der Resektabilität offen sind Spiral-CT und MRT Methode der Wahl. Wird erst intraoperativ eine Irresektabilität festgestellt, kann die Operation auch als explorative Laparotomie beendet werden (was immerhin auf 5 Patienten in der Studie zutrifft) [22]. 3.3. Behandlungsstrategie Die Wahl des Behandlungsverfahrens richtet sich nach dem Ausmaß der Lebererkrankung. Während benigne Lebertumoren anhand operativer Verfahren kurativ behandelt werden können, besteht bei den malignen Erkrankungen der Leber häufig das Problem der Resektabilität. Ob ein Lebertumor resektabel ist richtet sich nach dem Allgemeinzustand des Patienten, dem Tumorstadium, der lokalen Ausdehnung und der nach der Resektion zu erwartenden Restfunktion der Leber. Besteht allgemeine oder lokale Inoperabilität muss individuell abgewogen werden, ob lokale (Alkoholinjektion, Thermokoagulation, Kryotherapie, Laser-Photokoagulation, Gentherapie, elektromagnetische Strahlentherapie) bzw. Wellen regionale (Radiowellen, (regionale Mikrowellen), Chemotherapie, Chemoembolisation) oder systemische medikamentöse Therapieverfahren (systemische Chemotherapie, Hormontherapie) oder nur supportive Maßnahmen angewandt werden. Bei auf die Leber beschränkten irresektablen Tumoren ist eher ein regionales Therapieverfahren das Mittel der Wahl. Wird der Lebertumor erst durch Exploration als irresektabel gesichert, kann die Implantation eines Arteria-hepatika-Katheter zur regionalen Chemotherapie erwogen werden. Die Chemoembolisation steht bei nichtresektablem HCC als Therapiemöglichkeit zur Verfügung. Alle regionalen, nichtreserzierenden Verfahren haben mehrere Eigenschaften gemeinsam. Zum einen richtet sich die Therapie direkt gegen den Tumor, zum anderen wird eine fokale Nekrose erzeugt. Desweiteren können Lokalisation und Ausdehnung der Nekrosen durch den Therapeuten beeinflusst werden und die Nekrosen verbleiben im Gewebe [25]. Da im Rahmen der prospektiven Studie neben der Resektion auch konservative Verfahren angewandt wurden (Chemotherapie, Ethanolinjektion, Kryochirurgie und Strahlentherapie) sollen diese im Folgenden kurz erörtert werden. Die 1983 in Japan entwickelte perkutane Alkoholinjektion beruht auf eine Entstehung einer kompletten Koagulationsnekrose nach Injektion von 100% Ethanol in den Tumorherd und das umgebende Gewebe. Diese Therapie erfolgt in mehrfachen Sitzungen. Vor allem unilokuläre, möglichst durch eine Pseudokapsel gut abgegrenzte Tumoren, die einen Maximaldurchmesser von etwa 3 cm aufweisen, scheinen geeignet. Die Therapie scheint 13 sinnvoll bei einer begrenzten Anzahl von Herden. Limitiert wird der Indikationsbereich dieser Methode durch eine fehlende Begrenzung der meist weit fortgeschrittenen Tumoren zum umgebenden normalen Leberparenchym bzw. bei sehr kapselnah liegenden Tumoren. Vorteile sind die geringe Patientenbelastung, die niedrigen Kosten und die wiederholte Therapiemöglichkeit. Die in Lokalanästhesie durchgeführte Punktion erfolgt unter Ultraschalloder CT-Kontrolle, wobei unter behutsamen Zurückziehen der Nadel einige Milliliter des 100%igen Alkohols injiziert werden. Die zur Nekrose führende Wirkung von Alkohol wurde sowohl im Tierversuch als auch in humanen, reserzierten Tumoren nachgewiesen. Die seit 1963 bei Lebermetastasierung durchgeführte Kryotherapie basiert auf der ultraschallgesteuerten Vereisung eines Tumors anhand von im Tumor plazierten Sonden mittels flüssigem Stickstoff (-196°Celsius, da die Nukleationstemperatur bei verschiedenen Zellarten unterschiedlich ist und bei Tumorzellen nicht genau bekannt ist, wird im Schrifttum zur Tumorzerstörung eine Temperatur von wenigstens –50°C gefordert). Die Vereisung führt zu einer Nekrosenbildung (Absterben von Gewebe), wobei im Rahmen eines multifaktoriellen Geschehens bei der Gefrierschädigung von Zellen die intrazelluläre Eisbildung nach Erreichen der sogenannten Nukleationstemperatur das entscheidende letale Ereignis sein dürfte. Ein wichtiger Vorteil der Kryochirurgie gegenüber anderen lokalen, nichtreserzierenden Therapieverfahren ist die mechanische Fixation der Tumorzellen durch die extrazelluläre Eismatrix. Dadurch wird eine Dissemination der Tumorzellen während des Eingriffs verhindert. Die Wirksamkeit der Kryotherapie korreliert mit der Größe der Tumoren und der kompletten Nekrose aller Tumorzellen. Letzeres Ziel kann in der Regel bei multiplen Tumoren nicht erreicht werden. Zur Verstärkung kann eine regionale Chemotherapie angewendet werden. Hauptindikationen für die Kryobehandlung sind solitäre, nichtresektable Tumoren < 6cm und die komplementäre Therapie bei Resektion nicht im Gesunden oder mit zu geringem Sicherheitsabstand [25]. Steht die Chemotherapie als Therapieverfahren der Wahl im Vordergrund wird bevorzugt die regionale anstelle der systemischen Therapie angewandt. Zielvorstellung der regionalen Chemotherapie ist es, eine hohe lokale Zytostatikakonzentration d.h. höhere lokale Medikamenten-Konzentrationen mit gesteigerter lokaler Wirksamkeit in das Tumorgewebe zu erzielen und andererseits die Rate an unerwünschten Nebenwirkungen, wie sie vorwiegend bei systemischer Applikation auftreten, zu verringern. Die Gabe des Medikamentes erfolgt transarteriell über die A. gastroduodenalis in die A. hepatica permanent implantierten Portkatheter-Systemen basierend auf der Tatsache, dass die Tumoren (HCC, Metastasen) in erster Linie arteriell versorgt werden. Kontraindikationen für das Therapieverfahren sind extrahepatische Metastasen, ein Tumorbefall der Leber von 14 mehr als 50%, primär nicht resektabel erscheinende Metastasen oder intraoperativ als nicht resektabel erwiesene Metastasen, ein Quick-Wert von weniger als 50%, Thrombozytenkonzentrationen von weniger als 50G/l, Serumbilirubin von mehr als 7mg/dl oder ein massiver Aszites, desweiteren eine Enzephalopathie oder ein Karnofsky-Index weniger als 60%. In Bezug auf sekundäre Lebermalignome ist die regionale FUDR(Fluordeoxyuridin) Therapie heute gerade wegen der hohen Kosten und hepatobiliären Toxizität bis hin zu einer biliären Sklerose zugunsten der Folinsäure/5-FU-Therapie (nach ART-I-Protokoll, „Arbeitsgemeinschaft Regionale Tumortherapie“) weitgehend ersetzt, welche zu ähnlich hohen Remissionsraten und zu sehr günstigen Überlebenszeiten führt (entsprechend unserem Krankengut). Auch bei den primären Lebermalignomen ist ein Wandel zu verzeichnen. Die früher geltende FUDRAM- (FUDR+Adriamycin+Mitomycin) Therapie nach Patt et al. hat zugunsten der Therapie mit einer Kombination aus Cisplatin und Adriamycin von Carr et al. an Bedeutung verloren. Neben der regionalen Chemotherapie ist eine transarterielle Chemoembolisation möglich, unter deren Annahme der lokale Wirkungsgrad der regionalen arteriellen Chemotherapie durch die gleichzeitige Applikation des Chemotherapeutikums zusammen mit einem Embolisat, z.B. dem öligen Kontrastmittel Lipiodol, gesteigert werden kann. Lipiodol wird selektiv in den Tumorgefäßen gespeichert. Doxorubicin oder Epirubicin werden als Monotherapie, Cisplatin und Mitomycin in Kombination mit verschiedenen Embolisaten am häufigsten verwendet. Ein weiteres Therapieverfahren ist die konventionelle, extrakorporale Bestrahlung. Sie hat in der Behandlung von Lebertumoren einen marginalen Stellenwert aufgrund der durch die Strahlenexposition verursachten Leberfibrose und der Strahlenresistenz der HCC. Vor allem 131Jod-Lipiodol oder 90Yttrium fanden als sogenannte „interne“ Radiojodtherapie durch intraarterielle Injektion und lokaler Tumorzerstörung Anwendung [25]. Es darf jedoch nicht vergessen werden, dass allen hier genannten Verfahren keine kurative Rolle in der Behandlung von Lebertumoren zukommt. Sie ermöglichen im günstigsten Fall eine Tumorverkleinerung, häufig einen Wachstumsstillstand und erreichen dadurch sekundäre palliative Effekte. Ob eine Lebensverlängerung möglich ist, kann heute nicht sicher beurteilt werden. Es hat sich herausgestellt, dass sich gerade die regionalen/lokalen Therapieverfahren für die Tumorbehandlung eignen, da vor allem bei zirrhotischer Leber das nicht-tumoröse Parenchym nicht oder nur wenig beeinträchtigt wird. Es ist darauf zu achten, dass jede Behandlungsmaßnahme definierte Indikationen sowie Behandlungsausschlüsse hat, die im Einzelfall geprüft werden müssen. 15 3.4 Chirurgische Therapie Nach Abschluß der präoperativen Diagnostik und bei bestehender Resektabilität, tritt die chirurgische Therapie in den Vordergrund. Insbesondere etablierte sich gerade im Bereich maligner Erkrankungen eine zunehmend aggressive chirurgische Therapie mit potentiell kurativer Zielsetzung in der Behandlung von resektablen malignen Lebertumoren. Für die Darstellung der chirurgischen Vorgehensweise werden im Folgenden die in der Studie hauptsächlich verwendeten Methoden der chirurgischen Therapie benigner und maligner Lebererkrankungen vorgestellt. Für die operative Verfahrenswahl sind in der Leberchirurgie, insbesondere bei bestehender Malignität, zwei gegensätzliche Aspekte bedeutsam: die onkologische Radikalität und die postoperative Leberfunktion bzw. funktionelle hepatische Reserve. Bei einer gesunden Leber sind im Extremfall Resektionen von bis zu 80% durchaus vertretbar aber nicht grundsätzlich voraussetzbar. Eine klinische relevante Leberinsuffizienz kann allerdings nur ausgeschlossen werden, wenn weniger als 50% des funktionalen Leberparenchyms reserziert werden. Desweiteren ist darauf zu achten, dass das Verfahren der Wahl einen tumorfreien Resektionsrand garantiert, ohne dabei unnötig intaktes Parenchym zu opfern. Letztendlich ist die Kenntnis und Beachtung der segmentorientierten Anatomie und der Gefäßstrukturen grundlegende Voraussetzung für eine chirurgische Therapie [7,66]. Die an der intrahepatischen Aufteilung der portalen Strukturen orientierte Gliederung der Leber erfolgt nach Couinaud. Die Leber lässt sich demnach in zwei Hälften (linker und rechter Leberlappen), fünf Sektoren (lateraler (Segment VI und VII) und paramedianer (Segment V und VIII) Sektor der rechten Seite, paramedianer Sektor (Segment IV) sowie linker Lappen (Segment II und III) der linken Seite und Lobus caudatus) und zehn Segmente (I(a+b), II, III, IV(a+b), V, VI, VII, VIII“ aufteilen). Der linke Leberlappen besteht aus den Segmenten II, III, IV(a+b), der rechte Leberlappen aus den Segmenten V, VI, VII und VIII. Segment I(a+b) entspricht dem Lobus caudatus [44,64] (Abb. 7: Segment I befindet sich hinter (über) der Leberpforte und ist auf der Abbildung nicht zu erkennen). Die Leber durchziehen zwei Systeme von Gefäßstraßen, zum einen das System der afferenten Blutgefäße bestehend aus der Arteria hepatica und Vena portae, zum anderen das System der efferenten Blutgefäße bestehend aus den Lebervenen. Die beiden afferenten Blutgefäße laufen mit den intrahepatischen Gallengängen immer als Trias 16 hepatica (Glissonsche Trias) vereint. Die Lebertrias wird von etwas Bindegewebe und Lymphgefäße begleitet und bildet etwa dreieckige Zwickel zwischen den Leberläppchen [43]. Abb. 7. Segmentale Anatomie der Leber (nach Couinaud) [10] Die arterielle Versorgung der Leber erfolgt über die Arteria hepatica propria. Sie kommt aus dem Truncus coeliacus und ist die Fortsetzung der Arteria hepatica communis nach Abgang der Arteria gastroduodenalis. Bevor sie sich in der Porta hepatis in den Ramus dexter und den Ramus sinister aufteilt (häufigster Fall) gibt sie noch zwei Äste ab: die Arteria gastrica dextra zur kleinen Magenkrümmung und die Arteria cystica zur Gallenblase und zum Gallenblasengang (Abb.8). Für den linken Leberlappen wird meist noch eine Aufteilung für den lateralen Sektor beobachtet: eine sogenannte Arteria hepatica media für das Segment IV und eine Arteria lobi caudati sinister für den linken Teil des Lobus caudatus. Für den rechten Leberlappen beobachtet man noch eine Aufteilung für den posterioren und anterioren Sektor sowie rechten Teil des Lobus caudatus (Abb.9). Neben diesem hauptsächlich vorzufindenen arteriellen Gefäßverlauf sind noch einige Variationen bekannt. Zum einen können Ramus dexter und Ramus sinister getrennt aus dem Truncus coeliacus oder ein zusätzlicher Ast zum linken Leberlappen aus der Arteria gastrica sinistra entspringen, zum anderen besteht die Möglichkeit, dass die Arteria hepatica propria aus der Arteria mesenterica inferior oder der Ramus dexter aus der Arteria mesenterica superior entspringt und am Hinterrand zwischen Ductus hepatocholedochus und Pfortader zur Leber läuft. Die Leberarterienaufteilung im Hilus kann man gelegentlich als Trifikation vorfinden. Dies ist bei Eingriffen am Ligamentum hepatoduodenale, am Pankreaskopf und bei Einlegen eines arteriellen Ports zur Chemotherapie zu beachten [9,43,64]. 17 Abb. 8. Verteilung der Äste des Truncus coeliacus (nach Broelsch E, Kremer K, von Lüdinghausen M: Leber. In: Kremer K et al. , Chirurgische Operationslehre, Thieme-Verlag, Stuttgart New York 1993) 1. Truncus coeliacus 8. R. sinister a. hepaticae 2. A. hepatica communis 9. R. dexter a. hepaticae 3. A. gastrica sinistra 10. A. cystica 4. A. splenica 11. R. sinister accessorius der A. gastrica sinistra 5. A. hepatica propria 12. R. dexter accessorius der A. gastroduodenalis 6. A. gastroduodenalis 13. R. dexter accessorius der A. mesenterica superior 7. A. gastrica dextra 14. Sonderfall einer A. gastrica sinstra als Ast des R. sinister der A. hepatica propria Abb. 9. Schemazeichnung der intrahepatischen Arterienverzweigung (nach Skandalakis. In: Köckerling F, Waclawiczek H. W: Leberchirurgie, JA Barth-Verlag, Heidelberg Leipzig 1999) 18 Die Lebervenen verlaufen unabhängig von den Ästen der Vena portae ähnlich wie die Lungenvenen an den Segmentgrenzen immer von ventrokaudal in leichtem Bogen zum kraniodorsalen Leberrand bzw. zum oberen Abschnitt des Sulcus venae cavae und sind damit wichtige Grenzmarker für den Chirurgen. Es wird zwischen einer oberen Gruppe: rechte Lebervene (V. hepatica dextra), mittlere Lebervene (V. hepatica intermedia) und linke Lebervene (V. hepatica sinistra) und einer unteren Gruppe kleinerer, sehr variabler Venen (retrohepatische Venen, Vv. hepaticae inferiores, posteriores sive dorsales) unterschieden. Die Vena hepatica dextra liegt in der rechten Grenzspalte und entsorgt die posterioren und anterosuperioren Segmente (Segmente V,VI,VII und Teile von VIII). Die Vena hepatica media verläuft i. d. R. in der Trennebene zwischen rechtem und linkem Versorgungsgebiet und projiziert sich meist auf die Hauptgrenzspalte der Facies diaphragmatica. Sie entsorgt v.a. den Lobus quadratus und große Teile des rechten vorderen und linken mittleren Segmentes (vorwiegend Segmente IV und V) sowie des hinteren Abschnittes von Segment VIII. Die Vena hepatica sinistra liegt in der linken Grenzspalte bzw. der Tiefe des hinteren Abschnittes der Fissura ligamenti venosi. Sie entsorgt die linken lateralen Segmente (Segmente II und III) und die oberen Abschnitte des medialen Segmentes (IV) und gelegentlich auch des Lobus caudatus (Abb.10). Die retrohepatischen Venen sind eigenständige Abflüsse des paramedianen Leberparenchyms, insbesondere aus dem Lobus caudatus und aus den kavanahen Teilen des rechten Lappens. Die beiden Gruppen münden unmittelbar unter dem Foramen venae cavae des Zwerchfells in die Vena cava inferior [9,43]. Bei typischen Leberteilresektionen ist der Pfortaderverlauf zu beachten. Die 6-11 cm lange Pfortader mit einem Durchmesser von 10-12 mm entsteht aus der hinter dem Pankreaskopf gelegenen Vereinigung von Vena splenica und Vena mesenterica superior in Höhe des 2. Lendenwirbels. Nach Unterkreuzung des Duodenums erfolgt der weitere Verlauf im Ligamentum heptoduodenale. In der Regel teilt sich die Pfortader unmittelbar vor Erreichen des Leberparenchyms in einen kürzeren etwas stärkeren rechten und längeren etwas schwächeren linken Hauptast. Der linke Hauptstamm (R. sinister) verläuft bis in die linke intersektoriale Fissur extrahepatisch, dann gibt er Äste zum Segment II ab. Danach teilt er sich auf und verzweigt sich in die Segmente III und IV. Zu beachten ist, dass aus dem Hauptstamm ein bis drei posteriore Äste zum Segment I-links ziehen. Der rechte Hauptstamm nimmt an der rechten Seite der portalen Bindegewebsplatte die Vena cystica auf und teilt sich am Eintritt in das Parenchym nach Abgabe des R. caudatus (Segment I unter Einschluss des Processus caudatus) in einen Ast für den anterioren und einen Ast für den posterioren Sektor (Abb.10). Weiterhin ist zu beachten, dass in vereinzelten Fällen die Pfortaderäste für beide Sektoren unabhängig voneinander entspringen können. Diese 19 Variante ist bei der linksseitigen Hemihepatektomie von Bedeutung. Unterbindet man den Pfortaderast nach dem Abgang des ersten großen nach rechts ziehenden Astes, ohne die Aufteilung zu beachten, kommt es zu einer Durchblutungsstörung der Segmente V und III [9]. Abb. 10. Venöse und portalvenöse Gefäßarchitektur der Leber Der rechte und linke Leber-Gallen-Gang (Ductus hepaticus dexter et sinister) vereinigen sich i. d. R. am Hilum und damit extrahepatisch und zwar knapp unterhalb der Birfucatio v. portae zum Ductus hepaticus communis. Bevor dieser sich als Ductus choledochus fortsetzt mündet noch der Ductus cysticus in den Ductus hepaticus communis (Abb.11) [9]. Abb. 11. Gallenwegsystem Abb. 12. Intrahepatische Gallengangsverzweigung (nach Skandalakis 1989. In: Köckerling F, Waclawiczek H. W: Leberchirurgie, JA Barth-Verlag 1999) 20 3.4.1 Resektionsverfahren Heute stehen verschiedene Resektionsverfahren zur Verfügung. Bei peripher gelegenen Tumoren geringeren Ausmaßes oder unklaren Läsionen können kleine, nicht anatomische Resektionen durchgeführt werden. Bei größeren Tumoren oder sonstigen Prozessen, die auf ein oder mehrere Segmente bzw. auf einen Leberlappen beschränkt sind, werden Standardresektionen wie Mono- oder Polysegmentresektionen bzw. links- oder rechtsseitige Hemihepatektomien vorgenommen. Liegen Tumoren vor, welche die anatomischen Grenzen zwischen linken und rechten Leberlappen überschreiten, können erweiterte Resektionen durchgeführt werden, wobei dann ein größerer Parenchymverlust in Kauf genommen wird. Unter erweiterten Hemihepatektomien kann auch die Kombination einer klassischen Leberresektion mit Resektion der zentralen Gallenwege und/oder der essentiellen Gefäße (Pfortader, Leberarterie, Lebervene, Hohlvene) verstanden werden. Bei diesen ausgedehnten Resektionen kann die komplette vaskuläre Okklusion oder die Resektion an der gekühlten, mit Konservierungslösung durchspülten Leber notwendig werden. Als sogenannte Perfusionslösung stehen heute die durch ihr günstigeres Fließverhalten und geringerem Risiko hyperkaliämischer Herz-Rhythmus-Störungen aufgrund des niedrigeren Kaliumgehaltes bevorzugte Histidin-Tryptophan-Ketogluturat (HTK)- Lösung nach Bretschneider und die University-of-Wisconsin-Lösung zur Verfügung. Eine Infiltration der großen Lebervenen, der Vena cava inferior sowie gegebenenfalls der zentralen Hilusstrukturen verbunden mit aufwendigen Gefäßrekonstruktionen kann eine Resektion in situ erheblich erschweren oder unmöglich machen. Um das Operationsgebiet zugänglicher zu machen kann in diesem Fall die Leber teilweise oder vollständig aus dem Körper genommen werden, sogenannte Ante-situ- und Ex-situ-Resektionen der Leber. Dieses Verfahren wird aber eher in seltenen Fällen angewandt. Liegen Tumoren vor, die als sicher benigne eingestuft werden (z.B. Hämangiome; Leberzysten) versucht man diese tumorösen Prozesse mit Hilfe von Enukleationen oder Zystentdachungen zu entfernen, um möglichst das gesamte gesunde Leberparenchym zu erhalten [53]. Unter der Voraussetzung, dass die meisten Lebertumoren anfangs auf ihr Segment begrenzt wachsen, hat sich die segmentorientierte Resektionstechnik als optimales Operationsverfahren der Wahl in Bezug auf Radikalität und Funktionalität (die portalvenöse, lebervenöse und arterielle Versorgung der Restleber wird nicht kompromittiert; die Orientierung der intrahepatischen Gallenwege am segmentalen Aufbau der Leber gewährleistet die biliäre intrahepatische Drainage des verbleibenden Restleberparenchyms) herausgestellt, da sie sich an den entsprechenden anatomischen Grenzflächen orientiert. 21 Es werden vier Segmentresektionsformen unterschieden. Ist der Tumor nur auf ein Segment begrenzt wird eine Monosegmentresektion (komplette Entfernung einer einzelnen anatomischen Einheit) durchgeführt. Sind mehrere nebeneinander liegende Segmente betroffen steht die Bi- und Polysegmentresektion im Vordergrund (Entfernung mehrerer miteinander verbundener Einzelsegmente). Liegen die Tumorherde an verschiedenen Bereichen der Leber wird die Mehrfach-Segmentresektion (simultan an verschiedenen Bereichen der gleichen Leber durchgeführte Segmentresektion) angewandt. Die vierte Resektionsform, die „segmentorientierte Modifikation klassischer Resektionen“ ist eine Untergruppe von Polysegmentresektionen, bei der die Lobektomie rechts unter Erhaltung des Lobus quadratus im Vordergrund steht. Die Resektion kann als eigentliche Segmentresektion durchgeführt werden, bei der das Leberparenchym möglichst exakt in der gefäßarmen Grenzschicht durchtrennt wird. Anwendung findet dieses Verfahren bei umschriebenen benignen Veränderungen und bei malignen Tumoren, bei denen die prä- und intraoperative Untersuchung eine ausreichende Distanz zwischen Tumorrand und venösem Hauptstamm bzw. portaler Aufzweigungsebene nachgewiesen hat. Bei ungünstig gelegenen Malignomen, die nahe an die intrahepatischen Grenzflächen heranreichen oder diese sogar verlagern findet nicht die Segmentresektion sondern die sogenannte Perisegmentresektion Anwendung. In unmittelbarer Umgebung solcher TumorKontaktbereiche wird daher die Resektionsebene unter Schonung des portalen Zuflusses, 510 mm in das jeweilige Nachbarsegment verschoben. Im Falle einer über die Segmentgrenzen hinausreichende Tumorausbreitung ist eine an der anatomischen Gliederung orientierte Resektion nicht mehr möglich. Als Therapieverfahren der Wahl steht dann die atypische Segmentresektion im Vordergrund [66]. Bei den Hemihepatektomien unterscheidet man drei Resektionsformen. Die rechtsseitige Hemihepatektomie umfasst die Entfernung der Segmente V-VIII. Die linksseitige Hemihepatektomie geht mit dem Verlust der Segmente II-IV und eventuell zusätzlich Segment I einher. Bei der linkslateralen Leberresektion werden die Segmente II und III entfernt. Breitet sich der Tumor über die anatomischen Grenzen aus werden, wie bereits erwähnt, erweiterte Hemihepatektomien durchgeführt. Die erweiterte Rechtsresektion umfasst zusätzlich zu den Segmenten V-VIII die Segmente IVa und IVb und gegebenenfalls Segment I. Bei der erweiterten Linksresektion werden neben den Segmenten I-IV die Segmente V und VIII entfernt, so dass nur die Segmente VI und VII zurückbleiben [53]. Die Leberresektionsverfahren konnten in den vergangenen zwei Jahrzehnten durch die Fortschritte der Operationstechnik wesentlich verbessert werden. Aus einem zunächst eher experimentell durchgeführten Eingriff hat sich zusehends ein standardisierter Eingriff entwickelt. Die Leberresektion, insbesondere zur Behandlung metastasierender, solider 22 Tumoren, kann heute mit sehr geringer perioperativer Letalität (Senkung von 10-25% auf mittlerweile <5% bzw. sogar <3%) und postoperativer Morbidität (Senkung von 30 auf mittlerweile deutlich <5%) durchgeführt werden. Die meisten Erfahrungen liegen bisher mit den Metastasen kolorektaler Karzinome vor. Die 5-Jahresüberlebenszeiten betragen hier bei primärer, aber auch bei wiederholter Metastasenresektion jeweils 25-30%. Durch adjuvante Therapiemaßnahmen konnte die Prognose bisher nicht verbessert werden (im Gegensatz zu unserer Studie) [42]. Die chirurgische Therapie ist dann indiziert, wenn Größenwachstum und Perforationsgefahr mit erheblicher Blutung, sowie Abflussstörungen im Bereich der Leberpforte eine Eliminierung eines benignen Tumors erforderlich machen bzw. im Falle eines malignen Leberprozesses ein multizentrisches Tumorwachstum, eine extrahepatische Metastasierung, multiple Sekundärmetastasen, ein diffuser Befall beider Leberhälften, eine Infektion an den Gallenwegen, eine Sepsis, eine Invasion in das angrenzende Zwerchfell oder das Ligamentum heaptoduodenale, eine eingeschränkte Lebersyntheseleistung, ein Einbruch des Tumors in die abführenden Lebervenen und Pfortader und ein schweres Trauma ausgeschlossen sind. Liegen Sekundärmetastasen, Metastasen beschränkter Anzahl, seitenbegrenzte Metastasen oder primäre Leberkarzinome vor, welche nur in einer Hälfte lokalisiert sind und eine ausreichende Funktion des Restparenchyms aufweisen, besteht eine absolute Operationsindikation [9]. Während kleinere Lebereingriffe kaum mit einem Risiko behaftet sind, können größere Eingriffe enorme Risiken und Komplikationen nach sich ziehen. Sollten größere Eingriffe durchgeführt werden, ist die Kontrolle bzw. Substitution des Eiweiß- und Zuckerstoffwechsels und der Blut und Leberwerte von entscheidender Bedeutung. Neben der Überprüfung der Gerinnungsfaktoren, der Transaminasen und des Serum-Bilirubins ist die präoperative Abschätzung der Parenchymfunktion mit einer Faktorenanalyse der Faktoren II, V und VII und Kontrolle von Albumin, Cholesterin und Bilirubin anzustreben. Desweiteren müssen sich die OP-Risiken und Komplikationen im perioperativen Verlauf bewusst gemacht werden. Neben möglichen intra- und postoperativen Blutungen sowie Infektionen nach Substitution von Blut- und Blutprodukten sind als weitere wichtige Komplikationsmöglichkeiten zu nennen: die Gefahr des Pneumothorax; mögliche Luftembolien bei der Operation an den Lebervenen; Gallengangsverletzungen, Fisteln und intraabdominelle Infektionen bei Operationen am Hilus sowie Peritonitiden und Pankreatitiden; Magen-, Ösophagus-, Milzund Zwerchfellverletzungen während des Eingriffs; Pleuraergüsse; subphrenische Flüssigkeitsansammlungen; Wundinfektionen, Platzbauch und Hernienbildung durch die große Bauchinzision oder die Möglichkeit des Leberversagens aufgrund der zu großen Funktionseinbuße bei einem zu geringen Restparenchym (seltener bei Linksresektion der Leber) [9]. 23 Kremer, Lierse, Platzer, Schreiber und Weller geben beispielsweise eine postoperative Letalität von 5 und 25% bei Rechtsresektion der Leber an, während selektive Eingriffe und gutartige Tumoren mit einer Letalität von <2% einhergehen. Das Risiko der Nachblutung liegt <5%. Mit subphrenischen Flüssigkeitsansammlungen, rechtsseitgen Pleuraergüssen und Drainierung ist in 15-25% der Fälle zu rechnen. Erweiterte Rechtsresektionen gehen ebenfalls mit einer postoperativen Letalität von 5-25% einher, während hier mit einer subphrenischen Flüssigkeitansammlung, rechtsseitgen Pleuraerguß und Drainierung in 2535% der Fälle zu rechnen ist. Gallefisteln und Gallelecks können bei der erweiterten rechtsseitgen Hemihepatektomie in 3-5% der Fälle auftreten [9]. 3.4.1.1 Lagerung und Zugangswege Am Anfang der chirurgischen Therapie steht die richtige Lagerung des Patienten im Vordergrund. Die bevorzugte Lagerung des Patienten ist die leicht überstreckte Rückenlagerung mit Auslagerung des rechten Arms. Bei ausgedehnten Rechtsresektionen wird der Patient nahe der rechten Tischkante gelagert und der rechte Arm an einem Querbügel vor dem Kopf befestigt. Der sterile Bereich dehnt sich von der hinteren Axillarlinie über das gesamte Abdomen bis an die Clavicula aus. Die endgültige Festlegung hinsichtlich Resektabilität und Verfahrenswahl fällt, speziell im Falle multipler maligner Läsionen, erst bei der Laparotomie. Als Zugang wird die quere Oberbauchlaparotomie mit Erweiterung in der Medianlinie bis zum Xyphoid (Mercedes-Stern) empfohlen. Bei ausschließlich rechtsseitiger Resektion kann eine L-förmige rechtsseitige Oberbauchlaparotomie bzw. J-Inzision gewählt werden (rechtsseitiger subcostaler Schnitt, der median bis zum Xyphoid verlängert wird) [9,44,60]. Anhand der nach der Laparotomie durchführbaren Palpation der Leber, Exploration des Abdomens und intraoperativen Sonographie wird letztendlich die Entscheidung der Resektionsform getroffen. Vor allem die Exploration der Lymphabflusswege ist bei maligner Lebererkrankung von entscheidender Bedeutung für die weitere Vorgehensweise. Mittels Schnellschnittuntersuchung kann ein Lymphknotenbefall bestätigt oder ausgeschlossen werden. Anhand der intraoperativen Sonographie ist der Tumor nochmals darstellbar, weitere Herde können mit hoher diagnostischer Sicherheit nachgewiesen bzw. ausgeschlossen werden und eine genaue Lagebestimmung des Tumors zu den Lebergefäßen ist möglich. 24 3.4.1.2. Linksseitige bzw. rechtsseitige Hemihepatektomie [8, 9, 44] 1.) Identifizierung von Diagnose und Indikation. 2.) Eröffnen des Abdomens und Exploration des gesamten Situs sowie Darstellung der Leberoberfläche, Palpation und ultrasonographische Evaluation des Gesamtorgans. [ Besondere Aufmerksamkeit gilt einem möglichen Lokalrezidiv (bei Vorliegen von Lebermetastasen) oder einem extrahepatischen Lymphknotenbefall. ] 3.) Durchtrennung der Ligg. falciforme hepatis und triangulare sinistrum bzw. dextrum (Abb. 13). 4.) Cholezystektomie. [ Inzision des Peritoneum entlang des D. choledochus zum Calotschen Dreieck und Aufsuchen und Durchtrennen der A. cystica und des D. cysticus; anschließend Entfernung der Gallenblase aus dem Leberbett mit Inzision der Leberkapsel. ] Abb. 13. Mobilisation des betreffenden Leberlappens (nach Broelsch E, Kremer K, von Lüdinghausen M: Leber. In: Kremer K et al., Chirurgische Operationslehre, Thieme-Verlag 1993. Kleines Bild nach Köckerling F, Waclawiczek H. W: Leberchirurgie, JA Barth-Verlag 1999) 25 5.) Lymphadenektomie. [ Bei positivem Befall der Lymphknoten wird die Resektion abgebrochen. ] 6.) Anschlingen des Lig. hepatoduodenale und der V. cava inferior. 7.) Präliminare Gefäßdurchtrennung zur Unterbrechung der Blutversorgung zu den zu reserzierenden Bereichen mit Verhinderung einer Tumorzellausschwemmung bei weiterer Mobilisation der Leber durch Absetzen der nach links bzw. rechts ziehenden Gefäße und Strukturen (A. hepatica sinistra, V. portae (linker Ast), D. hepaticus sinister mit Demarkation des linken Leberlappens bzw. A. hepatica dextra, V. portae (rechter Ast), D. hepaticus dexter mit Demarkation des rechten Leberlappens). [ Der unilaterale Arterienast wird hilusnah, der entsprechende Pfortaderast im Bereich der Gabel durchtrennt und übernäht. ] (Abb. 14) Abb. 14. Präliminare Gefäßdurchtrennung (nach Buck T. In: Broelsch E, atlas of liver surgery, Churchill Livingstone 1993. Kleines Bild nach Broelsch E, Kremer K, von Lüdinghausen M: Leber. In: Kremer K et al., Chirurgische Operationslehre, Thieme 1993) 26 8.) Linksseitige Hemihepatektomie: Eröffnen des kleinen Netzes mit evtl. Absetzen einer akzessorischen linken Leberarterie und Präparation entlang dem Lig. Venosum. [ Im Falle einer Mitresektion des Segments I wird die gesamte V. cava freigelegt. ] Rechtsseitige Hemihepatektomie: Isolation der retrohepatischen V. cava inferior, indem von kaudal nach kranial kleine Lebervenenmündungen aus dem rechten Leberlappen bzw. dem Segment I in die V. cava mittels Clips oder Übernähungen abgesetzt werden (Abb. 15). 9.) Linksseitige Hemihepatektomie: Mobilisierung und Darstellung der mittleren und linken Lebervene und Absetzen der linken Lebervene Æ komplette Demarkation des linken Leberlappens. [ Die Unterbindung der linken Lebervene wird erst durchgeführt, wenn Sicherheit bzgl. der Identifizierung der linken und rechten Lebervene besteht, da die linke und mittlere Lebervene oft gemeinsam münden. Es besteht erhebliche Blutungsgefahr. ] (Abb. 16) Rechtsseitige Hemihepatektomie: Mobilisierung, Darstellung und Absetzen der rechten Lebervene Æ komplette Demarkation des rechten Leberlappens. [ Es besteht erhebliche Blutungsgefahr. ] Wenn nach Mobilisierung der Leber keine Möglichkeit besteht die jeweilige Lebervene zu verschließen (z.B. große Nähe des Tumors zur Vena cava), ist eine totale vaskuläre Okklusion (Aufhebung des Blutflusses im Ligamentum hepatoduodenale (Pringle-Manöver) und Okklusion der Vena cava infra- und suprahepatisch) möglich. Wenn zuvor keine präliminare Gefäßunterbindung erfolgt ist, wird die Leberresektion bzw. Hemihepatektomie in Inflow-Okklusion im 15- max.20- minütigem-Intervall mit einem Tourniquet durchgeführt (Pringle-Manöver). 10.) Intraoperative Sonographie. [ Wiederholte Überprüfung der Resektionslinie in Bezug auf Lebervene und intrahepatischer Pfortaderaufteilung. Es ist darauf zu achten, dass ein Sicherheitsabstand von mindestens 1 cm zum Tumor eingehalten wird. ] 27 Abb. 15. Isolation der Vena cava inferior nach Buck T. In: Broelsch E, atlas of liver surgery, Churchill Livingstone 1993. Abb. 7. Isolation der Vena cava inferior nach Broelsch E; illustrated by Buck T: atlas of liver surgery. Churchill Livingstone 1993. Abb. 16. Abklemmen und Absetzen der linken Lebervene nach Buck T. In: Broelsch E, atlas of liver surgery, Churchill Livingstone 1993. 28 11.) Markierung der Resektionslinie mittels Thermokoagulation vom Gallenblasenfundus zum Mündungsbereich der linken Lebervene bei der linksseitigen Hemihepatektomie bzw. Markierung der Resektionslinie mittels Thermokoagulation bis in das Gallenblasenbett und bis zur V. cava bei der rechtsseitgen Hemihepatektomie. 12.) Kapseldurchtrennung (elektrische Nadel) und Parenchymdurchtrennung (Schere, Clips, Overholt-Klemmen, Ligaturen und Umstechungen) (Abb. 17,18). 13.) Blutstillung (bipolare Elektrokoagulation, ggf. Argon-Beamer, Clips, Ligaturen, Umstechungen). [ Diffuse Blutungen werden mit Hilfe der vorübergehenden Kompression der Resektionsfläche (z.B. heiße Bauchtücher) gestillt. ] Wenn der Gallengang nicht präliminar durchtrennt wurde, wird er bei der Resektion offen abgesetzt. Es ist sinnvoll den Gallengang bzw. Zystikusstumpf zunächst lang zu belassen und erst am Ende der Resektion zu versorgen, um über ihn mittels Kochsalzinjektion ein Galleleck ausfindig zu machen und zu verschließen. Ist ein Galleleck aufgetreten, wird dies mittels monofilen Faden umstochen. Nachdem die Leberresektion erfolgt ist, wird, falls zuvor unterbrochen, die Leberperfusion wieder freigegeben. 14.) Einlegen von Easy-flow-Drainagen (Blutaustritt) und evtl. dünnkalibrigen T-Drains (Galleaustritt). 15.) Versiegelung der Resektionsfläche mit Fibrinklebern, Kollagenvliesen oder ArgonBeamer. Nach Rechtsresektion Refixation des Lig. falciforme an der vorderen Bauchwand um eine Rotation der Restleber nach rechts (evtl. Gefäßabknickung) zu vermeiden. Nach Linksresektion Fixation des linken Segmentes am Lig. triangulare sinistrum (Torsionsvermeidung der linken Lebervene). 16.) Schichtweiser Bauchdeckenverschluss mit fortlaufender Peritonealnaht, Faszieneinzelknopfnähten und Hautnähten. 29 Abb. 17. Nach Entfernung des linken Leberlappens vorliegende Resektionsfläche (nach Buck T. In: Broelsch E, atlas of liver surgery, Churchill Livingstone 1993) Abb. 18. Nach Entfernung des rechten Leberlappens vorliegende Resektionsfläche nach Buck T. In: Broelsch E, atlas of liver surgery, Churchill Livingstone 1993. 30 3.4.1.3 Erweiterte linksseitge bzw. rechtsseitge Hemihepatektomie [8,9,39] 1.) Identifizierung von Diagnose und Indikation. 2.) Eröffnen des Abdomens und Exploration des gesamten Situs sowie Darstellung der Leberoberfläche, Palpation und ultrasonographische Evaluation des Gesamtorgans. [ Besondere Aufmerksamkeit gilt einem möglichen Lokalrezidiv (bei Vorliegen von Lebermetastasen) oder einem extrahepatischen Lymphknotenbefall. ] 3.) Durchtrennung der Ligg. falciforme hepatis und triangulare sinistrum bzw. dextrum. 4.) Aufsuchen und Durchtrennen des D. cysticus und der A. cystica nach Inzision des Peritoneums entlang des D. choledochus zum Calotschen Dreieck (Abb. 19). 5.) Lymphadenektomie. [ Bei positivem Befall der Lymphknoten wird die Resektion abgebrochen. ] 6.) Anschlingen des Lig. hepatoduodenale und der V. cava inferior (Abb. 19). Abb. 19. Präparation im Hilus mit Anschlingen der A. hepatica sinistra und des linken Ductus hepaticus (nach Broelsch E, Kremer K, von Lüdinghausen M: Leber. In: Kremer K et al., Chirurgische Operationslehre, Thieme 1993) 31 7.) Explorative Präparation im Hilus im Bereich der Gallengangsgabel und der Arterienbifurkation mit Darstellung der rechten bzw. linken Leberarterie und der entsprechenden Tumorgrenze. 8.) Absetzen der nach links bzw. rechts ziehenden Gefäße und Strukturen (A. hepatica sinistra, D. hepaticus sinister bzw. A. hepatica dextra, D. hepaticus dexter) (Abb. 20). [ Die linke bzw. rechte Arterie wird mit geringem Sicherheitsabstand von der Bifurkation zur rechten bzw. linken Leberarterie ligiert und abgesetzt. Bei Tumorinfiltration Gefäßresektion und Rekonstruktion durch ein Interponat (autologe V. saphena magna). ] 9.) Aufsuchen und Absetzen des linken bzw. rechten Pfortaderastes nach Isolation der Pfortader rechts bzw. links mit Darstellung des Tumorrandes Æ Demarkation des entsprechenden Lappens (Abb. 21). [ Bei Mitresektion des Lobus quadratus Absetzen des entsprechenden Pfortaderastes und des entsprechenden arteriellen Astes. Bei Wandinvasion des Tumors in die Pfortader besteht die Möglichkeit der Gefäßresektion mit anschließender End-zu-EndAnastomose oder Ersatz durch ein Venen-Patch aus der V. saphena magna. ] 10.) Erweiterung der Resektion durch Absetzen des D. hepaticus dexter bzw. sinister und Lymphadenektomie. Abb. 20. Absetzen des Ductus hepaticus dexter und Durchtrennung der A. hepatica dextra Abb. 21. Absetzung des rechten Pfortaderastes (nach Broelsch E, Kremer K, von Lüdinghausen M: Leber. In: Kremer K et al., Chirurgische Operationslehre, Thieme 1993) 32 11.) Erweiterte linksseitige Hemihepatektomie: Eröffnen des kleinen Netzes mit evtl. Absetzen einer akzessorischen linken Leberarterie und Präparation entlang dem Lig. venosum. [ Im Falle einer Mitresektion des Segments I wird die gesamte V. cava freigelegt. ] Erweiterte rechtsseitige Hemihepatektomie: Isolation der retrohepatischen V. cava inferior, indem von kaudal nach kranial kleine Lebervenenmündungen aus dem rechten Leberlappen bzw. dem Segment I in die V. cava mittels Clips oder Übernähungen abgesetzt werden (Abb. 22). 12.) Erweiterte linksseitige Hemihepatektomie: Mobilisierung und Darstellung der linken und mittleren Lebervene und Absetzen dieser Æ komplette Demarkation des entsprechenden Leberbereichs. [ Es besteht erhebliche Blutungsgefahr. ] Erweiterte rechtsseitige Hemihepatektomie: Mobilisierung, Darstellung und Absetzen der rechten und mittleren Lebervene, wobei die rechte Vene vor der Resektion, die mittlere Vene während der Parenchymphase durchtrennt werden Æ komplette Demarkation des entsprechenden Leberbereichs [ Es besteht erhebliche Blutungsgefahr. ] (Abb. 22,23) Wenn nach Mobilisierung der Leber keine Möglichkeit besteht die jeweilige Lebervene zu verschließen (z.B. große Nähe des Tumors zur Vena cava), ist eine totale vaskuläre Okklusion (Aufhebung des Blutflusses im Ligamentum hepatoduodenale (Pringle-Manöver) und Okklusion der Vena cava infra- und suprahepatisch) möglich. Wenn zuvor keine präliminare Gefäßunterbindung erfolgt ist wird die Leberresektion bzw. Hemihepatektomie in Inflow-Okklusion im 15- max.20- minütigem-Intervall mit einem Tourniquet durchgeführt (Pringle-Manöver). 13.) Intraoperative Sonographie. [ Wiederholte Überprüfung der Resektionslinie in Bezug auf Lebervene und intrahepatischer Pfortaderaufteilung. Es ist darauf zu achten, dass ein Sicherheitsabstand von mindestens 1 cm zum Tumor eingehalten wird. ] 33 Abb. 22. Isolation der retrohepatischen V. cava inferior und Absetzen der V. hepatica dextra (nach Broelsch E, Kremer K, von Lüdinghausen M: Leber. In: Kremer K et al., Chirurgische Operationslehre, Thieme 1993) Abb. 23. Absetzen der mittleren Lebervene (nach Buck T. In: Broelsch E, atlas of liver surgery, Churchill Livingstone 1993) 34 14.) Markierung der Resektionslinie mittels Thermokoagulation. 15.) Kapseldurchtrennung (elektrische Nadel) und Parenchymdurchtrennung (Schere, Clips, Overholt-Klemmen, Ligaturen und Umstechungen) (Abb. 25). Bei der erweiterten Linksresektion ist während der Parenchymdissektion auf die nach rechts ziehenden Hilusstrukturen zu achten, bei der erweiterten Rechtsresektion auf die nach links-lateral ziehenden Gefäß- und Gallengänge. 16.) Blutstillung (bipolare Elektrokoagulation, ggf. Argon-Beamer, Clips, Ligaturen, Umstechungen). [ Diffuse Blutungen werden mit Hilfe der vorübergehenden Kompression der Resektionsfläche (z.B. heiße Bauchtücher) gestillt. ] Nachdem die Leberresektion erfolgt ist, wird, falls zuvor unterbrochen, die Leberperfusion wieder freigegeben. 17.) Bei vorliegenden Klatskin-Tumoren (Tumoren im Bereich der Gallengangsgabel) erfolgt nach zusätzlicher Resektion der Hepatikusgabel und des gesamten extrahepatischen Gallengangs bis zum Duodenum an dieser Stelle eine Gallengangsrekonstruktion durch eine Cholangiojejunostomie mit Roux-Y-Schlinge (Abb. 24). 18.) Einlegen von Easy-flow-Drainagen (Blutaustritt) und evtl. dünnkalibrigen T-Drains (Galleaustritt). 19.) Versiegelung der Resektionsfläche mit Fibrinklebern, Kollagenvliesen oder ArgonBeamer. Nach Rechtsresektion Refixation des Lig. falciforme an der vorderen Bauchwand um eine Rotation der Restleber nach rechts (evtl. Gefäßabknickung) zu vermeiden. Nach Linksresektion Fixation des linken Segmentes am Lig. triangulare sinistrum (Torsionsvermeidung der linken Lebervene). 20.) Schichtweiser Bauchdeckenverschluss mit fortlaufender Peritonealnaht, Faszieneinzelknopfnähten und Hautnähten. 35 Abb. 24. Gallengangsrekonstruktion (nach Broelsch E, Kremer K, von Lüdinghausen M: Leber. In: Kremer K et al., Chirurgische Operationslehre, Thieme 1993) Abb. 25. Nach der erweiterten Rechtsresektion vorliegende Resektionsfläche (nach Buck T. In: Broelsch E, atlas of liver surgery, Churchill Livingstone 1993) 36 3.4.1.4. Segmentresektion (am Beispiel der Resektion des Segmentes IV) [8,9,66] 1.) Identifizierung von Diagnose und Indikation. 2.) Eröffnen des Abdomens und Exploration des gesamten Situs sowie Darstellung der Leberoberfläche, Palpation und ultrasonographische Evaluation des Gesamtorgans, insbesondere Exploration des Hilus und Darstellung der Gallengangsgabel. [ Besondere Aufmerksamkeit gilt einem möglichen Lokalrezidiv (bei Vorliegen von Lebermetastasen) oder einem extrahepatischen Lymphknotenbefall. ] 3.) Cholezystektomie. 4.) Lymphadenektomie und Probeexzision. [ Bei positivem Befall der Lymphknoten wird die Resektion abgebrochen. ] 5.) Anschlingen der V. cava inferior. 6.) Exploration des Lebervenendreiecks im Bereich der suprahepatischen V. cava Inferior. 7.) Durchtrennung der Ligg. falciforme hepatis und triangularia. 8.) Darstellung der A. hepatica sinistra und dextra sowie des D. hepaticus sinister und Präparation der A. hepatica sinistra und des D. hepaticus sinister. 9.) Darstellung und Durchtrennung des entsprechenden Leberartereinastes (meist aus der linken Leberarterie kommend) und Gallengangsastes (Abb. 26). 10.) Präparation im Lig. teres und Isolation des medialen Randes des Lobus quadratus sowie Darstellung und Absetzen des Pfortaderastes für das Segment IV Æ Demarkation des entspechenden Bereichs (Abb. 27). 11.) Intraoperative Sonographie. [ Wiederholte Überprüfung der Resektionslinie mit Evaluation des Verlaufs der mittleren und der linken Vene für die Dissektion zwischen beiden. ] 37 Abb. 26. Absetzen des Arterien- und Gallengangastes (nach Broelsch E, Kremer K, von Lüdinghausen M: Leber. In: Kremer K et al., Chirurgische Operationslehre, Thieme 1993) Abb. 27. Präparation im Lig. teres hepatis, Resektionsfläche (nach Buck T. In: Broelsch E, atlas of liver surgery, Churchill Livingstone 1993) 38 12.) Kapselinzision (elektrische Nadel) und Parenchymdissektion (Schere, Clips, OverholtKlemmen, Ligaturen und Umstechungen) entlang dem Lig. falciforme mit Umstechungsligaturen der Strukturen des linken lateralen Segmentes (Abb. 28), sowie Parenchymresektion vom Hilus nach kranial entlang der V. cava inferior und Absetzen des medialen Segmentes vom rechten Leberlappen (Abb. 29). [ Versorgung der Lebervenenäste mit Umstechungen bei der Dissektion. ] An dieser Stelle ist ein Ausklemmen der V. cava inferior gelegentlich hilfreich. Die Hilusgefäße im Lig. hepatoduodenale brauchen in der Regel nicht ausgeklemmt werden. 13.) Parenchymdissektion entlang dem Gallenblasenbett auf der rechten Seite. 14.) Blutstillung (bipolare Elektrokoagulation, ggf. Argon-Beamer, Clips, Ligaturen, Umstechungen). [ Diffuse Blutungen werden mit Hilfe der vorübergehenden Kompression der Resektionsfläche (z.B. heiße Bauchtücher) gestillt. ] Nachdem die Leberresektion erfolgt ist, wird, falls zuvor unterbrochen, die Leberperfusion wieder freigegeben. 15.) Einlegen von Easy-flow-Drainagen (Blutaustritt) und evtl. dünnkalibrigen T-Drains (Galleaustritt). 16.) Versiegelung der Resektionsfläche mit Fibrinklebern, Kollagenvliesen oder ArgonBeamer. 17.) Schichtweiser Bauchdeckenverschluss mit fortlaufender Peritonealnaht, Faszieneinzelknopfnähten und Hautnähten. 39 Abb. 28. Parenchymresektion Abb. 29. Parenchymresektion (nach Broelsch E, Kremer K, von Lüdinghausen M: Leber. In: Kremer K et al., Chirurgische Operationslehre, Thieme 1993) Abb. 30. Nach Entfernung des Segments IV vorliegende Resektionsfläche (nach Buck T. In: Broelsch E, atlas of liver surgery, Churchill Livingstone 1993) 40 3.4.1.5. Atypische Segmentresektion (am Beispiel der Keilexzision) [9,53] 1.) Identifizierung von Diagnose und Indikation. 2.) Eröffnen des Abdomens und Exploration des gesamten Situs sowie Darstellung der Leberoberfläche, Palpation und ultrasonographische Evaluation des Gesamtorgans. 3.) Ggf. Anschlingen des Lig. hepatoduodenale als Vorsichtsmaßnahme bzw. PringleManöver (je nach Ausmaß der Resektionsfläche) oder manuelle Kompression des angrenzenden Leberparenchyms. 4.) Markierung der Resektionsfläche mittels Thermokoagulation. 5.) Kapseldurchtrennung (elektrische Nadel) und Parenchymdurchtrennung (Schere, Clips, Overholt-Klemmen, Ligaturen und Umstechungen). [ Es ist darauf zu achten, dass ein Sicherheitsabstand von mindestens 1 cm zum Tumor eingehalten wird. ] 6.) Blutstillung (bipolare Elektrokoagulation, ggf. Argon-Beamer, Clips, Ligaturen, Umstechungen). [ Diffuse Blutungen werden mit Hilfe der vorübergehenden Kompression der Resektionsfläche (z.B. heiße Bauchtücher) gestillt. ] Nachdem die Exzision erfolgt ist, wird, falls zuvor unterbrochen, die Leberperfusion wieder freigegeben. 7.) Einlegen von Easy-flow-Drainagen (Blutaustritt) und evtl. dünnkalibrigen T-Drains (Galleaustritt). [ Vorhandene Gallelecks werden umstochen. ] 8.) Versiegelung der Resektionsfläche mit Fibrinklebern, Kollagenvliesen oder ArgonBeamer. 9.) Schichtweiser Bauchdeckenverschluss mit fortlaufender Peritonealnaht, Faszieneinzelknopfnähten und Hautnähten. 41 3.4.1.6. Zystektomie (am Beispiel Echinococcus cysticus) [9,53] 1.) Identifizierung von Diagnose und Indikation. 2.) Eröffnen des Abdomens und Darstellung der Leberoberfläche sowie ultrasonographische Evaluation des Gesamtorgans. 3.) Sorgfältige Abdeckung des Operationsbereichs, damit der infektiöse Zysteninhalt nicht in die freie Bauchhöhle gelangt. 4.) Punktion der Zyste und Injektion von hypertoner (10-20%iger) Kochsalzlösung oder 40%iger Glukoselösung (Abtötung der Erreger vor Zystenöffnung). 5.) Perizystektomie bzw. Zystektomie. [ Bei der Perizystektomie Echinokokkuszyste und kommt es Lebermembran zu einer unter totalen Exstirpation von simultaner Versorgung der durchtrennten Blut- und Gallegefäße. Es resultiert eine sorgfältige zu versorgende Parenchymwunde. Die Resthöhle wird je nach Größe mit breit fassenden Nähten verschlossen, mit einem Netzzipfel tamponiert oder offen gelassen. ] 6.) Sanierung der Höhle. 7.) Evtl. T-Drainage bei Mitbeteiligung des Gallenwegssystems. 8.) Drainage und Wundverschluss. [ Eine alternative Möglichkeit ist die Marsupialisation, bei der die gespaltene, nicht infizierte Zyste ausgeräumt und zusammen mit Peritoneum, Faszie am Hautrand fixiert wird. Ist dies nicht möglich, sorgfältige Tamponade zur Abgrenzung von der Umgebung und Drainage. ] 3.4.1.7. Leberabszess [9] 1.) Sonographische Lokalisationsbestimmung. 2.) Sonographische Punktion und Absaugung (Keim- und Resistenzbestimmung). 3.) Drainage oder Freilegung, Tamponade und Drainage. 42 3.5. Postoperative Phase Die postoperative Phase kann von verschiedenen Komplikationen begleitet sein. Generell stellt sich die Frage, inwieweit die einzelnen chirurgischen Verfahren durchgeführt werden können, um eine ausreichende postoperative Restleberfunktion zu gewährleisten. Während einzelne Segmentresektionen ohne großen Parenchymverlust ein wesentlich geringeres Risiko einer postoperativen Leberinsuffizienz in sich tragen, erhöhen Hemihepatektomien, im Besonderen erweiterte Leberteilresektionen mit ausgedehntem Parenchymverlust das Risiko einer ausgeprägten postoperativen Leberinsuffizienz. Eine ausreichende Restleberfunktion ist eine lebenswichtige Voraussetzung einer kurativen Resektion. Beinhaltet das operative Verfahren während der Leberresektion auch die Gefäßresektion im Leberhilus, so kann das Risiko derart erhöht sein, dass nach der Resektion eine Thrombenbildung auf arterieller oder portalvenöser Seite mit Kompromittierung der marginalen Restleberfunktion einen letalen Leberausfall nach sich zieht [73]. Aber nicht nur die erweiterten Resektionsverfahren, sondern generell jeglicher reserzierender Lebereingriff kann ursächlich für eine postoperative Leberdysfunktion sein. Komplikationen bei Leberresektionen sind neben der postoperativen Leberinsuffizienz und der intraoperativen Blutung auch das Auftreten von Lebernekrosen, Gallefisteln, postoperativen Blutungen oder subphrenischen Abszessen. Ursachen der postoperativen Leberdysfunktion sind neben der Verschlechterung des schon bestehenden Grundleidens (Virushepatitis, chronische Lebererkrankung, Leberverfettung), auch Medikamente durch die Anästhesie (z.B. Halothan), intra- bzw. postoperative Transfusionen und Blutverluste, eine postoperative nicht ausreichende Restleberfunktion, eine bestehende Hypothermie aufgrund der zu langen Abklemmzeit der Leber mit Beeinträchtigung der Lebersyntheseleistung und resultierendem hepatorenalen Syndrom, ein ischämischer Leberschaden, Schock, Hypoxie oder extrahepatische Gallengangsobstruktionen durch Gallengangsverletzung, Choledocholithiasis und Pankreatitis oder eine postoperative Cholestase. Gallelecks können zu einem Biliom führen oder sogar eine gallige Peritonitis nach sich ziehen. Bei ausgedehntem Parenchymverlust treten häufig Pneumonien aufgrund der herabgesetzten Gesamtfunktion der von Kupfferschen Sternzellen im Restleberparenchym auf und nach Manipulationen am Zwerchfell können Pleurareizergüsse entstehen [9,39,42,44,53]. Die dargestellten Gefahren und Komplikationen zeigen in eingehender Deutlichkeit, dass nicht erst postoperativ nach Auftreten der Komplikation gehandelt, sondern schon präoperativ und auch intraoperativ abgewogen werden muss, z.B. inwieweit die Leberresektion überhaupt möglich ist, um eine ausreichende Restleberfunktion zu 43 gewährleisten bzw. welche Möglichkeiten es gibt das Risiko einer postoperativen Leberinsuffizienz zu reduzieren (z.B. große persönliche Erfahrung des Operateurs; präoperative Chemoembolisation mit Induktion einer Hypertrophie des Leberlappens; die Stimulation der Leberregeneration anhand von hepatischen Wachstumsfaktoren; präoperative gentherapeutische Einschleusung von Effektorgenomen der Leberregeneration) [39,53]. Das intraoperative Vorgehen entscheidet über die postoperative Situation. Ein Beispiel hierfür ist die Blutungskontrolle mit Hilfe des Pringle-Manövers, des Argon-Beamers, der Kompression, des Fibrinklebers und Kollagenvlieses. Anhand dieser Methoden können große Blutverluste vermieden und damit wiederum die Morbidität und Letalität gesenkt werden. Neben der beschriebenen unmittelbar postoperativ vorliegenden Phase gibt es auch noch die auf längere Dauer zu betrachtende postoperative Zeit. Während die meisten Patienten mit benignen Veränderungen nach kurativ reserzierendem Eingriff als geheilt angesehen werden, hängt die Prognose nach Resektion maligner Tumoren von der Tumorgröße, dem Vorliegen von Tumorthromben oder intrahepatischen Metastasen, von einem tumorfreien Resektionsrand von mindestens 1cm und von der Leberfunktion ab. Bei entsprechend positiven Selektionskriterien werden für Tumoren unter 5cm 5-Jahres-Überlebensraten bis 80% beschrieben. In durchschnittlichen Patientenkollektiven liegt diese Rate bei 20-40%. Im Falle primärer Lebermalignome ist eine Nachsorge im strengen Sinn nur für reserzierte Patienten sinnvoll. Die Nachsorge beschränkt sich auf 3-monatliche klinische Kontrollen mit zusätzlicher Sonographie und Bestimmung des Alpha-Feto-Proteins. Am häufigsten zeigt sich ein Tumorrezidiv intrahepatisch und in seltenen Fällen kann dann erneut eine Resektion diskutiert werden bzw. eine Chemoembolisation in Frage kommen. Im Falle sekundärer Lebermalignome erfolgen alle sechs Monate regelmäßige Kontrollen, sowie eine klinische Untersuchung, Sonographie des Abdomens, Röntgenuntersuchung des Thorax und gegebenenfalls Bestimmung der Tumormarker. Im Anschluss an den stationären Aufenthalten der Patienten besteht die Möglichkeit der Rehabilitation gründend auf Sicherung bzw. Verbesserung der Lebensqualität unter Voraussetzung eines definierten Rehabilitationsbedarfs und individueller Rehabilitationsfähigkeit [74]. Aus heutiger Sicht und gegenüber den vergangenen Jahrzehnten sind die Kompliaktionsraten hinsichtlich der perioperativen Morbidität deutlich gesenkt worden (unter 15%). Auch die Letalität ist auf unter 10% (sogar <5% bis <3%) zurückgegangen [42,74]. 44 4.1. Patienten und Methoden Im Zeitraum vom 22.05.1998 bis 10.01.2001 wurden im Knappschaftskrankenhaus Recklinghausen, Klinik für Allgemein- und Unfallchirurgie, Akademisches Lehrkrankenhaus der Ruhr-Universität Bochum, unter Leitung von Professor Büsing 94 Patienten mit benignen (n=26) bzw. malignen (n=68) Lebertumoren/-erkrankungen behandelt (Abb.31). Im Falle einer benignen Erkrankung der Leber stellten die Leberzysten den höchsten Anteil dar (n=9), gefolgt von der fokalen nodulären Hyperplasie (n=6), dem Leberhämangiom (n=5) und nekrotischen Veränderungen bzw. Entzündungen (n=3). Die Histoplasmose (n=1), der Leberabszess (n=1) und das Leberzelladenom (n=1) stellten Einzelfälle dar (Abb.32). Im Falle einer malignen Lebererkrankung stellten die Lebermetastasen den höchsten Anteil dar (n=57), wovon die meisten Patienten mit Lebermetastasen kolorektaler Karzinome vorstellig wurden (n=47), gefolgt von dem hepatozellulären Karzinom (n=4), dem Klatskin-Tumor (n=2), dem cholangiozellulären Karzinom (n=1) und der Gallenblasen-Karzinom-Infiltration in die Leber (n=1). Bei 3 Patienten ist der Tumor aufgrund der Datenlage nicht ermittelbar (Abb.33). 73 Patienten unterzogen sich einer alleinigen Leberresektion (n=66) oder zusätzlichen Kryotherapie (n=7). Bei einem Patienten konnte das Therapieverfahren nicht ermittelt werden. Die verbliebenen 21 Patienten wurden einer anderen Therapie zugeführt (n=16) oder waren aufgrund der Tumorausdehnung inoperabel (n=4); der Eingriff wurde bei diesen als explorative Laparotomie beendet. Die weitere Behandlung erfolgte dann unter palliativen Aspekt anhand lokaler bzw. regionaler Behandlungsverfahren (Radiatio, Chemotherapie, Chemoembolisation). Die Auswertung der Patientendaten umfasst zum einen den Vergleich benigner und maligner Lebertumoren (mit schwerpunktmäßiger Betrachtung der Lebermetastasen kolorektaler Karzinome) im Hinblick auf Alter, Geschlecht, bösartig 72% gutartig 28% Abb. 31. Tumorcharakterisierung (n=94). KKH-Recklinghausen 1998-2001. 45 OP-Verfahren (Technik, portale Okklusionszeit, perioperativer Blutverlust), OP-Dauer, Dauer der Intensivbehandlung, postoperative Liegezeit sowie intra- und postoperative Komplikationen, zum anderen die Analyse der Charakteristika der Primärtumoren (Lokalisation, TNM-Stadium, Grading) und der Metastasen kolorektaler Karzinome (Lokalisation, Metastasenanzahl, Metastasengröße, synchrone/metachrone Metastasierung und deren postoperative Liegezeit) sowie das Ausmaß der Leberresektion, die erzielte Radikalität (R0-, R1-, R2-Resektion; wobei die Patienten mit R0-Resektionen entsprechend des histologischen Befundes in eine R0a-Gruppe (histologisch tumorfreier Resektionsrand > 1cm) bzw. R0b-Gruppe (histologisch tumorfreier Resektionsrand < 1cm) unterteilt werden), die Anwendung konservativer Behandlungsverfahren (Chemotherapie, Radiatio), (Krankenhaus)-letalität und Überlebenswahrscheinlichkeit. FNH 23% Leberhämangiom 19% Leberzyste 34% Nekrose/Entzündung 12% Leberzelladenom 4% Leberabszess 4% Histoplasmose 4% Abb. 32. Benigne Lebertumoren (n=26). KKH-Recklinghausen 1998-2001. Le be rme tastase n 85% HCC 6% T umor unbe kannt 4% G B -C a-Infiltration 1% K latskin-T umor 3% cholangioz e lluläre s-C a. 1% Abb. 33. Maligne Lebertumoren (n=68). KKH-Recklinghausen 1998-2001. 46 Das Durchschnittsalter der Patienten mit benignem Lebertumor lag zum Zeitpunkt der Leberoperation bei 51,5 (21 bis 80) Jahren. Die Frauen waren häufiger bertoffen als die Männer (Tab.1). Das Durchschnittsalter der Patienten mit malignem Lebertumor bzw. kolorektalen Lebermetastasen lag zum Zeitpunkt der Leberoperation bei 62,7 (33 bis 79) Jahren bzw. 62,1 (33 bis 79) Jahren. Die Männer waren geringgradig häufiger betroffen als die Frauen (Tab.2). Tabelle 1. Alters- und Geschlechterverteilung zum Zeitpunkt der Leberresektion bei gutartigen Lebertumoren (n=26). Tabelle 2. Alters- und Geschlechterverteilung zum Zeitpunkt der Leberresektion bei malignen Lebertumoren (n=68); kursiv gedruckte Zahlen = Anzahl der Patienten mit metastasiertem kolorektalem-Ca. (n=47). Anzahl der Patienten (n) Alter(Jahre) Geschlecht Anzahl der Patienten (n) < 40 41-50 51-60 61-70 > 70 7 (26,9%) 4 (15,4%) 8 (30,8%) 5 (19,2%) 2 (7,7%) Alter(Jahre) weiblich männlich 22 (84,6%) 4 (15,4%) Geschlecht < 40 41-50 51-60 61-70 >70 1 (1,5%) 6 (8,8%) 16 (23,5%) 32 (47,1%) 13 (19,1%) weiblich 30 (44,1%) männlich 38 (55,9%) 0 (0,0%) 4 (8,5%) 12 (25,5%) 23 (48,9%) 8 (17,1%) 22 (46,8%) 25 (53,2%) Die Indikation zur Leberresektion wurde wie schon erwähnt bei 73 Patienten gestellt. Standardverfahren zur Lebersegmentresektion Behandlung (53,8%), benigner gefolgt von Lebertumoren der war die atypische Zystentdachung bei zystischen Veränderungen der Leber (26,9%) und der anatomischen Segmentresektion (11,5%). Die Trisegmentektomie (3,9%) und die Zystektomie (3,9%) waren nur in Einzelfällen die Methoden der Wahl in der Behandlung gutartiger Leberveränderungen (Abb.34). Standardverfahren zur Resektion maligner Lebertumoren waren die Hemihepatektomie (22,7%) und erweiterte Hemihepatektomie (20%) sowie atpypische Lebersegmentresektion (16%). Die anatomische Segmentresektion wurde nur in 4 Fällen (5,3%) durchgeführt, die Trisegmentektomie (1,3%) war nur in einem Fall Methode der Wahl. 5,3% der Lebereingriffe waren Kombinationseingriffe in Form einer Hemihepatektomie (anatomisch bzw. erweitert) und Lebersegementresektion (anatomisch bzw. atypisch). Bei 9,3% der Eingriffe wurden die reserzierenden Verfahren mit nicht reserzierenden Methoden kombiniert in Form einer Hemihepatektomie bzw. Segmentresektion (anatomisch bzw. atypisch) und gleichzeitiger Kryotherapie bzw. Thermoablation. Die restlichen Eingriffe an der Leber (13,5%) waren reine nicht reserzierende Verfahren (Kryotherapie und Kryotherapie kombiniert mit Thermoablation 47 bzw. Alkoholinjektion) (Abb.35). Betrachtet man die Lebereingriffe bei Lebermetastasen kolorektaler Karzinome gesondert, zeigen sich nur geringgradige Unterschiede im Vergleich zu den insgesamt analysierten OP-Verfahren maligner Lebertumoren. Auch hier waren die erweiterte Hemihepatektomie (22,6%) und Hemihepatektomie (19,4%) sowie die atypische Segmentresektion (17,7%) die Standardverfahren, während die anatomische Segmentresektion in 4,8% der Fälle und die Kombinationseingriffe in 6,5% der Fälle die Methoden der Wahl waren. Bei 9,7% der Eingriffe wurden die reserzierenden Verfahren mit nicht reserzierenden Methoden kombiniert in Form der oben genannten Hemihepatektomie bzw Segmentresektion (anatomisch bzw. atypisch) und gleichzeitiger Kryotherapie bzw. Thermoablation. Die restlichen Eingriffe an der Leber (12,9%) waren reine nicht reserzierende Verfahren (Kryotherapie und Kryotherapie kombiniert mit Thermoablation bzw. Alkoholinjektion) (Abb.36). Von den 68 Patienten mit malignen Tumoren an der Leber wurden 2 Patienten in der Nachbeobachtungszeit wegen neuerlich aufgetretener Tumoren/Metastasen einer zweiten Leberresektion unterzogen. Bei den mit Lebermetastasen kolorektaler Karzinome behandelten Patienten kamen 8 Patienten aufgrund eines Rezidivs nach auswärtig durchgeführter Leberresektion während in der Nachbeobachtungszeit kein Patient wegen neuerlich aufgetretener Metastasen nochmals vorstellig wurde. 4 Patienten unterzogen sich jedoch einer zweizeitigen Metastasenbehandlung und wurden zu einem späteren Zeitpunkt (durschnittlich 2,5 Monate) wiederholt stationär aufgenommen. Die Nachbeobachtungszeit betrug im Mittel 13 Monate (2-34). Stichtag der letzten Nachbeobachtung war März 2001. 14 14 12 10 7 8 6 3 4 1 1 2 0 a ty p . S e g m e n tre s e k tio n S e g m e n tre s e k tio n T ris e g m e n te k to m ie Z y s te n td a c h u n g Z y s te k to m ie Abb. 34. Operationsverfahren zur Entfernung benigner Lebertumoren. KKH Recklinghasuen 1998-2001. n= 26 Eingriffe bei 26 Patienten. 48 17 18 15 16 14 12 12 10 8 8 6 6 4 4 4 4 2 1 1 2 1 0 atyp. Segmentresektion Segmentresektion Trisegmentektomie Hemihepatektomie erw. Hemihepatektomie Hemi. (anatom./erw.) und Seg. (anatom./atyp.) Kryoablation Kryoablation + Alkoholinjektion/Thermoablation Kryoablation + Hemi./Seg. (anatom./atyp.) Thermoablation + Seg. inoperabel unbekannt Abb. 35. Operationsverfahren zur Entfernung maligner Lebertumoren n= 75 Eingriffe bei 68 Patienten. KKH Recklinghausen 1998- 2001. 14 14 12 12 11 10 8 6 5 6 4 4 3 3 2 1 2 1 0 0 atyp. Segmentresektion Segmentresektion Trisegmentektomie Hemihepatektomie erw. Hemihepatektomie Hemi. (anatom./erw.) und Seg. (anatom./atyp.) Kryoablation Kryoablation + Alkoholinjektion/Thermoablation Kryoablation + Hemi./Seg. (anatom./atyp.) Thermoablation + Seg. inoperabel unbekannt Abb. 36. Operationsverfahren zur Entfernung von Lebermetastasen kolorektaler Karzinome n= 62 Eingriffe bei 47 Patienten. KKH Recklinghausen 1998-2001. 49 Bei den gutartigen Lebertumoren wurden 12 reserzierende Eingriffe unter Zuhilfenahme der temporären Hilusokklusion (Pringle-Manöver) durchgeführt. Lediglich bei 3 Lebereingriffen in Form der atypischen Segmenresektion kam das Pringle-Manöver nicht zur Anwendung. Die durchschnittliche portale Okklusionszeit betrug 14 Minuten (zwischen 6 und 25 Minuten). Die restlichen Eingriffe (Leberzysten) wurden ohne Hilusokklusion therapiert (n=8). Bei 3 Leberoperationen konnte die Anwendung der temporären Hilusokklusion nicht ermittelt werden. Im Falle einer malignen Lebererkrankung wurden 45 Eingriffe unter Zuhilfenahme der temporären Hilusokklusion durchgeführt. Bei 8 Lebereingriffen in Form der atypischen Segmentresektion kam die portale Okklusion nicht zur Anwendung. Die durchschnittliche portale Okklusionszeit betrug 24 Minuten (zwischen 6 und 43 Minuten). Die erweiterten Hemihepatektomien zeigten mit einer Dauer von durchschnittlich 30 Minuten die längste portale Okklusionszeit, während die atypischen Segmentresektionen mit durchschnittlich 17 Minuten die kürzeste Okklusionszeit aufwiesen (Abb.37). Die restlichen 13 Lebereingriffe wurden einer nicht reserzierenden Therapie und somit keiner temporären Hilusokklusion unterzogen. Bei 9 Leberoperationen konnte die Anwendung des Pringle-Manövers nicht ermittelt werden. Betrachtet man nun gesondert die portale Okklusionszeit bei den aufgrund einer Lebermetastasierung kolorektaler Karzinome durchgeführten Leberresektionen, zeigt sich eine minimale Varianz. 41 reserzierende Eingriffe wurden unter Zuhilfenahme der temporären Hilisokklusion therapiert. Lediglich bei 5 Lebereingriffen in Form der atypischen Segmentresektion kam das Pringle-Manöver nicht zur Anwendung. Die durchschnittliche portale Okklusionszeit betrug ebenfalls 24 Minuten (zwischen 6 und 43 Minuten). Die erweiterten Hemihepatektomien zeigten auch hier mit einer Dauer von durchschnittlich 29 Minuten die längste portale Okklusionszeit, während die atypischen Segmentresektionen mit durchschnittlich 17 Minuten die kürzeste portale Okklusionszeit aufwiesen (Abb.37). Die restlichen Eingriffe (nicht reserzierend) wurden ohne Hilusokklusion therapiert (n=10). Bei 7 Leberoperationen konnte die Anwendung der temporären Hilusokklusion nicht ermittelt werden. Die durchschnittliche Operationszeit im Falle eines reserzierenden Eingriffs (hauptsächlich atypische Lebersegmentresektion) aufgrund eines benignen Lebertumors betrug 2 Stunden und 18 Minuten (zwischen 1 Stunde 15 Minuten und 3 Stunden 21 Minuten) und lag damit im Durchschnitt 52 Minuten unterhalb der Eingriffszeit bei Leberresektion maligner Lebertumoren bzw. 44 Minuten unterhalb der Operationszeit bei Lebermetastasenentfernung kolorektaler Primärtumoren (zwischen 1 Stunde 20 Minuten und 5 Stunden 47 Minuten) (Abb.38). In den folgenden Abbildungen werden die einzelnen Therapieverfahren mit den entsprechenden Okklusionszeiten und Operationszeiten bei malignen Lebertumoren allgemein und bei Lebermetastasierung kolorektaler Karzinome detailliert dargestellt (Abb.37 und 38). 50 Segmentresektion (atypisch) Segmentresektion (atypisch) 16:54 Segmentresektion (anatomisch) 21:30 Hemihepatektomie 23:47 Hemihepatektomie erweitert 5:00 Segmentresektion (anatomisch) 21:25 Hemihepatektomie 16:54 30:25 10:00 15:00 20:00 25:00 30:00 35:00 min:sec 23:32 Hemihepatektomie erw eitert 29:29 5:00 10:00 15:00 20:00 25:00 30:00 35:00 min:sec Abb. 37. Portale Okklusionszeit reserzierender Lebereingriffe bei malignen Lebertumoren (links) bzw. Lebermetastasierung kolorektaler Karzinome (rechts). KKH-Recklinghausen 1998-2001. Segmentresektion 02:36 Segmentresektion Hemihepatektomie 03:07 Segmentresektion atypisch 03:07 Kryoablation 03:16 Hemihepatektomie erweitert 03:30 00:00 00:30 01:00 01:30 02:00 02:30 03:00 03:30 04:00 h:min 02:06 Hemihepatektomie Segmentresektion atypisch 02:57 03:07 03:21 Kryoablation Hemihepatektomie erweitert 03:30 00:00 00:30 01:00 01:30 02:00 02:30 03:00 03:30 04:00 h:min Abb. 38. OP-Dauer reserzierender und ablativer Lebereingriffe bei malignen Lebertumoren (links) bzw. Lebermetastasierung kolorektaler Karzinome (rechts). KKH-Recklinghausen 1998-2001. 51 Einschließlich der postoperativen Phase wurden bei den Leberresektionen maligner Tumoren und und Lebermetastasen kolorektaler Karzinome zwischen 0 17 Erythrozytenkonzentrate (durchschnittlich 3 EK´s) transfundiert. Der Verbrauch an Blutplasmaprodukten lag zwischen 0 und 34 (durchschnittlich 4 FFP´s), die der Thrombozytenkonzentrate zwischen 0 und 3 (durchschnittlich 0,1 TK). Die Verwendung von Blutkonserven bei reserzierenden Lebereingriffen aufgrund benigner Lebertumoren zeigten deutliche Unterschiede. Die transfundierten Erythrozytenkonzentratkonserven lagen zwischen 0 und 8 (durchschnittlich 0,9 EK´s). An Blutplasmaprodukten wurden zwischen 0 und 5 (durchschnittlich 0,6) verbraucht. Thrombozytenkonzentrate wurden in keinem Fall transfundiert. Der postoperative stationäre Aufenthalt lag nach gutartiger Lebertumorentfernung im Mittel bei 11,2 Tagen (Entlassung zwischen dem 3.-20. Tag) bzw. nach maligner Tumorentfernung/kolorektaler Lebermetastasenentfernung bei 16,1 Tagen (Entlassung zwischen 4./8.- 36. Tag). Nach der Leberoperation waren die Patienten mit bösartiger Erkrankung im Durchschnitt 2 Tage länger (im Mittel 2,8 Tage: zwischen 0,2 und 13 Tagen) in Intensivbehandlung, während die Patienten mit gutartiger Erkrankung im Durchschnitt 0,7 Tage (zwischen 0,2 und 1 Tag) intensiv behandelt werden mussten. Von den 68 an einem bösartigen Lebertumor erkrankten Patienten zeigten 57 eine Lebermetastasierung. Die Metastasierung erfolgte bei 47 Patienten als Folge eines kolorektalen Karzinoms. Der Primärtumor war bevorzugt im Bereich des rechten Kolons (Colon ascendens), sowie linken Kolons (Colon descendens) und Rektums lokalisiert (Abb.39). Abb. 39. Lokalisation der Primärtumoren bei 47 Patienten mit hepatisch metastasierendem kolorektalen Karzinom. KKH-Recklinghausen 1998-2001. Wort & Bild Verlag Konradshöhe GmbH & Co.KG. 52 Bei 4 Patienten mit Lebermetastasierung wurden zwei Tumoren diagnostiziert (Magen- und Rektum-Ca.; Rektum- und Coecum-Ca.; Kolon- und Rektum-Ca. und Rektum- und MammaCa.), wobei nicht ermittelt werden konnte, welcher dieser Primärtumoren für die Lebermetastasierung verantwortlich war. Desweiteren wurde die inhomogene Gruppe von 8 Patienten mit unterschiedlichen Primärtumor betrachtet. Lediglich bei Karzinomen des Pankreas (n=3) und des Magens (n=2) fand sich eine geringgradig größere Fallzahl, die übrigen Lokalisationen stellten Einzelfälle dar (Mamma-Ca. (n=1), cholangiozelluläres-Ca. (n=1), Nasopharynx-Ca. (n=1) (Abb.40). Aufgrund des unterschiedlichen Metastasierungsverhaltens dieser Tumoren im Vergleich zum kolorektalen Karzinom und der geringen Zahl wurden diese Fälle von der Ermittlung der Prognoseparameter ausgenommen. Rektum-Ca. 20% Rektosigmoid-Ca. 7% Sigma-Ca. 11% Pankreas-Ca. 5% Kardia-Ca. 4% cholangiozelluläres-Ca. 2% Colon-Ca. 43% Mamma-Ca. 2% Coecum-Ca. 4% Nasopharynx-Ca. 2% Abb. 40. Primärtumoren bei Metastasen kolorektaler und nichtkolorektaler Tumoren. KKH-Recklinghausen 1998-2001. 31 Patienten zeigten eine synchrone Metastasierung. Damit wurden die kolorektalen Lebermetastasen entweder gleichzeitig mit dem Primärtumor (40,4% der Fälle) oder postoperativ, jedoch innerhalb von 12 Monaten nach erfolgter Primärtumoroperation (25,5% der Fälle) diagnostiziert. In 34,1% der Fälle lagen metachrone Lebermetastasen vor. Die Indikation zur Leberresektion ergab sich unter Einhaltung der entsprechenden Indikationskriterien (kurativ operierte Primärkarzinome, kein lokoregionäres Rezidiv, keine Lymphknotenmetastasierung , keine weitere Fernmetastasierung). Das Zeitintervall zwischen 53 der Operation des Primärtumors und dem Auftreten der Metastasierung lag bei diesen Patienten im Durchschnitt bei 10 Monaten (0 bis 48 Monate) (Abb.41) metachron (Metastasennachweis mehr als ein Jahr nach der Primärtmuoroperation) synchron (Lebermetastasen postoperativ, jedoch innerhalb von 12 Monaten diagnostiziert) synchron (Lebermetastasen gleichzeitig mit dem Primärtumor diagnostiziert) synchron (Metastasennachweis innerhalb eines Jahres nach der Primärtumoroperation) 0 5 10 15 20 25 30 35 n = 47 Anzahl der Patienten Abb. 41. Intervall zwischen Primärtumoroperation und Auftreten der Lebermetastasierung bei 47 Patienten mit metastasierendem kolorektalen Karzinom. KKH-Recklinghausen 1998-2001. Die postoperative Liegezeit ist bei synchronen gegenüber metachronen Resektionen nur geringgradig verlängert (Abb.42) Patienten 14 metachron 12 synchron 10 8 6 4 2 0 ~5 ~ 10 ~ 15 ~ 20 ~ 25 ~ 30 ~ 35 > 35 Tage postoperativ Abb. 42. Postoperative Liegezeit bei 38 reserzierenden Eingriffen kolorektaler Lebermetastasen. KKHRecklinghausen 1998-2001. 54 Für die klinische Stadieneinteilung kolorektaler Karzinome findet in Deutschland zunehmend die TNM-Klassifikation (T= Invasionstiefe des Primärtumors; N= Lymphknotenstatus; M= Vorhandensein von Fernmetastasen (in dieser Studie die resultierende Lebermetastasierung) ) der Union International Contre le Cancer (UICC) Verwendung. Tabelle 3. Tumortiefenwachstum (T-Stadien) und Lymphknotenstatus (N-Stadien) beim kolorektalen Karzinom. TNM-Klassifikation der UICC; p (pathological) = nach histopathologischer Aufarbeitung. T-Primärtumor pT X Primärtumor kann nicht beurteilt werden pT 0 Kein Anhalt für Primärtumor pT is Carcinoma in situ pT 1 Tumor infiltriert die Submukosa pT 2 Tumor infiltriert die Muscularis propria pT 3 Tumor infiltriert durch die Muskularis propria in die Subserosa oder in nicht peritonealisiertes perikolisches oder perirektales Gewebe pT 4 Tumor infiltriert direkt in andere Organe oder Strukturen und/oder perforiert das viszerale Peritoneum N-Regionäre Lymphknoten pN X Regionäre Lymphknoten können nicht beurteilt werden pN 0 Keine regionären Lymphknotenmetastasen pN 1 Metastasen in 1-3 regionären Lymphknoten pN 2 Metastasen in 4 oder mehr regionären Lymphknoten pN 0 Regionäre Lymphadenektomie und histologische Untersuchung von 12 oder mehr Lymphknoten Ein weiteres Beurteilungskriterium und wichtiger Aspekt hinsichtlich der Prognose und Therapie ist der histopathologische Differenzierungsgrad (Grading) des Primärtumors. Die Einteilung reicht von nicht beurteilbar über gut differenziert bis zu undifferenziert (GX = Differenzierungsgrad kann nicht beurteilt werden; G1 = gut differenziert; G2 = mäßig differenziert; G3 = schlecht differenziert; G4 = undifferenziert). Je höher das Grading bzw. je schlechter der Differenzierungsgrad des Primärtumors, desto höher ist die Malignität, die Strahlenempfindlichkeit und die Wachstumsgeschwindigkeit. Die Beurteilung der Fernmetastasierung erfolgt anhand der Einteilung in pM X, pM 0, pM 1 (pM X = Fernmetastasen können nicht beurteilt werden; pM 0 = keine Fernmetastasen; pM 1 = Fernmetastasen). Tabelle 4. Stadiengruppierung beim kolorektalen Karzinom. TNM-Klassifikation der UICC und Stadiengruppierung der in der Studie untersuchten Patienten (bei neun Patienten war die Stadiengruppierung nicht ermittelbar). TNM-Stadiengruppierung Stadium 0 Stadium 1 Stadium 2 Stadium 3 Stadium 4 pT is pT 1 pT 2 pT 3 pT 4 jedes T jedes T jedes T pN 0 pN 0 pN 0 pN 0 pN 0 pN 1 pN 2 jedes N pM 0 pM 0 pM 0 pM 0 pM 0 pM 0 pM 0 M1 Patienten (Studie) 0 1 5 10 22 55 Letztendlich werden zur Festlegung der Therapie und zur Effektivitätsbeurteilung neoadjuvanter und adjuvanter Behandlungsstrategien anhand der TNM-Klassifikation Stadiengruppen gebildet, die den Schweregrad der Tumorerkrankung darstellen (Tab. 4). Die Charakteristika der in der Studie analysierten Primärtumoren (TNM-Stadium, Grading) sind in den Abbildungen 43-45 zusammengestellt. Am häufigsten zeigten die analysierten Primärtumoren mit 61,7% das Stadium T3, während das T2-Stadium in 8,5% der Fälle, sowie das T4-Stadium in 6,4% der Fälle nur in Einzelfällen vorzufinden war. Das T1-Stadium konnte in keinem Fall verzeichnet werden, wobei darauf hinzuweisen ist, dass bei immerhin 10 Patienten das T-Stadium aufgrund der Datenlage nicht ermittelt werden konnte. Die Analyse des N-Stadiums zeigte hauptsächlich in 29,8% der Fälle das N2-Stadium, gefolgt von Stadium N0 in 25,5% der Fälle und N1 in 17% der Fälle, während das Stadium N3 in 4,3% der Fälle zu verzeichnen war. Auch hier war bei immerhin 10 Patienten das N-Stadium aufgrund der Datenlage nicht ermittelbar. In den meisten Fällen (55,3%) zeigte sich der Differenzierungsgrad G2. Differenzierungsgrad G1 (6,4%), G3 (10,6%) und G4 (2,1%) waren wesentlich seltener diagnostiziert worden. Bei 12 Patienten fehlten auch hier die Daten, die nicht ermittelt werden konnten. Die Charakteristika der Lebermetastasen sind in den Abbildungen 46-48 zusammengestellt. In 38,3% der Fälle fanden sich solitäre Tumoren, während 57,5% der Patienten multiple Metastasen aufwiesen. In 4,2% der Fälle konnte die Lebermetastasenanzahl nicht ermittelt werden. Bei der Auswertung der Tumoranzahl in der Leber wurde keine Differenzierung zwischen möglicher Satellitenknoten und mehreren Metastasen vorgenommen. Die Größe (maximaler Durchmesser) lag zwischen 0,3 und 14 cm (Mittelwert 4,8 cm; Median 3,7 cm). Die Tumorknoten waren unilobulär 59,6% (linker Leberlappen 14,9%, rechter Leberlappen 44,7%) und in beiden Leberlappen 38,3% gelegen. Die histologische Aufarbeitung der Resektate ergab in 37 Fällen eine R0-Resektion, wobei in 24 Fällen der tumorfreie Abstand zum Resektionsrand größer als 1 cm (R0a) und in 13 Fällen kleiner als 1 cm (R0b) war. In keinem Fall ergab sich eine R1-Resektion mit Tumorzellausläufern im Resektionsbereich. Desweiteren wurde kein chirurgischer Eingriff als R2-Resektion (makroskopischer Tumorrest) beendet. In einem Fall war das R-Stadium nicht ermittelbar. 56 30 25 20 15 10 5 0 Tx T1 T2 T3 T4 1 0 4 29 3 P atie nten Abb. 43. T-Stadium der kolorektalen Karzinome. KKH-Recklinghausen 1998-2001. 14 12 10 8 6 4 2 0 P atienten Nx N0 N1 N2 N3 1 12 8 14 2 Abb. 44. N-Stadium der kolorektalen Karzinome. KKH-Recklinghausen 1998-2001. 30 25 20 15 10 5 0 Patienten G1 G2 G3 G4 3 26 5 1 Abb. 45. Differenzierungsgrad der kolorektalen Karzinome. KKH-Recklinghausen 1998-2001. 57 20 15 10 5 0 Patienten 1 2 3 >3 18 6 4 17 Abb. 46. Metastasenanzahl bei Lebermetastasen kolorektaler Karzinome. KKH-Recklinghausen 19982001. 30 25 20 15 10 5 0 Patienten < 5 cm 5 - 10 cm > 10 cm 28 11 4 Abb. 47. Lebermetastasengröße bei Lebermetastasen kolorektaler Karzinome. KKH-Recklinghausen 1998-2001. 25 20 15 10 5 0 Patienten re. Leberlappen li. Leberlappen re.+ li. Leberlappen 21 7 18 Abb. 48. Lokalisation der Lebermetastasen. KKH-Recklinghausen 1998-2001. 58 Für die Entscheidung zur Leberresektion und die Wahl des chirurgischen Verfahrens sind die Beachtung der gegensätzlichen Aspekte der Leberfunktion und Radikalität von großer Bedeutung. Eine hohe Reservekapazität und eine gute Regenerationsfähigkeit des gesunden Lebergewebes erlaubt ausgedehnte Resektionen ohne dauerhafte funktionelle Einschränkungen. Bei einer gesunden Leber kann bis zu 70% (im Extremfall bis zu 80%) des Parenchyms reserziert werden (Tab. 5). Tabelle 5. Resektionsausmaß Resektionsausmaß nach anatomiegerechten Leberresektionen Parenchymverlust nach Leberresektion Resektion Segmente Leberparenchym (%) 5 bis 8 60% Hemihepatektomie rechts erweitert 4, 5 bis 8 70% Hemihepatektomie links 1, 2 bis 4 40% 2 bis 3 25% z.B. 1 bis 4 + X 70% Hemihepatektomie rechts Hemihepatektomie links lateral Hemihepatektomie links erweitert Innerhalb eines Zeitraums von 8-12 Wochen werden durch Hyperplasie der Restleber fast alle Funktionen kompensiert. Entscheidend bei der Festlegung der Resektionsgrenzen ist der Verlust des nichttumorösen Lebergewebes. Wird ein großer Tumor durch eine ausgedehnte Resektion entfernt, so kann dabei, wenn nur wenig funktionell gesundes Gewebe mitreserziert wird, nur eine minimale Einschränkung der Leberfunktion die Folge sein. Kritisch ist es, wenn ein kleiner Tumor in zentraler Lage nur durch eine erweiterte Resektion zu entfernen ist. Besonders kritisch ist eine Resektion bei deutlich eingeschränkter Leberfunktion. Hier sollte man sich auf präoperativ erhobene Funktionsparameter und Tests als Entscheidungshilfe zur Indikation verlassen. Die Indikation zur Leberteilresektion ist individuell bezogen auf den Patienten, die Biologie des Tumors und die notwendige chirurgische, anästhesiologische und intensivmedizinische Kompetenz zu stellen [10,42,53]. Das Resektionsausmaß der bei den in der Studie aufgrund einer Lebermetastasierung durchgeführten Leberresektionen schwankt zwischen 15% und 80%. Die meisten Patienten wiesen einen Parenchymverlust von 60% (n=13) und 70% (n=12) auf, wobei ausgedehnte Resektionen mit über 60% Parenchymverlust nur bei weitgehend normalen Gewebe der Restleber möglich sind, entsprechend den hier therapierten Patienten (in keinem Fall lagen zirrhotische Veränderungen der Leber vor). Ein Patient wurde sogar unter einem Parenchymverlust von 80% reserziert. Trotz einer derart ausgedehnten Resektion gestaltete sich der postoperative Verlauf komplikationslos. Der Patient konnte 17 Tage nach der 59 Operation aus dem stationären Aufenthalt entlassen werden. Unter weiterer postklinischer Beobachtung (13 Monate) wies der Patient kein Rezidiv und keine besonderen Auffälligkeiten auf. Gerade nach den ausgedehnteren Resektionen kann in der frühpostoperativen Phase für einige Tage ein deutlicher Substitutionsbedarf an Gerinnungsfaktoren zur Stabilisierung der Hämostase notwendig sein, da die Syntheseleistung zunächst eingeschränkt ist (das laboranalytische Minimalprogramm besteht in der Messung der Thrombozyten-Zahl, der Thromboplastin-Zeit (Quickwert), aPTT, Antithrombin und Fibrinogen [64]). Desweiteren gibt die Analyse diverser Laborparameter Hinweise auf eine reduzierte Leberfunktion oder Dysfunktionen; z.B. deuten erhöhte Bilirubinwerte auf eine reduzierte Leberfunktion, eine Galleabflussstörung oder eine intrahepatische Cholestase hin. Erhöhte Transaminasen sind Zeichen für noch vorhandene Leberteilnekrosen (Tab.6). Tabelle 6. Laborparameter vor und nach Leberresektion kolorektaler Lebermetastasen (n=38). KKH Recklinghausen 1998-2001. Laborparameter 150-400 l/nl 270 0. Tag postop. 188 Quick 70-110 % 94 74 66 73 76 PTT-a < 40 sec. 30 32 38 34 33 200-400 mg/dl 463 234 302 377 240 AT III 65-120 % 117 75 76 66 58 GOT < 18 U/l 14 189 201 56 23 GPT < 20 U/l 22 179 228 125 46 GGT < 28 U/l 51 42 55 59 98 G- Bili < 1,2 mg/dl 1 1,6 2,5 4 7,2 D- Bili < 0,25 mg/dl 1,5 0,7 2,1 3,3 5,7 Thrombozyten Fibrinogen präop. 1. Tag postop. 195 2.-5. Tag postop. 184 6.-10. Tag postop. 270 Von den 38 an der Leber reserzierten Patienten mit kolorektalen Lebermetastasen wurden 20 Patienten zusätzlich einer Portimplantation zur regionalen Chemotherapie unterzogen. Im Fall einer ausgedehnten Metastasierung war die alleinige Portimplantation Therapie der Wahl (n=6). Grundlage der Indikation zur regionalen Chemotherapie war eine rein hepatische Manifestation der Metastasen (Tab.7). Bei Patienten mit intraoperativ nachgewiesener zusätzlicher extrahepatischer Metastasierung wurde eine kombinierte systemische und regionale Chemotherapie durchgeführt (n=1). 60 Tabelle 7. Verfahrenswahl zur Therapie von Lebermetastasen in Abhängigkeit von der Lokalisation des Primärtumors Verfahrenswahl Primärtumor Kolon/Rektum Sonstige n n Resektion 18 3 Resektion und Portimplantat 20 3 Portimplantat 6 0 keine Resektion und kein Portimplantat 2 1 unbekannt 1 1 4.2. Ergebnisse Nach Resektion der gutartigen Lebertumoren zeigten 16 Patienten (88,9%) einen unkomplizierten intra- und postoperativen Verlauf. Bei 2 Patienten (11,1%) traten postoperativ Komplikationen in Form einer Darmatonie (n=1) und eines Gallelecks (n=1) auf, während intraoperativ keine Komplikationen zu verzeichnen waren. 5 Patienten (27,8%) zeigten postoperativ einen Pleuraerguss bei sonst unkomplizierten Verlauf. Im Falle einer Leberzystenentfernung wiesen 2 Patienten (25%) postoperative Komplikationen auf (Oberbauchatonie, Wundheilungsstörung), während die restlichen 6 Patienten (75%) einen unkomplizierten Verlauf zeigten. Damit liegt die Komplikationsrate nach Lebereingriffen aufgrund benigner Lebererkrankungen bei 15,4% (4 von 26). Die postoperative Morbidität nach Leberresektion kolorektaler Lebermetastasen lag entsprechend der Literatur vergleichsweise hoch. Bei 15 reserzierten Patienten (39,4%) traten intraoperativ (n=1; 2,6%) bzw. postoperativ (n=14; 36,8%) Komplikationen auf. Eine Aufschlüsselung der einzelnen Komplikationen gibt Tabelle 8. 28 der 38 an der Leber reserzierten Patienten (73,7%) zeigten postoperativ einen Pleuraerguss, wobei der rechtsseitige (n=11) und beidseitige (n=11) Pleuraerguss am häufigsten zu verzeichnen war. Der linksseitige Pleuraerguss lag nur in Einzelfällen vor (n=3). 61 Tabelle 8. Komplikationen nach Resektion kolorektaler Lebermetastasen (n= 38). KKH-Recklinghausen 1998-2001. Komplikationen Patienten (n) intraoperative Komplikationen Blutung 1 von 38 postoperative Komplikationen Gallefistel/Biliom Leberhämatom Wundheilungsstörung Ikterus galliges Erbrechen Aszites Dyspnoe Pneumothorax Pneumonie Niereninsuffizienz Multiorganversagen Vorderwandinfarkt Sinustachykardie Bradyarrhythmie Reizhusten Ductus hepaticus Stenose Fieber akute Pankreatitis zentrale Stauung Meteorismus Nachblutung Thrombose V. brachialis axillaris und subclavia links 8 Patienten mit kolorektalen 3 von 38 3 von 38 2 von 38 2 von 38 2 von 38 2 von 38 2 von 38 2 von 38 1 von 38 1 von 38 1 von 38 1 von 38 1 von 38 1 von 38 1 von 38 1 von 38 1 von 38 1 von 38 1 von 38 1 von 38 1 von 38 1 von 38 Lebermetastasen verstarben während des Krankenhausaufenthaltes (n=4) bzw. im weiteren poststationär beobachteten Verlauf (n=4). 1 Patient verstarb 21 Monate nach Diagnose mehrerer Lebermetastasen im Zusammenhang mit einem Rektumkarzinom und nach durchgeführter Primärtumoroperation mit anschließender Chemotherapie aufgrund eines inoperablen Befundes. Ein weiterer Patient verstarb innerhalb der Klinik nach wiederholter Rektumoperation und nach Kryoablation der Lebermetastasen aufgrund einer kardiopulmonalen Dekompensation, respiratorischer Verschlechterung, Einbruch der Hämodynamik, Fieber bis 41 Grad und einem therapieresistentem septischen Multiorganversagen 1,5 Monate nach operativem Eingriff. 6 Patienten verstarben nach Leberresektion stationär (n=3; Nierenversagen, 62 Kreislaufinstabilität, SIRS, Multiorganversagen bzw. Vorderwandinfarkt bzw. Nachblutung, Bradyarrhythmie) bzw. poststationär (n=3). Die Gesamtletalität lag nach reserzierenden Eingriffen demnach bei 15,8%. Die Korrelation von Letalität und Ausmaß der durchgeführten Resektion belegt Tabelle 9. Tabelle 9. Krankenhausletalität nach Resektion von Lebermetastasen kolorektaler Karzinome; n=50 Eingriffe bei 38 Patienten. Resektion Krankenhausletalität (n) Segm entresektion 0/3 atypische Segm entresektion 0/11 Hem ihepatektom ie 2/12 erweiterte Hem ihepatektom ie 1/14 30-Tage-Letalität 5,3 % 2/38 Gesam t 7,9 % 3/38 Bei einer mittleren bzw. medianen Nachbeobachtungszeit von 13 bzw. 11 (2-34) Monaten waren von allen reserzierten Patienten noch 32 (84,2%) am Leben. Die restlichen Patienten sind wenige Wochen nach der Operation im Krankenhaus (n=3) bzw. wenige Monate im weiteren postoperativen Verlauf (n=3) verstorben. 5 der 38 (13,1%) Patienten mit R0Resektion haben ein erneutes Tumorrezidiv entwickelt, wobei 4 Patienten zuvor in einem anderen Krankenhaus einer Leberresektion unterzogen wurden und mit einer erneut aufgetretenen Lebermetastasierung das Knappschaftskrankenhaus-Recklinghausen für eine erneute Therapie aufsuchten. Von diesen 4 Patienten verstarb ein Patient wenige Wochen nach der Operation während des stationären Aufenthaltes. Aus den in Recklingausen operierten Patientengut ist innerhalb des Beobachtungszeitraumes nur ein Patient aufgrund eines Tumorrezidivs 17 Monate nach der Erstoperation erneut an der Leber operiert worden. Die mittlere (mediane) Überlebenswahrscheinlichkeit für alle an der Leber reserzierten Patienten beträgt 15,8 (12,5) Monate bei einer 2-Jahres-Überlebensrate von 82,1%. Die mittlere (mediane) rezidivfreie Überlebenswahrscheinlichkeit für alle an der Leber reserzierten Patienten beträgt 14 (12) Monate bei einer 2-Jahres-Überlebensrate von 81,9% (Abb.49). Die Analsye der rezidivfreien Überlebenswahrscheinlichkeit bezieht den in 63 Recklinghausen nach Erstoperation wiederholt reserzierten Patienten, sowie die Patienten (n=4), welche zuvor an einem anderen Krankenhaus operiert wurden mit ein. In der weiteren Analyse wurden bezüglich der Prognosefaktoren nur die aus dem eigenen Krankengut untersuchten Patienten einbezogen. Basierend auf den bisherigen Veröffentlichungen und klinischen Erfahrungen wurden 13 Faktoren mit möglicher prognostischer Relevanz ausgewählt. Die Berechnung der kumulativen Überlebenszeiten, grundsätzlich bezogen auf den Zeitpunkt der Leberresektion, erfolgte nach Kaplan-Meier unter Einschluss der perioperativen Letalität. Der statistische Vergleich der Überlebenschancen, bezogen auf die verschiedenen zugrunde gelegten Parameter wurde mit dem Chi-Quadrat-Test durchgeführt, wobei man einen p-Wert von weniger als 0,10 mit „grenzwertig signifikant“, einen p-Wert von weniger als 0,05 mit „signifikant“ und einen p-Wert von weniger als 0,01 mit „sehr signifikant“ bezeichnete. Die Ergebnisse der Untersuchnug über den Einfluss der einzelnen Faktoren auf das Überleben der Patienten sind für das Gesamtkollektiv in den folgenden Abbildungen zusammengestellt. Danach spielte das Geschlecht allein keine entscheidende Rolle. Die Lokalisation oder das Stadium (N-Klassifikation) des Primärtumors hatte ebenfalls keinen erkennbaren Einfluss auf die Prognose. Von den zahlreichen untersuchten Parametern, die das Ausmaß der Lebermetastasierung bzw. der Resektion näher charakterisieren, waren folgende ohne zumindest statistisch signifikante Bedeutung für die Überlebensrate: Lokalisation der Lebermetastasen (rechter Leberlappen, linker Leberlappen, beide Leberlappen), Metastasengröße (≤ 5cm, > 5cm), Art der Leberteilentfernung (sparsame gegenüber ausgedehnteren Resektionen), Tumormasse in Relation zum normalen Lebergewebe (PHR). Prognostisch relevante Faktoren waren die Radikalität der Leberresektion, mit abnehmenden tumorfreien Sicherheitsabstand zum Resektionsbereich verringerte sich die Überlebensrate und mediane Überlebenszeit, zusätzliche konservative Behandlungsverfahren (adjuvante regionale Chemotherapie) und das Intervall zwischen Primärtumoroperation und Leberresektion (synchron vs. metachron). Hochsignifikante Unterschiede fanden sich bezüglich der Anzahl der Lebermetastasen, mit zunehmender Anzahl der Tumorknoten verschlechterte sich die Prognose. Ein weiterer ungünstiger Prognosefaktor war der perioperative Blutverlust, mit zunehmender Menge der Bluttransfusionen verringerte sich die Überlebensrate. Von Bedeutung war ebenfalls das Alter, wobei hier eine Prognoseverschlechterung bei den jüngeren (51-60 Jahre) gegenüber den älteren Patienten zu verzeichnen war. 64 Überlebenswahrscheinlichkeit 100 [%] 90 80 70 60 50 0 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 Monate Abb. 49. Allgemeine und rezidivfreie Überlebenswahrscheinlichkeit nach Leberresektion nach KaplanMeier, alle Patienten (n=38). ___ Überleben allgemein; - - - rezidivfreies Überleben. Alter 100 [%] 90 80 70 60 50 0 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 Monate Abb. 50. Überlebenswahrscheinlichkeit nach Leberresektion nach Kaplan-Meier. Einfluss des Alters auf das Überleben nach Leberresektion (n=33). ___ (51-60); ___ (61-70); - - - (>70) [ p = 0,002 ] 65 Geschlecht 100 [%] 90 80 70 60 50 0 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 Monate Abb. 51. Überlebenswahrscheinlichkeit nach Kaplan-Meier. Einfluss des Geschlechts auf das Überleben nach Leberresektion (n=38). ___ weiblich; - - - männlich [ p = 0,700 ] Lokalisation Prim ärtum or 100 [%] 90 80 70 60 50 0 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 Monate Abb. 52. Überlebenswahrscheinlichkeit nach Kaplan-Meier. Einfluss der Lokalisation des Primärtumors auf das Überleben nach Leberresektion (n=38). ____ Kolon; - - - Rektum [ p= 0,700] 66 N-Klassifikation 100 [%] 90 80 70 60 50 0 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 Monate Abb. 53. Überlebenswahrscheinlichkeit nach Kaplan-Meier. Einfluss der N-Klassifikation des Primärtumors (n=18). ___ N1; - - - N2 [ p = 0,397] Anzahl Lebermetastasen 100 [%] 90 80 70 60 50 0 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 Monate Abb. 54. Überlebenswahrscheinlichkeit nach Kaplan-Meier. Einfluss der Anzahl der Lebermetastasen auf das Überleben nach Leberresektion (n=37). ___ 1; - - - 2/3; ___ >3 [ p = 0,002 ] 67 Durchmesser größte Metastase 100 [%] 90 80 70 60 50 0 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 Monate Abb. 55. Überlebenswahrscheinlichkeit nach Kaplan-Meier. Einfluss des Durchmessers der größten Metastase auf das Überleben nach Leberresektion (n=37). ___ ≤5cm (n=21); - - - >5cm (n=16) [p= 0,341 ] Lokalisation Lebermetastasen 100 [%] 90 80 70 60 50 0 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 Monate Abb. 56. Überlebenswahrscheinlichkeit nach Kaplan-Meier. Einfluss der Lokalisation der Lebermetastasen auf das Überleben nach Leberresktion (n=34). ___ re. LL; - - - beide LL (n=13) [ p = 0,841 ] 68 Metachron/synchron 100 [%] 90 80 70 60 50 0 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 Monate Abb. 57. Überlebenswahrscheinlichkeit nach Kaplan-Meier. Einfluss der synchronen/metachronen Metastasierung nach Leberresketion (n=37). ___ synchron; - - - metachron [ p = 0,041 ] Art des Eingriffs 100 [%] 90 80 70 60 50 0 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 Monate Abb. 58. Überlebenswahrscheinlichkeit nach Kaplan-Meier. Einfluss der Art des Eingriffs auf das Überleben nach Leberresketion (n=38). ___ peripher/Segmentresektion; - - - Hemihepatektomie [ p = 0,568 ] 69 Tumormasse 100 [%] 90 80 70 60 50 0 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 Monate Abb. 59. Überlebenswahrascheinlichkeit nach Kaplan-Meier nach kurativer Leberresektion (R0) kolorektaler Karzinome in Abhängigkeit von der prozentualen Tumormasse (n=38). ___ <25%; - - - 2550%; ___ 50-80% [ p = 0,469 ] Radikalität 100 [%] 90 80 70 60 50 0 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 Monate Abb. 60. Überlebenswahrscheinlichkeit nach Kaplan-Meier. Einfluss der Radikalität auf das Überleben nach Leberresektion (n=38). ___ R0a (n=23); - - - R0b (n=15) [ p = 0,027 ] 70 Menge der Bluttransfusion 100 [%] 90 80 70 60 50 0 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 Monate Abb. 61. Überlebenswahrscheinlichkeit nach Kaplan-Meier. Einfluss des perioperativen Blutverlustes auf das Überleben nach Leberresektion (n=38). ___ ≤ 5; - - - ≤ 10; ___ > 10 [ p = <0,001 ] adjuvante regionale Chemo 100 [%] 90 80 70 60 50 0 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 Monate Abb. 62. Überlebenswahrscheinlichkeit nach Kaplan-Meier. Einfluss der adjuvanten Chemotherapie nach radikaler Leberresktion von Lebermetastasen beim kolorektalen Primärtumor (n=38). ___ Resektion; - - - Resektion und regionale Chemotherapie [ p = 0,021 ] 71 5. Diskussion Der Spontanverlauf der Lebermetastasierung nach verschiedenen Tumorerkrankungen ist letal. Ältere Untersuchungen zeigen eine mittlere Überlebenszeit von wenigen Wochen und Monaten [4,38]. Auf der Suche nach einer klinisch bedeutsamen Behandlungsmethode ist die Beachtung eins ausgewogenen Verhältnisses zwischen Schaden und Nutzen für den Patienten von grundlegender Bedeutung. Allein die Resektion, durch viele Studien und Veröffentlichungen klar belegt, bietet den Patienten mit kolorektalen Lebermetastasen die Möglichkeit langjähriger Palliation und gelegentlich auch Heilung [5,18,20,57,54,62]. Bei fehlender extrahepatischer Tumormanifestation sowie isolierten, mit Sicherheitsabstand resektablen Metastasen gilt heute die Resektion von Lebermetastasen kolorektaler Karzinome als etablierte Behandlungsmethode. Die operationsbedingte Letalität liegt im internationalen Vergleich zwischen 0 und 10%, im eigenen Krankengut bei 7,9% [5,18,20,42,54,56,57,62]. Das operative Risiko ist somit als verhältnismäßig gering einzustufen, weitgehend kalkulierter und sicherlich akzeptabel, um so mehr, als die zu erwartende Überlebenschance durch die Operation signifikant verbessert werden kann. Mit keinem anderen Therapieverfahren ist die Prognose von Patienten mit Lebermetastasen kolorektaler Karzinome gegenwärtig so günstig zu beeinflussen wie durch eine Leberresektion. Nach wie vor wird jedoch diskutiert, welche Patienten von der Leberresektion bezüglich einer Verlängerung der Überlebenszeit profitieren. In zahlreichen meist retrospektiven Studien wurde der prognostische Einfluss der folgenden Parameter auf die Überlebensrate analysiert: Alter, Geschlecht, Primärtumorlokalisation, Stadium des Primärtumors, Differenzierungsgrad des Primärtumors, Anzahl, Größe und Lokalisation der Lebermetastasen, Intervall Resektionsverfahren, Blutverlust, zwischen Primärtumorlokalisation Resektionsausmaß, Tumormarkerverlauf, Radikalität adjuvante der regionale und Resektion, Metastasierung, perioperativer Chemotherapie. Aufgrund inhomogener Patientenkollektive, unterschiedlicher Fallzahlen und Behandlungskonzepte ergaben sich zum Teil divergierende Ergebnisse bezüglich einzelner prognostischer Faktoren. In der eigenen Untersuchung wurden sämtliche genannten Parameter ausgewertet mit Ausnahme der Tumormarker, da zahlreiche Patienten weder einen erhöhten CEA- noch einer erhöhten Ca-19-9-Wert aufwiesen und somit dieser Parameter im Gegensatz zu allen übrigen nur bei „Tumormarker-positiven“ Patienten eine Aussage erlauben würde. Das Alter der Patienten hatte in unserer Untersuchung gegenüber zahlreichen anderen Studien in der Literatur [16,21,31,32,35,48,50,57,58,61,63,65] einen signifikanten Einfluss 72 auf die Prognose: Prognoseverbesserung mit steigendem Alter, (p=0,002, sehr signifikant) [24,49]. Die Analyse eines prognostischen Überlebenswahrscheinlichkeit, ergab im Einflusses eigenen des Geschlechts Krankengut keinen auf die signifikanten Unterschied (p=0,700). Der Literaturvergleich zeigt, dass in den meisten Studien ebenfalls kein bzw. nur ein geringgradiger Einfluss des Geschlechts auf die Prognose zu verzeichnen ist [11,21,24,31,32,48,50,57]. Nur vereinzelte Studien zeigen einen Prognosevorteil für das weibliche bzw. männliche Geschlecht [16,34,65]. Die statistische Auswertung der Primärtumorlokalisation (Kolon/Rektum) bezüglich eines prognostischen Einflusses auf die Überlebenszeit (p=0,700) ergab in Übereinstimmung mit der Literatur keine signifikanten Ergebnisse [2,11,16,24,31,32,34,56-58,61,63]. Die meisten Patienten der Studie wiesen als T-Stadium des Primärtumors das Stadium T3 auf (Tumor infiltriert durch die Muskularis propria in die Subserosa oder in nicht peritonealisiertes perikolisches oder perirektales Gewebe). Allein in diesem Stadium sind alle registrierten Todesfälle in dem vorliegenden Beobachtungszeitraum zu finden, weswegen auch nur dieser Parameter bezüglich der Überlebenswahrscheinlichkeit analysiert werden konnte. Die Überlebensrate zeigte nach dem ersten postoperativen halben Jahr bereits eine Senkung von 15%, nach 12 Monaten von über 20%. Bis zum Ende des Beobachtungszeitraums konnte eine Überlebensrate von 79% verzeichnet werden. Diese Werte sind mit denen anderer Untersuchungen vergleichbar [p]. In der Literatur divergieren die Ergebnisse bezüglich des prognostischen Einflusses dieses Parameters. Während einige Autoren einen Einfluss des Primärtumorstadiums auf die Prognose belegten [31,34,35,37,49,62], zeigten die Arbeiten anderer Untersucher keine Einflüsse der TKlassifikation auf die Prognose [2,11,16,24,31,32,56-58,61,63,65]. Bezüglich der N-Klassifikation des Primärtumors konnten im eigenen Krankengut für Patienten mit einer N1-Klassifikation im Vergleich zu N2 keine signifikanten Unterschiede in der Prognose festgestellt werden (p=0,397). Die Ergebnisse in der Literatur sind nicht eindeutig. Während in verschiedenen Studien die N-Klassifikation keinen signifikanten Einfluss auf das Überleben der Patienten hatte [32,56,57], konnte in anderen Untersuchungen die prognostische Bedeutung aufgezeigt werden [16,31,34,49]. Besonders irritierend wirkt hier der Umstand, dass in Nachfolgestudien [21,58,63] einige der Kliniken, die in früheren Studien [2,11,61] eine Prognoseverschlechterung beim Vorliegen regionärer Lymphknotenmetastasen feststellten, dieser Effekt nicht mehr oder nur eingeschränkt 73 nachweisbar war. Eine mögliche Erklärung dieses Phänomens könnte in der zunehmenden Verbreitung der adjuvanten Chemotherapie bei N-positiven Kolonkarzinomen (auch in unserem Krankengut) in den letzten Jahren liegen, die den ungünstigen prognostischen Einfluss der positiven mesenterialen Lymphknoten teilweise mildern könnte. Die meisten Patienten der Studie wiesen einen mäßig differenzierten Primärtumor auf (G2). Allein in diesem Stadium sind alle registrierten Todesfälle in dem vorliegenden Beobachtungszeitraum zu finden, weswegen auch nur dieser Parameter bezüglich der Überlebenswahrscheinlichkeit analysiert werden konnte. Die Überlebensrate im eigenen Krankengut sank in den ersten 6 Monaten nach der Leberresektion bereits um 18% und nach weiteren 6 Monaten um 25%. Bis zum Ende des Beobachtungszeitraums konnte eine Überlebensrate von 75% verzeichnet werden. Auch hier sind die Werte mit denen anderer Untersuchungen vergleichbar [p]. In der Literatur fanden sich mehrere Studien, in denen das Grading des Primärtumors untersucht wurde, wobei jedoch, abgesehen von einer Untersuchung [61], keine prognostische Bedeutung gefunden wurde [16,21,24,31,32,34,48,57,61]. Hinsichtlich der Anzahl (solitär, ≤3, >3) der Lebermetastasen zeigte sich eine deutliche Prognoseverschlechterung mit steigender Metastasenzahl. Patienten mit solitären bzw. 2-3 Lebermetastasen hatten eine signifikant bessere Prognose als jene mit mehr als 3 Lebermetastasen (p=0,002 sehr signifikant). Auch in der Literatur sind vergleichbare Ergebnisse, in denen Patienten mit mehr als 3 Lebermetastasen eine signifikant schlechtere Prognose hatten, beschrieben [16,18,34,35,37,49,56,57,62]. Neben der Anzahl der Lebermetastasen wurde die Metastasengröße unter prognostischen Aspekt analysiert. Die statistische Auswertung bezüglich eines prognostischen Einflusses auf die Überlebensrate ergab keine signifikanten Unterschiede (p=0,341) [32,56]. In der Literatur finden sich zahlreiche Berichte über eine Prognoseverschlechterung bei großen Metastasen, möglicherweise infolge der größeren Ausdehnung in der Leber und der damit verbundenen höheren Schwierigkeit einer kurativen Resektion, sowie dem längeren Bestehen der Metastasierung. Dabei fällt auf, daß für die Größe der Metastasen, die mit einer ungünstigen Prognose einhergehen soll, beinahe so viele Grenzwerte wie Studien dazu vorliegen. Dementsprechend schwankt Prognoseverschlechterung zu die Grenze erwarten des ist, Durchmessers, zwischen 3 ab der eine und 10 cm. [16,18,20,31,34,35,48,49,50,57,62,63,65,68]. 74 Die Lokalisation der Lebermetastasen hatte in unserem Krankengut keinen Einfluss auf die Prognose (p=0,841), ähnlich der Studie von Riesener et al. [2,11,24], während andere Studien einen prognostischen Einfluss auf die Überlebenszeit verzeichneten [16,18,31,32,34,57]. Das rezidivfreie Intervall nach Primärtumorresektion zeigte eine signifikante Abhängigkeit auf die Überlebensrate. Patienten mit synchroner Metastasierung wiesen eine günstigere Prognose gegenüber Patienten mit metachronen Metastasen auf (p=0,041). Hier unterscheidet sich die Analyse mit zahlreichen Arbeiten anderer Untersucher, in denen die metachrone Metastasierung als prognostisch günstiger eingestuft wird. Patienten mit metachroner Metastasierung wiesen dort eine signifikant bessere Prognose auf als Patienten mit synchroner Metastasierung [24,31,56,61,63]. Da diese Studien über den im eigenen Krankengut beobachteten Zeitraum hinausgehen, könnte der Unterschied daraus resultieren. Jedoch zeigen die Studien bereits in den ersten zwei postoperativen Jahren einen Prognosevorteil für die metachrone Metastasierung, so dass die Divergenz für diesen Zeitraum im Vergleich zum eigenen Krankengut eindeutig hervortritt. Bei der weiteren Literaturrecherche fanden sich auch Studien ohne signifikanten Einfluss auf die Prognose [31,57]. Das Resektionsverfahren (periphere Resektion und Segmentresektion vs. Hemihepatektomie) hatte in unserem Krankengut keinen Einfluss auf die Prognose (p=0,568) Im Literaturvergleich divergieren die Ergebnisse. Zum einen fanden sich in Übereinstimmung mit unserer Analyse Studien, bei denen kein statistisch signifikanter Unterschied festgestellt werden konnte [57], zum anderen Untersuchungen, bei denen ein Einfluss der Resektionsform auf die Prognose vorlag, wobei kleinere Eingriffe prognostisch günstiger waren als Hemihepatektomien [16,46,65], bzw. Patienten, deren Lebermetastasen nur durch Trisegmentektomie entfernt werden konnten im Vergleich zu Patienten mit peripheren Resektionen oder Lobektomien eine ungünstigere Prognose aufwiesen [37] und Patienten mit anatomischer im Vergleich zu peripherer Leberresektion eine bessere Prognose hatten [63]. Der Überlebenswahrscheinlichkeit Lebermetastasen in Abhängigkeit nach zu kurativer der Leberresektion prozentualen (R0) Tumormasse kolorektaler kann keine prognostische Bedeutung nachgewiesen werden (p=0,469). In der Literaturrecherche fand sich eine Studie [57], die genau das Gegenteil repräsentierte. Dort war die prozentuale Tumorausdehnung von hochsignifikanter Bedeutung für die Prognose. 75 Bezüglich der Radikalität des Eingriffs fanden sich in der Literatur zahlreiche Studien, die einen klaren Prognosevorteil für R0-reserzierte Patienten (makroskopisch komplette Tumorentfernung mit histologisch tumorfreien Resktionsrand) gegenüber R1-reserzierten (histologisch Tumorrest) bzw. R2-reserzierten Patienten (makroskopisch Tumorrest) aufwiesen [1,24,31-33,35,46,50,56,57,61,65]. Der Vergleich der R0-reserzierten Patienten zu den R1/R2- reserzierten konnte im eigenen Patientengut nicht durchgeführt werden, da nach histologischer Aufarbeitung der Resektate in keinem Fall eine R1-Resektion mit Tumorzellausläufern im Resektionsbereich vorlag und bei keinem Patienten der chirurgische Eingriff als R2-Resektion beendet wurde. Jedoch konnte für das eigene Krankengut in Übereinstimmung mit zahlreichen anderen Untersuchern bestätigt werden, dass nicht nur das Erzielen einer R0-Resektion für die Langzeitprognose von größter Bedeutung ist, sondern zusätzlich die Einhaltung eines histologisch nachgewiesenen tumorfreien Sicherheitsabstands von mind. 1 cm [1,31,32,35,49,54,62]. Bei Betrachtung der R0reserzierten Patienten aus unserem Krankengut und Unterteilung innerhalb dieser Gruppe zwischen Resektionen, die mit einem histologischen tumorfreien Sicherheitsabstand von mehr als 1cm (R0a) bzw. weniger als 1cm (R0b) durchgeführt wurden, ergaben sich signifikante Unterschiede (p=0,027) in der Überlebensrate. Patienten mit einer R0aResektion wiesen eine durchschnittliche Überlebenszeit von 16 Monaten auf, während die Überlebenszeit in der Gruppe mit R0b-Resektion lediglich bei 9 Monaten lag. Die 2-JahresÜberlebensrate beträgt für Patienten mit einem weniger als 1cm breiten Sicherheitsabstand (R0b) 78%, während die Patienten mit einem mehr als 1cm tumorfreien Sicherheitsabstand vom Resektionsrand (R0a) eine 2-Jahres-Überlebensrate von 91% aufwiesen. Das Ausmaß des perioperativen Blutersatzes hatte in unserer Analyse, in Übereinstimmung zu den Berichten einzelner Untersucher, die eine Prognoseverschlechterung bei zunehmender Menge der Bluttransfusion angeben [58,68], eine große prognostische Bedeutung (p=<0,001, sehr signifikant). Mehrere Studien zeigten einen positiven Effekt einer postoperativen adjuvanten regionalen Chemotherapie nach kurativer Resektion von Lebermetastasen kolorektaler Karzinome [18,46,70]. Auch in unserer Studie ist der positive Effekt erkennbar. Die Resektion und anschließende regionale Chemotherapie zeigt gegenüber einer alleinigen Resektion ohne weitere Therapie eine deutlich günstigere Prognose (p=0,021). 76 6. Zusammenfassung Die Resektion von Lebermetastasen kolorektaler Primärtumoren kann heute als wenig belastendes Verfahren gelten. Während die durchschnittliche Lebenserwartung ohne reserzierendem Eingriff als schlecht anzusehen ist, kann die Prognose durch Entfernung der Tumoren wesentlich verbessert werden ( 2-Jahresüberlebensrate um 80% (eigenes Krankengut) und 5-Jahresüberlebensrate von 25-30% (Literatur) ). Bei den 38, aufgrund kolorektaler Lebermetastasen, reserzierten Patienten fanden sich als signifikante Faktoren für die Prognose: die Radikalität der Operation (Prognosegewinn bei Patienten mit einem histologisch tumorfreien Resektionsrand größer als 1cm (R0a) mit einer medianen Überlebenszeit von 16 Monaten gegenüber Patienten mit einem histologisch tumorfreien Resektionsrand kleiner als 1cm (R0b) mit einer medianen Überlebenszeit von 9 Monaten), das Intervall zwischen Primärtumoroperation und Auftreten der Metastasierung (Prognosegewinn bei Patienten mit synchroner gegenüber Patienten mit metachroner Metastasierung), die adjuvante regionale Chemotherapie, die Anzahl der Lebermetastasen (Prognoseverschlechterung mit (Prognoseverbesserung steigendem mit steigender Alter) Metastasenzahl), und der das perioperative Alter Blutverlust (Prognoseverschlechterung bei zunehmender Menge der Bluttransfusion). Anhand der Ergebnisse zeigt sich, dass Patienten mit kolorektalen Lebermetastasen von einer Leberresektion profitieren können bzw. bei ausgewählten Patienten mit kolorektalen Lebermetastasen eine Resektion grundsätzlich indiziert ist. Bei den 94 aufgrund benigner bzw. maligner Erkrankung/Tumoren der Leber behandelten Patienten zeigten sich in der Vergleichsanalyse: ein Überwiegen des weiblichen Geschlechts, ein im Durchschnitt jüngeres Lebensalter, eine hauptsächlich durchgeführte atypische Segmentresektion als Therapie der Wahl, eine kürzere Operationsdauer, eine kürzere portale Okklusionszeit, ein geringerer perioperativer Blutverlust, eine kürzere Intensivbehandlung, ein kürzerer stationärer Aufenthalt, eine geringere Morbidität und eine Letalität von 0% im Falle einer vorliegenden Benignität. 77 7. Literaturverzeichnis 1) Adson, M.A. Resection of liver metastases – When is it wortwhile? World J Surg 11: 511-520 (1987) 2) Adson, M.A., Heerden, J.A. van, Adson, M.H., Wagner, J.S., Ilstrup, D.M. Resection of hepatic metastases from colorectal cancer. Arch Surg 119: 647-651 (1984) 3) Anschütz, W. Über die Resektion der Leber. Klin Vorträge NF Nr 356/57: 451-529 (1903) 4) Assel, H., Voges, S., Fedderke, J. On the prognoses of metastatic liver: is the survival time determined by the location of the histological clssification of the primary tumor ? Tumor Diagn 3:146-149 (1981) 5) Bakalakos, E.A., Kim, J.A., Young, D.C., Martin, E.W. Jr. Determinants of survival following hepatic resection from metastatic colorectal cancer. World J Sirg 22: 399-404 (1998) 6) Berta, G., zitiert bei: Foster, J.H. History of liver surgery. Arch Surg 126: 381-387 (1991) 7) Bismuth, H., Castaing, D. Leberanatomie und ihre intraoperative Anwendung. Chirurg 61: 679-684 (1990) 8) Broelsch, C.E., illustrated by Buck, T. Atlas of liver surgery. Churchill Livingstone New York Edinburgh London Madrid Melbourne Tokyo 1993 78 9) Broelsch, C.E., Kremer, K., Lüdinghausen M. von. Leber In: Kremer, K., Lierse, W., Platzer, W., Schreiber, H.W., Weller, S. Chirurgische Operationslehre. Thieme-Verlag Stuttgart New York 1993 10) Büsing, M., Konczack, J., Schulz, T. Anatomiegerechte Leberresektionen – Indikation und operative Technik In: Zühlke, V., Kleinert, H. Aktuelles in der Chirurgie 12. Tagung der Chirurgischen Klinik der Bundesknappschaft 06.03.1999 Ponte Press 11) Butler, J., Attiyeh, F.F., Daly, J.M. Hepatic resection for metastases of the colon and rectum. Surg Gynecol Obstet 162: 109-113 (1986) 12) Calne, R.Y., Rolles, K., White, D.J.G. Cyclosporin A initially as the only immunosupressant in 34 recipients of cadaveric organs. Lancet 2: 1033-1036 (1979) 13) Cantlie, J. On a new arrangement of the right and left lobes of the liver. J Anat Physiol 32: 4-9 London 1898 14) Carpi da, J.B. Commentaria Super Anatomia Mundini. In: Die Geschichte der Medizin im Spiegel der Kunst. DuMont, Köln 1990, S 410 79 15) Couinaud C. Bases anatomiques des hepatectomies gauche et droite reglees, techniques qui en deroule J Chir 70: 933-966 Paris 1954 16) Doci, R., Gennari, L., Bignami, P., Montalto, F., Morabito, A., Bozzetti, F. One hundred patients with hepatic metastases from colorectal cancer treated by resection: analysis of prognostic determinants. Br J Surg 78: 797-801 (1991) 17) Eckert, P., Eichen, R. Portale Hypertension. Med Welt 28: 244-251 (1977) 18) Fong, Y., Fortner, J., Sun, R.L., Brennan, M.F., Blumgart, L.H. Clinical score for predicting recurrence after hepatic resection for metastatic colorectal cancer – analysis of 1001 consecutive cases. Ann Surg 230: 309-318 (1999) 19) Foster, J.G. History of Liver Surgery. Arch Surg 126: 381-387 (1991) 20) Foster, J.H. Survival after liver resection for secondary tumors Am J Surg 135: 389-394 (1978) 21) Funovies, J.M., Wenzel, E., Függer, R., Schemper, M. Leberresektion wegen hämatogener und infiltrierender Metastasen. Wien Klin Wochenschr 98: 813-820 (1986) 22) Galanski,M., Jörgensen,M., Högemann,D., Kirchhoff,T., Lotz,J., Baus,S., Prokop,M. Diagnostik und Differentialdiagnostik von Lebertumoren. Chir Gastroenterol 14: 184-195 (1998) 80 23) Garre´, C. (1889) Beiträge zur Leberchirurgie. Bruns Beitr Klin Chir 4: 181-196 24) Gayowski, T.J., Iwatsuki, S., Madariaga, J.R., Selby, R., Todo, S., Irish, W., Starzl, T.E., Experience in hepatic resection for metastatic colorectal cancer: Analysis of clinical and pathologic risk factors. Surgery 116: 703-711 (1994) 25) Geißler, F., Witzigmann, H., Tannapfel, A., Uhlmann, D., Hauss, J. Nichtoperative, regionale Therapieverfahren bei malignen Lebertumoren. Chir Gastroenterol 14: 206-211 (1998) 26) Glisson, F. In: Geschichte der Medizin im Spiegel der Kunst. DuMont Köln 1980, S 439 27) Gütgemann, A., Schriefers, K.H., Esser, G., Lie, T.S., Paquet, K.H., Käufer, C. Erfahrungsbericht über eine homologe Lebertransplantation. Dtsch Med Wochenschr 94: 1713 (1969) 28) Haberer, H. Experimentelle Unterbindung der Leberarterie. Arch klin Chir 78: 557-587 (1905) 29) Hardy, K.J. Liver Surgery: The Past 2000 Years. Aust N Z J Surg 60: 811-817 (1990) 30) Harvey, W. Movement of the heart and blood in animals. An anatomical essay. Blackwell Oxford 1957 81 31) Henne-Bruns, D., Vogel, I., Kremer, B. Ergebnisse der Leberresektion bei 113 Patienten mit Metastasen kolorektaler Karzinome. Zentralbl Chir 120: 84-89 (1995) 32) Henne-Bruns,D.,Vogel, I., Schröder, S., Schreiber, H.-W., Kremer, B. Resektion von Lebermetastasen colorectaler Karzinome. Ergebnisse und prognostische Faktoren. Chirurg 64: 283-289 (1993) 33) Hohenberger, O., Schlag, P., Herfarth, C. Erweiterte Resektion von Lebermetastasen beim kolorektalen Karzinom. Langenbecks Arch Chir 378: 110-114 (1993) 34) Hohenberger, P., Schlag, P., Schwarz, V., Herfarth, C. Leberresektion bei Patienten mit Metastasen colorektaler Carcinome, Ergebnisse und prognostische Faktoren. Chirurg 59: 410-417 (1988) 35) Hughes, K.S. et al Resection of the liver for colorectal carcinoma metastases: a multi-institutional study of indications for resection. Surgery 103: 278-288 (1988 ) 36) Israel J. Ein Fall von Exstirpation eines Lebercavernoms. Berl klin. Wochenschr 48: 662 (1911) 37) Iwatsuki, S., Esquivel, C.O., Gordin, R.D., Starzl, T.E. Liver resection for metastatic colorectal cancer. Surgery 100: 804-810 (1986) 38) Jaffe, B.M., Donegan, W.L., Watson, F., Spratt, J.S. Factors influencing survival patients with untreated hepatic metastases Surg Gynecol Obstet 127: 1-11 (1968) 82 39) Klempnauer, J., Schrem, H. Technik der erweiterten Hemihepatektomie. In: Köckerling, F., Waclawiczek, H.W. Leberchirurgie. Anatomie, Operationstechniken, Komplikationsvermeidung. Johann Ambrosius Barth Verlag Heidelberg Leipzig 1999 40) Kluge, F. Die Leber und ihre Krankheiten: Ein historischer Rückblick Leber Magen Darm 27: 15-22 (1997) 41) Langenbuch, C. (1888) Ein Fall von Resection eines linksseitigen Schnürlappens der Leber. Berl Klin Wochenschr 25: 37-38 42) Lehnert, T., Golling, M. Indikation und Ergebnisse der Lebermetastasenresektion Der Radiologe 41: 40-48 (2001) 43) Lippert, H. Lehrbuch der Anatomie. Urban & Schwarzenberg München Wien Baltimore 1993 44) Lippert, H. Technik der Hemihepatektomie In: Köckerling, F., Waclawiczek, H.W. Leberchirurgie. Anatomie, Operationstechniken, Komplikationsvermeidung. Johann Ambrosius Barth Verlag Heidelberg Leipzig 1999 45) Lius, A. Di un adenoma del fegato. Gazz Clin 23: 225 (1903) 83 46) Lorenz, M., Hottenrott, C., Encke, A. Adjuvante, regionale Chemotherapie nach Resektion von Lebermetastasen kolorektaler Primärtumoren. Zentralbl Chir 118: 279-289 (1993) 47) Mac Person, J. (1688), zitiert bei Mikeskey, W.E., Howard, J.M., DeBakey, M.E. Injuries of liver in 300 consecutive patients. Int Abstr Surg 103: 323-337 (1956) 48) Nakamura, S., Yokoi, Y., Suzuki, S., Baba, S., Muro, H. Results of extensive surgery for liver metastases in colorectal carcinoma. Br J Surg 79: 35-38 (1992) 49) Nordlinger, B., Guiguet, M., Vaillant, J.C., Balladur, P., Boudjema, K., Bachellier, P., Jaeck, D. Surgical resection of colorectal carcinoma metastases to the liver. A prognostic scorring system to improve case selection, based on 1568 patients. Association Francaise de Chirurgie. Cancer 77: 1254-1262 (1996) 50) Pedersen, I.K., Burcharth, F., Roikjaer, O., Baden, H. Resection of liver metastases from colorectal cancer. Indications and results. Dis Colon Rectum 37: 1078-1082 (1994) 51) Pichlmayr, R., Bockhorn, H., Bunzendahl, H. Leberersatz und Lebertransplantation. Münch Med Wochenschr 120: 207-210 (1978) 52) Pringle JH. Notes on the arrest of hepatic hemorrhage due to trauma. Ann Surg 48: 531-549 (1908) 53) Raab, R., Schlitt, H.J., Oldhofer, R. Technik der Leberresektion. Chir. Gastroenterol. 14: 213-218 (1998) 84 54) Rees, M., Plant, G., Bygrave Late results justify resection for multiple hepatic metastases from colorectal cancer. Br J Surg 84: 1136-1140 (1997) 55) Rex, H. Beiträge zur Morphologie der Säugerleber. Morp Jahrb 14: 517-616 (1888) 56) Riesener, K.-P., Winkeltau, G., Klemm, M., Schumpelick, V. Chirurgische Therapie von Lebermetastasen. Therapieverfahren, Ergebnisse und Prognosefaktoren Langenbecks Arch Chir 379: 321-328 (1994) 57) Ringe, B., Bechstein, W.O., Raab, R., Meyer, H.-J., Pichlmayr, R. Leberresektion bei 157 Patienten mit colorectalen Metastasen. Chirurg 61: 272-279 (1990) 58) Rosen, C.B., Nagorney, D.M., Taswell, H.F., Helgeson, S.L., Ilstrup, D.M., Van Heerden, J.A., Adson, M.A. Perioperative blood transfusion and determinants of survival after liver resection for metastatic colorectal carcinoma. Ann Surg 216: 493-505 (1992) 59) Rückert, R.J. Zur Geschichte der klinischen Lebertransplantation in Deutschland. Zentralbl Chir 117: 299-306 (1992) 60) Scheele, J. Die gefäßorientierte Segmentresektion der Leber Langenbecks Arch Chir 375: 308-317 (1990) 61) Scheele, J., Stangl, R., Altendorf-Hoffmann, A. Hepatic metastases from colorectal carcinoma: impact of surgical resection on the natural history. Br J Surg 77: 1241-1246 (1990) 85 62) Scheele, J., Stangl, R., Altendorf-Hofmann, A., Gall, F.P. Indicators of prognosis after hepatic resection for colorectal secondaries. Surgery 110: 13-29 (1991) 63) Scheele, J., Stangl, R., Altendorf-Hoffmann, A., Paul, M. Resection of colorectal liver metastases. World J Surg 19: 59-71 (1995) 64) Scheuerlein, H., Köckerling, F. Anatomie der Leber In: Köckerling, F., Waclawiczek, H.W. Leberchirurgie. Anatomie, Operationstechniken, Komplikationsvermeidung. Johann Ambrosius Barth Verlag Heidelberg Leipzig 1999 65) Seifert, J.K., Junginger, T. Resektion von Lebermetastasen kolorektaler Karzinome Langenbecks Arch Chir 381: 187-200 (1996) 66) Senninger, N., Kriegelstein, C.F. Technik der Segmentresektion. In: Köckerling, F., Waclawiczek, H.W. Leberchirurgie. Anatomie, Operationstechniken, Komplikationsvermeidung. Johann Ambrosius Barth Verlag Heidelberg Leipzig 1999 67) Starzl, T.E., Marchioro, T.L., von Kaulla, K.N., Hermann, G., Brittain, R.S., Waddell, W.R. Homotransplantation of the liver in humans. Surg Gynecol Obstet 117: 659-676 (1963) 68) Stephenson, K.R., Steinberg, S.M., Hughes, K.S., Vetto, J.T., Sugarbaker, P.H., Chang, A.E. Perioperative blood transfusion are associated with decreased time to recurrence an decreased survival after resection of colorectal liver metastases. Ann Surg 208:679-687 (1988) 86 69) Vesal, A. In: Illustrierte Geschichte der Medizin. Andreas Salzburg 1990, Bd. II, S 868-876 70) Wagmen, L.D., Kemeny, M.M., Leong, L., Terz, J.J., Hill, L.R., Beatty, J.D., Kokal, W.A., Riihimaki, D.U. A prospective randomized evaluation of the treatment of colorectal cancer metastatic to the liver. J Clin Oncol 8: 1885-1893 (1990) 71) Wendel W. Beiträge zur Chirurgie der Leber. Archiv klin Chir 95: 887-894 (1911) 72) Wolff H. Derzeitiger Stand der Lebertransplantation. Zentralbl Chir 104: 1626 (1979) 73) Wolff, H. Geschichte der Leberchirurgie In: Köckerling, F., Waclawiczek, H.W. Leberchirurgie. Anatomie, Operationstechniken, Komplikationsvermeidung. Johann Ambrosius Barth Verlag Heidelberg Leipzig 1999 74) www.med.uni-muenchen.de/tzm/empfehlung/gastro/S151.html - Primäre und sekundäre Lebermalignome - 87 8. Danksagung Mein besonderer Dank gilt meinem Doktorvater Herrn Prof. Dr. med. M. Büsing, Direktor der Klinik für Allgemein- und Unfallchirurgie des Knappschaftskrankenhauses Recklinghausen, Akademisches Lehrkrankenhaus der Ruhr-Universität Bochum, für die Vergabe des Themas und die Betreuung in allen Phasen der Vorbereitung und Entstehung. meinen Eltern Heinrich und Monika Ide, die stets Vertrauen in mich setzten und auf deren unerschöpfliche Unterstützung ich mich immer verlassen konnte. meinem Bruder Dipl. Ing. Michael Ide für die Unterstützung während des gesamten Studiums, dessen Abschluss diese Arbeit darstellt, insbesondere für die wertvollen Ratschläge während der Erstellung dieser Dissertation. Darüber hinaus spreche ich all denen meinen herzlichen Dank aus, die zu dem Gelingen meiner Arbeit beigetragen haben. 88 9. Lebenslauf Persönliche Daten Name: Anita Ide Geburtsdatum : 11.12.1976 Geburtsort: Bochum Schulbildung 1983-1987 Grundschule Hohe Eiche/Alte Bahnhofstr. in Bochum 1987-1996 Lessing-Gymnasium in Bochum Juni 1996 Abitur am Lessing-Gymnasium in Bochum Praktikum 01.08.-30.09.1996 Krankenpflegepraktikum in der Augenheilkunde an der Universitäts-Augenklinik am Knappschaftskrankenhaus Bochum Studium 1996-2002 Studium der Humanmedizin an der Ruhr- Universität Bochum 08/1998 Physikum 08/1999 Erster Abschnitt der Ärztlichen Prüfung 09/2001 Zweiter Abschnitt der Ärztlichen Prüfung Famulaturen 01.03.-31.03.1999 Allgemeinmedizin, Gynäkologie, Kinderheilkunde in einer Gemeinschaftspraxis in Bochum 10.09.-10.10.1999 Rechtsmedizin am Institut für Rechtsmedizin der Universitätskliniken Essen 14.02.-19.03.2000 Gynäkologie und Geburtshilfe Universitäts-Frauenklinik am an der Knappschafts- krankenhaus Bochum 17.07.-15.08.2000 Mund-, Kiefer- und Plastische Gesichtschirurgie an der Universitätsklinik für MKG-Chirurgie am Knappschaftskrankenhaus Bochum 89 16.08.-30.08.2000 Anästhesie und operative Intensivmedizin an der Universitätsklinik am Knappschaftskrankenhaus Bochum Praktisches Jahr 15.10.-03.02.2002 Chirurgie an der Chirurgischen-Universitätsklinik am Knappschaftskrankenhaus Bochum 04.02.-26.05.2002 Mund-, Kiefer- und Plastische Gesichtschirurgie an der Universitätsklinik für MKG-Chirurgie am Knappschaftskrankenhaus Bochum 27.05.-15.09.2002 Innere Medizin an der Medizinischen Universitätsklinik am Knappschaftskrankehaus Bochum 90