Mydocalm-Filmtabletten
Werbung

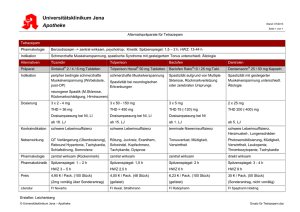
Mydocalm-Filmtabletten Qualitative und quantitative Zusammensetzung 1 Filmtablette enthält 50 mg Tolperisonhydrochlorid. Eine vollständige Auflistung der sonstigen Bestandteile fin-den Sie unter Abschnitt Sonstige Bestandteile. Darreichungsform Runde, rosa-farbene Filmtabletten mit einseitiger Prägung “50”. KLINISCHE ANGABEN Anwendungsgebiete Zerebrale und spinale Spastiken sowie lokale Muskelspasmen verschiedener Genese: Symptomenkomplex nach Läsionen der Pyramidenbahnen, Multiple Sklerose, Enzephalopathie bei Kindern und Erwachsenen. Rigor bei Erkrankungen des extrapyramidalen Systems. Trismus. Periphere Gefäßerkrankungen: Morbus Raynaud, obliterierende Arteriopathien, postthrombotische Zirkulationsstörungen. Dosierung, Art und Dauer der Anwendung Die Dosierung ist den individuellen Erfordernissen anzupassen. Sie beträgt im allgemeinen 3mal täglich 2 Filmtabletten. Die Dosierung wird bis zum Erreichen einer therapeutischen Wirkung unverändert beibehalten. Hierauf kann die Dosis auf 3mal täglich 1 Filmtablette reduziert werden. Die Behandlungsdauer ist vom Ergebnis abhängig. Je nach Bedarf kann auch eine mehrmonatige Therapie durchgeführt werden. Mit reichlich Flüssigkeit unzerkaut zu den Mahlzeiten einnehmen. Gegenanzeigen • Überempfindlichkeit gegenüber dem Wirkstoff Tolperisonhydrochlorid zw. anderen Bestandteilen des Arzneimittels, • Myasthenia gravis, • Bei der Anwendung bei Kindern und Jugendlichen liegen nur begrenzte Erfahrungen vor. Warnhinweise und Vorsichtsmaßnahmen für die Anwendung Bei Patienten mit eingeschränkter Nieren-, und/oder Leberfunktion sollte Tolperison nur unter strenger Indikationsstellung eingesetzt werden. Eine regelmäßige Überwachung der Nieren- bzw. Leberfunktion ist erforderlich. Tolperison bewirkt weder eine psychische noch eine physische Abhängigkeit. Wechselwirkungen mit anderen Mitteln Bis heute sind keine Interaktionen bekannt. Tolperison kann mit Benzodiazepinen, Glukokortikoiden, nichtsteroidalen Antiphlogistika und Vitamin-BPräparaten kombiniert werden. Bei gemeinsamer Verabreichung von Tolperison mit anderen zenral wirkenden Muskelrelaxanzien kann eine Dosisreduktion notwendig sein. Aufgrund des vermuteten genetischen Polymorphismus kann bei gleichzeitiger Anwendung von Benzodiazepinen, bzw. von nichtsteroidalen Antiphlogistika eine Dosisreduktion erforderlich sein. Schwangerschaft und Stillzeit Obwohl teratologische Untersuchungen keinen Anhaltspunkt für teratogene und embryotoxische Effekte in humantherapeutischen Dosen von Tolperison (siehe Abschnitt Präklinische Daten zur Sicherheit) ergeben haben, sollte Tolperison, wie die meisten Arzneimittel, während der Schwangerschaft im ersten Trimenon nicht, im weiteren Verlauf der, Schwangerschaft nur bei strenger Indikationsstellung angewendet werden. Da nicht bekannt ist, ob der Wirkstoff in die Muttermilch übergeht, sollte abgestillt werden. Auswirkungen auf die Verkehrstüchtigkeit und das Bedienen von Maschinen Tolperisonhydrochlorid besitzt keine sedative Wirkung und beeinträchtigt nicht die Fähigkeit zur aktiven Teilnahme am Straßenverkehr und zum Bedienen von Maschinen. Nebenwirkungen Selten (<1%) kann es zu leichten Kopfschmerzen, Nausea, Müdigkeit, Antriebslosigkeit, Muskelschwäche, Schwindelgefühl, Mundtrockenheit, Blutdruckabfall und Magen-Darmbeschwerden kommen. Diese Erscheinungen sind nach einer Dosisreduktion voll reversibel. Sehr selten (<0,1%) kommt es zu Überempfindlichkeitsreaktionen, wie Pruritus, Erythem, Exanthem, Dyspnoe, angioneurotischem Ödem und in einzelnen Fällen zum anaphylaktischen Schock. Überdosierung Die höchsten publizierten Dosen ohne spezifisch toxische Symptome lagen bei 800 mg. Bei Kindern wurde bei hohen Dosierungen (300 – 600 mg täglich) Erregbarkeit beobachtet. Ein 11 Monate altes Kind, das 750 mg Tolperison zu sich nahm zeigte supraventrikuläre und ventrikuläre Herzrhythmusstörungen mit verlängerter QT-Zeit. Nach erfolgreicher Wiederbelebung erholte sich die Patientin vollständig ohne Komplikationen. Therapie: Ein spezifisches Antidot gegen die Überdosierung existiert nicht, es wird eine unterstützende Therapie der Atmung und Maßnahmen zur Kreislaufstützung empfohlen. PHARMAKOLOGISCHE EIGENSCHAFTEN Pharmakodynamische Eigenschaften Pharmakotherapeutische Gruppe: Muskelrelaxanzien, zentral wirkende Mittel ATC Code: M03BX04 Tolperison ist ein zentrales Muskelrelaxans und setzt den Tonus der Skelettmuskulatur durch eine Modulierung der erregenden Einflüsse der Formatio reticularis auf die spinalen Motoneurone herab. Tolperison entfaltet seine Wirkung daher nur bei intaktem Tractus reticulo-spinalis. Pharmakologische Untersuchungen am Tier erbrachten für die Tolperison-Therapie den Nachweis – einer Abnahme der experimentellen hemiplegischen Muskelspastik, – einer Inaktivierung von polysynaptischen Reflexbögen im Bereich der spinalen Motoneurone, – einer peripheren, reflektorisch ausgelösten Vasodilatation. Pharmakokinetische Eigenschaften Tolperison wird im Dünndarm rasch und vollständig resorbiert, die maximale Plasmakonzentration wird 1,5 Stunden nach der Verabreichung erreicht. Tolperison wird in Leber und Niere extensiv metabolisiert, jedoch ist die pharmakologische Aktivität der Metaboliten unbekannt. Die Elimination erfolgt in 2 Phasen, einer raschen mit Halbwertszeit von 2 Stunden und einer langsamen mit einer Halbwertszeit von 12 Stunden. Tolperison kumuliert nicht im Organismus, sondern wird nach 8 Stunden zu 85% und nach 24 Stunden zu 98% der verabreichten Menge renal ausgeschieden. Möglicherweise liegt ein genetischer Polymorphismus von Tolperison vor, der die Notwendigkeit zur Dosistitration bedingt. Präklinische Daten zur Sicherheit Untersuchungen zur Toxizität belegen eine geringe Toxizität. In höheren Dosierungen treten Verhaltens- und Koordinationsstörungen, Ataxien, klonische Krämpfe und Aggressivität auf. Es wurden keine mutagene und teratogene Effekte beobachtet. Bei Reproduktionsstudien am Tier wurden Tolperisoninduzierte embryotoxische Veränderungen bei täglichen Dosen von 500 mg/kg bei Ratte und bei Dosen von 250 mg/ kg bei Kaninchen beobachtet. Es liegen keine Daten zu Kanzerogenese vor. PHARMAZEUTISCHE ANGABEN Sonstige Bestandteile Laktose, Maisstärke, mikrokristalline Zellulose, Talk, Stearinsäure, hochdisperses Siliciumdioxid, Zitronensäure, Hydroxypropylmethylcellulose, Macrogol, Titandioxid (E 171), Allurarot AC (E 129). Inkompatibilitäten Keine bekannt. Dauer der Haltbarkeit 36 Monate. Besondere Lagerungshinweise Nicht über 25° C lagern. Vor Licht geschützt aufbewahren. Art und Inhalt des Behältnisses PVC/Aluminium-Blisterpackung mit 30 (50) Filmtabletten. Hinweise für die Handhabung Keine. Zulassungsinhaber: Wabosan, Wien. Zulassungsnummer: 14.936 Zulassung: 25. Oktober 1971. Stand der Information: Februar 2010. Abgabe: Rezept- und apothekenpflichtig. PKZ: 30 ST RE1 (EKO: Y) [17.15]