anhang i verzeichnis der bezeichnungen, darreichungsformen
Werbung

ANHANG I
VERZEICHNIS DER BEZEICHNUNGEN, DARREICHUNGSFORMEN, STÄRKEN, ARTEN
DER ANWENDUNG DER ARZNEIMITTEL,
DER INHABER DER GENEHMIGUNG FÜR DAS INVERKEHRBRINGEN IN DEN
MITGLIEDSTAATEN
1
Mitgliedstaat
EU/EEA
Inhaber der Genehmigung für
das Inverkehrbringen
Österreich
GlaxoSmithKline Pharma GmbH, Fortum 0,5 g Albert Schweitzer-Gasse 6,
Trockenstechampullen
A-1140 Wien
Fortum 1 g Trockenstechampullen
Belgien
GlaxoSmithKline s.a. / n.v.
Rue du Tilleul 13
1332 Genval
Belgien
Phantasiebezeichnung
Name
Stärke
Darreichungsform Art der
Anwendung
500mg
Pulver zur
Herstellung einer
Injektionslösung
Pulver zur
Herstellung einer
Injektionslösung
Pulver zur
Herstellung einer
Injektions- oder
Infusionslösung
Pulver zur
Herstellung einer
Injektionslösung
1g
Fortum 2 g Trockenstechampullen
2g
Glazidim
500mg
Glazidim
1g
Glazidim
1g
Glazidim
2g
Glazidim
2g
Pulver zur
Herstellung einer
Infusionslösung
Pulver zur
Herstellung einer
Injektionslösung
Pulver zur
Herstellung einer
Infusionslösung
Pulver zur
Herstellung einer
Injektionslösung
2
intravenöse oder
intramuskuläre
Anwendung
intravenöse oder
intramuskuläre
Anwendung
intravenöse
Anwendung
Zur intravenösen
oder
intramuskulären
Anwendung
Zur intravenöse
Anwendung
Zur intravenösen
oder
intramuskulären
Anwendung
Zur intravenösen
Anwendung
Zur intravenösen
Anwendung
Inhalt
(Konzentration)
Mitgliedstaat
EU/EEA
Inhaber der Genehmigung für
das Inverkehrbringen
Bulgarien
Zypern
Glaxo Group Limited
Berkeley Avenue
Greenford
Middlex UB6 0NN
Vereinigtes Königreich
Tschechische
Republik
Glaxo Group Ltd.,
Fortum 500mg
Glaxo Welcome House, Berkeley
avenue, Greenford, Middlesex
UB6 0NN
Vereinigtes Königreich
Fortum 1g
Dänemark
Stärke
Darreichungsform Art der
Anwendung
Fortum
Glaxo Group Ltd.
Glaxo Wellcome House, Berkeley
avenue, Greenford, Middlesex
UB6 0NN, England
1g
Pulver zur
Herstellung einer
Injektionslösung
Zur intravenösen
oder
intramuskulären
Anwendung
Fortum
1g
Pulver zur
Herstellung einer
Injektionslösung
Zur intravenösen
Anwendung
500mg
Pulver zur
Herstellung einer
Injektionslösung
Zur intravenösen
Anwendung
1g
Pulver zur
Herstellung einer
Injektionslösung
Pulver zur
Herstellung einer
Injektionslösung
Pulver zur
Herstellung einer
Injektionslösung
Pulver zur
Herstellung einer
Injektionslösung
Zur intravenösen
Anwendung
GlaxoSmithKline Pharma A/S
Nykaer 68, 2605 Broendby
Dänemark
Phantasiebezeichnung
Name
Fortum 2g
2g
Fortum
500mg
Fortum
1g
3
Zur intravenösen
Anwendung
Zur intravenösen
Anwendung
Zur intravenösen
Anwendung
Inhalt
(Konzentration)
Die Ampullen
enthalten 1 g
Ceftazidim (als
Pentahydrat)
Mitgliedstaat
EU/EEA
Estland
Finnland
Inhaber der Genehmigung für
das Inverkehrbringen
Phantasiebezeichnung
Name
Stärke
Darreichungsform Art der
Anwendung
Fortum
2g
Zur intravenösen
Anwendung
Fortum
1g
Pulver zur
Herstellung einer
Injektionslösung
Pulver zur
Herstellung einer
Injektions/Infusionslösung
Zur intravenösen
oder
intramuskulären
Anwendung
1g
Glazidim
500mg
Pulver zur
Herstellung einer
Injektionslösung
Zur intravenösen
oder
intramuskulären
Anwendung
Die Ampullen
enthalten 500 mg
Ceftazidim (als
Pentahydrat)
Glazidim
1g
Pulver zur
Herstellung einer
Injektionslösung
Zur intravenösen
oder
intramuskulären
Anwendung
Die Ampullen
enthalten 1 g
Ceftazidim (als
Pentahydrate)
Glazidim
1g
GlaxoSmithKline Oy,
PB 24, 02231 Espoo
Finland
Glazidim
2g
GlaxoSmithKline Oy,
PB 24, 02231 Espoo
Finland
Glazidim
3g
Pulver zur
Herstellung einer
Injektions/Infusionslösung
Pulver zur
Herstellung einer
Injektions/Infusionslösung
Pulver zur
Herstellung einer
Injektions/Infusionslösung
Zur intravenösen
oder
intramuskulären
Anwendung
Zur intravenösen
oder
intramuskulären
Anwendung
Zur intravenösen
oder
intramuskulären
Anwendung
Die Ampullen
enthalten 1 g
Ceftazidim (als
Pentahydrat)
Die Ampullen)
enthalten 2 g
Ceftazidim (als
Pentahydrat)
Die Ampullen
enthalten 3 g
Ceftazidim (als
Pentahydrat)
Glaxo Wellcome Operations,
Glaxo Wellcome House, Berkeley
Avenue, Greenford, Middlesex,
UB6 0NN
Vereinigtes Königreich
Glaxo Operations UK Ltd, Glaxo
Wellcome House, Berkeley
Avenue, Greenford, Middlesex
UB6 0NN
England
Glaxo Operations UK Ltd, Glaxo
Wellcome House, Berkeley
Avenue, Greenford, Middlesex
UB6 0NN
Vereinigtes Königreich
GlaxoSmithKline Oy,
PB 24, 02231 Espoo
4
Inhalt
(Konzentration)
Mitgliedstaat
EU/EEA
Inhaber der Genehmigung für
das Inverkehrbringen
Phantasiebezeichnung
Name
Stärke
Darreichungsform Art der
Anwendung
Frankreich
Laboratoire GlaxoSmithKline
100, route de Versailles – 78163
Marly-le-Roi Cedex
Frankreich
Fortum enfants et
nourrisons
250mg
Pulver zur
Herstellung einer
Injektionslösung
Fortum enfants et
nourrisons
500mg
Pulver zur
Herstellung einer
Injektionslösung
Fortumset
1g
Fortum
1g
Pulver zur
Herstellung einer
Infusionslösung
(i.v.)
Pulver zur
Herstellung einer
Injektionslösung
Fortumset
2g
Fortum
2g
Fortum
500mg
Fortum
1g
Deutschland
GlaxoSmithKline GmbH & Co.
KG
Theresienhöhe 11
80339 München
Deutschland
Pulver zur
Herstellung einer
Infusionslösung
(i.v.)
Pulver zur
Herstellung einer
Injektionslösung
(i.v.)
Pulver zur
Herstellung einer
Injektions- oder
Infusionslösung
Pulver zur
Herstellung einer
5
Inhalt
(Konzentration)
Zur intravenösen
oder
intramuskulären
Anwendung
Zur intravenösen
oder
intramuskulären
Anwendung
Zur intravenösen
Anwendung
295mg
Zur intravenösen
oder
intramuskulären
Anwendung
Zur intravenösen
Anwendung
1182mg
Zur intravenösen
Anwendung
2364mg
Zur intravenösen
oder
intramuskulären
Anwendung
Zur intravenösen
oder
591mg
1182mg
2364mg
Mitgliedstaat
EU/EEA
Griechenland
Ungarn
Island
Inhaber der Genehmigung für
das Inverkehrbringen
GlaxoSmithKline a.e.b.e, Leof.
Kifissias 266,
152 32 Halandri, Athens
Griechenland
GlaxoSmithKline Kft.
1124 Bp, Csörsz u. 43.
Ungarn
GlaxoSmithKline ehf.
Thverholt 14
105 Reykjavík
Island
Phantasiebezeichnung
Name
Stärke
Darreichungsform Art der
Anwendung
Injektions- oder
Infusionslösung
Pulver zur
Herstellung einer
Injektions- oder
Infusionslösung
Pulver zur
Herstellung einer
Injektionslösung
Fortum
2g
Solvetan
1g
Solvetan
2g
Fortum
500mg
Fortum
1g
Fortum
2g
Fortum
1g
Fortum
2g
Pulver zur
Herstellung einer
Injektionslösung
Pulver zur
Herstellung einer
Injektionslösung
Pulver zur
Herstellung einer
Injektionslösung
Pulver zur
Herstellung einer
Infusionslösung
Pulver zur
Herstellung einer
Injektionslösung
Pulver zur
Herstellung einer
Infusionslösung
6
intramuskulären
Anwendung
Zur intravenösen
Anwendung
Zur
intramuskulären
oder intravenösen
Anwendung
Zur intravenösen
Anwendung
Zur intravenösen
Anwendung
Zur intravenösen
Anwendung
Zur intravenösen
Anwendung
Zur intravenösen
oder
intramuskulären
Anwendung
Zur intravenösen
Anwendung
Inhalt
(Konzentration)
Mitgliedstaat
EU/EEA
Inhaber der Genehmigung für
das Inverkehrbringen
Phantasiebezeichnung
Name
Stärke
Darreichungsform Art der
Anwendung
Irland
GlaxoSmithKline (Ireland)
Limited
Stonemasons Way,
Rathfarnham,
Dublin 16
Irland
Fortum
500mg
Pulver zur
Herstellung einer
Injektionslösung
Fortum
1g
Fortum
Fortum
Fortum
Italien
GlaxoSmithKline S.p.A. - Via A. Glazidim
Fleming, 2 –
37135 Verona
Italien
Glazidim
Pulver zur
Herstellung einer
Injektions- oder
Infusionslösung,
Ampulle
1g
Pulver zur
Herstellung einer
Infusionslösung,
Monovial
2g
Pulver zur
Herstellung einer
Injektions- oder
Infusionslösung,
Ampulle
2g
Pulver zur
Herstellung einer
Infusionslösung,
Monovial
250mg/ml
Pulver und
Lösungsmittel zur
Herstellung einer
Injektionslösung
500mg/1,5ml Pulver und
Lösungsmittel zur
Herstellung einer
Injektionslösung
7
Inhalt
(Konzentration)
Zur intravenösen
oder
intramuskulären
Anwendung
Zur intravenösen
oder
intramuskulären
Anwendung
Rekonstitutionslösu
ng enthält 500 mg
Ceftazidim
Zur Infusion
Rekonstitutionslösu
ng enthält 1 g
Ceftazidim
Zur intravenösen
oder
intramuskulären
Injektion oder
Infusion
Zur Infusion
Rekonstitutionslösu
ng enthält 2 g
Ceftazidim
Zur
intramuskulären
Anwendung
Zur
intramuskulären
Anwendung
Rekonstitutionslösu
ng enthält 1 g
Ceftazidim
Rekonstitutionslösu
ng enthält 2 g
Ceftazidim
Mitgliedstaat
EU/EEA
Inhaber der Genehmigung für
das Inverkehrbringen
Phantasiebezeichnung
Name
Stärke
Darreichungsform Art der
Anwendung
Glazidim
1g/3ml
Glazidim
1g/10ml
Pulver und
Lösungsmittel zur
Herstellung einer
Injektionslösung
Pulver und
Lösungsmittel zur
Herstellung einer
Injektionslösung
Pulver zur
Herstellung einer
Infusionslösung
Pulver und
Lösungsmittel zur
Herstellung einer
Infusionslösung
(Monovial)
Pulver und
Lösungsmittel zur
Herstellung einer
Infusionslösung
(Monovial)
Pulver zur
Herstellung einer
Infusionslösung
(Monovial)
Pulver zur
Herstellung einer
Infusionslösung
(Monovial)
Glazidim
2g
Glazidim
1g/100ml
Glazidim
2g/100ml
Glazidim
1g
Glazidim
2g
8
Zur
intramuskulären
Anwendung
Zur intravenösen
Anwendung
Zur intravenösen
Anwendung
Zur intravenösen
Anwendung
Zur intravenösen
Anwendung
Zur intravenösen
Anwendung
Zur intravenösen
Anwendung
Inhalt
(Konzentration)
Inhaber der Genehmigung für
das Inverkehrbringen
Phantasiebezeichnung
Name
Stärke
Darreichungsform Art der
Anwendung
Glaxo Allen S.p.A
Via Fleming, 2
Verona
Italien
Panzid
1g/3ml
Pulver und
Lösungsmittel zur
Herstellung einer
Injektionslösung
Zur
intramuskulären
Anwendung
Lettland
GlaxoSmithKline Latvia SIA
Bruninieku 5, Riga, LV-1001,
Lettland
Fortum 1 g powder for
solution for injection or
infusion
1g
Litauen
UAB „GlaxoSmithKline Lietuva“, Fortum
A. Goštauto g. 40A,
LT-01112 Vilnius, Litauen
Pulver zur
Herstellung einer
Injektions- oder
Infusionslösung
Pulver und
Lösungsmittel zur
Herstellung einer
Injektionslösung
Pulver und
Lösungsmittel zur
Herstellung einer
Injektionslösung
Pulver zur
Herstellung einer
Injektions- oder
Infusionslösung
Pulver zur
Herstellung einer
Injektions- oder
Infusionslösung
Pulver zur
Herstellung einer
Injektionslösung
Zur intravenösen
oder
intramuskulären
Anwendung
intravenöse oder
intramuskuläre
Anwendung
Mitgliedstaat
EU/EEA
Luxenburg
GlaxoSmithKline s.a. / n.v.
Rue du Tilleul 13
1332 Genval
Belgien
500mg
Fortum
1g
Fortum
2g
Fortum
3g
Glazidim
500mg
9
intravenöse oder
intramuskuläre
Anwendung
intravenöse
Anwendung
intravenöse
Anwendung
Zur intravenösen
oder
intramuskulären
Anwendung
Inhalt
(Konzentration)
1 g Ceftazidim (als
Ceftazdim
Pentahydrat)
Mitgliedstaat
EU/EEA
Inhaber der Genehmigung für
das Inverkehrbringen
Phantasiebezeichnung
Name
Stärke
Darreichungsform Art der
Anwendung
Glazidim
1g
Glazidim
1g
Pulver zur
Herstellung einer
Infusionslösung
Pulver zur
Herstellung einer
Injektionslösung
Glazidim
2g
Glazidim
2g
Pulver zur
Herstellung einer
Infusionslösung
Pulver zur
Herstellung einer
Injektionslösung
Pulver zur
Herstellung einer
Injektionslösung
Malta
Glaxo Operations UK Limited
Glaxo Wellcome House
Berkeley Avenue
Greenford
Middlesex UB6 0NN
Vereinigtes Königreich
Fortum
1g pro
Ampulle
Niederlande
Glaxo Smith Kline B.V.
Huis ter Heideweg 62
3705 LZ ZEIST
Niederlande
Fortum
500mg
Pulver zur
Herstellung einer
Injektionslösung
Fortum
1g
Pulver zur
Herstellung einer
Injektionslösung
Fortum
2g
Pulver zur
Herstellung einer
Injektionslösung
10
Zur intravenösen
Anwendung
Zur intravenösen
oder
intramuskulären
Anwendung
Zur intravenösen
Anwendung
Zur intravenösen
Anwendung
Zur intravenösen
oder
intramuskulären
Anwendung
Zur intravenösen
oder
intramuskulären
Anwendung
Zur intravenösen
oder
intramuskulären
Anwendung
Zur intravenösen
Anwendung
Inhalt
(Konzentration)
Mitgliedstaat
EU/EEA
Inhaber der Genehmigung für
das Inverkehrbringen
Phantasiebezeichnung
Name
Stärke
Darreichungsform Art der
Anwendung
Norwegen
GlaxoSmithKline AS
Forskningsveien 2A
Postboks 180 Vinderen
0319 Oslo
Norwegen
Fortum
500mg
Fortum
1g
Fortum
2g
Pulver zur
Herstellung einer
Injektions/Infusionslösung
Pulver zur
Herstellung einer
Injektions/Infusionslösung
Pulver zur
Herstellung einer
Injektions/Infusionslösung
Zur intravenösen
oder
intramuskulären
Anwendung
Zur intravenösen
oder
intramuskulären
Anwendung
Zur intravenösen
Anwendung
250mg
Pulver zur
Herstellung einer
Injektionslösung
500mg
Pulver zur
Herstellung einer
Injektionslösung
Zur intravenösen
oder
intramuskulären
Anwendung
Zur intravenösen
oder
intramuskulären
Anwendung
Zur intravenösen
oder
intramuskulären
Anwendung
Zur intravenösen
Anwendung
Polen
GlaxoSmithKline Export Ltd
Fortum
980 Great West Road
Brentford, Middlesex, TW8 9GS
Vereinigtes Königreich
Fortum
Fortum
Fortum
Portugal
Glaxo Wellcome Farmacêutica, Cefortam
Lda.
Rua Dr. António Loureiro Borges,
3
1g
Pulver zur
Herstellung einer
Injektions- oder
Infusionslösung
2g
Pulver zur
Herstellung einer
Injektions- oder
Infusionslösung
500mg/1,5ml Pulver und
Lösungsmittel zur
Herstellung einer
Injektionslösung
11
Zur intravenösen
oder
intramuskulären
Anwendung
Inhalt
(Konzentration)
Mitgliedstaat
EU/EEA
Rumänien
Slowakei
Inhaber der Genehmigung für
das Inverkehrbringen
Phantasiebezeichnung
Name
Stärke
Darreichungsform Art der
Anwendung
Aquiparque – Miraflores
1495 – 131 Algés
Portugal
Cefortam
1g/3ml
Cefortam
2g
Pulver und
Lösungsmittel zur
Herstellung einer
Injektionslösung
Pulver zur
Herstellung einer
Injektionslösung
Pulver zur
Herstellung einer
Injektionslösung
Glaxo Wellcome UK Limited,
Fortum
Glaxo Wellcome House, Berkeley
Avenue, Greenford, Middlesex,
UB6 0NN
Vereinigtes Königreich
Fortum
1g
Pulver zur
Herstellung einer
Injektionslösung
Fortum
1g
Pulver zur
Herstellung einer
Injektionslösung
Fortum
1g
Pulver zur
Herstellung einer
Injektionslösung
Fortum
2g
Pulver zur
Herstellung einer
Injektions- oder
Infusionslösung
Pulver zur
Herstellung einer
Injektionslösung
GlaxoSmithKline Slovakia sro., Fortum
Galvaniho7/A, 82104 Bratislava,
Slowakei.
500mg
500mg
12
Zur intravenösen
oder
intramuskulären
Anwendung
Zur intravenösen
Anwendung
Zur intravenösen
oder
intramuskulären
Anwendung
Zur intravenösen
oder
intramuskulären
Anwendung
Zur intravenösen
oder
intramuskulären
Anwendung
Zur intravenösen
oder
intramuskulären
Anwendung
Zur intravenösen
oder
intramuskulären
Anwendung
Zur intravenösen
Anwendung
Inhalt
(Konzentration)
Mitgliedstaat
EU/EEA
Slowenien
Spanien
Schweden
Inhaber der Genehmigung für
das Inverkehrbringen
GSK d.o.o., Ljubljana
Knezov štradon 90
SI-1000 Ljubljana
Slowenien
GlaxoSmithKline, S.A.
P.T.M.- C/Severo Ochoa, 2
28760 Tres Cantos (Madrid)
Spanien
GlaxoSmithKline AB
Box 516
169 29 Solna
Schweden
Phantasiebezeichnung
Name
Stärke
Darreichungsform Art der
Anwendung
Fortum
1g
Fortum
2g
Fortum
1g
Fortum Monovial
1g
Fortam IM/IV
500mg
Fortam IV
1g
Fortam 1g
1g
Fortam IV
2g
Fortum
250mg
Pulver zur
Herstellung einer
Infusionslösung
Pulver zur
Herstellung einer
Infusionslösung
Pulver zur
Herstellung einer
Injektions- oder
Infusionslösung
Pulver zur
Herstellung einer
Infusionslösung
Pulver zur
Herstellung einer
Injektionslösung
Pulver zur
Herstellung einer
Injektionslösung
Pulver zur
Herstellung einer
Injektionslösung
Pulver zur
Herstellung einer
Infusionslösung
Pulver zur
Herstellung einer
Injektionslösung
13
Inhalt
(Konzentration)
Zur intravenösen
Anwendung
Zur intravenösen
Anwendung
Zur intravenösen
Anwendung
Zur intravenösen
Anwendung
Zur intravenösen
Anwendung/i.m.
Zur intravenösen
Anwendung
Zur intravenösen
Anwendung/i.m.
Zur intravenösen
Anwendung
Zur
intramuskulären
oder intravenösen
Anwendung
250 mg Ceftazidim
(als Pentahydrat)
Mitgliedstaat
EU/EEA
Inhaber der Genehmigung für
das Inverkehrbringen
Phantasiebezeichnung
Name
Stärke
Darreichungsform Art der
Anwendung
Fortum
500mg
Pulver zur
Herstellung einer
Injektionslösung
Fortum
1g
Pulver zur
Herstellung einer
Injektionslösung
Fortum
1g
Fortum
Fortum
Fortum
Vereinigtes
Königreich
Glaxo Operations UK Ltd,
Fortum
Glaxo Wellcome House, Berkeley
Avenue, Greenford Road,
Middlesex, UB6 0NN
Fortum
Vereinigtes Königreich
Fortum
Pulver zur
Herstellung einer
Infusionslösung
1g Monovial Pulver zur
Herstellung einer
Infusionslösung
2g Monovial Pulver zur
Herstellung einer
Infusionslösung
2g
Pulver zur
Herstellung einer
Injektions/Infusionslösung
250mg
Pulver zur
Herstellung einer
Injektionslösung
500mg
Pulver zur
Herstellung einer
Injektionslösung
1g
Pulver zur
Herstellung einer
Injektionslösung
14
Inhalt
(Konzentration)
Zur
intramuskulären
oder intravenösen
Anwendung
Zur
intramuskulären
oder intravenösen
Anwendung
Zur intravenösen
Anwendung
500 mg Ceftazidim
(als Pentahydrat)
Zur intravenösen
Anwendung
1 g Ceftazidim (als
Pentahydrat)
Zur intravenösen
Anwendung
2 g Ceftazidim (als
Pentahydrat)
Zur intravenösen
Anwendung
2 g Ceftazidim (als
Pentahydrat)
intravenöse oder
intramuskuläre
Anwendung
intravenöse oder
intramuskuläre
Anwendung
intravenöse oder
intramuskuläre
Anwendung
118 mg pro g
Ceftazidim
1 g Ceftazidim (als
Pentahydrat)
1 g Ceftazidim (als
Pentahydrat)
118 mg pro g
Ceftazidim
118 mg pro g
Ceftazidim
Mitgliedstaat
EU/EEA
Inhaber der Genehmigung für
das Inverkehrbringen
Phantasiebezeichnung
Name
Stärke
Fortum
2g und 3g + Pulver zur
2g Monovial Herstellung einer
Infusionslösung
15
Darreichungsform Art der
Anwendung
intravenöse oder
intramuskuläre
Anwendung
Inhalt
(Konzentration)
118 mg pro g
Ceftazidim
ANHANG II
WISSENSCHAFTLICHE SCHLUSSFOLGERUNGEN UND BEGRÜNDUNG DER
EUROPÄISCHEN ARZNEIMITTELAGENTUR FÜR DIE ÄNDERUNG DER
ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS, DER
ETIKETTIERUNG UND DER PACKUNGSBEILAGE
16
Wissenschaftliche Schlussfolgerungen
Komplette Zusammenfassung der wissenschaftlichen Beurteilung von Fortum und zugehörigen
Bezeichnungen (siehe Anhang I)
Aufgrund der abweichenden nationalen Entscheidungen seitens der Mitgliedstaaten zur Genehmigung
von Fortum und dessen zugehörigen Bezeichnungen (Ceftazidim) wurde nach Artikel 30 der
geänderten Fassung der Richtlinie 2001/83/EG ein Verfahren ausgelöst, um seine abweichenden
Fachinformationen EU-weit zu vereinheitlichen. Fortum enthält Ceftazidim, ein CephalosporinAntibiotikum der dritten Generation mit In-vitro-Aktivität gegen einige grampositive und viele
gramnegative Bakterien, einschließlich P. aeruginosa. Fortum hemmt bakterielle Enzyme, die für die
Zellwandsynthese (Peptidoglycansynthese) notwendig sind, wodurch Zelltod induziert wird.
Ceftazidim ist seit seiner ersten Zulassung in 1983 in klinischem Gebrauch und hat in der klinischen
Praxis einen festen Platz. Es wird inzwischen weltweit verschrieben. Fortum ist in allen 27
Mitgliedstaaten der EU, sowie in Norwegen und Island, zugelassen. Der CHMP rief im Februar und
September 2010 eine Arbeitsgruppe zusammen.
Abschnitt 4.1 – Anwendungsgebiete
Der CHMP stellte die Abweichungen in Abschnitt 4 fest und verwies auf die aktuellen Leitlinien (EGLeitlinie für Fachinformationen, Oktober 2005, und CPMP/EWP/558/95 Rev. 1 - Note for Guidance
on Evaluation of Medicinal Products Indicated for Treatment of Bacterial Infections, 2004). Diesen
Leitlinien zufolge kann ein Anwendungsgebiet genehmigt werden, wenn die klinischen Daten für ein
günstiges Nutzen-Risiko-Verhältnis sprechen und das übliche Spektrum der Art und des Schweregrads
von Infektionen widerspiegeln. Anwendungsgebiete müssen spezifisch für die Infektion
(Infektionsstelle) sein. Ausgehend von der antibakteriellen Aktivität von Ceftazidim und klinischen
Daten, brachte der CHMP erhebliche Zweifel an der Eignung von Ceftazidim bei der empirischen
Behandlung einer Reihe von Infektionen zum Ausdruck, da solche Daten häufig (und bei manchen
Indikationen fast ausschließlich) aus offenen und/oder nicht-kontrollierten Prüfungen stammen. Daher
wurde Abschnitt 4.4 mit einem entsprechenden Warnhinweis ergänzt, um auf die Einschränkungen der
Studien hinzuweisen, anstatt die Anwendungsgebiete zu begrenzen.
1. Infektionen der unteren Atemwege
Nach Ansicht des CHMP sind die Begriffe „Atemwegsinfektion“ und „Infektionen der unteren
Atemwege“ unspezifisch und ihre genaue Bedeutung Auslegungssache. Bakterielle Infektionen der
unteren Atemwege können Infektionen wie Pneumonie, akute Bronchitis, akute Verschlimmerungen
einer chronisch-obstruktiven Lungenkrankheit, Pleuraempyem, Lungenabszess und Lungeninfektion
in Zusammenhang mit Mukoviszidose umfassen. Die aktuellen Leitlinien verlangen, dass die
Anwendungsgebiete spezifischer sind, da die verschiedenen klinischen Erkrankungen, die unter der
Bezeichnung „Infektionen der unteren Atemwege“ zusammengefasst sind, ätiologisch verschieden
sind und daher möglicherweise eine unterschiedliche Behandlung erfordern. In Übereinstimmung mit
den aktuellen Leitlinien unterteilte der CHMP die Anwendungsgebiete daher in ambulant erworbene
Pneumonie (Community Acquired Pneumonia, CAP) und nosokomiale Pneumonie (Hospital Acquired
Pneumonia, HAP).
Was CAP anbelangte, so nahm der CHMP die eingereichten Studien zur Kenntnis, einschließlich einer
Reihe nicht-vergleichender Studien bei Patienten mit Atemwegsinfektionen, darunter akute chronische
Bronchitis, Infektionen der unteren Atemwege (einschließlich Pneumonie) und akute
Verschlimmerung einer chronischen Bronchitis. Der Beurteilung zufolge waren die als Beleg
angeführten Studien von begrenzter Anwendbarkeit und mangelhaft beschrieben. Die Studien, die sich
mit CAP befassten, waren in der Regel klein, und den vorgelegten Daten zufolge konnte das
17
Studienkollektiv nicht angemessen charakterisiert werden. Vergleichende Studien scheinen generell
bessere Punktschätzungen einer klinischen Wirksamkeit der Vergleichsregimes gegenüber Ceftazidim
anzugeben, und die In-vitro-Aktivität von Ceftazidim würde nahe legen, dass es sich dabei nicht um
eine bevorzugte Erstlinien-Behandlung bei CAP handelt. Insgesamt war der CHMP der Ansicht, dass
die vorgelegten Daten nicht für CAP als Anwendungsgebiet sprechen, und äußerte besondere
Bedenken in Bezug auf die Aktivität von Ceftazidim gegen S. pneumoniae und das optimale
Dosisregime von Ceftazidim, wenn es sich dabei um das primäre Pathogen bei einer CAP handelt.
Letztendlich stimmte der CHMP nicht dafür, dass ambulant erworbene Pneumonie ein
Anwendungsgebiet darstellt.
Was HAP anbelangte, so nahm der CHMP die eingereichten Studien zur Kenntnis, einschließlich einer
Reihe nicht-vergleichender Studien bei Patienten mit Atemwegsinfektionen, darunter akute chronische
Bronchitis, Infektionen der unteren Atemwege (einschließlich Pneumonie) und akute
Verschlimmerung einer chronischen Bronchitis. Es wurden mehrere Studien vorgelegt, an denen nur
Patienten mit HAP teilnahmen, während andere Studien, die zum Stichwort „HAP“ vorgelegt wurden,
bei Patienten mit ventilatorassoziierter Pneumonie (VAP) durchgeführt worden waren. Nach Ansicht
des CHMP liefern die vorgelegten Studien Beweise für die Wirksamkeit bei der Behandlung von
Patienten mit HAP, wenngleich die Erfolgsquoten variabel waren. Was VAP anbelangte, hielt der
CHMP die Daten nicht für ausreichend, um eine Indikation zu befürworten.
Der CHMP hielt auch die Daten bei Kindern und Jugendlichen für sehr begrenzt, nahm aber die
beiden vom Inhaber der Genehmigung für das Inverkehrbringen vorgelegten Studien zur Kenntnis.
Die Überlegungen in Bezug auf CAP und HAP stimmen für Erwachsene und Kinder weitgehend
überein, und aus Studien bei Erwachsenen können Daten zur Wirksamkeit extrapoliert werden. Es
wurden die klinischen Erfahrungen bei außerhalb kontrollierter klinischer Studien mit Ceftazidim
behandelten Kindern berücksichtigt, und der CHMP zog daher in Betracht, dass die bei der
erwachsenen Bevölkerung erteilte Indikation auf Kinder und Jugendliche ausgeweitet werden sollte.
Der CHMP übernahm deshalb folgendes Anwendungsgebiet:
„Nosokomiale Pneumonie“.
2. Akute Infektionen bei Mukoviszidose
Der CHMP stellte fest, dass P. aeruginosa und Burkholderia cepacia die am häufigsten isolierten
Organismen bei Mukoviszidose sind und dass Ceftazidim gegen beide in vitro aktiv ist. Beide sind
allerdings oft gegen viele Antibiotika resistent, darunter auch gegen Ceftazidim, insbesondere bei
Patienten mit Mukoviszidose. Die meisten vorgelegten Studien waren von geringem Umfang und
nicht-kontrolliert und schlossen lediglich Patienten mit einer Infektion mit P. aeruginosa ein. Die
klinischen Erfolgsquoten lagen zwischen 75 % und 100 %, während die Quoten der Beseitigung der
Bakterien im Bereich von etwa 20 % bis 80 % lagen. Ungeachtet der Einschränkungen von Ceftazidim
war der CHMP dennoch der Ansicht, dass die Daten die klinische Wirksamkeit der Substanz bei
bronchiopulmonalen Infektionen bei Patienten mit Mukoviszidose belegen. Bei Patienten mit
Mukoviszidose ist die Behandlungssicherheit von besonderer Bedeutung, so dass bei der Bewertung
des Nutzen-Risiko-Verhältnisses von Ceftazidim bei dieser Population die vergleichsweise gute
Verträglichkeit und das geringe Risiko einer Lebertoxizität berücksichtigt wurden. Der CHMP
übernahm deshalb folgendes Anwendungsgebiet:
„Bronchiopulmonale Infektionen bei Mukoviszidose“
18
3. Fiebrige Neutropenie
Der CHMP nahm die vom Inhaber der Genehmigung für das Inverkehrbringen vorgelegten klinischen
Studien zur Kenntnis, an denen Patienten mit verschiedenen Basiserkrankungen und Ursachen für die
Neutropenie, Neutropenie oder Granulozytopenie verschiedenen Schweregrads und verschiedenen
Arten von Infektionen teilgenommen hatten. Ungeachtet der Einschränkungen der Daten liegen nach
Ansicht des CHMP Daten in angemessenem Umfang über Ceftazidim als Monotherapie oder in
Kombination mit anderen Antibiotika vor. Kürzlich durchgeführte systematische Übersichtsanalysen
und Metaanalysen der vorliegenden Fachliteratur lassen den Schluss zu, dass eine einleitende
Monotherapie mit einem Breitband-Betalactam effektiv ist und gleichzeitig weniger Nebenwirkungen
hervorruft als eine Behandlung mit einem Breitband-Betalactam plus einem Aminoglycosid. Der
CHMP übernahm folgendes Anwendungsgebiet:
„Ceftazidim kann beim Management neutropenischer Patienten mit einem vermutlich auf einen
bakteriellen Infekt zurückzuführenden Fieber angewendet werden.“
4. Infektionen der Haut und Weichteile
Der CHMP nahm die als Beleg für die Anwendungsgebiete Haut- und Weichteilinfektionen (Skin and
Soft Tissue Infections; SSTI) eingereichten Studien zur Kenntnis. Die verstärkte Resistenz
gramnegativer und insbesondere grampositiver Bakterien macht die Behandlung komplizierter SSTIs
(cSSTIs) komplexer. Den vorgelegten pharmakokinetischen Daten zufolge hat Ceftazidim eine gute
Gewebedurchdringung und ist in Hautgewebe/Blasen in ausreichender Konzentration vorhanden, um
für die Behandlung von SSTI geeignet zu sein. Die vom Inhaber der Zulassung für das
Inverkehrbringen außerdem vorgelegten klinischen Studien steuerten keine neuen Daten gegenüber
den anfänglichen Antworten bei. Zwar waren die bakteriologischen Daten aus den eingereichten
Studien begrenzt, aber nach Ansicht des CHMP lieferten sie dennoch Argumente für die Wirksamkeit
von Ceftazidim bei Infektionen mit Gramnegativen und insbesondere mit P. aeruginosa.
Nichtsdestotrotz bleiben Bedenken in Bezug auf Grampositive und insbesondere S. aureus bestehen.
Ausgehend von den In-vitro-Daten war der CHMP der Ansicht, dass Ceftazidim für eine empirische
Behandlung von cSSTI ungeeignet ist, obwohl einige Nachweise für die Wirksamkeit von Ceftazidim
bei moderaten bis schweren und komplizierten SSTI sprächen, wenngleich die vorliegenden
Belegdaten von eingeschränkter Qualität seien, und dass eine Kombination mit einem Antibiotikum
mit besserer Aktivität gegen grampositive Bakterien (z. B. Glykopeptide) notwendig sein könnte. Es
wurden zwar keine Studien vorgelegt, welche die Anwendung von Ceftazidim bei Kindern oder
Neugeborenen mit SSTI unterstützen, aber der CHMP war der Ansicht, dass die Überlegungen im
Hinblick auf cSSTI bei Erwachsenen und Kindern gleich sind. Schlussendlich begrenzte der CHMP
die Indikation auf komplizierte SSTIs, was die Daten aus den Studien besser widerspiegelt, und
übernahm folgende Indikation:
„Komplizierte Infektionen der Haut und Weichteile“
5. Knochen- und Gelenkinfektionen
Nach Ansicht des CHMP waren die zugunsten der Indikation vorgelegten Daten sehr begrenzt,
allerdings räumte der Ausschuss den allgemeinen Mangel an klinischen Studien guter Qualität bei der
Behandlung von Knochen- und Gelenkinfektionen ein. Es gibt keinen Konsens, was die am besten
geeignete Antibiose anbelangt, da die meisten nicht-kontrollierten Studien keine Unterscheidung
zwischen verschiedenen Wirkstoffen zulassen. Die vorgelegten Studien an tierexperimentellen
Modellen waren von begrenztem Nutzen, und es gab keine In-vitro-Daten bei grampositiven Arten.
Die pharmakokinetischen Eigenschaften von Ceftazidim legen allerdings eine angemessene
Knochendurchdringung nahe; dank seines antibakteriellen Spektrums ist es ein möglicherweise
nützlicher Wirkstoff für die Behandlung von Osteomyelitis bei einer Infektion mit Gramnegativen.
19
Was Pädiatrie-Patienten anbelangte, so war der CHMP der Ansicht, dass trotz mangelnder Studien zur
Unterstützung der Anwendung bei Kindern oder Neugeborenen mit Knochen- und Gelenkinfektionen
die Überlegungen für Erwachsene dieselben sind wie für Pädiatrie-Patienten. Schlussendlich
übernahm der CHMP folgende vereinheitlichte Indikation:
„Knochen- und Gelenkinfektionen“
6. Ohrinfektionen (einschließlich chronischer vereiterter Mittelohrentzündung und maligner
Entzündung des äußeren Gehörgangs)
Der CHMP nahm die als Beleg für diese Anwendungsgebiete eingereichten Studien zur Kenntnis, war
aber der Ansicht, dass sehr wenig klinische Daten vorgelegt worden sind. Der CHMP behandelte die
Indikation bei chronisch vereiterter Mittelohrentzündung und bei maligner Entzündung des äußeren
Gehörgangs (Otitis externa) als zwei separate Indikationen. Was chronische vereiterte
Mittelohrentzündung (Otitis media) anbelangt, so war der CHMP der Ansicht, dass angesichts der
antibakteriellen Aktivität von Ceftazidim und der Gewebedurchdringung von einer Wirksamkeit
ausgegangen werden kann. Als Nachweis für die relevante Gewebedurchdringungen bei Infektionen
im Mittelohr wurden pharmakokinetische Daten vorgelegt. Insgesamt war der CHMP der Ansicht,
dass zwar die klinischen Studien sehr begrenzte befürwortende Argumente liefern, Ceftazidim bei der
Behandlung von chronischer vereiterter Mittelohrentzündung aber dennoch als sinnvoll betrachtet
werden kann, wenn eine systemische Antibiose erforderlich wird und wenn die Ergebnisse einer
Kultur und von Sensitivitätstests vor Beginn der Behandlung bekannt sind. Was maligne
Entzündungen des äußeren Gehörgangs anbelangt, so legen die antibakteriellen Aktivitäten von
Ceftazidim sowie seine pharmakokinetischen Eigenschaften nach Ansicht des CHMP eine
Wirksamkeit nahe. Trotz des Mangels an guten klinischen Studien hielt der CHMP die Indikation
daher ausgehend von der sehr hohen Prävalenz von Pseudomonas als kausatives Agens, der Aktivität
gegen Pseudomonas und der geeigneten Pharmakokinetik von Ceftazidim für gerechtfertigt, wofür
einige klinische Studien Nachweise liefern. Berücksichtigt wurden auch die klinische
Langzeiterfahrung mit Ceftazidim und sein vergleichsweise gutes Sicherheitsprofil. Schlussendlich
übernahm der CHMP folgende Indikationen:
„Chronische vereiterte Mittelohrentzündung (Otitis media)“ und „Maligne Entzündung des äußeren
Gehörgangs (Otitis externa)“
7. Magendarm-, Gallen- und Abdominalinfektionen
Der CHMP stellte fest, dass es nur wenig klinische Belegdaten für diese Indikation gibt. Die einzige
randomisierte Studie, die vorgelegt wurde, zeigt die Wirksamkeit von Ceftazidim in Kombination mit
Clindamycin bei Patienten mit Peritonitis nach einer Darmperforation, d. h. bei komplizierten
intraabdominalen Infektionen. Bakteroide und E. coli waren die gängigsten Organismen, was bestätigt,
dass in vielen Fällen eine Antibiose mit angemessener Abdeckung anaerober Organismen benötigt
wird. Was die Pharmakokinetik/Pharmakodynamik (PK/PD) anbelangt, so räumte der CHMP ein, dass
die antibakterielle Aktivität von Ceftazidim in der Tat einen erheblichen Anteil der erwarteten
Pathogene abdeckt, es jedoch auch beträchtliche Lücken gibt, insbesondere Anaerobe und
Enterokokken, was von eher kontroverser Bedeutung ist. Die pharmakinetischen Daten zeigen eine
adäquate Durchdringung von Ceftazidim in die Peritonealflüssigkeit, wobei in den meisten Studien ein
Plasmaspiegel von etwa 60 % erzielt wird. Die PK/PD-Daten in Kombination mit Monte-CarloSimulationen legen nahe, dass Ceftazidim zusammen mit einer Abdeckung Anaerober möglicherweise
für komplizierte intraabdominale Infektionen geeignet sein könnte. Nach Ansicht des CHMP spricht
Einiges dafür, dass Ceftazidim bei komplizierten intraabdominalen Infektionen geeignet sein könnte,
vorausgesetzt, die Dosis ist ausreichend hoch. Auf der Grundlage der vorgelegten Daten beschloss der
CHMP eine Indikation bei komplizierten intraabdominalen Infektionen, verknüpft mit einem Hinweis
20
darauf, dass Ceftazidim zusammen mit einem anderen Antibiotikum zu verabreichen ist, wenn das
mögliche Spektrum der kausativen Bakterien nicht in sein Aktivitätsspektrum fällt. Der CHMP stellte
fest, dass für die Anwendung bei Kindern keine Daten vorgelegt wurden, war aber der Ansicht, dass
die Überlegungen zu intraabdominalen Infektionen für Erwachsene und Pädiatrie-Patienten gleich
sind. Schlussendlich übernahm der CHMP folgende vereinheitlichte Indikation:
„Komplizierte intraabdominale Infektionen“
8. Bakterielle Meningitis
Der CHMP war der Ansicht, dass die vorgelegten PK-Daten die Aussage, dass Ceftazidim
pharmakokinetische Eigenschaften besitzt, derentwegen es ein geeigneter Kandidat für die
Behandlung einer akuten bakteriellen Meningitis bei Erwachsenen und Kindern sein könnte,
unterstützen. In der klinischen Praxis wird Ceftazidim vor allem bei nosokomialer Meningitis
angewendet, wenn gramnegative Bakterien die vermutete oder bestätigte Ursache sind. Häufig
isolierte Arten sind E. coli, P. aeruginosa und Enterobacter. Es wird auch bei Meningitis nach
penetrierender Kopfverletzung eingesetzt. Neben dem erwarteten Bakterienspektrum ist eine LiquorPenetration der wichtigste Faktor, der die Eignung eines Antibiotikums für die Behandlung von
Meningitis bestimmt. Die Leitlinien empfehlen die Anwendung von Ceftazidim bei Meningitis in
spezifischen Szenarien wie nach Trauma oder in der Neurochirurgie, bei Patienten mit
Verweilimplantaten oder wenn bestimmte Pathogene die Verursacher sind. Nach Ansicht des CHMP
liefern die vorgelegten Nachweise zusammen mit der im Lauf von mehr als zwei Jahrzehnten
zusammengetragenen klinischen Erfahrung genügend Argumente für diese Indikation. Allerdings
unterstützen die Daten nicht die empirische Behandlung bei nicht-traumatischer ambulant erworbener
Meningitis, und Ceftazidim wird allgemein bei Staphylokokken-Meningitis als nicht geeignet
betrachtet. Der CHMP übernahm die folgenden Indikationen sowohl für Erwachsene als auch für
Pädiatrie-Patienten:
„Bakterielle Meningitis“
9. Harnwegsinfektionen
Der CHMP nahm die zur Unterstützung dieser Indikation eingereichten Daten zur Kenntnis. Art und
Schweregrad der Infektionen in den Studien waren unterschiedlich, und an den meisten Studien nahmen
Patienten mit komplizierten Harnwegsinfektionen teil. Bei komplizierten Harnwegsinfektionen ist eine
bakterielle Resistenz gegen Antibiotika prävalenter als bei nicht-komplizierten Harnwegsinfektionen, und
komplizierte Harnwegsinfektionen gehören zu den häufigsten Nosokomialinfektionen, wobei die meisten
Patienten Verweilkatheter haben. Wo eine empirische Therapie notwendig ist, sollte das antibakterielle
Spektrum des Antibiotikums die relevantesten Pathogene umfassen. Als intravenöses BreitbandAntibiotikum ist Ceftazidim für die Anwendung bei leichten bis moderaten unkomplizierten
Harnwegsinfektionen nicht grundsätzlich geeignet, da es erwartungsgemäß eher bei moderaten und
schweren Formen von komplizierten Harnwegsinfektionen und möglicherweise schweren Formen
unkomplizierter Harnwegsinfektionen eingesetzt würde. Schlussendlich qualifizierte der CHMP die
Indikation und übernahm die folgende Indikation für Erwachsene und Pädiatrie-Patienten:
„Komplizierte Harnwegsinfektionen“
10. Transurethrale Operation (TURP)
Der CHMP stellte fest, dass die Rate postoperativer Infektionen nach einer TURP den Daten der
Fachliteratur zufolge bei etwa 6 % liegt, wobei die Rate einer postoperativen Bakteriurie erheblich höher
ist. Das Spektrum der vorhandenen Bakterien ist kompliziert. Nosokomiale Harnwegsinfektionen müssen
abgedeckt sein, und die Pharmakokinetik des Antibiotikums muss wirksame Konzentrationen im Situs
21
zulassen. Nach Ansicht des CHMP erfüllt Ceftazidim diese Kriterien im Kontext einer TURP. Aus der
relevantesten Studie geht hervor, dass Ceftazidim den kombinierten Endpunkt einer postoperativen
Bakteriurie/klinischen Infektion bei der perioperativen TURP-Prophylaxe signifikant reduzierte. Die
Definition der Situationen, in denen eine perioperative Prophylaxe verabreicht wird, sollte nach Ansicht
des CHMP allerdings den nationalen Leitlinien überlassen bleiben. Schlussendlich übernahm der CHMP
folgende vereinheitlichte Indikation:
„Ceftazidim kann bei der perioperativen Prophylaxe von Harnwegsinfektionen bei Patienten angewendet
werden, die sich einer transurethralen Resektion der Prostata (TURP) unterziehen“
11. Infektionen bei Dialysepatienten
Der CHMP nahm die vom Inhaber der Genehmigung für das Inverkehrbringen zur Unterstützung
dieser Indikation eingereichten Daten zur Kenntnis. Abdominalinfektionen bei Patienten unter
chronischer ambulanter Peritonealdialyse (CAPD) entstehen häufig durch Kathetermanipulation, und
demzufolge sind vorwiegend Infektionen mit Grampositiven zu erwarten. Aufgrund wiederkehrender
Infektionen und häufiger Krankenhauskontakte dieser Patientengruppe tauchen oft resistente
Organismen auf. Alle vorgelegten Studien befassten sich ausschließlich mit Peritonitis bei Patienten
unter CAPD und bestätigen grampositive Arten als primäre Ursache für Peritonealinfektionen. Wie
der CHMP feststellte, wurden jedoch keine Studien vorgelegt, in denen Ceftazidim als Monotherapie
angewendet worden war. Schlussendlich war der CHMP der Ansicht, dass die vorgelegten Daten nur
Nachweise für die Eignung von Ceftazidim bei Peritonitis in Verbindung mit CAPD liefern, und
übernahm daher die folgende vereinheitliche Indikation:
„Peritonitis in Verbindung mit Dialyse bei Patienten unter CAPD“
12. Septikämie, Bakteriämie
Der CHMP nahm die vorliegenden Daten aus Studien bei erwachsenen Patienten zur Kenntnis, von
denen die meisten verschiedene Basisinfektionen hatten. Das antibakterielle Spektrum von Ceftazidim
ist gegen grampositive Pathogene sehr eingeschränkt, daher ist es kein geeignetes Mittel für eine
Monotherapie bei Bakteriämie, es sei denn, das Pathogen wurde bereits in Kultur genommen und
mindestens vorläufig identifiziert. Selbst wenn das Pathogen zu einer Art gehört, die normalerweise
gegenüber Ceftazidim empfindlich ist, stellt das steigende Risiko des Auftretens von Ceftazidim
hydrolysierenden Beta-Lactamasen mit oder ohne Impermeabilitäts-Resistenzmechanismen ein
Anwendungsrisiko da, bevor nicht Ergebnisse von Empfindlichkeitstests vorliegen. Nach Ansicht des
CHMP sind die eingereichten Daten daher nicht ausreichend, um die unqualifizierte Anwendung von
Ceftazidim zu unterstützen, wohingegen aber die Anwendung von Ceftazidim bei einer Bakteriämie
unter bestimmten Einschränkungen akzeptabel wäre. In Übereinstimmung mit der Haltung der
CHMP-Arbeitsgruppe war der CHMP der Meinung, dass ungeachtet der eingeschränkten vorliegenden
Nachweise in Bezug auf die Bakteriämie-Behandlung klinische Langzeiterfahrung mit diesem
Wirkstoff vorliegt, und übernahm daher folgende vereinheitlichte Indikation:
„Behandlung von Patienten mit Bakteriämie, die in Verbindung oder vermutlich in Verbindung mit
einer der vorstehend genannten Infektionen auftritt“.
Abschnitt 4.2 - Dosierung, Art und Dauer der Anwendung
Der CHMP listete die Dosierung separat für jede Indikation auf, überarbeitete die in der
Dosierungstabelle verwendete Terminologie und die Dosierungen ausgehend von den vorliegenden
Daten.
Für die intermittierende Anwendung wurden die folgenden Dosierungen angenommen:
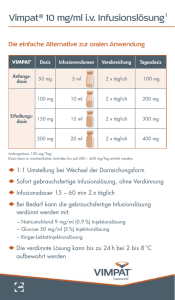
Bei bronchiopulmonalen Infektionen bei Mukoviszidose: 100 bis 150 mg/kg alle 8 Stunden.
22
Bei fiebriger Neutropenie, Nosokomial-Pneumonie und bakterieller Meningitis: 2 g alle 8 Stunden.
Bei Knochen- und Gelenkinfektionen, komplizierten Haut- und Weichteilinfektionen, komplizierten
intraabdominalen Infektionen und Peritonitis in Verbindung mit Dialyse bei CAPD-Patienten: 1-2 g
alle 8 Stunden.
Bei komplizierten Harnwegsinfektionen: 1-2 g alle 8 oder 12 Stunden.
Als perioperative Prophylaxe bei der transurethralen Resektion der Prostata (TURP): 1 g bei der
Narkoseeinleitung mit einer zweiten Dosis bei der Entfernung des Katheters.
Bei chronischer vereiterter Mittelohrentzündung (Otitis media) und maligner Entzündung des
äußeren Gehörgangs (Otitis externa): 1 bis 2 g alle 8 Stunden.
Für die kontinuierliche Infusion wurden die folgenden Dosierungen angenommen:
Bei bronchiopulmonalen Infektionen bei Mukoviszidose, fiebriger Neutropenie, NosokomialPneumonie, bakterieller Meningitis, Knochen- und Gelenkinfektionen, komplizierten Haut- und
Weichteilinfektionen, komplizierten intraabdominalen Infektionen und Peritonitis in Verbindung mit
Dialyse bei CAPD-Patienten: Eine Aufsättigungsdosis von 2 g, gefolgt von einer kontinuierlichen
Infusion von 4 bis 6 g alle 24 Stunden.
Abschnitt 4.3 - Gegenanzeigen
Der CHMP befasste sich mit einer Reihe von Gegenanzeigen, einschließlich einer
Überempfindlichkeit gegen sonstige Bestandteile und Cephalosporin-Antibiotika und
Überempfindlichkeitsreaktionen gegen alle Beta-Laktam-Antibiotika. Außerdem berücksichtigte der
CHMP die Kreuzreaktivität zwischen verschiedenen Arten von Beta-Laktam-Antibiotika.
Schlussendlich nahm der CHMP einen vereinheitlichten Wortlaut für Abschnitt 4.3 an.
Abschnitt 4.4 – Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung
Der CHMP stimmte den meisten Vorschlägen des Inhabers für das Inverkehrbringen zu, allerdings
wurden einige davon umformuliert. Insbesondere wurde der Abschnitt zu Allergien gegen BetaLaktam-Präparate umformuliert, um ihn mit den Gegenanzeigen in Abschnitt 4.3 abzugleichen.
Schlussendlich nahm der CHMP einen vereinheitlichten Wortlaut für Abschnitt 4.4 an.
Abschnitt 4.5 - Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen
Der CHMP stellte fest, dass Studien zu Probenicid und Furosemid durchgeführt worden sind, die
keine Wechselwirkungen mit Ceftazidim gezeigt hatten, und verwies darauf im Text. Weitere
Wechselwirkungen wurden besprochen und überarbeitet. Schlussendlich nahm der CHMP einen
vereinheitlichten Wortlaut für Abschnitt 4.5 an.
Abschnitt 4.6 – Fertilität, Schwangerschaft und Stillzeit
Der CHMP nahm die begrenzten Erfahrungen beim Menschen zur Kenntnis, jedoch auch, dass
tierexperimentelle Studien keine Anzeichen auf embryotoxische oder teratogene Wirkung ergaben.
Der CHMP zog den Schluss, dass bei einer Anwendung während der Schwangerschaft Vorsicht
geboten ist, dass Ceftazidim aber nicht von der Anwendung bei Frauen in der Stillzeit ausgenommen
werden sollte. Schlussendlich nahm der CHMP einen vereinheitlichten Wortlaut für Abschnitt 4.6 an.
Abschnitt 4.7 - Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von
Maschinen
Der CHMP stellte fest, dass vom Inhaber der Genehmigung für das Inverkehrbringen keine Studien
unternommen wurden, um die Auswirkungen von Ceftazidim auf die Verkehrstüchtigkeit oder die
Fähigkeit zum Bedienen von Maschinen zu untersuchen, und verwies darauf. Schlussendlich nahm der
CHMP einen vereinheitlichten Wortlaut für Abschnitt 4.7 an.
Abschnitt 4.8 - Nebenwirkungen
Innerhalb jeder Häufigkeitsgruppe wurden die Nebenwirkungen nach abnehmender Bedeutung
geordnet, und eine Reihe von unerwünschten Ereignissen wurde überarbeitet. Schlussendlich nahm
der CHMP einen vereinheitlichten Wortlaut für Abschnitt 4.8 an.
23
Abschnitt 4.9 - Überdosierung
Der CHMP fügte ausführliche Informationen zu Symptomen hinzu, die aus der Erfahrung bei
Überdosierungen bei Patienten mit Niereninsuffizienz stammen, wie sie in einigen nationalen
Fachinformationen vorliegen. Schlussendlich nahm der CHMP einen vereinheitlichten Wortlaut für
Abschnitt 4.9 an.
Abschnitt 5.1 - Pharmakodynamische Eigenschaften
Die endgültige Tabelle der Arten wurde überarbeitet und den angenommenen Anwendungsgebieten
angeglichen, indem nur solche Arten aufgeführt wurden, die für die genannten Anwendungsgebiete
maßgeblich sind. Schlussendlich nahm der CHMP einen vereinheitlichten Wortlaut und eine
überarbeitete Tabelle zur mikrobiologischen Empfindlichkeit für Abschnitt 5.1 an.
Abschnitt 5.2 - Pharmakokinetik
Der CHMP überarbeitete diesen Abschnitt und ergänzte ihn mit umfassenden Informationen,
einschließlich grundlegender pharmakokinetischer Daten und Angaben zur Pharmakokinetik bei
bestimmten Patientengruppen. Schlussendlich nahm der CHMP einen vereinheitlichten Wortlaut für
Abschnitt 5.2 an.
Abschnitt 5.3 - Präklinische Daten zur Sicherheit
Der CHMP war der Ansicht, dass die zur Unterstützung des ursprünglichen Antrags auf Genehmigung
für das Inverkehrbringen durchgeführten nicht-klinischen Studien zwar damals akzeptabel waren, nach
heutigem Standard aber keine konventionelle Testreihe darstellen, und entfernte daher das Wort
„konventionell“. Schlussendlich nahm der CHMP einen vereinheitlichten Wortlaut für Abschnitt 5.3
an.
Begründung für die Änderung der Zusammenfassung der Merkmale des Arzneimittels, der
Etikettierung und der Packungsbeilage
In Erwägung nachstehender Gründe
Der Zweck des Verfahrens war die Harmonisierung der Zusammenfassung der Merkmale des
Arzneimittels, der Etikettierung und der Packungsbeilage.
Die von den Inhabern der Genehmigung für das Inverkehrbringen vorgeschlagene
Zusammenfassung der Merkmale des Arzneimittels, Etikettierung und Packungsbeilage wurde auf
der Grundlage der eingereichten Dokumentation und der wissenschaftlichen Erörterung innerhalb
des Ausschusses geprüft.
empfahl der CHMP die Änderung der Genehmigung für das Inverkehrbringen für Fortum und
zugehörige Bezeichnungen (siehe Anhang I), für welche die Zusammenfassung der Merkmale des
Arzneimittels, die Etikettierung und die Packungsbeilage in Anhang III aufgeführt sind.
24
ANHANG III
ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS, ETIKETTIERUNG
UND PACKUNGSBEILAGE
Hinweis: Diese Zusammenfassung der Merkmale des Arzneimittels, die Etikettierung und die
Packungsbeilage liegen in der zum Zeitpunkt der Entscheidung der Kommission gültigen
Version vor.
Nach der Entscheidung der Kommission werden die zuständigen Behörden in den
Mitgliedstaaten in Verbindung mit dem Referenzmitgliedstaat die Produktinformationen je
nach Erforderlichkeit aktualisieren. Diese Zusammenfassung der Merkmale des Arzneimittels,
die Etikettierung und die Packungsbeilage geben daher nicht zwingend den aktuellen Wortlaut
wieder.
25
ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS
26
1.
BEZEICHNUNG DES ARZNEIMITTELS
Fortum und zugehörige Namen (siehe Anhang I) 250 mg Pulver zur Herstellung einer
Injektionslösung
Fortum und zugehörige Namen (siehe Anhang I) 500 mg Pulver zur Herstellung einer
Injektionslösung
Fortum und zugehörige Namen (siehe Anhang I) 1 g Pulver zur Herstellung einer Injektionslösung
Fortum und zugehörige Namen (siehe Anhang I) 1 g Pulver zur Herstellung einer Injektions- oder
Infusionslösung
Fortum und zugehörige Namen (siehe Anhang I) 2 g Pulver zur Herstellung einer Injektions- oder
Infusionslösung
Fortum und zugehörige Namen (siehe Anhang I) 3 g Pulver zur Herstellung einer Injektions- oder
Infusionslösung
Fortum und zugehörige Namen (siehe Anhang I) 1 g Pulver zur Herstellung einer Infusionslösung
Fortum und zugehörige Namen (siehe Anhang I) 2 g Pulver zur Herstellung einer Infusionslösung
[Siehe Anhang I – Ist national auszufüllen]
2.
QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG
[Ist national auszufüllen]
Die vollständige Auflistung der sonstigen Bestandteile siehe Abschnitt 6.1.
3.
DARREICHUNGSFORM
250 mg, 500 mg, 1 g Pulver zur Herstellung einer Injektionslösung
Pulver zur Herstellung einer Injektionslösung
[Ist national auszufüllen]
1 g, 2 g, 3 g Pulver zur Herstellung einer Injektions- oder Infusionslösung
Pulver zur Herstellung einer Injektions- oder Infusionslösung
[Ist national auszufüllen]
1 g, 2 g Pulver zur Herstellung einer Infusionslösung (Monovial Darreichung)
Pulver zur Herstellung einer Infusionslösung
[Ist national auszufüllen]
4.
KLINISCHE ANGABEN
4.1
Anwendungsgebiete
Fortum wird angewendet bei Erwachsenen und Kindern inklusive Neugeborenen (von Geburt an), bei
Infektionen, die untenstehend aufgelistet sind.
Nosokomiale Pneumonie
Broncho-pulmonale Infektionen bei zystischer Fibrose
Bakterielle Meningitis
Chronisch eitrige Otitis media
Maligne Otitis externa
Komplizierte Harnwegsinfektionen
Komplizierte Haut- und Weichteilinfektionen
Komplizierte intraabdominale Infektionen
Knochen- und Gelenksinfektionen
27
Peritonitis assoziiert mit Dialyse bei CAPD-Patienten
Behandlung von Patienten mit Bakteriämie im Zusammenhang oder bei vermutetem Zusammenhang
mit einer der oben angeführten Infektionen.
Ceftazidim kann zur Behandlung von neutropenischen Patienten mit Fieber, aufgrund einer
vermuteten bakteriellen Infektion, eingesetzt werden.
Ceftazidim kann als peri-operative Prophylaxe für Harnwegsinfekte bei Patienten, die sich einer transurethralen Resektion der Prostata (TURP) unterziehen, verwendet werden.
Bei der Wahl von Ceftazidim sollte sein antibakterielles Spektrum berücksichtigt werden, welches
hauptsächlich auf aerobe Gram-negative Bakterien limitiert ist (siehe Abschnitt 4.4 und 5.1).
Ceftazidim sollte gemeinsam mit anderen antibakteriellen Substanzen angewendet werden, wenn die
mögliche Bandbreite der verursachenden Bakterien nicht vom Wirkspektrum von Ceftazidim
abgedeckt wird.
Offizielle Richtlinien zum angemessenem Gebrauch von antibakteriellen Arzneimitteln sollten
berücksichtigt werden.
4.2
Dosierung, Art und Dauer der Anwendung
Dosierung
Tabelle 1: Erwachsene und Kinder 40 kg
Intermittierende Verabreichung
Infektion
Broncho-pulmonale Infektionen bei zystischer
Fibrose
Fiebrige Neutropenie
Nosokomiale Pneumonie
Bakterielle Meningitis
Bakteriämie*
Knochen- und Gelenksinfektionen
Komplizierte Haut- und Weichteilinfektionen
Komplizierte intraabdominale Infektionen
Peritonitits assoziiert mit einer Dialyse bei
Patienten mit CAPD
Komplizierte Harnwegsinfektionen
Zu verabreichende Dosis
100 - 150 mg/kg/Tag alle 8h, Maximum 9 g pro
Tag1
2 g alle 8 h
1-2 g alle 8 h
1 -2 g alle 8 h oder 12 h
perioperative Prophylaxe bei transuretheraler
Prostata Resektion
1 g beim Start der Anästhesie
und eine zweite Dosis beim Entfernen des
Katheters
Chronisch eitrige Otitis media
Maligne Otitis externa
Kontinuierliche Infusion
Infektion
Fiebrige Neutropenie
Nosokomiale Pneumonie
Broncho-pulmonale Infektionen bei zystischer
Fibrose
Bakterielle Meningitis
Bakteriämie*
Knochen- und Gelenksinfektionen
1 g - 2 g alle 8 h
Zu verabreichende Dosis
Startdosis von 2 g gefolgt von einer
kontinuierlichen Infusion von 4 bis 6 g alle 24 h1
28
Komplizierte Haut- und Weichteilinfektionen
Komplizierte intraabdominale Infektionen
Peritonitis assoziiert mit Dialyse bei CAPDPatienten
1
Erwachsene mit normaler Nierenfunktion haben 9 g/Tag ohne Nebenwirkungen vertragen.
* Im Zusammenhang mit einer im Abschnitt 4.1 angeführten Infektion oder bei Verdacht auf einen
solchen Zusammenhang.
Tabelle 2: Kinder < 40 kg
Kinder und Kleinkinder > 2
Monate und Kinder < 40 kg
Infektion
Normale Dosierung
Komplizierte
Harnwegsinfektionen
Chronisch eitrige Otitis media
Maligne Otitis externa
100 – 150 mg/kg/Tag
aufgeteilt auf 3 gleiche Dosen,
Maximum 6 g/Tag
Intermittierende Verabreichung
Neutropenische Kinder
Broncho-pulmonale Infektionen
bei zystischer Fibrose
Bakterielle Meningitis
Bakteriämie*
Knochen- und
Gelenksinfektionen
Komplizierte Haut- und
Weichteilinfektionen
Komplizierte intraabdominale
Infektionen
Peritonitis assoziiert mit Dialyse
bei CAPD-Patienten
150 mg/kg/Tag aufgeteilt auf 3
gleiche Dosen, Maximum
6 g/Tag
100 – 150 mg/kg/Tag aufgeteilt
auf 3 gleiche Dosen, Maximum
6 g/Tag
Kontinuierliche Infusion
Neugeborene und Kinder ≤ 2
Monate
Intermittierende Verabreichung
Fiebrige Neutropenie
Nosokomiale Pneumonie
Broncho-pulmonale Infektionen
bei zystischer Fibrose
Bakterielle Meningitis
Bakteriämie*
Knochen- und
Gelenksinfektionen
Komplizierte Haut- und
Weichteilinfektionen
Komplizierte intraabdominale
Infektionen
Peritonitis assoziiert mit Dialyse
bei CAPD-Patienten
Infektion
Bei den meisten Infektionen
Startdosis/Bolus von 60100 mg/kg gefolgt von einer
kontinuierlichen Infusion von
100-200 mg/kg/Tag, Maximum
6 g/Tag
Normale Dosierung
25-60 mg/kg/Tag aufgeteilt auf
2 gleiche Dosen1
1
Bei Neugeborenen und Kindern ≤ 2 Monaten, kann die Serumhalbwertszeit von Ceftazidim drei bis
viermal so hoch sein wie bei Erwachsenen.
* Im Zusammenhang mit einer im Abschnitt 4.1 angeführten Infektion oder bei Verdacht auf einen
29
solchen Zusammenhang.
Kinder
Die Sicherheit und Wirksamkeit von Fortum, verabreicht als kontinuierliche Infusion, wurde für
Neugeborene und Kinder ≤ 2 Monate nicht bewiesen.
Ältere Patienten
Im Hinblick auf die altersbedingte verringerte Clearance von Ceftazidim bei älteren Patienten sollte
die tägliche Dosis bei Patienten über 80 Jahren normalerweise 3 g nicht überschreiten.
Patienten mit eingeschränkter Leberfunktion
Die vorliegenden Daten weisen nicht auf die Notwendigkeit einer Dosisanpassung bei schwach oder
moderat eingeschränkter Leberfunktion hin. Es gibt keine Studiendaten an Patienten mit stark
eingeschränkter Leberfunktion (siehe auch Abschnitt 5.2). Eine engmaschige klinische Überwachung
zur Sicherheit und Wirksamkeit ist anzuraten.
Patienten mit eingeschränkter Nierenfunktion
Ceftazidim wird von den Nieren unverändert ausgeschieden. Daher sollte die Dosis bei Patienten mit
eingeschränkter Nierenfunktion reduziert werden (siehe auch Abschnitt 4.4).
Eine Initialdosis von 1 g sollte verabreicht werden. Die Erhaltungsdosis sollte auf Basis der KreatininClearance berechnet werden:
Tabelle 3: Empfohlene Erhaltungsdosis von Fortum bei Patienten mit eingeschränkter Nierenfunktion
– intermittierende Infusion
Erwachsene und Kinder 40 kg
Kreatinin-Clearance
(ml/min)
50-31
30-16
15-6
<5
Ungefähres SerumKreatinin
µmol/l (mg/dl)
150-200
(1,7-2,3)
200-350
(2,3-4,0)
350-500
(4,0-5,6)
> 500
(> 5,6)
Empfohlene
Einzeldosis von
Fortum (g)
Dosierungsfrequenz
(stündlich)
1
12
1
24
0,5
24
0,5
48
Bei Patienten mit schweren Infektionen sollte die Dosis um 50 % erhöht oder die Dosierungsfrequenz
erhöht werden.
Bei Kindern sollte die Kreatinin-Clearance an die Körperoberfläche oder fettfreie Körpermasse
angepasst werden.
Kinder < 40 kg
Kreatinin-Clearance
(ml/min)**
50-31
30-16
Ungefähres SerumKreatinin*
µmol/l (mg/dl)
150-200
(1,7-2,3)
200-350
30
Empfohlene
individuelle Dosis
mg/kg Körpergewicht
Dosierungsfrequenz
(stündlich)
25
12
25
24
(2,3-4,0)
350-500
15-6
12,5
24
(4,0-5,6)
> 500
<5
12,5
48
(> 5,6)
* Die Serum-Kreatinin-Werte sind Richtwerte, welche möglicherweise nicht genau das gleiche
Ausmaß von Einschränkung für alle Patienten mit eingeschränkter Nierenfunktion anzeigen.
** Geschätzt aufgrund der Körperoberfläche, oder gemessen
Eine engmaschige klinische Überwachung zur Sicherheit und Wirksamkeit ist anzuraten.
Tabelle 4: Empfohlene Erhaltungsdosis von Fortum bei Patienten mit eingeschränkter Nierenfunktion
– kontinuierliche Infusion
Erwachsene und Kinder 40 kg
Kreatinin-Clearance
(ml/min)
50-31
30-16
≤15
Ungefähres Serum-Kreatinin
µmol/l (mg/dl)
Dosierungsfrequenz
(stündlich)
150-200
(1,7-2,3)
200-350
(2,3-4,0)
>350
(>4.0)
Startdosis von 2 g gefolgt von
1 g bis 3 g / 24 h
Startdosis von 2 g gefolgt von
1 g / 24 h
Nicht untersucht
Bei der Dosiswahl ist Vorsicht angebracht. Eine engmaschige klinische Überwachung zur Sicherheit
und Wirksamkeit ist anzuraten.
Kinder < 40 kg
Die Sicherheit und Effektivität von Fortum, verabreicht als kontinuierliche Infusion, wurde bei
Kindern < 40 kg mit eingeschränkter Nierenfunktion nicht bewiesen. Eine engmaschige klinische
Überwachung zur Sicherheit und Wirksamkeit ist anzuraten.
Bei Anwendung von Dauerinfusionen bei Kindern mit eingeschränkter Nierenfunktion soll die
Kreatinin-Clearance der Körperoberfläche oder der Magermasse angepasst werden
Hämodialyse
Die Serumhalbwertszeit während der Hämodialyse variiert von 3 bis 5 h.
Nach jeder Hämodialyse sollte die Erhaltungsdosis von Ceftazidim, wie in der untenstehenden Tabelle
empfohlen, erneut gegeben werden.
Peritonealdialyse
Ceftazidim kann während der Peritonealdialyse und während der kontinuierlichen ambulanten
Peritonealdialyse verwendet werden (CAPD).
Zusätzlich zur intravenösen Verabreichung kann Ceftazidim auch in die Dialyseflüssigkeit eingebracht
werden (üblicherweise 125 bis 250 mg auf 2 Liter Dialyselösung).
Bei Patienten mit Nierenversagen mit kontinuierlicher arteriovenöser Hämodialyse oder HochflussHämofiltration auf Intensivstationen: 1 g täglich entweder als Einzeldosis oder in aufgeteilten Dosen.
31
Bei Niedrigfluss-Hämofiltration folgen Sie der Dosisempfehlung für Patienten mit eingeschränkter
Nierenfunktion.
Bei Patienten mit venovenöser Hämofiltration and venovenöser Hämodialyse folgen Sie der
Dosisempfehlung in der untenstehenden Tabelle.
Tabelle 5: Dosierungsrichtlinie für kontinuierliche venovenöse Hämofiltration
Verbleibende
Erhaltungsdosis (mg) bei einer Ultrafiltrationsrate (ml/min) von 1:
Nierenfunktion
5
16.7
33.3
50
(KreatininClearance
ml/min)
0
250
250
500
500
5
250
250
500
500
10
250
500
500
750
15
250
500
500
750
20
500
500
500
750
1
Erhaltungsdosis ist alle 12 h zu verabreichen.
Tabelle 6: Dosierungsrichtlinie für kontinuierliche venovenöse Hämodialyse
Verbleibende
Erhaltungsdosis (mg) bei einem Dialysat Durchfluss von 1:
Nierenfunktion
1,0 Liter/Stunde
2,0 Liter/Stunde
(Kreatinin
Ultrafiltrationsrate
Ultrafiltrationsrate (Liter/Stunde)
Clearance
(Liter/Stunde)
ml/min)
0,5
1,0
2,0
0,5
1,0
2,0
0
500
500
500
500
500
750
5
500
500
750
500
500
750
10
500
500
750
500
750
1000
15
500
750
750
750
750
1000
20
750
750
1000
750
750
1000
1
Erhaltungsdosis ist alle 12 h zu verabreichen.
Art der Anwendung
Fortum sollte durch intravenöse Injektion oder Infusion verabreicht werden, oder mittels tiefer
intramuskulärer Injektion. Empfohlene intramuskuläre Injektionsstellen sind der obere äußere
Quadrant des Gluteus maximus oder der laterale Teil des Oberschenkels. Fortum Lösung kann direkt
in die Vene verabreicht oder in den Schlauch des Infusionsbestecks eingebracht werden, wenn der
Patient parenterale Flüssigkeiten erhält.
Üblicherweise wird die intravenöse Verabreichung, intermittierende Injektion oder kontinuierliche
Infusion empfohlen. Eine intramuskuläre Verabreichung soll nur dann in Erwägung gezogen werden,
wenn die intravenöse Verabreichung nicht möglich oder für den Patienten weniger geeignet ist.
Die Dosis hängt ab von Schwere, Empfindlichkeit, Ort und Typ der Infektion und vom Alter und der
Nierenfunktion des Patienten.
4.3
Gegenanzeigen
Überempfindlichkeit gegen Ceftazidim, andere Cephalosporine oder einen der sonstigen Bestandteile.
Schwere Überempfindlichkeit (z. B. anaphylaktische Reaktion) gegen andere Beta-LactamAntibiotika (Penicilline, Monobactame und Carbapeneme) in der Anamnese.
32
4.4
Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung
Wie bei allen Beta-Lactam-Antibiotika wurden schwere und gelegentlich tödliche
Überempfindlichkeitsreaktionen berichtet. Im Falle einer schweren Überempfindlichkeitsreaktion
muss die Behandlung mit Ceftazidim sofort abgebrochen werden und angemessene
Notfallsmaßnahmen müssen eingeleitet werden.
Vor Beginn der Behandlung sollte festgestellt werden, ob der Patient in seiner Vorgeschichte bereits
schwere Überempfindlichkeitsreaktionen, hervorgerufen durch Ceftazidim, durch andere
Cephalosporine oder durch andere Typen von Beta-Lactam-Antibiotika hatte.
Vorsicht ist geboten, wenn Ceftazidim Patienten mit leichten Überempfindlichkeitsreaktionen gegen
andere Beta-Lactam-Antibiotika in der Vorgeschichte verabreicht wird.
Ceftazidim hat ein eingeschränktes antibakterielles Spektrum. Es ist zur alleinigen Behandlung
mancher Infektionsarten nicht geeignet, außer der Erreger ist bereits dokumentiert und als
empfindlich bekannt, oder es besteht ein sehr großer Verdacht, dass die wahrscheinlichsten Erreger für
die Behandlung mit Ceftazidim geeignet sind. Dies trifft insbesondere bei Erwägungen zur
Behandlung von Patienten mit Bakteriämie und zur Behandlung der bakteriellen Meningitis, Hautund Weichteilinfektionen sowie Knochen- und Gelenksinfektionen zu. Zusätzlich ist Ceftazidim
empfindlich auf Hydrolyse durch einige der erweiterten Spektren von Beta-Lactamasen (ESBLs).
Deshalb sollte die Information über die Prävalenz von ESBL produzierenden Organismen
berücksichtigt werden, wenn Ceftazidim zur Behandlung ausgesucht wird.
Antibiotika-assoziierte Colitis und pseudomembranöse Colitis wurden bei fast allen Antibiotika
berichtet, einschließlich Ceftazidim. Diese können in ihrer Ausprägung von mild bis lebensbedrohlich
schwanken. Dies ist zu bedenken bei Patienten, die an einer Diarrhö während oder anschließend an die
Behandlung mit Ceftazidim leiden (siehe Abschnitt 4.8). Der Abbruch der Behandlung mit Ceftazidim
und eine spezifische Behandlung gegen Clostridium difficile sollten erwogen werden. Arzneimittel,
die die Peristaltik hemmen, sollten nicht angewendet werden.
Gleichzeitige Behandlung mit hohen Dosen Cephalosporin und nephrotoxischen Arzneimitteln wie
Aminoglykosiden oder wirksamen Diuretika (z. B. Furosemid) kann die Nierenfunktion ungünstig
beeinflussen.
Ceftazidim wird über die Nieren ausgeschieden, daher sollte die Dosis entsprechend der
Einschränkung der Nierenfunktion reduziert werden. Patienten mit eingeschränkter Nierenfunktion
sollten zur Sicherheit und Wirksamkeit engmaschiger kontrolliert werden. Neurologische Folgen
wurden gelegentlich berichtet, wenn die Dosis bei Patienten mit eingeschränkter Nierenfunktion nicht
reduziert wurde (siehe Abschnitte 4.2 und 4.8).
Längere Anwendung kann zu vermehrtem Wachstum von nichtempfindlichen Keimen (z. B.
Enterokokken, Pilze) führen, was eine Unterbrechung der Behandlung oder andere angemessene
Maßnahmen erfordern kann. Wiederholte Überprüfung des Zustandes des Patienten ist wichtig.
Ceftazidim beeinflusst Enzym-basierte Tests für Glykosurie nicht, aber eine leichte Beeinflussung
(falsch-positiv) der Kupfer-Reduktionsmethode (Benedict, Fehling, Clinitest) kann vorkommen.
Ceftazidim beeinflusst den alkalischen Pikrat-Test für Kreatinin nicht.
Bei ungefähr 5% der Patienten fällt durch die Behandlung mit Ceftazidim der Coombs-Test positiv
aus, was die Blut-Kreuzprobe beeinträchtigen kann.
Wichtige Information über einen Bestandteil von Fortum:
250 mg Pulver zur Herstellung einer Injektionslösung
Fortum 250 mg enthält 13 mg Natrium pro Durchstechflasche.
33
500 mg Pulver zur Herstellung einer Injektionslösung
Fortum 500 mg enthält 26 mg Natrium pro Durchstechflasche.
1 g Pulver zur Herstellung einer Injektions- oder Infusionslösung, 1 g Pulver zur Herstellung einer
Infusionslösung
Fortum 1 g enthält 52 mg Natrium pro Durchstechflasche
2 g Pulver zur Herstellung einer Injektions- oder Infusionslösung, 2 g Pulver zur Herstellung einer
Infusionslösung
Fortum 2 g enthält 104 mg Natrium pro Durchstechflasche
3 g Pulver zur Herstellung einer Injektions- oder Infusionslösung
Fortum 3 g enthält 156 mg Natrium pro Durchstechflasche
Dies sollte bei Patienten berücksichtigt werden, die eine natriumarme Diät einhalten.
4.5
Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen
Wechselwirkungsstudien wurden nur mit Probenecid und Furosemid durchgeführt.
Gleichzeitige Anwendung hoher Ceftazidim-Dosen mit nephrotoxischen Arzneimitteln kann die
Nierenfunktion ungünstig beeinflussen (siehe Abschnitt 4.4).
Chloramphenicol wirkt in vitro als Antagonist von Ceftazidim und anderen Cephalosporinen. Die
klinische Bedeutung ist unbekannt, aber bei gleichzeitiger Anwendung von Ceftazidim und
Chloramphenicol sollte die Möglichkeit des Antagonismus bedacht werden.
4.6
Fertilität, Schwangerschaft und Stillzeit
Schwangerschaft
Die Daten zur Anwendung von Ceftazidim bei schwangeren Frauen sind begrenzt. Tierstudien haben
keine direkten oder indirekten schädlichen Wirkungen auf Schwangerschaft, embryonale/fötale
Entwicklung, Geburtsvorgang oder postnatale Entwicklung gezeigt (siehe Abschnitt 5.3).
Fortum sollte schwangeren Frauen nur verschrieben werden, wenn der Nutzen das Risiko überwiegt.
Stillzeit
Ceftazidim wird in geringen Mengen in die Muttermilch ausgeschieden, jedoch sind bei
therapeutischen Ceftazidim-Dosen keine Auswirkungen auf gestillte Kinder zu erwarten. Ceftazidim
kann während der Stillzeit angewendet werden.
Fertilität
Es liegen keine Daten vor.
4.7
Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von
Maschinen
Es wurden keine Studien durchgeführt, um die Auswirkungen auf die Verkehrstüchtigkeit und die
Fähigkeit zum Bedienen von Maschinen zu untersuchen. Allerdings können unerwünschte Effekte (z.
B. Schwindelgefühl) auftreten, die die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von
Maschinen beeinflussen (siehe Abschnitt 4.8).
4.8
Nebenwirkungen
Die häufigsten Nebenwirkungen sind Eosinophilie, Thrombozytose, Phlebitis oder Thrombophlebitis
bei intravenöserAnwendung, Diarrhö, vorübergehender Anstieg von Leberenzymen, makulopapulöser
34
oder urtikarieller Ausschlag, Schmerz und/oder Entzündung nach intramuskulärer Injektion und
positiver Coombs Test.
Es wurden Daten von gesponserten und nicht gesponserten klinischen Studien verwendet, um die
Häufigkeiten für häufige und gelegentliche Nebenwirkungen zu bestimmen. Die Häufigkeiten aller
anderen Nebenwirkungen wurden hauptsächlich mittels post-Marketing-Daten bestimmt, diese
beziehen sich eher auf eine Berichterstattungsrate als auf eine wahre Häufigkeit. Innerhalb jeder
Häufigkeitsgruppierung werden Nebenwirkungen in abnehmender Schwere aufgelistet. Die folgende
Einteilung wurde zur Klassifizierung der Häufigkeiten verwendet:
Sehr häufig (1/10)
Häufig (1/100, <1/10)
Gelegentlich (1/1.000, <1/100)
Selten (1/10.000, <1/1.000)
Sehr selten (<1/10.000)
Nicht bekannt (Häufigkeit auf Grundlage der verfügbaren Daten nicht abschätzbar)
Systemorganklasse
Häufig
Infektionen und
parasitäre Erkrankungen
Erkrankungen des Blutes
und des Lymphsystems
Eosinophilie
Thrombozytose
Gelegentlich
Candidiasis
(einschließlich
Vaginitis und orale
Candidose)
Neutropenie
Leukopenie
Thrombozytopenie
Erkrankungen des
Immunsystems
Erkrankungen des
Nervensystems
Gefäßerkrankungen
Erkrankungen des
Gastrointestinaltrakts
Leber- und
Gallenerkrankungen
Erkrankungen der Haut
und des
Unterhautzellgewebes
Kopfschmerzen
Schwindel
Phlebitis oder
Thrombophlebitis bei
intravenöser
Anwendung
Diarrhö
Vorübergehender
Anstieg eines oder
mehrerer
Leberenzyme3
Makulopapulöser
oder urtikarieller
Ausschlag
Antibiotikaassoziierte Diarrhö
und Colitis2 (siehe
Abschnitt 4.4)
Abdominale
Schmerzen
Übelkeit
Erbrechen
Sehr selten
Nicht bekannt
Agranulozytose
Hämolytische
Anämie
Lymphozytose
Anaphylaxie
(einschließlich
Bronchospasmus
und/oder Hypotonie)
(siehe Abschnitt 4.4)
Neurologische
Folgeerscheinungen1
Parästhesie
Geschmacksstörung
Ikterus
Pruritus
35
Toxische epidermale
Nekrolyse
Stevens-JohnsonSyndrom
Erythema
Multiforme
Angioödem
Erkrankungen der Nieren
und Harnwege
Allgemeine
Erkrankungen und
Beschwerden am
Verabreichungsort
Untersuchungen
Schmerz und/oder
Entzündung nach
intramuskulärer
Injektion
Positiver Coombs
Test4
Vorübergehende
Erhöhung des
Blutharnstoffes, des
Blut-HarnstoffStickstoffes und/oder
des Serum Kreatinins
Fieber
Interstitielle
Nephritis
Akutes
Nierenversagen
1
Es gab Berichte von neurologischen Folgeerscheinungen einschließlich Zittern, Myoklonie,
Krämpfen, Enzephalopathie und Koma bei Patienten mit eingeschränkter Nierenfunktion, bei denen
die Dosis von Fortum nicht angemessen reduziert wurde.
2
Diarrhö und Colitis können mit Clostridium difficile und einer pseudomembranösen Colitis in
Zusammenhang stehen.
3
ALT (SGPT), AST (SOGT), LDH, GGT, alkalische Phosphatase.
4
Ein positiver Coombs Test entwickelt sich in ca. 5 % der Patienten und kann die Blut-Kreuzprobe
beeinflussen.
4.9
Überdosierung
Überdosierung kann zu neurologischen Folgen führen einschließlich Enzephalopathie, Krämpfen und
Koma.
Überdosierungs-Symptome können auftreten, wenn bei Patienten mit eingeschränkter Nierenfunktion
die Dosis nicht angemessen reduziert wird (siehe Abschnitte 4.2 und 4.4).
Der Ceftazidim Serum-Spiegel kann mittels Hämodialyse oder Peritonealdialyse reduziert werden.
5.
PHARMAKOLOGISCHE EIGENSCHAFTEN
5.1
Pharmakodynamische Eigenschaften
Pharmakotherapeutische Gruppe: Antibiotika zur systemischen Anwendung. Cephalosporine der
dritten Generation, ATC-Code: J01DD02.
Wirkmechanismus
Ceftazidim inhibiert die bakterielle Zellwand-Synthese durch Bindung an Penicillin-Bindeproteine
(PBPs). Dadurch wird die Biosynthese der Zellwand (Peptidoglycan) unterbrochen, was zur
bakteriellen Zelllyse und zum Tod der Bakterien führt.
Pharmakokinetische/Pharmakodynamische Beziehung
Für Cephalosporine wurde gezeigt, dass der wichtigste pharmakokinetisch-pharmkodynamische Index
im Zusammenhang mit der in vivo Wirksamkeit der prozentuale Zeitanteil innerhalb eines
Dosierungsintervalls ist, in der die Konzentration an ungebundenem Ceftazidim über der minimalen
Hemmkonzentration (MIC) für einzelne Zielarten liegt (z. B. % T > MIC).
Resistenzmechanismus
Bakterielle Resistenz gegen Ceftazidim kann auf einem oder mehreren der folgenden Mechanismen
beruhen:
36
Hydrolyse durch Beta-Lactamasen. Ceftazidim kann wirksam durch ein erweitertes Spektrum
an Beta-Lactamasen (ESBLs) hydrolysiert werden, einschließlich der SHV Familie von ESBL
und AmpC-Enzymen, die bei einigen aeroben Gram-negativen Bakterienarten konstitutiv
vorhanden (dereprimiert) sind oder induziert werden können.
reduzierte Affinität von Penicillin-Bindeproteinen zu Ceftazidim
Undurchdringlichkeit der äußeren Membran, wodurch in Gram-negativen Organismen die
Erreichbarkeit der Penicillin-Bindeproteine für Ceftazidim eingeschränkt wird.
bakterielle Efflux-Pumpen.
Grenzwerte
Folgende Minimale Hemmkonzentrationen (MIC) wurden vom European Committee on Antibicrobial
Susceptibility Testing (EUCAST) ermittelt:
Organismus
Grenzwerte (mg/l)
S
I
R
Enterobacteriaceae
≤1
2-4
>4
Pseudomonas aeruginosa
≤ 81
-
>8
≤4
8
>8
Nicht Spezies bezogene
Grenzwerte2
S = sensibel, I = intermediär, R = resistent .
1
Die Grenzwerte beziehen sich auf die Hochdosistherapie (2 g dreimal täglich).
2
Nicht-Spezies bezogene Grenzwerte wurden hauptsächlich auf Basis von PK/PD Daten bestimmt und
sind unabhängig von der MIC Verteilung spezieller Spezies. Sie sind nur bei Spezies, die nicht in der
Tabelle oder in den Fußnoten angeführt sind, zu verwenden.
Mikrobiologische Empfindlichkeiten
Die Verbreitung erworbener Resistenzen einzelner Arten kann geografisch und zeitlich variieren.
Lokale Information zu Resistenzen ist erwünscht, besonders bei der Behandlung schwerer Infektionen.
Bei Bedarf sollte der Rat eines Experten gesucht werden, wenn die lokale Verbreitung von
Resistenzen den Nutzen von Ceftazidim bei zumindest einigen Infektionsarten in Frage stellt.
Üblicherweise empfindliche Arten
Gram-positive Aerobe:
Streptococcus pyogenes
Streptococcus agalactiae
Gram-negative Aerobe:
Citrobacter koseri
Escherichia coli
Haemophilus influenzae
Moraxella catarrhalis
Neisseria meningitidis
Proteus mirabilis
Proteus spp. (andere)
Providencia spp.
Arten bei denen erworbene Resistenzen problematisch sein können
Gram-negative Aerobe:
Acinetobacter baumannii£+
Burkholderia cepacia
Citrobacter freundii
Enterobacter aerogenes
Enterobacter cloacae
Klebsiella pneumoniae
37
Klebsiella spp. (andere)
Pseudomonas aeruginosa
Serratia spp.
Morganella morganii
Gram-positive Aerobe:
Staphylococcus aureus£
Streptococcus pneumoniae££
Gram-positive Anaerobe:
Clostridium perfringens
Peptococcus spp.
Peptostreptococcus spp.
Gram-negative Anaerobe:
Fusobacterium spp.
Von Natur aus resistente Organismen
Gram-positive Aerobe:
Enterococci einschließlich Enterococcus faecalis und Enterococcus faecium
Listeria spp.
Gram-positive Anaerobe:
Clostridium difficile
Gram-negative Anaerobe:
Bacteroides spp. (viele Stämme von Bacteroides fragilis sind resistent).
Andere:
Chlamydia spp.
Mycoplasma spp.
Legionella spp.
£
Für Methicillin-empfindliche S. aureus wird eine natürlich vorhandene geringe Empfindlichkeit
gegenüber Ceftazidim angenommen. Alle Methicillin-resistenten S. aureus sind resistent gegenüber
Ceftazidim.
££
Bei intermediär empfindlichen oder Penicillin-resistenten S. pneumoniae kann erwartet werden, dass
zumindest eine reduzierte Empfindlichkeit gegenüber Ceftazidim besteht.
+
Hohe Resistenzraten wurden in einem oder mehreren Gebieten/Ländern/Regionen innerhalb der EU
beobachtet.
5.2
Pharmakokinetische Eigenschaften
Resorption
Nach intramuskulärer Anwendung von 500 mg und 1 g Ceftazidim werden rasch SpitzenPlasmaspiegel von 18 bzw. 37 mg/l erreicht. Fünf Minuten nach intravenöser Bolus-Injektion von 500
mg, 1 g oder 2 g sind die Plasmaspiegel bei 46, 87 bzw. 170 mg/l. Die Kinetik von Ceftazidim ist
innerhalb des Einzeldosisbereiches von 0,5 bis 2 g nach intravenöser oder intramuskulärer Dosierung
linear.
Verteilung
Die Serumprotein-Bindung von Ceftazidim ist gering und liegt bei etwa 10 %. Höhere
Konzentrationen als die MIC für die gängigen Erreger kann in Geweben wie Knochen, Herz, Galle,
Sputum, Kammerwasser, Synovia, Rippenfell- und Bauchfell-Flüssigkeit erreicht werden. Ceftazidim
passiert schnell die Plazenta und wird in die Muttermilch ausgeschieden. Die Penetration durch die
intakte Blut-Hirn-Schranke ist schwach, woraus bei Fehlen einer Entzündung ein niedriger
Ceftazidim-Spiegel in der Cerebrospinal-Flüssigkeit resultiert. Wenn die Hirnhäute entzündet sind,
werden Konzentrationen von 4 bis 20 mg/l oder mehr in der Cerebrospinal-Flüssigkeit erreicht.
Biotransformation
Ceftazidim wird nicht metabolisiert.
38
Ausscheidung
Nach parenteraler Anwendung sinken die Plasmaspiegel mit einer Halbwertszeit von ungefähr 2 h.
Ceftazidim wird durch glomeruläre Filtration unverändert über den Urin ausgeschieden; ungefähr 80
bis 90 % der Dosis werden im Urin innerhalb von 24 h wiedergefunden. Weniger als 1 % wird über
die Galle ausgeschieden.
Besondere Patientengruppen
Eingeschränkte Nierenfunktion
Die Ausscheidung von Ceftazidim ist bei Patienten mit eingeschränkter Nierenfunktion verringert und
die Dosis sollte reduziert werden (siehe Abschnitt 4.2).
Eingeschränkte Leberfunktion
Das Vorliegen einer schwachen bis moderaten Leber-Fehlfunktion hatte keinen Effekt auf die
Pharmakokinetik von Ceftazidim bei einzelnen Personen, denen 2 g intravenös alle 8 h über 5 Tage
verabreicht wurden, vorausgesetzt die Nierenfunktion war nicht beeinträchtigt (siehe Abschnitt 4.2).
Ältere Patienten
Die verringerte Clearance, die bei älteren Patienten beobachtet wurde, war primär mit einer
altersbedingten Abnahme der renalen Clearance von Ceftazidim verbunden. Die mittlere
Ausscheidungs-Halbwertszeit schwankte zwischen 3,5 und 4 h nach einer Einzelgabe oder
wiederholter BID Dosierung über 7 Tage von 2 g IV Bolus Injektionen bei Patienten von 80 Jahren
oder älter.
Pädiatrische Patienten
Die Halbwertszeit von Ceftazidim ist bei Frühgeburten und Neugeborenen nach Dosen von 25 bis 30
mg/kg auf 4,5 bis 7,5 h verlängert. Bei 2 Monate alten Kindern ist die Halbwertszeit allerdings
innerhalb des Bereiches von Erwachsenen.
5.3
Präklinische Daten zur Sicherheit
Basierend auf den konventionellen Studien zur Sicherheitspharmakologie, Toxizität bei wiederholter
Gabe, Reproduktionstoxizität und Genotoxizität lassen die präklinischen Daten keine besonderen
Gefahren für den Menschen erkennen. Studien zum kanzerogenen Potential wurden mit Ceftazidim
nicht durchgeführt.
6.
PHARMAZEUTISCHE ANGABEN
6.1
Liste der sonstigen Bestandteile
[Ist national auszufüllen]
6.2
Inkompatibilitäten
[Ist national auszufüllen]
6.3
Dauer der Haltbarkeit
[Ist national auszufüllen]
6.4
Besondere Vorsichtsmaßnahmen für die Aufbewahrung
[Ist national auszufüllen]
6.5
Art und Inhalt des Behältnisses
39
[Ist national auszufüllen]
6.6 Besondere Vorsichtsmaßnahmen für die Beseitigung und sonstige Hinweise zur
Handhabung
Alle Größen von Fortum-Durchstechflaschen werden mit reduziertem Druck bereitgestellt. Wenn das
Produkt aufgelöst wird, wird Kohlendioxid freigesetzt und es kommt zu einem Druckanstieg. Kleine
Blasen Kohlendioxid in der rekonstituierten Lösung können ignoriert werden.
Anleitung für die Herstellung
Siehe Tabelle über zuzufügende Volumina und entsprechende Konzentrationen der Lösung, was bei
Bedarf von Teildosen hilfreich sein kann.
Ampullengröße
Zuzufügende Menge
Verdünnungsmittel
(ml)
250 mg Pulver zur Herstellung einer Injektionslösung
250 mg
Intramuskulär
1.0 ml
Intravenöse Bolusgabe
2.5 ml
500 mg Pulver zur Herstellung einer Injektionslösung
500 mg
Intramuskulär
1.5 ml
Intravenöse Bolusgabe
5 ml
1 g Pulver zur Herstellung einer Injektions- oder Infusionslösung
1g
Intramuskulär
3 ml
Intravenöse Bolusgabe
10 ml
Intravenöse Infusion
50 ml*
2 g Pulver zur Herstellung einer Injektions- oder Infusionslösung
2g
Intravenöse Bolusgabe
10 ml
Intravenöse Infusion
50 ml*
3 g Pulver zur Herstellung einer Injektions- oder Infusionslösung
3g
Intravenöse Bolusgabe
15 ml
Intravenöse Infusion
75 ml*
* Vermerk: Die Zugabe sollte in 2 Schritten erfolgen
Ungefähre
Konzentration (mg/ml)
210
90
260
90
260
90
20
170
40
170
40
Die Lösung variiert in der Farbe von hellgelb bis bernsteinfarben, abhängig von der Konzentration,
dem Verdünnungsmittel und den Lagerbedingungen. Bei Beachtung der gegebenen Empfehlungen
haben diese Farbunterschiede keinen Einfluss auf die Wirksamkeit.
Ceftazidim-Konzentrationen zwischen 1 mg/ml und 40 mg/ml sind kompatibel mit folgenden
Injektionslösungen:
Natriumchlorid 9 mg/ml (0,9 %)
M/6 Natrium-Laktat
Natrium-Laktat (Hartmann-Lösung)
5 % Dextrose
0,225 % Natriumchlorid mit 5 % Dextrose
0,45 % Natriumchlorid mit 5 % Dextrose
0,9 % Natriumchlorid mit 5 % Dextrose
0,18 % Natriumchlorid mit 4 % Dextrose
10 % Dextrose
Dextran 40 10 % in 0,9 % Natriumchlorid
Dextran 40 10 % in 5 % Dextrose
Dextran 70 6 % in 0,9 % Natriumchlorid
Dextran 70 6 % in 5 % Dextrose
40
Ceftazidim-Konzentrationen zwischen 0,05 mg/ml und 0,25 mg/ml sind mit Intra-peritonealen
Dialyseflüssigkeiten (Laktate) kompatibel.
Ceftazidim kann für die intramuskuläre Anwendung mit 0,5 % oder 1 % Lidocain-HydrochloridLösung hergestellt werden.
Der Inhalt einer 500 mg Ampulle Ceftazidim zur Injektion, gelöst mit 1,5 ml Wasser zur Injektion,
kann zu einer Metronidazol-Injektion (500 mg in 100 ml) zugefügt werden und beide behalten ihre
Aktivität.
250 mg, 500 mg Pulver zur Herstellung einer Injektionslösung, 1 g, 2 g, 3 g Pulver zur Herstellung
einer Injektions- oder Infusionslösung:
Herstellung einer Lösung für die Bolus-Injektion
1. Stecken Sie die Spritzennadel durch den Ampullenverschluss und spritzen Sie die zur
Verdünnung empfohlene Menge an Lösung hinein. Das Vakuum kann den Eintritt der
Verdünnungslösung unterstützen. Entfernen Sie die Spritzennadel.
2. Zum Auflösen schütteln: Kohlendioxid wird freigesetzt und man erhält eine klare Lösung in
etwa 1 bis 2 Minuten.
3. Drehen Sie die Ampulle um. Stecken Sie die Nadel mit komplett gedrücktem Spritzenstößel
durch den Ampullenverschluss und ziehen Sie das komplette Volumen der Lösung in die
Spritze auf (der Druck in der Ampulle kann beim Aufziehen helfen). Stellen Sie sicher, dass
die Nadel in der Lösung bleibt und nicht in den Kopfraum eintritt. Die entnommene Lösung
kann kleine Blasen Kohlendioxid enthalten; diese können vernachlässigt werden.
Diese Lösungen können direkt in die Vene gegeben werden, oder in den Schlauch des
Infusionsbestecks, wenn der Patient parenterale Flüssigkeiten erhält. Ceftazidim ist mit den meisten
üblicherweise verwendeten intravenösen Flüssigkeiten mischbar.
1 g, 2 g, 3 g Pulver zur Herstellung einer Injektions- oder Infusionslösung:
Herstellung von Lösungen zur iv Infusion von einer Ceftazidim Injektion in Standard-Ampullen
Darreichung (Mini-Taschen oder Büretten-Typ Set):
Herstellung unter Verwendung von insgesamt 50 ml (für 1 g und 2 g Ampullen) und 75 ml (für 3 g
Ampullen) kompatibler Verdünnungslösung, hinzugefügt in ZWEI Stufen wie nachstehend.
1. Stecken Sie die Spritzennadel durch den Ampullenverschluss und spritzen Sie 10 ml der
Verdünnungslösung für die 1 g und 2 g Ampullen und 15 ml für die 3 g Ampullen hinein.
2. Entfernen Sie die Nadel und schütteln Sie die Ampulle bis die Lösung klar ist.
3. Geben Sie keine Nadel für den Druckausgleich hinein, bis das Arzneimittel gelöst ist. Stecken
Sie eine Nadel für den Druckausgleich durch den Ampullenverschluss, damit der interne
Druck entweicht.
4. Übertragen Sie die rekonstituierte Lösung in das endgültige Verabreichungssystem (z. B.
Mini-Taschen oder Büretten-Typ Set), was ein Gesamtvolumen von mindestens 50 ml (75 ml
für die 3 g Ampulle) ergeben sollte, und wenden Sie diese mittels intravenöser Infusion über
15 bis 30 Minuten an.
Vermerk: Um die Sterilität zu erhalten, ist es wichtig dass die Druckausgleichsnadel nicht durch den
Ampullenverschluss gesteckt wird, bevor das Arzneimittel gelöst ist.
1 g, 2 g Pulver zur Herstellung einer Infusionslösung (Monovial Darreichung)
Herstellung einer Lösung zur intravenösen Infusion:
Der Inhalt eines Monovials wird in einen kleinvolumigen Infusionsbeutel gegeben, der 0,9 %
Natriumchlorid Injektionslösung, oder 5 % Dextrose Injektionslösung, oder eine andere kompatible
Flüssigkeit enthält.
41
Das 2 g Monovial muss einem 100 ml Infusionsbeutel zugegeben werden.
1. Ziehen Sie den abnehmbaren Teil des Etiketts ab und entfernen Sie den Deckel.
2. Stecken Sie die Nadel des Monovials in die zusätzliche Öffnung des Infusionsbeutels.
3. Zur Aktivierung drücken Sie den Plastiknadelhalter des Monovials herunter auf die AmpullenSchulter bis ein Klicken zu hören ist.
4. Halten Sie das Monovial aufrecht, füllen Sie die Ampulle zu ungefähr zwei Drittel durch
mehrmaliges Drücken des Beutels.
5. Schütteln Sie die Ampulle, um das Ceftazidim zu lösen.
6. Beim Lösen wird das Ceftazidim etwas aufschäumen.
7. Übertragen Sie die rekonstituierte Ceftazidim-Lösung in den Infusionsbeutel durch Drücken
und Loslassen des Beutels. Halten Sie den Beutel dabei mit der Ampulle nach oben gerichtet.
8. Wiederholen Sie die Schritte 4 bis 7, um die Ampulle auszuspülen. Entsorgen Sie das leere
Monovial sicher. Prüfen Sie, dass das Pulver aufgelöst ist und dass der Beutel nicht undicht
ist.
Nicht verwendetes Arzneimittel oder Abfallmaterial ist entsprechend den nationalen Anforderungen
zu entsorgen.
7.
INHABER DER ZULASSUNG
[Siehe Anhang I – Ist national auszufüllen]
{Name und Anschrift}
<{Tel.-Nr.:}>
<{Fax-Nr.:}>
<{e-mail:}>
8.
ZULASSUNGSNUMMER(N)
[Ist national auszufüllen]
9.
DATUM DER ERTEILUNG DER ZULASSUNG/VERLÄNGERUNG DER
ZULASSUNG
[Ist national auszufüllen]
10.
STAND DER INFORMATION
[Ist national auszufüllen]
42
ETIKETTIERUNG UND PACKUNGSBEILAGE
43
A. ETIKETTIERUNG
44
ANGABEN AUF DER ÄUSSEREN UMHÜLLUNG
Umkarton
1.
BEZEICHNUNG DES ARZNEIMITTELS
Fortum und zugehörige Namen (siehe Anhang I) 250 mg Pulver zur Herstellung einer
Injektionslösung
Fortum und zugehörige Namen (siehe Anhang I) 500 mg Pulver zur Herstellung einer
Injektionslösung
Fortum und zugehörige Namen (siehe Anhang I) 1 g Pulver zur Herstllung einer Injektionslösung
Fortum und zugehörige Namen (siehe Anhang I) 1 g Pulver zur Herststellung einer Injektions-oder
Infusionslösung
Fortum und zugehörige Namen (siehe Anhang I) 2 g Pulver zur Herststellung einer Injektions-oder
Infusionslösung
Fortum und zugehörige Namen (siehe Anhang I) 3 g Pulver zur Herstellung einer Injektions-oder
Infusionslösung
Fortum und zugehörige Namen (siehe Anhang I) 1 g Pulver zur Herstellung einer Infusionslösung
Fortum und zugehörige Namen (siehe Anhang I) 2 g Pulver zur Herstellung einer Infusionslösung
[Siehe Anhang I - ist national auszufüllen]
Ceftazidim
2.
WIRKSTOFF(E)
[ist national auszufüllen]
3.
SONSTIGE BESTANDTEILE
[ist national auszufüllen]
4.
DARREICHUNGSFORM UND INHALT
[ist national auszufüllen]
5.
HINWEISE ZUR UND ART(EN) DER ANWENDUNG
Packungsbeilage beachten.
250 mg, 500 mg, 1 g Pulver zur Herstellung einer Injektionslösung; 1 g Pulver zur Herstellung einer
Injektions- oder Infusionslösung
Intramuskuläre oder intravenöse Anwendung.
2 g, 3 g Pulver zur Herstellung einer Injektions- oder Infusionslösung
1 g, 2 g Pulver zur Herstellung einer Infusionslösung (Fertigspritze)
Intravenöse Anwendung.
6.
WARNHINWEIS, DASS DAS ARZNEIMITTEL FÜR KINDER UNERREICHBAR UND
NICHT SICHTBAR AUFZUBEWAHREN IST
Arzneimittel für Kinder unzugänglich aufbewahren.
7.
WEITERE WARNHINWEISE, FALLS ERFORDERLICH
45
8.
VERFALLDATUM
Verwendbar bis:
9.
BESONDERE LAGERUNGSHINWEISE
[ist national auszufüllen]
10.
GEGEBENENFALLS BESONDERE VORSICHTSMASSNAHMEN FÜR DIE
BESEITIGUNG VON NICHT VERWENDETEM ARZNEIMITTEL ODER DAVON
STAMMENDEN ABFALLMATERIALIEN
11.
NAME UND ANSCHRIFT DES PHARMAZEUTISCHEN UNTERNEHMERS
[Siehe Anhang I - ist national auszufüllen]
{Name und Adresse}
<{Tel}>
<{Fax}>
<{e-mail}>
12.
ZULASSUNGSNUMMER(N)
[ist national auszufüllen]
13.
CHARGENBEZEICHNUNG
Ch.-B.
14.
VERKAUFSABGRENZUNG
[ist national auszufüllen]
15.
HINWEISE FÜR DEN GEBRAUCH
[ist national auszufüllen]
16.
INFORMATION IN BRAILLE-SCHRIFT
[ist national auszufüllen]
46
ANGABEN AUF DEM BEHÄLTNIS
Etikett (Injektionsflasche mit Pulver)
1.
BEZEICHNUNG DES ARZNEIMITTELS
Fortum und zugehörige Namen (siehe Anhang I) 3 g Pulver zur Herstellung einer Injektions-oder
Infusionslösung
[Siehe Anhang I - ist national auszufüllen]
Ceftazidim
2.
WIRKSTOFF(E)
[ist national auszufüllen]
3.
SONSTIGE BESTANDTEILE
[ist national auszufüllen]
4.
DARREICHUNGSFORM UND INHALT
[ist national auszufüllen]
5.
HINWEISE ZUR UND ART(EN) DER ANWENDUNG
Packungsbeilage beachten.
6.
WARNHINWEIS, DASS DAS ARZNEIMITTEL FÜR KINDER UNERREICHBAR UND
NICHT SICHTBAR AUFZUBEWAHREN IST
Arzneimittel für Kinder unzugänglich aufbewahren.
7.
WEITERE WARNHINWEISE, FALLS ERFORDERLICH
8.
VERFALLDATUM
Verwendbar bis:
9.
BESONDERE LAGERUNGSHINWEISE
[ist national auszufüllen]
10.
GEGEBENENFALLS BESONDERE VORSICHTSMASSNAHMEN FÜR DIE
BESEITIGUNG VON NICHT VERWENDETEM ARZNEIMITTEL ODER DAVON
STAMMENDEN ABFALLMATERIALIEN
11.
NAME UND ANSCHRIFT DES PHARMAZEUTISCHEN UNTERNEHMERS
[Siehe Anhang I - ist national auszufüllen]
{Name und Adresse}
47
<{Tel}>
<{Fax}>
<{e-mail}>
12.
ZULASSUNGSNUMMER(N)
[ist national auszufüllen]
13.
CHARGENBEZEICHNUNG
Ch.-B.
14.
VERKAUFSABGRENZUNG
[ist national auszufüllen]
15.
HINWEISE FÜR DEN GEBRAUCH
[ist national auszufüllen]
16.
INFORMATION IN BRAILLE-SCHRIFT
[ist national auszufüllen]
48
MINDESTANGABEN AUF KLEINEN BEHÄLTNISSEN
Injektionsflasche
1.
BEZEICHNUNG DES ARZNEIMITTELS SOWIE ART(EN) DER ANWENDUNG
Fortum und zugehörige Namen (siehe Anhang I) 250 mg Pulver zur Herstellung einer
Injektionslösung
Fortum und zugehörige Namen (siehe Anhang I) 500 mg Pulver zur Herstellung einer
Injektionslösung
Fortum und zugehörige Namen (siehe Anhang I) 1 g Pulver zur Herstllung einer Injektionslösung
Fortum und zugehörige Namen (siehe Anhang I) 1 g Pulver zur Herststellung einer Injektions-oder
Infusionslösung
Fortum und zugehörige Namen (siehe Anhang I) 2 g Pulver zur Herststellung einer Injektions-oder
Infusionslösung
Fortum und zugehörige Namen (siehe Anhang I) 1 g Monovial Darreichung Pulver zur Herstellung
einer Infusionslösung
Fortum und zugehörige Namen (siehe Anhang I) 2 g Monovial Darreichung Pulver zur Herstellung
einer Infusionslösung
[Siehe Anhang I - ist national auszufüllen]
Ceftazidim
250 mg, 500 mg, 1 g Pulver zur Herstellung einer Injektionslösung; 1 g Pulver zur Herstellung einer
Injektions- oder Infusionslösung
Intramuskuläre oder intravenöse Anwendung.
2 g Pulver zur Herstellung einer Injektions- oder Infusionslösung
1 g, 2 g Pulver zur Herstellung einer Infusionslösung (Monovial Darreichung)
Intravenöse Anwendung.
2.
HINWEISE ZUR ANWENDUNG
Packungsbeilage beachten.
3.
VERFALLDATUM
Verwendbar bis:
4.
CHARGENBEZEICHNUNG
Ch.-B.
5.
INHALT NACH GEWICHT, VOLUMEN ODER EINHEITEN
[ist national auszufüllen]
6.
WEITERE ANGABEN
49
PACKUNGSBEILAGE
50
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER
Fortum und zugehörige Namen (siehe Anhang I) 250 mg Pulver zur Herstellung einer
Injektionslösung
Fortum und zugehörige Namen (siehe Anhang I) 500 mg Pulver zur Herstellung einer
Injektionslösung
Fortum und zugehörige Namen (siehe Anhang I) 1 g Pulver zur Herstellung einer
Injektionslösung
Fortum und zugehörige Namen (siehe Anhang I) 1 g Pulver zur Herstellung einer Injektionsoder Infusionslösung
Fortum und zugehörige Namen (siehe Anhang I) 2 g Pulver zur Herstellung einer Injektionsoder Infusionslösung
Fortum und zugehörige Namen (siehe Anhang I) 3 g Pulver zur Herstellung einer Injektionsoder Infusionslösung
Fortum und zugehörige Namen (siehe Anhang I) 1 g Pulver zur Herstellung einer
Infusionslösung
Fortum und zugehörige Namen (siehe Anhang I) 2 g Pulver zur Herstellung einer
Infusionslösung
Ceftazidim
Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses
Arzneimittels beginnen.
Heben Sie die Packungsbeilage auf. Vielleicht möchten Sie diese später nochmals lesen.
Wenn Sie weitere Fragen haben, wenden Sie sich an Ihren Arzt.
Wenn eine der aufgeführten Nebenwirkungen Sie erheblich beeinträchtigt oder Sie Nebenwirkungen
bemerken, die nicht in dieser Gebrauchsinformation angegeben sind, informieren Sie bitte Ihren Arzt.
Diese Packungsbeilage beinhaltet:
1.
Was ist Fortum und wofür wird es angewendet?
2.
Was müssen Sie beachten, bevor Ihnen Fortum gegeben wird?
3.
Wie ist Fortum anzuwenden?
4.
Welche Nebenwirkungen sind möglich?
5.
Wie ist Fortum aufzubewahren?
6.
Weitere Informationen
1.
WAS IST FORTUM UND WOFÜR WIRD ES ANGEWENDET?
Fortum ist ein Antibiotikum zur Anwendung bei Erwachsenen und Kindern (einschließlich
Neugeborene). Es wirkt, indem es Bakterien abtötet, die Infektionen verursachen. Es gehört zu einer
Gruppe von Arzneimitteln, die Cephalosporine genannt werden.
Fortum wird angewendet zur Behandlung von schweren bakteriellen Infektionen:
der Lungen oder des Brustraumes
der Lungen und Bronchien bei Patienten, die an zystischer Fibrose leiden
des Gehirns (Meningitis)
des Ohres
der Harnwege
der Haut und Weichteilgewebe
des Bauchs und der Bauchwand (Peritonitis)
der Knochen und Gelenke.
51
Fortum kann auch angewendet werden:
zur Vorbeugung von Infektionen während Prostataoperationen bei Männern
zur Behandlung von Patienten mit niedriger weißer Blutkörperchenzahl (Neutropenie), die
Fieber haben auf Grund einer bakteriellen Infektion.
2.
WAS MÜSSEN SIE BEACHTEN, BEVOR IHNEN FORTUM GEGEBEN WIRD?
Fortum darf Ihnen nicht gegeben werden:
wenn Sie überempfindlich (allergisch) gegen Ceftazidim oder einen der sonstigen
Bestandteile des Arzneimittels sind (aufgelistet in Abschnitt 6).
wenn Sie eine schwere allergische Reaktion gegen ein anderes Antibiotikum (Penizillin,
Monobactame und Carbapeneme) hatten, da Sie genauso gegen Fortum allergisch sein können.
Bitte informieren Sie Ihren Arzt, bevor Sie die Behandlung mit Fortum beginnen, wenn Sie
glauben, dass dies auf Sie zutrifft. Fortum darf Ihnen dann nicht gegeben werden.
Besondere Vorsicht bei der Anwendung von Fortum ist erforderlich
Während Ihnen Fortum gegeben wird, müssen Sie auf bestimmte Anzeichen achten, z. B. auf
Bauchbeschwerden wie Durchfall, allergische Reaktionen und Erkrankungen des Nervensystems.
Dadurch wird das Risiko für mögliche Probleme verringert (siehe Abschnitt 4 „Beschwerden auf die
Sie achten sollten“). Wenn Sie eine schwere allergische Reaktion gegen ein anderes Antibiotikum
hatten, können Sie auch gegen Fortum allergisch sein.
Wenn Sie eine Blut- oder Urinuntersuchung benötigen
Fortum kann die Ergebnisse von Urinuntersuchungen auf Zucker und eine Blutuntersuchung, die als
der Coombs-Test bekannt ist, beeinflussen. Wenn Sie Untersuchungen durchführen lassen:
Informieren Sie die Person, die die Probe entnimmt, dass bei Ihnen Fortum angewendet
wurde.
Bei Einnahme von anderen Arzneimitteln
Bitte informieren Sie Ihren Arzt, wenn Sie andere Arzneimittel einnehmen, wenn Sie kürzlich mit der
Einnahme anderer Arzneimittel begonnen haben oder Sie beginnen, neue Arzneimittel einzunehmen,
auch wenn es sich um nicht verschreibungspflichtige Arzneimittel handelt.
Fortum sollte Ihnen nicht ohne Rücksprache mit Ihrem Arzt gegeben werden, wenn Sie gleichzeitig:
ein Antibiotikum namens Chloramphenicol einnehmen.
eine Art von Antibiotikum, Aminoglykoside genannt, einnehmen z. B. Gentamicin, Tobramycin
entwässernde Tabletten (Furosemid) einnehmen
Informieren Sie Ihren Arzt, falls dies auf Sie zutrifft.
Schwangerschaft und Stillzeit
Informieren Sie Ihren Arzt bevor Ihnen Fortum gegeben wird:
Wenn Sie schwanger sind, glauben, dass Sie schwanger sein könnten oder eine
Schwangerschaft planen
Wenn Sie stillen
Ihr Arzt wird den Nutzen Ihrer Behandlung mit Fortum gegen das Risiko für Ihr Baby abwägen.
Verkehrstüchtigkeit und das Bedienen von Maschinen
Fortum kann Nebenwirkungen hervorrufen, die die Verkehrstüchtigkeit beeinträchtigen wie z.B.
Benommenheit. Fahren Sie nicht und bedienen Sie keine Maschinen außer Sie sind sicher davon nicht
betroffen.
Wichtige Information über sonstige Bestandteile von Fortum
52
Fortum enthält Natrium.
Wenn Sie eine kochsalzarme Diät einhalten müssen, sollten Sie dies berücksichtigen.
Fortum-Stärke
Fortum 250 mg
Fortum 500 mg
Fortum 1 g
Fortum 2 g
Fortum 3 g
Fortum 1 g Monovial
Fortum 2 g Monovial
3.
Menge pro Ampulle
13 mg
26 mg
52 mg
104 mg
156 mg
52 mg
104 mg
Wie ist Fortum anzuwenden?
Fortum wird normalerweise von einem Arzt oder einer Pflegekraft gegeben. Es kann als Tropf
(intravenöse Infusion) oder als Injektion direkt in eine Vene oder einen Muskel angewendet werden.
Fortum wird unter Verwendung von Wasser für Injektionszwecke oder einer geeigneten
Infusionsflüssigkeit durch den Arzt, Apotheker oder die Pflegekraft hergestellt.
Übliche Dosis
Ihr Arzt entscheidet über die richtige Dosis Fortum für Sie. Sie ist abhängig von: der Schwere und Art
der Infektion; davon, ob Sie irgendwelche anderen Antibiotika einnehmen; von Ihrem Alter und
Gewicht; davon, wie gut Ihre Nieren arbeiten.
Neugeborene Babys (0-2 Monate)
Babys bekommen 25 bis 60 mg Fortum pro kg Körpergewicht pro Tag, aufgeteilt auf zwei Gaben.
Säuglinge (ab 2 Monaten) und Kinder unter 40 kg Körpergewicht
Säuglinge oder Kinder bekommen 100 bis 150 mg Fortum pro kg Körpergewicht pro Tag
verabreicht, aufgeteilt auf drei Gaben. Höchstdosis: 6 g pro Tag.
Erwachsene und Jugendliche ab 40 kg Körpergewicht
1 bis 2 g Fortum dreimal täglich. Höchstdosis: 9 g pro Tag.
Patienten ab 65 Jahren
Die tägliche Dosis sollte normalerweise 3 g pro Tag nicht überschreiten, besonders wenn Sie über 80
Jahre alt sind.
Patienten mit Nierenproblemen
Ihnen kann eine von der allgemeinen Dosierungsempfehlung abweichende Dosis gegeben werden. Der
Arzt oder die Pflegekraft entscheidet je nach Schwere der Nierenerkrankung wie viel Fortum Sie
benötigen. Ihr Arzt wird Sie genau untersuchen und bei Ihnen werden möglicherweise regelmäßigere
Nierenfunktionstests durchgeführt.
Wenn eine größere Menge Fortum als verschrieben angewendet wurde:
Wenn versehentlich eine größere Menge, als Ihnen verschrieben wurde, angewendet wurde,
kontaktieren Sie sofort Ihren Arzt oder das nächste Krankenhaus.
53
Wenn die Anwendung von Fortum vergessen wurde:
Wenn bei Ihnen eine Injektion versäumt wurde, sollte diese so schnell wie möglich nachgeholt
werden. Wenn es allerdings beinahe Zeit für Ihre nächste Injektion ist, dann lassen Sie die versäumte
Injektion aus. Es wird nicht die doppelte Dosis (zwei Injektionen gleichzeitig) angewendet, wenn bei
Ihnen die vorherige Anwendung vergessen wurde.
Wenn Sie die Anwendung von Fortum abbrechen
Brechen Sie die Anwendung von Fortum nicht ab, außer Ihr Arzt sagt es Ihnen. Wenn Sie weitere
Fragen zur Anwendung des Arzneimittels haben, fragen Sie Ihren Arzt oder eine Pflegekraft.
4.
WELCHE NEBENWIRKUNGEN SIND MÖGLICH?
Wie alle Arzneimittel kann Fortum Nebenwirkungen haben, die aber nicht bei jedem auftreten müssen.
Beschwerden, auf die Sie achten sollten
Die folgenden schwerwiegenden Nebenwirkungen sind bei einer geringen Anzahl Behandelter
aufgetreten, die genaue Häufigkeit der Nebenwirkungen ist jedoch nicht bekannt:
Schwere allergische Reaktion. Anzeichen dafür sind erhobener (quaddelartiger) und
juckender Ausschlag, Schwellung, manchmal des Gesichtes oder Mundes, die Atemnot
verursacht.
Hautausschlag, der zu Blasenbildung führen kann und der wie kleine Zielscheiben aussieht (in
der Mitte gelegener dunkler Fleck, umgeben von einem blasseren Bereich, mit einem dunklen
Ring rund um den Rand).
Großflächiger Ausschlag mit Blasen und sich schälender Haut. (Dies können Anzeichen eines
Stevens-Johnson-Syndroms oder einer toxischen epidermalen Nekrolyse) sein.
Erkrankungen des Nervensystems: Zittern, Krampfanfälle und in manchen Fällen Koma. Dies
trat bei Patienten auf, wenn die verabreichte Dosis zu hoch war, insbesondere bei Patienten mit
Nierenerkrankungen.
Wenden Sie sich sofort an einen Arzt oder eine Pflegekraft, wenn bei Ihnen eines dieser
Symptome auftritt.
Häufige Nebenwirkungen
Diese können bis zu 1 von 10 Behandelten betreffen:
Durchfall
Schwellung und Rötung entlang einer Vene
erhobener (quaddelartiger) roter Hautausschlag, der mit Juckreiz verbunden sein kann
Schmerzen, Brennen, Schwellung oder Entzündung an der Einstichstelle.
Informieren Sie Ihren Arzt, wenn eine dieser Nebenwirkungen Sie beeinträchtigt.
Häufige Nebenwirkungen, die bei Blutuntersuchungen auftreten können:
Erhöhung der Zahl einer bestimmten Art an weißen Blutkörperchen (Eosinophilie)
Erhöhung der Anzahl an Blutplättchen (Zellen, die die Blutgerinnung fördern)
Erhöhung der Leberenzyme.
Gelegentliche Nebenwirkungen
Diese können bis zu 1 von 100 Behandelten betreffen:
Entzündung des Darms, die Schmerzen oder Durchfall, welcher Blut enthalten kann, verursachen
kann
Candida-Pilzinfektionen im Mund oder in der Scheide
54
Kopfschmerzen
Schwindel
Bauchschmerzen
Übelkeit oder Erbrechen
Fieber und Schüttelfrost.
Informieren Sie Ihren Arzt, wenn eine dieser Nebenwirkungen bei Ihnen auftritt.
Gelegentliche Nebenwirkungen, die bei Blutuntersuchungen auftreten können:
Abnahme der Anzahl weißer Blutkörperchen
Abnahme der Anzahl an Blutplättchen (Zellen, die die Blutgerinnung fördern)
Anstieg des Harnstoffs, Harnstoff-Stickstoffes oder des Serumkreatinins im Blut.
Andere Nebenwirkungen
Andere Nebenwirkungen sind bei einer geringen Anzahl an Behandelten aufgetreten, ihre genaue
Häufigkeit ist jedoch unbekannt:
Nierenentzündung oder Nierenversagen
Kribbeln („Ameisenlaufen”)
Unangenehmer Geschmack im Mund
Gelbfärbung der Haut oder der Augen.
Andere Nebenwirkungen, die bei Blutuntersuchungen auftreten können:
Rote Blutkörperchen werden zu schnell zerstört
Erhöhung der Zahl einer bestimmten Art weißer Blutkörperchen
Starke Abnahme der Anzahl weißer Blutkörperchen.
Wenn Nebenwirkungen bei Ihnen auftreten
Informieren Sie bitte Ihren Arzt oder Apotheker, wenn eine der aufgeführten
Nebenwirkungen Sie erheblich beeinträchtigt oder Sie Nebenwirkungen bemerken, die nicht
in dieser Gebrauchsinformation angegeben sind.
5.
WIE IST FORTUM AUFZUBEWAHREN?
Arzneimittel für Kinder unzugänglich aufbewahren.
[ist national auszufüllen]
6.
WEITERE INFORMATIONEN
Wie Fortum aussieht und Inhalt der Packung
[national auszufüllen]
Pharmazeutischer Unternehmer und Hersteller
[national auszufüllen]
Dieses Arzneimittel ist in den Mitgliedsstaaten des Europäischen Wirtschaftsraumes (EWR)
unter den folgenden Bezeichnungen zugelassen:
250 mg Pulver zur Herstellung einer Injektionslösung
Frankreich – Fortum enfants et nourrisons
Großbritannien, Polen, Schweden – Fortum
Italien – Glazidim, Ceftim
55
Fortum 500 mg Pulver zur Herstellung einer Injektionslösung
Belgien, Finnland, Italien, Luxemburg – Glazidim
Dänemark, Deutschland, Großbritannien, Irland, Litauen, Niederlande, Norwegen, Österreich, Polen,
Rumänien, Schweden, Slowakische Republik, Tschechische Republik, Ungarn – Fortum
Frankreich – Fortum enfants et nourrisons
Italien – Ceftim
Portugal – Cefortam
Spanien – Fortam IM/IV, Potendal
Fortum 1 g Pulver zur Herstellung einer Injektionslösung
Bulgarien - Fortum
Finnland - Glazidim
Fortum 1 g Pulver zur Herstellung einer Injektions- oder Infusionslösung
Belgien, Italien, Luxemburg – Glazidim
Dänemark, Deutschland, Frankreich, Großbritannien, Irland, Island, Lettland, Litauen, Malta,
Niederlande, Norwegen, Österreich, Polen, Rumänien, Schweden, Slowakische Republik, Slowenien,
Tschechische Republik, Ungarn, Zypern – Fortum
Estland – Fortum IM/IV
Frankreich – Fortumset,
Griechenland – Solvetan
Italien – Panzid, Ceftim
Portugal – Cefortam
Spanien – Fortam IV, Fortam Ig/IV, Fortam IM/IV, Potendal
Fortum 2 g Pulver zur Herstellung einer Injektions- oder Infusionslösung
Belgien, Italien, Luxemburg – Glazidim
Dänemark, Deutschland, Frankreich, Großbritannien, Island, Litauen, Niederlande, Norwegen,
Österreich, Polen, Rumänien, Schweden, Slowakische Republik, Tschechische Republik, Ungarn –
Fortum
Finnland – Glazidim
Frankreich – Fortumset
Griechenland – Solvetan
Portugal – Cefortam
Spanien – Fortam IV, Potendal
Fortum 3 g Pulver zur Herstellung einer Injektions- oder Infusionslösung
Finnland – Glazidim
Großbritannien, Litauen – Fortum
Fortum 1 g Monovial Pulver zur Herstellung einer Infusionslösung
Irland – Fortum
Slowenien – Fortum Monovial
Fortum 2 g Monovial Pulver zur Herstellung einer Infusionslösung
Großbritannien, Irland – Fortum
Diese Gebrauchsinformation wurde zuletzt genehmigt im {MM/JJJJ}.
56