Atombau und Periodensystem
Werbung
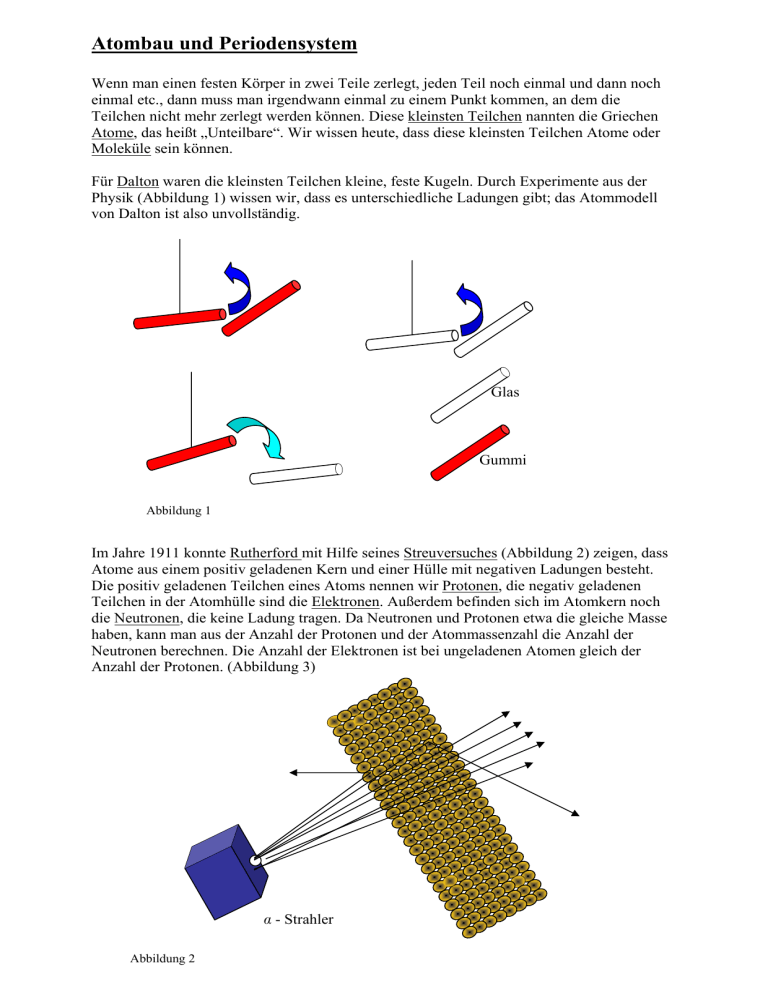
Atombau und Periodensystem Wenn man einen festen Körper in zwei Teile zerlegt, jeden Teil noch einmal und dann noch einmal etc., dann muss man irgendwann einmal zu einem Punkt kommen, an dem die Teilchen nicht mehr zerlegt werden können. Diese kleinsten Teilchen nannten die Griechen Atome, das heißt „Unteilbare“. Wir wissen heute, dass diese kleinsten Teilchen Atome oder Moleküle sein können. Für Dalton waren die kleinsten Teilchen kleine, feste Kugeln. Durch Experimente aus der Physik (Abbildung 1) wissen wir, dass es unterschiedliche Ladungen gibt; das Atommodell von Dalton ist also unvollständig. Glas Gummi Abbildung 1 Im Jahre 1911 konnte Rutherford mit Hilfe seines Streuversuches (Abbildung 2) zeigen, dass Atome aus einem positiv geladenen Kern und einer Hülle mit negativen Ladungen besteht. Die positiv geladenen Teilchen eines Atoms nennen wir Protonen, die negativ geladenen Teilchen in der Atomhülle sind die Elektronen. Außerdem befinden sich im Atomkern noch die Neutronen, die keine Ladung tragen. Da Neutronen und Protonen etwa die gleiche Masse haben, kann man aus der Anzahl der Protonen und der Atommassenzahl die Anzahl der Neutronen berechnen. Die Anzahl der Elektronen ist bei ungeladenen Atomen gleich der Anzahl der Protonen. (Abbildung 3) - Strahler Abbildung 2 Abbildung 3 23 Kernteilchen (=Atommasse) ________ _____________ 12 Neutronen ________ _____________ 23 11 Na 11 Protonen (=Ordnungs- oder Kernladungszahl) ________ _____________ 11 Elektronen (bei ungeladenen Atomen) ________ _____________ Niels Bohr, ein dänischer Physiker, konnte zeigen, dass sich die Elektronen auf verschiedenen Schalen befinden. In der ersten Schale können bis zu 2 Elektronen sein, in der zweiten bis zu 8, in der dritten bis zu 18, etc. Die Maximalzahl k der Elektronen für jede Schale kann man berechnen: k = 2 n² Dabei gibt n die Schale an. Auf der letzten Schale können immer nur maximal 8 Elektronen sein. Im Periodensystem der Elemente sind die Elemente nach der Anzahl der Protonen geordnet. Elemente mit ähnlichen Eigenschaften stehen dabei in einer Gruppe (Beispiel: Halogene). Dabei stellt man fest, dass immer die Elemente zu einer Gruppe gehören, die auf der letzten Schale die gleiche Elektronenanzahl besitzen. Elemente, die die gleiche Anzahl von Schalen haben, stehen in einer Periode. Wenn man die Reaktionen der einzelnen Elemente vergleicht, dann stellt man folgendes fest: • • Die Elemente der ersten Gruppe reagieren sehr gut, ebenso die der siebenten Gruppe. Die Elemente der achten Gruppe reagieren nicht. Offensichtlich haben die Atome das Ziel, auf der letzten Schale 8 Elektronen zu besitzen. Da die Atome der ersten bis siebenten Schale weniger Elektronen auf der letzten Schale haben, gehen sie Verbindungen mit anderen Atomen ein. So entstehen Moleküle. Atome, die auf der letzten Schale 1 bis 3 Elektronen haben, können diese an andere Atome abgeben. Die Atome der 5. bis 7. Gruppe haben 1 bis 3 Einzelelektronen, die zusammen mit den Elektronen anderer Elemente vier Elektronenpaare (=8 Elektronen) bilden können. Die Anzahl der Einzelelektronen der Atome heißt Wertigkeit. Beispiele: Zwei einwertige Atome verbinden sich: K* *I + KI Zwei einwertige und ein zweiwertiges Atom verbinden sich: 2 Na* + *S* Na2S Verbindung von einem vierwertigen und vier einwertigen Atomen: * *C* * + 4 H* Periodensystem der Elemente (Hauptgruppen) CH4









![Kugelwolkenmodell (KWM) der Atomhülle [c/ A. Schill]](http://s1.studylibde.com/store/data/006026842_2-f7ef645afd4f19b760ad28335b8d24ad-300x300.png)

