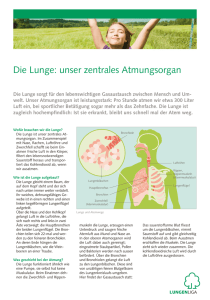
OBERER RESPIRATIONSTRAKT
Werbung

OBERER RESPIRATIONSTRAKT Oberer Respirationstrakt .................................................................................................................................... 1 Nase und Nasennebenhöhlen ......................................................................................................................... 3 Missbildungen: ........................................................................................................................................... 3 Fremdkörper und Inkrustationen: Rhinolithiasis. ...................................................................................... 3 Entzündungen. ........................................................................................................................................... 3 Akute unspezifische Rhinitis, akute unspezifische Sinusitis: ................................................................ 3 Akute virale Rhinitis: ............................................................................................................................. 3 Chronische unspezifische Rhinitis und Sinusitis: .................................................................................. 4 Chronische unspezifische Rhinitis/Sinusitis polyposa: ......................................................................... 4 Spezifische Rhinitiden und Sinusitiden. ................................................................................................ 4 Lepra der Nase: ...................................................................................................................................... 4 Rhinosklerom: ........................................................................................................................................ 4 Polypen und Polypose der Nase und Nasennebenhöhlen: .................................................................... 5 Benigne Tumoren der nase und der Nasennebenhöhlen. .......................................................................... 5 Papillome des respiratorischen Epithels der Nase und Nasennebenhöhlen: .......................................... 5 Plattenepitheliales Papillom des Nasenvestibulum:............................................................................... 5 Seltene Tumoren der Nasen- und Nasennebenhöhlen: .............................................................................. 5 Osteom: .................................................................................................................................................. 5 Angiofibrom ........................................................................................................................................... 6 maligne Tumoren der nase und der Nasennebenhöhlen. .......................................................................... 6 Plattenepithelcarcinom:.......................................................................................................................... 6 Adenocarcinome der Nasennebenhöhlen: .............................................................................................. 7 Undifferenziertes Nasopharynxcarcinom: ............................................................................................. 7 Sonstige Maligne Tumoren des Nasopharynx ........................................................................................... 7 Malignes Melanom: ............................................................................................................................... 7 Esthesioneuroblastom: ........................................................................................................................... 8 LARYNX ....................................................................................................................................................... 9 Vorbemerkung: ...................................................................................................................................... 9 Missbildungen von Larynx und Hypopharynx ........................................................................................... 9 Missbildungen des Larynx ..................................................................................................................... 9 Dysontogenetische Halsfisteln und -zysten: .......................................................................................... 9 Verletzungen des Kehlkopfes ................................................................................................................ 9 Stoffwechselstörungen des Larynx ...................................................................................................... 10 Kreislaufstörungen des Kehlkopfes ......................................................................................................... 10 Glottisödem, Larynxödem ................................................................................................................... 10 Entzündungen des Kehlkopfes : Laryngitis ............................................................................................ 10 Akute Laryngitis................................................................................................................................... 10 SOFO: Diphtherische Laryngitis....................................................................................................... 10 Chronische Laryngitis .............................................................................................................................. 11 Chronische unspezifische Laryngitis ................................................................................................... 11 Chronische spezifische Laryngitis: ...................................................................................................... 11 Tumoren und tumorartige Läsionen des Larynx ..................................................................................... 11 tumorartige Läsionen des Larynx ............................................................................................................. 11 Stimmlippenpolyp ................................................................................................................................ 11 Amyloidtumor des Larynx ................................................................................................................... 11 Benigne Tumoren des Larynx .................................................................................................................. 12 Multiple Papillome des Larynx ............................................................................................................ 12 Solitäres Papillom des Larynx ............................................................................................................. 12 Granularzelltumor des Larynx ............................................................................................................. 12 Maligne Tumoren des Larynx und ihre Vorstufen ................................................................................... 12 Plattenepitheliale Dysplasien und Carcinoma in situ ........................................................................... 12 Invasives Plattenepithelkarzinom des Larynx ...................................................................................... 13 Seltene Tumoren des Larynx ............................................................................................................... 14 NASE UND NASENNEBENHÖHLEN Anatomische Vorbemerkung: Nase: Vestibulum von Epidermis ausgekleidet ; am Nasenseptum im Vestibulum Plattenepithel. Die Nasenhaupthöhle von ektodermal entstandenen Flimmerepithel ausgekleidet( = Schneiderepithel; im Gegensatz zu dem entodermal entstandenem Flimmerepithel von Trachea und Bronchien). Darunter insbesondere in den Nasenmuscheln eine breite Lamina propria mit Schwellkörperblutgefässen: Weite unregelmässige Blutgefässe mit dicker grobsträhniger glatter Muskulatur. Am Nasenseptum am Übergang von Plattenepithel zu Flimmerepithel der Locus Kiesselbach, ein häufiger Ausgangspunkt von Epistaxis. Auskleidung der Nasennebenhöhlen (Sinus maxillaris, frontalis, ethmoidalis und sphenoidalis) durch schmales respiratorisches Epithel aus Flimmerepithelien, Becherzellen und Reservezellen. Darunter eine dünne Lamina basalis. In der Lamina propria seromuköse Drüsen und spärlich Schwellkörperblutgefässe. Sinnesorgane der Nase: Olfactorisches System: Riechregionen Vomeronasales Organ: Fragliche Wirksamkeit bei Menschen; bei Tieren Rezeptor für Pheromone. Canalicukus bei 60% der Menschen im caudalen Nasenseptum bds. vorhanden. MISSBILDUNGEN: Aprosopie: Fehlen von Nasen- und Riechorganen. Arhinie, familiär:DEF: Vollständiges Fehlen der Weichgewebe der Nase. autosomal-dominant; Choanalatresie, Mikrophthalmie, Mikroencephalie.Hypertelorismus.Extrem selten. Arrhinencephalie: Fehlen von Bulbi olfactorii und Teilen der Nase. Exp. Bei Pn/Pdn-Maus: Vollständiges ehlen der Bulbi olfactorii und der olactorischen Nervenprojektion Fehlen des nipple-search-Reflexes. Mensch: bei 8,5% aller ZNS-Missbildungen fehlen auch die Bulbi olf.; häufig kombiniert mit Mittelhirn-Defekt-Syndromen. AE/PG:Defekt es hox-Gens Otx2 Verlust von Kopfstrukturen durchDefekte des anterioren visceralen Entoderms (und des Organizers). Cyclopie: Über dem unpaaren Auge eine wulstartige Vorwölbung (Proboscis). Choanalatresie: Kompletter oder inkompletter Verschluss der Choanen zum Nasopharynx hin durch epithelisierte Bindegewebslamelle oder Bindegewebs-/Knochenlamelle. Kiefer-/Gaumenspalten und Ductus-nasopalatinus-Fistel: Siehe Mundhöhle. FREMDKÖRPER UND INKRUSTATIONEN: RHINOLITHIASIS. EPI: Häufig im Kindesalter in die Nase eingebrachte Fremdkörper sind Erdnüsse, Schusserkugeln, Haarklammern, Papier und Stofffetzen sowie Spielzeugpartikel. PG: Akute Verletzungen der Schleimhäute --> Blutungen; chronische Inkorporation --> Einbettung in Schleim --> Belüftungsstörung --> chronische Rhinitis und Sinusitis. MO: Verrostete und tw. von Schleimhaut überzogene Partikel; sekundäre Verkalkung des Schleimes --> Rhinolith: die Verkalkung verläuft dabei nicht homogen sondern in zwiebelschalenartig (=„Liesegang-Ringen“) . Auch nekrotische Nasenschleimhautpolypen oder spontan eingedickte Schleimkoagel können calcifizieren --> Rhinolith. ENTZÜNDUNGEN. Akute unspezifische Rhinitis, akute unspezifische Sinusitis: AE: : Viren s.u.; chemische Reize (Säuren, Dämpfe). Allergisch (Typ 1 Reaktion): Heuschnupfen. Angioneurotisches Ödem Quincke: (PG: Kongenitaler Defekt des C 1-inhibitors.) MA: Hyperaemie der Schleimhaut, vermehrte seromuköse Sekretionsschleimhäute durch vermehrte Sekretion aus serösen und mukösen Drüsen sowie (gering) Transsudation (glukose- negatives Nasensekret!). MI: Verquollene, hyperaemische Schleimhäute; ausgeprägtes interstitielles Ödem und erweiterte Schwellkörperblutgefässe. PRG: Bestens (akute Rhinitis) bis eingeschränkt (Quincke, Reizgasinhalation). Akute virale Rhinitis: EPI: extrem häufig. AE: Grippe-, Rhino-, Echo-, Adenoviren; Replikation nur in Primaten (Grippe auch in Frettchen). Häufig Superinfekion durch Bakterien. PG: nstieg von Bradykinin, Cytokinen und Chemokinen und s-ICAM-1 durch Rhinoviren indziert. Recruitment von Monozyen und Granulozyten (nicht on Lymphozyten!); Eradikation der Vien durch TH1-Typ- Zytokine; die gebildeten neutralisierenden Immunglobline sind ws. Für die Infektionsüberwindung ohne Bedetung: van Kempen et al. Rhinology 37:97 (1999). Chronische unspezifische Rhinitis und Sinusitis: EPI: Sehr häufig, bes. Jugendliche und jüngeres Erwachsenenalter. Abnahme mit fortschreitendem Alter. AE: Habituell; allergisch: Heuschnupfen. Beruflich: Kältearbeitsplätze, chemische Industrie (aggressive Sägewerksbetriebe (Tropenhölzer!). Staubreiche Arbeitsplätze.50% durch Bakterien MA: Verdickte Schleimhaut-> eingeengte Atemwege. KLIN: Klassifikation der Rhinitiden als akut, rezidivierend akut, subakut, chronisch . Dämpfe), MI: Unterschiedliche Formen: 1.Atrophische Rhinitis/Sinusitis EPI: selten; Land:Stadt=2:1 AE: Ws.Klebsiella ozaena; eventl. Eisenmnagel; 80% Entzündungstyp II n.Coombs und Gell. MA: Ausweitung von Nase- und Nasennebenhöhlen; borkiger Belag. MI: abgeflachtes Epithel, Ausbildung von Plattenepithelmetaplasien, trockene Nase. 2.Hyperplastische Rhinitis/Sinusitis: MI: Verbreiterung des respiratorischen Epithels durch Zellvermehrung von Flimmerepithelien, Reservezellen +/- Becherzellen. Verdickung der Lamina basalis; Verbreiterung und ödematöse Verquellung der Lamina propria: Vermehrung von seromukösen und mukösen Drüsen ; lymphozytäre und plasmazelluläre Infiltrate unter dem Oberflächenepithel, in der Umgebung von Blutgefässen und Drüsen. Mukozelenbildung: Cystische Ausweitung von mukösen Drüsen in der Nasennebenhöhlenschleimhaut und Pseudocystenbildung durch chronisch inveteriertes (=eingedicktes) Ödem. Sonderformen: Chronische allergische Rhinitis/Sinusitis: EPI: Kinder seltener als Erachsene; M:F=2:1 PG:Plasmocytoide (CD123 positive) Monocyten sammeln sich in der Nasen/NNH-SH an Umwandlung zu Antigenpräsentierenden denritischen Zellen MI: Vermehrt Plasmazellen und eosinophile Granulozyten in der Lamina propria; homogene Verdickung der Lamina basalis. Chronische unspezifische Rhinitis/Sinusitis polyposa: MO:Schleimhautpolypen der Nase und der Nasennebenhöhlen: Bis 5 cm grosse polypoide Schleimhautpartikel überzogen von glattem spiegelndem Epithel; myxoide, gallertige Schnittfläche; Vasomotorischer Typ: Wenige Entzündungszellen; inflammatorischer Typ: Zahlreiche Entzündungszellen. Spezifische Rhinitiden und Sinusitiden. Lepra der Nase: DEF: Beteiligung der Nase bei generalisierter Lepra; AE: : Mycobacterium leprae . PG: Durch Befall von Gesichtshaut und Nasenschleimhäuten und daraus resultierender ausgedehnter Destruktion --> hochgradige Entstellung des Gesichts (Löwengesicht, Facies leontina). Morphologie MA: Ausgedehnte Exulcerationen der Schleimhaut und der darunterliegenden Weichteile und Knochen; Zusammenbruch des Mittelgesichts. MI: Epitheloidzellgranulome mit Nekrosen (Lepra tuberculosa) bis grossflächigen Infiltraten aus plumpen Histiozyten mit schaumigen Cytoplasma; darinnen massenhaft säurefeste Stäbchen (Virchow-Zellen). Nachweis durch Ziehl-Neelson-Färbung oder Fite-Faraco-Färbung. Rhinosklerom: DEF: Durch Bakterien hervorgerufene Erkrankungen der Nasenschleimhäute mit ausgeprägten Destruktionen. AE: : Klebsiella rhinoscleromatis; sie wird nur partiell durch die phagozytierenden Histiozyten digeriert Tod der Histiozyten. EPI: Selten; familiäre Häufung; insbesondere in Osteuropa; sozial Unterprivilegierte.Guatemale, Uganda; HIV-Patienten. Morphologie MA: Infiltration von Haut, Nasen- und Nasennebenhöhlenschleimhäuten bis zu den tieferen Atemwegen. Plumpe Auftreibungen der Nasen, Schwellung des Mittelgesichts. MI: Infiltration der Schleimhäute durch plumpe, dicht gelagerte Histiozyten mit schaumigen hellen Cytoplasma; in Silberfärbungen gut darinnen nachweisbare plumpe, stäbchenförmige Bakterien (Klebsiella rhinoscleromatis): MikuliczZellen; dazwischen Lymphozyten und Plasmazellen. PRG: Stadienhafter Verlauf: 1.Katarrhalisch, 2.granulomatös 3.sklerotisch. Defektheilung nur durch langzeitige antibiotische Therapie erreichbar. Polypen und Polypose der Nase und Nasennebenhöhlen: DEF: Polypoide Schleimhautvorwölbungen der Nasen- und Nasennenbenhöhlen ohne neoplastischem Charakter. EPI: Bei chronischer Nasen- und Nasennebenhöhlenentzündung sehr häufig; M : F = 3 : 1! PG: Drei unterschiedliche Typen: 1. Vasomotorischer Typ: +/- proteinreiches Schleimhautödem der Lamina propria; --> Vorwölbung des respiratorischen Epithels; Ausbildung von cystischen Hohlräumen in den ödematösen Bindegewebe der Lamina propria --> pseudocystische Mukozelen. 2. Inflammatorischer Typ: Besonders bei Allergien: Perivasale und subepitheliale dichte Ansammlungen von Plasmazellen und eosinophilen Granulozyten; ödematöse Verquellung der Lamina propria. 3. Cystischer Typ: Bei Sekretretentionen der serösen, seromukösen und mukösen Drüsen --> cystische Dilatation der Drüsen --> echte Cysten --> cystische Nasenschleimhautpolypen. (Anm: Besonders bei Kindern mit cystischer Fibrose). Morphologie MA: Meist multiple bis 3 cm grosse gallertige Schleimhautpolypen. MI: S. PG. Auffällige homogene Verbreiterung der Lamina basalis subepithelial und periglandulär. PG: Rezidivfreudig jedoch absolut benigne. BENIGNE TUMOREN DER NASE UND DER NASENNEBENHÖHLEN. Papillome des respiratorischen Epithels der Nase und Nasennebenhöhlen: DEF: Vom ektodermalem respiratorischem Epithel (Schneiderepithel) der Nasennebenhöhlen ausgehende Tumoren; deshalb engl. Schneiderian papilloma. EPI: Häufigste Tumoren der Nasen und Nasennebenhöhlen. 1/3 aller NNH-Tumoren. Altersgipfel 5. Dekade; M : F = 5 : 1. AE: /PG: : Irritation; nur selten HPV-Viren nachweisbar. Morphologie MA: +/- exophytische meist unilaterale Tumoren von Nasen und Nasennebenhöhlen; auf der Schnittfläche im Gegensatz zu einfachen Nasenschleimhautpolypen gelblich weisse guirlandenartige Verbreiterungen des Epithels. MI: Tumoren auf Plattenepithelien oder hochprismatischen Epithelien (Transitionalzelltyp) mit erhaltener Kern-Plasma-Relation und normochromen Zellkernen. Exophytisches oder invertiertes Wachstum: Das Oberflächenepithel dabei kryptenartig in die Lamina propria eingesenkt. PRG: Rezidivfreudig; geringe Entartungsrate (--> Transitionalzellcarcinom, Plattenepithelcarcinom - Entwicklung bei1 - 2 % der Patienten); Druckatrophie des angrenzenden Knochens, Knochen- Arrosion. Plattenepitheliales Papillom des Nasenvestibulum: DEF: Vom spezifischen Plattenepithel des Nasenvestibulum ausgehende Tumoren. EPI: Häufig. PG: Irritation; nicht selten papillomavirus-induziert („Verruca vulgaris des Nasenvestibulum“). Morphologie MA: Verrucöse bis 0,5 cm grosse feste weisse Tumoren. MI: Akanthopapillomatöse Aufwerfung des Plattenepithels; Vermehrung vor allem der Zellen des Stratum spinosum; oberflächliche Hyperkeratose. Gelegentlich Koilozyten (--> Viruspapillom). PRG: Gut jedoch rezidivfreudig. SELTENE TUMOREN DER NASEN- UND NASENNEBENHÖHLEN: Osteom: DEF: Von reifen Knochen ausgehende benigne Tumoren. EPI: Nicht selten; vor allem Stirnhöhle. MA: Elfenbeinartige sehr harte Tumoren. MI: Osteoma eburneum: Ausschliesslich aus kompakten reifen Knochenanteilen bestehender Tumor. Osteoma spongiosum: Stark verbreiterte Spongiosabälkchen in tumorartiger Anordnung. PRG: Absolut benigne. Angiofibrom SYN: Juveniles nasopharyngeales Angiofibrom, juveniles Nasen-Rachenfibrom EPI: Selten ( 1: 150 000 stationären HNO - Behandlungen) ; nahezu ausschliesslich bei männl. Jugendlichen im Alter von 721 Jahren; Durchschnittsalter 15 J. Besonders in Familien mit adenomatöser Polyposis des Colon; APC-Gen-Defekte spielen dabei jedoch keine Rolle. PG: Tumor aus dem ortsspezifischem fibrovaskulärem Stroma des Epipharynx (--> Tumorlokalisation nur dort!).Tumorentstehung durch somatische ß-Catenin-Mutationen in sporadischen Angiofibromfällen. MA: Fester, graurötlicher bis purpurfarbener, bei OP stark blutender Tumor des Nasopharynx. Destruktion des Os sphenoidale, Einbruch in die Orbita. MI: Unregelmässig konfigurierte, gebogene Blutgefässe mit minimaler Ausbildung einer Media; dazwischen zunächst zellreiches, später zellarmes, hyalinisiertes Bindegewebe.Die Stromazellen sind dabei die neoplastischen Zellen, nicht die Endothelien. PRG: Fragwürdig; der Prozess kommt nicht selten nach der Pubertät zum Stillstand. Fibrose Dysplasien, ossifizierendes Fibrom, Meningiome (siehe dort). Nasales Gliom und Enzephalozele: Aus Astrozyten und spärlich Ganglienzellen bestehende Proliferate in den kranialen Anteilen der Nasenhöhle. Oft mit Verbreiterung des Nasenrückens einhergehend. MALIGNE TUMOREN DER NASE UND DER NASENNEBENHÖHLEN. Vorbem: Insgesamt seltene Tumoren bei Kaukasiern (1 % aller Malignome); häufiger in Asien und Afrika; 90% der Tumoren in Kiefer- und Nasenhöhle. Risikofaktoren: Holzbearbeitende Berufe (insbesondere Tropenhölzer), Textil-, Schuh-, petrochemische Industrie. Belastung mit Chrom, Nickel, Thorium, Kohlenwasserstoffen. Histologische Typen: Plattenepithelcarcinome und Varianten: 70 %, Adenocarcinome 6 %, Speicheldrüsentumoren 4 %, Lymphome 5 %, Melanome 2,4 % ,sonstige. Plattenepithelcarcinom: EPI:Nickel-, Leder -, Holz- Arbeiter PG: Durch Metaplasien des Schneiderepithels --> unreife Plattenepithelmetaplasie --> Dysplasie 1 - 3 --> invasives Plattenepithelcarcinom. Morphologie MA: Bröckelige weissliche Tumoren; Lymphknotenmetastasen bei Diagnosestellung in 10 %. MI: Atypische Plattenepithelverbände mit hyperchromatischen Zellkernen, gestörter Kern-Plasma-Relation +/- Verhornung; gelegentlich pseudoglanduläre Tumorzellanordnung. PRG: Inital strahlensensible Tumoren; spätere Strahlenresistenz. Adenocarcinome der Nasennebenhöhlen: EPI: Selten; starke Korrelation in Europa mit Staubbelastung in holzverarbeitenden Berufen (Eiche und Tropenhölzer); ferner Arbeiter mit Holzschutzmitteln,Farben und Lacken. Als Berufskrankheit anerkannte Fälle in Dtschl: 147 Fälle (1985-1998); abnehmende Tendenz (Wolf et al. Acta Otolaryng Suppl 535: 1-16 (1998). Morphologie MA: +/- gallertige bröckelige Tumoren. MI: Verschiedene Varianten: 1. Adenocarcinom vom Colontyp: Tubulär und tubulo-papillär angeordnete atypische Zylinderepithelien mit gestörter KernPlasma-Relation. 2.Adenoid- cystische Carcinome (Zylindrome): Cribrös gelagerte nur mässig pleomorphe Tumorzellen. Langsam wachsende jedoch incurable Tumoren (s.Speicheldrüsentumoren) Undifferenziertes Nasopharynxcarcinom: DEF: Sonderform des Nasennebenhöhlencarcinoms mit charakteristischer Morphologie und sehr schlechter Prognose (!). EPI: Selten in Nordeuropa; häufiger Tumor in Südostasien, Mittelmeerraum und Nordafrika. M : F = 3 : 1; 5. Lebensjahrzehnt. PG: Sehr enge Assoziation mit Epstein-Barr-Virus: EBV in ca. 80 % der asiatischen Fälle nachweisbar, in Europa nur in 20 %. Das EB- Virus wird dabei nicht in das menschliche Genom aufgenommen sondern liegt episomal. EBER-1 immer positiv,EBNA-2: immer negativ Morphologie MA: Grosse weiche weissliche destruierende Tumormassen. MI: Identisch mit lymphoepithelialem Carcinom Schmincke-Regaud der Tonsillen: Grosse Epithelien mit stark vergrösserten Zellkernen, zahlreichen Nukleolen und basophilem Cytoplasma; zwischen diesen epithelialen (!) Tumorzellen zahlreiche kleine reaktive (!) Lymphozyten.Overexpresssion von p53. PRG: Schlecht ( im Ggsatz zum lymphoepithelialen Ca der Tonsille!). Klassifikation der Karzinome des Nasopharynx nach UICC 1997 T1 T2 Nasopharynx Weichteile des Oropharynx und/oder der Nasenhöhle T2a Ohne parapharyngeale Ausbreitung T2b Mit parapharyngealer Ausbreitung T3 Infiltration von Knochenstrukturen und/oder Nasennebenhöhlen T4 Intrakranielle Ausbreitung und/oder Hirnnerv(en), Fossa infratemporalis> Hypopharynx> Augenhöhle N1 Unilateral, < 6 cm, über Supraklavikulargrube N2 Bilateral, < 6 cm, über Supraklavikulargrube N3 (a) > 6 cm/ (b) Ausdehnung in die Supraklavikulargrube SONSTIGE MALIGNE TUMOREN DES NASOPHARYNX Malignes Melanom: EPI: Selten; 5. Lebensjahrzehnt.Keine Assoziation mit EBV. Morphologie +/- schwärzliche Tumoren aus atypischen Melanozyten. Oft Tumorriesenzellen. PRG: Unvorhersehbar; teils schlecht, teils wesentlich besser als Melanome der Haut in vergleichbarer Grösse! 3-JÜR:60% Esthesioneuroblastom: EPI: Selten; Häufigkeitsgipfel im 2. und 6. Lebensjahrzehnt. .Keine Assoziation mit EBV. Morphologie MA: Polypoide weissliche, weiche Tumoren. MI: Kleine rundliche Tumorzellen (blue-small-round-cell-Tumor), nahezu keine Cytoplasma. Lagerung der Tumorzellen in Rosetten und Pseudorosetten. PRG: Häufig Metastasen und Einbruch in das ZNS. Lymphome: Lymphommitbeteiligung oder primäre MALT-Lymphome; s. dort. Chordome: S. Hirntumoren. LARYNX Vorbemerkung: Anatomie, Histologie: Larynxgrundskelett: Aufbau aus fünf Knorpeln: Schildknorpel (Cartilago thyreoidea), Ringknorpel (Crt. cricoidea), Epiglottis und den beiden Arytenoid-Knorpeln die untereinander durch Gelenke verbunden sind und durch die Skelettmuskulatur des KK stabilisiert werden. Daneben mehrere kleine Knorpel in den Bändern. Histologisch: bei Ngb. ausschliesslich aus hyalinem Knorpel bestehend; im Laufe des Lebens Umwandlung des Knorpels von Epiglottis, Arytenoiden und kleinen Kehlkopfknorpeln in elastischen Knorpel; im fortgeschrittenen Alter dystrophe Kalzifikationen des Larynx (Beginn im 2. Ljz) und +/- ausgeprägte Neigung zur partiellen Ossifikation (Ausnahme: Epiglottis die nie verknöchert) (dabei M>>F). Einteilung des KK- Binnenraums in drei Regionen: Supraglottisch, glottisch und subglottisch. Kehlkopf-Weichteile: Supraglottisch und infraglottisch: Auskleidung durch respiratorisches Epithel; an der Glottis +/- breites nicht verhornendes Plattenepithel, durch lange Reteleisten im Bindegewebe der Plica vocalis verankert. Häufig metaplastische Plattenepithelbildungen in den mechanisch belasteten Abschnitten der Epiglottis und den Arytenoidknorpeln. Darunter in der Lamina propria zahlreiche seröse und seromuköse Drüsen, spärlich Lymphgefässe und dünnwandige Blutgefässe. Zahlreiche seromuköse Drüsen in der Lamina propria des Taschenbandes; Mündung in den Sinus ventricularis Morgagni ( kontinuierliche Befeuchtung der Stimmlippen). Unter der Lamina propria das knorpelige Kehlkopfskelett (s.o..).Häufig lymphatisches Gewebe an der Epiglottis (sog. „Tonsilla laryngis“) Embryologie: Entwicklung aus dem Vorderdarm als Laryngotrachealrinnne (2.-3Woche), Abschnürung vom Oesophagus durch das Septum oesophagotracheale; Kehlkopfeingang aus drei Wülsten aufgebaut: Ventraler Wulst Epiglottis; laterale Wülste Ausbildung der Arytenoidwülste. 4. Und 5. Visceralbogen Schildknorpelplatten. Ausbildung der KK-Binnenmuskulatur im 2.Monat, der Stimmlippe im 3.Embryonalmonat. MISSBILDUNGEN VON LARYNX UND HYPOPHARYNX Missbildungen des Larynx EPI: schwere Missbildungen sehr selten: MO: Agenesie des Kehlkopfes: nur bei Acardius amorphus. Kasuistische Mitteilungen von Aplasien der Epiglottis, einzelner Schildknorpel oder des Ringknorpels . Sehr selten Atresie des Kehlkopfes (als Todesursache eines Ngb.), gelegentlich dorsale Schlusstörungen des Ringknorpels dorsale/ posteriore Larynxspalte. Oft Kombinationen mit anderen Missbildungen Laryngocele: durch Missbildung (oder Schleimretention, besonders nach Tbc.-Narben, erworbene?) hernienartige Aussackungen des Sinus Morgagni. Entwicklung in das Taschenband (=innere L.) oder durch die Membrana hyothyreoidea in die Halsweichteile (= äussere L.). Laryngocelen : 6,8% mit Kehlkopfkarzinomen assoziiert; Auftreten bei 2% von Gesunden, und 18% von KK-Karzinompatienten. Anm: Laryngocelenartige Luftsäcke physiologisch bei Brüllaffen. Dysontogenetische Halsfisteln und -zysten: SYN: Branchiogene Fisteln und Zysten. DEF: Durch unvollständigen Verschluss der Halsbucht („Kiemengänge“) entstehende Fisteln zwischen Haut und Pharynx; bei Verschluss der inneren als auch der äusseren Öffnung des Fistelganges Bildung von Halszysten. Morphologie: Laterale Halszyste/fistel: AE/PG: Persistenz von Resten der branchiogenen Gänge oder Kiemenfurchen. MA: Im oberen Halsdreieck, vor dem M.sternocleidomastoideus gelegene Zyste; schmierig rahmiger Inhalt. MI: Auskleidung der Zyste durch ein nicht-verhornendes Plattenepithel oder ein (tonsilläres) Transitionalepithel; darunter ein tonsillenähnliches hyperplastisches lymphatisches Stroma. Mediane Halszyste/fistel (Thyreoglossale Zyste):AE/PG: Bei der Descension der Schilddrüsenanlage vom Zungengrund in die spätere orthotope Stellung liegengebliebene Schilddrüsenparenchymreste. MA: in der Medianlinie zwischen Zungengrund , Körper des Os hyoideum und dem Proc. pyramidalis der Schilddrüse gelegene Fistelgänge und bis 2cm grosse Zysten. Bräunlicher, cholesterinreicher Cysteninhalt. MI: in den Zystenwänden +/- regressiv verändertes Schilddrüsengewebe: kleine Follikel mit kubischen Thyreozyten. (Selten: DD: Dermoidzysten am Zungengrund, mit Talggrüsen, Haarfollkeln und Schweissdrüsen in den Wänden). PRG: Lästig aber gut; manche Zysten manifestieren sich erst in der Pubertät. In sehr seltenen Fällen können sich Plattenepithelkarzinome aus lateralen Halszysten entwickeln (sog. „branchiogene Plattenepithelkarzinome ). Anm: Ws. sind dies nur Lymphknotenmetastasen von Plattenepithelkarzinomen bei nicht gefundenem Primärtumor. Verletzungen des Kehlkopfes Äussere Traumen: Kehlkopf- Frakturen bes. bei älteren Männern durch Einwirkung von Schlag, Erhängung, Erdrosselung (das Os hyoideum frakturiert dabei meist mit). KO: Erstickung durch Schleimhaut-Ödem und -Einblutung (selbst wenn die Schlinge wieder gelöst ist). Innere Traumen und Wegestörungen: Intubationstrauma: Häufig; meist belanglose submucöse Einblutungen; bei Dauerintubation Exulceration der Stimmlippe +/des Taschenbandes (=Decubitalulcus); bei Abheilung Intubationsgranulom (=Intubationspolyp): dichtgelagerte kleine Blutgefässe in einem ödematösen Stroma. +/- erodierte Oberfläche des Polypen. Bolustod: Tod durch aspirierte grössere Speisebrocken im Larynx („Wettessen“; Psychopathen, Säufer); Todesmechanismus dabei seltener Ersticken sondern eher reflektorischer Herzstillstand. (Der „Heimlich’sche Handgriff“ nützt wahrscheinlich in beiden Situationen gleich viel. In England und einzelnen US-Staaten zentrales Atemloch in Kinderbonbons um ein Ersticken bei Aspiration zu vermeiden). Stoffwechselstörungen des Larynx Amyloidose: Kehlkopfbeteiligung bei generalisierter oder lokalisierter A.: Ablagerung von gelblichen und weisslichem, derbfestem Amyloid in der KehlkopfSH.; rauhe Stimme. Xanthelasmen: Histiozytoide Schaumzellen in der Submucosa ( Diabetes mellitus; Lipidstoffwechselstörungen). Mucoidspeicherung im Kehlkopf: Plumpe, weisslich- polypoide Vorwölbungen (wenige mm gross) an der Plica vocalis ( Mucopolysaccharidosen; Myxödem/Hypothyreose; rauhe Stimme bei Akromegalie!). PRG: Insgesamt ohne klinische Bedeutung. KREISLAUFSTÖRUNGEN DES KEHLKOPFES Glottisödem, Larynxödem DEF: Schleimhautödem des (gesamten) Kehlkopfes, das bei stärkerer Ausprägung zum Erstickungstod führen kann. EPI: Als Ursache für einen plötzlichen Tod im allg. Obduktionsgut selten; im rechtsmedizinischen Untersuchungsgut viel häufiger. AE/PG: Vasomotorische Reaktion der Kehlkopfvenolen auf die Inhalation von Reizgasen (Nitrosegase! Starke Säuren, Rauchgase; Kampfgas LOST); allergische Ödeme (Quincke-Ödem; Medikamentenallergie: bes.Penicilline, Jod!); Insektenstich an Hals, Zungengrund oder Epiglottis. Fortgeleitete Entzündungen: Mundbodenphlegmone inflammatorisches Glottisödem. Morphologie: MA: Meist mehr an der Epiglottis und im Vestibulum laryngis als an der Glottis lokalisiertes wässriges Ödem; kissenartige Schwellung der Schleimhaut Einengung des KK-Lumen Erstickung ( Suffokationsstellung der Epiglottis: „schiffchenartige“ Deformation der Epiglottis. Anm: Bei längerer Leichenliegedauer kann die Ödemflüssigkeit aus der Schleimhaut absinken/verdunsten; Suffokationsstellung der Epiglottis und Tardieu-Flecken subpleural sind bessere Beweise dafür. MI: Wasserklare, proteinarme Ödemflüssigkeit in der Submukosa. PRG: Bei obduzierten Fällen schlecht. Sonst : vollständige Rückbildung. ENTZÜNDUNGEN DES KEHLKOPFES : LARYNGITIS Akute Laryngitis EPI: Sehr häufige unspezifische akute Laryngitis. AE: Irritativ (Schreien, Rauchen, Fussballspiel); Inhalation von Reizgasen; Infektiös (Adenoviren, Coxsackie-, Rhinoviren etc.). Morphologie: Hyperämie der Schleimhaut; +/- Fibrinbeläge, Verdickung der Ligg.vocales. PRG: Im allg. gut; bei rezidivierender oder chronischer Irritation chronische Laryngitis. SOFO: Diphtherische Laryngitis SYN: Kruppöse L, croupöse L, pseudomembranöse L. EPI: In Ländern der ersten Welt +/- ausgestorben (von gelegentlichen -und dann meist zu spät diagnostizierten Ausbrüchen abgesehen). In der 3.Welt nicht selten. Anm: Typisches Beispiel einer Pathomorphose: der Charakter einer Krankheit ändert sich innerhalb von Jahrzehnten von hochletal bis zu blandem Verlauf. AE: Corynebact.diphtheriae; bewegungslose Stäbchenbakterien (Dieterle-Färbung; Warthin-Starry-Färbung!); nur für Menschen pathogen; Übertragung durch symptomlose Carrier. PG: Vermehrung der Bakt. Im Schleim von Larynx und Pharynx; Bildung von Toxin Epitheldefekte weitere Nidation von Bakterien und Toxinbildung Ausgedehnte Epithelnekrosen Serumexudation Pseudomembranen in Larynx und Pharynx. Morphologie: MA: Festhaftende, gelblich-weisse durch Einblutungen auch bräunliche Pseudomembranen an Tonsillen, im Pharynx und Larynx; das Abziehen der Pseudomembranen petecchiale Einblutungen. Ödematöse Schwellung der Schleimhaut Atemnot Erstickung. MI: Breites fibrinöses Exudat mit nekrotischen Granulozyten, abgeschilferten Epithelien (und +/- sekundärer Besiedlung durch Bakterien und Sprosspilzen). Darunter in der Lamina propria ein nur mässiges, monozytäres und lymphozytäres Infiltrtat. Spätphase: Ablösung der Pseudomembranen, restitutio ad integrum. PRG: KO: Diphtherische Myokarditis( akutes Herzversagen) und Polyneuritis (N.glossopharyngeus!). Bester Schutz durch Schutzimpfungen! CHRONISCHE LARYNGITIS Chronische unspezifische Laryngitis EPI: Sehr häufig, M>>F; besonders 4.-7.Ljz.; meistens hypertrophische L., sehr selten atrophische Laryngitis. AE/PG: Irritationen: Rauchen, Stäube (Holzstäube!), Infektionen. Gastrooesophagealer Reflux? Anpassung der Schleimhaut an die Noxe durch Metaplasie des Epithels. Morphologie: MA: Weisslich verdickte Schleimhaut (=layngeale Leukoplakie) an den am stärksten belasteten Stellen. MI: Hypertrophische Laryngitis: Verbreiterung des Plattenepithels : Vermehrung der Basalzellen, Verbreiterung des Stratum spinosum ; oberflächliche +/- breite Verhornung (= laryngeale leukoplakische Keratose); Verlängerung der Reteleisten ; diffuse und follikuläre lymphozytäre Infiltrate in der Lamina propria. Atrophische Laryngitis: selten, Abflachung des Epithels. s.a. Coryza. PRG: Heiserkeit; Kontrollbedürftigkeit da: nicht selten nach Jahren Plattenepithelkarzinome. Chronische spezifische Laryngitis: EPI: inzwischen selten. Früher häufige Komplikation der grossen Infektionskrankheiten: Tuberkulose ( aerogen-canaliculäre Infektion bei offener Lungentuberkulose) oder bei Syphilis (Tertiär-Stadium; Paganini verstarb an seiner Kehlkopf-Lues). Morphologie: Tuberkulöse Laryngitis:MA: Verdickte grauweisse Schleimhaut mit knotiger Oberfläche. MI: Verkäsende Granulome in der Lamina propria; „pseudoepitheliomatöse Hyperplasie“ des überkleidenden Plattenepithels, die ein Plattenepithelkarzinom vortäuschen kann (und auch in ein solches übergehen kann). Luetische Laryngitis: MA: Gummöse Destruktion des knorpeligen Larynxskelets. MI: Gummata, Perichondritis. TUMOREN UND TUMORARTIGE LÄSIONEN DES LARYNX Vorbem: Pseudotumoren: reaktive (und deshalb prinzipiell +/- rückbildungsfähige ) polypoide Schleimhautvorwölbungen. Durch Phonationsstörungen lästig. Auch echte Tumoren des Larynx sind häufig; sie gehen i. allg. vom autochthonen oder metaplastischen Plattenepithel aus; mesenchymale Tumoren in der Lamina propria: selten; mesenchymale Tumoren der Larynxmuskulatur oder des knorpeligen Larynxskelets: kasuistisch mitgeteilte Raritäten. TUMORARTIGE LÄSIONEN DES LARYNX Stimmlippenpolyp AE: Chronische Irritation und Überlastung der Stimmlippe durch übertriebene oder falsche Phonation. (deshalb SYN: SchreierKnötchen, Unteroffiziersknötchen, Sängerknötchen, Schulmeister-Knötchen....) PG: Irritation Verbreiterung des Plattenepithels und Ausbildung eines subepithelialen Ödems chronisches inveteriertes Ödem (=Reinke- Ödem der Stimmlippen) lokale Schleimhautvorwölbung, Einsprossen von Blutgefässen, Thrombosen. Morphologie: MA: weissliche bis rötliche, nur wenige mm grosse breitbasige Knötchen meist am vorderen Drittel der Stimmlippe. MI: Teleangiektatischer Stimmlippenpolyp:plattenepithelial überkleidete Polypen; das Polypenstroma zell arm, fibrin- und hyalin durchtränkt; zahlreiche dünnwandige weite Blutgefässe; darinnen +/- zahlreiche Fibrinthromben. Granulationsgewebspolyp: (häufig nach Intubationen: Intubationsknötchen; Kontaktgranulom) +/- exulcerierte SH-Oberfläche; zahlreiche strotzend hyperämische Kapillaren; dazwischen Granulozyten, Histiozyten. PRG: Lästig aber gutartig. Wichtig als DD zu Kehlkopfkarzinom. Amyloidtumor des Larynx DEF: Solitäre, noduläre Amyloidablagerung PG: idiopatisch, kryptogen, essentiell; Kein Zusammenhang mit generalisierter Amyloidose. MA: bis 3cm grosser, harter, gelblich-weisser submucöser Knoten im Larynx Stridor. MI: Kongo-positives Amyloid. BENIGNE TUMOREN DES LARYNX Multiple Papillome des Larynx EPI: Häufigste Larynxtumoren im Kindesalter (meist multipel auftretend). Selten bei Erwachsenen . AE/PG: Durch HPV-Viren, bes. Typ 6 und 11. (Ws. aus Condylomen der Vulva bei der Geburt übertragen! ). Morphologie: MA: Meist mehrere - zahlreiche feinhöckerig- papilläre, rosa Tumoren an den Stimmlippen, im Vestibulum laryngis und in der Trachea; bis 0,5cm gross. MI: Vielschichtiges verhornendes Plattenepithel; im Stratum spinosum Koilozyten; feingliedriges gefässführendes Stroma. PRG: Rezidivfreudig; selten Entartung (im Kindesalter). Solitäres Papillom des Larynx EPI: Nicht selten; Erwachsene (4.-6.Ljz.) AE: ?, Irritation. Nicht durch HPV-Viren verursacht Morphologie: MA: Bis 1cm grosse grobhöckerige Tumoren im Larynx; starke Verhornung. MI: Schlanke papilläre Stromafäden von einem stark verbreiterten, Epitheldysplasien. Erhaltene Lamina basalis. PRG: Mässige Entartungstendenz; DD: Verrucöses Karzinom des Larynx (=Ackerman- Tumor). verhornendem Plattenepithel überzogen. +/- Granularzelltumor des Larynx EPI: Selten. Morphologie: Typische Granularzellen mit plumpem, von zahlreichen PAS-positiven Granula durchsetztem Zytoplasma, zentralen kleinen Zellkernen . Wichtig: Häufig über dem Tumor lokalisiertes Plattenepithel stark verbreitert und +/dysplastisch: Gefahr der Fehldiagnose eines Karzinoms. PRG: gut. MALIGNE TUMOREN DES LARYNX UND IHRE VORSTUFEN Plattenepitheliale Dysplasien und Carcinoma in situ EPI: 5.- 6.Ljz; M>>F; AE: Berufs- und Freizeit-bedingte Noxen (Cancerogene, Zigarettenrauch (>40Zigarettten = 13faches Risikio/ Alkoholiker: Alkohol wirkt als Cocarcinogen).: Andere Karzinome des Aerodigestivtrakts sind prädisponierend; relativer Schutz durch Östrogene; relative Gefährdung durch hohe Testosteron-Spiegel. Bei den extrem seltenen Larynxkarzinomen des Kindesalters: HPV- induzierte Papillomatose. Selten: Familiäre Belastung (möglicherweise bei Personen mit erhöhter Induzierbarkeit von Arylhydrocarbon-Hydroxylase). In 30-50% der Fälle Nachweis von HPV, besonders HPV 6+11.Multiple HPV-Typen in einer Zelle repliziert. PG: Irritation Epitheldefekte Regeneration Fehlregeneration Dysplasie Grad I-III Carcinoma in situ; da diese Vorgänge multitop ablaufen: multitopes CIS/Karzinom ( Cancer-Field- Theory). Begünstigung durch Vitamin-A-Mangel oder Vitamin B12/FolatMangel: Retrocriciodales Karzinom bei Plummer-Vinson-(=Patterson-Kelly)-Syndrom. Morphologie: MA: Weisslich verdicktes, aufgerauhtes Stimmband; Initialläsion am Übergang von resp. Epithel und Plattenepithel; vorderes Stimmbanddrittel (= keratotische Form); seltener: rötliche Areale (=erythroplakische Läsion) : meist Carcinoma in situ oder mikroinvasives Ca. MI: Vermehrung der Zellen des Stratum germinativum, Störung der Kern- Plasma-Relation und Hyperchromasie der Zellkerne. Atypische Mitosen. +/- ortho-- und parakeratotische Verhornung der Schleimhautoberfläche. Dysplasie Grad I: Dysplastische basaloide Zellen im unteren Drittel der Epithelbreite; Dysplasie Grad II: Dysplastische Zellen bis in das mittlere Drittel des Epithels; Dysplasie Grad III: Dysplastische Zellen bis in das obere Drittel des Plattenepithels; fliessender Übergang zu Carcinoma in situ: Stärkere Hyperchromasie der Zellkerne, mehr Mitosen „wilder“ als Dysplasie Grad III. Knospenartige Vorwölbung des Epithels nach der Tiefe zu; kein Durchbruch durch die Lamina propria (DEF!) EINTEILUNG DER KEHLKOPFKARZINOM-VORSTUFEN NACH KLEINSASSER ; PROGNOSE. Grad I Grad II Einfache epitheliale Hyperplasie, Akanthose, einfach atypisches Entartungsrisiko Ca 2-5% nach langer Zeit Epithel, Dysplasie. Keine Kernatypien Epitheliale Hyperplasie und mässige Dysplasie; Akanthose (oder Grad III selten Atrophie) des Epithels. Schwere Dysplasie und Carcinoma in situ; häufig mit invasivem Entartungsrisiko Ca PE-Carcinom an anderer Stelle des Larynx verbunden. 100% nach 5Jahren Zahlreiche Kernatypien Anm: Carcinoma in situ ist jedoch keineswegs obligate Vorstufen eines Plattenepithelkarzinoms des Larynx. „Zahlreiche“ invasive Plattenepithelkarzinome des Larynx entstehen spontan auf dem Boden einer hyperplastischen Laryngitis/ einfachen Hyperplasie. Invasives Plattenepithelkarzinom des Larynx DEF: Invasives Plattenepithelkarzinom: Durchbruch des malignen Epithels durch die Lamina basalis. EPI: Häufigkeitsgipfel von 55-65 Jahre (5-10 Jahre später als Dysplasien; s.o.); M:F= 25:1 (Karzinom mit höchster Geschlechtsspezifität - abgesehen von den reinen Genitalkarzinomen!). 12600 Fälle/Jahr in USA. AE/PG: s.o. Morphologie MA: Von der Glottis (und nur in Ausnahmefällen von anderen Lokalisationen: Epiglottiskarzinom!) ausgehende derbe weissgelbliche Tumoren; grobhöckerig aufgeworfene Oberfläche, meist deutliche Verhornung. Wachstum zunächst nur flachinvasiv (=mikroinvasives Karzinom) und horizontal entlang dem Lig.vocalis; später stark exophytisches Wachstum Verschluss des Larynx. Erst in der Spätphase Einbruch und Durchbruch durch den Knorpel äussere Halsweichteile. Lymphogene Metastasierung. Fernmetastasen nur in 10% aller Autopsie(!)-fälle. MI: Klassisches verhornendes Plattenepithelkarzinom: Durchbruch des Tumors durch die Lamina basalis; dabei Vergrösserung der Epithelien, der Zellkerne (Vergröberung des Chromatinmusters) stärkere Azidophilie des Zytoplasma, schärfere Zellgrenzen. Gruppierte und monocelluläre Verhornung, Ausbildung von Hornperlen. Nicht-verhornendes Plattenepithelkarzinom: kleinere Tumorzellen, hyperchromatische Zellkerne. Verrucöses Plattenepithelkarzinom= Ackerman-Tumor: Akanthopapillomatöse Verbreiterung der Schleimhaut durch gut differenzierte, an der Tumoroberfläche verhornende Plattenepithelien; kompakte „kirchturmspitzenartig“ aufgeworfene Hornlamellen an der Oberfläche ( „verrucös“). Nur selten erkennbarer Durchbruch des Tumors durch die Lamina basalis. Meist gute PRG. (Schwierige Diagnose an einer PE!) Spindelzellkarzinom und Carcinosarcom: Schlecht differenzierte Karzinome mit hyperchromatischen, pleomorphen Zellkernen und schmalem -spindelzelligem- Zytoplasma. IMMUN: Expression von Keratin und Vimentin in diesen Tumorzellen. Ws. sind ein Grossteil der sog. Carcinosarcome des Larynx .nur spindelzellig- entdifferenzierte Karzinome. Basaloides Carcinom des Larynx: Basaloide Tumorzellen in kompakter Lagerung; palisadenförmige Ausrichtung der Zellkerne an der Grenze zur Lamina propria.Schlechte PRG. PRG: Bei adaequater Therapie: nicht schlecht. Tod selten durch Fernmetastasen sondern meist durch Lokalkomplikationen (Tumorblutungen, Ummauerung der Halsgefässe ( Hirninfarkte), Tumorkachexie. Klassifikation der Karzinome des Larynx nach UICC 1997 Supraglottis Tl Ein Unterbezirk normal beweglich T2 Schleimhaut von mehr als einem Unterbezirk von Supraglottis/Glottis oder Schleimhaut eines Areals ausserhalb Supraglottis, keine Larynxfixation T3 Begrenzt auf Larynx, mit Stimmbandfixation, oder Invasion jenseits Postkrikoid, in präepiglottisches Gewebe, Basis Zunge T4 Ausbreitung durch Schildknorpel in Weichteile des Halses/Schilddrüse/ ösophagus Glottis T1 Auf Stimmbänder begrenzt/normal beweglich Tla Ein Stimmband T1b Beide Stimmbänder T2 Ausbreitung auf Supra- oder Subglottis/eingeschränkte Beweglichkeit T3 Stimmbandfixation T4 Ausdehnung jenseits des Larynx T2 T3 T4 N1 N2 Subglottis T1 Begrenzt auf Subglottis Ausbreitung auf Stimmband oder -bänder, normal oder eingeschränkt beweglich Stimmbandfixation Ausdehnung jenseits des Larynx Alle Bezirke Ipsilateral solitär < 3 cm Ipsilateral solitär > 3 bis 6 cm der Ipsilateral multipel < 6 cm Bilateral, kontralateral < 6 cm N3 >6cm Seltene Tumoren des Larynx Neuroendokrine Karzinome (s.Lunge), Adenokarzinome vom Speicheldrüsentyp (s.dort); Chondrome und Chondrosarkome des Knorpelskelets; Rhabdomyome der Kehlkopfmuskulatur. Unterer Respirationstrakt 16 LUNGE 16 Lungenmissbildungen: 16 Anomale Lungenlappungen: 16 Lungenhypoplasien und kongenitale Zwerchfellhernie. 16 Bronchopulmonale Sequestration: 16 Branchiogene Cyste: 17 Congenitale adenomatoide Malformation. 17 Forgut- Malformation: 17 (Motoyama: Nat.Gen. 20:54-7 (1998) 17 Kongenitale pulmonale Lymphangiektasie. 17 Frühkindliche Lungenstörungen. 17 Pulmonale hyaline Membranen: 17 Bronchopulmonale Dysplasie 17 Mekoniumaspiration: 19 Neugeborenenpneumonie: 19 Funktionsstörungen der Lunge: 19 Asthma bronchiale: 19 Chronische obstruktive Lungenerkrankung. 19 Chronische obstruktive Bronchitis. 19 Bronchiektasen: 20 Lungenemphysem: 20 DD: Alterslunge: 20 Durchblutungsstörungen der Lunge: 20 Pulmonale Hypertonie: 21 Lungenarterienthrombembolie: 21 Chronic thromboembolic pulmonary hypertension 22 PG. Monocyte- chemoattractant protein 1 (MCP1) ist hochreguliert. 22 MO: disseminierte Mikrothrombe in den pulmonalen Arteriolen; pulmonale Arteriosklerose.............. 22 (Kimura: Am.J.Resp. Crit Care Med. 164:319 (2001) 22 Lungengefässerkrankungen: 23 Pulmonalarteriensklerose: 23 Atemnot-Syndrom des Erwachsenen, Adult Respiratory Distress -Syndrome: 23 Stoffwechselerkrankungen der Lunge. 23 Amyloidose der Lunge 23 Pulmonale Kalzifikationen und Ossifikationen: 23 Pulmonale alveoläre Mikrolithiasis: 23 Pulmonale Alveolarproteinosen: 23 Lungenbeteiligung bei angeborenen Stoffwechselstörungen: 24 Entzündungen der unteren Atemwege 25 Akute Tracheobronchitis: 25 Bronchiolitis: 25 Sofo: Infantile Bronchiolitis obliterans: 25 Alveoläre Pneumonien. 25 Lobärpneumonie. 25 Sekundäre Pneumonien: 26 Bronchopneumonien und Herdpneumonien. 26 Nekrotisierende Pneumonie. 26 Legionärskrankheit. 26 Interstitielle Pneumonie. 27 Spezifische Pneumonien: Tuberkulose, Sarkoidose 27 Lungentuberkulose: 27 Mykobacterium avium intracellulare (MAI) 28 Weitere atypische Mycobakteriosen und BCG-Impfreaktion 28 Tularämie: 28 Sarkoidose der Lungen. 28 Chronische interstitielle Pneumonien ungeklärter Aetiologie und Lungenfibrosen. 29 Hamman- Rich- Lunge: 29 Staublungenerkrankungen, Pneumokoniosen. 30 Silikose. 30 Asbestose: 30 Anthrakose: 31 Organische Stäube: 31 Extrinsische allergische Alveolitis. 31 Lungentumoren 32 Lungencarcinome 32 Histologische Typen: 32 Adenocarcinome der Lunge: 33 Grosszelliges Lungencarcinom/Riesenzellcarcinom. 33 Benigne Tumoren und Tumoren geringerer Malignität von Lunge und Bronchien. 33 Hamartom: 33 Carcinoide der Lunge: 33 Sekundäre Lungentumoren: Lungenmetastasen. 33 Vergleichende Subklassifikation der morphologischen Differenzierung von Lungenkarzinomen .... 33 Pleura: 35 Pneumothorax: 35 Spannungspneumothorax: 35 Pleuraerguss: 35 Fibrinöse Pleuritis: 35 Eitrige Pleuritis: 35 Tuberkulöse Pleuritis: 35 Pleuraempyem 36 Pleurahyalinose: 36 Primäre Tumoren und tumorartige Läsionen: 37 Hyaline Pleuraplaques 37 Lokalisiertes fibröses Mesotheliom: 37 Maligne Mesotheliome. 37 Sekundäre Pleuratumoren: 37 Pleurametastasen, Pleuracarcinose. 37 UNTERER RESPIRATIONSTRAKT LUNGE Anatomische Vorbemerkung: Gliederung der Lunge in dreilappige rechte Lunge (400 - 450 g), zweilappige linke Lunge (350 - 400 g) ; beidseits jeweils Segment 1-10; das 7. Lungensegment existiert nur rechts. Bronchialsystem: Hauptbronchus:->Lappenbronchus Lungenlappensegment: zehn Segmentbronchien; zehn Lungensegmente. Dichotome Verzweigungen der Segmentbronchien in kleine Bronchien, Bronchiolen, sechs terminale Bronchiolen (= 1 Lobulus), ein terminaler Bronchiolus; Aufspaltung eines terminalen Bronchiolus in 3 Bronchioli respiratorii Ductus alveolaris Alveole. Histologie: I. Bronchus: Auskleidung durch Flimmerepithelien, Becherzellen und Reserve (= Basal)zellen. Mehrreihige Anordnung des Epithels; Basalmembran ;darunter die Bronchialdrüsen. Sowohl im Oberflächenepithel als auch in den Bronchialdrüsen endokrine Zellen = (Feyrter- ) Kultschitsky- Zellen (=Feyrter- Zellen; bilden u.a. Bombesin,Calcitonin, Serotonin und Leukencephalin; funktionell: ws.Hypoxierezeptoren) II. Bronchiolus: Auskleidung durch Flimmerepithel und Clara Zellen. (Max Clara- Zellen = Keulenzellen (wg. ihrer keulenförmigen Gestalt): apokrin -serös sezernierendes Epithel der Bronchiolen; bilden Hypophase der bronchiolären Flüssigkeit; darüber die zähere Epiphase. Clara-Zellen stehen unter ß-adrenerger Stimulation.Bildung von Surfactant-Apoproteinen und Proteinse-Inhibitoren. Typisches<Protein: Clara-Zell-spezifisches<Protein und Uteroglobin. III. Alveolen: Epithel Dünne und dicke Alveolarwandportionen Auskleidung der Alveolen durch Typ 1 (= membranöse) Pneumozyten; in den Winkeln der Alveolen Typ 2 (= kubische = granuläre) Pneumocyten (Bildung von Lamellarkörperchen; Bildung von Surfactant). Im Alveolarlumen Makrophagen/Hämosiderophagen. IV. Im Interstitium Kapillaren mit Endothelauskleidung und Verschmelzung der basalen Membran mit der alveolären Basalmembran. Fibroblasten, Kollagenfasern. Verbindung zwischen zwei benachbarten Alveolen durch die Kohn’schen Poren, die den Durchtritt von Surfactant Factor und Makrophagen und entzündlichem Exudat durch die Alveolarwände ermöglichen. Entwicklung der Lunge: Laryngotrachealen Rinne an der Vorderseite des Urdarmes (26. bis 28. Entwicklungstag): Aussprossung der Lungenknospen. Danach: frühembryonale Phase 4.-7Woche, pseudoglanduläre Phase 7. - 17. Woche, canaliculäre Phase 17. - 24. Woche, terminale Phase 24. Schwangerschaftswoche - Ende der Schwangerschaft. LUNGENMISSBILDUNGEN: Anomale Lungenlappungen: EPI: Häufig, 20% aller Autopsie- Fälle. AE: ? MO: Unregelmässige Septierungen der Lunge unterschiedlich tief ausgeprägt: breites Spektrum von oberflächlichen Furchen bis zu tiefen Einkerbungen. Fehlende Lungenlappen äusserst selten. PRG: per se bedeutungslos; sind jedoch oft Hinweis auf weitere cardiale und gastrointestinale Missbildungen. Lungenhypoplasien und kongenitale Zwerchfellhernie. EPI: 1 / 2.000 bis 5.000 Neugeborene; Lokalisation: links sehr viel häufiger als rechts. AE: : ? selten familiär. Reduktion des Hox NKx2-Faktors Exp.: Induktion von Lungenhypoplasie und Zwerchfellhernie durch Nitrofen am 8. SchwangerschaftsTag (Maus): Hypoplastische Ausbildung der Lungenperipherie. PG: Hochgradige Reduktion von Bronchien und Alveolen in der ipsilateralen Lunge; geringgradigere Hypoplasie der kontralateralen Lunge. Persistierende pulmonale Hypertension. MO: Reduzierter Gehalt an Bronchien und Alveolen; dickwandige Blutgefässe in der Lunge. Anm: Selten Lungenhypoplasien auch ohne Zwerchfellhernien bei Skoliose, Zwergwuchssyndrom. Potter- Syndrom (Nierenagenesie/Nierendysplasie- Syndrome), Anencephalie. Bronchopulmonale Sequestration: DEF: 1. Fehlende Verbindung zwischen normalen Luftwegen und dem in einer Lunge bzw. in der Thoraxhöhle sequestrierten Lungenteilstück und 2. Gefässversorgung nicht durch Lungengefässe sondern durch aberrierende Arterien aus der Aorta oder den Interkostalarterien. PG: Aberrierende Lungenknospe. MA: Spongiöses, nicht fibrosiertes Gewebe intralobär oder extralobär. Wenn gleichzeitig eine Vorderdarmabschnitten besteht: = bronchopulmonary foregut malformation. MI: +/- ausgereiftes Lungengewebe, gelegentlich eingelagerte Skeletmuskulatur. Verbindung zu den Branchiogene Cyste: PG: Akzessorische Lungenknospen aus dem Vorderdarm. MA: Cyste im Mediastinum, Thorax oder oberen Abdomen. MI: Auskleidung der Cyste durch Bronchialepithel; in der Cystenwand abgrenzbares Knorpelgewebe sowie gelegentl. Speicheldrüsengewebe. KO: Selten Malignisierung einer lateralen Halszyste Plattenepithelcarcinom. Congenitale adenomatoide Malformation. EPI: Selten bei Neugeborenen und Feten; Symptomatik häufig erst im Erwachsenenalter. PG: Hamartomatöser Missbildungstumor; ein möglicher Initialdefekt ist eine fetal erworbene Bronchialsegmentatresie. MA: In einem Lungenlappen eine flüssigkeitsreiche cystische Masse. MI: Multiple drüsenartige Strukturen mit einer Epithelauskleidung entsprechend unreifer oder dysplastischer Bronchiolen: Kubische bis hochprismatische Epithelien; nestartig zusammengelagerte schleimbildende Zellen. Komplikationen: Ausgangspunkt für Lymphoblastom und Rhabdomyosarkome. Therapie: Resektion. Forgut- Malformation: (Motoyama: Nat.Gen. 20:54-7 (1998) DEF:Oesophagus-Atresie, tracheopulmonale Fistel, Lungenanomliaen und Oeosophagus – und Trachealstenosen. EPI:bei 1:2000 bis 1:5000 Ngb in Japan. PG: Zink-Finger- Transskriptionsfaktoren Gli 1, Gli2 und Gli3 induzieren sekretorisches Glycoprotein sowie sonic hedgehog (shh)wirkt als endodermales Signal auf hindgut- und Lungenbildung; bei Gli2 -/- Oesophagusatresie. Gli2 und Gli3 defiziente Mäuse bilden keinen Oesophagus, Trachea und keine Lungen. MA: s.o. Kongenitale pulmonale Lymphangiektasie. EPI: Selten primär, öfter in Kombination mit einer Herz-Missbildung. MO: Massive Dilatation von subpleuralen und septalen Lymphgefässen. FRÜHKINDLICHE LUNGENSTÖRUNGEN. Pulmonale hyaline Membranen: PG: Unreife. MO: Überblähung von terminalen Bronchiolen und Ductus alveolares; ausgedehnte Nekrosen der Pneumozyten I. und II. Ordnung; Auskleidung der Alveolen und Bronchiolen durch homogene eosinrote Fibrinniederschläge. Bronchopulmonale Dysplasie Syn: Wilson- Mikity- Syndrom EPI: Häufig bei länger beatmeten Neugeborenen und Frühgeborenen. PG: Kombinationsschaden aus Sauerstoffeinwirkung und Barotrauma. Morphologie 1.Frühstadium: MA: Hyperaemische cyanotische Lungen. MI: hyaline Membranen; Bronchio- und Bronchiolektasie. Ein Teil der Bronchien von Plattenpithelmetaplasien ausgekleidet. Frühe septale Fibrose. 2.Subakutes Stadium: Bronchiolitis obliterans, Abbau der pulmunalen hyalinen Membranen, Proliferation von Pneumocyten Typ II. Perialveoläre Fibrose mit abwechselnd überblähten und kollabierten Lungenabschnitten . 3.Chronisches fibroproliferatives Stadium: MA: Endstadium Lunge (honeycomb-lung). Unregelmässige Gefässwandverdickungen; Plattenepithelmetaplasien. Anm: Das Krankheitsbild wurde ursprünglich als Missbildung angesehen und als Wilson-Mikity-Syndrom beschrieben. Mekoniumaspiration: PG: bei intrauteriner Asphyxie beginnende Atmung mit Fruchtwasseraspiration. Entzündungsreaktion auf Fruchtwasserbestandteile (Haare, Hornlamellen, Mekoniummaterial). MA: Hyperaemische, atelektatische Lungen. MI: Intrabronchiale und intraalveoläre reichliche (!) Fruchtwasserbestandteile nachweisbar; sie verursachen eine ausgeprägte Entzündungsreaktion intraalveoläre und intrabronchiale Granulozyten, Fremdkörperriesenzellen und Einblutungen (!) PRG: Unter Dexamethason-Tp.überleben 60% (wenn die ersten 28 Tage überstanden sind). Neugeborenenpneumonie: EPI: Todesursache bei 20 % der verstorbenen Neugeborenen (USA). PG: Aspiration von infizierter Amnionflüssigkeit bei vorzeitigem Fruchtblasensprung und konsekutivem Amnion- InfektionsSyndrom: (Erreger: Staphylococcen, Streptococcen, Chlamydien). Morphologie MA: düsterrote, hyperämische und atelektatische Lungen; Lungenabszesse. MI: massenhaft neutrophile Granulozyten in den Alveolen.. SOFO: Haemorrhagische Neugeborenen-Pneumonie: meist nach 24-48 Std. auftretende massive intrapulmonale Haemorrhagien. AE: ?, Unreife, Virusinfektionen, IRDS (=Infantile respiratory distress Syndrome), Hypothermie, Herzfehler. PRG: miserabel Exp.: detritus-freies Mekonium in Lungen injiziert Epithelnekrosen in Bronchien und Lungen durch Apoptose und Nekrose; Mekonium enthält reichlich Phospholipase A2 FUNKTIONSSTÖRUNGEN DER LUNGE: Asthma bronchiale: DEF: Erhöhte Reagibilität der Bronchien auf verschiedenste Reize verursachen paroxysmalen expiratorischen Stridor. EPI: Häufige Erkrankung: 3 - 6 % der US-Bevölkerung, vor allem Kinder und Jugendliche. Männer : Frauen = 3 : 2; Mortalität bei Menschen von 5 - 34 Jahren (USA): 0,4/100.000; die Mortalität bei Negern doppelt so hoch wie bei Kaukasiern. 2.000 Tote pro Jahr in England und Wales. Orte mit höchster Asthmamortalität: New York City, Philadelphia (hier jedoch unabhängig von der Luftverschmutzung !). Häufig Asthma bei Minority-Gruppen (Puertoricaner, Kubaner ..). PG: 1.Extrinisch-atopisches Asthma: Durch Allergien ausgelöste Überproduktion von IgE = Typ I-Reaktion. F>>M 2.Extrinsisch-nonatopisch es Asthma: Typ III-Reaktion. F>M. 3.Intrinsisches Asthma: Erwachsene, weniger starke Ausbildung. EPI: Erwachsene, Frauen > Männer. Morphologie MA: Volumen pulmonum auctum: Überblähung der Lungen; bei Eröffnung des Thorax bleiben die Lungen entfaltet und kollabieren nicht (<-Obstruktion der kleinen Bronchien). Häufig interstitielles Lungenemphysem und Emphysem von Mediastium und Halsweichteilen. MI: 1.im Intervall: Vermehrung von Becherzellen des respiratorischen Epithels; homogene Verdickung der Lamina basalis; eosinophile Granulozyten in der Lamina propria der Bronchien. Zytolyse und piece-meal- Degranulation der eosinophilen Granulozyten Anfall. 2.im Anfall: Spastische Einengung der Bronchiolen; zähe Schleimmassen mit Ausbildung von Epithelabschilferungen (= Creolakörperchen), Curschmann’schen Spiralen und Freisetzung von Charcot- Leydig’schen Kristallen im Schleim. KO: Mögliche Spätfolgen: Pulmonale Hypertonie, Lungenemphysem (?). Pneumonien, intrabronchiale Aspergillusbesiedlung! CHRONISCHE OBSTRUKTIVE LUNGENERKRANKUNG. SYN: (COPD-Chronik Obstructive Pulmonary Disease). DEF: Sammelbegriff für 1. Chronische obstruktive Bronchitis, 2. Bronchiektasen, 3. Bronchiolitis, 4. Emphysem. Chronische obstruktive Bronchitis. EPI: 20.000 Tote und 10.000.000 erkrankte in den USA (1983). 10 % der Bevölkerung. Endogen: Chronische Irritation (davon 90 % Raucher). COPD bei 5 % der Nichtraucher, 20 % der leichten Raucher und 30 % der starken Raucher. Luftverschmutzung, Arbeitsplatzbelastung. Exogen: Cystische Fibrose, Aspiration, Immunabwehrschwäche. MA: Hyperaemie der Bronchialschleimhaut, vermehrt zäher Schleim intrabronchial; Hypertrophie der Bronchialmuskulatur (-> strickleiterartige Umwandlung der Bronchialschleimhaut); Dilatation der Bronchien (-> zylindrische Bronchien).Dilatation der Bronchialdrüsenausführungsgänge, als kleine Punkte sichtbar. Hustenfurchen der Leber: In sagitaler Richtung verlaufende Furchen der Facies diaphramatica der Leber. MI: Hyperplasie von Becherzellen und Reservezellen sowie von Bronchialdrüsen. Erhöhung des REID- Index = Dicke der Bronchialdrüsenzone / Breite der Bronchialschleimhaut insgesamt (normal 0,36 - 0,41; Bronchitis: 0,44 - 0,79). Plattenepithelmetaplasien der Bronchialschleimhaut insb. an den Carinen. Bronchiektasen: Tubuläre Bronchiektasen: Erworbene zylinderförmige Bronchiektasen, bis unter die Pleura aufschneidbar. Der Bronchiendurchmesser darinnen grösser als jener der begleitenden Lungenarterie. Sakkuläre Bronchiektasen: Angeboren; Meist ganzer Lungenlappen oder ganze Lunge befallen; mukopurulentes Sekret in den Aussackungen.(Konzept der „angeborenen Bronchiektasen“ ist fraglich da bislang keine eindeutigen genetischen Zusammenhänge nachgewiesen werden konnten und keine sakkulären Bronchiektasen bei Kleinkindern und Neugeborenen beschrieben wurden). LUNGENEMPHYSEM: DEF: Permanente abnorme Vergrösserung eines Teiles oder des ganzen Lungenacinus unter Destruktion des Lungengewebes. AE/PG: Emphysementstehung: Experiment: Proteaseninstellation in Mäuselungen führt zu panlobulären Lungenemphysem in wenigen Tagen. Daraus abgeleitet: Lungenemphysementstehung durch Störung des Protease-Antiproteasegleichgewichts. (Proteasen aus neutrophilen eosinophilen Makrophagen; Antiproteasen: Alpha 1 Makroglobulin (Serum)=Alpha 1 Antritrypsin: Alpha-1-Antitrypsinmangel: Wird durch zwei Allele (=Proteinase-Inhibitor -Allel=PI) mit ca. 30 verschiedenen Typen kodiert. Am häufigsten : PMM=gesund; PIZZ: nur 10 % der normalen Alpha 1 Antitrypsinaktivität vorhanden; Ausbildung von Leberzirrhosen im Kindesalter, von Lungenemphysem beim Erwachsenen).Bei PMZ=Heterozygot=60 % der normalen Alpha 1 Antitrypsinaktivität vorhanden. Lokale Destruktion von Alpha 1 Antitrypsin durch Zigarettenrauch (Oxidation des Cysteins). Klin: COPD-Typ A: Pink puffer: Panacinäres (=panlobuläres) Emphysem; trockener Husten, erhöhtes Residualvolumen, reduzierte Vitalkapazität. Hyperventilation (Dyspnoe). Kastenthorax. COPD-Typ B: Blue bloater: Chronische Bronchitis +/- zentrilobuläres /panacinäres Emphysem. Mukopurulentes Sputum, häufig Infektionen. Bronchialstenose -> Hypoventilation; PO 2 PCO2 CO 2 Narkose! Makroskopisch/mikroskopische Formen: Zentrilobulär=proximal acinäres Lungenemphysem. Häufigste Form des Lungenemphysems; oft bei Rauchern: Ausweitung von Ductus alveolares und terminalen Bronchiolen. Panacinär: Gesamter Lungenacinus betroffen. AE: : Alpha 1 Antitrypsinmangel (s.u.), Distal acinär=paraseptales Emphysem: Seltenste Form an Stellen des stärksten Donders’schen Unterdrucks. Irreguläres Emphysem (=Narbenemphysem): In der Umgebung von Lungennarben Ausweitung der Acini. Komplikationen des Lungenemphysems: Cor pulmonale: Hypoxaemie-> Pulmonalarterienkonstruktion, Pulmonalhypertonie mit adaptiver Rechtsherzhypertrophie. Pulmonalvenensklerose bei 50 % der Patienten (induziert durch Vasokonstriktion oder Linksherzunsuffizienz). Begünstigung der Entstehung von Bronchopneumonien. Tp.: u.a. Lungentransplantation. DD: Alterslunge: DEF: Kein Emphysem da es eine regelhafte Entwicklung im Alter darstellt. Aber: Exp: Mäuse in keimfreier und allergenfreier Umgebung entwickeln keine Alterslunge. MA: Bräunliche leicht kollabierende Lunge („welke Alterslunge“). MI: Zunahme des Hohlraumdurchmessers in allen Lungenabschnitten. Reduktion der Alveolen. Verminderung des elastischen Bindegewebes (?). DURCHBLUTUNGSSTÖRUNGEN DER LUNGE: Pulmonale Hypertonie: (Klassifikation der pulmonalen Hypertonie ; WHO-Konferenz 1998, Evian) Primäre pulmonale Hypertonie Pulmonale arterielle Hypertonie - Sporadisch : assoziiert mit speziellem Phänotyp der glatten Muskulatur. - Familiär Assoziiert mit - Bindegewebserkrankungen - Angeborenen Shunt-Vitien - Portaler Hypertonie - HIV-Infektion Medikamenten und Toxinen - Persistierender pulmonaler Hypertonie des Neugeborenen - Sonstigen Formen Pulmonal venöse Hypertonie Erkrankungen des linken Vorhofs oder linken Ventrikels Klappenvitien des linken Herzens Extrinsische Kompression der Pulmonalvenen Pulmonale venookklusive Erkrankung Sonstige Formen Sekundäre pulmonale Hypertonie bei Erkrankungen des respiratorischen Systems und/oder Hypoxämie chronisch obstruktive Lungenerkrankungen Interstitielle Lungenerkrankungen Schlafbezogene Atemstörungen Hypoventilationssyndrome Chronischer Aufenthalt in großen Höhen Angeborene Lungenerkrankungen Sonstige Formen Pulmonale Hypertonie infolge chronischer thrombotischer und/oder embolischer Prozesse Chronisch rezidivierende Thrombembolien Obstruktion der distalen Pulmonalarterien - Embolisch (Thromben, Tumormaterial, Parasiten, Fremdkörper) - In-situ Thrombosen - Sichelzellkrarikheit Pulmonale Hypertonie durch Erkrankungen mit Beteiligung der Lungengefäße Entzündlich - Schistosomiasis - Sarkoidose Sonstige Formen; Pulmonale kapilläre Hämangiomatose. Chronic thromboembolic pulmonary hypertension s.u. MA: Erweitertes Lumen der Pulmonalarterien (ihr Durchmesser überschreitetet den des begleitenden Bronchus); Verdickung der Pulmonalarterienwand; gelbliche plaqueartige Lipideinlagerungen in die Intima --> Pulmonalarteriensklerose; Ausbildung von Atherombeeten. MI: Wandhypertrophie, Intimazellproliferation ; bei längerem Bestehen: Ausbildung von Haemangiom- ähnlichen Gefässkonvoluten ( sog. "plexiforme Läsionen"); Endstadium: nekrotisierende Arteriitis und thrombangitischer Verschluss der Gefässe; Graduierung I-VI; ) PRG: Leichte Formen reversibel, schwere Formen (plexiforme Läsionen) irreversibel. Lungenarterienthrombembolie: EPI:Häufige, überraschende Todesursache bei bettlägerigen Patienten besonders nach der ersten Mobilisation. Adipöse Patienten = Risikopatienten. Lungenarterienthrombembolien bei Durchzug von Wetterfronten besonders häufig. PG und Morphologie: Abschwemmen einer nicht bindegewebig organisierten (Abscheidungs- oder Gerinungs-) Thrombose aus Bein- oder Beckenvenen mit dem Blutstrom durch das rechte Herz in den Truncus pulmonalis und die Lungenarterien. Der weitere Verlauf abhängig von Grösse und Zahl der Lungenarterienthrombembolien: Kleine Thrombembolien: Keine wesentlich Symptomatik; bindegewebige Organisation unter Ausbildung von „Strickleiter“Thromben in den Pulmonalarterien. Zahlreiche rezidivierte kleine Lungenarterien Thrombembolien können zur pulmonalen Hypertonie führen (Morbus Ayerza). Mittlere Grösse der durch Thrombembolie verschlossenen Lungenarterien: Kompensatorische Erweiterung der Bronchialarterien (systemischer Kreislauf!) nach Verschluss einer Lobulararterie, Hyperämie. Grosse Lungenarterien durch Lungenemboli verschlossen: -->Reflektorischer Herzstillstand; subakutes Rechtherzversagen: Dilatation des rechten Ventrikels, Stauungsblutfülle der grossen Venen (bes. auffällig: Stauung der Hals- und Kopfvenen).Häufig zunächst kleine (= „prämonitorische“) Lungenembolie, danach: Massive= Fulminante Lungenarterienthrombembolie: (fulmen=Blitz) Klin: Plötzlich massive Verschlechterung des Krankheitszustandes; Kollaps, Einflussstauung. PG: wenn > 50 % der Lungenstrombahn verlegt sind-> akutes Cor pulmonale. Letalität dabei 50 %. Mechanische Obstruktion per se ist jedoch als Todesursache unwahrscheinlich da Ballonokklusion oder Lungenresektionen etc. kein Rechtsherzversagen verursachen. Deshalb Hypothesen für das Todesgeschehen: 1. Vagaler Reflex -> Spasmus von Coronararterien und Pulmonalarterien. 2. Reflex-> Periphere Vasodilatation. 3. Reflektorischer Herzstillstand durch Vagusreizung. 4. Massive Freisetzung von vasoaktiven Substanzen aus den Thrombozyten -> Pulmonaler Vasospasmus. Sofo: Andere Lungenarterienembolien: Paradoxe Embolie: Passage eines Thrombembulus durch ein offenes Voramen ovale in den linken Vorhof und von dort in den systemischen Kreislauf. Voraussetzung: Rechtsatrialer Druck> als Linksartrialer Druck, z. B. bei akuter pulmonaler Hypertonie in Folge einer fulminanten Lungenarterienthrombembolie. Luftembolie (100 ml können letal sein, 200 ml wurden toleriert) im allgemeinen klinischer Effekt bei 40 ml injizierter Luft. Fettemboliesyndrom: Massive Freisetzung von Fettzellen und Fett durch Trauma (Multitrauma, Oberschenkelfrakturen, Oberschenkelnagelungen) bei reduzierter Fettabbauleistung der Lungen: Pulmonale Hypertonie und Rechtsherzinsuffizienz 24 - 72 Stunden nach dem Trauma. Zerebrale Symptomatik durch Fettembolien im Gehirn nach Passage der Lungenstrombahn durch die Fetttröpfchen nach 72 - 96 Stunden. Lungeninfarkt: Lungenarterienthrombembolie bei gleichzeitiger Linksherzinsuffizienz: Entstehen eines Lungeninfarkts. MA: Massive Hyperaemie und zunehmende Einblutungen in ein keilförmiges Lungenareal distal des verschlossenen Pulmonalarterienastes. mi: Initialphase: Hochgradige Kongestion sämtlicher Blutgefässe; Einblutungen in die Alveolen. Scharfe Demarkation zu den belüfteten übrigen Lungengewebe ( Spätphase:Abräumung mit Hämosiderinablagerung und Restitutio ad integrum oder bindegewebige Organisation unter Ausbildung einer Lungennarbe. Häufig oberflächliche fokale Pleuritis über dem Infarkt. CHRONIC THROMBOEMBOLIC PULMONARY HYPERTENSION PG. Monocyte- chemoattractant protein 1 (MCP1) ist hochreguliert. MO: disseminierte Mikrothrombe in den pulmonalen Arteriolen; pulmonale Arteriosklerose. (Kimura: Am.J.Resp. Crit Care Med. 164:319 (2001) LUNGENGEFÄSSERKRANKUNGEN: Pulmonalarteriensklerose: AE: : Längerbestehende pulmonale arterielle Hypertonie durch Linksherzinsuffizienz, Lungeneigenerkrankung (Emphysem, Tuberkulose), Herz- oder Gefässmissbildungen; konsekutiv bei chronischer Hypoxie und Bergvölkern (Himalaya, Anden). MA: Erweiterte, gelbliche Lungenarterien; Ausbildung flacher Atherombeete; Vermehrung kollagenen und elastischen Fasern. MI: Beteiligung kleiner Blutgefässe bei starker pulmonaler Hypertonie: Ausbildung zwiebelschalenartiger Intimafibrose kleiner Arterien; Gefässknäuelbildungen (=plexiforme Läsionen). Atemnot-Syndrom des Erwachsenen, Adult Respiratory Distress -Syndrome: PG: Bei hypovolaemischen Schock: Prolongierte Vasokonstriktion der Lunge-> ischämische Alveolarepithelnekrosen. Bei Sepsis zusätzlich: Endothelnekrosen durch Endotoxine gramnegativer Bakterien. Bei pankreatitischem Schock: Phospholipase induzierte Endothel- und Pneumozytennekrosen. Bei Inhalation von toxischen Gasen: Direkte Pneumozytennekrosen. EPI: Schocklunge= häufigste Komplikation bei Schock (50,3 % aller Patienten mit schwerem Schock), 150.000 Schocklungenfälle/Jahr in USA. Morphologie Frühphase (1-3.Tag) MA: Schwere düsterrote Lungen mit relativ trockener Schnittfläche (interstitielles Lungenödem fliesst nicht so leicht ab wie intraalveoläres Lungenödem!). MI: Massives interstitielles Ödem, insbesondere in den Bindegewebsräumen um die Venolen. Verbreiterung der Alveolarsepten; Nekrose von Pneumozyten I. Vermehrt surfactant in Pneumozyten II. Inaktivierung des Surfactant-Factors durch Serumbestandteile-> Ausbildung von Atelektasen. Intermediärphase:( 3. - 14. Tag): MA: Schwere , rot-gelb-bunte Lungen; aufgerauhte, fibrinbelegte Pleura. MI: Zunehmende pulmonale hyaline Membranen; beginnende Organisation der pulmonalen hyalinen Membranen, Reepithelisierung der Alveolarwände durch regenerierende Pneumozyten (kubische Pneumozyten=kuboide Mataplasie). Spätphase: MI: Organisation und Abbau von pulmonalen hyalinen Membranen. Restitutio ad integrum oder irreguläre Lungenfibrosenbildungen. Komplikation: In Intermediär- und Spätphase häufig sekundäre Bronchopneumonien. Letalität bei ARDS: 50 % (10 - 90 %). STOFFWECHSELERKRANKUNGEN DER LUNGE. Amyloidose der Lunge AE: : Generalisierte primäre oder sekundäre Amyloidose. PG: Noduläres AL –Amyloid auch bei Mb.Sjögren und infolge iv-Drogenmissbrauch. MA: 1..Diffuse perivasale und intraseptale Ablagerungen von Amyloid (AA) Konsistenzvermehrung. 2.Tumoröse Ablagerungen von Amyloid: 5 - 10 cm grosse knollenartige Ablagerungen von Amyloid im Lungengewebe subpleural MI: Amyloid (Kongofärbung: rot; im polarisierten Licht grüngelbe Metachromasie). und DD: Altersamyloid in der Lunge: Transthyretin- Amyloid; Kein Nachweis mkit anderen Amyloidantikörpern. Durchschnittsalter 83 Jahre. Pulmonale Kalzifikationen und Ossifikationen: Pulmonale alveoläre Mikrolithiasis: DEF/MO: Kleine 3 mm grosse, die Alveolen ausfüllende Kalkkugeln. Seltenes Vorkommen; Dendritiforme pulmonale Ossifikation und disseminierte noduläre pulmonale Ossifikation: Irreguläre, die Alveolen und Ductus alveolares ausfüllende Kalkniederschläge. Häufig bei chronischer Stauungsblutfülle. Pulmonale Alveolarproteinosen: DEF:Intraalveoläre Aneicherung von Proteinen und Surfactant-Bestandteilen; dadurch zunehmende respiratorische Insuffizienz. AE/PG: Unterschiedliche Formen: genetisch bedingt: 1.Mutationen des surfactant-Protein B, die zu kompletter Surfactant-Protein- Defizienz führen (insges. z.Zt.21 Mutationen bekannt; Gen auf Chromosom 2; Aufwendiges Processing des Proteins im Pneumozyten Typ2.). Genfrequenz 1:3000. Autosomal rezessiv.50% Letalität in den ersten 5 Jahren. 2.Defekte der gemeinsamen ß-Kette des GM-CSF/IL-3- und IL-5-Reteptors. erworben: "sekundäre" Formen bei AIDS, myeloischen Leukosen, Lymphomen und Gammopathien nicht selten. Als Ko bei Lipidpneumonie, Staubinhalation (AL, TI- Staub) und medikamentös (alkylierende Zytostatika; Antidepressivum Iprindol) .Selten letal. MA/RÖ: Perihiläre intersitielle Fibrose ("Bat-Wing-Sign") und unregelmässiges Pflastermuster im CT ("Crazy paving pattern"). MI: Ausfüllung der Alveolen durch +/- grobgranuläres, PAS-positives Alcian-negatives Material; sekundäre interstitielle Fibrose der Alveolarsepten und Besiedlung durch Bakterien/Aspergillus. Lungenbeteiligung bei angeborenen Stoffwechselstörungen: Morbus Gaucher, Mb.Niemann-Pick, Morbus Fabry und Mb.Pompe Erkrankungen (Typ II Glykogenose). ENTZÜNDUNGEN DER UNTEREN ATEMWEGE Akute Tracheobronchitis: EPI: Häufige Erkrankung, besonders Jugendliche, Abwehrgeschwächte, Bettlägerige. AE: : Bakterien (Staphylococcen, Streptococcen, Haemophilus, Klebsiellen, Bordetella). Mykoplasmen (Mykoplasma pneumonie, Chlamydia trachomatis). Viren (Rhino- Corona- Influenza- Parainfluenza-, Adenoviren). Ma: Hochrote Trachea und Bronchien mit Fibrinbelägen, reichlich Schleim (mukopurulente Tracheobronchitis), Geringe Einblutungen. mi: Epithelnekrosen, Granulozyten, Fibrinniederschläge. Sonderformen der Tracheobronchitis: Nekrotisierende Tracheobronchitis: Ausgedehnte Epithelnekrosen; Einblutungen in die Trachea. Plattenepithelmetaplasien des Regenerationepithels (besonders bei Influenza und Parainfluenza). Lymphoplasmazelluläre Bronchitis/Bronchiolitis: Mykoplasmapneumonie. Pseudomembranöse Tracheobronchitis: Ma: Festhaftende aus Fibrin- und Detritusmaterial bestehende Pseudomembranen über der nekrotischen Schleimhaut. Beim Abziehen dieser Pseudomembranen: Ausbildung petecchialer Blutungen. Pseudomembranös=diphtherisch (dabei meist zusätzlich „Stiernacken“ durch Schwellung der Halsweichteile, Lymphadenitis, Fieber, Tachykardie, gelegentlich Myocarditis und Neuropathie) Chronische Bronchitis s.u. COPD: Bronchiolitis: DEF: Spektrum von minimalen bis schwersten Erkrankungen. PG: Rauchen, inhalative Reizstoffe (Nitrosegase), Virusinfekte, idiopathisch. MI: Becherzellhyperplasie der Bronchiolen; Epithelabschilferungen, Granulationsgewebe. Peribronchiale lymphozytäre Infiltration. Sofo: Infantile Bronchiolitis obliterans: EPI: In den ersten zwei Lebensjahren durch Respiratory-Syncytial-Virus, Parainfluenza, Mykoplasma Masern oder Keuchhusteninfektionen. Gel.nach Lungentransplantation; Kritische Rolle dabei: Chemokine MCP1/CCR2 MA: Emphysematöse Blähung der Lungen. MI: Lymphozytäre Infiltrate, Epithelnekrosen, Plattenepithelmetaplasien der Bronchiolen Destruierende Bronchiolitis; Obliteration des Bronchiallumens durch Granulationsgewebe. Nachweis von RSV durch in-situ-Hybridisierung. SOFO: BOOP= Bronchiolitis obliterans obstructive Pneumonia Swyer-James- Syndrom: Unilateral hyperlucent lung due to bronchiolitis obliterans and pulmonary artery hypoplasia ALVEOLÄRE PNEUMONIEN. DEF: Entzündliches Infiltrat intraalveolär. Ausbreitung von Alveole zu Alveole über die Kohn’schen Poren bei reichlichem Exudat Konsolidierung der Lunge. Erreger meist extrazellulär. Primäre Pneumonien dabei verursacht durch virulente Erreger bei zuvor Gesunden; sekundäre Pneumonien als Folge einer Grunderkrankung (Abwehrschwäche, Bettlägerigkeit, Schleimretention). Erreger meist Bakterien geringer Virulenz (Mischflora). Lobärpneumonie. EPI: 40 - 80 % aller ausserhalb des Krankenhauses erworbenen Pneumonien. Prädisposition: Kinder, Alte, Alkoholiker, Leberzirrhose, Sichelzellanämie. Erreger: Streptococcus pneumonie; 80 verschiedene Serotypen, besonders Serotyp 1 - 8 . Virulenz des Erregers korreliert mit Ausbildung der Polysaccheridkapsel. Morphologie MA: Nur ein oder zwei Lungenlappen von der Pneumonie befallen; die übrigen Lungenlappen +/- unverändert. Phasenhafter zeitlicher Ablauf der Pneumonie in allen Abschnitten des befallenen Lungenlappens. Dabei Ausbreitung von Pneumococcen und entzündlichem Exudat von Alveole zu Alveole über die Kohn’schen Poren. Anschoppungsphase (24 - 48 Stunden): MA: Düsterroter schwerer ödematöser Lungenlappen. mi: Hochgradige Hyperaemie der alveolären Kapillaren; wandhaftende Granulozyten, Granulozyteninfiltration in das Interstitium. Proteinreiches hämorrhagische Lungenödem. Klin: Hohes Fieber; Krepitatio indux, „pflaumenbrühartiges“ Sputum. Rote Hepatisation (3. - 5. Tag). MA: Fester, „leberartiger“ befallener Lungenlappen durch Verfestigung des haemorrhagische Exudats durch Fibrinausfällung. Graue Hepatisation (5. - 9. Tag). MA: Schwere befallene Lunge (Lungengewicht 1 - 2 kg); graurote Ober- und Schnittfläche; trockene Schnittfläche abstreifbare Fibrinpfröpfe. Beginnende Reperfussion über die Bronchialarterien. Stadium der Lösung (gelbe Hepatisation), Lyse (am 7., 9. oder 11. Tag). MA: Verringerung der Konsistenz des befallenen Lungenlappens; gelbe putriden Schnittfläche. MI: Einwandern von Granulozyten in das Exudat; Auflösung des Exudats durch die Proteasen aus Granulozyten und Makrophagen; Exudat teilweise expektoriert, teilweise in den Kreislauf aufgenommen. Klin: In dieser Phase durch die Mobilisation des Exudats stärkste Kreislaufbelastung. Verlauf als Krisis mit Schüttelfrost oder protrahierter Lysis. Häufigster Todeszeitpunkt bei Lobärpneumonie. Verlauf: Restitutio ad integrum: Im allgemeinen folgenlose Abheilung der Pneumonie; nach 14 Tagen wieder Entfaltung der Lunge (Krepitatio redux). Selten inkomplette Lösung des Exudats; Infiltration der Fibroblasten: Karnifizierte Pneumonie. KO: Fibrinös eitirige Pleuritis; Pleuraempyem; Bakteriämie und Sepsis (Letalität trotz Antibiose:20 - 30 %). Anm: Unter Antibiotikatherapie und bei Streptococcus pneumonie Typ IV bis VI. häufig atypische Lobärpneumonien: Kein eindeutiger phasenhafter Ablauf, kein exakt umschriebener lobärer Befall. Andere primäre Pneumonien: beta-hämolytische Streptococcenpneumonie AE: Streptococcus pyogenes, Str. agalaktiae. Kinder, Komplikation nach Virusinfekten. MA: Lobuläre Pneumonie. mi: Blutiges oder eitriges Exudat. Staphylococcus-aureus-Pneumonie: Kleinkinder. MA: Eitrig-hämorrhagisches Exudat. Dunkle Lungen, thrombosierte Lungengefässe->abszedierende Pneumonie nach 2 - 3 Tagen. Fibrose und multiple Abszesshöhlen nach 7 Tagen. Ausgeprägte Begleitpleuritis. Klebsiellen- Pneumonie (=Friedländer’sche Pneumonie). EPI: Männer + Säufer, Diabetiker, konsumierende Erkrankungen. Nur 1 % der Pneumonien aber hohe Letalität (zur Zeit 50 %!). MA: Grosser schwerer befallener Lappen; Abszessbildungen. mi: Makrophagenreiches Exudat; lebhafte Granulationsgewebsbildung nach einer Woche. SEKUNDÄRE PNEUMONIEN: Bronchopneumonien und Herdpneumonien. EPI: Häufigste Pneumonie im Sektionsgut; kritische Begleiterkrankung zahlreicher anderer Grunderkrankungen; häufigste krankenhauserworbene Pneumonie. AE: /PG: : Bakterien geringerer Virulenz (E.coli, Pseudomonas, Hämophilus influencae, Mischflora). In Lungenödem/Bronchialsekret gefüllten abhängigen Lungenpartien beginnend. MA: Fleckförmiger disseminierter Befall der Lungen beidseits in Anlehnung an die Bronchien. Perifokale Ödembildung. mi: Multiple Pneumonieherde mit unterschiedlichem Entwicklungsalter: Teils im Stadium der Anschoppung, teils im Stadium der Lyse. Exudat: Fibrin, Pus. KO: Pleuritis, Mediastinitis, infektiös-toxisches-Rechtsherzversagen. Nekrotisierende Pneumonie. DEF: Nekrotisierende Pneumonien mit raschem , oft letalem Verlauf .Ausgedehnte Nekrosen des Lungengewebes, hämorrhagisches Exudat. AE: : Yersinia pestis: Erreger selten in Wildtieren in USA; selten menschliche Infektionen. Bubonenpest: An der Flohbissstelle (=Primäraffekt). Eingeblutete Nekrose; Lymphadenitis im Abstromgebiet. Sekundärer Befall der Lunge oder primär durch Inhalation des Erregers (=primäre Lungenpest). MA: Haemorrhagisch- nekrotisierende Pneumonie. MI: Granulozyten, Erythrozyten und Detritusmaterial in den Alveolen; plumpe stäbchenförmige Erreger in grosser Zahl nachweisbar. Legionärskrankheit. Erreger: Legionella pneumophila (gramnegativer Bazillus, durch Dieterle Färbung darstellbar). In 80 % benigne subakute Pneumonie; in 20 %, besonders bei Abwehrgeschwächten letale Nekrotisierende Pneumonie. INTERSTITIELLE PNEUMONIE. DEF: Pneumonie mit entzündlichem Exudat (Lymphozyten, Monozyten, Plasmazellen) in Interstitium der Alveolarsepten, im perivasalen Bindegewebe und perilobulär. AE/PG: Erreger: Mykoplasmen ( Mycoplasma pneumoniae , M. psitacci).Viren (Influenza, Parainfluenza, Respiratory-SyncytialVirus, Adenoviren, Cytomegalieviren, Herpes). Rickettsien: Coxiellea burneti. Pneumocystis carinii. MA: Schwere, röntgenstrahldichte Lungen mit trockerener Schnittfläche und ausreichender Belüftung. . RÖ: Starke Lungenverschattung; trotzdem geringe Repirationsstörung („Walking-Pneumonia“ ; „kommt mit dem Fahrrad in die Klinik“);Diskrepanz zwischen Röntgenbild und klinischen Befund. mi: Verbreiterung der Alveolarsepten; Pneumozytennekrosen und konsekutive pulmonale hyaline Membranen. In den Epithelien und Bindegewebszellen oft Viruseinschlusskörper nachweisbar. ) Masernvirus-Pneumonie Vielkernige Riesenzellen (=Warthin-Finkeldey-Riesenzellen. Grippe: Hämorrhagische Tracheobronchitis und Bronchopneumonien. Fieber Husten, geringe Dyspnoe MI:Nekrosen des Bronchialepithels, Desquamation. Aggressive Varianten ("Spanische Grippe", 1918 die zum Tode der gesamten Familie des Malers Egon Schiele führte; oder bleibende zerebrale Schäden als v.Economo'sche Erkrankung hinterliess; Hongkong-Grippe 1997 vom Huhn auf Menschen übertragen Letalität 35%!).Sekundäre Besiedlung der Nekrosen diurch Staph aureus. Pneumocystis-carinii-Pneumonie: EPI: Abwehrgeschwächte Frühgeborene. Beim Erwachsenen Hinweis auf schwere Immunabwehrschwäche (AIDS). Erreger: Pneumocystis carinii, der DNA-Typisierung nach ein Sprosspilz, kein Protozoon MA: Grosse voluminöse Lunge mit abstreifbarem Schaum aus Pneumocystiserregern . mi: Die Alveolen prall angefüllt mit Pneumocystis-carinii-Erregern (schlecht sichtbar in HE, gut sichtbar in Grocott- Färbung oder immunhistochemisch). Nachweis in der Bronchio-alveolären-Lavage BAL. Die Alveolarsepten durch Plasmazell- und Monocyteninfiltrate hochgradig verbreitert. SPEZIFISCHE PNEUMONIEN: TUBERKULOSE, SARKOIDOSE DEF: Spzifische Pneumonien sind durch ein erkrankungstypisches Granulom charakterisiert, das aus Form und Gestalt einen Rückschluss auf den Erreger ermöglicht. Lungentuberkulose: EPI: Bis 1992 abnehmende Häufigkeit in Westeuropa; jetzt erneute Zunahme wegen Risikogruppen: Flüchtlinge und Einwanderer aus Krisengebieten mit hoher Infektionsrate und niedrigem sozio-ökonomischem Level; Personen mit niedrigem sozio-ökonomischen-Standard; AIDS-PAtienten. Besondere Anfälligkeit: Säuglinge/Kleinkinder; Reaktivierung einer Tuberkulose bei fortgeschrittenem Alter/konsumierenden Erkrankungen. Patienten mit Lungensilikose (inzwischen selten). Anm: Konrad Adenauer litt seit jungen Jahren an Tuberkulose; sie ersparte ihm den Wehrdienst. Seine 2.Frau verstarb an Tbc; vielleicht verbot er deshalb das Rauchen in seiner Umgebung. Auch Papst Pius XII überlebte seine Lungentuberkulose viele Jahre (möglicherweise durch die zupackende Fürsorge der bayerischen Schwestern des heiligen Kreuzes). Mme Pompadur litt Zeit ihres Lebens an Tbc, und verstarb daranBaruch Spinoza stirbt. 1677 an Lungentuberkulose. Frühe Fälle: Äyptsche Mumien; Ungarn 7.-8.Jhdt.nChr.: Knochentuberkulose (Haas, Am.J.Phys.Anthropol. 113: 293-304 (2000). AE: Erreger: Mycobacterium tuberculosis hominis (AE: aerogene Mensch-Mensch-Übertragung); selten M.tuberculosis bovinus (infizierte Milch/Käseprodukte)-> Primäraffekt im Darm. M.tub.galinaceus und atypischen Tuberkelbakterien: Klinisch/röntgenologisch atypischer Verlauf. PG und Stadieneinteilungen: 1.Historische Einteilung: Ranke - Stadien: Primäraffekt- Generalisationstadium- Organtuberkulose . 2:Neuere Einteilung: 1. Primärphase: Noch keine Abwehr ausgebildet; Tuberkulinreaktionen negativ Primärkomplex=Ghon’scher-Komplex: Inhalation von Tuberkelbakterien; Folgen: Entzündungsherd=Primäraffekt in Lungenmittellappenbereich.; -> Lymphogene Streuung zu den dazugehörigen Lungenhiluslymphknoten=Primärkomplex. Ausheilung unter Verkreidung des Primärkomplexes ODER präallergische lympho- hämatogene Streuung in Meningen (Meningitis tuberculosa), Knochen oder andere Organe sowie Generalisierung : präallergische lymphohämatogene Streuung in Meningen (Meningitis tuberculosa) , in Knochen (Wirbelsäule, Epiphysenfugen!) sowie andere Organe. Massive Generalisierung (=Tuberculosepsis = Typhobacillosis Landouzy). 2.Postprimärphase: Circa 6 Wochen nach der Erstinfektion: Entwicklung einer Immunantwort (=Tuberkulinkonversion; die Tuberkulinteste werden positiv). Makrophagenaktivierung (durch Lymphokine: Makrophagen- aktivierender Faktor MAF-> Tuberkelbakteriendestruktion; Makrophagenmigration inhibierender Faktor MIF: Fördert Ansammlung von Makrophagen im befallenen Areal. Entwicklung einer Typ IV Hypersensitivität-> käsige Nekrose). Durch Reaktivierung oder Reinfektion pulmo-pulmonale hämatogene Streuung in die Lunge. Bestes Mikromilieu für Tuberkelbakterien in den Lungenspitzen (=Simon-Spitzenherd); von dort Abtropfung von tuberkelbakterienhaltigem Exudat bronchiogen in tiefere Abschnitte (Assmann’sches subclavikuläres Frühinfiltrat; --> acinonodöse Lungentuberkulose (acinonodöser Herd = Tuberkulom). Bei Einschmelzung der käsigen Nekrosen: Kaverne. Morphologie MA: Tuberkel: 1 bis 3 mm gross, gelblich, hirsekornartig. Tuberkulom: Mehrere Zentimeter gross, aus konfluierten tuberkulösen Lobuli und Acini aufgebaut. Zentrale Verkäsung.Die käsigen Massen können vernarben, verkreiden, verkalken, abgeräumt werden oder bei Anschluss an Bronchus ausgehustet werden: Dadurch Ausbildung einer Kaverne. mi: Tuberkel = Epitheloidzellgranulome aus sekretorisch umgewandelten Histiozyten (breites Cytoplasma; Vermehrung des rauhen endoplasmatischen Retikulum; stark eingeschränkte Phagozytose ) und Langhans’schen Riesenzellen. Aufbau der Langhans’schen Riesenzellen durch Verschmelzung von Makrophagen/Histiozyten miteinander. Die bis zu 20-Zellkerne hohlspiegelartig an einer Hälfte der Circumferenz der Zelle. Die kernfreie Seite der Riesenzelle „deutet“ auf die käsige Nekrose. Zentral im Tuberkel eine +/- käsige Nekrose = feinkörniger Zerfall des Gewebes. Bei besonders starker Abwehrlage: Kaum käsige Nekrosen ; proliferative Prozesse stehen im Vordergrund ( produktive Lungentuberkulose). KO: Respiratorische Insuffizienz (restriktive Lungenerkrankungen durch kalzifizierte und fibrosierte Pleuritis tuberculosa und Narbenfeldern in der Lunge: „in Schwielen gefesselte Lunge“. Arrosion eines Blutgefässes durch eine Kaverne: Hämoptoe, Blutsturz. Reaktivierung, Sepsis Landouzy. Selten: Lungencarcinom. Atypische Mykobakteriosen: SYN: NTM= non-tuberculous mycobacterial infection. EPI: Wichtige Ursache von tb.- induzierten Infektionen bei Kindern im Kopf- und Halsbereich; fistelnde axilläre Lymphadenitiden. AE: M.avium (kommt auch in Fischen vor), M.Intracellulare, M.kansasii,M.fortuitum,M.chelonae(häufig in der Erde), M.scrofulosum. KO: meist resistent gg.typische Tuberkostatica, jedoch empfindlich gg.Clarithromycin, Ciprofloxazin... TP: u.a.chirurgische Ausräumung. Mykobacterium avium intracellulare (MAI) EPI: Mykobacterium avium intracellulare (MAI) Infektionen häufig bei Patienten mit AIDS. MA: Unscharf begrenzte Granulome. MI: Grosse Ansammlungen von Histiozyten mit schaumigen Cytoplasma. Darinnen massenhaft stäbchenförmige MAI-Erreger. Nachweis durch Kultur, Ziehl- Neelson- Färbung oder Nachweis der Erreger- DNA mittels Polymerase-Ketten-Reaktion. Weitere atypische Mycobakteriosen und BCG-Impfreaktion EPI: Vorwiegend Kinder; osteuropäische Zuwanderer. MO: Unterschiedl.Granulome, z.T.landkartenartig; inkomplette Verkäsung, nb. Langhans-Riesenzellen auch RZ vom Fremdkörpertyp und Granulozyten und Lymphozyten am Rande der Nekrose bnesonders in Hals-lymphknoten und Mediastinum. Typisierung von typischen und atypischen Tbb durch PCR. PRG: z.T.selbstlimitierend; oft resistent gg.herkömmliche Tuberkulostatika. DD: Reticulär abszedierende Lymphadenitiden, Mb.Bang, Tularämie (s. LK) Tularämie: Übetragung durch Schermäuse. Sarkoidose der Lungen. EPI: Frauen > Männer, 20 - 40 Jahre. In Europa bevorzugt in Skandinavien. Schwarze > Weisse (USA). PA: Ungeklärt; granulomatöse Reaktion in zahlreichen Organen. Neuerdings Nachweis von Mykobakterien -DNA in Granulomen durch PCR. (PCR trägt nichts zur DD zwischen Tbc. Und Sarcoidose bei!) Klin: Meist geringe oder fehlende Beschwerden. Bei aktiver Sarkoidose: Angiotensin-converting -enzyme (ACE) im Serum bei 80 % der Patienten erhöht. Intracutaner Tuberkulintest (z.B.Tine-Test) bei Sarcoidose negativ, bei Tbc mit gleichartigem histologischem Bild positiv. Sarkoidose-Zytologie: Umkehr des T 4/8 Verhältnisses in der bronchio-alveolären Lavage. Morphologie MA/ RÖ: Stadieneinteilung: 0 = normal (8% der Patienten mit Sarkoidose (Heilung 100 %). I = bilaterale hiläre Lymphadenitis (50 % der Patienten; 60 - 90 % Heilung). II.=bilaterale hiläre Lymphadenopathie und Lungenparenchyminfiltrate (30 % der Patienten; Heilung 50 %). III.=nur Parenchym -Infiltrate (12 % der Patienten; Heilungsrate 30 %). MI: Nicht verkäsende Granulome bes. in Lunge und Lymphknoten. „Saftige Epitheloidzellen“ und Langhansriesenzellen zum Teil mit Asteroid- und Conchoidkörpern (Conchoidkörper = Schaumannkörperchen).Im Vergleich zur Tuberkulose weniger umgebende Lymphozyten -> sog. „nackte Granulome“. KO: Interstitielle Lungenfibrose Lungeninsuffizienz (selten). CHRONISCHE INTERSTITIELLE PNEUMONIEN UNGEKLÄRTER AETIOLOGIE UND LUNGENFIBROSEN. SYN: UIP= usual interstitial pneumonia. EPI: Selten; Männer = Frauen; mittleres bis fortgeschrittenes Alter. Meist letal nach 4 -5 Jahren. AE: : Ungeklärt; 40 % virusinfektähnlicher Beginn. 20 % bei rheumatischer Grunderkrankung selten nach Pneumonie. Sklerodermie (Systemic sclerosis).Als KO bei M.Sjögen und bei Edelmetallarbeitern. PG: Lungenfibrose und -destruktion durch Enzyme aus Makrophagen und neutrophilen Granulozyten; Immunkomplexe. MA: Subpleurale Fibrose; die Lungenoberfläche wie „gehämmert“; visceroparietale Pleuraverwachsungen. Konsistenzvermehrung, unregelmässig erweiterte Bronchien. MI: Verbreitertes Interstitium infiltriert durch Lymphozyten, Plasmazellen und Monozyten. Auftreten von Myofibroblasten und S100+ dendritischen Reticulumzellen. Regeneration des Alveolarepithels: Ersatz der Pneumozyten I durch cuboidmetaplastische Pneumozyten; zunehmende irreguläre Fibrose meist in den abhängigen Lungenpartien. Übergang in Endstadiumlunge = Honigwabenlunge = Hamman- Rich- Syndrom. DD: Idiopathische intersitielle Fibrose und BOOP: Bronchiolitis obliterans organising pneumonia. Hamman- Rich- Lunge: MA: Irreguläre bienenwabenförmige Ausweitung der distalen Lufträume; ausgeprägte Fibrose. Anm: Diagnose durch offene Lungenbiopsie. Sonderformen der Interstitiellen Pneumonie: Abgegrenzt werden BIP = Bronchiolitis obliterans mit interstitieller Pneumonie. GIP = Interstitielle Pneumonie mit Riesenzellen: (= Hartmetall-Lunge bei Cobalt-Sensitivität) . LIP = Lymphoide interstitielle Pneumonie mit Übergang zum MALT-Lymphom der Lunge. (Alte Klassifikation nach Liebow 1977).: Gegenwärtige Klassifikation interstitieller Pneumonien ( Katzenstein u. Myers 2000): Usual Interstial Pneumonia; Desquamative Interstitial Pneumonia; Acute Interstitial Pneumonia = akutes Hamman- RichSyndrom; Nonspecific Interstitial Pneumonia/Fibrosis TYP LOKALISATION Zeitl.Ablauf Alveolarsepteninfiltration Histologie UIP Fleckförmig, oft subpleural spärlich DIP Diffus, uniform versch.Phasen nebeneinander uniform AIP NSIP Diffus,uniform Diffus, uniform uniform uniform spärlich stark fleckförmige Fibrose, Fibroblastenherde, Mikroskop.Bienenwabenmuster Intraalveol.Makrophagen, keine hylinen Membranen diff. interstitielle Fibroblastenproliferation spärlich Fibroblasten und Makrophagen. spärlich AIP= acute interstitial pneumonia; NSIP= Non-specific interstitial pneumonia. Histologic features for diagnosing the idiopathic interstitial pneumonias (Katzenstein & Myers Classification: 1998) Histologic feature UIP Distribution of changes Temporal appearance Alveolar septat inflammation Collagen-type fibrosis Patchy, non-uniform, Variegated* Seant, patchy Characteristic, patchy Fibroblast proliferation Fibroblast foci usually present Intraalveolar macrophage Occasional, focal accumutation Microscopic honeycomb change Characteristic Hyaline membranes Absent DIP AIP NSIP Diffuse, uniform Uniform Scant Variable, diffuse Diffuse, uniform Uniform Scant Absent Diffuse, uniform often subpleural Uniform Prominent Variable, diffuse Absent Diff use Diffuse, interstitial Rare fibroblast foci No Occasional, focal Usually absent Absent No Occasional, focal Usually absent Absent UIP, usual interstitial pneumonia; DIP, desquamative interstitial pneumonia; AIP, acute interstitial pneumonia; NSIP, nonspecifie interstitial pneumonia(fibrosis. Temporal variegation indicates that the process has been occurring and recurring over a long period of time. lt is recognized histologically by the mixture of acute chariges (usually fibroblast foci) with old or inactive changes (cotlagen scarring and honeycomb change). Zitiert aus: ALA Katzenstein, J.L.Myers: Nonspecific interstitial pneumonia and the other idiopathic interstitial pneumonias: Classification and Diagnostic Criteria Am.J.Surg.Path. 24:1-3 (2000). Die Klassifikation ist aus der ursprünglichen Liebow'schen K. hervorgeggangen. STAUBLUNGENERKRANKUNGEN, PNEUMOKONIOSEN. DEF: Charakteristische Lungenerkrankungen durch anorganische Stäube. Die wichtigsten Staublungenerkrankungen: Silikose, Asbestose, Farmerlunge. Silikose. EPI: Klassische Staublungenerkrankung der Bergleute, Mineure, Tunnelbauer, Steinbrucharbeiter in früheren Jahren. Bei Bergwerksarbeitern in quarzhaltigen Flözen (Anthrakosilikose). Starke Abnahme durch Schutzmassnahmen im Bergbau: 1960: 10,8 % Prävalenz; 1983: 1,9 % Prävalenz (England). AE: /PG: : Siliciumdioxid aus Quarztrilobit oder Cristobalith (Durchmesser 2 - 3 mikrometer)-> Phagozytose der Staubpartikel durch Makrophagen; intrazelluläre Destruktion von Phagolysosomen durch den Membraneffekt des Quarzstaubs. Zelltod; Freisetzung des Staubpartikels und der Makrophagenenzyme. Dadurch Entzündung, Fibrose. Ältere Theorien: Mechanische Irritation durch Quarzstaub; piezoelektrischer Effekt des Quarzstaubs ; toxische Eigenschaften des gelösten Siliciumdioxids. MA/RÖ: Stadium I: Hiluslymphknoten Vergrösserung. Stadium II. Schneegestöberlunge, StadiumIII. Staub- Ballungen: Auf der Schnittfläche der Lunge harte, bis 5 mm grosse grau schwarze sandartige Körnchen oft mit perifokalem Emphysem. Bei Ballungen bis 5 cm grosse harte von Staub durchsetzte Fibroseareale. MI: Silikotisches Granulom: .Entwicklung zunächst nur wenige mm grosser Knötchen an den Verzweigungen der Bronchiolen 1. und 2.Ordnung. Aufbau der Knötchen: Zentrale hyaline Fibrose mit konzentrisch angeordnetem +/- zellfreiem Hyalin; nach aussen zu ein Mantel aus Staubmakrophagen mit doppelbrechenden Kristallen; spärlich Epitheloidzellen und Lymphozyten. Keine zentrale Verkäsung (!; DD zu Tuberkeln!). Fibrosierte Pleuritis. KO: Respiratorische Insuffizienz; Cor pulmunale.Prädisposition für typische und atypische Tuberkulosen. Keine erhöhte Kanzerogenität durch Silikose da keine vermehrte Pneumozytenregeneration erfolgt sondern nur Makrophagen beteiligt sind. Sonderformen: Kaplansyndrom = Silikose + rheumatoide Arthritis. MA: Grosse konfluierte silikotische Granulome mit schiessscheibenartiger Bänderung von weissen staubarmen und grauschwarzen staubreichen Ablagerungen. Akzelerierte Silikose: Nach starker Siliciumdioxidbelastung (Sandstrahler!) massive Silikose mit intraalveolärer Lipid-, Phospholipid- und Proteinablagerung. Asbestose: EPI: 10.000 Tote pro Jahr (USA) durch asbestbedingte Erkrankungen. Risikoberufe: Schiffsarbeiter, Bauarbeiter, Bremser von Bergwerksschacht-Aufzügen. Seltener: Hobbywerker. AE: /PG: : Asbest = fibröses Silikat (SiO4). In Crysotil, Amosith , Crocidolith. Inhalation der langen Asbestfasern; Aufnahme durch Makrophagen. Stimulation von Fibroblasten und Makrophagen durch die Asbestfasern, keine Zelldestruktion. Im Sputum und in der Lunge Asbestkörperchen: Dünner zentraler 10 mikrometer langer Asbestfaden umgeben von eisenhaltigen Glykoproteinmantel in perlenschnurartiger Anordnung („Schaschlikspiess“). Zur genauen Asbestfasergehaltbestimmung: Speziallabors mit chemischer Bestimmung. MA: Minimale pulmonale Fibrosierungsherde bis grossflächige Fibrosen in mittlerem und unterem Lungendrittel, besonders posterobasal. Graues subpleurales Fibroseband und intraparenchymatöse grauweisse Fibroseherde mit irregulären Ausläufern fibrocystische Lungenherde: bienenwabenartige, 3mm grosse Zysten zwischen Fibrosearealen massive Fibrose: bis 10cm grobe derbe Fibroseareale. (Im Ggsatz zu anderen Pneumokoniosen: keine auffällige Bronchiektasenbildung). MI: Asbestkörperchen (s.o.) Fibrosen: Irreguläre, sternförmige Fibroseareale in Anlehnung an Bronchioli respiratorii; Einstrahlung der Fibrose in die angrenzenden Alveolen zunehmende fibröse Obliteration der umgebenden Alveolarräume. Keine konzentrischen Staubgranulome wie bei Silikose. Graduierung der Asbestose: Makroskopisch: Ausdehnung nil < 25% der Lunge Mikroskopisch: nil Minimal-Asbestose 25-50% Mittelgradig > 50% Hochgradig Nachweis von Asbestkörpern. LM Nachweis minimaler Fibrosierungsherde im Bereich der Bronchioli resp. und der begleitenden Gefässe m. Einstrahlung bis in die direkt angrenzenden Alveolarsepten, sowie in diesen Arealen eingelagerten Asbestkörpern.Dabei reicht der einmalige Nachweis von Asbestkörpern zur Diagnosestellung nicht aus (Dtsch.Ges.Pathol, DMW 94:A975 (1997).* Reticulin- und Kollagenfasern mit Obliteration der Alveolen und ausgedehnteren Metaplasien. Kollagen-Fibrose ausgedehnte Obliteration der Alveolen in grösseren Arealen fibrozystische Umwandlung der Lange massive Fibrose. *diese Def. ist für die Begutachtung von Lungenkarzinomen und Pleuramesotheliomen hinsichtlich eine BK ungemein wichtig ! KO: 1. Hyaline Pleuraplaques: Plattenartige aus hyalinisierten Bindegewebe bestehende Verdichtungen in der Pleura parietalis und im Zwerchfell. Kein Krankheitsherd. 2.Bronchialcarcinome (multiplikativer Effekt von Zigarettenrauch!). 3.Maligne Mesotheliome von Pleura, Peritoneum und Pericard. Asbestose begünstigt die Entstehung einer Lungentuberkulose nicht! Anthrakose: EPI: Sehr häufig in geringgradiger Ausbildung. Sehr selten: „massive anthracosis“ PG: Kohlestaubablagerungen in peribronchialem Bindegewebe der terminalen Bronchialen und im Interstitium der Lunge. Als reine Anthrakose ohne Krankheitswert. MA: Zunächst netzartige Einlagerungen von Kohlenstaub (=Anthrakose-Pigment) subpleural und intrapulmonal im Interstitium der Lungenlobuli; später diffuse Anthrakose-Pigment-Ablagerungen und Abschwemmung in die Lymphgefässe Hiluslymphknoten-Anthrakose ( eventl. auch Abschwemmung in die paraaortalen und perigastralen Lymphknten!). MI: Extra-und intrazelluläre (in Makrophagen!) Ablagerung des polarisationsoptisch isotropen schwarzen Anthrakosepigments im Interstitium und subepithelial in den Bronchioli resp. SOFO: „massive anthracosis“ bei engl. Kohlebergwerksarbeitern: Exzessive Kohlestaubeinlagerungen fokale Einschmelzung der Ablagerungen (eine Silikoseund infektiöse Komponente ist dabei in Betracht zu ziehen). PRG: Die reine Anthrakose ohne path. Bedeutung; entscheidend ist die zusätzliche Komponente im Kohlenstaub: Quarz Mischstaub-Silikose; Cancerogene (Benzpyrene etc.) Lungentumoren. Organische Stäube: Extrinsische allergische Alveolitis. EPI: Häufig bei verschiedenen Berufszweigen: Farmerlunge, Vogelzüchterlunge, Bagasossis, Kürschnerlunge, etc. PG: Verschiedene Allergene induzieren eine extrinsische allergische Alveolitis. Morphologie Air-Conditioner-Lunge, MA: Fibrosierte Lunge mit verdickter Pleura visceralis; „gehämmerte“ Lungenoberfläche; fibrosierte Schnittfläche. Unregelmässig erweiterte Bronchien, Endstadiumlunge. MI: Disseminierte nicht verkäsende Granulome aus Histiozyten, Epitheloidzellen und vielkernigen Riesenzellen (DD: Sarkoidosegranulom!). LUNGENTUMOREN LUNGENCARCINOME EPI: Einer der häufigsten malignen Tumoren in Europa und USA: 40.000 Tote pro Jahr in England, 120.00 Tote in USA/Jahr; 28 900 Neuerkrankungen/Jahr in Dtschl. .Fünffache Inzidenzunahme seit 1950, in letzter Zeit stagnierend. Häufiger bei Männern (Rauchen). M:F(1960)= 7 : 1; M:F (1987)= 2,5 : 1. Ausgeprägtes Nord- Süd- Gefälle der LungenkarzinomSterblichkeit (besonders bei Männern!): Süditalien/Südfrankreich: 25/100Tsd.; Mittelitalien 60/100Tsd.; Niederlande/Ruhrgebiet80/100Tsd.; Schottland 100/100Tsd. AE: /PG: : 1. Zigarettenrauchen > 40 Zigaretten pro Tag = 20-fache Lungencarcinominzidenz. 10 Jahre nach Raucherstop „normale“ Inzidenz. Pathogenetischer Faktor des Rauchs: Zahlreiche carcinogene (aromatische) Amine, polyzyklische Kohlenwasserstoffe, Nickel) aber: EXP: Tiere im vergleichbarem Zigarettenrauch gehalten entwickeln keine Lungentumoren! Formale PG: Rauchen -> Cilienverlust des respiratorischen Epithels -> Plattenepithelmetaplasie -> Dysplasie Grad 1, 2, 3-> Carcinoma in situ, invasives Carcinom. 2. Luftverschmutzung: Keine eindeutigen Korrelationen. 3. Berufliche Noxen: Asbest (insbesondere zusammen mit Zigarettenrauchen!), Hüttenwerksgase. Kohlenbergwerke mit hoher radioaktiver Strahlung: (hist.) Bergkrankheit von Schneeberg und Joachimstal. Morphologie Zentrale Lungencarcinome: 75 % der Lungencarcinome zentral = hilusnahe lokalisiert Ausgang von der Bronchialschleimhaut; Aufrauhung, Verdickung der Bronchialschleimhaut ,Verschluss des Bronchus mit distal davon lokalisierter Retentionspneumonie (=endogene Lipidpneumonie), z. B. im Lungenmittellappen. Periphere Carcinome (25 %): meist ein Lungenrundherd (Rundschatten, „coin-lesion“). Selten: Pneumonieartige Lungenverschattung. Ausbreitung: Zentral Lungencarcinome via Lymphgefässe in die Hiluslymphknoten und in die Lymphknoten an der Trachea. Via Ducutus thoracicus in die Vena jugularis und hämatogene Metastasierung in die übrige Lunge. Retrograde Lymphangiosis carcinomatosa in die subpleuralen Lymphgefässe, durch die Pleura; Pleuracarcinose: Multipler zuckergussartige Absiedlungen bes. in den caudalen Anteilen der Thoraxhöhle. Hämatogene Metastasierung in Nebennieren (Nebennierenmetastasen in 50 % der Fälle!), Leber, Hirn und Knochen (jeweils 20 %). Nieren (15%). Histologische Typen: Plattenepithelcarcinom: 70 % zentral lokalisiert. MA: (A) Polypoider Typ, (B) nodulärer Typ: Neigung zu vertikalem invasivem Wachstum.( C ) Superfizial infiltrierender Typ: Oft ausgedehnter Bronchienbefall ohne kritische Stenosierung des Bronchiallumens. (D)Kombinationen und multitope Plattenepithelcarcinome. MI: Plattenepithelien mit gestörter Kern-Plasma-Relation, hyperchromatischen Zellkernen und monozellulärer oder gruppierter Verhornung. Gute Differenzierung des Plattenepithelcarcinoms in 33 % der Fälle. Hohe Mitoseraten, aggressives Wachstum. Kleinzelliges Lungencarcinom: PG: Bronchial- epitheliales Neoplasma aus entodermaler Stammzelle mit neuroendokrinen Charakteristika (Ausgangszelle: Kultschitzkyzellen). Starke Korrelation mit Zigarettenrauchen. Morphologie MA: Typ 1: Vorzugsweise subepitheliales Wachstum in der Bronchialschleimhaut; häufigste Form. Typ2-nodulärer Tumor: Obstruktion von Bronchien. Typ 3: Kombinationstumoren Typ 4 peripheres kleinzelliges Lungencarcinom. MI: Sehr kleine Tumorzellen mit hyperchromatischen Zellkernen und nahezu keinem Cytoplasma. (Tumorzellen = 2 x Lymphozytengrösse). Unterscheidung zwischen runden sehr kleinen Tumorzellen (Oat-cell) und grösseren gering spindeligen Tumorzellen (Intermediate Type). Einteilung der kleinzelligen Lungencarcinome nach dem Pathology Panel of the International Association for the study of lung cancer: 1.Kleinzelliges Lungencarcinom, klassisch. 2. kleinzelliges mit grosszelliger Komponente (gering oder ausgeprägt). 3. kombiniertes kleinzelliges Carcinom (DD: Carcinoide der Lunge). Immunhistochemischer Nachweis von neuronenspezifischer Enolase Peptidhormonen, neuronalem Adhäsionsmolekül (N-CAM). EMI: Intracytoplasmatische membrangebundene 100 - 200 nm grosse Granula im Cytoplasma der Tumorzellen. Adenocarcinome der Lunge: EPI: Häufigstes Lungencarcinom in Japan und orientalischen Ländern; Zunahme in USA und Europa; M:F = 2 : 1. MA: Häufig in der Lungenperipherie, Penetration der Pleura, Pleuracarcinose! Neigung zu intrapulmonaler Ausdehnung. Seltener: Pneumonieartige Ausbreitung in einem Lungenlappen. Narbencarcinomtyp. MI: Tubuläre , glanduläre und tapetenartige Lagerung der Tumorzellen in der Lungenperipherie. Unterschiedliche Zelltypen: Clara Zelltyp (nach dem Anatomen Max Clara), Bronchialdrüsentyp, Becherzelltyp, Pneumozytentyp II-Typ, Bronchialoberflächenzelltyp. Grosszelliges Lungencarcinom/Riesenzellcarcinom. MA: Rundliche Tumoren mit scharfen Tumorgrenzen; weisse, fischfleischartige Schnittfläche. MI: Grosse polygonale Zellen mit gestörter Kern-Plasma-Relation; eosinophiles Cytoplasma; dünnes bindegewebiges Stroma. Varianten: Klarzelliges Carcinom und Riesenzellcarcinom. BENIGNE TUMOREN UND TUMOREN GERINGERER MALIGNITÄT VON LUNGE UND BRONCHIEN. Hamartom: DEF: Missbildungsgeschwulst aus allen geweblichen Bestandteilen der Lunge in unregelmässiger Zusammensetzung; meist chondromatöes Hamartom. EPI: M : F = 1 : 2; benigner Verlauf. MA: Scharf umschriebene periphere knorpelähnliche Tumoren. MI: Knorpelabschnitte abwechselnd mit myxoidem Gewebe und Bindegewebe. Carcinoide der Lunge: EPI: 1 - 2 % aller Lungentumoren; M : F = 1: 1. PG aus Kulschitzkyzellen. MA: Kugelförmiger Tumor in den Lappen oder Segmentbronchien. MI: Helle Zellen mit gering gestörter Kern-Plasma-Relation, feingranuläres acidophiles Cytoplasma. Lagerung in soliden und trabekulären Verbänden. Keine Nekrosen. KO: Obstruktive Pneumonie ; Ausbildung von Bronchiektasen. Seltene Tumoren: Plattenepithelpapillome (solitär oder polytop bei Papillomavirusbefall (häufig Typ 6 und 11); sklerosierendes Hämangiom; entzündlicher Pseudotumor. SEKUNDÄRE LUNGENTUMOREN: LUNGENMETASTASEN. EPI: Lunge = Organ mit häufigster Absiedlung von Metastasen aus Karzinomen des Gastrointestinaltrakts, der Niere, Prostata, und Mamma. MA: Meist multiple unterschiedlich grosse Tumorknoten über beide Lungen verteilt, besonders subpleural; Einbruch in die Pleura; daneben oft eine von den Metastasen ausgehende netzartig die Lobuli umgreifendeLymphangiosis carcinomatosa von Lunge und Pleura. MI: Entsprechend dem Ausgangspunkt. Vergleichende Subklassifikation der morphologischen Differenzierung von Lungenkarzinomen System WHO AFIP Plattenepithel- Ca Adeno - Ca Klassisches PE-Ca , Acinar, papillär, Spindelzell-Ca bronchioloalveolär, solid-mucinös G1-G3 G1-G3; bronchioloalveoläres Grosszelliges Ca Riesenzell-Ca, Klarzelliges Ca Klassisch; undifferenziert, Kleinzelliges Ca Oat-Cell, Intermediate- Cell , Combined Type lymphocyte-like = oat-cell- carcinoma ; AdenoCa WPLC (=Working G1-G3 Party for Lung Cancer) Klin. Eigenschaften Relative Häufigkeit 30% des Tumortyps Lokalisation Zentral 67% Paraneoplast.Syndr. Hypercalcämie G1-G3; bronchioloalveolär; papillär Riesenzell-Ca, Klarzelliges-Ca mucinös; stratifiziert, Riesenzell-Ca, Klarzelliges Ca polygonalcell type; combined type lymphocyte-like, intermediate, fusiform, polygonalcell-type 29% 16% 24% Peripher 67% Osteoarthropathie Peripher 67% Gynaekomastie, Galaktorrhoe Zentral 80% Inappropriate ADH Prod.und -sekretion Cushing-Syndrom, Hyperpigmentation, Hypocalcämie,Eaton - Lambert- Syndrom Lungenkarzinom : KLASSIFIKATION NACH UICC (1997): TX Positive Zytologie T1 <3cm T2 > 3 cm, Hauptbronchus > 2cm von der Carina, Invasion von viszeraler Pleura, partielle Atelektase T3 Brustwand, Zwerchfell1 Perikard, mediastinale Pleura, Hauptbronchus < 2cm von der Carina, totale Atelektase T4 Mediastinum, Herz, grosse Gefässe, Carina, Trachea, Ösophagus> Wirbelkörper, getrennte Tumorherde gleichen Lappen, maligner Erguss N1 Ipsilateral peribronchial/hilär N2 Ipsilateral mediastinal/subcarinal N3 Kontralateral mediastinal/hilär, ipsi- oder kontralaterale Skalenuslymphknoten oder supraklavikulär Ml Einschliesslich getrennter Tumorherde in einem anderen Lappen im PLEURA: Vorbemerkungen. Pleurahöhle als Verschieberaum der Lunge gegen die Thoraxwand. Gewährleistung der Lungenentfaltung durch den Donders’schen Unterdruck in der Pleurahöhle. Auskleidung der Pleurahöhle durch „ glattes, spiegelndes, durchsichtiges“ Mesothel. Darunter submesotheliale Bindegewebszellen und eine Lamina fibrosa. MI: Mesothelien: Abgeflachte epithelähnliche Zellen mit kleinen zentralen Zellkernen, breitem Cytoplasma und zahlreichen Mikrovilli an der Zelloberfläche deren Länge bis zur Hälfte des Zelldurchmessers betragen können. Amphophilie des Cytoplasma. Eosinophiles Cytoplasmas in der inneren Hälfte in der Umgebung des Zellkerns; Basophiles Cytoplasma in den äusseren Zellabschnitten. Bei Irritation: Kubische Umwandlung der Pleuradeckzellen. IMMUNCYTO: Doppelexpresssion von Keratinen (=Epithelmarker) und Vimentin (=Bindegewebsmarker) in den Mesothelien. Schwache Expression von carcinoembryonalen Antigen CEA; keine Expression von Humanem epithelialem Antigen (HEA) in den Mesothelien.; starke Exressxion von Calretinin. Pneumothorax: PG: Eröffnung des Pleuraspalts durch Verletzungen der Thoraxwand (äusserer Pneumothorax) oder der Lunge (innerer Pneumothorax); Zusammenbrechen des Donders’schen Unterdrucks; Kollaps der Lunge durch die elastischen Rückstellkräfte der Lunge und konsekutive Minderdurchblutung der Lunge. Einseitiger Zwerchfellhochstand. Minderdurchblutung der Lunge -> reaktive pulmonale Hypertonie. Spannungspneumothorax: PG: Durch check-valve (= Rückschlagventil)- Mechanismus Entstehung eines Überdrucks in der Pleurahöhle. Starke Kompression der Lunge; Verschiebung des Zwerchfells nach caudal--> konvexe Verbiegung des Zwerchfells. Verschiebung der Mediastinalorgane zur Gegenseite. AE: : Trauma, insbesondere Anspiessung einer Lunge durch frakturierte Rippe; Platzen einer Emphysemblase. PRG: Spontane Resorption eines kleineren Pneumothorax; Drainagemassnahmen (Bühlaudrainage); bei viszeroparietalen Pleuraverwachsungen: Nur geringe Gefahr durch Pneumothorax. Pleuraerguss: DEF: Flüssigkeitsansammlung in der Pleura > 50 ml. Funktionelle Beschwerden > 300 ml (auch sichtbar im Röthorax). PG: Transudat durch Stauungsblutfülle in venösen (!) Kreislauf z. B. bei Rechtsherzinsuffizienz. Transudat: Spezifisches Gewicht < 1,015 Proteingehalt < 1,5 g/100 ml. MA: Bernsteinfarbene wasserklare Flüssigkeit. Gelegentlich sekundäre Einblutungen oder geringe Fibrinniederschläge. MI: (jeder Pleuraerguss sollte cytologisch untersucht werden!). Akut: Wenige unauffällige Mesothelien. Chronisch: Aktivierte Mesothelien: Vergrösserte Zellkerne, leichte Störung der Kernplasmarealtion, geringe Hyperchromasie der Zellkerne. 1-2 kleine Nukleolen. Amphophilie des Cytoplasmas. Lagerung der Mesothelien in Einzelzellen, papillären Gruppen und Zellballen. Beimischungen: Hämorrhagischer Pleuraerguss: Erythrozyten: Nach Radiatio; als Randreaktion bei Pleuracarcinose. Hämorrhagisch-lymphoyztär (Urämie!) häufig bei Tumorabsiedlungen in der Pleurahöhle (verstärkte Suche nach Tumorzellen). Lymphozytärer und lymphozytär-hämorrhagischer Pleuaerguss: bei Pleuracarcinose und Pleuritis tuberculosa. Fibrinöse Pleuritis: AE: : Viral (Coxsackie, Echoviren; physikalisch/chemisch: Radiatio, Urämie; Begleitpleuritis, Pleuritis bei Lungeninfarkt, Pneumonien. Eitrige Pleuritis: Bakterien (fortgeleitet aus Pneumonie), bei Septicopyämie. Tuberkulöse Pleuritis: Hämatogen oder von der Lunge aus übergreifend: Obliteration des Pleuraspalts durch +/- verkalkende käsige Nekrosemassen. Pleuraempyem DEF: Exudat in der Pleurahöhle (spezifisches Gewicht > 1.015). MA: Trübes, gelbliches Exudat; Fibrinschlieren. MI: Massenhaft Granulozyten und Fibrin; dazwischen aktivierte Mesothelien mit vergrösserten Zellkernen und Tumoren der Pleura: Pleurahyalinose: PG: Asbest: (umstritten!). Morphologie MA: Grosse elfenbeinfarbene Plaques in den basalen Anteilen der Pleura parietalis und P. diaphragmalis. Feste- harte Konsistenz. Gelegentlich Kalkeinlagerungen. MI: zellarme Knoten; breite Kollagen- und Hylinablagerungen; unauffällige Mesothelüberkleidung. PRG: Ohne klin. Krankheitswert; eventl. Hinweis auf Asbestbelastung. Primäre Tumoren und tumorartige Läsionen: Hyaline Pleuraplaques AE: : Asbestbelastung, idiopathisch. MA: Grosse plattenartige von Pleura überdeckte hyaline Platten in der caudalen Pleurahöhle vor allem parietal seltener fiszeral. Zähe weisse Schnittfläche. MI: Unauffällige oder leicht aktivierte mesotheliale Überkleidung der Pleura darunter zellarmes hyalinisiertes Bindegewebe. Klin: Ohne klinische Bedeutung. Allenfalls als Hinweis auf Asbeststaubbelastung. Lokalisiertes fibröses Mesotheliom: EPI: Sehr selten. MA: Feste, zellreiche gestielte Knoten. MI: Aus Mesothelien oder submesothelialen Fibroblasten hervorgehende zellreiche Tumoren. Dreieckige oder spindelzellige Tumorzellen. Starke Keratinpositivität! PRG: Rezidive in 16 % der Fälle. Keine maligne Entartung bekannt. Maligne Mesotheliome. EPI: M : F = 3 : 1; durchschnittliche Überlebensdauer 15 Monate selten auch viel länger. Zunahme der Inzidenz jeweils um 20 % alle fünf Jahre. AE: /PG: : Asbestinhalation insbesondere Crocidolith am gefährlichsten, Chrysotilasbest am wenigsten gefährlich. Potenzierender Effekt von Zigarettenrauch. Unterschiedliche individuelle Empfindlichkeit gegen Asbestinhalation; selten: familiäre Mesotheliome. (Schlüsselarbeit: Wagner, Sleggs, Marchand: Diffuse pleural mesothelioma and asbestos exposure in the North Western Cape Province. Br.J.Industrial Medicine: 17 : 260 - 71 (1960). MA: Konfluierende Knoten und Platten an Pleura visceralis und parietalis insbesondere in den caudalen Pleuraabschnitten und an der Pleura diaphragmalis. MI: Drei unterschiedliche Wachstumstypen: Epithelial (75 %), Biphasisch = Mischtyp (22 %), Sarkomatoid = Fibrös (2,4 %). Epitheliales Mesotheliom: Papilläre und tubuläre Tumorzellkomplexe aus kubischem, bis flachen Zellen. Zahlreiche sehr lange dünne Mikrovilli an der Zelloberfläche; Mikrovillisaum; Amphophilie des Cytoplasmas: die perinucleären Zytoplasmaabschnitte sind eosinophil, die äusseren Abschnitte basophil. Sarkomatoider Typ: Überwiegend Spindelzellen mit starker Expression von Keratin in den Tumorzellen. Reichlich Kollagen zwischen den Tumorzellen. DD: Pleuracarcinose. Pleuramesotheliom: Klassifikation nach UICC 1997 T1 Ipsilaterale Pleura T2 Ipsilaterale Lunge/endothorakale Faszie/ Zwerchfell/ Perikard T3 Ipsilaterale Brustwandmuskulatur/ Rippen/ mediastinale Organe oder Gewebe T4 Direkte Ausbreitung auf kontralaterale Pleural Lunge Peritoneum/intraabdominale Organe/Ha1sgewebe N1 Ipsilateral peribronchial/ hilär N2 Ipsilateral mediastinal/ subcarinal N3 Kontralateral mediastinal/hilär, ipsi- oder kontralaterale Skalenuslymphknoten oder supraklavikulär Sekundäre Pleuratumoren: Pleurametastasen, Pleuracarcinose. EPI: Sehr häufig bei epithelialen und mesenchymalen Endstadiumtumoren. Wesentlich häufiger als maligne Mesotheliome. Häufig Pleurametastasen bei Mammacarcinomen (!),Ovarialcarcinomen (!), Lungencarcinomen, Magen- und Coloncarcinomen. MA: Zuckergussartige Überkleidung von Pleura parietalis und visceralis durch Tumorzellen. Meist ausgeprägter haemorrhagisch fibrinöser und lymphozytenreicher Pleuraerguss . MI: Adenokarzinommetastasen: Papilläre und tubuläre Tumorzellkomplexe mit +/- verschleimendem Cytoplasma, hyperchromatischen Zellkernen mit ein- bis zwei Makronukleolen und dreidimensional gelagerten Tumorzellkomplexen im Pleuraerguss. Plattenepithelcarcinommetastasen: Einzeln oder gruppiert gelagerte Tumorzellen mit entrundeten und hyperchromatischen Zellkernen; stark vergröbertes Chromatinnetzwerk.