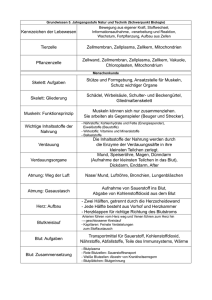
- Vetstudy
Werbung

1. Funktion der Zellorganellen - Zellmembran: Barriere und Kontakt zur Außenwelt, Signalaufnahme, Transport von Stoffen - Begrenzung (Ausmaße der Zelle, Unterschiede zwischen intra- und extrazellulärer Flüssigkeit (IZF/EZF) - Selektiver Filter: aktiver und passiver Transport - Flexibilität: Zellwachstum, Zellteilung - Signalvermittlung: Rezeptoren, G-Proteine - Zellerkennung: Oberflächenstruktur - Transport - Cytoplasma/Cytosol: Summe der membranfreien Grundsubstanz außerhalb des Zellkerns, allgemeiner Stoffwechsel, Proteinsynthese, Glykogen, intrazelluläre Bewegungen, Cytoskelett - ER – endoplasmatisches Retikulum: Synthese von Membran- und Exportproteinen (rauhes ER), Lipidsynthese (glattes ER), als sarkoplasmatisches Retikulum (SR) in Muskelzellen ein wichtiger Calcium-Speicher - Peroxisomen: Kompartiment für verschiedene Spezialaufgaben > z.B. Oxidation von Stoffen zwecks Entgiftung ; Oxidase, Katalase - Lysosomen: Verdauung endozytierter Substanzen, Hydrolasen - Golgi-Apparat: Gesamtheit der Dictyosomen (= einzelne Membranvesikelstapel der GolgiZysternen); Oligo- und Polysaccharidsynthese - Zellkern (Nukleus):DNA-Replikation, Transkription, Synthese und Reifung der mRNA, Bildung ribosomaler Untereinheiten im Nucleolus - Mitochondrium: Atmung, ATP-Produktion Extrazellularraum Intrazellularraum Blutplasma Cytoplasma mmol / Liter 2. Verhältnis Anionen Natrium Na+ Kalium K+ Calcium Ca2+ Andere Kationen 142 4 2,5 2,5 10 (8 – 30) 155 (100 – 155) 0,1 – 1 µmol/l 10 14 : 1 1 : 39 > 2.500 : 1 Kationen Chlorid ClBicarbonat HCO3Sulfat SO42Phosphat HPO42- 103 27 0,5 1,5 4 (4 – 30) 10 (8 – 15) 9 50 26 : 1 2,7 : 1 1 : 18 1 : 33 Transportmechanismen an der Zellmembran Aktiver und passiver Transport passiver Transport > Diffusion, entlang eines elektrochemischen Gradienten > Zellmembran muss eine Durchlässigkeit (Permeabilität) aufweisen, für die lipidlöslichen Stoffe > Atemgase und Nicht-Elektrolyte. Die Lipiddoppelschicht ist für diese Substanzen nicht selektiv - Transport durch Ionenkanäle, schnellstes System – 107 Ionen/Sekunde > ein in der Zellmembran eingelassenes, integrales Protein fungiert als Ionenkanal > Transport eines geladenen Teilchens entlang eines elektrochemischen Gradienten > Dazu muss intra- und extrazellulär eine verschieden hohe Konzentration des betreffenden Ions vorhanden sein, was im allgemeinen auch der Fall ist. > Zelle ist innen negativ geladen > es muss eine Triebkraft für das betreffende Ion bestehen um hinein und hinaus zu diffundieren > die Selektivität eines Ionenkanals ergibt sich aus den elektrischen Ladungen der 1 Aminosäuren in der inneren Tunnelwand. Ist die Wandladung positiv geladen kollidieren positiv geladene Ionen (z. B. Na+) mit dem elektrischen Feld der Wandladung und können somit Engstellen im Tunnel nicht passieren, während ein negativ geladenes Teilchen (z.B. Cl-) durch die positive Wandladung sogar schneller durch den Kanal transportiert wird, als wenn er nicht geladen wäre. In diesem Fall handelt es sich also um einen anionenselektiven Ionenkanal - Transporter (Carrier) – erleichterte Diffusion > für höhermolekulare Substanzen wie Glucose und Aminosäuren gibt es spezielle Transportsysteme > Carrier. > Diese können Substanzen gekoppelt in eine Richtung transportieren > Symport, durch Cotransporter > Substanzen können von einem Transportermolekül in entgegengesetzte Richtung transportiert werden > Antiport durch Exchanger > Substanz wird allein von einem Carrier transportiert > Uniport > da die Substanzen mit den Carriern eine Bindung eingehen ist bei einer hohen Konzentration der Substanz eine Sättigung erreicht und alle Carrier sind besetzt und die Transportrate maximal > Transportkinetik verdeutlicht die Sättigungsrate - Bei reiner Diffusion ist die Transportrate V von der Substratkonstante C linear abhängig - erfolgt der Transport jedoch durch einen Carrier „bergab“ in Richtung des Konzentrationsgradienten spricht man von erleichterter Diffusion. Deren Sättigungskinetik ist durch den Michaelis-Menten-Formalismus beschreibbar: Die Michaelis Konstante Km beschreibt die Substratkonzentration, bei der das Transportsystem halb gesättigt ist. aktiver Transport - es wird Energie in Form von ATP verbraucht - kann auch gegen einen Konzentrationsgradienten stattfinden - ATP-getriebener Transporter > bei dem aktiven Transport gegen den Konzentrationsgradienten wird Energie in Form von ATP verbraucht - primär aktiver Transport: ATP-Umsetzung findet direkt im Transportmolekül statt Bsp. Na+/K+-Pumpe > 3 Na+-Ionen (raus) im Tausch gegen 2 K+-Ionen (rein), dadurch wird die intrazelluläre Na+-Konzentration auf einem niedrigen Wert von ca. 10 mmol l-1, während die intrazelluläre K+-Konzentration hoch ist mit etwa 100 mmol l-1. Dieses Transportsystem wird auch als Na+/K+-ATPase bezeichnet. Es gibt auch die Ca2+-ATPase und die für die Protonensekretion im Magen wichtige H+/K+-ATPase - sekundär aktiver Transport: nutzt einen durch primär aktiven Transport aufgebauten Konzentrationsgradienten als Triebkraft für den Carrier-vermittelten Transport. Bsp. Na+-gekoppelter Glucose-Symport – SGLT1-Transporter befindet sich in der apikalen Membran von Epithelzellen des Dünndarms oder im proximalen Tubulus der Niere. Es gibt auch den Na+-gekoppelten Transport von Aminosäuren ebenfalls im Dünndarm - Gap junctions > Kommunikationskontakte > großlumige Poren > Fluss von Molekülen von einer Zelle in eine andere 2 > Connexone benachbarter Zellmembranen koppeln sich aneinander und bilden einen kommunizierenden Kanal um einen Austausch von Stoffen zu ermöglichen (z.B. cAMP) > es können sowohl niedermolekulare Substanzen als auch elektrische Ströme durch den offenen Kanal von einer Zelle in die andere übertreten > Connexone bestehen aus 6 identischen Proteinen (Connexin), sind sie nicht gekoppelt sind sie geschlossen, so das die Zelle keine Elektrolyte verliert > Fluss der Substanzen erfolgt ähnlich wie bei Ionenkanälen aufgrund des Gradienten und durch Diffusion. Sie sind aber nicht selektiv und öffnen/schließen sich nicht > häufig zu finden zwischen den Herzmuskelzellen > Durchlässigkeit wird durch Ca2+-Ionen reguliert - Exo- und Endocytose > speziell entwickelter Mechanismus für größere Partikel oder Moleküle, die weder lipophil direkt durch Zellmembran gelangen oder für die es kein geeignetes Transportsystem gibt > Exocytose: vesikelartige Strukturen werden aus der Zelle geschleust > Endocytose: vesikelartige Strukturen werden in die Zelle geschleust Aufnahme von festen Stoffen > Phagocytose Aufnahme von flüssigen Stoffen > Pinocytose 3. Signalübertragung - Direkte Signalübertragung: Mit Botenstoff über Gap junctions zwischen Signal- und Zielzelle (funktionelles Syncycium/single unit: eine Vereinigung von viele Gap junctions, z.B. im glatten Herzmuskel oder der Blase – Gegenteil: Multi unit im Auge mit einzelnen Gap junctions) - Autokrine und parakrine Signalübertragung: Von Signalzelle an Zielzelle über Botenstoff an Rezeptor gleicher Zelle (autokrin) oder Rezeptor einer Nachbarzelle (parakrin), Transport also über extrazelluläre Flüssigkeit > schnelle Wirkung, kurze Reaktionsdauer, Signalform chemisch, Zielzellen: Körperzellen > Bsp.: NO, gastrointestinale Hormone, Wachstumshormone - Endokrine Signalübertragung: In der Signalzelle gebildeter Botenstoff geht über in den Blutkreislauf und wird von da aus an die Zielzelle über einen Rezeptor abgegeben. Beispiel: Hormone, die über die Blutbahn zur Zielzelle transportiert werden (Adrenalin, Insulin) > langsame Wirkung, längere Reaktionsdauer, Signalform chemisch, Zielzellen: Körperzellen > Bsp.: Insulin, Glucagon, Aldosteron, Schilddrüsenhormone - Nervensignalübertragung: Die Signalzelle gibt über ein elektrisches Signal die Botensubstanz (Neurotransmitter) ab und die Zielzelle nimmt diesen über einen Rezeptor auf > Synapsen > schnelle Wirkung, kurze Reaktionsdauer, Signalform chemisch und elektrisch, Zielzellen: Neurone, Muskeln, endo- und exokrine Drüsen > Bsp.: Acetylcholin, Noradrenalin, Glutamat - Hydrophile Transmitter: z.B. Neurotransmitter: Adrenalin / Peptidhormone: Insulin, Glucagon Ausschüttung über Exocytose (Signal: Ca2+), Transport über extrazelluläre Flüssigkeit, schnelle Wirkung, Membranrezeptor - Hydrophober Transmitter: z.B. Steroidhormone: Progesteron, Östrogen, Aldosteron Synthese nach Bedarf, Ausschüttung über Diffusion nach STimulation, Transport kurzer Strecken gelöst in extrazellulärer Flüssigkeit, Transport langer Strecken gebunden an Trägerproteinen, langsame Wirkung, Cytosol- oder Kernrezeptor > konstantes Verhältnis: ca. 1 % freie Botensubstanzen und Rest an Trägerproteine gebunden - Membranrezeptoren: Ionotrope Rezeptoren: Ionenkanal = Rezeptor Metabotrope Rezeptoren: Rezeptorprotein in Membran, Transmitter gebunden an GProtein – dieses startet dann Signalkaskade oder öffnet Ionenkanäle besondere Form: Tyrosinkinase Rezeptor für z.B. Insulin, über Rezeptorenzyme, die durch den Botenstoff aktiviert werden 3 - Cholinerge Rezeptoren (binden Acetylcholin): > nicotinerge Rezeptoren = ionotrop – Stimulation sympathischer und parasympathischer postganglionäre Neurone > muskarinerge Rezeptoren = metabotrop M1: vor allem auf Neuronen, fördern Erregbarkeit M2: Herz, senken Herzfrequenz M3: Glatte Muskulatur, Kontraktion Drüsenzellen: Sekretion - Adrenerge Rezeptoren: alpha 1 und 2, beta 1 – 3 - Second messenger: > Ca2+: Modulation von Enzymaktivitäten > cGMP: Phosphorlierung von Proteinen, Öffnen/Schließen von Ionenkanälen > cAMP: Phosphorlierung von Proteinen > Inositol 1, 4, 5-Trisphosphat: Phosphorlierung von Proteinen, Modulation von Enzymaktivitäten Alpha 1 Vaßokonstriktion (Gefäßverengung) Kontraktion Sphingteren Uteruskontraktion Pupillendilatation Gegensätzliche Wirkung Alpha 2 Beta 1 Hemmung AcH Herz: steigert Frequenz und Kontraktionskraft Intestinale Reninfreisetzung Relaxion Beta 2 Vasodilatation (Gefäßerweiterung) Bronchodilatation Uterusrelaxion Thermogenese - Darm: > M3: Noradrenalin > Sympathikus: Motilität Längs- und Ringmuskulatur sinkt > alpha 2 und beta 3: Acetylcholin > Parasymphatikus: Motilität steigt - Herz: > beta 1: Adrenalin > Sympathikus: Herzfrequenz wird gesteigert > M2: Parasympathikus: Herzfrequenz wird gesenkt - Kreislauf: > alpha 1: Noradrenalin > Sympathikus: Vasokonstriktion, Hautgefäße > beta 2: Vasodilatation, Bronchodilatation - Muskelzittern > Acetylcholin – nicotinerg 4. Cholinerge Erregungsübertragung: Synapsen, nicotinerg, muskarinerg, wo? - Freisetzung von Acetylcholin (ACh): Vesikel der präsynaptischen Nervenendigungen entleeren sich in den synaptischen Spalt, wenn aufgrund von eintreffenden Aktionspotentialen die zytosolische Ca2+-Konzentration ansteigt - Adrenalin und Noradrenalin können über präsynaptische alpha2-Adrenozeptoren die Freisetzung von Acetylcholin hemmen; an Parasympathikusfasern kann dies Acetylcholin auch selbst tun, indem es an präsynaptische Autorezeptoren bindet - postsynaptisch wird Acetylcholin an Cholinorezeptoren gebunden > zum einen im VNS in den vegetativen Ganglien > zum anderen an den vom Parasympathikus innervierten Organen - für Acetylcholin gibt es zwei Hauptgruppen von Rezeptoren die N(ikotinergen)- und die M(uskarinergen)- Cholinozeptoren (Erregung durch Nikotin bzw. Muskarin) - bei den N-Cholinozeptoren unterscheidet sich der Nerventyp Nn in den vegetativen Ganglien vom Muskeltyp Nm an der motorischen Endplatte dadurch, dass er aus anderen Untereinheiten aufgebaut ist - beide sind zugleich Cholinozeptoren und Kationenkanäle (ionotrope Rezeptoren) 4 - Bindung von Acetylcholin sorgt für einen schnellen Einstrom von Na+ und Ca2+ und damit für ein schnelles EPSP (Exzitatorische (erregende) postsynaptische Potential), das, sofern es überschwellig ist, postsynaptisch ein Aktionspotential auslöst - M-Cholinozeptoren beeinflussen die synaptische Übertragung indirekt über G-Proteine - M1-Cholinozeptor (in vegetativen Ganglien, im ZNS, in exokrinen Drüsen) aktiviert über ein Gq-Protein die Phospholipase Cbeta; daraufhin werden im postganglionären Neuron IP3 (Inositoltriphosphat) und DAG (Diacylglyerin) freigesetzt, die einen Ca2+ -Einstrom und ein spätes EPSP bewirken - M2-Cholinozeptor (im Herz) wirkt über ein Gi-Protein, das v.a. in Sinus- und AV-Knoten sowie im Vorhof bestimmte K+-Kanäle öffnet und somit negativ chrono- und dromotrop auf die Herzerregung wirkt; außerdem hemmt es die Adenylylcyclase, so dass u.a. der Ca2+ Einstrom ins Zytosol sinkt - M3-Cholinozeptor (v.a. in glatter Muskulatur) Acetylcholin-Bindung führt über ähnliche Reaktionen wie beim Typ M1 über einen Ca2+ -Einstrom zur Kontraktion - beendet wird die Acetylcholin-Wirkung durch Spaltung mit Hilfe der Acetylcholinesterase im synaptischen Spalt; 50 % des so freiwerdenden Cholins werden wieder in die präsynaptische Nervenendigung aufgenommen und in den Vesikeln gespeichert - Antagonist für alle M-Typ-Cholinozeptoren ist Atropin 5. Second messenger (Botenstoffe) Der erste Signalweg verläuft über cyclisches Adenosinmonophosphat (cAMP), das durch ein intrazellulär membranassoziiertes Enzym, die Adenylatcyclase, gebildet wird - es wird über extrazelluläre Rezeptoren und G-Proteine aktiviert und bildet aus ATP das cAMP - die einzelnen Stationen dieser Signalkaskade bewirken dabei eine enorme Signalverstärkung, sodass bereits die Aktivierung weniger Rezeptoren genügt um große Mengen cAMP zu mobilisieren - dieses führ über die Aktivierung von Proteinkinase A (PKA) zur Phosphorylierung eines Effektorproteins (z.B. eines Ionenkanals) - dieser Signalweg hat neben seiner stimulierenden Wirkung auch einen inhibitorischen Effekt (statt stimulierender G-Proteine werden dann inhibitorische G-Proteine ausgeschüttet, die die Adenylatcyclase und damit die cAMP-Produktion hemmen) - Beispiel für stimulierende Wirkung: durch ADH über cAMP und PKA induzierte Stimulation der epithelialen Na+ -Kanäle im distalen Tubulus der Niere - Beispiel für inhibitorische Wirkung: Wirkung des Wachstumshormons Somatostatin, das die cAMP-Produktion in Zellen vermindert - Inaktivierung des cAMP erfolgt durch Spaltung zu Adenosinmonophosohat durch die Phosphodiesterase Zweiter intrazellulärer Signalweg ist die cGMP-Kaskade, die einem ähnlichen Schema folgt - cGMP ist hier beteiligt - GMP-Bildung aus GTP wird von einem Rezeptor aktiviert und das Molekül wirkt über Proteinkinase G - dieses Enzym kann ebenfalls Zielproteine phosphorylieren, moduliert aber über die Hemmung des cAMP-abbauenden Enzyms den cAMP-Signalweg (kann unterschiedlich ablaufen) - cGMP kann darüber hinaus in wenigen Fällen, z.B. bei Sinneszellen, unter Umgehung der Proteinkinase G auch direkt auf Ionenkanäle wirken - Regulation des Insulinspiegels und Relaxation der glatten Muskulatur an den Blutgefäßen sind Beispiele für die cGMP-Wirkung Dritter intrazellulärer Signalweg wird auch als Ca2+ -Signalkaskade bezeichnet und funktioniert wesentlich komplexer - Ausgangspunkt ist ebenfalls ein membranständiger Rezeptor, auf den das Hormon Serotonin als extrazellulärer first messenger wirkt 5 - - - - 6. nach Rezeptoraktivierung wird das membranständige Enzym Phospholipase C stimuliert, das ein Phospholipid der Membran an das Phosphatidylinositol-4,5-biphosphat (IP3) und 1,2-Diacylglycerin (DAG) spaltet DAG bleibt in der Membran und aktiviert die membranständige Proteinkinase C (PKC) durch laterale Wirkung IP3 gelangt ins Cytosol und bewirkt dort eine Entleerung der im ER lokalisierten Ca2+Speicher durch Anstieg des intrazellulären Ca2+ -Spiegels können zellspezifische Reaktionen ausgelöst werden und Ca2+-Kanäle in der Membran aktiviert werden, so dass auch extrazelluläre Ca2+ -Ionen in die Zelle einströmen und die intrazelluläre Ca2+ Konzentration weiter erhöhen neben der phosphorylierenden Wirkung der PKC und der Signalwirkung der intrazellulären Ca2+ -Ionen wird auch die Aktivität des cytoplasmatisch lokalisierten, Ca2+ -bindenden Proteins Calmodulin verändert, das ebenfalls weitere zelluläre Enzyme modulieren kann intrazelluläre Signalwege sind die cAMP-Signalkaskade, die cGMP-Signalkaskade und der über Phosphorinositol- und Diacylglycerinverbindungen regulierte Ca2+ Signalweg strukturelle und funktionelle Gliederung des Nervensystems (Glia-Zellen) ZNS - Zentrales Nervensystem (Systema nervosum centrale) - Übergeordnetes Kontrollsystem – steuert sämtliche willkürliche und unwillkürliche Funktionen der Organe - Schätzungsweise 100 Milliarden Neurone bilden die Gesamtheit der Motoneuronen des zerebrospinalen (somatischen) Nervensystems - Zerstörte Neuronen i.d.R. nicht ersetzbar – Verlust ihrer Funktion! - Nervengewebe des ZNS > Gesamtheit aller Interneurone > Motoneurone des zerebrospinalen, willkürlichen Nervensystems > zentrale Anteile der Axone sensibler Neurone > präganglionäre Motoneurone des unwillkürlichen, vegetativen Nervensystems - Besteht aus Rückenmark (Medulla spinalis) und Gehirn (Encephalon) - Entwicklung aus dem Neuralrohr - Entwicklung im 3-Bläschen-Stadium > Vorderhirn (Prosencephalon) > Mittelhirn (Mesencephalon) > Hinterhirn (Rhombencephalon) - Weitere Entwicklung > Vorderhirnbläschen stülpt sich zum Endhirn (Telencephalon) mit den Seitenventrikeln und dem dahinterliegenden Zwischenhirn (Diencephalon) aus. > Hinterhirnbläschen differenziert sich zum Nachhirn (Metencephalon) mit dem Kleinhirn und zum Markhirn (Myelencephalon, Medulla oblongate) aus - Gehirn > Bilateralsymmetrisch aufgebaut > Schutz durch spezifische Skelettbildung, Hirnschädelkapsel und Wand des Wirbelkanals > schließt Hohlraumsystem von vier Ventrikeln und einem Aquädukt ein, deren Binnenräume mit Gehirnflüssigkeit (Liquor cerebrospinalis) gefüllt sind - Graue Substanz > Kerngebiet (Nucleus) des Inneren Gehirns sowie Rinde (Cortex) des Groß- und Kleinhirns > liegt im Rückenmark zentral und säulenförmig - Weiße Substanz > schließt Leitungsbahnen ein, die der Vernetzung zentraler Kerngebiete dienen und zentrale Abschnitte des Nervensystems mit der Peripherie verbinden 6 PNS - Peripheres Nervensystem - Verbindung zwischen dem ZNS und den Organen - Paarig angeordnete Gehirn- und Spinalnerven, die als Rückenmarksnerven den jeweiligen Rückenmarkssegmenten der Hals-, Brust-, Lenden- und Kreuzwirbelsäule entspringen - Besteht aus Neuronen und Ganglien - Leitungsbahnen des peripheren Nervensystems sind die Nerven - Nerven > Zellausläufer von Nervenzellen, deren Perikaryen (Soma) im ZNS oder in den anliegenden Spinal- bzw. Hirnnervenganglien liegen > Jede Nervenfaser ist in ihrer gesamten Länge der Fortsatz einer einzigen Nervenzelle > vernetzen die Organe und das ZNS untereinander Nerventypen efferente (axonale, motorische) Nervenfortsätze > sendet nervale Impulse Impulse von höheren (ZNS) zu niedrigeren (PNS) Zentren (zentrifugal) > motorische Neurone, da sie die Erregung an Muskeln leiten > Kerngebiete liegen für die peripheren Nerven im Ventralhorn des Rückenmarks oder für die Gehirnnerven im Hirnstamm in der grauen Substanz > jede Muskelzelle steht mit nur einem einzigen Neuron in Verbindung afferente (dendritische, sensible) Nervenfortsätze > leiten von Nervenendigungen oder Sinneszellen in umgekehrter Richtung (PNS zu ZNS) Im ZNS wird der nervale Reiz als Empfindung bewusst – sensibles Neuron periphere Gliazellen (Schwann-Zellen) > Bildner der Myelinscheiden - die meisten Nerven sind gemischte Nerven – sensorische und motorische Fasern sowie auch Nervenfasern des VNS (symphatisch und parasymphatisch) > Nervenfortsätze leiten die Erregung stets nur in eine Richtung > Nervenfaserbündel sind ummantelt von bindegewebigen Hüllen – Leitschienen für Blutgefäße (Vasa ervosum) Motorische Wurzeln > efferente Nervenfasern die in der Ventralwurzel das Rückenmark verlassen und deren Impulse an die Muskulatur geleitet werden Sensible Wurzeln > sensible Impulse der Körperoberfläche oder tieferer Organe verlaufen über die Dorsalwurzel des Rückenmarks in das ZNS und durchlaufen vor Eintritt in das Rückenmark ein sensibles Ganglion (Ganlion spinale) und treten dann als sensible Wurzeln in das ZNS ein Reflex > Erregungen werden unmittelbar von sensiblen Leitungsbahnen auf motorische umgeschaltet ohne das Impulse das Gehirn erreichen Ganglien > Ansammlungen von Nervenzellen (Nervenknoten) außerhalb des ZNS sensible Ganglien: einschließlich der Perikaryen der sensiblen Neurone - alle Spinalganglien, eingelagert in die sensiblen Dorsalwurzeln (Radices dorsales) - im Kopfbereich, die mit den Gehirnnerven in Verbindung stehen vegetative Ganglien: beinhalten die postganglionären Motoneuronen des VNS - im unwillkürlichen Nervensystem als postganglionäre Motoneurone - versorgen glatte Muskelzellen der Organe und Gefäße sowie organspezifische Drüsen > Grenzstrangganglien – Truncus sympathicus > prävertebrale Ganglien – 2. Neuron der sympathischen Bahn für die Bauchorgane > parasymphatische Ganglien – im Kopfbereich > intramurale Ganglien – in der Wand des Magen-Darm-Kanals (Plexus nervorum submucosus und myentericus) Somatisches (willkürliches) Nervensystem - Sensible Neuronen leiten nervale Impulse der Körperoberfläche und aus dem Bewegungsapparat zum ZNS 7 - Reizbeantwortung - unbedingter Reflex > nervaler Impuls durch afferenten, sensiblen Reiz ausgelöst z.B. durch Dehnung eines Muskels oder einer Sehne (Sensoren) > Beantwortung über einfachen Reflexbogen auf efferentes, motorisches Neuron Dehnungsreflex > monosynaptischer Reflex (Eigenreflex) der unbewusst, schnell und gleichförmig abläuft Kniesehnen-, Patellarsehnen- oder Archillissehnenreflex > polysynaptische Reflexbögen (Fremdreflex): mehrere Neuronen an Impulsbeantwortung beteilig - bedingter Reflex: erlernte, erworbene Reflexe VNS - Vegetatives Nervensystem - Anpassung von Organen und Versorgungssystemen an physiologische Bedingungen und Bedürfnisse - Konstanthaltung des inneren Milieus des Körpers > Atmung > Verdauung > Herz-Kreislauf-System > Sexualfunktion > Druck- und Temperaturanpassungen > Sauerstoffgehalt des Blutes - Einteilung VNS Sympathisches Nervensystem (Sympathicus) > Kerngebiete ausschließlich im Rückenmark (thorakolumbal) > Axone treten gemeinsam mit den motorischen Neuronen aus dem Ventralhorn des Rückenmarks aus und ziehen zum Grenzstrang (Truncus sympathicus) > Aktivierung der Lebensfunktionen (katabole Funktion) - Erhöhung Blutdruck, Atem- und Herzfrequenz - Verengung der Gefäße - Gewinnung von Glukose (Glykolyse) - Steigerung Schweißsekretion, Aufstellen der Haare, Erweiterung der Pupille - Reduktion der Verdauungsprozesse > Neurotransmitter: Noradrenalin; Kotransmitter: Neuropeptid Y > Sympathomimetika: Reizverstärkung; Sympatholytika: heben Wirkung am Rezeptor weitgehend auf > ß-Blocker vermindern Herzfrequenz und senken durch Gefäßerweiterung den Blutdruck Parasympathisches Nervensystem (Parasympathicus) > größter Anteil der Fasern verläuft im N. Vagus (X. Gehirnnerv) > Kerngebiete: Hirnstamm (kranialer Parasympathicus) und Sakralmark (pelviner Parasympathicus) > postganglionäre Neurone liegen in den parasympathischen Kopfganglien sowie in den prävertebralen und intramuralen Ganglien der Organe > wirkt hemmend auf den Energieverbrauch im Körper (trophotrope Funktionen) - Absenkung der Atem- und Herzfrequenz bis auf Basiswerte - Verengung der Bronchen - Verengung der Pupille - Steigerung der Verdauungsprozesse - Steigerung des Stoffwechsels > Neurotransmitter: Acetylcholin / Kotransmitter: z.B. vasoaktives intestinales Peptid (VIP) > Parasympatholyticum: Atropin > erweitert lokal appliziert die Pupille ENS - enterales Nervensystem (auch intramurales NS) - eigenständiger Teil des vegetativen Nervensystems und unabhängig vom sympathischen und parasympathischen Nervensystem - lokalisiert in der Wand des gesamten Magen-Darm-Kanal (Oesophagus bis Rektum) 8 - sowohl anatomisch, als auch funktionell zweigeteilt: Plexus myentericus (Auerbach Plexus): > in kleinen Ganglien gesammelte multipolare Nervenzellen und Fasern des VNS > in der Tunica muscularis zwischen der Längs- und Zirkulärmuskulatur sowie Cajal Zellen > reguliert Darmmotilität (Peristaltik) > steuert Sekretion (z.B. von Enzymen) der Magen-Darm-Wand Plexus submucosus (Meissner-Plexus): > Anhäufungen von Ganglienzellen und Nervenfasern > zwischen Tunica muscosa und Tunica muscularis, fast im kompletten Gastrointestinaltrakt > innerviert dünne Schicht von glatten Muskelzellen der Lamina muscularis mucosae (Feinbewegung der Darmschleimhaut) > steuert autonom die Sekretion Drüsen im Magen-Darm-Trakt > Gesamtaktivität beeinflusst durch sympathisches und parasympathisches Nervensystem - beide Plexus spielen eine Rolle bei der Regulation der Durchblutung - das ENS kann Effektoren, wie Muskel und Mucosa, getrennt ansteuern und deren Aktivität stimulieren oder hemmen und ist darüber hinaus auch in der Lage deren Aktivitäten zu koordinieren (Sekretion und Muskelkontraktionen während der Propulsion des Darminhaltes sind z.B. zeitlich aufeinander abgestimmt) - Sekretion von Wasser, Elektrolyten und Mucus erfolgt vor der propulsiven Kontraktion der Muskulatur (zusätzlich wird Durchblutung erhöht, um Sekretion von Flüssigkeit und Elektrolyten zu unterstützen) - um diese Funktionen zu regulieren existieren im ENS funktionell unterschiedliche Zelltypen - das ENS besitzt sensorische Neurone, Interneurone und Motoneurone, die für die Regulation komplexer Vorgänge zwingend erforderlich ist - auch „Bauch-Gehirn“, dass eine Reihe von Reflexschaltkreisen besitzt, die es je nach Stimulus installieren kann - für die Kommunikation innerhalb des Systems und für die Kontrolle der Effektorsysteme steht die enorme Anzahl von etwa 25 Transmittersubstanzen zur Verfügung - Sensorische Neurone: > die intrinsischen Sensoren fungieren als primär eigenständige afferente Nerven und sind für die Eigenständigkeit des Magen-Darm-Kanals von entscheidender Bedeutung > Signale der enterischen Sensoren beeinflussen primär andere enterische Nervenzellen > sie codieren hauptsächlich mechanische und chemische Reize > Mechanozeptoren registrieren die Wandspannung, die intraluminalen Drücke oder Volumenveränderungen > Mechanosensible Nerven in der Mucosa werden durch Scherreize erregt > Chemozeptoren reagieren auf Nährstoffe, die Osmolarität oder den pH des luminalen Inhaltes - Interneurone: > Kommunikation zwischen enterischen Nervenzellen wird durch Interneurone sichergestellt, die Millionen von synaptischen Verbindungen zu enterischen Nervenzellen aufrechterhalten > sie verarbeiten Signale, die von anderen enterischen Nervenzellen oder auch vom Gehirn kommen und scheiden über die Aktivierung oder Hemmung der verschiedenen Reflexschaltkreise > wie im Gehirn sind die interneuronalen Schaltkreise Basis für höhere Funktionen eines integrativen Nervensytems - Motoneurone: > innervieren die Effektorsysteme und sind die letzten Glieder enterischer Schaltkreise > Signale der sensorischen bzw. Interneurone werden über erregende postsynaptische Signale (EPSPs) an die Motoneurone weitergegeben > Transmitter, die diese EPSPs erzeugen, sind ACh und eine Reihe von Neuropeptiden > man unterscheidet zwischen Muskel-, Sekreto- und Vaso-Motoneuronen > Aktivierung kann zu Hemmung oder Erregung der Effektoren führen, je nachdem ob die Motoneurone hemmende oder erregende Neurotransmitter ausschütten > wichtigster erregender Neurotransmitter der Muskel-Motoneurone ist Acetylcholin, 9 das muscarinerge Rezeptoren auf den glatten Muskelzellen der Magen-Darm-Wand aktiviert und motilitäts-stimulierend wirkt; außerdem gibt es noch die Substanz P (ein Neuropeptid, das erst bei länger anhaltender Stimulation freigesetzt wird) > wichtigste hemmende Muskel-Motoneurone sind Stickstoffmonoxid (NO), Vasoaktives Intestinales Peptid (VIP), Pituitary Adenylate-Cyclase Activating Peptide (PACAP) und Adenosintriphosphat (ATP); ihre hemmende Wirkung führt zu einer Relaxtation des Darms 7. Neuron und Synapse Neuron = Nervenzelle - erregbare Zellen mit unterschiedlicher Form und Funktion - dienen der Aufnahme, Verarbeitung und Weiterleitung von Informationen in mehrzelligen Organismen - Ganglion: Ansammlung von Nervenzellen in der Nähe von Sinnesorganen - Coelenterata (Nesseltiere und Rippenquallen): haben bereits einfache Nervennetze (Konzentration von Neuronen in Ring- und Längssysteme) - Cephalisation: Gehirnbildung am Vorderende der höheren Tiere. Dazu sind mehrere Ganglien durch kurze Verbindungen (Kommissuren) vernetzt - im peripheren Nervensystem verschiedene Organisationsprinzipien: > Strickleiternervensystem von einigen Anneliden > Bauchmark von Insekten > Rückenmark der Wirbeltiere - Synapsen verbinden Neuronen zu größeren funktionellen Einheiten - prinzipiell gleich aufgebaut: Dendriten am Soma (Zellkörper), die eingehende Signale aufnehmen und im Soma integriert werden und zum Axonhügel weitergeleitet werden. Dort entstehen aus der von den Dendriten zusammengefassten Information die Aktionspotentiale, deren Frequenz die Information codiert. Die Serie der APs wird über das vom Soma ausgehende Axon weitergeleitet und führt in den Synapsen zur Freisetzung von Transmittersubstanzen (Überträgerstoffe), die wiederrum auf die Dendriten eines folgenden Neurons oder auf eine andere Effektorzelle (z.B. Muskelzelle) wirken >> der Informationsfluss geht immer von den Dendriten zur Synapse !!! - Efferente Erregungsleitung: Axon leitet elektrisches Signal zu anderen Neuronen im ZNS und PNS oder zu Effektorzellen - Afferente Erregungsleitung: Dendriten nehmen die Signale von Axonen anderer Zellen auf und führen diese dem Soma zu - Kollaterale: Verzweigungen des Axons am distalem Ende um Informationen gleichzeitig an verschiedene Zellen abzugeben > Kontakt zu nachgeschalteten Neuronen = Divergenz - Konvergenz: Efferenzen von vorgeschalteten Neuronen bilden synaptische Kontakte an derselben Nervenzelle - Neuronentypen > Motoneuronen (motorische Nervenzelle > multipolar) - leiten bei Wirbeltieren Informationen vom Rückenmark zur Muskulatur und beeinflussen deren Aktivität - Axon kann deshalb über 1 m lang werden > Interneurone (bipolar) - stellen im Nervengewebe lokale Verbindungen her - vermitteln Informationen über geringe oder große Entfernungen zwischen Nervenzellen > Sensible Neurone (pseudounipolar) - Reizwahrnehmung und Übermittlung von Informationen > Purkinje-Zellen - kommen nur im Kleinhirn vor - beteiligt an der Bewegungssteuerung - Funktion der Feinkoordination vieler anderer Nervenzellen - stark verzweigter Dendritenbaum – verarbeitet viele eingehende Informationen, bündelt diese und leitet diese über das kurze Axon gezielt weiter 10 - Besonderheit gegenüber nicht-erregbaren Zellen sind die spannungssensitiven NatriumKanäle - neben Ruhepotenzial kann Aktionspotenzial ausgebildet werden - Aktionspotentiale und die Pausen zwischen ihnen bilden Informationen, ähnlich wie beim Computer (An = 1 und Aus = 0) - Neben den Nervenzellen ist ein Nervensystem aus Gliazellen aufgebaut, die die Neuronen unterstützen > Glia = gr. Leim, Kitt > Verhältnis Gliazellen : Neurone > 10 : 1 > keine Aktionspotenziale, sind zeitlebens teilungsfähig > können den Effekt von Transmittersubstanzen modulieren (vermitteln), sind aber nicht selbst an der Informationsübertragung beteiligt > Füll- und Stützgewebe: Können Defekte im Nervensystem durch Wucherungen ausfüllen > Ernährungsfunktion > Isolierungsfunktion > Pufferung von K+ > Beeinflussen Anzahl der Synapsen > Immunfunktion, Phagozytose > Regeneration der Nervenfaser, Rolle von Wachstumsfaktoren > Zentrales Nervensystem: hauptsächlich Stützfunktion: Oligodendrozyten > umhüllen Neurone Ernährungs- und Entsorgungsfunktion: Astrozyten > Versorgungszellen, umhüllen Neurone und sorgen Stoffe mit diesen aus, außerdem beteilig an Blut-Hirn-Schranke Phagozytose: Mikroglia > Peripheres Nervensystem: Schwann-Zellen > umhüllen Neurone und bilden um Axone des PNS die isolierende Myelinscheide (Schwannsche Scheide), die eine besondere Funktion für die Weiterleitung des Aktionspotentials hat > myelinisierte, Markhaltige Neurone >> Gegensatz: nicht myelinisierte, marklose Neurone 8. Ruhemembranpotential - Erregung Neuron > Gegenteil: Aktionspotential basaler Zustand: Ruhepotential - Grundvoraussetzungen > ungleiche Ionenverteilung zwischen dem Extrazellulärraum (EZR) und dem Intrazellulärraum (IZR) > Konzentrationsgradienten Extrazellularraum Intrazellularraum Blutplasma Cytoplasma mmol / Liter Anionen Natrium Na+ Kalium K+ Calcium Ca2+ 142 4 2,5 10 (8 – 30) 155 (100 – 155) 0,1 – 1 µmol/l Verhältnis 14 : 1 1 : 39 > 2.500 : 1 Kationen 11 Chlorid ClBicarbonat HCO3- 103 27 4 (4 – 30) 10 (8 – 15) 26 : 1 2,7 : 1 > selektive Permeabilität der Zellmembran > Leitfähigkeit für K+-Ionen höher als für Na+ und Cl> K+-Diffusionspotenzial, K+-Gleichgewichtspotenzial > Aktivität der Na+/K+-Pumpe > Ruhepotenzial - Selektive Permeabilität der Zellmembran > Hauchdünne Doppellipidschicht > Oberflächen hydrophob, Barriere zwischen IZF und EZF > Gut durchlässig für lipophile Substanzen (nichtdissoziierte Fettsäuren, Steroidhormone, Gase) > Schlecht durchlässig für hydrophile Substanzen (z.B. Kationen, Anionen) > Transportproteine > selektive Permeabilität > bewirkt Ladungstrennung > Diffusionspotenziale - Elektrochemisches Gleichgewicht, Nernst-Gleichung, erweiterte Form der NernstGleichung: Goldman-Hodgkin-Katz-Gleichung passive Membranantwort: tonische Potenziale - Definitionen > Das Ruhemembranpotential einer Nervenzelle liegt bei -70 bis -90 mV > Abweichungen nach oben werden als Depolarisation bezeichnet (erleichtert die Erregbarkeit) > Abweichungen nach unten werden als Hyperpolarisation bezeichnet (erschwert die Erregbarkeit) > Am Schwellenpotenzial (-50 bis -60 mV) erfolgt die aktive Membranantwort, es kommt zu einem Aktionspotenzial nach dem Alles-oder-Nichts-Prinzip > unterschwellige und überschwellige Reize erzeugen passive bzw. aktive Membranantworten - Passive Membranantwort = tonische Potenziale (Elektrotonus) > Passive elektrische Eigenschaften der Nervenzelle Kabeleigenschaften - wichtig für Sinneszellen > Soma - Dicke der Membran ~6 nm - verschiedene Leitfähigkeiten für geladene Teilchen > Membranwiderstand, Membrankapazität > Membranzeitkonstante τ (1 – 20 ms) > Dendrit, Axon: Längswiderstand > Membranlängskonstante λ (0,1 – 2 mm) > Folge: Zeitliche und räumliche Begrenzung der Fähigkeit der Zellmembran, elektrische Informationen weiterzugeben bzw. weiterzuverarbeiten - Zusammenfassung „Tonische Potenziale“ > „Schnelligkeit“ des tonischen Potenzials (Membranzeitkonstante τ) wichtig für zeitliche und räumliche Summation von synaptischen Erregungen > „Reichweite“ des tonischen Potenzials (Membranlängskonstante λ) wichtig für die Erregungsweiterleitung - Refraktärphase > Absolute Refraktärphase (~ 1-2 ms) - Depolarisationen beliebiger Höhe und Dauer können kein neues Aktionspotential auslösen (Frequenzbegrenzung max. 500/s) > Relative Refraktärphase (~ 4 ms) - schließt sich an die absolute Refraktärphase an - hier können einige Na+-Kanäle bei ausreichend hoher und langer Depolarisation erneut geöffnet werden (ist aber unphysiologisch) > Die Refraktärität basiert auf dem Aktivierungsverhalten des Na+-Systems: geschlossen aktivierbar, geöffnet aktiviert, geschlossen inaktiviert Konsequenzen der Refraktärphase > Begrenzung der Übererregbarkeit (max. „Aktionspotentiale feuern“ z.B. in der Retina 100 Hz) 12 > Gerichtete Erregungsleitung (die Erregung kann sich nur in Richtung der „aktivierbaren“ Membran fortpflanzen, nicht aber in Richtung der „nicht aktivierbaren, refraktären“ Membran 9. Skelettmuskulatur - quergestreifte Muskulatur - vor allem für die willkürlichen, aktiven Bewegungen Körperbewegungen zuständig - unterteilbar in rote und weiße Muskulatur > rote Muskulatur (Rotfärbung durch höheren Gehalt an Muskelfasern mit oxidativer Energiegewinnung) ist eher für die ausdauernden Bewegungen zuständig (überwiegt also bei Ausdauersportlern) > weiße Muskulatur kann schneller kontrahieren und stärkere Bewegungen ausführen (bildet also bei Kraftsportlern einen erheblichen Teil der Muskelmasse) - Die Befestigung eines Skelettmuskels erfolgt über Sehnen am Skelett oder an Faszien und wird in Ansatz und Ursprung unterteilt - Aufbau > Ein Skelettmuskel besteht aus Muskelfasern, die bis zu 15 cm lang sein können und außen von Bindegewebe (Faszie) umhüllt sind > Ein Skelettmuskel ist in seiner Gesamtheit von Bindegewebe umgeben (Epimysium), von dem so genannte Septen in das Innere ziehen und sowohl die einzelnen Muskelfasern (Endomysium) umhüllen als auch Gruppen von Muskelfasern zu Muskelfaserbündeln zusammenfassen (Perimysium) Jede Muskelfaser ist aus Tausenden von fadenförmigen Strukturen aufgebaut, den so genannten Myofibrillen. Diese durchziehen nebeneinander die Muskelfaser der Länge nach und sind aus kleineren Einheiten aufgebaut, den Myofilamenten. In diesen Eiweißstrukturen verläuft die Muskelkontraktion durch gegenseitiges Ineinanderschieben. > Grundlage der Muskelbewegungen sind die kontraktilen Einheiten, die aus parallel angeordneten Actin- und Myosinfilamenten bestehen. > Die globulären Moleküle des Actins bestehen aus einem schraubenartig verdrillten Doppelstrang des F-Actins, in dessen Furche ein weiterer Proteinstrang (Tropomyosin) verläuft. In regelmäßigen Abständen von 6 nm ist ein weiteres kugelförmiges Protein (Troponin) angelagert. > Die Myosinfilamente bestehen aus einem Myosinstab an dessen Ende der Myosinkopf gelenkig angelagert ist. Die Filamente sind so angeordnet, dass die bündelförmig zusammengelagerten Myosinfilamente mit den nach außen gerichteten Myosinköpfchen zwischen die Actinfilamente gleiten können. Dadurch verkürzt sich das kontraktile Element nach dem sogenannten Gleitfilamentmechanismus. 10. Monosynaptischer (Eigen-) Reflex (Muskelspindel) Muskelspindeln - Sinnesorgane in den Muskeln, die den Dehnungszustand der Skelettmuskulatur erfassen - gehören zur Gruppe der Propriozeptoren und sind PD-Sensoren (Proportional- und Differentialeigenschaft) - schützen Muskeln vor Überdehnung - bei plötzlicher Dehnung des Muskels lösen sie den so genannten Dehnungsreflex aus, wodurch sich der Muskel wieder zusammenzieht > z.B. Patellarsehnenreflex (Kniesehnenreflex) - bestehen aus fünf bis zehn (Menschen: 1 - 3 mm lang) quergestreiften Muskelfasern, die von einer Bindegewebshülle umgeben sind - zwischen den Muskelfasern des Beinstreckers (M. quadriceps femoris) im Oberschenkel 500 – 1.000, bis zu 10 mm lang - je mehr Muskelspindeln in einem Muskel vorhanden sind, desto feiner können die mit diesem verbundenen Bewegungen abgestimmt werden - liegen parallel zur Arbeitsmuskulatur und enthalten zwei Typen von intrafusalen Muskelfasern > Kernkettenfasern (P-Sensor) > Kernsackfasern (D-Sensor) 13 - beide sind von den Endigungen afferenter Typ-Ia-Neuronen spiralförmig umwickelt - Kernkettenfasern zusätzlich von solchen afferenter Typ-II-Neuronen Eigenreflex - Liegen Rezeptor und Effektor im gleichen Organ, können die Reize sehr schnell beantwortet werden > Der Reflex wird dann als Eigenreflex bezeichnet und die Erregungsübertragung verläuft monosynaptisch z.B. Patellarsehnenreflex Dehnungsreflex - sie nicht kontraktile Mitte der Muskelspindelfasern ist von afferenten sensiblen Nervenfasern, den Ia-Fasern umsponnen - wird der Muskel gedehnt, wird auch die Muskelspindel und somit der mittlere Teil gedehnt, wodurch in den Ia-Fasern ein Signal (Aktionspotential) erzeugt wird - das Signal wird über den Spinalnerv ins Hinterhorn der grauen Substanz des Rückenmarks weitergeleitet und über eine Synapse im Vorderhorn monosynaptisch auf α-Motoneurone übertragen, welche die Kontraktion der Skelettmuskelfasern im gedehnten Muskel bewirken - das α-Motoneuron divergiert, verzweigt sich, wobei ein Ast zur Renshaw-Zelle geht, die durch ihren hemmenden Einfluss auf das sie zuvor innervierende α-Motoneuron bewirkt, dass die Kontraktion des jeweiligen Muskels nur kurzzeitig erfolgt - durch diese negative Rückkopplung kann trotz Störungen eine bestimmte Muskellänge konstant aufrechterhalten werden - je weniger Muskelfasern von einem α-Motoneuron innerviert werden, umso feiner abgestimmt kann die Bewegung sein: Bei Augen- und Finger-Muskeln versorgt ein Motoneuron etwa 100 Muskelfasern, bei anderen Muskeln bis zu 2000 - Leitungsgeschwindigkeit > α-Motoneurone beträgt 80 bis 120 ms-1 > γ-Motoneurone 40 ms-1 Steuerung der Muskellänge - Über die sogenannte γ-Spindelschleife lässt sich die Muskellänge steuern - die Muskelfasern der Muskelspindeln (intrafusale Muskelfasern) sind an den kontraktilen Enden mit motorischen Nervenfasern, den γ-Motoneuronen, verbunden - werden diese aktiviert, kontrahieren sich die Enden der Muskelspindelfasern - dadurch wird aber ihre Mitte gedehnt, die Ia-Fasern erzeugen ein Aktionspotential, welches wiederum ins Hinterhorn des Rückenmarks geleitet und auf α-Motoneurone übertragen wird - diese lösen eine Kontraktion der Skelettmuskelfasern aus, wodurch die Muskelspindel und damit auch der mittlere Teil der Muskelspindelfasern entspannt wird - dies geschieht solange, bis die Ia-Fasern keine Dehnung mehr wahrnehmen Spindelpause - Die Spindelpause erfolgt bei statischer Muskelarbeit. Es werden erst die α-Motoneurone aktiviert, später dann die γ-Motoneurone Dadurch kommt es zu folgenden Erscheinungen: Die extrafusalen Fasern (Muskelfasern außerhalb der Muskelspindeln) verkürzen sich (der Impuls läuft durch den willkürlichen motorischen Kortex, also über die Pyramidenbahn) Der mittlere Teil der Muskelspindel erschlafft dadurch Da keine Spannung mehr auf den Fasern ist, erfolgt auch keine Impulsleitung mehr (Spindelpause) > Der Rezeptor ist in diesem Moment inakti Empfindlichkeitsregulierung - Die Empfindlichkeitsregulierung erfolgt unbewusst über die γ-Motoneurone des efferenten Systems in Zusammenarbeit mit dem afferenten Teil 14 - die Spindel ist der einzige Rezeptor im Körper, der efferent versorgt wird, alle anderen werden nur afferent versorgt - eine ähnliche Anpassung an einen Stimulus findet man allerdings auch bei den Haarzellen des akustischen Systems Regelkreis - Die Muskelspindeln sind Elemente eines komplexen Steuer- und Regelsystems, welches folgende Bedeutungen hat: Schutz vor Überdehnung der Muskeln durch den Dehnungsreflex Einstellung und Aufrechterhaltung einer konstanten Muskelspannung (Tonus) dadurch Aufrechterhaltung einer bestimmten Gelenk- und Körperstellung Feindosierung von Bewegungen durch Zu- und Abschalten von Muskelfasern - die motorischen Zentren des Gehirns als Führungsglied dienen als Sollwertgeber für die Länge von Muskeln - der Sollwert wird als Aktivität der γ-Fasern an das Regelglied Muskelspindel weitergegeben - in der Muskelspindel wird der Istwert, die Länge der Muskelfasern und damit die Länge der mit den Muskelfasern fest verbundenen Muskelspindel, mit dem Sollwert verglichen - ist der Istwert kleiner, bedeutet dies, dass die Mitte der Muskelspindelfasern gedehnt ist - dieser Faserabschnitt dient als Messglied, seine Dehnung wird als Aktivität der IaNervenfasern codiert und als Stellwert über die α-Motoneurone an die Muskelfasern übertragen - deren Kontraktion wirkt als Stellgröße so lange, bis die Muskelspindel soweit verkürzt ist, dass die Fasermitte nicht mehr gedehnt ist - als Störgröße wirkt jede Dehnung der Muskeln, ob bei Lageveränderungen des Körpers, Schlag auf die Sehne oder Kontraktion des Antagonisten - α- und γ-Motoneurone sind mit motorischen Zentren des Gehirns verbunden, so dass Muskelkontraktionen willkürlich und unwillkürlich gesteuert werden können - bei komplexen Bewegungsabläufen, wie zum Beispiel dem Gehen, ändert das Gehirn die Sollwerte für verschiedene Muskelgruppen entsprechend dem Bewegungsprogramm 11. Muskelfasertypen und motorischen Einheit - ein einzelnes Motoneuron bildet zusammen mit allen von ihm innervierten Muskelfasern eine sogenannte motorische Einheit (ME) - die Muskelfasern einer einzelnen ME können über größere Anteile des Muskelquerschnitts verteilt sein - zu deren Versorgung spaltet sich das Motoneuron in Kollateralen und deren Endbäumchen - drei verschiedene Typen von Zuckungsfasern werden unterschieden: > langsam zuckende (Typ S = slow) >schnell zuckende (Typ F = fast oder mit den Untertypen FR und FF) - Typ S –Fasern sind wenig ermüdbar und auf Dauerleistung ausgelegt; Kapillar- und Mitochondriendichte, Gehalt an Fetttröpfchen und Myoglobin sind hoch (rote Farbe) und sie haben einen stark entwickelten oxidativen Stoffwechsel - Typ F –Fasern dienen v.a. kurzzeitigen, schnellen Kontraktionen, sie sind rasch ermüdbar, enthalten viel Glykogen und wenig Myoglobin - Verteilung der Typen ist je nach Muskel unterschiedlich (in „roten“ Muskeln überwiegen MEs vom Typ S; in „weißen“ Muskeln die vom Typ F - je mehr MEs ein Muskel hat, desto feiner kann die Kontraktion abgestuft werden - beim auf kurze Sprintstrecken spezialisierten Quarterhorse sind 93% der vorhandenen Fasern schnell kontrahierende und damit schneller ermüdende Fasern und 7% sind langsam kontrahierende und damit langsam ermüdende Fasern - Zahl der schneller ermüdenden Fasern ist beim Vollblüter niedrigen - beim schweren Hunter sind nur noch 69% schnelle Fasern und 31% langsame - bei Hunden ist die Verteilung der Muskelfasertypen mit der bei Pferden vergleichbar (bei Sprintern, wie den Greyhounds sind 97% schnelle Fasern; Foxhounds , die eine gute Ausdauerleistung bringen müssen haben nur 65% schnelle Fasern 15 - beim Kamel überwiegen die langsamen Fasern (langsame Tiere mit hoher Audauer); Menschen genauso - für länger andauernde Arbeit ist es entscheidend, dass die aerobe ATP-Produktion groß ist - Sauerstoffaufnahme ist deshalb für die Beurteilung des Stoffwechsels bei Ausdauerbelastung von besonderer Bedeutung TYP I TYP IIA TYP IIB S FR FF Langsam Schnell Schnell Oxidative Kapazität hoch Mittel bis hoch Gering Kapillardichte Hoch mittel Niedrig Glykogengehalt Mittel Hoch Hoch Ermüdung gering Mittel Hoch Kontraktionsgeschwindigkeit s= slow; FR= fast, resistant to fatigue; FF= fast fatigable 12. Vorgänge an der motorischen Endplatte (Curare, Hypocalzämie) - Die motorische Endplatte überträgt die Erregung von einer Nervenfaser auf die Muskelfaser - sie stellt eine chemische Synapse mit dem Transmitter Acetylcholin dar - sie besteht aus einem mikroskopisch sichtbaren Synapsenendknöpfchen in Form einer Aufquellung am Ende eines Axons (präsynaptisch) und - nur getrennt durch den synaptischen Spalt - einem dicht anliegenden, speziell strukturierten Membranteil einer Muskelfaser (postsynaptisch) - Am präsynaptischen Teil der Synapse ankommende Aktionspotenziale bewirken die Öffnung von Calciumporen. Das einströmende Calcium (Ca2+) setzt Vesikel, die sich im Synapsenendknöpfchen befinden und Acetylcholin enthalten, in Bewegung. Die Vesikel bewegen sich in Richtung des synaptischen Spaltes, bis sie zur Membran des Endknöpfchens gelangen und mit der Membran verschmelzen. Dabei schütten sie Acetylcholin in den synaptischen Spalt aus. Acetylcholin bindet an - Acetylcholinrezeptoren in der postsynaptischen Membran der Muskelzelle > Diese Rezeptoren enthalten Ionenkanäle, sie sind ionotrop > Der ionotrope Acetylcholinrezeptor wird auch als nikotinerger Acetylcholinrezeptor bezeichnet, da Nikotin als Agonist auf ihn wirkt. Das Nikotin des Rauchers erreicht aber lokal keine ausreichende Konzentration, um eine relevante Wirkung zu erzielen. Der Acetylcholinrezeptor ist ein unspezifischer Kationenkanal, der für Natrium-, Calcium- und Kalium-Ionen leitfähig ist > Durch die unterschiedlichen Triebkräfte für diese Ionen fließt vor allem ein durch Natrium- und Calcium-Ionen getragener Strom durch diesen Kanal. Die Folge ist eine Depolarisation der Muskelzelle, die das so genannte Endplattenpotenzial von einem Ruhemembranpotential auf ein Generatorpotential positiviert. Dieses Generatorpotential ist ein elektrotonisches Potential. Das heißt, es breitet sich passiv über die Muskelfasermembran aus (im Gegensatz zum Aktionspotenzial). Überschreitet das Generatorpotential das Schwellenpotenzial, öffnen sich spannungssensitive Natriumkanäle und ein Aktionspotenzial entsteht > Das Aktionspotenzial löst durch den daraufhin folgenden Calcium-Einstrom die Muskelkontraktion aus: - Über die Öffnung spannungsaktivierter Calcium-Kanäle in den (transversalen) T-Tubuli 16 - - der Muskelzelle und Aktivierung von intrazellulären Ryanodin-Rezeptoren kommt es zu einer Ausschüttung von Calcium-Ionen aus dem sarkoplasmatischen Retikulum (dem ER der Muskelzelle). Der resultierende starke Anstieg der intrazellulären CalciumKonzentration bewirkt die Kontraktion der Muskelzelle. Calcium-Ionen üben somit eine Schlüsselrolle bei der elektromechanischen Kopplung, der Verbindung von elektrischer Erregung an der Membran bis zur Kontraktion aus Acetylcholin wird aus dem synaptischen Spalt durch das Enzym Acetylcholinesterase hydrolysiert und damit abgebaut Wenn die Funktion der Acetylcholinrezeptoren z. B. durch Autoimmunantikörper gestört wird, kann es zu muskulärer Ermüdbarkeit und Schwäche (Myasthenia gravis) kommen Curare: Gift das an die AcH-Rezeptoren bindet, diese aber nicht aktiviert. Das AcH kann also nicht mehr an die Rezeptoren binden und somit. Deswegen bewirkt Curare Muskellähmungen. Zum Tode führt es dadurch, dass es zu einer Lähmung der Atemmuskulatur kommt und dadurch zum Atemstillstand. Da das ZNS weitgehend intakt bleibt und auch der Herzmuskel nicht betroffen ist, muss der Patient ausreichend beatmet werden, bis die Wirkung nachlässt. Tödlich wirkt das Curare nur verabreicht über die Blutbahn, nicht aber über den Verdauungstrakt Hypokalzämie: wenn der Calciumspiegel im Serum unter 2,2 mmol/l (9 mg/dl) oder der Gehalt von Calciumionen unter 1,1 mmol/l (4,5 mg/dl) liegt. Sie bewirkt eine Störung des Gleichgewichts zwischen verschiedenen Elektrolyten und kann zu einer Übererregbarkeit des Nervensystems führen, was sich in Krämpfen in der Skelettmuskulatur äußert. In einigen Fällen wird auch ein Spasmus der glatten Muskulatur ausgelöst. Im Allgemeinen wirkt das Parathormon der Hypocalzämie kurzfristig entgegen. 13. Calciumhaushalt - Calcium ist ein Mengenelement (Element mit mehr als 50 mg pro kg Körpergewicht), also kein Spurenelementen - Mit einem Körperbestand von 1 – 1,1 kg ist Calcium der mengenmäßig am stärksten vertretene Mineralstoff im menschlichen Organismus - 99 % des im Körper vorkommenden Calciums befinden sich in Knochen und Zähnen – die calciumreiche Verbindung Hydroxylapatit (Ca5(PO4)3(OH)) verleiht ihnen Stabilität und Festigkeit. Gleichzeitig dienen die Knochen als Speicher für Calcium – bei Calciummangel kann ein Teil davon aus den Knochen gelöst und für andere Aufgaben zur Verfügung gestellt werden - Die Knochenentkalkung (Osteoporose) kommt vor allem bei älteren Menschen vor - Innerhalb der Zellen ist Calcium an der Erregung von Muskeln und Nerven, dem GlykogenStoffwechsel, der Zellteilung sowie an der Aktivierung einiger Enzyme und Hormone beteiligt - Erst der Einstrom von Calcium-Ionen in die Muskelzellen führt zu einer Kontraktion der Muskulatur - Außerhalb der Zellen ist Calcium an der Blutgerinnung und der Aufrechterhaltung der Zellmembranen beteiligt - Im Blut muss ständig eine Konzentration von 2,1 – 2,6 mmol/l Calcium gegeben sein. Sie wird durch die Hormone Calcitriol, Calcitonin und Parathormon reguliert - Nur 0,1 % des im Körper vorhandenen Calciums findet sich im Extrazellulärraum, > davon ist 30–55 % an Proteine gebunden, > 5–15 % liegt in Form von Komplexen vor (z. B. Calciumhydrogencarbonat, Calciumcitrat, Calciumsulfat, Calciumphosphat oder Calciumlactat) - Nur ca. 50 % des extrazellulären Calcium liegt in frei ionisierter und damit in biologisch aktiver Form vor - Ein erhöhter Calcium-Spiegel im Blut wird als Hyperkalzämie bezeichnet - ein zu niedriger Calcium-Spiegel als Hypokalzämie. 14. Gasaustausch im Gewebe - Atmung > Zellatmung: oxidative Umsetzung von Nährstoffen in der Zelle 17 - - - - - - > externer und interner Gasaustausch: Aufnahme und Abgabe der Atemgase und deren Transport im Körper und zu den Zellen Gasaustausch bei einfachen Organismen (z.B. Anneliden) über Körperoberfläche Höhere Organismen haben Kiemen und Lungen entwickelt Transport der Atemgase erfolgt überwiegend über das Blut und die Hämolymphe > Insekten haben ein eigenes Transportsystem ausgebildet: Tracheen Zum Transport von Atemgasen im Blut sind spezielle Atmungspigmente notwendig: Hämoglobin diffundiert ein Gas wird dabei nicht die Konzentration berücksichtigt, sondern der Partialdruck von z.B. Sauerstoff und Kohlendioxid gelangt das arterielle Blut ins Gewebe ist sein pCO2 geringer als in den umgebenden Zellen, da diese als Endprodukte des Stoffwechsels unter anderem große Mengen von CO2 bilden das CO2 diffundiert deshalb entlang des Druckgradienten in die Kapillaren, in den jedoch nur ein geringer Teil des CO2 physikalisch im Blut gelöst wird Der überwiegende Teil des CO2 diffundiert in die Erythrozyten und wird dort mit Hilfe der Carboanhydrase (Enzym) als Katalysator schnell in Kohlensäure (H2CO3) umgesetzt, welche dann im intrazellulären pH-Milieu der Erythrozyten (pH-Wert 7,2) sofort in Protonen (H+) und Bicarbonat (HCO3-) dissoziiert Da im Inneren der Erythrozyten eine Ionenhomöostase herrscht sind die meisten der neu gebildeten Bicarbonationen im Überschuss vorhanden und diffundieren über einen Anionenaustauscher (Bande-3-Protein) ins Blutplasma im Austausch mit Cloridionen die ins Innere strömen >> Chloridverschiebung Die anfallenden H+-Ionen werden zum größten Teil durch das Hämoglobin gepuffert, was durch die gleichzeitige Abgabe von O2 an das Gewebe begünstigt wird, weil desoxygeniertes Hämoglobin die Protonen noch besser bindet. Gleichzeitig begünstigt die Protonenbindung an das Hämoglobin die diese O2-Abgabe und verbessert die CO2Aufnahme der Erythrozyten > Haldane Effekt Etwa 5 % des in das Kapillarblut diffundierten CO2 bindet direkt an NH2-Gruppen des Hämoglobins und bildet eine Carbaminoverbindung (Carbamat) und wird so in den Erythrozyten zur Lunge transportiert Da die Carbamatbildung vom desoxygenierten Hämoglobin begünstigt wird, wird das CO2 bei der O2-Beladung des Hämoglobins in den Lungenkapillaren vom oxygenierten Hämoglobin wieder freigesetzt - In den Lungenkapillaren laufen die Reaktionen umgekehrt ab: > da hier das Blut einen geringeren pCO2 hat, diffundiert HCO3- aus dem Plasma in die Erythrozyten zurück und verbindet sich mit H+ zu Kohlensäure, die wieder zu H2O und CO2 zerfällt > Das CO2 diffundiert dann entlang einen Druckgradienten über das Kapillar- und Alveolarepithel in den Alveolarraum, aus dem es durch die Ventilation in die Umgebung abgegeben wird 18 - die Luft gelangt an das Alveolargewebe (speziell ausgebildetes Atmungsepithel), dort treten die Gase einfach durch Diffusion in das Blut über. Dazu müssen die Gase zwei zelluläre Barrieren überwinden, die jeweils nur einschichtig ausgebildet sind > Alveolarepithel > Endothel der Lungenkapillaren (unter dem Alveolarepithel) - die Atemgase O2 und CO2 werden in den Lungenkapillaren zwischen dem Alveolarraum und dem Blut ausgetauscht - dieser Austausch erfolgt über Diffusion nach dem Fick´schen Diffusionsgesetz entlang des Druckgradienten, danach ist eine große Austauschfläche und eine geringe Diffusionsstrecke günstig > Alveolaroberfläche beim erwachsenen Menschen: ca. 100 m2 bei ca. 300 Mio. Alveolen, die von einem dichten Netz von Lungenkapillaren umschlossen werden > kurze Diffusionsstrecke durch flache Alveolarwand aus Typ-I-Epithelzellen - Diffusion abhängig von ruhiger Atmung und Luftdruck auf Meereshöhe - Hyperventilation > beschleunigte Atemfrequenz oder erhöhte Atemtiefe > alveolärer pO2 wird erhöht und der pCO2 erniedrigt > die Druckdifferenz von pCO2 zum Kapillarblut erhöht sich und es strömt mehr CO2 aus den Lungenkapillaren in den Alveolarraum > dadurch verändern sich die Pufferverhältnisse im Blut und werden alkalischer >> respiratorische Alkalose: Schwindel und Schwächegefühl > Gegenreaktion: metabolische Azidose führt dem Blut vermehrt Protonen zu, indem der Austausch von H+ und HCO3- in den Nierentubuli entsprechend verändert wird > Sekundenschnell! > Gegenteil: Hypoventilation - Fick´schen Diffusionsgesetz J = D x A x (delta C / delta x) J > Fluss der diffundierenden Substanz D > Diffusionskoeffizient A > zur Verfügung stehende Fläche des Alveolarepithels delta x > Dicke der beiden Epithelschichten delta C > Konzentrationsdifferenz der diffundierenden Substanzen zwischen innen u. außen 15. Äußere Atmung - die Lunge ist ein blind endendes Organ, das mit der Außenwelt über ein Atemwegsystem verbunden ist. Sie besteht aus 2 Lungenlappen rechts und links von Herzen innerhalb des abgeschlossenen Thorakalraums - die Luft gelangt über den Mund-Rachenraum in die Trachea (Luftröhre) und von dort in die beiden Hauptbronchien, die sich in jedem Lungenlappen weiter baumartig verzweigen und schließlich nach ca. 16 Verästelungen in die Terminalbronchien münden - Alle diese Gänge haben vorwiegend eine Leitungsfunktion der Atemgase und nehmen nicht am Gasaustausch teil > Totraum 19 - daran schließen die respiratorischen Bronchiolen an, diese können durch seitlich alveolare Aussackungen bereits am Gasaustausch teilnehmen. Hauptsächlich erfolgt dieser jedoch über die Wand der Alveolen (Mensch besitzt ca. 300 Mio.) - die Atemwege besitzen in ihren primären Abschnitten noch knorpelige Wandspangen, die das Lumen offen halten - Im Epithel der Atemwege liegen schleimsezernierende Zellen und Cilien, die eingedrungenen Staub und Fremdkörper verkleben und wieder nach außen befördern können > Reinigungsfunktion - außerdem wird die Luft auf Körpertemperatur erwärmt und im Nasen-Rachenraum befeuchtet - In den Wänden der Atemwege befindet sich glatte Muskulatur, die durch das VNS (Sympathikus und Parasympathikus) innerviert werden und die Öffnungsweite der Atemwege steuern. Bei asthmatischen Anfällen sind die Atemwege stark eingeengt und es kommt zur Luftnot - Außerdem können bestimmte Rezeptoren in der Schleimhaut Hustenreflexe auslösen, bei der Reizung durch Fremdkörper - die Alveolen sind der Ort des Gasaustausches, sie besitzen dafür eine besonders angepasste, dünne Wand, die aus einem Epithel mit Typ I und Typ II-Zellen besteht. > Typ-I-Zellen: flache Form, hauptsächlich für Gasaustausch zuständig, enthalten zahlreiche epitheliale Transportsysteme für Ionen und Wasser, die für konstante Dicke des Flüssigkeitsfilms sorgen. Sie entwässern auch die bei der Geburt noch flüssigkeitsgefüllte Lunge des Fetus und sorgen beim Erwachsenen ständig für eine angepasste Flüssigkeits-Clearance aus der Lunge, damit keine Ödeme (Flüssigkeitsansammlungen) entstehen. > Typ-II-Zellen: sezernieren zusätzlich Surfactant – besteht aus einer Flüssigkeit mit oberflächenaktiven Substanzen (Phosphatidylcholin, Proteine, Lipide), die sich wie ein Film über die innere Oberfläche der Alveolen legen und deren Oberflächenspannung vermindert, die sonst die Alveolen kollabieren ließe. Regulation der Atmung - Atmung erfolgt sowohl unwillkürlich über regemäßige Atmungsreflexe als auch willkürlich bei bewusst verstärktem Ein- oder Ausatmen - Atmung wird im Gehirn gesteuert – Atemzentrum in der Medulla oblongata, das aus Neuronengruppen mit verschiedenen Aktivitäten besteht (Inspirations-, Exspirations- und pneumotaktisches Zentrum) > Diese Neuronengruppen hemmen sich teilweise gegenseitig, sodass bei ihrer über Motoneurone weitergeleiteten Aktivierung abwechselnd ein- und ausgeatmet wird. Das pneumotaktische Zentrum gibt dabei den Rhythmus vor - Die Rezeptoren für die Atmungsregulation messen den Partialdruck der Atemgase an zwei pO2-Messstellen im Blut – Chemorezeptoren am Aortenbogen (Glomus aorticum) und an der Halsschlagader (Glomus caroticum) - und führen die Ergebnisse über Bahnen des VNS (N. vagus, N. glossopharyngeus) ins Atemzentrum. > weitere Chemorezeptoren befinden sich zentral im Gehirn und messen den pCO2 und den pH-Wert im Liquor > daneben gibt es noch Mechanorezeptoren die auf die Dehnung des Brustkorbs reagieren, sie schalten das Einatmen bei maximaler Dehnung des Thorax aus (HeringBreuer-Reflex) - nicht rückgekoppelte Reize aus der Peripherie beeinflussen auch die Atmungsregulation z.B. Körper- und Umgebungstemperatur, Hormone (Progesteron – Schwangerschaft), Muskelarbeit und Emotionen - Diese Reize sind alle in ein rückgekoppeltes System (Regelkreis) der Atmung integriert. Die Messergebnisse der Rezeptoren (Ist-Werte) werden mit den Soll-Werten im Atemzentrum verglichen und Atemfrequenz und -tiefe entsprechend angepasst. Dieses wirkt sich wieder auf pO2, pCO2 und den pH-Wert in Blut und Liquor aus, deren aktuelle Werte dann wieder dem Atemzentrum mitgeteilt werden 20 Hämoglobin - Hämoglobin ist ein tetrameres Protein, also ein Eiweiß mit 4 Untereinheiten. Jede dieser Untereinheiten besteht aus einer Polypeptidkette (Globin) und einer prosthetischen Gruppe (Häm). Jeweils 2 der vier Globinketten sind identisch, so dass im Atmungspigment Hämoglobin zwei alpha-Ketten und zwei beta-Ketten vorhanden sind. Das Häm ist aus 4 Pyrrolringen aufgebaut, deren Stickstoffatome in der Mitte ein 2-wertiges Eisenatom komplex binden - O2- und CO2- Transport, außerdem Puffersystem im Blut - zum O2-Transport im Blut lagert sich O2 in den Lungenkapillaren an das Hämoglobin an und löst sich in den Gewebekapillaren wieder von ihm ab. O2- beladenes Hämoglobin wird als Oxyhämoglobin bezeichnet, nach der Abgabe des O2 wird es als Desoxyhämoglobin bezeichnet - CO (Kohlenmonoxid) hat zu Hämoglobin eine weitaus höhere Affinität als O2. Deshalb bindet Hämoglobin bevorzugt CO, sofern es im Blut vorhanden ist. Das Hämoglobin wird dann oxidiert und als Methämoglobin bezeichnet. Dieses kann durch das Enzym Methämoglobin-Reduktase wieder in die normale Form überführt werden - gibt dem Blut die charakteristische Farbe. Die Farbe ändert sich je nach O2 –Sättigung (vor allem bei den Vertebraten). Das Eisenzentralatom des Hämoglobins gibt dem Blut bei vollständiger Beladung eine hellrote Farbe und bei abnehmender Sättigung eine dunkelrote Farbe - beim Erwachsenen: HbA - in der Embryonalzeit werden verschiedene Hämoglobine gebildet - Im Fetus kommt ab dem 3. Schwangerschaftsmonat das HbF vor als Hauptanteil des Neugeborenenhämoglobins - Erst im Alter von 1,5 Jahren erreicht das Kleinkind den Hämoglobinstatus eines Erwachsenen mit fast 100 % HbA und nur noch geringe Mengen an HbF - Hämoglobinbildung kann auch verändert vererbt werden und zu Krankheiten führen > Sichelzellenanämie: in der beta-Kette in Position sechs statt Glutamin Valin (AS). Dieses führt zu einer Deformation der Erythrozyten. > Thalassämie: AS-sequenz ist korrekt, es wird jedoch zu wenig Globin gebildet Sauerstofftransport im Blut (Sauerstoffbindungskurve, Einflüsse, fetales Blut) - zwei Möglichkeiten: > physikalisch im Plasma gelöst (etwa 1 – 2 %) > chemisch gebunden an Hämoglobin - Die Transportrate im Blut (Konvektion) ist abhängig von der Menge Sauerstoff pro Volumeneinheit Blut und der Transportgeschwindigkeit durch den Kreislauf - Im Blut wird O2 an spezielle Atmungspigmente gebunden - beim Menschen an Hämoglobin, bei anderen Tieren andere Atmungspigmente (Chlorocruorin, Hämerythrin, Hämocyanine) > Hämoglobin ist im Tierreich am weitesten verbreitet als Blutfarbstoff. Bei fast allen Vertebraten und auch einigen Invertebraten ab den Plathelminthes (Ascaris) [Schnecken, Muscheln, Ringelwürmer, einige Krebse und Seegurken] > Hämoglobin kommt bei Wirbeltieren nur in den Erythrozyten vor, bei einigen Wirbellosen (z.B. Anneliden) kann es auch frei gelöst im Plasma vorliegen - An das Zentraleisenatom lagert sich bei der Oxygenierung (Anlagerung) ein Molekül O2 an, das aber nicht bindet, also nicht zu einer Oxidation des Eisens führt. Die Oxygenierung ändert aber die Konformation im Häm und sogar im Globin und erleichtert dadurch eine weitere Oxygenierung der benachbarten Häm-Moleküle - Jedes Hämoglobinmolekül kann 4 O2-Moleküle binden - maximale Aufnahmefähigkeit aller Hb-Moleküle im Blut = O2-Kapazität - 1 g Hb bindet maximal 1,39 ml O2 - beim bestimmen der Hb-Konzentration in der Blutprobe eines Menschen kann man daraus auch die O2-Kapazität berechnen. Diese zeigt die Ausdauerleistungsfähigkeit von Sportlern an - Hämoglobingehalt eines Körpers auch abhängig vom O2-Gehalt der Umgebung, da in großer Höhe mehr Erythrozyten und somit auch mehr Hb gebildet wird. Diese 21 Höhenanpassung nutzen auch Sportler aus um eine bessere Ausdauerleistungsfähigkeit zu bekommen. Auch durch Blutdoping oder durch Erythropoetin kann dieses erreichen - Veränderung der Hb-Affinität, abhängig von pH-Wert und CO2 > Bohr Effekt Verringerung durch > Protonen (pH-Verschiebung) – fällt der pH-Wert des Blutes ab (z.B. weil in der arbeitenden Muskulatur Milchsäure gebildet wird) fallen vermehrt Protonen an > CO2 – durch die Umwandlung von CO2 zu Kohlensäure, die dann Bicarbonat und Protonen dissoziiert, kann es ebenfalls zum Abfall des pH-Wertes kommen. Die Protonen binden an das Hb und senken dessen Affinität zu O2 , so dass dieses abgegeben wird und ins Gewebe diffundiert > Temperaturerhöhung – begünstigt bei homoiothermen Organismen die O2-Abgabe ins Gewebe > Diphosphoglycerat (2,3-DPG) - organisches Phosphat, das in Säugererythrozyten in hoher Konzentration vorkommt und ebenfalls Hämoglobin bindet CO2-Transport im Blut (Bohr und Haldane) - auch CO2 wird größtenteils über Hämoglobin transportiert - gelangt das arterielle Blut ins Gewebe ist sein pCO2 geringer als in den umgebenden Zellen, da diese als Endprodukt des Stoffwechsels unter anderem große Mengen von CO2 bilden - Das CO2 diffundiert deshalb entlang des Druckgradienten in die Kapillaren, in denen aber nur ein geringer Teil physikalisch im Blut gelöst wird. Überwiegend diffundiert es in die Erythrozyten und wird dort mithilfe des Enzyms Carboanhydrase schnell in Kohlensäue (H2CO3) umgewandelt. Diese dissoziiert im intrazellulären pH-Millieu der Erythrozyten (7,2) sofort in Protonen (H+) und Bicarbonat (HCO3-) > eigentlich langsame Reaktion, die durch die Carboanhydrase katalytisch beschleunigt wird - Haldane-Effekt: Je weniger Hämoglobin mit Sauerstoff beladen ist, desto mehr CO2 wird aufgenommen > hohe Aufnahmebereitschaft für CO2 im Gewebe > optimale Abtransportleistung. Durch hohe Sauerstoffkonzentration in der Lunge kann CO2 besser abgegeben werden. > Desoxyhämoglobin kann mehr CO2 binden als Oxyhämoglobin. 22 - Bohr-Effekt: O2-Bindungsfähigkeit des Hämoglobins ist abhängig von pH-Wert (und damit von pCO2). Umgekehrt der Haldane-Effekt: CO2-Transportvermögen des Blutes ist abhängig vom pO2. Am Hämoglobinmolekül besteht eine 'Konkurrenz' um Aufnahme von H+-Ionen (Pufferung) einerseits und O2-Molekülen (am Häm) andererseits - die beiden Mechanismen behindern einander sozusagen gegenseitig. Der 'Hb-Muli' kann also nicht die ganze Last des O2 und des CO2 bzw. pH voll tragen - von der jeweils anderen Last 'fällt' immer etwas vom Hämoglobin herunter Vogelatmung - Gasaustausch in der Vogellunge findet zwischen den Blutkapillaren und den gasdurchströmenden Parabronchien statt, wobei die beiden Strömungsrichtungen senkrecht zueinander verlaufen > Kreuzstrom - Inspiration: > verbrauchte Luft aus den Parabronchien geht in die vordere Luftsackgruppe (Halsluftsäcke, Clavicularluftsack, kranialer Brustluftsack) > gleichzeitig geh frische, eingeatmete Luft über den Hauptbronchus direkt in den Bauchluftsack und über den mediodorso und lateroventro Bronchus (Sekundärbronchen des Paläopulmo) in den kaudalen Brustluftsack !!! Zusatz !!! Bei höher entwickelten Vögeln: Neopulmo = laterodorso Bronchus, der eine direkte Verbindung zum kaudalen Brustluftsack darstellt: frische Luft gelangt direkt hier rein und ein Teil verlässt hierdurch auch wieder den Luftsack - Danach: > Luft aus kaudaler Luftsackgruppe (BauchLS und kaudaler BrustLS) geht in die Parabronchien wo der Gasaustausch stattfindet > gleichzeitig geht verbrauchte Luft aus der kranialen Luftsack-Gruppe über den medioventro Bronchus (und nur über den!!!) in den Hauptbronchus und wird von da in die Trachea weitergeleitet -> CO2 wird ausgeatmet - Luftsäcke dienen als Blasebälge und Luftspeicher - Vögel können durch diesen Atemmechanismus sowohl während der Inspiration als auch während der Exspiration Gasaustausch vollziehen, da immer frische Luft in die Parabronchien geführt wird 16. Insulin und Glucagon - Regelung des Blutzuckerspiegel (Pankreas) - Die Regulation der Traubenzuckerkonzentration (Glukose) im Blut erfolgt durch einen Regelkreis aus zwei Hormonen, die in Abhängigkeit von der Blutzuckerkonzentration ausgeschüttet werden - Insulin ist das einzige Hormon, das den Blutzuckerspiegel senken kann. Sein Gegenspieler ist das Glucagon, dessen Hauptaufgabe es ist, den Blutzuckerspiegel zu erhöhen >> Auch Adrenalin, Kortison und Schilddrüsenhormone haben blutzuckersteigernde Wirkungen - Der Blutzuckerspiegel steigt vor allem nach der Aufnahme kohlenhydratreicher Nahrung an. Als Reaktion darauf wird von den B-Zellen Insulin ins Blut ausgeschüttet > die B-Zellen werden ATP-abhängig depolarisiert, Calcium strömt ein und bewirkt eine Exocytose von Insulin. Die Hauptwirkung des Insulins für die rasche Senkung der Blutzuckerkonzentration ist seine „Schlüsselfunktion“ für den Transport von Glukose aus dem Blutplasma und aus der Gewebsflüssigkeit in das Zellinnere - Vor allem die Leber- und Muskelzellen können in kurzer Zeit große Mengen von Glukose aufnehmen und sie in der Folge entweder in Form von Glykogen speichern oder in Energie umwandeln (Glykolyse) - Auch auf andere Arten von Zellen wirkt Insulin, es hat Einfluss auf den Fett- und Aminosäurestoffwechsel sowie auf den Kaliumhaushalt Insulin 23 - lebenswichtiges Peptidhormon für Menschen und Tiere, besteht aus zwei Ketten mit jeweils 21 bzw. 30 Aminosäuren und wird aus Proinsulin durch Abspaltung einer Verbindungskette gebildet - wird im endokrinen Pankreas in den B-Zellen der Langerhanssche Inseln, die inselartig auf dem Organ verteilt sind und nur ca. 2 % des Pankreasgewebe darstellen, gebildet senkt den Blutzuckerspiegel, reagiert auf erhöhte Glucoseausschüttung im Blut (ab ca. 5 mmol Glucose/l Blut) - Die Insulinausschüttung erfolgt oszillierend (abwechselnd). Alle drei bis sechs Minuten wird Insulin in die Blutbahn abgegeben - Die Insulinmoleküle werden in den Vesikeln des Golgi-Apparats, der an der Zellmembran der B-Zelle liegt, durch Zink-Ionen zu Hexameren gebunden und so stabilisiert gespeichert - Insulin spielt eine wesentliche Rolle bei: Diabetes mellitus Typ-I-Diabetes: zerstörte B-Zellen Typ-II-Diabetes: verminderte Wirkung von Insulin Insulinresistenz Metabolisches Syndrom Hyperinsulinismus Insulinom Glucagon - direkter Gegenspieler von Insulin, Peptidhormon aus 29 Aminosäuren, wird aus Proglucagon gebildet - wird im endokrinen Pankreas in den A-Zellen der Langerhansschen Inseln gebildet - erhöht den Blutzuckerspiegel, wird beim Abfall der Blutzuckerkonzentration sezerniert - aktiviert die Bildung von Glucose aus Glykogen in Leber- und Fettzellen 17. Speichelregulation - In der Mundhöhle wird die Nahrung durch den Kauvorgang (Mastikation) zerkleinert und durch den Speichel schon teilweise in die flüssige Phase überführt, dies ist wichtig für die Geschmacks- und Geruchsrezeptoren - Das Speicheldrüsensekret enthält Mucin – ein Mucopolysaccharid – das als Gleitmittel zum Schlucken und zur weiteren Beförderung der Nahrung notwendig ist - Säugetiere besitzen in der Mundhöhle drei paarige Speicheldrüsen > Ohrspeicheldrüse (Gl. Parotis) > rein wässriger Speichel (seröser Speichel) > Unterkieferdrüsen (Gl. Mandibularis) > seromuköser Speichel, enthält viel Mucin > Unterzungendrüse (Gl. Sublingualis) > seromuköser Speichel, enthält viel Mucin >> werden nur bei Bedarf zur Sekretion stimuliert und durch das VNS reguliert - In der Mundschleimhaut gibt es viele weitere, kleine Drüsen, die Speichel sezernieren - Speicheldrüsen besitzen ein weit verzweigtes Gangsystem, das aus blind endenden Endstücken (Acini) besteht, die über Ausführungsgänge in einen gemeinsamen Porus münden. Jeweils ein Endstück (Acinus) und der darauf folgende Ausführungsgang (Kanal) bilden eine funktionelle Einheit. Darum winden sich viele Blutgefäße, die ein dichtes Kapillarnetz bilden. Innerviert ist jede funktionelle Einheit von Ästen des VNS (Sympathikus und Parasympathikus) - Speichel besteht aus einer wässrigen Flüssigkeit, die hauptsächliche Elektrolyte und verschiedene zusätzliche Stoffe enthält. Neben großen Mengen an Na+, K+ und Cl- finden sich auch HCO3- das als Puffersystem dient. Dadurch wird der pH-Wert des Speichels im neutralen Bereich bis leicht alkalisch (pH-Wert 7,2 – 8,4) - Speichel Säugetiere: hypotonisch / Speichel Wdk: isotonisch - Neben den Elektrolyten befinden sich im Speichel auch Eiweiße, z.B. Immunglobuline und andere Plasmaproteine - Beim Mensch, Nagetier und Schwein enthält der Speichel zur Kohlenhydratverdauung auch alpha-Amylasen - Im Speichel des Menschen findet sich auch noch Rhodanidionen (SCN-), die der Desinfektion dienen 24 - Generell ist der Speichel von Wirbeltieren arm an Enzymen, außer der Amylase kommt bei Schlangen noch eine Protease vor. Fettabbauende Enzyme fehlen vollständig - Beim Wdk enthält der Speichel große Mengen an Harnstoff, der wieder dem Vormagensystem zugeführt wird und dort von den Symbionten in mikrobielles Eiweiß umgewandelt wird - Bei Invertebraten finden sich neben Amylasen häufig noch Proteasen sowie Zusatzstoffe, die die Blutgerinnung verhindern (Hirudin beim Blutegel, Anticoagulin bei Stechmücken). Giftstoffe (z.B. bei Kegelschnecken) können die Beute lähmen oder töten. Analgetika verhindern oft, das ein Insekt beim Stechen frühzeitig entdeckt wird - Regulation sowohl der Menge als auch der Zusammensetzung des Speichels durch antagonistische Regulation des VNS. > Eine Reizung der parasympathischen Fasern des N. glossopharyngeus und des N. facialis bewirkt über die Ausschüttung von Acetylcholin eine Vasodilatation der Blutgefäße und dünnflüssiger, enzymarmer Speichel (seröser Speichel) wird vermehrt gebildet. > Eine Reizung des Sympathikus bewirkt die Ausschüttung von Noradrenalin, welches auf die beta-adrenergen Rezeptoren wirkt und eine Vasokonstriktion der Gefäße auslöst. Dadurch wird wasserarmer, enzym- und mucinreicher Speichel (muköser Speichel) ausgeschüttet - Speichelbildung: > Zusammensetzung erfolgt in zwei Schritten. Zunächst wird von den Epithelzellen des Acinus ein isotoner Primärspeichel gebildet, dessen Zusammensetzung der des Blutplasmas ähnlich ist. Durch einen basolateralen Na+/K+/Cl--Symport wird Chlorid in die Zellen akkumuliert und durch einen apikalen Cl— Kanal in das Lumen des Ainus abgegeben. Wasser und Na+ folgen osmotisch über den parazellulären Weg. Über apikale Anionenkanäle wird auch HCO3- als Puffer in das Lumen abgegeben. Dieser Primärspeichel fließt aus den Acini in die Ausführungsgänge, wo er sekundär modifiziert wird. Das Epithel der Ausführungsgänge ist wasserundurchlässig, kann aber Ionen resorbieren oder sezernieren. Da Na+ und Cl- aus dem Ausführungsgang resorbiert und K+ und HCO3- sezerniert werden, ist der Sekundärspeichel arm an Na+ und Cl- und reich an K+ und HCO3- . Beim Menschen ist der Sekundärspeichel hypoton, dies ist vorteilhaft für die Geschmacksrezeption in der Mundhöhle - Speichelsekretion beim Wdk > bei digastrischen Tieren (mehrhöhliger Magen) ist die Speichelsekretion dauerhaft und nicht wie bei monogastrischen Tieren nur während der Dauer der Nahrungsaufnahme. Dadurch werden große Mengen an Speichel sezerniert - Rind 180 L/Tag - Schaf 16 L/Tag – Mensch 0,7 L/Tag > Beim Rind sezernieren in den Pausen der Nahrungsaufnahme und beim Wiederkauen neben den kleinen Drüsen in der Mundschleimhaut auch die großen Speicheldrüsen. Diese Dauersekretion ist notwendig, um ständig HCO3- als Puffersystem in die Vormägen zu bringen. Dadurch werden die bei der mikrobiellen Verdauung entstehenden kurzkettigen Fettsäuren neutralisiert und ein nur schwach saurer pH-Wert im Wdk-Magen aufrecht erhalten. 18. Magenschleimhaut (Aufbau, Funktion, Drüsen, pH) - 3 Drüsenzonen: > Cardiadrüsenzone, bei Schwein sehr groß, sonst nur klein unter der kutanen Schleimhaut (am Eingang des Ösophagus in der Cardia) Distal schließen an: > Fundusdrüsenzone > Pylorusdrüsenzone diese sind bei allen Haustieren markant ausgeprägt - drüsenloser Teil, mit kutaner Schleimhaut ausgekleidet, um die Cardia herum beim Pferd, Ratte und Hamster und Schwein - Alle im Magen vorkommenden Drüsen sind tubuläre Drüsen, die in die Magengrübchen einmünden 25 - Gesamtsekretvolumen pro Tag > Hund: 0,2 – 0,5 Liter > Schwein: 2 – 3 Liter > Pferd: 6 – 8 Liter > Mensch: 1 – 2 Liter - Sekretion der Fundusdrüsen > bestehen aus Nebenzellen (Halszellen), Belegzellen (Parietalzellen) und Hauptzellen, die alle aus Stammzellen im „Halsbereich“ der Drüsen und werden ständig durch neue Zellen ersetzt (Turnover) > Halszellen sezernieren wie das Oberflächenepithel (das auch die Magengrübchen [Faveolae] auskleidet) Schleim > Belegzellen sezernieren HCl, sie besitzen im apikalen Bereich verzweigte Gänge (Canaliculi), die zum Lumen hin offen sind. Bei der Aktivierung der Belegzellen verschmelzen zusätzliche intrazelluläre Canaliculi mit der apikalen Membran und öffnen sich nach außen, so dass die apikale Zelloberfläche vergrößert wird. Aus den Canaliculi wird isotone Flüssigkeit sezerniert, die bis zu 150 mM HCl enthält - Sekretionsmechanismus gebildet durch eine apikale H+/K+-ATPase und Cl- und K+Kanäle. H+ stammt aus dem Stoffwechsel der Zelle und wird über Carboanhydrase freigesetzt. Für den Cl- -Vorrat der Zelle sorgt ein basolateraler Cl-/HCO3- -Antiport. K+ wird über die basolaterale Na+/K+-ATPase bereitgestellt. K+ und Cl- können die Zelle apikal passiv entlang ihres elektrochemischen Gradienten verlassen, während H+ durch die H+/K+-ATPase aktiv gegen einen vielfachen Gradienten in das Lumen befördert wird, wozu Energie in Form von ATP benötigt wird - sezernieren auch den instrinsic factor, der zur Vitamin B12 Resorption im Dünndarm notwendig ist > Hauptzellen sezernieren Enzyme durch Exocytose - Endopeptidasen bzw. die inaktive Vorstufe (Pepsinogen) von Pepsin zur Eiweißverdauung. Diese Vorstufen werden durch eine autokatalytische Abspaltung von ca. 45 AS von Pepsinogen unter der Einwirkung von HCl aktiviert - Magensaftsekretion > reflektorisch ausgelöst durch Nahrungsaufnahme > Regulation durch nervale Regulationsvorgänge, lokale gastrische Reflexe und intestinale Einflüsse > Beteiligt sind Geschmacks- und Geruchsnerven, sie über bedingte Reflexe und den N. vagus auf den Magen einwirken. In der Magenwand treffen diese nervalen Einflüsse auf das Netzwerk der lokalen gastrischen Reflexe. Die Menge der einzelnen Bestandteile des Magensafts wird durch unterschiedliche Mechanismen reguliert. > Die Pepsinogensekretion der Hauptzellen wird über Noradrenalin, Sekretin, Acetylcholin und Cholecystokinin stimuliert. - Noradrenalin und Acetylcholin: Überträgerstoffe des ENS - Sekretin und Cholecystokinin: gastrointestinale Hormone, lokal in der intestinalen Wand gebildet. Hauptzellen besitzen spezielle Rezeptoren für diese. 26 > auch die Salzsäuresekretion der Belegzellen wird über gastrointestinale Hormone und Überträgerstoffe reguliert. - Acetylcholin wird unter Einfluss des N. vagus aus intramuralen Ganglien freigesetzt und wirkt auf enterochromaffine Zellen (ECF-Zellen) der Magenwand. Diese schütten Histamin aus, was auf spezifische H2-Rezeptoren in der basolateralen Membran der Belegzellen wirkt und diese zur HCl-Sekretion stimuliert (parakriner Effekt). - Auch G-Zellen (gastrinproduzierende Zellen) in der Magenwand spielen eine Rolle, sie setzen Gastrin ins Blut frei, welches auf die Gastrin-Rezeptoren der Belegzellen ebenfalls stimulierend wirkt. Die G-Zellen werden vom N. vagus über intramurale Ganglien und die Ausschüttung eines gastrin-releasing peptide (GRP) stimuliert - auch D-Zellen befinden sich in der Magenwand, diese geben das Peptidhormon Somatostatin ab, welches negativ auf die Gastrinsekretion der G-Zellen wirkt. Die DZellen werden durch die HCl-Sekretion stimuliert und dient dadurch zur Vermeidung überschüssiger Säureproduktion. > Sekretion der Schleimsubstanzen wird ebenfalls über Acetylcholin und Prostaglandin E stimuliert. Acetylcholin wirkt über das second-messenger-System Diacylglycerin und Inositoltriphosphat, Prostaglandin E dagegen über cAMP. > der wichtigste Auslöser für die Schleimsekretion ist ein niedriger pH-Wert im Magen, der über einen enterischen Reflex die Prostaglandinbildung anregt. Diese kann durch Glucocorticoide sowie ASS (Aspirin) gehemmt werden. Dadurch wird die Schleimsekretion vermindert und damit die Magenwand durch die Magensäure geschädigt. Durch kann es zu Gastritis oder sogar Magengeschwüren (Ulzera) kommen. 19. exokrines Pankreas - Bauchspeicheldrüse liegt unterhalb des Magens - hat Ausführungsgang (Ductus pancreaticus) in das Duodenum - besteht aus endokrinem und exokrinem Teil > endokriner Teil: Langerhanssche Inseln, zur Produktion von Insulin und Glucagon > exokriner Teil: zur Produktion von enzymhaltigen Verdauungssäften - funktionell ähnlich wie eine Speicheldrüse aufgebaut - zusammengesetzte tubulo-alveoläre Drüse mit Endstücken (Alveolen oder Acini) und einem komplexen Gangsystem, das mit kubischen Zellen (Gangzellen) ausgekleidet ist und in einem gemeinsamen Ausführungsgang (Ductus pancreaticus) ins Duodenum enden - Sekretion von Elektrolyten und Wasser erfolgt sowohl in den Gangzellen, als auch in den Acinuszellen - Acinuszellen > ausgeprägtes rauhes ER, großer Golgi-Apparat und zahlreiche Sekretgranula > sezernieren hauptsächlich Verdauungsenzyme (Trypsin, Chymotrypsin, Elastasen, Carboxypeptidasen, Pankreas- und Phospholipasen), die durch die Epithelzellen der Ausführungsgänge (Acinuszellen) mit einer chloridreichen, alkalischen Flüssigkeit komplettiert und in das Duodenum abgegeben werden > Sekretion von folgenden Verdauungsenzymen durch Exocytose - Peptidasen (inaktiv) z.B. Trypsinogen, Chymotrypsinogen, Proelastase - Nucleasen (aktiv) z.B. Ribonuclease, Desoxyribonucleasn - Amylase (aktiv) z.B. alpha-Amylase - Lipasen Lipase und Cholesterinesterase (aktiv), Pro-Colipase (inaktiv) > Sekretion von chloridreichem (Cl-) Sekret, alkalisch - Cl- durch Cl- -Kanal der apikalen Membran ins Lumen - Na+ und K+ folgen aus elektrischen Gründen parazellulär durch Zonulae occludentes - Cl- -Aufnahme durch basolaterale Membran (BLM) durch Na+/K+/2Cl- -Cotransporter - Na+ und K+ werden durch N+/K+-Pumpe (-ATPase) bzw. K+ -Kanäle der BLM wieder ausgeschleust - durch Aktivierung der Cl- und K+ -Kanäle kann die Elektrolyt- und Wassersekretion (osmotisch bedingt) stimuliert werden - Gangzellen > spärliches ER, keine Sekretgranula 27 - - - - - > Sekretion einer bicarbonatreichen (HCO3-) Elektrolytlösung, alkalisch - HCO3- -Sekretion abhängig von der cytoplasmatischen Carboanhydrase - Cl- -Kanal funktionell gekoppelt mit Cl-/HCO3- -Austauscher der apikalen Membran - N+/H+-Austauscher in basolateralen Membran - energetisiert wird Sekretionsprozess durch die N+/K+-ATPase (-Pumpe) der BLM, sie sorgt für die Aufrechterhaltung des transmembralen elektrochemischen Na+-Gradienten - N+ und K+ folgen passiv dem luminal sezernierten HCO3- parazellulär - Wasser wird osmotisch ins Gangsystem überführt Bauchspeichelsekretion pro Tag: > Hund ca. 0,2 - 0,4 L > Mensch und Schwein ca. 1 - 2 L > Rind ca. 10 - 15 L > Pferd sehr viel mehr 30-35 L/Tag Flussrate des Bauchspeichels bei Monogastriern stark von Fressaktivität abhängig und beeinflusst Elektrolytzusammensetzung und pH-Wert des Bauchspeichels mit zunehmender Flussrate steigt HCO3- -Konzentration (bis 140 mmol/l) und Cl- Konzentration sinkt (bis 25 mmol/l) > Ausnahme Pferd: HCO3- -Konzentration (ca. 60 mmol/l steigt mit Flussrate kaum an und ist stets geringer als Cl- -Konzentration (ca. 90 mmol/l) + N und Ca2+-Konzentrationen unabhängig von der Flussrate, entsprechen weitgehend Plasmakonzentration Durch den hohen HCO3- des Pankreassekrets wird die vom Magen stammende Salzsäure neutralisiert, so dass das pH-Optimum für die Verdauungsenzyme erhalten bleibt Regulation der Sekretion der Gangzellen durch Acetylcholin aus Endigungen des N. vagus sowie intestinalen Hormonen > Sekretin (Peptidhormon) aus S-Zellen des Dünndarms steigert Sekretion in Gangzellen (Epithelzellen der Ausführungsgänge) - Sekretinabgabe ausgelöst durch niedrigen pH-Wert des Chymus im proximalen Dünndarm durch Magensäure - Sekretin stimuliert dabei über Sekretinrezeptoren der Zellmembran die Adenylatcyclase und damit die Bildung von cAMP, welches die Sekretion des Sekrets (NaHCO3)aus den Gangzellen anregt - Sekretabgabe in das Duodenum neutralisiert die H+-Ionen unter Bildung von H2O und CO2, so dass der Stimulus für die Sekretinabgabe abgeschwächt wird > Acetylcholin (Parasympathikus) regt über die Aktivierung der VIPergen Neurone die Sekretion der Gangzellen an, was ebenfalls über cAMP vermittelt wird Regulation der Sekretion der Acinuszellen durch Cholecystokinin (CCK) aus I-Zellen des Dünndarmepithels sowie Acetylcholin > Sekretionssteigernd > CCK wirkt über CCK-Rezeptoren Zellmembran, Ausschüttung von CCK angeregt durch Spaltprodukte der Protein- und Fettsäuren-Verdauung > Acethylcholin wirkt über muskarinerge cholinerge Rezeptoren der Zellmembran > Aktivierung der Rezeptoren über intrazelluläre Freisetzung von Inositoltriphosphat und Diacylglycerin (Second messenger) aus einem Phospholipid der Zellmembran > Inositoltriphosphat erhöht sofort intrazelluläre Ca2+-Konzentration durch Öffnung der Ca2+ -Kanäle des im ER gespeicherten Calciums > Ca2+ und Diacylglycerin aktivieren gemeinsam eine Proteinkinase (C) welche über die Phosphrlylierung von Proteinen die Exocytose sowie Cl- -Sekretion stimuliert mit der Futteraufnahme entstehen zusätzlich Stimulationen, die die Pankreassekretion bei Monogastriern sehr stark fördern > cephale Phase durch Geruch und Geschmack des Futters gefördert > gastrale Phase wird durch die Dehnung der Magenwand gefördert > intestinale Phase basiert auf der vermehrten Abgabe der Intestinalhormone Sekretin und CCK in die Blutbahn >> Effekte werden durch eine pH-Erniedrigung (Sekretin) bzw. durch den Anfall von Spaltprodukten der Protein- und Fettverdauung (CCK) im Dünndarmlumen ausgelöst 28 20. pH im Darm - als Puffersysteme im Dickdarminhalt dienen das HCO3- - und H2PO4 2-/ HPO4 2—System - das HCO3- stammt überwiegend aus Sekretionsprozessen in den einzelnen Abschnitten des Intestinaltraktes, während Phosphat vor allem allimentären Ursprungs ist - bei Schwein und Pferd ist HCO3- das dominierende Puffersystem, bei Fleischfressern überwiegt das Phosphat-Puffersystem - der pH-Wert des Dickdarminhaltes liegt ebenso wie im Vormageninhalt mit Werten zwischen 6 und 7 im leicht sauren Bereich 21. Resorptionsvorgänge im Dünndarm Dünndarm ist der hauptsächliche Ort für Verdauung und Resorption von Nahrungsstoffen, Vitaminen, Elektrolyten und Flüssigkeit - in 3 Abschnitte unterteilt: Duodenum, Jejunum, Ileum - Oberfläche ist durch Ringfalten, Darmzotten und Mikrovilli enorm vergrößert - in der Mucosa viele Verdauungsenzyme eingebaut => riesige funktionelle Fläche für die enzymatische Verdauung und die Resorptions- und Sekretionsvorgänge (neuronal und hormonell reguliert) - Wasser und Elektrolyte werden durch Lieberkühn-Krypten ins Lumen sezerniert Motorik: - zwischen äußerer Längsmuskulatur und innerer Ringmuskulatur befindet sich ein dichtes Nervenzellnetz, mit regelmäßigen Ganglien = Plexus myentericus (Auerbachplexus) - weiter innen befindet sich ein zweites Nervengeflecht = Plexus submucosus (Meissnerplexus) - beide Nervennetze gehören zum enterischen NS und regulieren die Resorptions- und Sekretionsvorgänge (Pl. submucosus), sowie die Dünndarmmotorik (Pl. myentericus) - Bewegungsvorgänge werden durch endogene Reflexe gesteuert, an denen sowohl sensorische, als auch motorische Fasern beteiligt sind - diese Reflexe koordinieren Kontraktion und Erschlaffung benachbarter Muskelbezirke => es entsteht eine aufsteigende Erregung und eine absteigende Hemmung, die den Weitertransport des Darminhalts ermöglicht - komplexes neuronales Netzwerk auch als little brain of the gut bezeichnet (da komplex verschaltet) äußere Innervation umfasst sympathische und parasympathische Fasern und viszerale Afferenzen - sympathische Stimulation hemmt die Darmmotilität, parasympathische steigert sie - glatte Muskelzellen der Darmmuskulatur generieren ihren eigenen bioelektrischen Rhythmus (BER), durch welchen verschiedene Bewegungstypen der Darmmotilität erzeugt werden: > propulsive Peristaltik verursacht wandernde Kontraktionswellen von oral nach aboral, die den Darminhalt Richtung Dickdarm vorantreiben > Segmentationsbewegungen werden durch regelmäßigen Wechsel von Kontraktionsund Erschlaffungsphasen verursacht und zerkleinern und durchmischen den Darminhalt > Pendelbewegungen bestehen aus auseinander- und zusammenlaufenden Kontraktionswellen, zerkleinern und durchmischen den Darminhalt > außerdem: tonische Kontraktionen (Dauerkontraktionen), die eine Verschlussfunktion 29 haben und ausschließlich an den Sphinkteren der Darmabschnitte (Pylorus, Ileocaecalklappe) stattfinden; zwischen den Verdauungsphasen gibt es die interdigestive Motilität, die früher auch als Hungerkontraktion bezeichnet wurde - äußere extramurale Reflexe koordinieren die Motilität zwischen den einzelnen Abschnitten des Magen-Darm-Kanals - gastrocolischer Reflex steuert die vorsorgliche Entleerung des Dickdarms bei Füllung des Magens Resorption und Sekretion: - Dünndarmepithel ist als Barriere aufgebaut, die einen gerichteten Transport vom Darmlumen ins Blut und andersrum gewährleistet - die transportierten Substanzen können dabei quer durch die Epithelzellen (transzellulärer Transport) oder zwischen den Zellen (parazellulärer Transport) gelangen - zur Überwindung von Konzentrationsgradienten und Zellmembranen gibt es bestimmte Transportmechanismen (Kanäle, Transporter, Pumpen = integrale Proteine die in die Zellmembran integriert sind) - da der Dünndarm ein sehr durchlässiges Epithel ist, fließen je nach osmotischer Druckdifferenz zwischen Lumen und Plasma große Mengen Flüssigkeit über den parazellulären Weg - der Dünndarm resorbiert generell große Mengen an NaCl und sezerniert Anionen (Cl-, HCO3-) in das Lumen - Natrium strömt entlang eines elektrochemischen Gradienten über einen Symport mit Glucose in die Zelle und wird über eine Na+ / K+ -ATPase über die basolaterale Membran ins Blut transportiert, dabei energetisiert der apikale Na+ -Einstrom den Einwärtstransport von Glucose - ähnliche Cotransportsysteme existieren in der Membran für Na+ -gekoppelten Aminosäuretransport - es gibt aber auch Aminosäuretransporter, die ohne Na+ -Kopplung arbeiten, auch Dipeptide werden über eigenständige apikale Transportsysteme aufgenommen - die resorptiven Mechanismen im Dünndarm arbeiten normalerweise sehr effektiv; somit wird mit den Salzen auch viel Flüssigkeit osmotisch aus dem Lumen eliminiert, sodass tägl. nur etwa 1L Flüssigkeit pro Tag in den Dickdarm gelangt. Wird der Sekretionsmechanismus für Anionen stark angeregt, wird hauptsächlich Chlorid in den Dünndarm sezerniert und zieht osmotisch große Mengen Wasser aus dem Blut ins Lumen; es kommen in diesem pathophysiologischen Zustand bis zu 20 L Flüssigkeit in den Dickdarm => wässriger Durchfall, da Dickdarm diese Volumina nicht resorbieren kann - Auslöser sind oft Toxine enteraler Bakterien (z.B. Colibakterien) 22. Dickdarm (Funktion, Resorption, Fermente, Motorik) im Dickdarm wird der Darminhalt durch die fast vollständige Resorption von NaCl und Wasser weiter eingedickt und durch Kolonmotilität zu Faeces geformt, die bis zur Defäkation gespeichert werden - Kolon ist haustriert und besitzt längs verlaufende Bindegewebsstreifen, die Taenien - zwischen den Taenien ist die Kolonwand ausgestülpt (Haustren) => es entstehen seitliche Divertikel - im Kolon werden Na+ und Cl- resorbiert und K+ und HCO3- sezerniert - Na+ wird durch apikale Na+-Kanäle in die Zelle aufgenommen und durch eine basolaterale Na+ / K+ -ATPase weiter ins Blut befördert, das hierbei aufgenommene K+ kann über apikale K+-Kanäle ins Lumen abgegeben werden - gesteuert werden diese Vorgänge durch das Nebennierenhormon Aldosteron - das Dickdarmepithel hat, im Vergleich zum Dünndarm, nur eine geringe Oberflächenvergrößerung und besteht aus flächig angeordneten Oberflächenzellen und dazwischen gelagerten Krypten - in den Kryptenzellen ist der Mechanismus der Cl- -Sekretion ebenfalls vorhanden, sodass auch im Kolon, unter Einfluss von bakteriellen Toxinen oder Entzündungsstoffen, eine sekretorische Diarrhö ausgelöst werden kann - ist der Koloninhalt durch Motilitätsstörungen oder Resorption zu stark eingedickt kommt es zur Verstopfung (Obstipation) 30 - im Kolon befindet sich eine umfangreiche Keimbesiedelung, die ein wichtiges, mikrobielles System bildet. Kolonbakterien produzieren Vitamin K und kurzkettige Fettsäuren sowie Methan - außerdem wird im Kolon der Chymus gespeichert - für die Aufrechterhaltung der Dickdarmflora und ihrer metabolischen Funktionen sind folgende Faktoren Voraussetzung: > Neutralisation saurer Endprodukte des mikrobiellen Stoffwechsels > Verweilzeit der Digesta im Dickdarm > Verdünnung von Stoffwechselendprodukten durch die flüssige Phase des Dickdarminhaltes > Resorption von Endprodukten der mikrobiellen Fermentation - Im Dickdarm findet die finale Wasser- und Elektrolytresorption zur Eindickung des Kots statt. 23. Verdauung und Resorption Kohlenhydrate (Monogastrier) - Kohlenhydrate (Zucker) sind die häufigsten Moleküle in der Natur - als Stärke und Cellulose kommen sie in Pflanzen vor und bilden eine wichtige Nahrungsquelle für tierische Organismen. Dazu müssen die KH jedoch durch Enzyme in ihre molekulare Form (z.B. Glukose) gespalten werden - Monosaccharide sind die einfachsten Zuckerverbindungen. Sie bestehen aus einer Kohlenstoffkette mit der Formel (CH2O)n und kommen im Organismus hauptsächlich als Pentosen oder Hexosen vor - in wässriger Lösung bilden Monosaccharide stabile, ringförmige Verbindungen - mit anderen Monosacchariden können sie sich über o-glykosidische Verbindung zu Di-, Oligo- oder Polysacchariden verbinden. Diese hochmolekularen Ketten können verzweigt sein und kommen in der Natur als pflanzliche Reservestoffe (Stärke) oder pflanzliche Baustoffe (Cellulose) vor - im Dünndarm sind die wichtigsten Nahrungskohlenhydrate, die durch Enzyme des Pankreas (Amylase) und des Dünndarmepithels (Di- und Oligosaccharidasen) verdaut werden: Stärke (+Glykogen – tierische Stärke in der Leber), Saccharose und Laktose. - im Dickdarm oder im Vormagensystem (Wdk) werden hauptsächlich Strukturkohlenhydrate wie z.B. Cellulose, Hemicellulose und Pektin (Bestandteile der pflanzlichen Zellwand) abgebaut, da diese durch die Enzyme im Dünndarm nicht angegriffen werden - die alpha-glykosidische Bindung der Stärke (Amylose) kann durch das Enzym Amylase gespalten werden. Amylase spaltet 1,4-alpha-glykosidische Bindungen der Stärke hydrolytisch, wodurch Maltose, Maltotriose und alpha.Dextrine entstehen. Diese Bruchstücke werden anschließend durch die in der Bürstensaummembran des Dünndarmepithels verankerten Di- und Oligosaccharidasen zu Glukose aufgespalten. (Glucoamylase = Maltasen; alpha-Dextrinase = Isomaltase; Saccharase) Hauptort für diese Stärkeverdauung: proximales Drittel des Dünndarms - die entstehende Glucose und Galactose wird durch einen Na+-Cotransport (Carrier) in die Bürstensaummembran aufgenommen und von da aus ins Interstitium geleitet durch Diffusion - zur Spaltung der beta-glykosidischen Bindung der Cellulose wird das mikrobielle Enzym Cellulase benötigt. Dieses kommt nur bei wenigen Tieren vor (Silberfischchen) und wird sonst vor allem durch Symbionten im Verdauungstrakt bereitgestellt. Cellulose wird im Dickdarm mikrobiell abgebaut, wobei als resorbierbare Endprodukte kurzkettige Fettsäuren (Essigsäure, Propionsäure und Buttersäure) entstehen - Carboanhydrasen – Glykosidasen und Polysaccharidasen > Polysaccharidasen sind häufig Amylasen, die langkettige Kohlenhydrate (Stärke, Glykogen) abbauen und aus ihnen Oligosaccharide und Disaccharide bilden. > Glykolidasen (aus Pankreas oder der Glykokalyx der absorbierenden Darmepithelzellen) greifen Disaccharide (Fructose, Maltose, Laktose) an und zerlegen diese in resorbierbare Monosaccharide - Saccharose (Rüben-/Rohrzucker) besteht aus einem Glucose- und Fructosemolekül und ist über eine 1,2-alpha-glykosidische Verbindung verknüpft. Saccharose wird durch das 31 bürstensaummembranständige Enzym Saccharase in Glucose und Fructose zerlegt. Saccharase kann auch Maltose und Maltotriose spalten - Laktose (Milchzucker) besteht aus einem Glucose- und einem Galactosemolekül, die über eine 1,4-beta-glykosidische Verbindung verknüpft sind. Laktose wird durch das bürstensaummembranständige Enzym Laktase zu Glucose und Galactose hydrolysiert - Die Verwertung von Laktose stellt bei vielen Erwachsenen ein Problem dar, da sie das beim Säugling vorkommende Enzym Laktase oft nicht mehr besitzen. Deshalb können sie den Milchzucker nicht mehr abbauen, was oft erhebliche Darmbeschwerden verursacht (Laktoseunverträglichkeit). 24. Verdauung und Resorption Fett (Monogastrier) - Fette dienen dem Organismus als Energieträger und –speicher sowie als Baustoff in Membranen - auch wichtige Signalstoffe und Hormone - Fette bestehen aus Alkohol (Glycerin) und Fettsäuren, die sich über Veresterung unter Wasserabspaltung verbinden - in der Natur meist Triglyceride, bei denen alle drei OH-Gruppen des Glycerins mit jeweils einer Fettsäure verestert sind - in tierischen und pflanzlichen Fetten kommen am häufigsten Fettsäuren mit 16 und 18 CAtomen vor, z.B. Palmitinsäure (C16H32O2) - Gesättigte Fettsäuren enthalten zwischen den Kohlenstoffatomen nur einfache Bindungen - Ungesättigte Fettsäuren können verzweigt sein und Doppelbindungen enthalten und bei Raumtemperatur oft von öliger Konsistenz, z.B. Ölsäure - nicht essentielle Fettsäuren – vom Körper selbst synthetisiert essentielle Fettsäuren z.B. Linolsäure – müssen mit der Nahrung aufgenommen werden > oft wichtige Ausgangsprodukte für die Synthese von Signalstoffen (z.B. Prostaglandine) - Fette sind hydrophob und können in den Fettzellen (Adipozyten) als Neutralfette gespeichert werden - bei der Fettverbrennung fällt ungefähr die doppelte Energie an als bei der Nutzung von Proteinen oder Kohlenhydraten > hocheffektive Energielieferanten des Organismus - werden Fettsäuren im Fettmolekül teilweise durch andere Verbindungen ersetzt, wodurch sich fettähnliche Substanzen bilden > Lipoide wie z.B. Vitamine, Carotinoide, Steroidhormone und Gallensäuren - wichtigste Futterlipide: > Tri(acyl)glycerine > Phospholipide (meist Lecithin) > Cholesterin(ester) Verdauung Triacylglycerine - bereits im Magen durch gastrale und linguale Lipase (pH-Optimum 3 – 7) eingeleitet > Hydrolysierung zu Diacylglycerinen, Monoacylglycerinen und Fettsäuren > vorallem Abspaltung von mittelkettigen und ungesättigten langkettigen endständigen Fettsäuren > gastrale und linguale Lipase aufgrund des intraluminalen sauren Milieus auch im Duodenum aktiv - distal der Einmündung des Ductus pancreaticus ins Duodenum Fortsetzung durch die pankreatische Lipase > Hydrolysierung der Di- und Triacylglycerinen zu beta-Monoacylglycerinen (mit mittelständiger Fettsäure) und Fettsäuren > abhängig von der Colipase, die über das Pankreassekret als Pro-Colipase in den Dünndarm gelangt und durch Trypsin aktiviert wird (durch Abspaltung des Pentapeptids Enterostatin) - Lipasewirkung auch abhängig von Anwesenheit der konjugierten Gallensäuren Tauround Glykocholsäure sowie Tauro- und Glykochenodesoxycholsäure als Detergentien, die die Emulgierung der wasserunlöslichen Triacylglycerine im wässrigen Milieu des Dünndarmlumens bewirken > die konjugierten Gallensäuren bilden an der Oberfläche der Triacylglycerintröpfchen eine 32 monomolekulare Schicht - hydrophober Pol der konjugierten Gallensäuren den Triacylglycerinen zugewandt - hydrophiler Pol der wässrigen Phase zugewandt > je mehr konjugierte Gallensäuren im Dünndarmlumen vorhanden sind, um so kleiner werden Triacylglycerintröpfchen und umso größer wird ihre Gesamtoberfläche (viel kleine Kugeln haben eine größere Oberfläche als eine große Kugel mit gleichem Volumen) - Lecithin (Phosphaditylcholin) gelangt über die Galle in den Dünndarm und ist ebenfalls ein Detergenz und unterstützt daher die emulgierende Wirkung der Gallensäuren - Die Oberflächenvergrößerung der der Triacylglycerintröpfchen begünstigt die Wirkung der Lipase, da diese an der Oberfläche der Lipidtröpfchen (Öl-Wasser-Grenze) wirkt - Colipase ist Platzhalter für die Lipase an der Oberfläche der Triacylglycerintröpfchen und verhindern deren Inaktivierung durch die Gallensäuren - Auch die bei der Hydrolyse der Triacylglycerine durch die Lipase anfallenden Monoacylglycerine und Fettsäuren sind Detergentien und unterstützen ebenfalls die Emulgierung der Triacylglycerine - Monoacylglycerine und Fettsäuren sind im wässrigen Milieu des Dünndarmlumens schlecht löslich, bilden jedoch als Detergentien zusammen mit den konjugierten Gallensäuren die gemischten Micellen (Solubilisierung) > Molekülaggregate bei denen der hydrophobe Molekülanteil (z.B. Hydrocarbonkette der Fettsäuren) zentralwärts und der hydrophile Anteil (z.B. COOH-Gruppe der Fettsäuren) nach außen gerichtet ist > Durchmesser von 3 – 5 nm (Emulsionskügelchen 100 – 1.000 nm) > Solubilisierung ist Voraussetzung für Resorption der Fettsäuren und Monoacylglycerine Resorption von Fettsäuren und Monoacylglycerinen - Liegen im Dünndarmlumen in micellarer Lösung vor und gelangen physiologischer Weise in der proximalen Dünndarmhälfte per Diffusion durch die Bürstensaummembran in das Zottenepithel - Durch das saure Mikroklima an der Epitheloberfläche (bedingt durch den Na+/H+Austauscher der Bürstendaummembran) werden Fettsäuren in diesem Bereich in die undissoziierte Form überführt, wodurch der Transport durch die Bürstensaummembran beschleunigt wird (bessere Lipidlöslichkeit) - die konjugierten Gallensäuren werden aufgrund ihres niedrigen pK-Werts (Taurocholsäure 2,5) im sauren Mikroklima an der Epitheloberfläche kaum in die undissoziierte Form überführt und werden daher nicht im Jejunum sondern erst im Ileum resorbiert (Diffusion durch einen Na+-abhängigen sekundär aktiven Transport effektiv resorbiert) > begünstigt Emulgierungs- und Solubilisierungsfunktion der konjugierten Gallensäuren im Jejunum - im Cytoplasma des Dünndarmepithels werden die durch die Bürstensaummembran aufgenommenen Monoacylglycerine und Fettsäuren über zwei Stoffwechselwege (alphaGlycerinphosphatweg und Monoacylglycerinphosphatweg) wieder zu Triacylglycerinen aufgebaut > diese werden dann von in der Epithelzelle gebildeten Apolipoproteinmolekülen umhüllt (Chylomikronen 50 – 400 nm). Bestehen dann aus Triacylglycerin sowie auch Fettsäureester von Cholesterin sowie fettlösliche Vitamine und Provitamine (Vitamin A, E, D und K, Carotine) und andere fettlösliche Substanzen - im Golgi-Apparat werden mehrere Chylomikronen von einer Membran umhüllt und via Cytoskelett zur Basolateralen Membran transportiert, wo sie durch Exocytose in das Interstitium ausgeschleust werden um anschließend hauptsächlich in die Lymphkapillaren überzutreten - kurz- und mittelkettige Fettsäuren werden im Dünndarmepithel kaum in Triacylglycerine eingebaut und verlassen die Epithelzelle über die basolaterale Membran und gelangen in die Blutkapillaren und somit ins Pfortaderblut Verdauung und Resorption der Phospholipide - wichtigstes Nahrungsphospholipid ist Phosphatidylcholin (Lecithin) - auch aus der Galle in den Dünndarm 33 - umgewandelt durch die Phospholipase A2 zu Lysophosphatin durch Abspaltung der mittelständigen Fettsäure > kommt über das Pankreassekret als inaktives Proenzym in den Dünndarm und wird durch Trypsin aktiviert - Lysophosphatin gelangt durch Diffusion in die Epithelzelle und wird durch Reveresterung mit einer Fettsäure wieder in Phosphatidylcholin umgewandelt, welches für die Bildung der Lipoproteinhülle der Chylomikronen benötigt wird > gelangt also mit den Chylomikronen in die Lymphkapillaren und letztendlich in die V. cava Resorption von Cholesterin - Cholesterin (Cholesterol) hauptsächlich in Futtermitteln tierischen Ursprungs - außerdem über die Galle in den Dünndarm - über das Futter zugeführtes Cholesterin etwa mit 15 % mit Fettsäuren verestert - Cholesterinester werden im Dünndarmlumen durch die pankreatische Cholesterinesterase gespalten - Cholesterin gelangt durch carriervermittelte erleichterte Diffusion in die Epithelzelle und wird mit Fettsäuren reverestert in die Chylomikronen inkorporiert - In den Kryptenzellen kann Cholesterin synthetisiert werden, Hauptort für die Synthese jedoch Leber 25. Verdauung Proteine - Proteine (Eiweiße) dienen als Baustoff der Zellen (integrale Proteine der Zellmembran, Cytoskelett > Actin, Tubulin) und als Funktionsstoffe (Hormone, Enzyme, Abwehrstoffe) Beteiligte Peptidasen sind aufgeteilt in Endo- und Exopeptidasen, sowie Peptidasen mit speziellen Funktionen: - Endopeptidasen spalten Peptidbindungen durch Hydrolyse vor allem im mittleren Bereich der Proteinmoleküle, Exopeptidasen spalten endständige AS der Proteinmoleküle ab - wenn endständige AS mit freier Carboxylgruppe, dann als C –terminale AS bezeichnet, wenn AS mit freier Aminogruppe, dann als N –terminale AS bezeichnet; die Exopeptidase wird dann entweder als Carboxypeptidase oder als Aminopeptidase bezeichnet - zu den Endopeptidasen zählen das Pepsin (von den Hauptzellen des Magenfundus als Pepsinogen sezerniert) und das Trypsin, Chymotrypsin und Elastase (werden über das Pankreassekret als inaktive Proenzyme Trypsinogen, Chymotrypsinogen, Proelastase ins Duodenum gebracht) - auch die Carboxypeptidasen A und B gelangen in inaktiver Form (Procarboxypeptidase A und B) über das Pankreassekret ins Duodenum - Aktivierung der Peptidasen erfolgt im Dünndarm durch das BSM-ständige (Bürstensaum) Enzym Enteropeptidase (Trypsinogen > Trypsin) sowie durch Trypsin (Trypsinogen > Trypsin, Chymotrysinogen > Chymotrypsin, Proelastase > Elastase), jeweils durch Abspaltung eines Peptids - neben den Peptidasen des Magens bzw. des Pankreas sind verschiedene BSM-ständige Peptidasen (Aminopeptidasen, Carboxypeptidasen, gamma- Glutamylpeptidase, Dipeptidasen) an der Proteinverdauung beteiligt - Verdauung der Nahrungsproteine beginnt im Magen wo sie durch das saure Milieu denaturiert werden (Denaturierung = Verlust der Sekundär- und Tertiärstruktur der Proteine); dadurch wird die proteolytische Wirkung von Pepsin (pH-Optimum 1-3) begünstigt, wobei als Spaltprodukte Peptide und auch AS anfallen - Pepsin kann also in geringem Umfang auch endständige AS abspalten und ist außerdem auch noch im Duodenum wirksam, da der pH-Wert im Sauren liegt - allerdings scheint Pepsin nicht sehr bedeutsam für die Proteinverdauung zu sein, da nach Ausfall der Pepsinproduktion im Magen die Proteinverdauung im Verdauungstrakt nicht nennenswert vermindert ist - offenbar vermögen Endopeptidasen des Pankreas Ausfall von Pepsin zu kompensieren 34 - die über das Pankreassekret als Proenzyme in den Dünndarm gelangenden Endo- und Exopeptidasen hydrolysieren nach ihrer Aktivierung die Nahrungsproteine zu Oligopeptiden und AS - Peptidasen der BSM spalten die Oligopeptide zu Di- und Tripeptiden und AS auf, so dass diese als resorptionsfähige Endprodukte im Dünndarm anfallen - neben den Nahrungsproteinen werden auch sog. endogene Proteine verdaut (gelangen über gastrointestinale Sekrete (Muzine) sowie über die an der Zottenspitze abgeschilferten Epithelzellen ins Dünndarmlumen) - an der Proteinverdauung sind Endopeptidasen des Magens und Pankreas, Exopeptidasen des Pankreas und der BSM des Dünndarmepithels, sowie weitere BSM-ständige Peptidasen beteiligt. Als resorptionsfähige Endprodukte fallen AS sowie Di- und Tripeptide an. 26. Resorption Peptide Monogastrier - die Verdauung beginnt bereits im Magen, wo durch die Salzsäure die Proteine denaturiert werden und unter dem Einfluss der Säure das inaktive Pepsinogen in die aktive Peptidase überführt wird - im Darm wird durch den dort herrschenden pH-Wert das Pepsin größtenteils inaktiviert, kann aber anfangs, solang der Speisebrei noch sauer ist, weiterwirken - in der Hauptsache werden die Proteine jedoch erst im Dünndarm zu Aminosäuren und Oligopeptiden (hauptsächlich Di- und Tripeptide) hydrolysiert und anschließend resorbiert - dabei helfen sowohl Peptidasen des Pankreas als auch enterale Enzyme der Bürstensaummembran - nach ihrer Tätigkeit teilt man die Peptidasen (eiweißspaltende Enzyme) folgendermaßen ein: Endopeptidasen spalten Peptidbindungen zwischen Aminosäuren innerhalb der Polypeptidkette; Exopeptidasen spalten AS vom Ende der Ketten ab daneben gibt es Sonderformen (Carboxypeptidasen spalten AS mit freier Carboxylgruppe ab (C-terminale AS), Aminopeptidasen spalten AS mit freier Aminogruppe ab (N-terminale AS) - die Peptidresorption erfolgt zu 98% im proximalen Tubulus über sekundär aktive Na+Aminosäure-Symporter - für verschieden AS gibt es verschiedene Transporter; allerdings haben AS die eine ähnliche Konfiguration besitzen gleiche Transporter - für die Peptidresorption werden kleinere Peptide in AS gespalten, die dann aufgenommen werden können - größere Peptide gelangen über Endozytose in die Tubuluszellen; im Zytosol findet anschließend ihre Zerlegung in Aminosäuren statt - die Resorption durch die Magenwand steht in keinem Vergleich zu der des Intestinaltraktes - nur kurzkettige Fettsäuren und andere schwache Säuren, die im stark sauren Mageninneren undissoziiert vorliegen, werden resorbiert - wenn diese Säuren in den Epithelzellen dissoziieren und dadurch viel von ihrer Membrantätigkeit einbüßen, kann es im Epithel zur Anreicherung und schließlich zu Epithelschäden kommen 27. Verdauung Proteine beim Wdk - Abbau von Proteinen erfolgt in den Vormägen enzymatisch durch Proteasen mikrobiellen Ursprungs bis zu Oligopeptiden, Dipeptiden und Aminosäuren - überwiegender Teil der Proteasen stammen von Bakterien - kleinere Peptide und Aminosäuren können von Mikroorganismen aufgenommen werden und intrazellulär zu Ammoniak und Corticosteroide (CS) abgebaut werden oder für die Neusynthese von mikrobiellem Protein wiederverwertet werden - Umfang des ruminalen Proteinabbaus ist variabel und wird durch Proteineigenschaften (Löslichkeit, Sekundär- und Tertiärstruktur, Struktur von Disulfidbrücken) bestimmt - je nach Proteinquelle werden zwischen 30 - 70% des Gesamtproteins im Pansen abgebaut; bei Protein aus frischem Gras bis zu 100% 35 - verschiedene Pflanzeninhaltsstoffe (z.B. Tannine) oder auch chemische Behandlungsverfahren können durch Reduktion der Proteinlöslichkeit eine Verminderung des Proteinabbaus bewirken - NPN-Verbindungen werden ebenfalls durch mikrobielle Enzyme abgebaut; Hauptendprodukte sind dabei NH4+ und CO2 und je nach Substrat organische Säuren - der von den Mikroorganismen gebildete Ammoniak wird in die Pansenflüssigkeit ausgeschieden (außer durch diesen NH4+ -Eintritt in die Pansenflüssigkeit, wird die NH4+ Konzentration durch die NH4+ -Elimination bestimmt, die sich aus NH4+ -Assimilation durch Mikroorganismen, Resorption durch die Pansenwand und Abfluss in den unteren Verdauungstrakt zusammensetzt) 28. Ruminohepatischer Kreislauf - Kreislauf zwischen Pansen und Leber zur besseren Ausnutzung des Stickstoffs im Futter - es findet eine kontinuierliche Rezirkulation von Harnstoff statt - das im Vormagen freigesetzte NH3 / NH4+ wird direkt von der Pansenwand resorbiert und gelang über das Blut der Pfortader (V. portae) in die Leber > hier wird es im Harnstoffzyklus zu Harnstoff umgewandelt (Harnstoffsynthese) und entgiftet - Harnstoff gelangt über die V. hepatica und nach Perfusion des Lungenkreislaufs über das arterielle Blut zu den Speicheldrüsen und zur Vormagenwand in den Pansen zurück. Dort wird der Harnstoff mit Hilfe der bakteriellen Urease in NH3 und CO2 gespalten und steht so wieder für die mikrobielle Aminosäuresynthese zur Verfügung - Höhe der Harnstoffzirkulation über die Speicheldrüsen ist eine Funktion der Harnstoffkonzentration im Plasma; Konzentration im Mischspeichel ca. 65% der des Plasmas - Harnstoffzyklus ein Teil des Zyklus findet in den Mitochondrien statt, ein anderer im Cytosol Mitochondrium Bicarbonat wird phosphoryliert und somit aktiviert Ammoniak lagert sich unter Abspaltung des Phosphatrestes an; es entsteht Carbamat Carbamat wird wieder phosphoryliert und somit aktiviert; es entsteht CarbamoylPhosphat Carbamoyl-Phosphat wird dephosphoryliert und auf Ornithin überführt; es entsteht Citrullin Citrullin wird im Antiport gegen Ornithin ins Cytosol gebracht (ATP wird verbraucht!!!) Cytosol Citrullin reagiert mit L-Aspartat zu Argininosuccinat vom Argininosucchinat spaltet sich Fumarat ab; es entsteht Arginin Arginin wird zu Ornithin und Isoharnstoff gespalten (Ornithin geht zurück ins Mitochondrium und Isoharnstoff wird zu Harnstoff) 29. Hauben-Pansen-Motorik - charakterisiert durch regelmäßige, stereotype Kontraktionssequenzen, die nacheinander verschiedene Anteile von Haube und Pansen erfassen - es wird zwischen A und B –Zyklen unterschieden bzw. zwischen primären und sekundären Zyklen - A-Zyklen breiten sich von kranial nach kaudal aus und beginnen mit einer biphasischen Haubenkontraktion (während der ersten Kontraktion verkleinert sich die Haube auf ca. die Hälfte, zweite ist noch kräftiger und lässt das Lumen der Haube nahezu verschwinden), dann kontrahiert sich der Pansenvorhof => Ingesta wird zurück in die sich relaxierende Haube geführt; nun beginnt sich der dorsale Pansensack von kranial nach kaudal zu kontrahieren (Pansenpfeiler ziehen sich hierbei ringartig zusammen und bewegen sich nach dorsal), dann kontrahiert sich der ventrale Pansensack (Pfeiler bewegen sich nach ventral, so dass Flüssigkeit über den kranialen Pansenpfeiler nach kranial in den Pansenvorhof gelangen kann) 36 - B-Zyklen laufen ohne Beteiligung von Haube und Pansenvorhof ab; sie beginnen mit Kontraktion des ventralen Blindsackes mit sich anschließender Kontraktion des dorsalen und dann des ventralen Pansensackes - Pansenkontraktionen sind adspektorisch in der linken Hungergrube erkennbar - Motorik ist also durch A und B-Zyklen gekennzeichnet. Sie ermöglicht eine intensive Durchmischung der Ingesta, Abgabe der Pansengase (Ruktus) und den Weitertransport aus dem Reticulorumen in den Psalter - Reguliert wird die Hauben-Pansen-Motorik durch vago-vagale Reflexe. Das Reflexzentrum liegt in der Medulla oblongata. Das enterische Nervensystem hat hier nur eine untergeordnete Bedeutung - Bestandteile des Reflexbogens sind: 1. Rezeptoren in der Maulhöhle, der Wand des Vormagens, Labmagens und Duodenums 2. afferente Nervenbahnen die über den N.vagus projizieren 3. paariges, bilaterales Magenzentrum in der Medulla oblongata 4. efferente Nervenfasern, die über den N.vagus laufen 5. glatte Muskulatur der Vormagenwand als Erfolgsorgan Am wichtigsten sind Rezeptoren in der Wand von Haube und Pansen! > Mäßige Dehnung der Wand des Reticulorumens führt zu einer vermehrten Motorik von Haube und Pansen > Starke Dehnung und hohe Fettsäurekonzentrationen hemmen die Motorik > Die Aktivierung von Rezeptoren in der Maulhöhle, Labmagen und Duodenum hat zusätzliche Einflüsse 30. Psalter-Motorik - es ist zu unterscheiden zwischen Motorik des Psalterkanals und des Psalterkörpers - die des Psalterkanals steht in enger Beziehung zur Hauben-Pansen-Motorik - Psalterkanal erweitert sich stets auf dem Höhepunkt der 2. Haubenkontraktion (bei offener Hauben-Psalter-Öffnung wird die Ingesta aus dem Bereich des Haubenbodens in den Psalter angesaugt (Saugphase)); daraufhin schließt sich die Öffnung und der Kanal kontrahiert sich, Ingesta wird teilweise zwischen die Psalterblätter gepresst (Druckphase) - es schließt sich eine Kontraktion des Psalterkörpers an => Ingesta wird in Richtung PsalterLabmagen-Öffnung gepresst - kurz vor der folgenden Haubenkontraktion relaxiert sich der Psalterkörper komplett - Psaltermotorik wird primär lokal reguliert (intrinsische Kontraktionen) - Psalter funktioniert als Saug-Druck-Pumpe. Motorik der Psalterkörpers ist nur teilweise mit der Hauben-Pansen-Motorik koordiniert und von N.vagus weitgehend unabhängig 31. Chlorid-Transport im Magen Darm Trakt - Chloridtransport aus dem Lumen zur Blutseite weist eine enge Koppelung zum (elektroneutralen) Na+ -Transport auf - diese Beziehung ergibt sich aus der Nutzung der mit Hilfe der Carboanhydrase in den Zellen aus H2CO3 entstehenden Dissoziationsprodukte H+ und HCO3- Verwendung der Protonen für den Na+/H+ -Austauscher wird kombiniert mit einem Anionenaustauscher in der luminalen Membran, der die HCO3- -Abgabe ins Lumen mit der Aufnahme von Chlorid ermöglicht - über basolaterale Abgabe des Chlorids ist nichts bekannt - die HCO3- -Abgabe ins Lumen muss als wichtiger, aber häufig nicht beachteter Faktor der Pufferung der Vormagenflüssigket angesehen werden - im distalen Jejunum und Ileum findet sich ein Chlorid-/ Bicarbonat-Antiporter, durch den die Chloridresorption durch die Bürstensaummembran stattfindet - durch die basolaterale Membran gelangt das Cl- durch Ionenkanäle - der größte Teil des Chlorids wird aber über solvent drag transportiert - ca. 80% des gesamten Chlorids werden im Dünndarm resorbiert 32. Nahrungsregulation (Ghrelin, Leptin) 37 - von endokrinen Zellen der Fundusdrüsen des Magens wird das Hungerhormon Ghrelin in die Blutbahn abgegeben - Sekretion ist nach Nahrungsentzug erhöht - Konzentration steigt i.d.R. unmittelbar vor einer Mahlzeit an und sinkt während der Mahlzeit wieder - Hunger-Effekt von Ghrelin geht mit einer über das ZNS vermittelten Steigerung der Magenmotorik und Magensaftsekretion einher (wirkt direkt auf hypothalamische Neurone im Nucleus arcuatus) - Leptin ist ein Fettzellhormon, dass in Abhängigkeit von der Größe der Fettzellen freigesetzt wird und hemmend auf die Nahrungsaufnahme wirkt - Leptin ist demnach Gegenspieler des Ghrelins und an der Regulation der Größe der Fettdepots und damit des Körpergewichts beteiligt - da Ghrelin zusätzlich auch die Freisetzung vom Wachstumshormon im Hypophysenvorderlappen anregt, könnte die relativ hohe Nahrungsaufnahme während des Wachstums, die auf einer erhöhten Mahlzeitenfrequenz basiert, durch Ghrelin bedingt sein Kreislauf: Magen leer / Nährstoffoxidation niedrig -> Hunger durch nervale und humorale Signale ausgelöst-> Gehirn bekommt Signal für Hunger/Appetit -> Nahrungsaufnahme -> Magen voll / Nährstoffoxidation hoch -> Sättigung - Magenentleerung vom Dünndarm gesteuert (durch Resorption von Nahrungsbausteinen über vagale Reflexe) - außer Leptin und gastralen Mechanosensoren sind auch intestinale Sensoren für Glucose, AS und Fettsäuren, sowie intestinale Osmosensoren an der Sättigung beteiligt - Besonderheiten beim Wiederkäuer: Feedback-Signale aus dem Vormagen, Ghrelin wurde bisher nicht nachgewiesen, Osmolarität des Panseninhalts führt ebenfalls zur Sättigung - Sättigungssignale werden vorwiegend über den N. vagus ans Gehirn übermittelt 33. Vergleich Vormagenverdauung - körpereigene Verdauung, Enzyme, Produkte, Vor/Nachteile Verdauungsort Polygastrier (Wiederkäuer) Vormagen Celluloseverdauung Sehr hoch (durch Mikroorganismen in den Gärkammern, die Enzyme produzieren, die die betaglykosidischen Bindungen der Cellulose spalten können (langer Vorgang, der lange Retentionszeit benötigt => Vormägen als Speicher sehr gut geeignet) Bei Fütterung von qualitativ gutem Gras sind Hauswiederkäuer durch die lange Retentionszeit den Pferden überlegen Mono-, Di- und Polysaccharide Abbau zu kurzkettigen Fettsäuren in den Vormägen; werden schnell resorbiert; entscheidende Energiequelle für endogenen Monogastrier Dickdarm (Spezies eingeteilt in Tiere, bei denen mikrobielle Verdauung im Caecum erfolgt (Caecumverdauer; Hamster, Kaninchen, Chinchillas…) und in welche bei denen Verdauung im Colon verläuft (Colonverdauer; Pferde) Gering (da Cellulose und andere Zellwandbestandteile nicht durch körpereigene Enzyme abgebaut werden können und durch kürzere Retentionszeit) Bei Fütterung von qualitativ schlechtem Gras sind Pferde den Wiederkäuern überlegen, da sie die Passagezeiten erhöhen können und aus der großen aufgenommen Futtermenge bei Verdauung im Dünn- und Dickdarm noch relativ viele Nährstoffe ziehen Abbau zu kurzkettigen Fettsäuren im Dickdarm; werden schnell resorbiert; entscheidende Energiequelle für endogenen 38 Hochwertiges Eiweiß Abbau hochwertiger Kohlenhydrate und Futterprotein Fette Mikrobiell gebildetes Protein Stoffwechsel; Wiederkäuer müssen die benötigte Glucose vor allem aus Propionat, glucogenen AS, Laktat und Glycerin synthetisieren (Gluconeogenese) Wird in Vormägen mikrobiell abgebaut; das gebildete Ammoniak und AS können Mikroorganismen bei der Proteinbiosynthese nutzen Zucker? Durch Lipasen der Mikroorganismen gespalten; freigesetzte ungesättigte FS werden hydriert und es entstehen gesättigte FS (v.a. Stearinsäure); nur kleiner Teil kann im Dünndarm und im Körper durch Desaturasen in Ölsäure überführt werden; langkettige FS werden im Dünndarm resorbiert und bei der Fettsynthese verwendet => Körperfett enthält viel gesättigte, wenig ungesättigte FS Futterproteine schlechter Qualität und NPN-Verbindungen können bei der Synthese von hochwertigem mikrobiellem Protein genutzt werden. Mikrobielles Protein kann im Dünndarm verdaut werden Stoffwechsel Kann bereits im Magen und Dünndarm gespalten und als Monosaccharide, AS bzw. Peptide resorbiert werden Vorteil; können leichtverdauliche Teile im Magen und Dünndarm spalten und als Monosaccharide, AS bzw. Peptide resorbieren; Kohlenhydrate und Proteine, die nicht im Dünndarm abgebaut werden können, gelangen in den Dickdarm und können dort mikrobiell genutzt werden Aufgenommene Triacylglycerin werden im Dünndarm gespalten; im Futterfett vorhandene ungesättigte FS bleiben weitgehend erhalten und werden ins Körperfett eingebaut; das Fettsäuremuster des Körperfettes entspricht hier also der Zusammensetzung der Fette im Futter Können das gebildete mikrobielle Protein meistens nicht nutzen Ausnahme: Caecotrophie der Kaninchen 34. Wiederkäuen, Ablauf, wo im Zyklus, vagovagale Reflexe, exogene Einflüsse (Stress) Wiederkäuen ist elementare Voraussetzung für den physiologischen Ablauf der Verdauungsvorgänge im Vormagen: - die mit dem Wiederkauen einhergehende Zerkleinerung großer Partikel führt zu einer Oberflächenvergrößerung, die Voraussetzung für eine intensive mikrobielle Besiedelung und den Abbau von Zellinhaltsstoffen ist => Wiederkauen beeinflusst indirekt das Ausmaß der mikrobiellen Fermentation (vor allem bei raufutterreicher Nahrung) - Wiederkauen ist mit einem erhöhten Speichelfluss verbunden; Wiederkauaktivität beeinflusst damit das Milieu im Reticulorumen - die mit dem Wiederkauen einhergehende Abnahme der Partikelgröße und Zunahme der Partikeldichte beeinflussen entscheidend den Ablauf der Ingestapassage aus dem Reticulorumen in den Psalter - Wiederkauen wird durch Stimulation der epithelialen Rezeptoren in der Mucosa von Haube Pansenvorhof induziert - bei strukturreicher Nahrung dauert das Wiederkauen zwischen 8 und 11 Stunden, je feiner das Futter desto mehr sinkt die Wiederkauaktivität ab 39 - epitheliale Rezeptoren projizieren über vagale Fasern zum Wiederkauzentrum in der Medulla oblongata => nach Vagotomie oder Decerebrierung tritt kein Wiederkäuen mehr auf - jeder Wiederkauzyklus beginnt mit der Rejektion eines Bolus in die Maulhöhle, dadurch werden Ingesta aus dem Bereich von Haube und Pansenvorhof vor die Cardia gehoben, deren unterer Sphinkter sich gleichzeitig öffnet; infolge einer Inspiration bei angehobenem weichem Gaumen vergrößert sich der Unterdruck im thorakalen Bereich des Ösophagus so dass der Bolus in den Ösophagus angesaugt wird; eine schnelle antiperistaltische Kontraktion des Ösophagus befördert den Bolus in die Maulhöhle; durch kurzes Schließen der Epiglottis wird verhindert, dass Ingesta in die Trachea gelangt - in der Maulhöhle wird der Bolus zunächst durch Anheben der Zunge ausgedrückt; die Flüssigkeit wird sofort wieder abgeschluckt - jeder Wiederkauzyklus dauert ca. 1 Minute - Futterpartikel werden zerkleinert und die Speichelsekretion ist mehr als verdoppelt - der nächste Zyklus beginnt nach einer kurzen Pause von ca. 5-10 Sekunden - für jede Rejektion wichtig: Haben-Pansen-Motorik, Atmung und Aktivität des Ösophagus synchronisiert (gelingt am besten im Ruhezustand und deshalb ist das Wiederkauen vor allem bei liegenden, dösenden Tieren zu beobachten) - Aufregung und Stress wirken stark hemmend - als Pseudo-Wiederkauen wird eine Aktivität bezeichnet, bei der Boli rejiziert werden, ohne dass sich Kaubewegungen anschließen (vor allem bei Fütterung von strukturarmen Rationen zu beobachten) - Wiederkauen ist ein guter Indikator für die Tiergesundheit - Wiederkauen repräsentiert einen angeborenen, komplexen, vago-vagal gesteuerten reflektorischen Vorgang; Futter wird ca. 8 Stunden täglich wiedergekaut 35. Mikroorganismen im Pansen - Verdauung in den Vormägen der Wdk abhängig von der mikrobiellen Besiedlung - Mikroorganismen bilden ein Ökosystem innerhalb der Vormagenabteilungen - Beziehung zwischen Wirtstier und Mikroorganismen = Symbiose (Nutzen für jeden Partner) Leistungen Wirtstiere: > Konstanthaltung der Körpertemperatur > Substratbereitstellung aus Futter und endogenen Sekreten > Erhaltung eines Fließgleichgewichts durch Speichelsekretion und Flüssigkeits/Partikelumsatz Leistungen der Mikroorganismen: > Bereitstellung von hochwertigen Nährstoffen durch Fermentations- und Syntheseleistungen - wichtigste Fermentationsleistung: mikrobieller Abbau von pflanzlichen Zellbestandteilen wie Cellulose und anderen Kohlenhydraten zu kurzkettigen Fettsäuren, die das Wirtstier nutzen kann - wichtige Syntheseleistungen: Bildung mikrobiellen Proteins, essentieller und nicht essentieller Aminosäuren sowie wasserlöslicher Vitamine > Umwandlung von potentiell toxischen Substanzen in unschädliche Substanzen (Nitrite, Phytoöstrogene sowie Pflanzen- und Pilztoxine) - Bakterien, Protozoen: ca. 10 % des Volumenanteils der mikrobiellen Biomasse in den Vormägen sowie im Pansen, ca. 200 verschiedene Spezies Bakterien: - essentielle für die grundlegenden biochemischen Stoffwechselvorgänge, spalten Kohlenhydrate (Zellulose, Hemizellulose, Pektine, Xylane, Zucker) und Proteine - Besiedlung beginnt unmittelbar nach der Geburt durch den Kontakt zu anderen Tieren, der Umgebung sowie dem Futter - Zunahme der Dichte der Bakterienpopulation in der ersten Woche - Keimdichte beim erwachsenen Tier: zwischen 1010 und 1011 /ml - Zellgröße der Pansenbakterien: zwischen 1 und 10 µm Durchmesser 40 - Population besteht überwiegend aus anaeroben Keimen, nur wenig aeroben Keime - 70 – 80 % haften an der Oberfläche der Nahrungspartikel oder dem Pansenepithel - Beteiligung an der Aufrechterhaltung des Pansenmilieus: Die am Epithel haftenden Bakterien verwerten O2 und halten dadurch das anaerobe Milieu aufrecht (den O2Partialdruck niedrig) und das negative Redoxpotential von −250 bis −300 mV sorgt dafür, dass der Abbau der Kohlenhydrate nur bis zu den kurzkettigen Fettsäuren und nicht vollständig zu CO2 und H2O erfolgt, so dass die in den Fettsäuren enthaltene Energie vom Wirtstier genutzt werden kann - Die im Pansensaft befindlichen Archaebakterien bilden aus CO2 und H2 Methan und senken somit den H2-Partialdruck im Pansen, was eine übermäßige Bildung von Ethanol und Milchsäure verhindert. Methan ist für den Wiederkäuer nicht verwertbar und muss zusammen mit dem CO2 als „Abgas“ über den Ruktus abgegeben werden - qualitative und quantitative Zusammensetzung der Bakterienflora futterabhängig Protozoen: - anaerob, Ciliaten und Flagellaten, nicht essentiell für den mikrobiellen Vormagenstoffwechsel - Besiedelung ebenfalls postnatal, durch Kontakt der Tiere zueinander - Ciliaten (Wimperntierchen): Konzentration in der Pasenflüssigkeit zwischen 105 und 108 Zellen/ml; Größe von ca. 20 bis 200 µm (Hälfte der im Pansen vorhandenen mikrobiellen Biomasse) - Flagellaten (Geißeltierchen): Konzentration in der Pansenflüssigkeit zwischen 103 und 104 Zellen/ml, weniger als Bakterien, jedoch hohe Variabilität; Größe von zwischen 4 und 14 µm Durchmesser; Abhängig von der Zusammensetzung des Futters, der Häufigkeit der Mahlzeiten und versch. Physikochemischen Faktoren Pilze - nicht essentiell für den mikrobiellen Vormagenstoffwechsel - obligat anaerob, Temperaturoptimum von 33 bis 41 °C - als Zoosporen in der Pansenflüssigkeit, als Sporangium (vegetative Form) an Pflanzenpartikeln - Dichte der Pilzpopulation steigt mit dem Rohfasergehalt der Nahrung - metabolisieren einige lösliche Kohlenhydrate, pflanzliche Polysaccharide, Proteine - sind befähigt langkettige Fettsäuren zu synthetisieren - Endprodukte bei der mikrobiellen Fermentation > Kohlenhydrate > Mono-/Oligosaccharide > Pyruvat > kurzkettige Fettsäuren, Gase > Proteine > Oligopeptid, Aminosäuren > Ammoniak, Carbonsäure, bakterielle Proteine > Fette > Glycin > kurzkettige Fettsäuren Fette > langkettige Fettsäuren > Aufnahme durch Mikroorganismen > Mikroorganismen synthetisieren Vitamin C, B-Vitamine und Vitamin K 36. Gallensäurebildung, Gallenfarbstoff, Gelbsucht - Gallenbildung durch Leberzellen und von Epithelzellen der hepatischen Gallengänge - von der Leber sezernierte Galle wird in der Gallenblase gespeichert und durch Elektrolytund Wasserresorption eingedickt – die Zusammensetzung der Galle ist also in Leber und Gallenblase unterschiedlich >> Ausnahme: Pferd, Kamel, Reh, Ratte und Taube haben keine Gallenblase, die Lebergalle gelangt direkt durch den Ductus choledochus in den proximalen Dünndarm Zusammensetzung der Galle beim Fleischfresser Leber-Galle Gallensäuren hauptsächlich Tauro- und Glykocholsäure Gallenfarbstoffe Hauptsächlich Bilirubindiglucuronat Phospholipide 35 Gallenblasengalle mmol / l 300 1 5 2 15 41 Hauptsächlich Lecithin Cholesterin Na+ K+ Ca2+ ClHCO3pH-Wert 2 165 5 2,5 90 45 8,2 10 280 10 12 15 10 6,5 - pro Tag durch den Ductus choledochus in den Dünndarm gelangende Galle: > Mensch und Schwein: 0,5 – 1 Liter > Hund: 0,1 - 0,2 Liter > Schaf: 0,5 – 0,7 Liter > Rind: 3 – 5 Liter > Pferd: 7 – 10 Liter Konzentrierung der Galle in der Gallenblase - organische Komponenten der Galle (konjugierte Gallensäuren, Gallenfarbstoffe, Phospholipide, Cholesterin) erfolgt durch Resorption von Wasser. Wasser folgt bei der Resorption dem resorbierten Na+ und Cl- aus osmotischen Gründen - Na+ wird durch Na+/H+-Austauscher und Cl- durch Cl-/HCO3- -Austauscher der apikalen Membran in die Epithelzellen der Gallenblase aufgenommen - durch die basolaterale Membran wird Na+ durch eine Na+/K+-Pumpe und Cl- durch einen Anionenkanal (auch für HCO3- durchlässig) ausgeschleust. Es kommt dadurch zu einer lokalen Erhöhung der Osmolarität in den interzellulären Spalten, die zum Gallenblasenlumen hin durch Zonulae occludentes (tight junctions) abgeschlossen sind. Dadurch wird die Wasserresorption entlang einem lokalen osmotischen Gefälle bedingt. - das HCO3- aus der Gallenblasen-Galle verschwindet liegt an der Sekretion von H+ durch den Na+/H+-Austauscher > das sezernierte H+ reagiert an der Oberfläche des Gallenblasenepithels mit HCO3- zu H2CO3 , welches zu CO2 und H2O zerfällt - aufgrund seiner guten Lipidlöslichkeit diffundiert CO2 in das Epithel, wo es mittels der Carboanhydrase-(CA)Reaktion in HCO3- und H+ überführt wird - H+ gelangt über den Na+/H+-Austauscher wieder in das Lumen, während HCO3- die Epithelzelle teils über den Anionenkanal der basolateralen Membran und teils über den Cl-/HCO3- -Austauscher der apikalen Membran verlässt - über den Ausschleusungsprozess durch die basolaterale Membran wird der HCO3- Übertritt in das Interstitium und die Blutbahn vermittelt, also hängt die HCO3- -Resorption vom Na+/H+-Austauscher der apikalen Membran, von der Carboanhydrase und dem Anionenkanal in der basolateralen Membran ab - die höhere Konzentration der Gallensäuren, -farbstoffe, Phospholipide und Cholesterin in der Gallenblasen-Galle zur Lebergalle kommt durch die Wasserresorption die durch Elektrolytresorption angetrieben wird, zustande > Mensch: 5 – 10 Mal höher > sonstige Haustiere: 2 – 3 Mal höher - Die organischen Komponenten der Galle werden in der Gallenblase kaum resorbiert - trotz der starken Konzentrierung der Gallensäuren und der übrigen organischen Komponenten weist die Gallenblasen-Galle annähernd die gleiche Osmolarität wie die Lebergalle auf, weil die Gallensäuren größtenteils micellar gelöst und damit nur wenig osmotisch aktiv sind - Gallensäuren und Phospholipide mit hydrophilem und hydrophobem Ende: Detergentien > bilden in wässriger Lösung Molekülaggregate (Micellen), bei denen hydrophobes Ende den Kern und hydrophiles Ende die Schale bilden. Im Kern z.T. auch hydrophobes Cholesterin inkorporiert - hydrophobes Ende: Steroidgerüst der konjugierten Gallensäuren bzw. Fettsäurereste der Phospholipide - hydrophiles Ende: Taurin/Glycin der konjugierten Gallensäuren bzw. Phosphatgruppe der Phospholipide) 42 - konjugierte Gallensäuren: relativ starke Säuren, liegen also als Anionen vor - gemischten Gallensäuremicellen weisen an Außenseite viele negative Ladungen auf, sind also Polyanionen, die Kationen mit ihrer Wertigkeit entsprechend binden und damit immobilisieren. Dies erklärt die hohe Konzentration von Kationen (Na+, K+, Ca2+) in der Galle der Gallenblase und deren geringe osmotische Aktivität. Die osmotische Aktivität von Na+ und Ca2+ in der Gallenblase entspricht Konzentrationen von etwa 145 mmol/l (Na+) bzw. 1,5 mmol/l (Ca2+). Die geringe Konzentration von anorganischen Anionen (Cl-, HCO3-) in der Gallenblase ist darauf zurückzuführen, dass die konjugierten Gallensäuren nicht vollständig micellar gelöst sind und somit teilweise als freie Anionen vorliegen Füllung und Entleerung Gallenblase - Nüchtern: Ductus choledochus an der Einmündung in das Duodenum durch Kontraktion der glatten Zirkulärmuskulatur (Sphincter Oddi) verschlossen (Hund, Katze, Mensch), so dass das die von der Leber sezernierte Galle vom Ductus hepaticus aus über den Ductus cysticus in die Gallenblase statt über den Ductus choledochus ins Duodenum gelangt - Beim Wiederkäuer ist die Wirkung der Zirkulärmuskulatur gering, so dass sie Speicherung /Eindickung in der Galle weniger effizient ist - beim Pferd gelangt die Galle durch Fehlen der Gallenblase kontinuierlich ins Duodenum Gallensäuren - in den Leberzellen aus Cholesterin synthetisiert: zunächst wird Cholesterin hydroxyliert, hydriert und ein C3-Fragment abgespalten, so dass die Chenodesoxycholsäure entsteht. Eine weitere Hydroxylierung führt dann zur Cholsäure. Die so entstandenen Säuren haben einen pKa-Wert von 6 – 7. Sie werden mit Coenzym A und ATP aktiviert und reagieren mit den Aminosäuren Glycon und Taurin zu den wirksamen Gallensäuren mit pKa 2. >> Konjugation mit Aminosäuren ist funktionell wichtig damit die Emulgationswirkung im Dünndarm mit pH 7 – 8 erfolgt - Erst Anwesenheit von Gallensäuren ermöglicht die Bildung von Micellen im Darmchymus - Voraussetzung für im Dünndarm stattfindende, durch Micellen vermittelte Resorption von Lipiden und fettlöslichen Vitaminen - Verdauung von Lipiden beginnt mit deren Emulgation, wo zunächst mechanisch aus großen Fetttropfen kleinere Tropfen entstehen. Die Gallensäuren und Phospholipide setzen die Oberflächenspannung herab und erleichtern diesen Prozess. Im Dünndarmchymus kann nun die Pankreaslipase nach Aktivierung durch eine Co-Lipase angreifen und Triglyceride zu freien Fettsäuren und 2-Monoacylglycerinen hydrolysieren. Die Resorption der Fettsäuren wird durch Micellenbildung möglich > Fetttröpfchen, die mit einem Monolayer aus Gallensäuren, Monoacylglycerinen und Phospholipiden überzogen sind. Diese Schicht bildet gegenüber dem wässrigen Milieu des Darmlumens eine FettWasser- Grenzfläche aus, wodurch der nötige Kontakt der Lipide mit Enterocyten möglich wird, der Voraussetzung für die Resorption von Monoacylglycerinen, freien Fettsäuren und Cholesterin ist - Die Gallensäuren bleiben zurück und werden durch bakterielle Enzyme zum Teil in die sekundären Gallensäuren umgesetzt. Im Ileum erfolgt über einen sekundär-aktiven Na+Cotransporter der Bürstensaummembran die Aufnahme in das Zottenepithel gegen einen elektrochemischen Gradienten. Der Austritt ins Interstitium erfolgt dann durch die Basolaterale Membran durch einen Anionenaustauscher im Austausch gegen Bicarbonat und von dort erfolgt die nahezu vollständige Rückresorption der konjugierten Gallensäuren über das Blut der Pfortader in die Leber (enterohepatischer Kreislauf) und wird von den Leberzellen aufgenommen und wieder in die Gallenkanälchen sezerniert - Im Jejunum werden konjugierte Gallensäuren teilweise durch Diffusion absorbiert - pro Tag durchlaufen die konjugierten Gallensäuren 5 – 10 Mal den Darmtrakt - nur etwa 3 – 4 % der über die Galle in den Dünndarm gelangenden konjugierten Gallensäuren treten in den Dickdarm über, wo sie durch Bakterien dekonjugiert und in dieser Form teilweise durch Diffusion resorbiert werden – der Rest wird ausgeschieden - in der Leber findet dann eine erneute Konjugierung mit Taurin oder Glycin statt - Außerdem regulieren sie neben der Cholesterinaufnahme über die Nahrung die Neusynthese von Cholesterin im Organismus - wichtigsten Gallensäuren: Glykocholat und Taurocholat (bzw. –cholsäure) 43 - in der Gallenblase selbst dienen die Gallensäuren zusammen mit Phosphatidylcholin als Lösungsvermittler für das Cholesterin der Gallenflüssigkeit - werden durch Kontraktion der Gallenblase durch einen Ausführungsgang ins Duodenum abgegeben und durch Cholecystokinin (CCK) reguliert - im Dickdarm erhöhen sie die Wasserpermeabilität des Epithels - Spaltprodukte der Fett- und Proteinverdauung im Dünndarm bewirken die Freisetzung des Intestinalhormons Cholecystokinin (CCK) – dieses führt zur Kontraktion der glatten Muskulatur der Gallenblase und zur Erschlaffung des Sphincter Oddi wodurch sich die Gallenblase im Anschluss an die Fütterung entleert - Außerdem wird die Entleerung der Gallenblase durch die reflektorische Freisetzung von Acetylcholin durch postganglionäre parasympathische Neurone unterstützt, welches auch kontrahierend auf die Muskulatur der Gallenblase wirkt - Gallenbildung in der Leber wird reguliert durch die Konzentration der Gallensäuren im Pfortaderblut, die Sekretionsleistung der Leber durch Sekretin Gallenfarbstoffe - Wichtigste: Bilirubin und Biliverdin - entstehen beim Abbau von Häm in den reticuloendothelialen Zellen der Leber, der Milz und des Knochenmarks - Häm gehört zur Gruppe der Metalloporphyrine (Vorkommen in Katalase, Peroxidasen, Cytochromen) - Enzyme zur Häm-Biosynthese in jeder Zelle vorhanden, in der Leber besonders hohe Aktivitäten - Biliverdin: > erstes Abbauprodukt des Häm entsteht durch Wirkung einer mikrosomalen Hämoxygenase > im zweiten Schritt reagiert es über die cytosolische Bilirubin-reductase zu Bilirubin - Enzym fehlt Vögeln, Reptilien und dem Sumpfbiber > Galle grünliche Farbe - Bilirubin wird als lipophile Substanz an Albumin gebunden zur Leber transportiert, wo es zu einer Kopplung an Glucuronsäure kommt > Diglucuronid, das als wasserlösliche Verbindung mit der Galle ausgeschieden wird - im Dickdarm Reduktion des Bilirubins bis zu den farblosen Verbindungen Stercobilinogen und Urobilinogen - nach Oxidation mit Sauerstoff bzw. Wasserstoffentzug entstehen u.a. Urobilin und Stercobilin (bedingt die normale Kotfarbe) - die verschiedenen Abbauprodukte des Bilirubins werden z.T. im Darm resorbiert und gelangen so erneut in die Leber (enterohepatischer Kreislauf), aber auch ein geringer Teil zur Niere und werden ausgeschieden - Gallenfarbstoff hat keine physiologische Bedeutung für die Verdauung Gelbsucht (Ikterus) - verschiedene Farbstoffe beeinflussen die Farbe des Blutplasmas > Carotinoide, andere Pigmente - auch der Gehalt an Bilirubin bestimmt die Farbe - Störung des Bilirubinstoffwechsels (Abbauprodukt des roten Blutfarbstoffs Hämoglobin) - Auslöser Gallensteine, Leberzirrhose oder Hepatitis - Equiden haben physiologischer Weise schon eine relativ hohe Bilirubinkonzentration im Blut - bei anderen Tierarten ist der Gehalt an Bilirubin bei verschiedenen Krankheitsprozessen zunächst durch vermehrte Sekretion bzw. verminderte Ausscheidung (Anstieg der Serumkonzentration = Hyperbilirubinämie) und anschließend zum Austritt durch das Gefäßendothel mit Einlagerung im Körpergewebe wodurch es zunächst zur Gelbfärbung der Lederhaut (Sklera) des Auges und später auch zur Gelbfärbung der Haut und der Schleimhäute kommt. Auch die Verfärbung von Körperflüssigkeiten und anderen Organen sind möglich, z.B. dunkelbrauner Urin oder heller bis weißer Kot - Prähepatischer/Hämolytischer Ikterus: Ursache vor der Leber > durch stark gesteigerten Zerfall von roten Blutkörperchen (Erythrozyten) im Rahmen einer Hämolyse kommt es zum vermehrten Anfall des unkonjugierten Bilirubins > physiologischer Weise auch beim Neugeborenenikterus (Icterus haemolyticus neonatorum) 44 - Kurz nach der Geburt werden die mit dem fetalen Hämoglobin beladenen Erythrozyten vermehrt abgebaut und durch neu gebildete rote Blutkörperchen ersetzt - üblicherweise unschädlich. Bei massiv erhöhten Bilirubinwerten kurz nach der Geburt (z.B. durch eine bestehende Rhesus-Inkompatibilität (Erythroblastose) oder bei Frühgeburten) besteht allerdings die Gefahr des Kernikterus, einer Schädigung wichtiger Zentren des ZNS schlechte Prognose > Auch bei Bluttransfusionskomplikationen (Untergang von Blutkörperchen) möglich - Intrahepatischer/Hepatozellulärer Ikterus: Störung in der Leber > mehrere Abläufe in der Leber können gestört sein: - Bilirubinaufnahme in die Leberzellen: unzureichende Aufnahme von unkonjugiertem Bilirubin kann einerseits durch Leberzellschädigung (z.B. im Rahmen einer Virushepatitis oder einem akuten Leberversagen) oder andererseits durch Überlastung des zelleigenen Transportsystems bedingt sein. Einige Medikamente (manche Antibiotika) müssen über dieselben Transportwege ausgeschieden werden und können dabei mit dem Bilirubin konkurrieren. - Bilirubinkonjugation (Umwandlung von wasserunlöslichem, unkonjugiertem in wasserlösliches, konjugiertes Bilirubin): Gendefekte von Enzymen (M. GilbertMeulengracht) - Transport von konjugiertem Bilirubin aus der Leberzelle heraus: Leberzellschäden oder vererbte Störungen der notwendigen Strukturen (Dubin-Johnson Syndrome) - Abfluss aus den Gallenkanälchen der Leber in die intrahepatischen Gallenwege: ähnlich posthepatischem Ikterus bereits hier Ausscheidung von Bilirubin und anderen Substanzen gestört (intrahepatische Cholestase) - Posthepatischer/Cholestatischer Ikterus: Störung im Gallengangsystem hinter der Leber > Störung des Gallenabflusses aus der Leber durch den Ductus choledochus in das Duodenum > Da in der Galle neben Bilirubin auch verschiedene andere Substanzen ausgeschieden werden, treten neben der Gelbfärbung von Haut und Schleimhäuten auch verschiedene andere Symptome auf > Gemeinsam werden alle Erscheinungen unter der Bezeichnung Cholestase subsumiert. > Am häufigsten sind es Gallensteine, die im Ausführungsgang steckenbleiben und ihn verlegen. > Aber auch Tumoren (Bauchspeicheldrüse, Gallenblase, Gallengängen oder Zwölffingerdarm) können zu plötzlichen Verschlüssen des Ausführungsganges und damit zu einem Verschlussikterus (oder Obstruktionsikterus) führen > Gallensteinen führen häufig gleichzeitig zu einer Gallenkolik – schmerzhaft > tumoröse Veränderungen in diesem Stadium oft noch schmerzfrei > seltene angeborene Ursache: Gallengangatresie im Neugeborenenalter Gallensteine - Treten bei Haustieren im Vergleich zum Menschen selten auf - Beim Menschen bestehen Gallensteine hauptsächlich aus Cholesterin, dessen micellare Löslichkeit recht begrenzt ist - Bei Haustieren bestehen Gallensteine hauptsächlich aus Ca-Bilirubinat, wobei den Gallensteinen häufig bakterielle Infektionen der Gallenblase voraus gehen, die mit einer Hydrolyse des Bilirubindiglucuronats zu Bilirubin und Glucuronsäure einhergehen. Das schlecht lösliche Ca-Salz des Bilirubins fällt dann aus. 37. enterohepatischer Kreislauf Leber-Darm-Kreislauf - mehrfaches Zirkulieren bestimmter Substanzen im Körper von Säugetieren zwischen Darm, Leber und Gallenblase - neben körpereigenen Substanzen (Gallensäuren) auch Arzneimittel und Gifte - keine eigenständige anatomische Struktur des Körpers mit spezifischer Aufgabe (z.B. Blutkreislauf) sondern das Verhalten bestimmter Stoffe im Körper, das sich aus ihren chemischen und physikalischen Eigenschaften ergibt - über die Nahrung aufgenommene Stoffe gelangen nach Passage durch den Magen vom > Darm durch Resorption in den Blutkreislauf und über die Pfortader (Vena portae) in die 45 - Leber > Metabolisierung: Dort werden sie zum Teil durch Enzyme sowohl gespalten als auch mit bestimmten chemischen Gruppen versehen (=Konjugate) > Ziel: vor allem die Entgiftung und die Erhöhung der Wasserlöslichkeit (Hydrophilie) und damit die Ausscheidung dieser Stoffe > Von der Leber werden sie dann mit der Galle über die Gallenblase und den Gallengang in den Darm abgegeben, von wo sie dann in Abhängigkeit von ihren chemischen und physikalischen Eigenschaften durch Resorption erneut in den Blutkreislauf und damit in die Leber gelangen können dient vor allem der Speicherfunktion physiologischer Stoffe und verringert die Menge die neu gebildet oder neu aufgenommen werden muss Gallensäuren 85 – 95 % enterohepatischer Kreislauf, werden hauptsächlich im Dünndarm resorbiert Gallenfarbstoff Bilirubin 15 – 20 % enterohepatischer Kreislauf auch Cholesterin und Vitamin B12 wichtig bei der Dosierung von im Darm resorbierten Medikamenten wie Tabletten, Kapseln, Dragees und peroral eingenommene Lösungen Gift der Herbstzeitlosen: Colchicin Beschleunigung der Ausscheidung von Giftstoffen mit enterohepatischem Kreislauf oder von entsprechenden Arzneistoffen im Fall einer Überdosierung ist durch Gabe von Aktivkohle möglich - Durch diese werden die betreffenden Stoffe gebunden, aus der Zirkulation zwischen Leber und Darm entzogen und mit der Kohle ausgeschieden > > Genauen Ablauf Resorption siehe Thema Galle !!! < < 38. Kreislauf und Blutdruck - Vertebraten und Vögel: geschlossenes Kreislaufsystem - Blut zirkuliert kontinuierlich durch sämtliche Organe und die peripheren Körperabschnitte, Herz wirkt hierbei als Kreislaufpumpe - Arterielle und venöse Anteile des Kreislaufsystems durch Scheidewand zwischen den Herzkammern vollständig voneinander getrennt - Integrationssystem des Körpers, in dessen An- und Abtransportwegen (Strombahnen) Stoffe zu Zellen und Geweben bzw. wieder zurück gelangen können > Nährstoffe, Blutgase, Enzyme, Elektrolyte, Vitamine, Hormone, Stoffwechselprodukte, Wärme, Abwehrstoffe, Wasser und Blutzellen - Transportmittel: Blut (Haema, Sanguis) - Blutvolumen: Haussäugetiere 6 – 8 % des Körpergewichts, Katze: nur 4 % > Anämie gefährdet! - Zirkulationszeit: 1 Blutkörperchen vom Herz hin und wieder zurück > Großtiere 30 Sek. > mittelgroße Tiere 15 Sek. > Katze 7 Sek. - Blutkreislauf (Systema cardiovasculare): Blut gefülltes Kreislaufsystem eingebunden in die Blutbahn - Lymphgefäßsystem (Systema lymphaticum): Drainagesystem, leitet Körperflüssigkeit (Lymphe) aus dem Interstitium ins Blut zurück - Knochenmark: Blutbildungsstätte (Hämopoese) - Milz: Organ der Blutkontrolle, beim Pferd auch Blutspeicher - Hochdruck-Verteilersystem nach Verlassen des Herzens wird das Blut über größere Arterien und kleinere Arteriolen in die Peripherie gepresst. Dort wird das sauerstoffangereicherte (oxygenierte) Blut in die Peripherie transportiert. Dort verzweigen sich diese Gefäße in unzählige kleine und extrem dünnwandige „Haargefäße“ (Kapillargefäße, Vasa capillaria) – durch deren Wand erfolgt der Gasaustausch, der Transport niedermolekularer Stoffe und Wasser sowie die Wanderung der Blutzellen - Niederdruck-Sammelsystem In den peripheren Kapillaren tritt ein hoher Strömungswiderstand auf, der zu einem signifikanten Abfall des Blutdrucks führt. Dieser setzt sich in den Rücklaufgefäßen fort: 46 Venolen und Venen. Die venösen Strombahnen führen sauerstoffarmes (desoygeniertes) Blut und können zusätzlich die Funktionen eines Blutspeichers übernehmen, aus dem bei Bedarf Blut wieder in die Zirkulation abgegeben werden kann (Haut, Unterhaut, Lunge, Milz) > Die Venen münden wieder in das Herz Herz - Pumpe – vierkammeriger Muskelschlauch mit rhythmischen Kontraktionen um das Blut in weiterführende Gefäße zu pressen - Herzklappen geben die Strömungsrichtung vor und verhindern den Rückfluss - Zwei Hauptkammern (Ventriculi cordis) mit jeweils einer vorgeschalteten Vorkammer (Atrium cordis) - Jede der beiden Hauptkammern hat am Ende je eine Klappe > eine verhindert beim Zusammenziehen der Kammer (Systole) das Rückströmen in das zuführende venöse Gefäß > die andere verhindert dass das Blut aus den abführenden arteriellen Gefäßen nach Erschlaffen der Kammer (Diastole) in die Kammer zurückfließt - rechtes und linkes Herz vollständig getrennt durch Scheidewand – jedoch äußerlich zu einheitlichem Herz vereint - rechtes Herz: presst das Blut durch das Kapillargebiet der Lunge – kleiner Kreislauf oder Lungenkreislauf - linkes Herz: verteilt das Blut im übrigen Körper – großer Kreislauf oder Körperkreislauf - Blut fließt vom linken Ventrikel über die Aorta in den Körper und zurück über die Hohlvene (V. cava) und die rechte Vorkammer in die rechte Kammer. Von dort fließt es über die Lungenarterie, Lunge und Lungenvene in die linke Vorkammer und schließlich wieder in die linke Kammer - Pfortaderkreislauf: Seitschluss des Körperkreislaufs. Aus einem ersten Kapillargebiet des Magen-Darm-Kanals sowie den übrigen unpaarigen Organen der Bauchhöhle (Milz, Bauchspeicheldrüse) wird das venöse Blut zunächst von der Pfortader (V. portae) gesammelt und unter Umgebung der hinteren Hohlvene in der Leberpforte unmittelbar der Leber zugeführt. In der Leber durchströmt das venöse Blut ein zweites Kapillarbett und sammelt sich dann an der Vorderseite der Leber über die Lebervenen in der kaudalen Hohlvene und gelangt über diese in den rechten Vorhof des Herzens - Organe und Gewebe werden in der Regel von Gefäß-Nerven-Bündeln versorgt, bei denen Arterien und Venen, Lymphgefäße und Nerven gemeinsam in bindegewebigen Leitungsbahnen verlaufen, die in den Gliedmaßen meist in der Beugerseite der Gelenke verlaufen um Verletzungen vorzubeugen. Kreislauf - Flüssigkeiten sind nicht kompressibel, so dass in jedem Gefäßabschnitt pro Zeiteinheit dasselbe Volumen fließt - jede lokale Volumenverminderung führt also zu einer Volumenvergrößerung im restlichen Kreislaufsystem - Blutvolumen Herz und Lunge: ca. 15 % arterieller Abschnitt: ca. 10 % im Kapillarbereich: ca. 5 % venöser Bereich: ca. 70 % > Blutreservoir des Körpers - Fließgeschwindigkeit des Blutes abhängig vom Querschnitt der Gefäße des betreffenden Abschnitts - Bei parallel angeordneten Gefäßen (z.B. Kapillarbereich) zählt der Gesamtquerschnitt - Strömungsgeschwindigkeit ist dort am größten, wo der Gesamtquerschnitt am geringsten ist > Aorta - Strömungsgeschwindigkeit ist dort am geringsten, wo der Gesamtquerschnitt am größten ist > Kapillarbett - Entsprechend des Querschnitts verhält sich auch der Druckverlauf 47 - Druck von Flüssigkeit in einem System nimmt mit fortschreitender Entfernung kontinuierlich ab, solange der Gefäßquerschnitt gleich bleibt > verringert sich der Gefäßquerschnitt an einer Stelle fällt der Druck hier stärker ab > im Kreislaufsystem ist der größte Druckabfall in den allmählich enger werdenden Arterien, Arteriolen und Kapillaren - In kleineren Gefäßen: laminare Strömung > Blut fließt ohne Turbulenzen glatt an der Gefäßwand entlang > höchste Geschwindigkeit in der Mitte und geringste am Rand (parabolisches Strömungsprofil) - Strömung von der Druckdifferenz und den Gleitwiderständen zwischen den verschiedenen Flüssigkeitsschichten (Viskosität) abhängig - In größeren Gefäßen: meist pulsierende, laminare Strömung > z.B. in den großen Arterien wo das Blut bei jedem Herzschlag zunächst beschleunigt wird, sich dann aber durch Verformung der Gefäßwand (Pulswelle) wieder verlangsamt - Turbulente Strömung bewegt sich nicht nur Richtung Längsachse sondern gleichzeitig nach allen Seiten und tritt im Organismus nur an Stellen auf, an denen sich Strömungswirbel bilden > z.B. Herzklappen oder an Gefäßabzweigungen > verursachen im Gegensatz zur laminaren Strömung Vibrationen und Geräusche, die mit dem Stethoskop deutlich zu hören sind (z.B. Schließgeräusche der Herzklappen) > kommen in den peripheren Gefäßen nur selten vor Blutgefäße - Arterie: größeres Gefäß, Strömungsrichtung vom Herz weg in Peripherie, ohne Austauschfunktion > elastische Arterien: Aorta, Aortenbogen, Truncus brachiocephalicus, Lungenarterien > muskulöse Arterien: herzferne Arterien mit glatten Muskelzellen in der Tunica media >> Windkesselfunktion: Volumen des Aortenbogens vergrößert sich durch Elastizität, Wandspannung steigt durch Vergrößerung des Durchmessers. In der Austreibungsphase (Systole) dehnt sich die Aorta und speichert so einen kleinen Teil des ausgetriebenen Bluts. In der Diastole entspannt sich das Herz, es wird kein Blut ausgetrieben. Die Aorta zieht sich wieder zusammen und pumpt das gespeicherte Blut gleichmäßig in den Körperkreislauf. Dies führt zu einem gleichmäßigen, kontinuierlichen Blutfluss und somit zu einem konstanten Blutdruck. Außerdem schützt diese Funktion vor einer Schädigung der Kapillaren durch eine ungebremste Blutwelle der Systole. - Arteriole: kleinere Arterie (20 – 100 µm Weite), arterielle Druckregulatoren - Kapillare: extrem dünnwandig mit Stoff- und Gasaustausch zwischen Blut und Gewebe > sinkende Fließgeschwindigkeit und sinkender Blutdruck, nicht in Hornhaut, Linse, Knorpel, Zahnschmelz > Transport- und Barriereschicht (Blut-Gewebe-Schranke in Lunge, Niere und Gehirn) > fördern Filtration und Resorption, Bildung einer blutgerinnungshemmenden Schicht > Sinuskapillaren in der Leber, im roten Knochenmark und in der Milz > Phagozytose - Venole: kleinere Vene, geringes Lumen, dünne Wand, keine elastischen Fasern - Vene: größere Gefäße, Wand auffällig dünner als die der Arterien > sammeln Blut aus den Kapillargebieten, postkapillären Venolen und kleineren Venen und leiten es zum Herz hin und münden in den rechten Vorhof > Venenklappen: verhindern Rücklauf des venösen Blutes ins Kapillargebiet >> Gefäßversorgung durch Diffusion oder Vasa Vasorum (Gefäße der Gefäße) – kleine Kapillarnetze Lymphgefäße - transportiert Lymphe (eiweißhaltige Flüssigkeit, verdünntes Blutplasma) - unspezifische und spezifische Abwehr (Immunsystem) - Transport von Stoffen die vor Eintritt in die Blutbahn in regionalen Lymphknoten gereinigt werden müssen: Staub (Lunge), Keime (Haut, Magen-Darm-Kanal, Atemwege) - Transport von im Darm resorbierten Fetten 48 - System beginnt als blind endendes Rohrsystem in der Peripherie und mündet im Venenwinkel in das venöse Gefäßsystem (Lymphkapillaren, Leitgefäße, Transportgefäße, zentrale Lymphstämme, Lymphgänge) - Lymphozyten werden im Knochenmark und in den Lymphatischen Organen gebildet und gelangen mit der Lymphe über die Lymphgefäße in das Blut. Erkennen durch Oberflächenrezeptoren körperfremde Stoffe und lösen über spezifische Reaktionskette eine Immunantwort aus - Lymphknötchen: Peyersche Platten in der Darmwand - Thymus: übergeordnetes Immunorgan (primäres lymph. Organ) - Entwicklung der zellulären Immunität 39. Herzzyklus (Systole, Diastole, Herztöne, Drücke) - - - Funktionelles Synzytium: Zellen morphologisch voneinander getrennt, Cytoplasma jedoch durch Gap junctions verbunden Herz: mehrkammrige, mit Ventilen versehene Pumpe, die das Blut durch die mechanische Arbeit des Herzmuskels im Kreislauf umwälzt die einzelnen Zellen des Herzmuskels arbeiten koordiniert zusammen, indem sie ihre Aktivität über Gap junctions synchronisieren. Dabei funktioniert das Herz autorhythmisch – es generiert seinen Takt in eigenen Schrittmacherzentren Diastole: Entspannung 1. Druck in den Ventrikeln sinkt unter den Druck der Aorta und der A. pulmonalis, Taschenklappen verschließen sich > Beginn der Entspannungsphase (alle Klappen geschlossen) 2. Druck sinkt unter den Druck der Vorkammern, AV-Klappen öffnen sich > Ende der Entspannungsphase, Anfang der Füllungsphase 3. Blut aus Vorkammern und Venen strömt in die Kammern ein, Druck steigt wieder über den Druck der Vorkammern und die AV-Klappen schließen sich > Ende der Füllungsphase Systole: Kontraktion 4. Kontraktion > Beginn der Anspannungsphase 5. Druck steigt über den Druck der Gefäße, Semilunarklappen öffnen sich > Ende der Anspannungsphase, Anfang der Austreibungsphase 6. Druck fällt unter den Druck der Gefäße, Semilunarklappen schließen sich > Ende der Austreibungsphase 49 Herztöne sind hörbare Töne, die im Rahmen der physiologischen Herzaktion entstehen. > Sie stehen damit im Gegensatz zu den pathologischen Herzgeräuschen, welche meistens durch Defekte der Herzklappen erzeugt werden. > Es gibt vier Herztöne, wovon jedoch normalerweise nur zwei hörbar sind: - Der erste Herzton ist beim Gesunden immer hörbar. Er entsteht durch die Kontraktion der Muskulatur bei gefüllter Kammer zu Beginn der Anspannungsphase des Herzens - Der zweite Herzton ist ebenfalls beim Gesunden immer hörbar. Er ist in der Regel lauter als der erste. Er entsteht durch den Schluss der Semilunarklappen (Taschenklappen) der Aorta und des Truncus pulmonalis zu Beginn der Austreibungsphase >> 1. und 2. Herzton = systolisch << - Der dritte Herzton ist mit dem Stethoskop beim Gesunden nicht hörbar. Wenn er jedoch zu hören ist, kann es ein Hinweis auf eine Störung der linken Kammer sein. Kommt es in dieser beim Bluteinstrom zu Verwirbelungen, entsteht der Ton durch die davon ausgehende Vibration - Der vierte Herzton ist ebenfalls beim gesunden Erwachsenen nicht mit dem Stethoskop hörbar, bei gesunden Kindern jedoch manchmal schon. Bei Erwachsenen weist ein vierter Herzton ebenfalls auf eine pathologische Störung der linken Kammer hin. Der Ton entsteht kurz nach der Kontraktion der Vorhofmuskulatur durch den Bluteinstrom in eine steife oder hypertrophierte Kammer. Herzmuskelzellen besitzen ß-Rezeptoren an ihrer Oberfläche, welche durch Adrenalin und Noradrenalin (sympathisches NS) aktiviert werden > Adrenalin aus dem Nebennierenmark ausgeschüttet und über Blutzirkulation transportiert > Noradrenalin aus lokalen Speichern der sympatischen Nervenendigungen im Herzmuskel - wirken beide über G-Protein und cAMP sowie Proteinkinase A auf die L-Typ-Calciumkanäle und erhöhen deren Aktivität und lösen damit einen erhöhten Calciumeinstrom in die Zelle aus es kommt zu einer stärkeren Kraftentwicklung der Herzmuskelzelle: positive Ionotropie - wirken auf die ß-Rezeptoren der Zellen im Sinusknoten über G-Protein und cAMP und beschleunigen die Depolarisation dieser Zellen es kommt zu einer erhöhten Herzfrequenz: positive Chronotropie Das aus dem parasympathischen N. vagus ausgeschüttete Acetylcholin wirkt über muskarinerge Rezeptoren (vor allem M2-Rezeptoren) der Sinusknotenzellen und hemmt die Adenylatcyclase so dass der cAMP-Spiegel sinkt und der Calciumausstrom aus dem Sarkolemm wird durch Hemmung der L-Typ-Calciumkanäle vermindert dies führt zu einer geringeren Herzfrequenz: negative Chonotropie sowie reduzierter Kraftentwicklung der Herzmuskelzellen: negative Ionotropie Sympathische Stimulierung der Schrittmacherzellen des AV-Knotens bewirkt eine schnelle Fortleitung der Erregung: positive Dromotropie Parasympathische Stimulierung durch N. vagus führt zu einer langsameren Fortleitung der Erregung: negative Dromotropie >> übermäßige Stimulation des AV-Knotens durch den Parasympathikus kann zu einer vollständigen Blockade der Aktionspotentiale der Zellen im AV-Knoten führen: AV-Block << Störung des Elektrolythaushalts des Körpers haben schwerwiegende Auswirkungen auf die Kontraktionskraft und Frequenz des Herzmuskels: - vor allem Calcium, Magnesium und Kalium - Kalium-Mangel kann durch unkontrollierte Verwendung von Laxantien (Abführmitteln) zu einem ständigen Verlust von Kalium über den Stuhl führen und dadurch die Herztätigkeit gehemmt sein > führt zu einer funktionellen Herzschwäche - Brachykardie: verlangsamte Herzfrequenz Tachykardie: beschleunigte Herzfrequenz > Herzflattern/Herzflimmern bis zu 350 Kontraktionen / Min. 40. Schrittmacherzellen im Herzen - Herz ist unabhängig von anderen Reizen 50 - spezielle, relativ kleine, myofibrillenarme und sarcoplasmareiche, wenig differenzierte - Herzmuskelzellen in Vorkammern und Kammern fungieren als Reizgeber und Schrittmacher - sie bilden das Reizbildungs- und Erregungsleitungssystem des Herzens - setzt sich zusammen aus dem Sinus-Knoten (SA-Knoten), der an der Einmündungsstelle der Vena cava cranialis im rechten Vorhof gelegen ist; dem Atrioventrikular-Knoten (AV-Knoten), der an der Vorhof-Kammer-Grenze gelegen ist, dem sich anschließenden His-Bündel mit seinen zwei Tawara-Schenkeln und den sich weiter verzweigenden Purkinje-Fasern - im ellipsoiden (Hund) oder hufeisenförmigen (Pferd, Wiederkäuer) Sinusknoten sind wenige im Zentrum gelegene Zellen für Reizbildung verantwortlich (primäre Schrittmacherzellen) - im gesunden Herzen entsteht im Sinusknoten durch spontane Anhebung des Ruhepotentials (RP) von ca. -70 mV auf das Schwellenpotential (SP) von -40 bis -35 mV ein Reiz, der in eine Erregung überleitet (diastolische Depolarisation, Präpotential) - AP erfasst die Vorkammermuskulatur und wird über bestimmte Muskelbahnen an den AVKnoten weitergeleitet (Geschwindigkeit von 50-150 cm/s) - von dort wandert das AP über das His-Bündel durch die bindegewebige, zwischen Vor- und Hauptkammern gelegene und elektrisch nicht leitende Grenzschicht (Anulus fibrosus) in die Kammern - Erregung im mittleren Abschnitt des AV-Knotens verläuft sehr langsam (5 cm/s); dadurch wird sichergestellt, dass die Kammersystole erst beginnt, wenn Vorkammersystole beendet - im Kammermyokard breitet sich die Erregung erst über Purkinje-Fasern, dann über intermediäre Fasern und schließlich von Zelle zu Zelle aus - relativ schnelle Erregungsausbreitung im Purkinje-System verbessert die Synchronizität und Funktionalität der Kontraktion - Ruhepotential der Schrittmacherzellen des SA- und AV-Knotens ist mit -60 bis -70 mV weniger negativ als das des Arbeitsmyokards (~ -90mV); AP weist kein Plateau auf und ist somit kürzer als das der Kammermuskulatur; Ausnahme: intermediäre Fasern an der Kammermuskelgrenze, diese haben ein hohes Ruhepotential (-90 mV) und eine schnelle Erregungsweiterleitung => zusätzlicher Schutz vor Kammerflimmern - alle Anteile des Reizbildungs- und Erregungsleitungssystem besitzen die Fähigkeit zu spontaner Reizbildung (Unterschied: immer flacher abfallendes Präpotential) - Präpotential des Sinusknotens erreicht als erstes das Schwellenpotential und vermag als erstes eine Erregung auszulösen - fällt der Sinusknoten als primärer Schrittmacher aus, können der AV-Knoten und weiter distal gelegene Anteile des Systems die Schrittmacherfunktion übernehmen und mit langsamer Frequenz einen Ersatzrhythmus aufrecht erhalten (sekundäre, tertiäre Schrittmacher) - kontraktionsauslösende Reize werden im Herzen selbst gebildet; APs werden über ein spezielles Erregungsleitungssystem so auf das Arbeitsmyocard verteilt, dass sich das Herz entsprechend den hämodynamischen Erfordernissen optimal kontrahiert 41. Blut allgemein Blut rund 7 % der Körpermasse Funktionen - Gastransport (O2 und CO2) zwischen Lungen und Gewebe bzw. umgekehrt - Transport von Nährstoffen (GIT→Leber, Transport zwischen den Geweben) - Transport von Metaboliten zum Zielorgan (z.B. von Laktat vom Muskel zur Leber oder Herz) - Transport von Stoffwechsel-Endprodukten (z.B. Harnstoff von Leber zur Niere) - Transport von Hormonen (z.B. Erythropoetin von der Niere zum Knochenmark) - Wärmetransport: Regulierung der Abwärme aus inneren Organen - Abwehrfunktion: Transport von Leukozyten, Immunglobulinen und weiteren Abwehrstoffen - Koagulation: Schutz vor Blutverlust 51 - Aufrechterhaltung der Homöostase in der Gewebeflüssigkeit: “Milieu interieur”, Isotonie, Isoionie, Isohydrie, Isothermie - Aufrechterhaltung der hydraulischen Kraft z.B. bei Nierenfiltration (effektiver Filtrationsdruck) Zusammensetzung - 52 % Blutplasma = flüssige Bestandteile >> Buffy coat: Leuko- und Trombozytenfilm - 48 % Blutkörperchen = feste Bestandteile - Hämatokrit: Anteil der festen Blutbestandteile am Gesamtvolumen in % typische Hämatokritwerte: Mensch Männlich 43-50% Weiblich 37-45% Katze 30 – 44 % Hund 44 – 52 % Pferd (Kaltblut) 30 – 40 % Pferd (Vollblut) 40 – 50 % Schwein 33 – 45 % Rind 28 – 38 % Ziege 28 – 40 % Schaf 30 – 38 % Huhn 32 % Gans 44 % Ente 40 % - 1 kg Blutplasma besteht aus > 900 – 910 g Wasser > 65 – 80 g Proteine > 10 – 25 g Elektrolyte, Nicht-Protein-Stickstoff-Verbindungen (NPN), Kohlenhydrate, Lipide, kurzkettige Fettsäuren, Hormone, Spurenelemente Ion Na+ K+ Ca2+ Mg2+ ClHCO3H2PO4- /HPO42SO42Protein Glukose Lipide Harnstoff Gesamt NPN g/l 3,25 0,18 0,10 0,02 3,6 0,6 0,04 0,02 63 – 80 0,8 (0,35 – 2) 5 0,15 0,3 mmol/l 140 5 3 1 101 24 2 1 1 4,4 (2 – 11) NPN - Harnstoff als Endprodukt des Protein- und Aminosäuren-Stoffwechsels; Besonderheit beim Wdk., Ruminohepatischer Kreislauf - Hippursäure als Entgiftungsprodukt der Benzoesäure aus dem GIT bei Pflanzenfressern - Kreatinin als Abbauprodukt von Kreatin aus dem Muskel-Stoffwechsel - Harnsäure als Abbauprodukt des Purin- bzw. des Aminosäurenstoffwechsels bei Vögeln Kohlenhydrate - Blut der Vena portae führt Leber Monosaccharide (Glukose, Galactose und Fructose) zu 52 - Nach Leberpassage in der Vena hepatica nur noch Glukose Nüchtern-Glukose-Werte: > Monogastrier: 4 – 7 mmol/l > Wiederkäuer: 2 – 4 mmol/l > Vögel: 9 – 11 mmol/l - Regulation über Insulin und Glucagon (Endokrines Pankreas > A- und B-Zellen) Lipide und weitere Blutinhaltsstoffe - aus Nahrung über Darmwand und Lymphe als Chylomikronen (Lipoproteine: Triacylglycerine 90%, Phospholipide 4%, Cholesterin 5%, Proteinhülle) ins Blut > Einteilung entsprechend der Dichte - VLDL (very low density lipoproteins) - LDL (low density lipoproteins, Cholesterin-reich) - HDL (high density lipoproteins) - Lang- und kurzkettige Fettsäuren (an Albumin gebunden) - Ketonkörper (vor allem bei Hungerzuständen) - Milchsäure (vor allem bei Leistung, Training) - Blutfarbstoffe (Carotinoide, Bilirubin > zu viel Bilirubin: Ikterus [Gelbsucht]) Bestandteile des Blutes sind Elektrolyte, Proteine, Nicht-Protein-StickstoffVerbindungen, Kohlenhydrate, Lipide und Fibrinogen. Die Aufrechterhaltung der entsprechenden Plasmakonzentration ist entscheidend und wird in vielen Fällen reguliert. 42. Plasmaproteine und kolloidosmotischer Druck - Plasmaproteine können die Blutgefäße nur in geringer Menge verlassen und erfüllen im Blut vielfältige Aufgaben - am häufigsten im Blutplasma vorkommende Blutproteine: Glyko-, Lipo- oder Metalloproteine - Gesamtkonzentration 60 – 80 g/l - ca. 7 % des Plasmas bestehen aus den Plasmaproteinen: 60 % Albumine (67 kDa), 40 % Globuline (67 kDa bis 1,3 MDa) - Trennung der Proteine mittels Elektropoese möglich - y-Globuline hauptsächlich Immunglobuline (IgM, IgG, IgA), die der Körperabwehr dienen Funktionen der Plasmaproteine - Transport (spezifische und unspezifische Carrier) von wasserlöslichen Stoffen, Fettsäuren, Aminosäuren, Hormonen, Calcium und Enzymen - Pufferung – Aufrechterhaltung des Blut-pH-Werts durch Ampholytcharakter der Proteine - Nährfunktion > ca. 200 g Protein (40 kg Hund) kolloidal gelöst – schnell verfügbare Proteinreserve - Regulation des kolloidosmotischen (onkotischer) Drucks: trotz geringer molarer Konzentration der Proteine (=geringer osmotischer Wert) relativ hoher effektiver Druck durch Kolloidbildung (Kolloid = „Suspensionsform“) der Proteine - Beeinflussung der Blutviskosität - Homöostase und Blutgerinnung im Verlauf von Entzündungen > Fibrinogen, Prothrombin - spezifische und unspezifische Körperabwehr (Immunsystem – Immunglobuline) Ausgewählte Plasmaproteine - Albumine (60 %) > verursachen den kolloidosmotischen Druck des Blutes > Vehikelfunktion für viele im Blut transportierte Stoffe > Proteinreserve im Körper - Globuline (40 %) > Immunabwehr (gamma-Globuline) > Transportvesikel für Lipide, Eisen, Hormone und Spurenelemente (alpha- und betaGlobuline) 53 > α1-Globuline (4 %): - Transcortin (→ Steroidtransport > Cortisoltransport) - Transcobalamin (> Vitamin B12-Transport) - α1-Antitrypsin (→ Proteasehemmer) - HDL (→ Transport von Blutfetten) - Prothrombin (→ Proenzym von Thrombin) > α2–Globuline (8 %) - Haptoglobin (→ Bindung und Transport von Hämoglobin) - α2-Makroglobulin (→ Blutgerinnungshemmer) - α2-Antithrombin (→ Blutgerinnungshemmer, Bindung von Hormonen) - Coeruloplasmin (→ Kupfertransport) > β-Globuline (12 %) - Transferrin (→ Eisenbildung und -transport) - β-Lipoprotein (LDL (→ Transport von Blutfetten) - Fibrinogen (→ Blutgerinnungsfaktor) > γ-Globuline (16 %) - Immunglobuline (Antikörper) (IgA, IgD, IgE, IgG, IgM) Kolloidosmotischer Druck (KOD) - Teil des onkotischem Druck > zusammengesetzt aus kolloidosmotischen und osmotischem Druck (Donnan-Gleichgewicht) - der osmotische Druck der in einer kolloidalen Lösung (Dispersion) herrscht - gemessen an Anzahl der in der Lösung vorhandenen Makromoleküle - In Körperflüssigkeiten (z.B. Blutplasma) wird der kolloidosmotische Druck in erster Linie durch Proteine (z.B. Albumin) bestimmt 43. Blutgerinnung an der Blutgerinnung sind zahlreiche Gerinnungsfaktoren beteiligt (außer Ca2+ sind dies Proteine, die in der Leber synthetisiert werden) - für die Bildung der mit k gekennzeichneten Faktoren ist Vitamin K erforderlich - durch Verletzungen der Blutgefäße werden endotheliale Kollagenfasern freigelegt, an die sich Thrombozyten anheften (wird durch den von-Willebrand-Faktor vermittelt und läuft über einen rezeptorvermittelten Prozess, der gleichzeitig die Thrombozyten aktiviert) - Thrombozyten gehen von scheibenförmiger in dendritische Form über, aggregieren, bilden netzartige Struktur über der Verletzungsstelle; gleichzeitig Sekretion von gefäßverengenden Substanzen (Serotonin, Thromboxan A2 und platelet-derived growth factor) (verengen Blutgefäß und verlangsamen Blutfluss) - durch Ausschüttung weiterer Substanzen, wie ADP, sammeln sich neue Thrombozyten und werden aktiviert => es bildet sich ein mechanischer Verschluss der Verletzungsstelle (Thrombus) = Blutstillung - es folgt die Blutgerinnung, die durch Kaskade verschiedener Faktoren eine faserartig vernetzte Fibrinstruktur bildet, die sich über den Thrombus und die Verletzungsstelle legt und vollständig abdichtet - an der Kaskade sind viele Gerinnungsfaktoren beteiligt, die vorwiegend in der Leber gebildet werden und Vitamin K für die Synthese brauchen; außerdem sind Ca2+ -Ionen notwendig - Gerinnungsaktivierung kann endogen oder exogen ablaufen - endogene Aktivierung beginnt beim Endotheldefekt durch Kontakt der Kollagenfasern mit löslichen, im Plasma vorhandenen Gerinnungsfaktoren und läuft über eine Kaskade weiterer Faktoren (z.B. Kallikrein) - exogene Aktivierung ist etwas schneller und hat ihren Ausgangspunkt in der Gewebsthrombokinase, die bei größeren Verletzungen mit dem Blut in Berührung kommt und dort mit Ca2+ eine Kaskade auslöst - beide Wege münden im Blut zusammen und führen zur Bildung des Prothrombinaktivators, der unter Hilfe von Ca2+ ein Ende des Prothrombinmoleküls abspaltet und es zu Thrombin umwandelt 54 - es kommt zur Koaglutationsphase: Thrombin aktiviert das im Blut enthaltene Fibrinogen zu löslichem Fibrin, dessen monomere Filamente sich vernetzen und dann zu unlöslichem Fibrin werden - letzte Schritte der Blutgerinnungskaskade: 1. Aktivierungsphase: Prothrombin +Prothrombinaktivator+Ca2+ -> Thrombin 2. Koagulationsphase: Fibrinogen + Thrombin -> Fibrin (löslich) 3. Retraktionsphase: Fibrin (löslich) wird zu Fibrin (fest) - Blutgerinnung steht unter Kontrolle der Gerinnungshemmung, die durch Plasmin vermittelt wird - Plasmin sorgt für einen Abbau des vernetzten Fibrins und kann somit größere Thromben abbauen und einen Gefäßverschluss (Thrombose) verhindern - im Körper sind zusätzlich natürliche Thromboseschutzproteine (Heparin und Antithrombin III) vorhanden, die für ein ständiges Gleichgewicht zwischen Blutgerinnungs- und Gerinnungssteuerungssystem sorgen - Fibrinolyse kann auch künstlich ausgelöst werden (z.B. Streptokinase bei Herzinfarkten - fördert die Umwandlung von Plasminogen in Plasmin und der Thrombus lässt sich auflösen 44. Blutgruppen Mensch (AB0, und Rhesusfaktor, Antikörperbildung, warum werden bei A und B und AB schon vor Kontakt mit Antigenen Antikörper gebildet) AB0 -System: - die Erythrozytenmembran weist unterschiedliche Antigene auf, von denen manche nach Bluttransfusionen zur Blutgruppenunverträglichkeit und Hämolyse führen können - im AB0 –System bestimmen endständige Zucker von Glycolipiden die Blutgruppenzugehörigkeit - Blutgruppe A ist durch N-Acetylgalactosamin, Blutgruppe B durch Galactose, Blutgruppe AB durch die Kombination der Zuckerreste und Blutgruppe 0 durch das Fehlen beider Zucker gekennzeichnet - Blutgruppeneigenschaften A und B werden dominant vererbt (AA oder A0; BB oder B0, AB), so dass Blutgruppe 0 nur in homozygoter Form (00) auftritt - Besonderheit des AB0-Systems liegt in der Bildung von Antikörpern gegen die Blutgruppenantigene schon vor Kontakt mit fremden Blut - Individuen der Blutgruppe A bilden Antikörper gegen das Blutgruppen Antigen B und andersrum - Grund für die Antikörperbildung sind Substanzen, die mit der Nahrung aufgenommen oder von Darmbakterien gebildet werden und die gleiche Zuckerstruktur wie die Blutgruppenantigene besitzen - die Bildung von Antikörpern gegen Blutgruppe A (B) wird bei Trägern der Blutgruppe A (B) dadurch verhindert, dass autoreaktive Lymphozyten durch Selektion entfernt werden - Träger der Blutgruppe 0 bilden sowohl Anti-A- als auch Anti-B-Antikörper - Träger der Blutgruppe AB weisen keine Antikörper gegen Blutgruppe A oder B im Serum auf - bei Bluttransfusionen mit Blut anderer Blutgruppen binden die Antikörper an die Antigene auf der Erythrozytenmembran > Agglutination und Hämolyse durch Komplementaktivierung da es sich bei den Antigenen um Glykolipide handelt, bildet das Immunsystem fast nur IgM-Antikörper (wirken sehr stark agglutinierend, gelangen aber nicht über die Placenta > keine Unverträglichkeit im Embryo) Rhesus-System: - ist durch verschiedene Rh-Antigene charakterisiert; D hat die größte Bedeutung - fehlt das D-Antigen auf der Erythrozytenmembran, wird das Blut als rh-negativ bezeichnet - es besteht im Gegensatz zum AB0-System keine Kreuzreaktivität mit Antigenen aus dem Darm; es kommt daher erst nach Kontakt mit Rh-positivem Blut zur Antikörperbildung bei Rh-negativen Personen - bei wiederholten Schwangerschaften von Rh-negativen Müttern mit Rh-positivem Kind kann es zur Rh-Unverträglichkeit kommen 55 - bei der ersten Schwangerschaft und Geburt treten Rh-positive Erythrozyten in den mütterlichen Kreislauf und stimulieren die Bildung von IgM-Antikörpern, die die Placenta nicht passieren können - bei erneutem Kontakt während der nächsten Schwangerschaft kann es auf Grund des IgKlassenwechsels zur massiven Produktion von IgG-Antikörpern kommen, die die Placenta passieren, an das Rh-Antigen auf den fetalen Erythrozyten binden und zur Hämolyse führen - Prophylaxe: rh-negativen Müttern wird nach jeder Schwangerschaft ein Anti-Rh-Antiserum gegeben, das an die übergetretenen Rh-positiven Erythrozyten vom Kind bindet und so die Immunreaktion der Mutter vermindert Blutgruppen der Tiere: - besitzen verschieden Blutgruppensystem (Rinder haben z.B. 12 verschiedene Blutgruppensysteme, Katzen haben nur 2, kein 0) - bei den meisten Tieren kommt es bei der ersten Bluttransfusion in aller Regel nicht zu Unverträglichkeiten, da meistens Antikörper erst nach Kontakt mit fremden Blut (wie beim Rh-Faktor) gebildet werden > Reaktion erst nach erneutem Kontakt mit gleichem Blut 45. Blutverteilung im Körper / Regulation Blutvolumen (Kreislauf-/Blutdruckregulation) Blutverteilung im Körper- und Lungenkreislauf: - weitaus größter Teil befindet sich in den Venen => Venen sind der wichtigste Blutspeicher - Herz und Lunge 15%; arterielles System 10%, Kapillaren 5%, venöses System 70% Regulation des Blutvolumens: kurzfristiger Blutverlust: bei kurzfristigem Verlust kann es zu einer Zunahme des Venentonus kommen dadurch kann genügend Blut dem Herzen zufließen Sympathikusaktivierung bewirkt darüber hinaus eine Erhöhung des Widerstandes in den Arteriolen und führt damit zu einer Abnahme des effektiven Filtrationsdruckes und einer Zunahme der Reabsorption im venösen Teil der Kapillaren ermöglicht mittelfristig eine Ergänzung des intravasalen Volumens mittel- bis längerfristiger Blutverlust: Wasserausscheidung in der Niere wird durch Ausschüttung von Adiuretin (ADH=Vasopressin) vermindert über das Renin-Angiotensin-System kommt es zur erhöhten Vasokonstriktion in den Arteriolen und zur vermehrten Rückresorption von Na+ im distalen Tubulus, im Sammelrohr und im Dickdarm => Wasserrückresorption wird erhöht + Durst wird ausgelöst Volumenmangel bewirkt durch sympathische Stimulation eine Durchblutungsminderung der Niere, dabei wird Renin freigesetzt, das aus Angiotensinogen Angiotensin I bildet, aus dem durch das ACE dann Angiotensin II wird => Vasokonstriktion und ADH-Sekretion gefördert und die Freisetzung von Aldosteron; dadurch kommt es zur erhöhten Na+ - und Wasser-Resorption im Sammelrohr und Dickdarm in der Wand der Herzvorhöfe wird Atriopeptin gebildet und gespeichert; bei Dehnung der Vorhöfe wird durch Volumenzunahmen Atriopeptin vermehrt; Natriumrückresorption im Sammelrohr ist dadurch herabgesetzt und es wird mehr Wasser ausgeschieden => Verminderung eines erhöhten Blutvolumens zentrale Kreislaufregulation: Anpassung des arteriellen Blutdruckes, des Herzminutenvolumens und die Kontrolle des Blutvolumens es sind vor allem Neurone in der Medulla oblongata beteiligt mittlerer arterieller Druck im Körperkreislauf = Herzminutenvolumen + Gesamtperipherer Widerstand 56 Herzminutenvolumen: besteht aus Muskelpumpe, Atembewegungen, Blutvolumen, Aktivität der Sympathicusinnervation der Venen, venöser Druck, venöser Rückfluss, Vordruck, end-diastolisches Ventrikelvolumen, Schlagvolumen, Herzschlagfrequenz, Aktivität sympathischer und parasympathischer Nerven zum Herzen Gesamt-peripherer Widerstand: besteht aus Blutviskosität und Arteriolenradius kurzfristige Blutdruckregulation: kurzfristige Regulation des arteriellen Blutdrucks erfolgt weitgehend über Pressozeptoren durch reflektorische Veränderungen von Herztätigkeit und Gefäßtonus sie erfolgt auch über Vorgänge, die nicht im engeren Sinne zum Regelkreis gehören, dazu zählt man Chemozeptoren, Schmerzrezeptoren und Afferenzen aus dem Limbischen System und dem Cortex das kurzfristige Aufrechterhalten erfolgt über Kreislaufreflexe nach dem Prinzip eines Regelkreises mit Regler, Stellgliedern, Regelgröße und Messfühlern Rezeptoren, die Druckänderungen erfassen (Pressozeptoren) sind dehnungsempfindliche Endorgane im Carotissinus Afferenzen, die zum Kreislaufzentrum in der Medulla oblongata führen, haben einen ständigen hemmenden Einfluss (bei Abfallen des arteriellen Drucks nimmt der Sympathicotonus zu, während der Parasympathicotonus abnimmt => Zunahme der Herzschlagfrequenz und des Schlagvolumens und zur Zunahme des peripheren Widerstands) Pressozeptorenreflex ermöglicht eine schnelle, kontrollierte Gegenregulation bei kurzfristigen Druckveränderungen in den großen Arterien nach verminderter Erregung der Pressozeptoren kommt es zur verminderten Hemmung des Kreislaufzentrums, daraufhin werden Herzminutenvolumen und Widerstände in den peripheren Gefäßen gesteigert, dadurch kommt es zur Erhöhung des arteriellen Mitteldruckes Mittel- und längerfristige Blutdruckregulation: an ihr ist vor allem das Renin-Angiotensin-System beteiligt längerfristige Mechanismen der Blutdruckregulation beruhen in erster Linie auf Vorgängen, die das Blutvolumen in Relation zur Gefäßkapazität beeinflussen 46. Niere (Glomerulum, GFR, Autoregulation) paarig angelegt (im Beckenbereich beidseits der WS) - bohnenförmige Form (=>engl. Kidney) - von außen nach innen: Rinde (Cortex), Mark (Medulla), Nierenbecken mit ableitendem Harnleiter (Ureter) - außen von bindegewebiger Kapsel umgeben - aus dem Mark ragen Papillen mit den darin vorhandenen Endstücken (Nephrone) ins Nierenbecken - Nephrone > bilden die funktionelle Einheit der Niere > 2 Typen: corticale Nephrone (liegen weiter außen in der Rindenschicht) juxtamedulläre (reichen von der Rinde bis tief ins Mark) > Nephron beginnt mit einer blind endenden Struktur (Bowman-Kapsel) > Bowman-Kapsel umschließt ein Kapillarknäuel, den Glomerulus > Glomerulus wird von einer afferenten Arteriole gespeist und mündet in eine efferente Arteriole > von der Bowman-Kapsel aus führt ein Röhrensystem (Tubulus) zum Sammelrohr, das ins Nierenbecken mündet > Röhrensystem beginnt mit dem proximalen Tubulus, der sich direkt an die BowmanKapsel anschließt und eine geknäuelte Pars convoluta hat > mündet in die Pars recta (proximal gestreckt) > Pars recta geht über in die Henle-Schleife > Henle-Schleife hat dicken und dünnen ab- und ansteigenden Ast > dicker ansteigender Ast geht über in den distalen Tubulus, der ins Sammelrohr mündet 57 - - - - - - > Sammelrohr zieht parallel zur Henle-Schleife nach unten und mündet ins Nierenbecken > Nephronzahl ist je nach Tierart sehr unterschiedlich Nephrone sind die funktionelle Einheit der Niere!!! Filtrationseigenschaften > Wand der Tubulussegmente aus Epithelzellen (für Resorption von Wasser und der darin gelösten Stoffe) die Niere ist eines der am besten durchbluteten Organe (25% des Schlagvolumens des Herzens passieren nach der Systole die Gefäße beider Nieren) Gefäßquerschnitte der afferenten und efferenten Arteriolen sind so ausgelegt, dass im Glomerulus ein Stauungsdruck erzeugt wird, der eine Filtration des Blutplasmas in die Bowman-Kapsel ermöglicht efferente Gefäße vereinigen sich und führen über einen absteigenden Ast zu einem 2. Kapillargebiet, das die Tubuli und v. a. die Henle-Schleife umgibt hintereinander geschaltete Anordnung von zwei Kapillargebieten ist im Organismus sehr selten => besondere Funktionsweise! im Bereich der Henle-Schleife findet man Anastomosen, die einzelne Kapillargebiete miteinander verbinden = Vasa recta nach dem 2. Kapillargebiet verlässt das Blut die Niere über Nierenvenolen und die große Nierenvene (V. renalis) und mündet in die Vena cava caudalis Lymphgefäße findet man vor allem in der Rinde, weniger im Mark ; sie beginnen im perivaskulären Gewebe, ziehen entlang der Gefäße zum Nierenstiel (Hilus) und verlassen hier die Niere symp. und parasymp. Fasern des vegetativen NS entstammen dem Plexus coeliacus und ziehen zu den glatten Muskelzellen der Arterien, Arteriolen und z.T. zu den Tubuli (über Fkt. wenig bekannt, da Niere hauptsächlich hormonell gesteuert ist) Funktion der Nephrone > bilden über 4 Prozesse den Harn > im Glomerulus wird zunächst durch Filtration Primärharn gebildet > Primärharn wird durch Resorption und Sekretion so modifiziert, dass Endharn entsteht (hochkonzentriert) Glomeruläre Filtration: - durch die starke Nierendurchblutung wird ca. 15-20% des Wassers + gelöster Substanzen in die Bowman-Kapsel filtriert > Filtration beruht auf Druckdifferenzen: - hydrostatischer Druck Glomeruluskapillaren ca. 48mm Hg - hydrostatischer Druck Bowman-Kapsel ca. 13mm Hg - kolloidosmotischer Druck Glomeruluskapillaren ca. 25mm Hg >> effektiver Filtrationsdruck Peff: Peff= PGl – PB – PK = 48mm Hg – 13mm Hg – 25mm Hg = 10mm Hg - Anatomie der zuführenden Gefäße verursacht drastischen Druckabfall -> fällt Blutdruck noch weiter ab (durch Blutverlust, Schock), kann kein messbarer Peff mehr erzeugt werden => keine Filtration => Schockniere (durch Kollaps und Verklebung der Tubuli irreversible Schädigung) - Kapillarendothel hat Poren, die die zellulären Bestandteile des Blutes zurückhalten => keine Bluteiweiße im Primärharn - Filtration= passiver, auf Druckdifferenzen und Siebeigenschaften der Trennwände in der Bowman-Kapsel beruhender Vorgang >> GFR= glomeruläre Filtrationsrate, sie ist stark vom RPF= renaler Plasmafluss abhängig Proximaler Tubulus - Innenwand von Epithelzellen mit Mikrovilli gebildet => Oberflächenvergrößerung um das 60fache => enorme Resorptionskapazität > Massenresorption von Wasser, Ionen und Substraten > charakteristisch: Na+ gekoppelter Substrattransport (also Na+ zusammen mit Glucose oder AS) 58 > in der apikalen Zellmembran befinden sich zu diesem Zweck Cotransportsysteme, die Na+ entlang eines Gradienten in die Zelle einströmen lassen und dabei den Einwärtstransport des Substrats energetisieren > Na+ -Gradient wird durch Na+/K+ -ATPase aufrecht erhalten, die drei Na+ im Austausch mit zwei K+ aus der Zelle auf die Blutseite transportiert > neben Na+ -Symport-Carriern für Glucose und AS gibt es auch Na+ -gekoppelte Carrier für andere Stoffe (z.B. Phosphate, Sulfate, Acetat, Citrat und Vitamin C) > außerdem: Na+/H+ -Antiport, der Na+ in die Zelle und H+ aus der Zelle des proximalen Tubulus transportiert > Glucose wird im Bereich des proximalen Tubulus fast vollständig resorbiert => Urin enthält bei normalem Blutzuckerspiegel keinen Zucker, wenn ja Diabetes mellitus > im prox. Tubulus wird isoosmotisch 75% des filtrierten Volumens resorbiert, deshalb erreicht nur noch ca ¼ des Ultrafiltrats den absteigenden Ast der Henle-Schleife > im prox. Tubulus findet Massenresorption von vielen Substanzen und Wasser statt!!! kurz: Wasser, Glucose, AS, NaCl und andere Stoffe Henle-Schleife - im dünnen absteigenden Ast nur noch wenig Mikrovilli - Abschnitt ist für Wasser sehr durchlässig, aber es finden keine größeren aktiven Transportvorgänge für Ionen und andere Substanzen statt - hohe Wasserpermeabilität ist für den anschließenden Gegenstrommechanismus von großer Bedeutung - durch den starken Wasseraustritt erhöht sich die luminale Osmolalität kontinuierlich, bis zur Spitze der Schleife - im dünnen aufsteigenden Ast wird sie wieder kontinuierlich geringer, bis sie schließlich im dicken aufsteigenden Ast sehr gering ist - im dünnen aufsteigenden Ast wird NaCl resorbiert, diese Resorption wird im dicken aufsteigenden Ast durch ein spezielles Transportsystem vervielfacht - die Henle-Schleife baut einen osmotischen Gradienten zur Wasserresorption (Harnkonzentrierung) auf kurz: viel Wasser strömt durch, NaCl resorbiert distaler Tubulus - ist wieder geknäuelt und hat vielfache Windungen - hier werden Na+, Cl- und HCO3- resorbiert - K+ und H+ werden sezerniert - zur Na+-Resorption taucht hier ein apikaler Na+ -Kanal auf, parallel dazu läuft ein apikaler K+ -Kanal, der K+ ins Lumen entlässt - in diesem Segment wird weiter Wasser resorbiert - Transportmechanismen stehen unter hormonellem Einfluss der Nebennierenrindenhormone Aldosteron und Cortison Sammelrohr - spielt eine entscheidende Rolle bei der weiteren Harnkonzentrierung - verläuft parallel zur Henle-Schleife und zieht nach unten ins Nierenbecken - resorbiert NaCl - enthält zusätzlich spezielle Wasserkanäle (Aquaporine), die unter der hormonellen Kontrolle des antidiuretischen Hormons (ADH) stehen - Sammelrohr ist für andere Substanzen außer Harnstoff impermeabel Im distalen Tubulus und Sammelrohr stimulieren Hormone (Aldosteron und ADH) die Resorption von Na+ und Wasser Juxtaglomerulärer Apparat - osmotischer Status wird durch konstant geregelte Nierendurchblutung und GFR in Homöostase gehalten 59 - dazu dienen vielfältige autoregulative Mechanismen, die neben myogenen Dehnungsreflexen auch durch in der Niere gebildete Signalstoffe (Kinine, Urodilatin, Prostaglandine) vermittelt werden - Urodilatin erhöht die GFR durch Hemmung der tubulären Na+ -Resorption - Bradykinin erhöht die GFR durch eine lokale Vasodilatation - atriales natriuretisches Peptid (ANP) wirkt auf Rezeptoren der afferenten Arteriole und bewirkt über NO und cGMP eine Steigerung der GFR - Organismus muss schnell auf osmotische Belastungen reagieren und es muss ein Gleichgewicht zwischen glomerulärer Filtration und tubulärer Resorption und Sekretion vorhanden sein, dafür bedarf es eines Rückkopplungsmechanismus, der dem Glomerulus den tubulären Funktionszustand meldet - diese Funktion wird vom juxtamedullären Apparat übernommen - stellt eine enge Verbindung des distalen Tubulus mit dem Glomerulus und vor allem mit den afferenten und efferenten Arteriolen dar - zwischen Tubulus und Gefäßen liegt eine Gewebeschicht, die aufgrund ihres optisch dicht wirkenden Eindrucks als Macula densa bezeichnet wird; hier wird das proteolytische Hormon Renin gebildet, das nach Stimulus in die Arteriolen freigesetzt wird - entscheidend für das Ausmaß der Freisetzung ist die NaCl-Konzentration im distalen - Tubulus – wenn sie verändert ist, wird auch die Reninfreisetzung verändert - das in die Arteriolen abgegebene Renin wirkt auf das Globulin Angiotensinogen; es spaltet einen Teil ab, sodass Angiotensin I entsteht (wirkt leicht vasokonstriktorisch) - beim Durchfluss durch die Lungenkapillaren wird es durch ein angiotensin converting enzyme (ACE) in das Hormon Angiotensin II umgewandelt und wirkt nun im gesamten Kreislaufsystem stark vasokonstriktorisch und stimuliert zusätzlich die NaCl-Resorption in allen Epithelien - durch die allgemeine Vasokonstriktion wird der Blutdruck erhöht und die GFR gesteigert - in der Nebennierenrinde wird Aldosteron gebildet und durch Angiotensin II vermehrt ins Blut ausgeschüttet - Aldosteron wirkt u.a. auf den distalen Tubulus, erhöht dort die Na+ -Resorption und damit auch die osmotisch verursachte Wasserrückresorption der juxtaglomeruläre Apparat reguliert über das Renin-Angiotensin-AldosteronSystem den Blutdruck und die glomeruläre Filtrationsrate!!! Henle-Schleife und Gegenstromprinzip - Henle-Schleife und Sammelrohr bilden funktionelle Einheit, die Wasserrückresorption und Harnkonzentrierung dient Hormonelle Regulation der Wasserresorption: > das antidiuretische Hormon (ADH) wird auch als Vasopressin bezeichnet, da es auch vasokonstriktorische Wirkungen hat - wird im Hypothalamus gebildet und über neurosekretorische Nervenbahnen in den Hypophysenhinterlappen (HHL) transportiert und dort gespeichert - zentrale Osmorezeptoren im Gehirn steuern Produktion und Ausschüttung des ADH - wird bei Bedarf ins Blut ausgeschüttet und so an die Zielorgane gebracht - bindet an den membranständigen v2-Rezeptor in der basolateralen Membran, setzt dadurch eine Kaskade von intrazellulären Signalmolekülen in Aktion und aktiviert über G-Proteine ein an der Membraninnenseite lokalisiertes System - stellt den second messenger cAMP her, der auf die Proteinkinase 1 wirkt, die Aquaporine phosphoryliert und damit aktiviert - nach Öffnen dieser Kanäle strömt Wasser entlang des osmotischen Gradienten in die Zelle und weiter auf die basolaterale Seite - sehr schneller Effekt, der innerhalb von Minuten einsetzt - ADH ist ein Neuropeptid aus dem Gehirn und reguliert im Sammelrohr die Wasserkanäle (Aquaporine) 47. Nebennierenaufbau, Regulation, Hormone und Funktion Nebennieren besteht aus zwei Anteilen: Nebennierenmark und Nebennierenrinde - Mark ist ektodermaler, Rinde ist mesodermaler Herkunft 60 Nebennierenmark - in den Granula der Markzellen sind Adrenalin und Noradrenalin gespeichert (Catecholamine) - Tyrosin wird zu Dopa hydroxyliert, dieses wird dann zu Dopamin decarboxyliert und wirkt im ZNS und autonomen NS als Neurotransmitter, sowie als Hemmfaktor für die Prolactinfreisetzung - durch Hydroxylierung der Seitenkette von Dopamin entsteht Noradrenalin, durch die Wirkung einer Methyltransferase dann Adrenalin - für dieses Enzym ist hohe Glucocorticoidkonzentration erforderlich (durch Nachbarschaft an Nebennierenrinde gewährleistet) - Regulation der Biosynthese erfolgt auf nervalem Weg - Adrenalin wird im Mark gebildet, Noradrenalin auch in anderen chromaffinen Geweben - zusätzlich zur Hormonwirkung hat Noradrenalin auch eine Funktion als Neurotransmitter - für die Catecholamine werden Halbwertszeiten zwischen 20 Sekunden und 10 Minuten beschrieben. Die Inaktivierung erfolgt über: > Aufnahme in die sympathischen Nerven > Aufnahme in die chromaffinen Zellen des Nebennierenmarks > enzymatische Inaktivierung durch die Enzyme Catecholamin-O-Methyltransferase (COMT) und Monoaminooxidase (MAO) > Abbau (z.B. zu Vanillinmandelsäure) Wirkungen der Catecholamine - werden über verschieden Rezeptoren vermittelt (alpha- und beta- Rezeptoren) - Noradrenalin hat eine höhere Affinität zu alpha-Rezeptoren, Adrenalin zu beta-Rezeptoren => unterschiedliches Wirkungsspektrum - dienen generell dazu, den Körper bei hohen Belastungen zu unterstützen - Noradrenalin hat eine überwiegende gefäßverengende Wirkung => der diastolische Blutdruck steigt an - Adrenalin hat eine überwiegende gefäßerweiternde Wirkung (besonders im Muskel), in Haut, Darm und Niere allerdings Vasokonstriktion; steigt die Herztätigkeit, erhöht sich das Herzminutenvolumen, der systolische Blutdruck steigt an => peripherer Widerstand verringert sich => diastolischer Blutdruck sinkt - beide Catecholamine bewirken, dass die Blutversorgung von Haut, Darm und Niere zugunsten der anderen Organe verringert wird - Wirkung auf Verdauung und Genitaltrakt > Adrenalin und Noradrenalin setzen die Aktivität der glatten Muskulatur dieser Organe herab > Verdauung ist bei Abwehr und Flucht von untergeordneter Bedeutung, wird also „stillgelegt“ - Wirkung auf Kohlenhydratstoffwechsel > Blutglucosespiegel wird erhöht, da Glycogen vermehrt mobilisiert wird > für die Glucosekonzentrationserhöhung reichen sehr geringe Mengen Adrenalin > das hormonale Signal wird im Cytosol durch die Wirkung eine Systems verschiedener Kinasen verstärkt; dabei wird nach Bindung des Hormons an den Rezeptor die Adenylatcyclase aktiviert, das gebildete cAMP bewirkt die Umwandlung inaktiver Proteinkinase in die aktive Form; diese aktiviert nun die Phosphorylase-Kinase, die das Enzym Phosphorylase aktiviert > durch Hemmung der Insulinsekretion wird eine Wiederaufnahme der Glucose in die Organe verringert - Wirkung aufs respiratorische System > durch Stimulation des Atemzentrums im Gehirn steigt die Atemtiefe an, der Tonus der Bronchialmuskulatur wird herabgesetzt > Stimulation der Atmung durch Adrenalin ist mit einer erhöhten CO2-Produktion verbunden Nebennierenrinde 61 - Wird in drei Schichten gegliedert: > Zona glomerulosa liegt unter der Bindegewebskapsel der Rinde > Zona fasciculata hier werden vor allem die Hormone der Rinde gebildet > Zona reticularis ist die innerste Schicht und grenzt direkt an das Mark - Nebennierenrindenhormone sind Abkömmlinge des Cholesterins und werden als Corticoide bezeichnet - man unterscheidet zwei Gruppen: Glucocorticoide (wirken auf den Glucosestoffwechsel) und Mineralocorticoide (wirken auf die Natriumretention und Kaliumausscheidung) mit dem Hauptvertreter Aldosteron - Glucocorticoide: Cortisol und Corticosteron werden ins Blut sezerniert - sind überwiegend an Albumin gebunden; bei Pferden z.B. wird Cortisol im Blut durch ein spezifisches Bindungsprotein gebunden und transportiert (ist so nicht direkt wirksam, sondern stellt Speicherform dar) - Glucocorticoide werden bei Belastung in erhöhtem Maße gebildet und spielen wichtige Rolle bei Regulation des Metabolismus von Kohlenhydraten, Fetten und Proteinen - besitzen eine proteinkatabole Wirkung; es kommt zum vermehrten Eiweißabbau und zum Anstieg der Gluconeogenese aus Aminosäuren - es kommt zur Erhöhung der Blutglucosekonzentration sowie zur vermehrten Glykogenbildung in der Leber. Fettsäuresynthese in der Leber wird gehemmt - führen bedingt zur Hemmung der Proteinbiosynthese, zur verminderten Synthese entzündungsfördernder Substanzen und wirken somit entzündungshemmend - bei längerer, schwerer Belastung wird die Antikörperproduktion vermindert und die zelluläre Abwehr unterdrückt (immunsuppressive Wirkung) - Mineralocorticoide > Aldosteron aktiviert Na+ -Kanäle, induziert die Bildung und den zusätzlichen Einbau von Na+ -Kanälen in den apikalen Membranen der distalen Nierentubuli und in den Enterocyten des distalen Colons => elektrogene Natriumresorption wird erhöht > Natriumretention in den distalen Nierentubuli und eine erhöhte Natriumresorption im Colon dienen der Aufrechterhaltung der Natriumkonzentration im Blut > Fehlen Mineralocorticoide, so wird zu wenig Wasser in Niere und Colon resorbiert => es kommt zum Kreislaufkollaps Nebenniere ist an Überwindung von Belastungen (z.B. durch Stressoren) und an der Regulation des Natriumhaushaltes beteiligt!!! 48. Säure Basen Haushalt (Puffer, Acidose, Alkalose, Regulation) - Säure: Protonendonatoren > erhöhen Protonenkonzentration in wässriger Lösung: HA > H+ + A- Base: Protonenakzeptoren > senken Protonenkonzentration in wässriger Lösung: H+ + A- > HA - Starke Säuren geben ihre Protonen leichter ab als schwache. Je stärker die Säure, desto niedriger ist der pK-Wert. Bei stärkeren Säuren liegt Gleichgewicht eher auf der Seite der Ionen, bei den schwachen Säuren eher auf der anderen Seite - Puffer: sorgt dafür das sich der pH-Wert bei Zugabe einer Säure oder Base nicht zu sehr verändert, also das sich die Protonenkonzentration sich nicht oder nur gering verändert - Pufferkapazität Verhältnis zwischen der zugeführten Menge an H+ oder OH- Ionen zu der daraus resultierenden pH-Änderung. Größte Pufferkapazität wenn der aktuelle pH-Wert dem pKWert entspricht - Offenes System: Bicarbonatpuffer > die Konzentration der Bestandteile kann durch verschiedene Faktoren (Atmung, Niere) variiert werden. Wirkungsgrad der pH-Regulation besonders hoch. Puffersubstanz kann hinterher entfernt werden - Geschlossenes System: NBP > die Gesamtkonzentration der jeweiligen Pufferbase plus Puffersäure bleibt konstant nach Zugabe von H+. Geringere Pufferkapazität - Faktoren von der die Kapazität eines Puffersystems im Blut abhängt - Ziel der Puffersysteme ist es, die Relation zwischen dem pH-Wert des Blutes und dem pKWert des Puffersystems auf einen gleichen Wer zu bringen. Bei Bedarf reguliert durch die 62 - - - - Kapazität im Blut eines jeden Puffersystems sowie durch die Veränderlichkeit der Konzentration des Puffers im Blut Puffersysteme im Blut > Proteinat- und Hämoglobinat-Puffersystem > Dihydrogenphosphat/Hydrogenphosphat-Puffer > H2CO3/CO2/HCO3-System = wichtigster Puffer im Blut, offenes System Organe über die akute bzw. chronische Störungen des SBH kompensiert werden > Blut: SB-Puffer im Blut – sofortige Regulation > Lunge: Veränderung Ventilation – Gegenregulation in Minuten > Niere: Ausscheidung von saurem und alkalischen Harn – Gegenregulation in Stunden/Tagen > Leber: Hepatische Harnstoffbildung zur Begrenzung des Harnstoffverbrauchs bei Acidosen >> Gegenregulation in Stunden/Tagen der pH-Wert des Extrazellularraums und des Blutes wird bei Säugetieren hauptsächlich durch das Bicarbonatpuffersystem. Entscheidende Stellglieder im Regelkreis: > CO2-Abgabe aus dem Blut in die Lunge > Säuresekretion in der Niere CO2 + H2O > H2CO3 > HCO3- + H+ CO2 + OH- + H+ > HCO3- + H+ H2O > OH- + H+ Reaktion 1 läuft im Organismus sehr langsam ohne Katalysator ab die Reaktion CO2 + OH- + H+ läuft durch das Enzym Carboanhydrase sehr viel schneller ab Der CO2- Gehalt im Organismus wird durch die Lungenventilation und die Protonenabgabe über die Niere maßgeblich beeinflusst ist die Lungenventilation verringert, kommt es zu einer respiratorischen Alkalose, d.h. einem Absinken des pH-Wertes im Blut, das von der Niere sofort mit einer metabolischen Azidose (d.h. veränderte Protonenausscheidung) kompensiert wird. Auf diese Weise wird die durch die Atmungsveränderung erhöhte HCO3- -Konzentration wieder gesenkt. 49. Regulation des Säure-Basen-Haushalts in der Niere - In der Passage durch das Tubulusystem wird dem Ultrafiltrat fast das gesamt HCO3entzogen und H+ in das Filtrat sezerniert > erfolgt im proximalen Tubulusabschnitt über den Na+/H+-Austauscher - im distalen Tubulus und im Sammelrohr gibt es die entscheidenden Transportmechanismen in zwei Zelltypen zur Regelung des Säure-Basen-Haushalts. > Typ-A-Zellen: säuresezernierende und bicarbonatresorbierende Zellen besitzen in der apikalen Zellmembran eine aktive Protonenpumpe, die H+ aus der Zelle ins Tubuluslumen befördert. H+ stammt dabei aus der mit Carboanhydrase katalysierten, zellulären Reaktion. Das gebildete HCO3- gelangt über einen basolateralen Antiport im Austausch mit Cl- ins Interstitium. Die sezernierten Protonen können im Tubulus mit HCO3- wieder in CO2 und H2O umgewandelt werden. Da beide apikal in die Zelle diffundieren, können sie von der Carboanhydrase schnell wieder in Bicarbonat umgewandelt werden > Typ-B-Zellen: basensezernierende Zellen bei ihnen ist das Chlorid/Bicarbonat-Austauschsystem in der apikalen Zellmembran lokalisiert und die Zellen sezernieren ständig HCO3- ins Tubuluslumen. HCO3- stammt ebenfalls aus den von Carboanhydrase katalysierten Reaktionen in der Zelle. Die dabei im Überfluss anfallenden Protonen werden aber nicht wie bei den Typ-A-Zellen über die apikale Membran, sondern durch eine Protonenpumpe über die basolaterale Membran in das Interstitium und das Blut transportiert - durch diese beiden Zelltypen verfügen Säugetiere in der Niere also über ein hervorragendes System, um Säuren und Basen nach Bedarf entweder aus dem Körper zu entfernen oder in den Körper zurückzuführen - bei niederen Tieren mit einfacher aufgebauten Niere sind diese Mechanismen in den Kiemen (Fische) oder in der Haut (Amphibien) vorhanden - es gibt in der Niere drei Puffersysteme: Bicarbonat-, Phosphat- und Ammoniakpuffer tubulär sezerniertes H+ reagiert mit filtriertem HPO42- zu H2PO4- oder mit sezerniertem NH3 63 zu NH4+. Für diese beiden Verbindungen ist die Zellmembran aber nicht permeabel, so dass die Ionen mit dem Urin ausgeschieden werden. 50. Hendersson- Hasselbalch- Gleichung jede Säure kann bis zu einem bestimmten Grad dissoziieren - je stärker die Säure, desto stärker ihr Bestreben zu dissoziieren (Protonenabgabe => pHWert-Abfall verstärkt) - das Dissoziationsbestreben wird durch die Dissoziationskonstante K bzw. durch den pKWert (pK= -log K) beschrieben - da Skala dekadisch logarithmisch ist, ist wenn ein pK -Wert um eine Einheit niedriger ist, die Säure um das zehnfache stärker - Säuren mit pK –Wert < 1 = starke Säuren - Säuren mit pK –Wert 1-5 = mittelstarke Säuren - Säuren mit pK –Wert >5 = schwache Säuren - Konzentration freier H+ -Ionen und pH –Wert ergibt sich aus dem Dissoziationsgrad der Säuren - Henderson-Hasselbach-Gleichung: pH= pK+log [konjugierte Base]/[Säure] - für die Beurteilung des Puffersystems lässt sich folgendes aus der Gleichung schlussfolgern: > pH-Wert eines Puffersystems wird durch das Verhältnis konjugierter Base zu Säure bestimmt (nicht durch deren absolute Konzentration) > je mehr der pK -Wert einer Säure vom eingestellten pH-Wert der Lösung nach unten abweicht, desto größer ist der Anteil konjugierter Basen in dieser Lösung > sind die Konzentrationen von konjugierter Base und Säure gleich, so ergibt sich: pH=pK hier ist die Pufferkapazität am größten 51. Renin-Angiotensin-Aldosteron-System Renin-Angiotensin-Aldosteron-System (RAAS) ist eine Kaskada von verschiedenen Hormonen und Enzymen, die im wesentlichen den Salz- und Wasserhaushalt des Körpers steuern; zusätzlich ist es eins der wichtigsten blutdruckregulierenden Systeme Aktivierung: > am Anfang der Kaskade steht die Freisetzung von Renin aus dem juxtaglomerulären Apparat des Nierengewebes > juxtaglomerulärer Apparat besteht aus spezialisierten Zellen des Blutgefäßes, das das Nierenkörperchen (Glomerulus) mit Blut versorgt, aus der Macula densa (spezialisierte Zellen des Harnkanälchen, welche in der Nähe der Vas afferens verläuft), und aus speziellen Bindegewebszellen (Mesangiumzellen) > der juxtaglomeruläre Apparat misst den Blutdruck im Vas afferens, den Salzgehalt des Harns im Harnkanälchen und reagiert zudem auf Signale des vegetativen Nervensystems und auf verschiedene Hormone > Myoepithelzellen der Vasa afferentia bilden und speichern die Renin-Granula > folgende Einflüsse führen zur vermehrten Reninfreisetzung: - vermehrte Nierenkörperchendurchblutung - vermehrter Blutdruck (wird an Barorezeptoren gemessen) - vermehrte glomeruläre Filtrationsrate (GFR) - vermehrte Chloridkonzentration im Harn - Aktivierung des sympathischen Nervensystems > Renin wirkt als eiweißspaltendes Enzym (Protease) und spaltet aus dem in der Leber gebildeten Angiotensinogen das Angiotensin I ab > Angiotensin I wird vom ACE (angiotensin converting enzyme) in Angiotensin II umgewandelt (dieses ist das Endprodukt der Enzymkaskade) > Angiotensin II bewirkt eine Vasokonstriktion => dadurch erhöht sich der Blutdruck > in den Nieren führt Angiotensin II zur Verengung der Vasa efferentia => es erhöht sich der Gefäßwiederstand im Abflussbereich der Glomeruli und der Blutdruck der Kapillarschlingen und Nierenkörperchen wird erhöht; dies bedeutet, dass die Filtration in den Nierenkörperchen trotz vermehrter Nierendurchblutung aufrecht erhalten werden kann 64 > in der Nebennierenrinde führt Angiotensin II zu einer Freisetzung von Aldosteron => dieses fördert in den Nierenkanälchen den Rücktransport von Natrium und Wasser aus dem Urin ins Blut => NaCl-Gehalt des Blutes und Blutvolumen steigen > in der Hypophyse führt es zu vermehrter ADH (antidiuretisches Hormon) (auch Vasopressin genannt) Freisetzung => vermehrte Wasserausscheidung durch die Nieren => Wasserkonservierung > am ZNS führen verschiedene Hormone zu Salzhunger und verursachen das Durstgefühl > alle Effekte führen zusammen zur Erhöhung des Kochsalz- und Wassergehalts des Körpers, damit zu einem größeren Blutvolumen und dadurch zur Blutdruckerhöhung > Hormone des RAAS helfen also mit Blutdruckabfälle durch Salz- und Volumenverluste zunächst durch vermehrte Konservierung der verbliebenen Salz- und Wasserreserven zu kompensieren und sie dann durch vermehrte Zufuhr (Salzhunger und Durst) zu korrigieren > überschießende Systemaktivierung wird durch negative Rückkopplung vermieden (höherer Blutdruck, Angiotensin II und Aldosteron hemmen die Reninfreisetzung) 52. Wasserhaushalt (bei Salzmangel) > isotone Hyperhydratation; wird durch vermehrte Retention von Wasser und Salz im isotonen Verhältnis verursacht - aufgrund der Isotonie ändert sich der osmotische Gradient zwischen intra- und extrazellulärem Raum nicht - es kommt zu gleichzeitigen Vergrößerungen des intra- und extrazellulären Raumes - es kann zur Hypervolämie des Blutes und zu Ödemen kommen - Ursachen für diese Störung können Leber- und Nierenschäden sein (Absenkung des onkotischen Drucks), Herzinsuffizienzen (erhöhter hydrostatischer Druck), oder auch eine ungenügende Natriumausscheidung 53. Auge - Reizverarbeitung (welche Transmitter, welche Rezeptoren, Pupillenreflex mit welchem Muskel, Innervation, Atropin (Wirkung, Rezeptoren > muscarinerge) 65 3 Schichten: Cornea (Hornhaut) - äußere Schicht, im hinteren Abschnitt durch die Sklera (Lederhaut) weitergeführt: - Stützfunktion, Abgrenzung des Auges - zur Durchsichtigkeit der Cornea sind die Kollagenlamellen in exakt gleichen Abständen parallel nebeneinander angeordnet. Darüber kommt dann eine Kollagenlamellenschicht mit anderer räumlicher Orientierung, aber gleichem Faserverlauf - Verletzungen führen zur Quellung der Fasern und damit zur Trübung - Hornhauttransplantation möglich Uvea - mittlere Schicht - besteht aus Iris, Ziliarkörper und der Choroidea (Aderhaut) in der die Hauptblutgefäße des Auges verlaufen - im vorderen Augendrittel Ausstülpung der Iris mit Ziliarmuskel und Zonulafasern mit denen die Linse am Ziliarmuskel befestigt ist Retina (Netzhaut) - mündet in der N. opticus (Sehnerv) - enthält Photorezeptoren und Nervenfasern, die die Signale an den N. opticus weiterleiten - wird teilweise durch Diffusion aus den choroidealen Gefäßen ernährt - vor allem die Pferderetina ist weitgehen avaskulär – verändert sich bei eine intraokulären Entzündung (z.B. rezidivierende Uveitis) die Diffusionsstrecke durch Entzündungszellen oder Ödeme kommt es schnell zu Netzhautschädigungen durch mangelnde Versorgung der Retina 66 Physikalisch - optisches System: Lichtstrahlen werden beim Übertritt von einem in ein anderes durchsichtiges Medium gebrochen - bei einer kugeligen Grenzfläche zwischen zwei Medien entsteht dadurch eine Abbildung - Strahlen aus der Ferne fallen parallel ein und sammeln sich im hinteren Brennpunkt (Fh) - im Gegensatz zum Auge können bei den meisten optischen Systemen Strahlen auch in umgekehrter Richtung einfallen, die sich dann bei parallelem Eintreffen im vorderen Brennpunkt (Fv) sammeln > Verbindunglinie zwischen Fh und Fv = optische Achse, - Schnittpunkt mit der Übergangsfläche von einem Medium ins Andere = Hauptpunkt (H) - Brechkraft: > Kehrwert der vorderen Brennweite in Meter (Fv – H) = Dioptrien > abhängig von der Krümmung einer Linse und von beteiligten Brechungsindices - Luft 1,0 - Flüssigkeiten in Abhängigkeit von den gelösten Subtanzen > 1,3 - je weiter die Brechungsindices variieren, desto stärker ist die Brechung Kammerwasser - Entsteht kontinuierlich in der vorderen Augenkammer - abgesondert vom Ciliarkörper - hält Augeninnendruck konstant - Abfluss erfolgt beim Haustier meist durch größere Gefäße des skleralen Venenplexus - Abfluss beim Mensch durch den Schlemmschen Kanal - Aufgabe: Versorgung der nicht vaskularisierten Strukturen des Auges > Linse, Cornea, Glaskörper - kaum Unterschied zur Zusammensetzung des Blutplasmas, da es aus den Kapillaren der Ziliarfortsätze filtriert wird > proteinärmer und höherer Laktat- und Chloridgehalt - ca. 3 µl pro Minute produziert - pathologische Erhöhung des Augeninnendrucks (Glaukom) entweder durch gesteigerte Produktion von Kammerwasser oder durch Abflussbehinderung > Augeninnendruck steigt auf bis zu 60 mm Hg, was sekundär zur Degeneration der Sinneszellen der Netzhaut führt - physiologischer Augeninnendruck 20 mm Hg - Bei Haustieren primäre Glaukomgefahr durch den Abfluss über den Venenplexus wesentlich geringer als beim Menschen Dioptrischer Apparat - Auge = zusammengesetztes optisches System (dioptrischer Apparat) - Refraktion: Brechung von Lichtstrahlen durch Übertritt in Medien anderer optischer Dichte - Licht beim Auge aus der Luft kommend durch die aufgelagerte Tränenflüssigkeit, die Cornea, die vordere Augenkammer mit Kammerwasser, die Linse und durch den Glaskörper auf die Retina als umgekehrtes, verkleinertes Bild projiziert - Hauptbrechung am Auge (ca. 2/3 der Gesamtbrechung) am Übergang vom Medium Luft zur Tränenflüssigkeit, da deren Brechungsindices am stärksten differieren - Brechkraft des Auges bei unterwasserlebenden Tieren also deutlich reduziert - Cornea selbst ist avaskulär und reichlich mit myelinfreien Nervenfasern durchzogen - die Nervenfasern haben im Rahmen des Cornealreflexes eine wichtige Schutzfunktion - auch die in der Cornea enthaltenen Enzyme und sekretorisches Immunglobulin A schützen vor Infektionen - Tränendrüsen dorsolateral des Auges und geben Tränenflüssigkeit in Konjunktivalsack ab - Abfluss über Tränengang und Tränensack zur Nasenhöhle Akkommodation aktive Änderung der Brechkraft - höhere Brechkraft für in der Nähe liegende Gegenstände nötig als für in der Ferne liegende - geforderte Zunahme der Brechkraft direkt durch den Kehrwert der Entfernung des Gegenstandes gegeben 67 - maximal erreichbare Änderung der Brechkraft zwischen Fern- und Nahakkommodation = Akkommodationsbreite - Akkommodation des Auges durch stärkere Krümmung der Linse, wobei hauptsächlich deren Vorderseite an Brechkraft zunimmt - Linse besitzt große Eigenelastizität und kugelt sich ab, wenn sie nicht von außen am Linsenäquator von Zonulafasern straff gehalten wird. Die Kraft hierfür wird hauptsächlich durch die elastischen Strukturen der Aderhaut geliefert – dieser Zug kann jedoch durch Kontraktion des ringförmigen Ziliarmuskels verringert werden, wodurch Krümmung und Brechkraft der Linse zunehmen - Ziliarmuskel wird hauptsächlich parasympathisch innerviert (Naheinstellung), besitz aber auch einen geringen Anteil an sympathischer Innervation – er nimmt deshalb in Abwesenheit eines Akkommodationsziels einen gewissen Ruhetonus ein, der durch das dynamische Gleichgewicht zwischen beiden Arten der Innervation bestimmt wird - Akkommodationsbreite bei den Haussäugetieren im Vergleich zum Menschen teilweise deutlich geringer > Pferde besitzen starre Linse und schwach ausgeprägte Ziliarmuskeln > geringe Fähigkeit zur Akkommodation > Brechkraft der Linse des Hundes mehr als doppelt so groß wie die des Menschen > bei Vögeln ist an der Akkommodation häufig auch zusätzliche Änderung der Hornhautkrümmung beteiligt Kurz-, Weit- und Alterssichtigkeit - bei Kurz- und Weitsichtigkeit abweichende Augapfellänge - Kurzsichtigkeit (Myopie): parallel einfallende Strahlen schneiden sich schon vor der Netzhaut, weil der Augapfel zu lang ist (Hilfe: Zerstreuungslinse) - Weitsichtigkeit (Hyperopie): schon beim Sehen in die Ferne muss nahakkommodiert werden, da der Augapfel zu kurz ist (Hilfe: Sammellinse) - Altersweitsichtigkeit (Presbyopie): an Vorderfläche der Linse unter der Linsenkapsel liegt das Linsenepithel. Diese Epithelzellen sind die einzigen teilungsfähigen Zellen der Linse, sie verlängern sich und differenzieren sich zu Linsenfasern. Die Linse wächst also zeitlebens durch sich auflagernde Linsenfasern. Durch die Linsenkapsel können aber keine Zellen abgestoßen werden und so kommt es zur vollständigen Vergrößerung und Verdichtung des Kerns. Dadurch nimmt die Akkommodationsbreite im Alter ab, da die Linse nicht mehr so elastisch ist. Bei allen Haussäugetieren!!! Reflexabläufe Nahsehen - Lichtwellen eines sich nähernden Objektes werden zunächst hinter der Retina abgebildet - Informationen über das unscharfe Bild werden zu den visuellen Zentren des Gehirns geleitet - aktivierte oculomotorischen Zentren im Mittelhirn führen dann über die Oculomotoneurone die Akkommodationsreaktion durch - gleichzeitige Aktivierung von parasympathischen Nervenfasern - Kontraktion der Ziliarmuskeln wodurch sich die Linsenkrümmung erhöht - zur Verbesserung der Schärfentiefe Verringerung des Pupillendurchmessers - um Bild scharf zu halten muss die Linse ständig akkommodieren Pupillenreflexe - in das Auge einfallende Lichtmenge hängt von der Weite der Pupille ab - Erhöhung der retinalen Leuchtdichte führt zu einer reflektorischen Verengung der Pupille, um das Auge vor Blendung zu schützen - Reflexbogen zieht von den Photorezeptoren über die Sehnerven zum Mittelhirn und von da aus weiter zum Oculomotoriuskern - bei manchen Tieren wird die im geöffneten Zustand runde Pupille konzentrisch verengt, bei Katzen zu einem senkrechten Schlitz geschlossen - Belichtung nur eines Auges führt immer auch zur Pupillenverengung des anderen Auges (konsensueller Reflex) 68 - Steigerung des sympathiko-adrenalen Systems führen zu Erweiterung der Pupille - Beobachtung der Pupillenreaktion wichtig bei neurologischer Untersuchung und Überwachung der Narkosetiefe > oberflächliche Narkose: Pupille erweitert, es wirken noch Schmerzreize > Toleranzstadium: Pupille verengt, erhöhter Parasympathikustonus > ganz tiefe Narkose: Pupille durch zentrale Lähmung des N. oculomotorius wieder erweitert >> allerdings in Narkotika häufig Parasympatholytika wie Atropin oder Atropinderivate enthalten, die den Pupillenmuskel lähmen Aufbau Netzhaut und Signalverarbeitung - Netzhaut enthält sensorische Zellen des Auges - sie detektieren Lichtreize unterschiedlichster Wellenlängen und ermöglicht so das Farbensehen - Insgesamt 5 Zelltypen, die an der Verarbeitung der Lichtreize beteiligt sind - Rezeptoren die elektromagnetische Energie des Lichts in elektrochemische Signale umwandeln sitzen in der äußersten Schicht der Retina, so dass das Licht zunächst die gesamte Netzhaut passieren muss - Außen grenzen die Photorezeptoren an die nichtneuronalen Pigmentzellen, die das Pigment Melanin enthalten, welches das Augeninnere schwärzt und so die Lichtreflexion verhindert - Verarbeitung der Reize und Weitergabe der Information durch verschaltete Kette aus 3 Neuronen in der Netzhaut 1. Neuron: Photorezeptroren > Stäbchen oder Zapfen 2. Neuron: Bipolarzellen 3. Neuron: Ganglienzellen - Axone der Ganglienzellen vereinigen sich zum N. opticus und ziehen zum Gehirn - blinder Fleck: lichtunempfindliche Zone, da im Bereich des Austritts des Sehnervs keine Rezeptoren liegen - Horizontale Verschaltungen zwischen den Photorezeptoren und Bipolarzellen durch Horizontalzellen und Amakrine Zellen, so wird die Information über den Zustand einer Photorezeptorzelle an mehrere Ganglienzellen weitergegeben (Divergenz) und die Ganglienzelle enthält die Information vieler Photorezeptorzellen (Konvergenz) - Divergenz und Konvergenz: typische Eigenschaften von neuronalen Netzwerken, kommen immer gleichzeitig vor > hohe Flexibilität in Informationsverarbeitung - Ganglienzellen informieren Gehirn über Aktivität in ihrem retinalen rezeptiven Feld, welches aus den Bipolarzellen und den Photorezeptorzellen besteht, welches auf eine Ganglienzelle verschaltet > Ideales Verhältnis 1 : 1 : 1 - Stäbchen: so lichtempfindlich, das sie bereits von einem Photon erregt werden, können jedoch keine Farbe detektieren - Zapfen: geringere Empfindlichkeit für Licht, enthalten aber Pigmente, die Farben bestimmter Wellenlängen absorbieren können > Farbensehen unter Tageslichtbedingungen - Verteilung in der Retina ist tierartlich unterschiedlich > besonders viele Zapfen bei Tagaktiven Tieren – für Farbensehen (photoptisches Sehen) > hauptsächlich Stäbchen bei Katze, Kaninchen und Eulen, jedoch auch einige Zapfen bei diesen Dämmerungsaktiven Tieren, also auch Farbensehen möglich > nur Stäbchen bei Goldhamster, Igel, Maulwurf und Fledermaus, deswegen können diese Nachtaktiven Tiere nur schwarz-weiß sehen (skotopisches Sehen) - bei den meisten Tieren gibt es ebenfalls Bereiche der Retina, die auf hohe räumliche Auflösung spezialisiert sind, diese bei nachtaktiven Tieren aber fast ausschließlich mit Stäbchen besetzt > Nachtaktive Tiere (Mäuse, Ratten) besitzen insgesamt nur 1 – 3 % Zapfen > Reduktion zugunsten der lichtempfindlichen Stäbchen 69 - Vögel: über komplette Retina günstiges, niedriges Zahlenverhältnis zwischen Photorezeptoren und Ganglienzellen > hohe Sehschärfe - Steppentiere: horizontalen Streifen > schärfstes Sehen zum Horizont beobachten - auch Pferde haben diesen horizontalen Streifen, allerdings haben Pferde nur wenige Bereiche in der Retina die zum scharfen Sehen dienen, deshalb werden viele Dinge möglicherweise nur schemenhaft wahrgenommen werden können. Insgesamt Ganglienzelldichte außerhalb zweier kleiner spezialisierter Bereiche in der Retina des Pferdes gering > Auflösungsvermögen gering - jede Rezeptorzellen besitzt Außenglied, welches über dünnes Cilium mit dem restlichen Zellkörper verbunden ist. In Außengliedern zahlreiche Membranscheibchen (Stäbchen) bzw. Membraneinfaltungen mit dem jeweils eingelagerten Sehfarbstoff. Außenglieder zeitlebens erneuert und abgestoßene Bestandteile durch Phagozyten der Pigmentepithelschicht beseitigt - Zellkörper trägt Zellkern und Zellorganellen Photorezeption und Transduktion - Photorezeptoren von Vertebraten = Sinnesrezeptoren = keine Depolarisation bei Reizung, sondern Hyperpolarisation - im Dunkeln: kontinuierlicher Na+-Einstrom über Stäbchenmembran > Zelle depolarisiert > dabei hält cGMP die Na+ und Ca2+-Kanäle der Außensegmentmembran geöffnet, was eine ständige Transmitterausschüttung (Glutamat) an der Synapse bewirkt. Dadurch Aktivierung der Bipolarzellen, die inhibitorisch (hemmend) auf die Ganglienzellen wirken > so senden die Ganglienzellen keine Information zum Gehirn und zeigen dadurch Dunkelheit an - Lichteinfall: Na+-Kanäle der Photorezeptoren schließen, dadurch verringert sich Transmitterausschüttung. Die Bipolarzellen hemmen die Ganglienzellen nicht mehr und diese senden wieder Informationen zum Gehirn - retinale Rezeptoren schütten also bei Dunkelheit mehr Transmitter aus als bei Helligkeit - Phototransduktion so empfindlich, das bei extremer Dunkeladaption die Absolutschwelle des Sehens bei 1 – 4 Lichtquanten pro Stäbchen und Sekunde liegt 70 - Aufgabe der Photorezeptoren eintreffende physikalische Energie (Lichtquanten) in chemische Signale umzuwandeln = Transduktion – Stäbchen und Zapfen Signaltransduktionskaskade mit generell gleichen Komponenten: Opsin, 11-cis-Retinal, Transducin und Phosphodiesterase > Opsin (Protein) und 11-cis-Retinal (Chromophor, Aldehyd des Retinol [Vitamin A]) bilden in den Stäbchen Rhodopsin > 11-cis-Retinal kann Licht absorbieren (aufgrund Abfolge konjugierter Doppelbindungen), durch Bindung an Opsin wird sein Absorptionsmaximum in den Wellenlängenbereich des sichtbaren Lichts verschoben. Nach Lichtabsorption wechselt 11-cis-Retinal in Pikosekunden aufgrund eines Energietransfers von der 11-cis in die trans-Form (Stereoisomerisation) wodurch es zur Dissoziation von Opsin kommt, welches sich ebenfalls strukturell verändert und dadurch enzymatisch aktiv wird. Ein aktiven Opsin aktiviert nun bis zu 3.000 Transducinmoleküle (GTP-bindende Proeteine) welche die Phosphodiesterase aktiviert, wodurch die cGMP-Moleküle hydrolytisch gespalten werden. Durch den Konzentrationsabfall des cGMP schließen die cGMP-abhängigen Kationenkanäle. Dies führt zur Hyperpolarisation mit verringerter Transmitterfreisetzung. Diese Kaskade läuft in den Zapfen gleich, jedoch mit Isoformen der Komponenten Opsin, Transducin und Phosphodiesterase Tapetum lucidum - bei den meisten Haussäugetieren und nakaktiven Vögeln und Reptilien - Carnivore: aus Zellen aufgebaut - Herbivore: fibröser Ursprung - zwischen Pigmentepithel und den Blutgefäßen unter der Netzhaut - Bestandteile der Zellen: Kristalle (z.B. Zinkcysteinhydrat) (Hund) oder Riboflavon (Katze) - Photonen, die die neuronale Schicht der Netzhaut passiert haben werden reflektiert und können so die Rezeptorzellen nochmal reizen, was ein besseres Sehen bei Nacht ermöglicht, weil geringe Lichtreize nochmals ausgenutzt werden - Tiere mit Tapetum lucidum haben ein grün bis blau reflektierende Auge, wenn sie im Dunkeln von einer Lichtquelle angestrahlt werden Adaptionsmechanismen - Anpassung des Auges an unterschiedliche Beleuchtungsstärken = Adaption - zur Verarbeitung von Extremreizen (1 : 1012) verfügt das Auge über verschiedene Adaptionsmechanismen - wichtige Schutzfunktion ist der Pupillenreflex gegen Überbelichtung: die pigmentierte Iris, die durch Variation der Pupillenweite die Menge des einfallenden Lichts reguliert > die meisten Tiere besitzen für diese Regulation zwei antagonischtisch wirkende glatte Muskeln > M. sphincter pupillae und M. dilatator pupillae, innerviert vom Parasympathikus (Sphinctermuskulatur, Miosis) und Sympathikus (erweitert, Mydriasis) - Konzentration des Sehfarbstoffes, die sich in einem dynamischen Gleichgewicht befindet - Mechanismen der örtlichen und zeitlichen Summation während der Signalverarbeitung und weiterleitung - System nur gering in der Lage Helligkeiten voneinander zu unterscheiden, passt sich aber automatisch an die vorherrschende Beleuchtungsbedingungen an - die Retinalen rezeptiven Felder messen also Unterschiede in der Beleuchtungsstärke und nicht die Gesamtlichtmenge - Dunkeladaption = Anpassung an schwache Lichtverhältnisse – zunächst passen sich die Zapfen und dann die Stäbchen an – die Erhöhung der Empfindlichkeit kann bis zu einer Stunde dauern - umgekehrt führt die Helladaption = Anpassung der Rezeptoren an längere, hellere Lichteinstrahlung innerhalb von 10 bi 60 Sekunden, um das Auge vor Überblendung zu schützen Farbensehen 71 - wenn Sonnenlicht (weißes Licht) durch ein Prisma zerlegt wird entsteht ein farbiges Spektrum von Violett bis rot – Wellenlänge von 400 nm bis 750 nm - die Zapfen geben keine Informationen über die Wellenlänge des eintreffenden Reizes sondern reagieren immer gleich wenn sie die adäquate (passende) Wellenlänge absorbieren - Farbwahrnehmung entsteht also über retinale Ganglienzellen, die die Reaktion benachbarter Zapfen innerhalb eines rezeptiven Feldes vergleichen - Anteile der Signale der verschiedenen Zapfentypen werden an das Gehirn gemeldet und als Farben interpretiert - Farbensehen ist mehr als nur die Registrierung der er emittierten Wellenlängen eines Objektes – integrative Prozesse im Gehirn führen zur Wahrnehmung, was die Bestimmung schwer macht, wie Tiere Farben wahrnehmen - Analyse der vorhandenden Sinnesrezeptoren in der Netzhaut und deren Absorptionsmaxima - Trichromaten (gr. tria chromos = drei Farben) sind Lebewesen mit drei verschiedene Arten von Zapfen (Farbrezeptoren) in der Netzhaut - Beim Menschen gibt es drei Sorten von Zapfen mit unterschiedlichen Absorptionsmaxima: > rotempfindliche L-Zapfen (Long, lange Wellenlänge) > grünempfindliche M-Zapfen (Medium, mittlere Wellenlänge) > blauempfindliche S-Zapfen (Short, kurze Wellenlänge) - Aus den Messwerten der L-, M- und S-Zapfen erstellt das Gehirn ein Farbbild, wie wir es vom Alltag her kennen - Zapfen haben so geringe Empfindlichkeit, dass sie nur bei guten Lichtverhältnissen arbeiten > Bei Dämmerung oder Dunkelheit nimmt Funktionalitä stark ab, so dass die empfindlicheren Stäbchen einspringen müssen. Da es nur einen Typ von Stäbchen gibt und diese nicht zwischen verschiedenen Wellenlängen unterscheiden können, nimmt das Farbsehen mit aufkommender Dunkelheit ab. Deshalb können Menschen nachts keine Farben mehr erkennen - Trichromaten: nur Altweltaffen (Mensch, Gorilla, Pavian, Gibbon) - Dichromaten: alle anderen Säugetiere mit nur zwei Zapfentypen, kein Rot und Orange > Stiere, Pferde, Hunde - Tetrachromaten: Vögel, Fische, Reptilien, Amphibien, vier Arten von Farbrezeptoren > Vögel können die meisten Farben wahrnehmen, fast bis in den UV-Bereich, da die Photorezeptoren besitzen, die ein Absorptionsmaximum von 340 nm haben - Betrachtet man das Gefieder mit Hilfe einer UV-Lampe erkennt man einen deutlich Geschlechtsdimorphismus, was für den Menschen jedoch gleich bunt aussieht > Bienen: auch ähnlicher UV-Rezeptor, jedoch kein Rot-Rezeptor > Schlagen sehen Licht im Infrarot-Bereich um 800 nm Zentrale Verarbeitung Entstehung Bildwahrnehmung Entscheidend ist die Verarbeitung im Gehirn - 1. Schritt der Objekterkennung: immer die äußere Begrenzung des Objektes durch Messung der Helligkeitsunterschiede eines Objektes gegenüber seiner Umgebung. Rezeptive Felder der retinalen Ganglienzellen sind kreisförmig/ellipsoid und jede Ganglienzelle informiert das ZNS über den Lichteinfall in solch einem kleinen Areal der Retina - alle Bilder werden zunächst an der Netzhaut auf eine zweidimensionale Information reduziert (wie einzelne Punkt eines Fernsehbildes) und im visuellen Cortex wird aus dieser Information beider Retinae wieder ein dreidimensionales Bild gewonnen. Voraussetzung: jeder Punkt muss die räumlichen Beziehungen zu den anderen Punkten der Welt bewahren - Nach Umschaltung im Thalamus erreichen die Axone der Sehnerven die primäre Sehrinde - Dort stattfindende Projektion entspricht einer Karte der Retina: die Zellen mit nah beieinander liegenden rezeptiven Feldern geben die Information an Cortexzellen (liegen 72 auch nah beieinander) weiter. Der Output einer Gruppe verschiedener corticaler Zellen wird zusammengenommen um ein Bild zu erhalten Organisation des visuellen Cortex - für jeden Punkt auf der Retina ist ein Satz corticaler Zellen mit der gleichen räumlichen Anordnung vorhanden, die in Säulen angeordnet sind - in einer Säule liegen nur Zellen mit gleicher räumlicher Orientierung, in der benachbarten Säule befinden sich Zellen mit ähnlicher Anordnung aber geringer Abwandlung der Richtung - Stimulus mit spezieller Orientierung führt dazu, dass die Zellen der Säule mit derselben Orientierung am stärksten reagieren und die Zellen mit entgegengesetzter Orientierung keine Antwort zeigen - andere Neurone reagieren maximal, wenn die hell-dunkel-Kontur nicht nur eine bestimmte Orientierung sondern Unterbrechungen oder Ecken hat - besonders starke Aktivierung durch bewegte Reizmuster - Gesamtheit der einfachen und komplexen Zellen, die auf eine bestimmt Orientierung des Reizes anworten bilden eine Orientierungssäule Visuelle Assoziationszonen - primäre visuellen Cortex umgeben visuelle Assoziationszonen – bei Primaten stark ausgebildet - die Neurone der Assoziationszonen sind ebenfalls in Säulen angeordnet und integrieren und analysieren den vorverarbeiteten Ausgang des primären visuellen Cortex, um noch komplexere und detailliertere visuelle Muster zu erkennen - im primären Cortex spielen Linien, Orientierung und Bewegung eine Rolle in den höheren visuellen Assoziationszentren des Affen gibt es Neurone, die ausschließlich auf ein komplettes Abbild eines Affengesichts ansprachen – auch bei Schafen und Menschen Gesichtsfeld und binokulares Sehen - Blickfeld: Teil der Umwelt, der bei unbewegtem Kopf aber frei beweglichen Augen wahrgenommen wird - Gesichtsfeld: der mit unbewegten Augen erfasste Bereichs. Durch die ungleichmäßige Verteilung von Stäbchen und Zapfen in der Netzhaut ist das Gesichtsfeld je nach Farbe des Gegenstandes unterschiedlich groß - Teile des Blickfeldes werden von beiden Augen aufgenommen, was für scharfes, naturgetreues Sehen erforderlich ist, da es sonst keine dreidimensionalen Eindrücke gäbe - Tiefenwahrnehmung: leicht unterschiedliche Bilder der gleich Gegebenheit auf beiden Augen abgebildet, es entsteht jedoch ein einheitliches Bild hieraus – dafür Sorgen spezielle Zellen im visuellen Cortex - Binokulares (räumliches Sehen) ist für einen Jäger die Voaussetzung für das exakte Beurteilen von Entfernungen bis zur Beute > Katze: Gesichtsfeld 180° mit binokularem Anteil von 100° in welchem die Tiefenwahrnehmung möglich ist > Mensch sieht binokular, jedes Auge ein Gesichtsfeld von etwa 150°, Überschneidung 120° > Pferd, Schnepfe, Hase sehen monokular > Tiere mit gerade gerichteten Augen (Jäger) haben ein gutes räumliches Auflösungsvermögen wogegen Tiere mit seitlich angesetzten Augen (Beute) wenig überlappende Informationen erhalten und deshalb wenig Tiefenschärfe besitzen > Hund: Gesichtsfeld 240° mit Überschneidung von 60° > Hasen und Kaninchen: Gesichtsfeld 360° mit Überschneidung von nur 30° > Pferde: Gesichtsfeld 300° mit Überschneidung von 60° - ein Pferd mit kurz gehaltenen Zügeln hat deswegen kurz vor sich einen Bereich in dem es nichts sieht 54. Bau und Funktion Innenohr - besteht aus der knöchernen Schnecke (Cochlea), die drei, durch häutige Schichten umgebene Kanäle enthält - Bei Säugetieren ist die Schnecke in einer Spirale mit ca. 2 ½ Windungen geformt - Bei Amphibien und Vögeln hat sie eine fast lineare Form 73 - Oberer Kanal (Scala vesticuli), unterer Kanal (Scala tympani) >> Verbunden an der Spitze (Helicotrema) und mit Perilymphe gefüllt. Zwischen den beiden Kanälen liegt die Basilarmembran, die durch die Schallwellen in Schwingungen versetzt wird - dritter Gang (Scala media), getrennt von der Scala vestibuli durch die Reißner-Membran, gefüllt mit Endolymphe (produziert in der Stria vascularis der Scala med.) - Der Schall wird vom Steigbügel über das ovale Fenster auf die Perilymphe der Scala vestibuli übertragen - Die Schallwellen laufen über das Helicotrema und die Scala tympani zurück zum runden Fenster, welches sich in Ausgleichsbewegungen zum ovalen Fenster bewegt, um den Druck in der Schnecke konstant zu halten - Durch die Schallwellen wird die Basilarmembran in Schwingung versetzt, wobei ihr Resonanzverhalten zwischen den Frequenzen diskriminiert, so dass die maximale Auslenkung in einer bestimmten Entfernung vom ovalen Fenster frequenzspezifisch erfolgt - Frequenzunterscheidung (Wanderwellentheorie) - Die Amplituden der durch die Perilymphe laufenden Schallwellen wandern entlang der Basilarmembran und erreichen an einem bestimmten Punkt (abhängig von der Breite und der Elastizität der Basilarmembran) ihr Maximum. Dadurch wird das eigentliche Sinnesorgan erregt (Corti-Organ, eingelagert in der Basilarmembran entlang der gesamten Schnecke) - am Boden der Scala media befindet sich die Tektorialmembran, eine von Cilien gebildete, wulstförmige Ausstülpung der Basilarmembran - Das Corti-Organ ist der eigentliche Ort der Reizaufnahme in der Cochlea - Sinneszellen sind in zwei Gruppen und in 3 Reihen äußerer und eine Reihe innerer Haarsinneszellen zwischen den Stützzellen angeordnet - Nur äußere Haarzellen besitzen Stereozilien, die nach oben in die Tektorialmembran hineinragen - Die durch die Wanderwellen hervorgerufenen Ausbuchtungen der Basilarmembran verursachen eine Scherbewegung zwischen der Tektorial- und der Basalmembran - Dadurch werden auch die Stereozilien zur Seite bewegt und eine mechanoelektrische Transduktion (Umwandlung eines äußeren Reizes in ein physiologisches Signal) eingeleitet - Die äußeren Haarzellen werden allerdings nur von ca. 10 % der afferenten Neurone des Hörnervs versorgt, der überwiegende Teil dieser Neurone führt an die inneren Haarzellen, die aber keinen Kontakt mit der Tektorialmembran haben - Allerdings befindet sich zwischen Tektorial- und Basilarmembran ein mit Endolymphe gefüllter Spalt > hydrodynamische Kopplung - Bei den äußeren Haarzellen spielt die unterschiedliche Ionenzusammensetzung in den verschiedenen Gängen der Schnecke eine entscheidende Rolle, durch welche besondere endocochleäre Potenzialverhältnisse erzeugt werden - Die äußeren und inneren Haarzellen weisen ein Ruhepotential von ca. – 70 mV auf - Durch das Abbiegen der Cilien wird es moduliert und ein Rezeptorpotential entsteht - Endocochleäres Potenzial: in der Cochlea gibt es die Besonderheit, dass die Endolymphe in der Scala media mit ihrer hohen K+-Konzentration gegenüber den anderen Flüssigkeitsräumen ein positives Potential von ca. + 85 mV erzeugt - Da die Cilien und die apikale Membran der Haarzellen in diesen positiv geladenen Endolymphraum ragen, ergibt sich über die Zellmembran dieser Haarzellen insgesamt eine Potenzialdifferenz von + 155 mV - Das Ruhepotenzial dieser Zellen (- 70 mV) addiert sich also zum endocochleären Potenzial (+ 85 mV) und führt zu einem extrem hohen Potenzialgradienten, der als treibende Kraft für einen K+-Einstrom zur Verfügung steht - Stereozilien untereinander sind mit feinen Filamenten tip link verbunden - Ein laterales Abscheren der Cilien (Deflektion) führt zu einer Zugkraft an diesem Filament, wodurch sich K+-Kanäle in der Cilienmembran öffnen > es erfolgt ein K+-Einstrom, der die Haarsinneszelle depolarisiert und über die Freisetzung von intrazelluläre Ca2+-Ionen zur Ausschüttung eines afferenten Transmitters (Glutamat) führt - dieser Transmitter stimuliert über eine Synapse das afferente Neuron, das über die Hörbahn ins Gehirn führt 74 - etwas verzögert öffnen sich dann andere K+-Kanäle der Haarzelle, was zu einer Repolarisation des Rezeptorpotenzials führt - die äußeren Haarzellen kontrahieren sich bei diesem ständig ablaufenden Depolarisationszyklus rhythmisch und ändern so ihre Länge - durch genetischen Defekt der zur Repolarisation notwendigen K+-Kanäle sowie der Tight junctions dieser Sinnesepithelzellen kann es zu Schwerhörigkeit oder Taubheit kommen 55. Schmerzsinn (Nozizeption) - Aufgabe: Organismus vor Verletzungen und Schädigungen bewahren - Führen unmittelbar zur Flucht- und Abwehrreaktionen, die oft als unmittelbarere Reflexe blitzschnell ablaufen - Akutes Schmerzempfinden tritt oft erst nach einer Latenzzeit auf, die viele Minuten betragen kann > temporäre Analgesie - Akute Schmerzen sind biologisch sinnvoll und deaktivieren den Organismus um die Heilung zu fördern - Chronische Schmerzen sind nutzlos, da sie zu einer dauerhaften Aktivitätshemmung führen - Die schädigenden Reize werden von so genannten Nozizeptoren aufgenommen und im ZNS verarbeitet > freie Nervenendigungen > in verschiedenen Körpergeweben in verschiedener Anzahl vorkommend > nur aktive Nozizeptoren sprechen sofort auf schädigenden Reiz an > der weitaus größte Teil ist zunächst inaktiv und wird bei Bedarf durch lokal abgegebene Stoffe aktiviert, die hauptsächlich von entzündeten Gewebebereichen gebildet und abgegeben werden, so dass sich ein initiales Schmerzempfinden mit der Zeit noch erheblich verstärken kann > Sensibilisierung vor allem durch Prostaglandine und Leukotriene > setzen bei ihrer Reizung auch selbst vasodilatatorische Substanzen (Substanz P) frei, die stark durchblutungsfördernd wirken. Dadurch werden viele Blutzellen in das verletzte 75 - - - - Gewebe gebracht, die zusätzliche Substanzen (Histamin, Bradykinin, Serotonin) ausschütten Da die intensiven Prozesse der Wundheilung (Zellproliferation, Immunprozesse) ablaufen sieht entzündetes Gewebe immer stark gerötet aus Beim Säugetier werden Nozizeptoren der Haut durch myelinisierte Neurone (hochschwellige Nozizeptoren) gebildet, die am Ende eine fenestrierte Schwannsche Scheide aufweisen (Varikosität), so dass die Axonmembran am dieser Stelle frei liegt > werden nur durch starke mechanische Schmerzreize (Nadelstiche) erregt Polymodale Nozizeptoren reagieren dagegen auf ein breites Reizspektrum > Stiche, thermische Reize, chemischen Reizen (z.B. Säure) Erregung verläuft über unspezifische Kationenkanäle, die sowohl auf Liganden als auch Hitze reagieren Das Nervensystem leitet die nozizeptiven Reize nicht nur weiter, sondern verarbeitet und moduliert sie, so dass Schmerzempfindungen erheblich verstärkt und eine größere Hautoberfläche einbezogen werden (Hyperalgesie) Schmerzen aus peripheren Geweben (Oberflächenschmerz) werden besser wahrgenommen als Eingeweideschmerzen (Tiefenschmerz) Werden Schmerzen nicht rechtzeitig behandelt können sie auch nach Heilung noch fortbestehen Da die ableitenden Schmerzneurone im Hinterhorn des Rückenmarks eng zusammen liegen können sich viszerale und Oberflächenafferenzen vermischen und übertragene Schmerzen erzeugen, die oft in andere Körperregionen ausstrahlen oder sich an der Oberfläche in Headschen Zonen manifestieren Im ZNS können Schmerzen an verschiedenen Stellen blockiert werden > z.B. Bereiche des Mittelhirns (Nucleus raphe) Opiate (beta-Endorphin) und Enkephaline Psychische Einflüsse können Schmerzen verstärken oder vermindern 56. Geschmackssinn - chemische Reize wirken auf Chemosensoren - Geschmacksinn: Moleküle in Flüssigkeiten gelöst - Geruchssinn: Moleküle liegen frei in der Luft vor - vier primäre Geschmackqualitäten: sauer, salzig, bitter und süß - Mischempfindungen wie süßsauer, sauersalzig - Existenz von metallischem Geschmack und Glutamatgeschmack umstritten - nachgewiesen beim Menschen, bei Wirbeltieren ungewiss > vermutlich haben einzelne Individuen eine individuelle Geschmackswelt die von spezifischen ökologischen Erfordernissen bestimmt wird > individuellen Unterschiede sind außerordentlich groß und von verschiedenen Faktoren abhängig: Zusammensetzung der Grundnahrung, Lebensalter, etc. - Verhaltungsuntersuchungen um Präferenzen, Aversion (Ablehnung) oder Indifferenz (ohne Unterschied) gegenüber Testlösungen zu bestimmen - einige Vögel (Hühner) können nicht zwischen süß und bitter unterscheiden - die meisten Säugetiere trinken hypotone Salzlösungen lieber als reines Wasser, Hühner dagegen trinken freiwillig keine Salzlösung – jedoch saure oder alkalische Lösungen - erhebliche Speziesunterschiede in Bezug auf verschiedene Zuckerarten > erwachsene Hunde bevorzugen zuckerhaltiges Futter > Katzen verhalten sich indifferent und reagieren auf größere Mengen von Saccharose mit Erbrechen und Durchfall > Kälber (und Schweine): Präferenz für Saccharose, jedoch indifferent gegenüber Laktose > gemeinsam ist den meisten Haussäugetieren die Aversion gegenüber Saccharin - Sinneszellen des Geschmackssinns liegen bei allen Haussäugetieren in den Geschmacksknospen, die in den Geschmackspapillen der Zunge, in der Schleimhaut des weichen Gaumens, der Epiglottis und des Rachens liegen - Zunge: 3 verschiedene Typen von Geschmackspapillen > Pilzpapillen > Papillae fungiformis (200 – 400 Stück) 76 > Blattpapillen > Papillae foliatae (15 – 20 Stück) > Wallpapillen > Papillae vallatae (treten ca. 1 mm aus der Zungenoberfläche hervor) - Mechanorezeptoren: Fadenpapillen > Papillae filiformis, verteilt über die gesamte Zungenoberfläche (am Schutzsystem des Mund- und Rachenraumes beteiligt) Geschmacksknospen: - hauptsächlich in den Wänden und Falten der Zungenpapillen - enthalten 10 – 150 Sinneszellen, die wie Segmente von Orangen angeordnet sind und sich - nach oben in einen flüssigkeitsgefüllten Trichter (Porus) öffnen; zwischen den Sinneszellen sind Stützzellen eingebettet > Hunde, Rinder, Hasen: 15 - 30.000; Mensch: 5.000; > Enten 100; Hühner, Tauben: 20 – 40 > aus der Anzahl lässt sich nicht auf das Spektrum von Geschmackswahrnehmungen schließen, auch die verschiedene Verteilung auf der Zunge hat keine funktionellen Konsequenzen - Geschmackssinneszellen: modifizierte Epithelzellen > apikales Ende: Mikrovilli mit Geschmackssensoren > Lebensdauer der Sinneszelle etwa 1 Woche, fortlaufend durch Baselzellen ersetzt > im Alter Produktion der Sinneszellen zunehmend geringer so dass die Geschmacksempfindungen erheblich reduziert sind > zwischen den Sinneszellen winden sich marklose Nervenfasern aus Geschmacksneuronen verschiedener Hirnnerven und bilden mit diesen synaptische Kontakte > Geschmackssinneszellen verhalten sich wie sekundäre Sinneszellen, die bei Aktivierung die Freisetzung von Transmittern modulieren > Transduktionsprozess: Interaktion zwischen Geschmacksstoff und Rezeptormolekül erzeugt ein depolarisierendes Sensorpotential - Sauergeschmack > abhängig von der Konzentration von H+-Ionen > vollständig dissoziierte Säuren schmecken saurer als äquimolare Lösungen schwach dissoziierter Säuren > Ausnahme: z.B. stark sauer schmeckende Essigsäure – Hinweis auf zusätzliche Mechanismen > durch die Reaktion von H+-Ionen mit Proteinen eines K+-selektiven Membrankanals wird der Ausstrom von K+-Ionen blockiert und dadurch bildet sich ein depolarisierendes Sensorpotential - Salzgeschmack > wird durch wasserlösliche Salze hervorgerufen, die in Lösungen in Kationen und Anionen dissoziieren > z.B. in Na+ und Cl- bei Kochsalz > Grad der Salzigkeit lässt sich in einer Rangordnung für Kat- und Anionen beschreiben: Kationen: NH4+ > K+ > Ca2+ > Na+ > Li+ > Mg2+ Anionen: SO42- > Cl- > Br- > I- > HCO3- > NO3> das depolarisierende Sensorpotential entsteht bei Zunahme der extrazellulären Kationenkonzentration durch verstärkten Einstrom von Kationen durch einen spannungsunabhängigen selektiven Ionenkanal, der durch das nicht permeable Kation Amilorid blockiert werden kann. Anionen wirken dagegen nicht direkt auf die Sinneszellen; sie werden mit Hilfe spezifischer Transportmechanismen in die Stützzellen eingeschleust und führen dort Depolarisation, die über Gap junctions die Sinneszellen aktiviert - Bittergeschmack > durch Vielzahl von Stoffen hervorgerufen mit unterschiedlichen molekularen Strukturen > gemeinsam ist diesen Molekülen eine polare Gruppe die in definiertem Abstand mit einer hydrophoben Gruppe kombiniert ist > vorallem pflanzliche Bitterstoffe (Alkaloide, Chinin oder Strychnin) haben häufig eine hohe Toxizität > sinnvollerweise Bittergeschmack deswegen besonders empfindlich > bei den meisten Lebewesen besteht daher eine genetisch fixierte Aversion gegen bitter schmeckende Substanzen 77 - - - - - - - - > Im Transduktionsprozess wird nach Interaktion des Bitterstoffs mit spezifischen Rezeptorproteinen durch Aktivierung der intrazellulären IP3-Signalkaskade dir intrazelluläre Ca2+-Konzentration erhöht und die Transmitterfreisetzung ausgelöst Süßgeschmack > überwiegend durch organische Substanzen (Zucker, Alkohole, Glykole, Aminosäuren mit neutralem pH) hervorgerufen > die meisten Lebewesen reagieren auf süße Nahrungsmittel positiv, da sie das signalisieren das Kohlenhydrate und Proteine, also wichtige Nährstoffe, vorhanden sind > Moleküle süßlicher Substanzen sind unterschiedlich konfiguriert > alle süßen Stoffe scheinen an einem einzigen Typ von Rezeptormolekül zu binden, jedoch mit unterschiedlicher Affinität > Rezeptormolekül aktiviert über ein G-Protein die Adenylatcyclase (AC) und erhöht damit die intrazelluläre Konzentration von cAMP, das den K+-Ausstrom an selektiven Ionenkanälen vermindert und dadurch zu einem depolarisierten Sensorpotential führt > Der Transduktionsprozess wird entweder durch direkte Wirkung auf selektive Ionenkanäle vermindert oder durch intrazelluläre Botenstoffe ausgelöst prinzipiell kann jede Geschmacksinneszelle verschiedene Rezeptorproteine besitzen und daher ohne eine bevorzugte Empfindlichkeit auf eine Vielzahl von Reizstoffen reagieren, die mehreren und allen vier Geschmacksqualitäten angehören können auch thermische oder mechanische Reize können die Geschmackssinneszellen aktivieren ein spezifisches Geschmacksprofil findet sich erst in den Geschmacksneuronen, die nicht nur mehrere Sinneszellen synaptisch innervieren sondern auch zu verschiedenen Geschmacksknospen ziehen > Geschmacksprofil: für jede afferente Faser spezifische Rangfolge der Empfindlichkeit für die vier Grundqualitäten - so kann z.B. eine Faser am stärksten auf süß reagieren, weniger stark auf sauer oder salzig und am geringsten aus bitter - Reizintensität und Geschmackseindruck ergeben sich erst aus der gemeinsamen Verarbeitung der Information vieler afferenter Nervenfasern afferente Nervenfasern verlaufen im: N. facialis VII., N. glossopharyngeus IX., N. vagus X. Einige Geschmacksnerven verlaufen auch im N. trigeminus V., der aber überwiegend thermo- und mechanosensible Axone aus der Zunge enthält alle Geschmacksfasern ziehen ziehen gemeinsam im Tractus solitarius zum Nucleus tractus solitarii in die Medulla oblongata > von dort aus wird ein Teil der Geschmacksinformation zusammen mit anderen Modalitäten (Schmerz, Temperatur) über den kontralateralen Thalamus zum Gyrus postcentralis geleitet > andere Axone ziehen zu verschiedenen Kernen des Hirnstammes die an Verdauungsreflexe aller Art beteiligt sind: Speichelfluss, Magensaftsekretion, Schlucken, Würgen, Kauen, Mimik die emotionale Komponente des Geschmackssinnes wird über Verbindungen zum Hypothalamus und zum Limbischen System vermittelt die Empfindungsqualitäten eines Stoffes sind nicht nur von seiner Konzentration und der rezeptiven Reizschwelle, sondern auch von Adaptionsvorgängen abhängig. Sie sind beim Geschmackssinn stark ausgeprägt, können nach wenigen Sekunden beginnen und (z.B. bei Bittersoffen) Stunden anhalten Adaption wird durch die Spüldrüsen unterstützt nach längerer Einwirkung einer Lösung mit Geschmacksstoffen wird Wasser schmackhaft > Säureadaption: süß > Kochsalzlösung: bitter oder sauer Adaption erfolgt sowohl zwischen Stoffen mit der gleichen Grundqualität als auch zwischen Substanzen mit unterschiedlicher Geschmacksqualität 57. Geruchssinn - Geruchszellen in das Riechepithel der Nase eingebettet: primäre Sinneszellen - Auf deren apikaler Oberfläche befinden sich Cilien in einer dünnen Schleimschicht (Mucus), die in die Richtung des Luftraums der Nasenhöhle reichen 78 - Riechepithel bekleidet nur einen geringen Teil der Oberfläche, die anderen Flächen werden zum Anfeuchten und Aufwärmen der Atemluft benutzt - Die über die Atemluft in die Nasenhöhle gelangten Duftstoffe lösen sich in der Schleimschicht, die spezielle Bindungsproteine enthält - Dann gelangen die gelösten Duftstoffe in ontakt mit der Cilienmembran, in der sich viele tausend spezialisierte Duftstoffrezeptoren befinden - Bei Bindung zwischen Duftmolekül und zugehörigem Rezeptor wird Transduktionsprozess eingeleitet, der über die Aktivierung von G-Proteinen und die Synthese von cAMP abläuft, welches dann die Öffnung unspezifischer Kationenkanäle verursacht, so dass dich durch einen Ca2+-Einstrom Cl--Kanäle öffnen - Erst durch einen Cl--Ausstrom kommt es zur Depolarisation der Rezeptorzelle und infolge dieses Rezeptorpotenzials zu einer Serie von Aktionspotenzialen, welche über die langen Axone der Riechepithelzellen direkt zum Riechkolben (Bulbus olfactorius) im Gehirn geleitet - Riechzellen sind epithelialer Natur und haben begrenzte Lebensdauer und werden nach einigen Wochen durch neue Zellen ersetzt - Tiere mit starkem Geruchsvermögen: Makrosmaten > Nagetiere, Huftiere, Raubtiere > stark vergrößerres Riechepithel von fast 100 cm2 beim Hund - Tiere mit geringem Geruchsvermögen: Mikrosmaten > Mensch > wenig Riechsinneszellen und geringe Epithelfläche - Tiere bei denen kein Riechvermögen ausgebildet ist: Anosmaten - Pheromone aus dem Urin oder aus Präputial- und Analdrüsen > Eber: Androstenol (auch beim Mensch im Achselschweiß) > bei Fischen auch Alarm- und Schreckstoffe 58. Energieumsatz - energetische Umsatzrate ist eine variable Größe, steht unter Einfluss vieler Faktoren: > in erster Linie durch die Körpergröße bestimmt > auch durch Alter und Geschlecht > durch Umgebungstemperatur, Beleuchtung /Tageszeit und Jahreszeit > durch Ernährungs- und Funktionszustand des Organismus - Umsatzrate ist erhöht bei Nahrungsaufnahme, körperlicher Aktivität sowie bei Leistung (Wachstum, Milchproduktion, Trächtigkeit) - im postresorptiven Zustand, bei metabolisch indifferenter Umgebungstemperatur und körperlicher Ruhe gemessene Grundumsatz eines Individuums entspricht dem zur Aufrechterhaltung des Lebens minimal notwendigen Energieumsatz für Kreislauf, Atmung, Muskeltonus, Drüsentätigkeit, Zellteilung, u.a. - Beteiligung der einzelnen Gewebe am Grundumsatz ist entsprechend ihrem unterschiedlichen O2-Verbrauch und ihrem unterschiedlichen Anteil an der Gesamtkörpermasse verschieden (Niere 7%, Leber 12%) - Tier befindet sich im energetischen Erhaltungsumsatz, wenn es weder zu- noch abnimmt (Energiezufuhr=Energiehaltungsbedarf) - Energieumsatzrate bei körperlicher Arbeit oder Produktion= Leistungsumsatz - Bestimmung des postresorptiven Zustands wird bei Tieren nach unterschiedlich langer Futterkarenz erreicht (notwendige Hungerzeit hängt von der Futterpassagezeit ab; bei Wiederkäuern deutlich später und schwerer zu messen) - um Einflusses der Umgebungstemperatur auf Energieumsatzrate gleichzuhalten wird der Grundumsatz bei metabolisch indifferenter Umgebungstemperatur gemessen (hier ist die Energieumsatzrate eines homoiothermen Tieres am niedrigsten, da hier keine zusätzliche Wärme zur Aufrechterhaltung der Körpertemperatur produziert werden muss und die im körper gebildete Wärme so abgegeben werden kann) - körperliche Ruhe zeigen Tiere nur selten; deswegen müssen alle Körperbewegungen mit erfasst werden, damit die energetische Umsatzrate auf den Zustand der körperlichen Ruhe korrigiert werden kann - pro kg Körpermasse haben große Tiere eine niedrigere Energieumsatzrate als kleine Tiere (Grundumsatzrate von kleinen Tieren ist zwar absolut niedriger, relativ (pro kg Körpermasse) jedoch höher 79 - die Körperoberfläche von Tieren wächst mit zunehmender Größe unterproportional an => kleine Tiere haben deshalb pro kg Körpermasse eine größere Körperoberfläche und damit einen höheren Wärmeverlust an die Umgebung als große Tiere - aufgrund des unterproportionalen Zusammenhanges von wärmeabgebender Körpermasse können homoiotherme Tiere nicht beliebig klein werden, da wegen der dann zu großen relativen Körperoberfläche ihre Wärmeverluste an die Umgebung zu hoch wären; sie können aber auch nicht zu groß werden, da dann über ihre zu kleine relative Körperoberfläche zu wenig Wärme abgeführt würde - höhere relative Umsatzrate bei kleinen Tieren resultiert zusätzlich auch aus ihrem größeren Anteil stoffwechselintensiver Organe an der Gesamtkörpermasse - Grundumsatzrate von Säugetieren ist mit guter Näherung der ¾-Potenz ihrer Körpermasse proportional und beträgt pro kg ¾ etwa 283 kJ/Tag 59. Thermoregulation - Homoiothermie: > endotherme Tiere > gewinnen ihre Körperwärme vor allem aus ihrem Stoffwechsel (tachymetabolisch) > Körpertemperatur schwankt nicht mit der Umgebungstemperatur > Bsp. Vögel, Säugetiere > gleichwarm, warmblütig - Poikilothermie: > ektotherme Tiere > beziehen ihre Körperwärme aus der Umgebung durch Absorption und kaum aus dem eigenen Stoffwechsel (bradymetabolisch) > Bsp. Insekten, Fische, Amphibien, Reptilien > wechselwam, kaltblütig - Körperkern und Körperschale > Temperaturfelder des Körpers Körperkern: Gehirn, Inneres des Rumpfes mit den stoffwechselintensiven Organen (70 % der Wärmeproduktion). Körperschale: nähert sich schichtenweise der Außentemperatur. Wärme > äußere Schicht dünn, Kerngebiet groß – möglichst viel Abgabe der Wärme Kälte > Körperschale wird größer, da die Durchblutung der peripheren Gewebeschicht abnimmt - Ist-wert: der wirkliche, aktuelle Wert, der von verschiedenen Temperaturfühlern erfasst wird Soll-Wert: vom Hypothalamus festgelegt und tierartlich unterschiedlich zwischen 36 °C und 42 °C Regler der Temperaturregulation liegt im Hypothalamus und alle Temperatursignale werden dort hingeleitet > efferente Bahnen haben dort Ursprung und führen zu den Stellgliedern. Kerntemperatur-Messfühler: hoch konzentriert bei Säugern und Vögeln im Rückenmark und im Hypothalamus. Aktivität steigt bei Erwärmung an, da sie wie die Wärmerezeptoren der Haut arbeiten. Hauttemperatur-Messfühler: in der Haut verteilt und überwiegend Kälterezeptoren - Möglichkeiten der Wärmeabgabe körperliche Arbeit: Kerntemperatur steigt, Hauttemperatur sinkt aufgrund der Transpiration > innerer Wärmestrom: - Konduktion: Wärmeleitung im Gewebe vom Kern zur Schale - Konvektion: Wärmetransport übers Blut vom Kern zur Schale > äußerer Wärmestrom: - Konduktion: Wärmeabgabe direkt an eine leitende Unterlage - Radiation: direkte Wärmeabstrahlung - Konvektion: Abgabe über die Luft - Evaporation: Wärmeabgabe durch Transpiration und respiratorische Verdunstung - Veränderung der Hauttemperatur Abhängig von der Umgebungstemperatur, der Durchblutung und der Wärmeleitfähigkeit des Gewebes und davon, ob Arbeit geleistet wird - Gegenstromprinzip In den Extremitäten zur besseren Wärmeverteilung durch das venöse System. 80 - - - - Vorteile: Bei Kälte geht nicht soviel Wärme über das Blut verloren und bei Hitze kann überschüssige Wärme an die Umgebung abgegeben werden Möglichkeiten der Wärmebildung > willkürliche Bewegungen des Muskelapparates (Muskelkontraktionen) > unwillkürliche Aktivität der Muskeln (Kältezittern) > Steigerung von Stoffwechselvorgängen > zitterfreie Thermogenese im braunen Fettgewebe (kleine Nager) Thermoregulatorische Verhaltensweisen > Zusammenrollen > mit mehreren zusammenlegen > Aufsuchen warmer / kalter Plätze > Aufplustern des Gefieders / Aufstellen des Fells zur besseren Isolation > Sonne meiden bei zu großer Wärme Hitzeadaption: > Transpirationsrate wird erhöht bei verringertem Gehalt an Elektrolyten > Schweißproduktion nimmt auf Dauer ab um den Wasserhaushalt zu entlasten > größerer Durst, Abnahme der Leistung (z.B. Milchleistung= > Toleranzadaption: höhere Temperaturen werden als normal empfunden > Fellwechsel Kälteadaption: > Pelzwachstum (Isolation), besonderes Fell (Eisbären) > vermehrte zitterfreie Thermogenese > isolierende Körperschale (mehr Futter = mehr Fett) > Toleranzadaption: tiefere Temperaturen werden als normal empfunden > Schilddrüse produziert vermehrt T3 und T4 zur Erhöhung des Grundumsatzes > Depotfett wird mobilisiert 60. Wärmebildungsmechanismen (braunes Fettgewebe) - Wärmebildung eines homoiothermen Organismen erfolgt in den vom Körperkern vorhandenen, stoffwechselaktiven Organen, z.B. in der Leber und im Fettgewebe - je nach Aktivitätszustand des Körpers weitet sich die funktionelle Zone des Körperkerns erheblich aus und umfasst auch die Muskulatur der Extremitäten - Körperwärme durch zwei unterschiedliche Mechanismen gebildet: > die zitterfreie Thermogenese des Stoffwechsels > Kältezittern der Muskulatur - Zitterfreie Thermogenese: > findet vorwiegend im braunen Fettgewebe statt > dieses spezielle Gewebe befindet sich in mehreren Regionen des Cervicothorakalbereichs, vorwiegend im Rücken zwischen den Schulterblättern, aber auch am Hals, in der Nierenregion und im Mediastinum > braunes Fettgewebe wirkt (im Gegensatz zu dem weißlichen Depotfettgewebe) durch die hohe Anzahl von Mitochondrien und seiner stärkeren Vaskularisierung bräunlich. > in der inneren Membran der Mitochondrien des braunen Fettgewebes findet sich ein spezielles Entkopplungsprotein (UCPI) das die Atmungskette von der ATP-Produktion entkoppelt. > normalerweise wird in Mitochondrien durch einen Protonentransport über die innere Membran in den Intermediärraum ein Protonengradient geschaffen, der den in der inneren Membran gelegenen ATP-Synthease-Komplex zur Synthese von ATP antreibt. > durch die Aktivierung des Entkopplungsproteins, das als Protonenkanal wirkt, wird dieser treibende Protonengradient zerstört, sodass die aus der Atmungskette angelieferte Oxidationsenergie nicht in ATP umgesetzt, sonder vollständig als Wärme freigesetzt wird. > die Temperatur des braunen Fettgewebes kann so auf bis zu 46 °C ansteigen. Diese lokale Wärmebildung kann durch die gute Durchblutung des braunen Fettgewebes schnell in den übrigen Körper abgeführt werden. > die Aktivierung des normalerweise inaktiven Entkopplungsproteins geschieht über das sympathische Nervensystem in sekundenschnelle und kann unter Normaltemperaturen 81 auch durch eine Infusion von Noradrenalin ausgelöst werden. > das braune Fettgewebe ist bei Neugeborenen oder bei kälteakklimatisierten Tieren besonders gut ausgebildet. Sie macht bei Kleinsäugern den größten Teil der Wärmebildung. > bei erwachsenen Menschen, großen Haus- und Nutztieren und bei Vögeln ist es nicht ausgebildet. > Vögel kompensieren das fehlende braune Fettgewebe durch die mitochondrienreiche Flugmuskulatur und die gute Isolierung des Federkleids - Muskeltonus und Kältezittern: > in einer thermoneutralen Umgebung liefert der Grundumsatz des Stoffwechsels genügend Wärme, um die Körpertemperatur eines homoiothermen Tieres konstant zu halten > diese obligate Wärmebildung kann allerdings nicht wesentlich gesteigert werden, weshalb bei Kälte zusätzliche Wärmebildungsmechanismen aktiviert werden: - Erhöhung des Muskeltonus und Kältezittern > bei kalter Umgebungstemperatur nimmt deshalb bei den größeren Säugetieren die Impulsfrequenz der motorischen Neurone zu, wobei durch eine Änderung der neuronalen Verschaltung Beuger und Strecker gleichzeitig aktiviert werden, dadurch kommt es zunächst zu einer nicht sichtbaren Erhöhung des Muskeltonus. > Erst bei größerer Kälte wird die motorische Aktivität deutlich gesteigert, was zu einem deutlich sichtbaren Kältezittern führt. > das Kältezittern beginnt typischerweise in der Kaumuskulatur und erstreckt sich dann über den Schulterbereich und die Vorderextremitäten auf die Muskulatur der Hinterextremitäten. > werden die motorischen Bahnen für Willkürbewegungen benötigt, wird das Kältezittern unterbrochen, stellt sich anschließend aber wieder ein. > die Frequenz des Kältezittern ist von der Körpergröße abhängig. Kleinere Tiere zittern schneller als große. Kleinere Tiere können das Kältezittern als zusätzlichen Mechanismus zur Wärmebildung einsetzen, während es für größere Tiere die wesentliche Möglichkeit der Wärmebildung durch Stoffwechselleistung darstellt. Diese Wärmebildung findet jedoch in der peripheren Muskulatur statt und dadurch geht gleichzeitig durch Durchblutungssteigerung ein Teil der gebildeten Wärme über die Körperoberfläche an die Umgebung verloren 61. Hormone für Wachstum pränatal: - pränatales Wachstum erfolgt in erster Linie mitogen (durch mitotische Teilung) - vermutlich kontrollieren lokal aktive Wachstumsfaktoren das pränatale Wachstum - die somatotrope Achse ist noch kaum aktiv, obwohl das Wachstumshormon Somatotrophes Hormon (STH) in sehr hoher Konzentration vorkommt - eindeutig wachstums- und entwicklungsfördernd ist das Insulin - Insulin wird als das eigentliche anabole Hormon in der pränatalen Phasen angesehen und entfaltet seine Wirkung auf unterschiedliche Art und Weise auch von den Schilddrüsenhormonen geht ein positiver Effekt auf die fetale Entwicklung aus - besonders ausgeprägt ist der Einfluss auf die Reifung des peripheren und zentralen NS, sowie auf die Knochenentwicklung - Schilddrüsenhormone wirken besonders fördernd bei Amphibien und Vogelembryonen - STH ist kein effektives pränatales Wachstumsstimulanz postnatal: - normales Wachstum erfordert eine hormonale Regulation - hier steht im Gegensatz zur pränatalen Phase das STH im Vordergrund - Konzentration ist während der Pubertät stark erhöht; Ausfall führt zum Wachstumsstillstand - Insulin und Schilddrüsenhormone sind auch postnatal wichtige Wachstumsstimulatoren 82 - deutlicher als pränatal greifen Geschlechtshormone ins postnatale Wachstum ein (männliche Individuen wachsen schneller als weibliche) - Glucocorticoide und Catecholamine zeigen ebenfalls einen anabolen Effekt - STH ist hier ein effektives Wachstumsregulanz!!! 62. Schilddrüsenhormone - Hormone sind Triiodthyronin (T3) und Thyroxin (Tetraiodthyronin, T4) und werden in den Follikelepithelzellen der Schilddrüse gebildet - spielen wichtige Rolle für den Energiestoffwechsel und das Wachstum einzelner Zellen und den Gesamtorganismus => zwingend lebensnotwendig - Calcitonin wird von den C-Zellen gebildet und nicht als Schilddrüsenhormon bezeichnet - T3 und T4 sind nicht-proteinogene alpha-Aminosäuren und bestehen aus der AS Thyronin, die an ihren aromatischen Ringen im Falle von T3 an drei Positionen und von T4 an vier Positionen iodiert sind (Unterscheiden sich also nur an der Anzahl der gebundenen Iodatome) - für die Synthese der Schilddrüsenhormone wird Iod über die Nahrung aufgenommen (Schilddrüse ist darauf angewiesen) - Iodid-Ionen werden übers Blut zu den Follikelepithelzellen (Thyreozyten) der Schilddrüse transportiert und über den Natrium-Iodid-Symporter aufgenommen - Aktivität des Natrium-Iodid-Symporters wird durch das in der Hypophyse gebildete Thyreotropin (TSH) reguliert. TSH steigert die Aufnahme von Iod in die Thyreozyten - Schilddrüse setzt etwa 90-95% T4 und nur eine geringe Menge T3 frei; 80% befinden sich in der Blutbahn und Leber - Thyroxinausschüttung verstärtkt, wenn Thyroxinspiegel im Blutplasma zu stark absinkt und umgekehrt (Aufrechterhaltung des Schilddrüsenhormonspiegels wird dadurch geregelt) - Hypothalamus schüttet TRH (Thyreotropin-Releasinghormon) aus, dass die Hypophyse zur TSH-Ausschüttung anregt - TSH bewirkt verstärkte T3 und T4 –Bildung - Schilddrüsenhormone gelangen über die Blutbahn in die Zielzellen und könnten auch in den Bereich von Hypothalamus und Hypophyse gelangen, die mit speziellen Rezeptoren den T3 und T4 Blutspiegel wahrnehmen - mit wachsendem T3 und T4 –Spiegel wird die Bildung von TRH und TSH zunehmend gehemmt (negatives Feedback bwz. negative Rückkopplung) 83 - Produktion und Ausschüttung des TSH hängt zudem vom TRH-Spiegel ab - Hypothalamus gibt den Sollwert an und misst ständig den Istwert - um den Istwert an den Sollwert anzupassen kann der Hypothalamus die Produktionsmenge an TSH und Schiddrüsenhormonen beeinflussen - Schilddrüsenhormone sind nicht wasserlöslich und liegen im zirkulierenden Blut größtenteils an drei Proteine gebunden vor (TBG= Thyroxinbindendes Globulin, Thyroxinbindendes Präalbumin und Albumin) - kleinerer, aber biologisch aktive Teil zirkuliert frei im Blut (freies T3 und T4) - Schilddrüsenhormone dienen der Aufrechterhaltung einer ausgeglichenen Energiebilanz des Organismus; ermöglichen dass der Stoffwechsel dem jeweiligen Bedarf angepasst werden kann (im Kindesalter regen sie die Tätigkeit der Körperzellen aller Organe an und fördern hier das Wachstum) - beim Erwachsenen steigern sie in allen Geweben, außer dem des Gehirns, der Hoden und der Milz, den Stoffwechsel - fördern die Abgabe des Wachstumshormon STH, greifen in den Glukosestoffwechsel ein und regen die Tätigkeit der Nebenniere an; Wechselwirkung mit Sexualhormonen bekannt - Metamorphose von der Kaulquappe zum Frosch wird durch Thyroxin ausgelöst (zieht man Kaulquappen in iodfreiem Wasser aus, entsteht kein Frosch, sondern eine übermäßig große Kaulquappe) - Hunde leiden häufig unter Schilddrüsenunterfunktion (es besteht ein enger Zusammenhang zu aggressivem Verhalten) 63. Immunglobuline - werden als Reaktion auf Antigene gebildet und stehen im Dienste des Immunsystems - spezifische Bindung von Antikörpern an Antigene bildet einen wesentlichen Teil der Abwehr gegen die eingedrungenen Fremdstoffe - bei Krankheitserregern kann die Bildung von Antikörpern zur Immunität führen - werden von Leukozyten sezerniert, kommen im Glut und in der extrazellulären Flüssigkeit der Gewebe vor - Antikörper binden analog dem Schlüssel-Schloss-Prinzip (sehr spezifisch) - sezernierte Antikörper wirken durch verschiedene Mechanismen: z.B. Neutralisation von Antigenen (Antikörper bindet Antigen und blockiert dessen toxische Wirkung); Einhüllen von Krankeheitserregern - dadurch dass Antikörper zwei Antigen-Bindungsstellen haben kann es zur Agglutination kommen - IgA wird auf allen Schleimhäuten der Atemwege, Augen, des Magen-Darm-Trakts, des Urogeniatltrakts sowie über spezielle Drüsen rund um die Brustwarze sezerniert und schützt vor Pathogenen - IgD ist nur in geringen Mengen in sezernierter Form in Blut und Lympfe vorhanden - IgE vermittelt Schutz vor Parasiten - IgM ist die erste Klasse von Antikörpern, die bei Erst-Kontakt mit Antigenen gebildet wird und zeigt die akute Infektionsphase einer Krankheit an, z.B. anti-Masern-IgM gegen das Masernvirus - IgG wird erst in einer verzögerten Abwehrphase (3 Wochen gebildet) und bleibt lange erhalten; Nachweis zeigt eine durchgemachte Infektion oder Impfung an - IgY ist bei den Hühnern das Äquivalent zu IgG und in hoher Konzentration in Hühnereiern zu finden - IgW kommt bei Fischen vor - bildet der Körper gegen eigene Körperbestandteile Antikörper (sog. Autoantikörper), spricht man von einer Autoimmunkrankheit - aus Tieren gewonnene Antikörper (Antiseren) werden als Therapeutikum für verschiedenste Zwecke eingesetzt (z.B. als passiver Impfstoff) 64. Gravidität und Geburt Gravidität – Schwangerschaft 84 - Zeitspanne von Konzeption (Empfängnis) bis zur Geburt Spezies PFERD RIND SCHAF, ZIEGE SCHWEIN HUND KATZE MENSCH Durchschnittliche Graviditätsdauer in Tagen 336 (323 – 350) 280 (270 – 295) 150 (144 – 157) 114 (110 – 118) 63 (60 – 66) 63 (56 – 71) 266 (256 – 276) - Schwein, Schaf, Rind, Ziege: zwischen 16. und 18. Tag nach der Ovulation nimmt Embryo durch Anlagerung an das Endometrium zellulären Kontakt zur maternalen Umwelt auf > bei der Stute bis zum 35. Tag nach der Ovulation (Post ovulationem [p.ov.]) - Uterines Signale zur Luteolyse etwa 14. – 16. Tag nach der Ovulation, also immer vor der ersten physischen Kontaktaufnahme zwischen Embryo und Endometrium - (überlebens-)wichtigste Aufgabe des Embryos also zunächst die Verhinderung der Luteolyse, also Aufrechterhaltung der Gelbkörpers - Funktionsabläufe zum Einführen der Geburt 1. Embryo produziert Signal 2. Signal wird zum mütterlichen Organismus transportiert 3. Mütterlicher Organismus empfängt und erkennt Signal 4. Mütterlicher Organismus produziert Antwortsignal 5. Hypophyse und/oder Ovar reagieren mit der Umstellung von nicht gravid auf gravid Signale des Embryos - Schaf > Trophoblast sezerniert ab 12. Tag p.ov. ein Protein: ovines Trophoblastin (oTP) - bis zum 25. Tag nachweisbar > hat ausgeprägtes antiluteolytische Eigenschaften durch Hemmung der Oxytocinsynthese in den großen Luteinzellen > Primärstruktur des oTP weist hohen Homologiegrad mit alpha-Interferon (Glykoprotein, das infolge der Immunantwort sowie unter Einfluss zahlreicher antigener oder mitogener Stimuli gebildet werden) auf > verfügt auch über antivirale Eigenschaften > aufgrund seiner ausgeprägt antiluteolytischen Aktivitäten wird es als Interferon tau bezeichnet > oTP kann als embryonales Interferon bertrachtet werden, das in Abwesenheit von viralen Infektionen der Gebärmutter natürlicherweise in Trophoblasten exprimiert wird, weswegen es von anderen Interferonen unterschieden wird > bei Kontaktaufnahme zwischen Trophoblasten und Karunkelepithel erlischt oTP-Synthese - Rind und Ziege > ebenfalls Trophoblastproteine (bTP und cTP) > mit den selben antiluteolytischen Eigentschaften > Blockierung der Prostaglandinsynthese - Schwein > keine Blockierung der Prostaglandinsynthese sondern eine Reorientierung der endometrialen Prostaglandinsekretion > Tag 10 – 12 beginnt Schweineembryo Östrogen zu sezernieren, welches lokal wirkt und zum Austritt des endometrialen PGF2alpha aus den Uterusvenen führt > dieses geht in den arteriellen Schenkel des Gefäßsystems über und gelangt so in das Uteruslumen, ohne das Ovar in ausreichernder Konzentration erreichen zu können > aus einem endokrinen (Endometrium > Uterusvene > Ovararterie > Corpus luteum) wird 85 ein exokriner (Endometrium > Uterusvene > Ovararterie > Uteruslumen) Sekretionsmodus und die zyklische Luteolyse bleibt aus - Carnivoren (Hund und Katze) > wahrscheinlich kein frühes embryonales Signal, will die Lebensspannen des zyklischen und des Graviditätsgelbkörpers identisch sind > im Anschluss an die Ovulation entwickelt sich bei ausgebliebender oder steriler Paarung stets eine Pseudogravidität (Scheinschwangerschaft) > Funktion des Corpus luteum wird dabei rein maternal über hypophysäres LH (luteinisierendes Hormon) und Prolactin geregelt > Sonderfall Katze: ihre Gelbkörper während der Pseudogravidität nur eta 35 Tage funktionell intakt. Im Falle der Gravidität übernimmt die Placenta bis zum 64. Tag die Progesteronproduktion - Equiden > frühembryonales Signal notwendig, da sich die Lebensspanne des Corpus luteum bei der Stute nur dann verlängert, wenn der Embryo mindestens bis zum 15. Tag o.pv. in der Gebärmutter verbleibt > Embryo blockiert über seine Sekrete die uterine PGF2alpha-Synthese und –sekretion und bewahrt so den Gelbkörper vor dem Untergang Maternaler Hormone während Gravidität - Endokrine Übermittlung - Zunächst übernimmt Corpus luteum des Muttertieres Bereitstellung der essentiellen Hormone (Progesteron, bei einigen Tieren auch Östrogen) - Nachfolgend können sowohl der Fetus als auch die Placenta durch die Synthese spezifischer hormonaler Produkte zur Aufrechterhaltung der Gravidität beitragen - Feto-placentare Einheit: gegenseitige Abhängigkeit in Bereitstellung von Steroidhormonen > beteiligt: Fetus, Placenta, mütterlicher Organismus Mensch > Progesteronsynthese nach der 7. Woche der Gravidität von der Placenta übernommen, während Corpus luteum graviditatis abgebaut wird > Placenta ist auf Cholesterin aus dem maternalen Organismus angewiesen (nicht selbst in der Lage Cholesterin aus Acetat aufzubauen) > Fetus trägt nicht zur Progesteronsynthese bei (keine Enzymausstattung zur Synthese) > ab 10. Woche Progesteronsynthese durch plazento-maternale Kooperation > Östrogen spielt während der Gravidität Hauptrolle bei endokriner Regulation der Implantation, Entwicklung Milchdrüse, Geburt und Entsetzen Laktation > synthetisiert aus Androgenen, der Placenta fehlt jedoch Enzymsystem dazu und benötigt dazu Androgene aus den anderen beiden Komponenten - in der frühen Gravidität Nutzung der Androgene aus dem mütterlichen Blutstrom - zur Bedarfsdeckung ab 20. Woche fast vollständige Bereitstellung aus fetalem Kompartiment > wichtigste Östrogenvorstufe: Dehydroepiandrosteron (DHEA), produziert in der fetalen Nebenniere, wird anschließend sulfatiert zu Dehydroepiandrosteron-Sulfat (DHEA-S) > Placenta spaltet Sulfatrest ab, bildet aus DHEA Androstendion und Testosteron, die sie anschließend zu Östrogen aromatisiert Pferd > ähnliche Kompartimentierung der Steroidhormonsynthese > Placenta der Stute produziert ab 50. Tag große Mengen Progesteron > Vorstufen werden aus maternalem Kompartiment bereit gestellt > Fetus nicht beteiligt > ab 80. Tag hypertrophieren fetale Gonaden und synthetisieren DHEA-S, das direkt nach Sulfatierung in die Placenta transportiert und zu Östrogen aromatisiert wird > hypertrophierte Gonaden bilden sich gegen Ende der Trächtigkeit zurück womit der DHEA-S- und somit der Östrogenspiegel wieder abnimmt > Choriongonadotropine: Pferdetrophoblast synthetisiert ab 35. – 120. / 150. Tag Gonadotropin: equines Choriongonadotropin (eCG) - dient im Gegensatz zum humanen Choriongonadotropin (hCG) nicht Aufrechterhaltung 86 des Gelbkörpers während der Frühgravidität, denn Sekretion beginnt erst ab dem 38. Tag, nachdem die Regression (Rückgang) des Corpus luteum verhindert worden ist - eCG spielt viemehr bedeutende Rolle bei der Immunregulation während der Implantation (Tag 35 Stute) und bei Ausbildung akzessorischer Gelbkörper - Rind, Schwein, Ziege und Hund: > nach Ovariektomie im ersten oder zweiten Schwangerschaftsdrittel kommt es zum Abort. Appliziert man jedoch nach der Operation Progesteron bleibt die Gravidität erhalten. Die > Progesteronproduktion erfolgt bei diesen Tieren also bis zur Geburt vom Trächtigkeitsgelbkörper - Pferd, Katze, Schaf > sind in der Lage nach Ovariektomie die Gravidität aufrecht zu erhalten, da hier die Placenta während der fortgeschrittenen Gravidität ausreichend Progesteron synthetisiert > Pferd ab Tag 70 / Katze ab Tag 50 / Schaf ab Tag 55 Placentastoffwechsel - Vier wichtige Funktionen während Gravidität > Transport notwendiger Aufbaustoffe von Muttertier zu Fetus Aufnahme von Ausscheidungsstoffen des Fetus (Austauschfunktion) - einfache Diffusion: Gase und H2O - erleichterte Diffusion: Glukose und Aminosäuren mit Hilfe von Carrier-Molekülen - aktiver Transport: Natrium-, Kalium- und Calciumionen über spezifische Ionenpumpen > Synthese und Sekretion von Enzymen und Hormonen > Thermoregulation - Glukose ist einer der wichtigsten Energielieferanten während der Gravidität und bei Mehrlingsgraviditäten kann es beim Schaf zu Glukoseverarmung und Ketonkörperbildung (Ketose) beim Muttertier führen - Proteine und Lipide können die Placenta nicht passieren >> Ausnahme: Immunglobuline gelangen auf die fetale Seite und statten die Frucht mit wichtigen Antikörpern aus > Mensch und Maus: hämochorialer Typ > Hund und Katze: endotheliochorialer Typ > Ansonsten Aufnahme über das Kolostrum! - Lipide und Phospholipide werden von der Placenta enzymatisch gespalten und die niedermolekularen Produkte dem fetalen Organismus zur Eigentsynthese bereit gestellt - Spurenelemente und wasserlösliche Vitamine durchqueren Placenta und gelangen so leicht vom Muttertier zum Fetus - Relativ große Peptidhormone (TSH, ACTH, Insulin) können Placenta nicht passieren, dagegen treten Hormone mit geringer Molekülgröße (Steroidhormone, Catecholamine) ungehindert durch die Placenta Geburt (Partus) Vorbereitung Myometriumzelle auf Geburt - Bedeutendste hormonelle Veränderung bei Geburt: Wechsel des Progesteron-ÖstrogenVerhältnis - Gegen Ende der Gravidität sinkt der Progesteronspiegel im Blut bei den meisten Tieren ab, wobei gleichzeitig die relative Östrogenkonzentration zunimmt - Progesteron bewirkt während der Gravidität eine Ruhigstellung der Uterusmuskulatur (Progesteronblock) zur ungestörten Entwicklung der Frucht > dazu wird die elektrische Leitfähigkeit der Myometriumzellmembranherabgesetzt und die Fortleitung eines Reizes weitgehend blockiert - Nach Auflösung des Progesteronblocks ist die Antwortbereitschaft des Myometriums auf die kontraktile Stimulation wieder hergestellt - Der zunehmende Einfluss von Östrogen gegen Ende der Gravidität induziert die Synthese von Proteinen (Actomyosin), welche bei der Kontraktion wesentliche Bedeutung hat - Auch die Anzahl der Calciumkanäle in der Membran der Uterusmuskelzelle steigt um 60 % rapide an 87 - Elektrische und metabolische Kopplung der Myometriumzellen durch Gap junctions, welche die Fortleitung und Synchronisation der Kontraktionswellen im Uterus sicherstellen - Während der Gravidität ist die Zahl der Gap junctions im Myometirum nur gering und nimmt abhängig von der Östrogenkonzentration stark zu – so präpariert sie den Uterus auf Wehentätigkeit Endokrine Steuerung - Schaf: etwa 10 Tage vor der Geburt beginnen endokrine Veränderungen - zunächst im Fetus Anstieg der Cortisolsekretion aus der Nebennierenrinde (vermutlich erhöhte ACTH-Sekretion des fetalen Hypothalamus ursächlich beteiligt) - vom Fetus produziertes Signal zum Geburtsbeginn unbekannt - Entfernung der fetalen Nebennierenrinde und des fetalen Hypothalamus verlängern die Gravidität - Infusion von ACTH oder Glucocorticoiden in fetalen Blutkreislauf löst vorzeitige Geburt aus - Maternale Stimulationsfaktoren, die auf die fetale Nebenniere wirken spielen keine Rolle, da beim Schaf das maternale ACTH die Placenta nicht passieren kann und somit den fetalen Blutkreislauf nicht erreichen kann - Anstieg der fetalen Glucocorticoidsekretion folgt Abnahme der maternalen Progesteronkonzentration im Blut, bewirkt durch die Induktion des Enzyms 17alphaHydroxylase in der Schafplacenta - Anstieg der Enzymaktivität führt zu einer Zunahme eines Dihydroxyprogesteronmetaboliten (17alpha, 20alpha-dihydroxy-pregn-4-en-3-on) der zu Östrogen konvertiert werden kann - Beim Schaf nimmt die Progesteronsynthese zur Geburt hin nicht direkt ab, sondern die ansteigende Metabolisierung zu einem 17alpha-hydroxylierten Produkt resultiert in einer verminderten Progesteronverfügbarkeit - >> fetaler ACTH-Anstieg > fetaler Glucocorticoid-Anstieg > Anstieg der Progesteronmetabolisierung > Abnahme der Progesteronverfügbarkeit > Anstieg der Östrogensynthese << - Danach kommt es zu einer Zunahme der PGF2alpha Produktion wenige Stunden vor Beginn der uterinen Aktivität - PGF2alpha-Sekretion hängt vom stimulierenden Effekt der Östrogene auf die PhospholipaseA2-Aktivität ab, diese steigt mit Zunahme des Östrogeneinflusses an und setzt ihrerseits Arachidonsäure frei > Vorläufermolekül aller Prostaglandine - Zunahme der PGF2alpha-Konzentraion bewirkt > schnellere Luteolyse > Progesteronsynthese kommt zum erliegen > Auflösung des Progesteronblocks > sensibilisiert den Uterus für Oxytocin Geburtsverlauf - Vorbereitungs-, Öffnungs-, Austreibungs- und Nachgeburtsstadium - Zellen des Genitaltraktes (vorallem die der Cervix) beantworten zunehmenden Östrogeneinfluss mit Synthese und Sekretion von dünnflüssigem Schleim - Der zäh-pappige Schleimpfropf, welcher die Cervix während der Gravidität gegen die Außenwelt verschließt, löst sich auf und der dünnflüssige Schleim führt zu einer gleitfähigen Schleimhautoberfläche - Zusätzlich wird Relaxin freigesetzt, das das Bindegewebe der Cervix auflockert und den Beckenbändern und dem perivaginalen Gewebe eine erhöhte Elastizität verleiht > Rind und Schwein: Ovar > Pferd, Schaf und Katze: Placenta - Geburtsstadien Geburtsstadium Tierart Öffnungsphase Austreibungsphase Nachgeburtsphase Stunden Minuten Stunden Pferd Rind 1–4 2–6 10 – 3 30 – 60 1 6 – 12 88 Schaf Schwein 2–6 2 – 12 30 – 120 150 – 180 5–8 1–4 - Dauer eines Geburtsstadiums über- oder unterschritten: Dystokie (Geburtsstörung) - Die ersten spontan einsetzenden Wehen treiben den Fetus in seinen Fruchthüllen in den sich öffnenden inneren Muttermund, wodurch lokale Rezeptoren erregt werden und über einen neurohormonalen Reflexbogen zur Freigabe von Oxytocin aus dem Hypophysenhinterlappen führen > Ferguson-Reflex - Wehendauer und –frequenz bei allen Haustieren etwa gleich > 6 Wehen / 15 Minuten > Wehendauer 1 – 2 Minuten) - Freigesetzte Menge des wehenauslösenden Neurohormons entspricht mechanischen Druck auf die Rezeptoren und regelt so die Wehenkraft während der Aufweitung der Cervix und der Vagina - Mit Vortreiben der Frucht in die Vagina werden im dorsalem Scheidendach liegende Mechanorezeptoren gedeht, die reflektorisch die Bauchpresse auslösen und dadurch die Austreibungsphase unterstützen - Mit Expulsion (Austreibung) der Frucht wird die Nachgeburtsphase eingeleitet, die Placenta löst sich und wird ausgetrieben 65. Laktation - für Säugetiere (Mammalia) charakteristisch - gleichmäßige, bedarfsgerechte Versorgung des Neugeborenen mit Nährstoffen, vorher über die Plazenta - Bewegungs- und Futterunabhängig - zur Arterhaltung geringe Anzahl von Nachkommen nötig - Kolostralmilch: Kälber, Lämmer, Fohlen, Ferkel – Ausbildung einer passiven Immunität durch Immunglobuline - Entwicklung Mutter-Kind-Beziehung über regelmäßigen Kontakt durch Säugen - Aufnahme von Mikroorganismen für Besiedelung der Vormägen und des Darms - beim Saugakt: Freisetzung von Oxitocin (Hormon) durch die Hypophyse (ZNS) - Laktationsanöstrus: Laktation hat hemmenden Einfluss auf den Zyklus einer Tierarten - Milchbildung und Sekretion kann bei Milchkühen, Milchschafen, Milchziegen und Pferden durch fortlaufenden Milchentzug (Melken) über einen längeren Zeitraum aufrecht erhalten werden – Rind Milchleistung von 12000 kg jährlich möglich - Milch bedeutender Wirtschaftsfaktor, Kosmetikum und Nahrungsmittel für den Menschen (viele biologisch hochwertige Proteine, Calcium, Phosphor, Riboflavin, Vitamin B12 und B6, Thiamin, Niacin und Magnesium; Milchfett hoch Verdaulich) - Euter als Bioreaktor: Produktion von spezifischen Proteinen die von einigen Menschen nicht selbst synthetisiert werden können > Bsp. Blutgerinnungsfaktor VIII - Lokalisation der Milchdrüse tierartlich unterschiedlich: > inguinal: Kuh, Pferd, Schaf, Ziege > thorako-inguinal, abdominal: Schwein, Hund, Katze > thorakal: Primaten, Elefant, Seekuh, Fledermaus - Mammarkomplexe > Schaf, Ziege 2 > Pferd 2 > Rind 4 > Schwein 12 – 14 > Fleischfresser 8 oder 10 > Strichkanäle: Wiederkäuer und Nager 1, Hund 14, Mensch 20 - Aufbau eines Mammarkomplex 89 Phasen der Milchdrüsenentwicklung Mammogenese - morphologische Entwicklung >fetal: Entwicklung der Milchleiste aus dem Ektoderm - bis zur Geschlechtsreife keine wesentliche Größenzunahme; Fetteinlagerungen > Pubertät: Hormone aus dem Ovar stimulieren Milchdrüsenentwicklung während des Zyklus Wirkung Östrogen auf Gänge und Zitzen, Progesteron auf die Alveolen > Trächtigkeit und Laktation - Entwicklung Gangsystem durch Östrogene, Wachstumshormone und Glukokorticoide > Entwicklung der Alveolen durch Östrogene, Wachstumshormone, Prolactin, Oxitocin, Plazentäres Lactogen, Glukokorticoide, Trijodthyronin, Insulin und Progesteron (hemmt die Milchbildung während der Trächtigkeit) - Größe der Drüsen abhängig von Phase: DNS-Gehalt steigt während der Trächtigkeitsdauer tierartlich unterschiedlich - weitere Faktoren für die Mammogenese > Fütterungsniveau > Photoperiode > Dauer der Trockenstehzeit Lactogenese - Einsetzen von Milchsynthese und Milchsekretion > Ende der Trächtigkeit - Phase 1 > Ansammlung von Präkolostrum im Euter (schon ca. 4 Wochen vor der Geburt milchähnliches Sekret) > Zytologische und enzymatische Differenzierung der Alveolarzellen > Zunahme von rauhem ER und Golgi-Apparat: Zunahme der mRNA Mengen = hohe Proteinexression - Phase 2 > Sekretion des Kolostrums (Beginn mit Geburt) = eigentliche Laktation > Gesteigerte Mitoserate der Alveolarzellen > Umstellung des Nährstoffflusses vom Uterus zum Euter 90 > Stimulierung der Synthese der Milchinhaltsstoffe > Abgaben der Immunglobulinen in die Milch Galactopoese - Aufrechterhalten der Laktation > Geburt bis Trockenstellen bzw. bis Absetzen - Laktationsleistung abhängig von Stoffwechsel, Gesundheit, Genetik, Rasse, Alter, Laktationen, Trockenstehzeit, Melken oder Saugen, Futter, Klima, Haltung - Milchmenge abhängig von der Laktationsdauer Milchleistung verschiedener Spezies Spezies kg / Tag Laktation (kg) Rind (Fleischrassen) 8 – 15 Rind (Milchrassen) 20 – 50 5.000 – 12.000 Pferd 10 – 15 1.500 – 2.600 Schwein 8 – 10 400 – 600 Ziege (Milchrassen) 2–5 500 – 1.000 Schaf (Milchrassen 2–5 120 – 1.000 Kaninchen 0,05 – 0,3 Mensch 0,5 – 1 Laktationsdauer (Tage) 130 – 150 300 90 – 350 50 – 60 200 – 250 120 – 200 - Wichtige Voraussetzung für hohe Laktationsleistung ist die Anpassung der Durchblutung der Milchdrüse > 500 Liter Blute je Liter Milch = 20 bis 30 % des Herzminutenvolumens > Vasodilatation durch gesteigertes Herzminutenvolumen - für 30 Liter Milch werden benötigt: 2,1 kg Glucose 36 g Calcium 150 Liter Wasser 285 MJ Bruttoenergie >> 15.000 Liter Blut / Tag - ATP-Bedarf für die Synthese der Milchinhaltsstoffe: 1 g Laktose = 8,3 mmol ATP 1 g Protein = 30 mmol ATP 1 g Fett = 37,5 mmol ATP > Synthese aus - Glukoseoxidation (Ziege 25 %, Kuh 11 %, Sau 54 % des Energiebedarfs) - Acetatoxidation (Ziege 44 %, Kuh 29 % des Energiebedarfs) - Aminosäureoxidation - Aufrechterhaltung der Sekretion durch > Prolactin (Ausschüttung durch Saugen und Melken, beim Kaninchen einziges Hormon zur Aufrechterhaltung der Laktation, bei Maus und Wiederkäuer eher Wachstumshormone wichtig) > Insulin, Glucocorticoide, T3 > Wachstumshormone (beim Rind rbSTH (rekombinantes bovines STH); Chronische Applikation führt zu Steigerung der Milchleistung um 10 – 15 % - in Deutschland verboten) - Milchsekretion: kontinuierlicher Vorgang des Drüsenepithels - Milchspeicherung: Alveolarmilch und Zisternenmilch > Milchbildung: - Füllung des dynamischen Speichers: Alveolen und kleine Milchgänge - Füllung des statischen Speichers: nach 3 – 4 Stunden passiv, von unten nach oben Zitzenzisterne und Drüsenzisterne - Milchabgabe: schubweise nach Melken oder Saugen 91 - je länger die Zwischenmelkzeit, desto mehr Zisternenmilch > Kuh, Ziege: 30 – 50 % > Schwein, Pferd: 10 – 30 % - Euterinnendruck hemmt die Sekretion - Hemmendes Protein aus den Alveolarzellen (Feedback inhibitor of lactation) hemmt Sekretion (nach Bindung an Rezeptoren der Alveolarzellen = autokrine Regulation der Milchsekretion) - Zusammensetzung der Alveolarmilch und Zisternenmilch unterscheidet sich nicht in Protein-, Laktose- und Elektrolytgehalt, jedoch stark im Fettgehalt (Adhäsionskräfte) > Alveolarmilch hat einen größeren Fettgehalt. > Morgengemelk mit mehr Zisternenmilch hat einen niedrigeren Fettgehalt als Abendgemelk mit weniger Zisternenmilch > Zisternenmilch: nach Öffnung des Strichkanals passives abfließen der Milch > Alveolarmilch: Einschießen der Milch in die Zisterne = Milchejektion - neurohumoraler Reflexbogen: > „Anrüsten“ > Reflexauslösung durch taktilen Reiz beim Melken/Saugen > über das Rückenmark zum Gehirn geleitet kommt es vom Hypophysen-Hinterlappen zur Ausschüttung von Oxitocin welches über die Blutbahn und das Herz zum Euer gelangt und dort eine Kontraktion der glatten Muskelzellen der Alveolen auslöst > Oxitocin steigert die Euterdurchblutung um 30 – 50 %. Die rasche Anflutung fördert den Stoffwechsel der Epithelzellen > Catecholamine hemmen die Milchsekretion durch Vasokonstriktion der Euterarteriolen und Konstriktion der Milchgänge > Melkhäufigkeit: mehr als 2 Mal pro Tag steigert die Milchleistung um 10 – 25 % und verzögert gleichzeitig Auslösung der 1. Ovulation nach Geburt (2 x Melken 33 Tage) > Milchreifungsperiode: Rind, Schaf, Ziege: 6. – 21. / Pferd, Hund, Katze: 2. – 3. Laktationstag 92 66. Kolostralmilch (Erstmilch, Biestmilch) - Funktion und Zusammensetzung - Versorgung des Neugeborenen mit leicht verdaulichen Nährstoffe > fettlösliche Vitamine, Mineralstoffe, Hormone, Wachstumsfaktoren - Laxans: Abgang des Mekoniums (Stuhl des Neugeborenen – Schleimhaut, Galle, im Fruchtwasser verschluckte Haut- und Haarzellen) - Immunschutz für Wiederkäuer, Pferd und Schwein - bei Tierarten deren Placenten keine Immunglobulinpassage aufweisen unterstützt die Kolostralmilch die Immunabwehr des Neugeborenen (maternaler Immunschutz). Diese Neugeborenen können gegen Infektionserreger kaum Immunglobuline (Antikörper) bilden, da ihr Immunsystem noch nicht ausgereift ist. Sie sind daher auf die Übertragung maternaler Immunglobuline durch die Kolostralmilch angewiesen. > IgG-Resorption bis 12 ( -36) Stunden postnatal > IgA lokale Darm-Immunität (alle) - passiver Schutz der Neugeborenen Säugetieren gegenüber Erregern auf der Schleimhautoberfläche beruht auf > Maskierung von Oberflächenrezeptoren (z.B. E. coli) > Hemmung von Krankheitserregern, die sich innerhalb der Mucosazellen vermehren (z.B. Virus der TGE) > Neutralisation bakterieller Enterotoxine Spezies Übertragung Immunglobuline Intrauterin Kolostralmilch +++ +++ +++ + ++ + ++ +++ (+) +++ - Pferd Schwein Wdk Hund/Katze Ratte/Maus Mensch Meerschweinchen Kaninchen + gering / ++ mäßig / +++ intensiv Zeitraum der Resorption von Immunglobulinen 24 h 36 h 24 h 1 – 2 Tage 16 – 20 Tage - Bildung des Kolostrums etwa 3 Wochen, Abgabe in den ersten Tagen nach der Geburt - unterscheidet sich von der reifen Milch durch einen höheren Gehalt an Trockenmasse, Gesamtprotein, Casein, Milchserumproteinen und Mineralstoffen. Die Konzentration an Lactose ist jedoch deutlich geringer - Besonders das Erstkolostrum ist reich an Immunglobulinen (mehr als die Hälfte der Milchserumproteine) - Kuhmilch: IgG1, IgG2, IgM und IgA - IgG1 überwiegt im Kolostrum und der reifen Milch - Schweinemilch: IgG und IgM im Kolostrum, IgA in der reifen Milch - in der Kolostralmilch höhere Konzentrationen an Natrium, Calcium, Chlorid und Phosphat als in der reifen Milch. Jedoch niedrigere Konzentrationen von Kalium und Citrat - auch hohe Konzentration der fettlöslichen Vitamine A und E sowie ß-Carotin, sowie verschiedene Hormone und Wachstumsfaktoren - ß-Carotin und Hämoglobin verursacht die gelbe/bräunliche Färbung des Kolostrums - Zusammensetzung der Milch ändert sich in den ersten Tagen schnell. Immunglobuline, Vitamine und Mineralstoffe sinken, Lactose und Caseine steigen Bildung und Sekretion: - ab 4 Wochen vor der Geburt werden Immunglobuline des Blutplasmas (IgA und IgM) an Rezeptoren der basolateralen Membran der Drüsenzellen gebunden und durch Endocytose ausgenommen - in der 3. Bis 2. Woche (Schaf und Ziege 7. Woche) ante partum maximale Werte 93 - dieses eiweiß- und immunglobulinreiche Sekret wird in der letzten Woche vor dem Abkalben durch die einsetzende Synthese von Lactose mit Wasser verdünnt und bildet das Präkolostrum , das nach dem Abkalben abgegeben wird - nach der Geburt in der Phase II der Lactogenese wird zunächst noch Kolostrum gebildet und sezerniert, gleicht sich aber zunehmend der reifen Milch an > Dauer Kolostralmilchperiode und Milchreifung: - Rind, Schaf, Ziege: bis zum 5. Laktationstag - Kuh: 6. Bis 21. Tag nach der Geburt Milchreifungsperiode - Pferd, Hund, Katze: bis zum 2. 0der 3. Laktationstag 67. Eigenschaften u. Zusammensetzung der Milch - Milch ist eine Emulsion - Milchplasma = Milch – Fett - Milchserum (Molke) = Milchplasma – Caseine Kolostralmilch 3,3 14,2 2,9 5,2 1,2 Fett (%) Proteine (%) Laktose (%) Energie (MJ/kg) Mineralstoffe (%) Calcium (g/l) Reife Kuhmilch 3,5 ( – 5,5) 3,3 (3,1 – 3,9) 4,8 2,9 0,7 1,2 Zusammensetzung: - Wasser, Proteine (Caseine, Molkenproteine), Fette, Kohlenhydrate, Vitamine und Mineralstoffe - Außerdem: Immun- und Epithelzellen und Zellmembranen - Anteile der einzelnen Inhaltsstoffe sind jedoch von Tierart zu Tierart unterschiedlich - Bei Tierarten, die einen sehr energieintensiven Stoffwechsel betreiben, ist die Milch besonders reich an Fetten, Proteinen und Kohlenhydraten. Dazu gehört z.B. die Milch von Walen und Eisbären. Innerhalb einer Art haben auch Fütterung, Haltung, Laktationszeit sowie Gesundheitszustand und Alter der Tiere Einfluss auf Zusammensetzung der Milch - Die häufigsten Proteine, die etwa 80 % der Gesamtproteinmenge ausmachen, sind die Caseine. Die übrigen Proteine werden auch als Molkenproteine zusammengefasst. Unter der Bezeichnung Molkenproteine fasst man beta-Lactoglobulin, alpha-Lactalbumin, Rinderserumalbumin, Immunglobulin und die Proteosepepton zusammen. Die beim längeren Kochen von Milch zu beobachtende Entwicklung einer Haut an der Oberfläche wird durch die hitzeinduzierte Denaturierung von Albumin verursacht - Das wichtigste Kohlehydrat in der Milch ist Lactose, daneben sind Galactose, Glucose und Spuren anderer Kohlehydrate enthalten - pH-Wert von Milch zwischen 6,5 für frische Milch bis ca. 4,5 für saure Milch Zusammensetzung der Milch verschiedener Säugetiere Tierart Kuh Ziege Schaf Büffel Schwein Pferd Hund Katze Mensch Fett 37 45 74 104 68 19 85 70 38 Casein 28 25 46 28 13 39 37 4 Milchserumprotein g/Liter 6 4 9 20 12 6 Laktose 48 41 48 43 55 62 37 50 69 Calcium Spurenelemente Wasser Kohlenhydrate 1,2 0,9 2,3 0,7 0,8 0,9 % 87,5 86,6 82,7 82,8 4,8 3,9 6,3 5,5 4,2 0,7 0,4 90,1 5,9 0,3 0,3 87,2 7,0 94 95