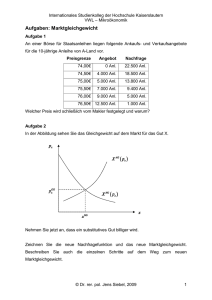
Fragen zum QF-Lebensmittel ab November 2004
Werbung

Fragen zum QF-Lebensmittel ab November 2004 1. Nennen Sie mindestens 5 Anforderungen, die aus der Sicht der Hygiene an Räume zu stellen sind, in denen Lebensmittel hergestellt werden. Räume müssen allseits umschlossen sein Dürfen nur ihrer Zweckbestimmung entsprechend verwendet werden Müssen für vorgesehenen Zweck geeignet sein: Größe, Beleuchtung, Ventilation, einwandfreier Bauzustand, Möglichkeit zur Reinigung Fußböden wasserundurchlässig, rutschfest, Ablaufmöglichkeit für Wasser Verbindungen zu Wänden oder Ablaufrinnen rundlich gekehlt Wände in angemessener Höhe und mit undurchlässigem Anstrich Ausreichende, leicht zugängliche Waschgelegenheiten Saubere Handtücher Räumlich abgetrennte Toiletten, deren Türen nicht in Räume öffnen dürfen, in denen offen mit LM manipuliert wird Keine Haustiere, Bekämpfung von Fliegen, Ungeziefer & tierischen Schädlingen Strikte Trennung in „reine“ und „unreine“ Räume Trennung von „Warm-„ und „Kalträumen“ Luftführung 2. Was bedeutet die Abkürzung „HACCP“, wozu dient das HACCP-Konzept und nennen Sie die Grundsätze des HACCP-Konzeptes HACCP = Hazard Analysis and Critical Control Points Konzept dient dazu, innerhalb des Eigenkontrollsystems solche gesundheitlichen Gefahren abzuwehren, die spezifisch anzusprechen sind, d.h. sie zu identifizieren, zu bewerten, kontinuierlich zu erfassen und zu beherrschen sind (kurz: “Verhinderung von Keimvermehrung, Wachstum, Toxinproduktion im LM und Vermeidung der Rekontamination, nicht der Kontamination!“) Grundsätze: 1) Gefahrenanalyse 2) Bestimmung der CCP’s 3) Festlegung von Grenzwerten (critical limits) 4) Monitoring 5) Korrekturmaßnahmen (corrective actions) 6) Verifizierung (Eigenkontrolle der Eigenkontrolle) 7) Dokumentation 3. Erklären Sie die Begriffe „primäre“, „sekundäre“ und „tertiäre“ Kontamination „primäre“ Kontamination: Mikroorganismen sind bereits im lebenden Tier/Tierbestand enthalten („pre-harvest“ Bereich) „sekundäre“ Kontamination: Mikroorganismen gelangen während der Gewinnung, der Beund Verarbeitung ins LM (durch Gewinnungs-/Verarbeitungstechnologie) „tertiäre“ Kontamination: Keime gelangen nach der Verarbeitung ins LM (im LM-Betrieb, im privaten Haushalt, in der Gemeinschaftsverpflegungseinrichtung) 4. Definieren Sie die Begriffe „Indikator-Organismen“ und „Index-Organismen“ und nennen Sie jeweils 2 Beispiele für den Bereich Fleisch Indikator-Organismen: Keime, deren Vorhandensein im LM für einen unsachgemäßen Umgang mit dem LM sprechen bzw. für eine bestimmte Art der Kontamination, bspw. coliforme Keime/Enterokokken sprechen für fäkale Kontamination; eine erhöhte aerobe mesophile Gesamtkeimzahl spricht für unzureichende Personalhygiene 1 Index-Organismen: Keime, die per se gesundheitlich bedenklich sind und nur bis zu einem bestimmten Grenzwert im LM vorhanden sein dürfen, bspw. Salmonella sp., Campylobacter jejuni, pathogene Varianten von Listeria monocytogenes, toxinogene Varianten von E. coli 5. Erläutern Sie die Parameter n, c, m und M bei attributiven „Drei-KlassenPlänen“. Welche LM werden nach solch einem Plan gemäß FlHygVO untersucht? n: Zahl der Proben einer Partie c: Zahl der Proben, die Werte zwischen m und M aufweisen dürfen m: Richtwert, bis zu welchem alle Ergebnisse als zufrieden stellend anzusehen sind M: Grenzwert, der von keiner Probe überschritten werden darf Es können nun drei Klassen eingeteilt werden, eine bis zum Richtwert m, eine zwischen m und M und eine über dem Grenzwert M. Eine Partie gilt als zufrieden stellend, wenn keiner der Werte m überschreitet, als annehmbar, wenn c nicht überschritten wird und als nicht annehmbar wenn c und/oder M überschritten werden Nach diesem Drei-Klassen-Schema werden Hackfleisch und Fleischzubereitungen nach FlHV Anl. 2a, Nr. 9ff bewertet 6. Definieren Sie den Begriff „Spezifikation“! Spezifikation = vertragliche Vereinbarung zwischen Empfänger und Lieferant, z.B. im Hinblick auf mikrobiologische Normen 7. Definieren Sie den Begriff „Food Safety Objective“! Food Safety Objektive = Aussage über die Häufigkeit oder maximale Konzentration einer mikrobiologischen Gefahr in einem LM, die als für den Verbraucherschutz akzeptabel angesehen wird; Umsetzbarkeit durch Gute-Hygiene-Praxis und HACCP-Konzept muss gewährleistet sein Ungleich mikrobiologischer Kriterien 8. Nennen Sie 4 Rechtswerke aus dem Lebensmittel- und Fleischhygienerecht, in denen mikrobiologische Normen verankert sind! FlHV Entscheidung 93/51/EWG GeflFlHV EiprodukteVO TrinkwasserVO MilchVO DiätVO FischHV Entscheidung 2001/471/EG 9. Wo finden sich Empfehlungen zur Beurteilung von Listeria monocytogenesNachweisen in LM? Nach welchen Gesichtspunkten sind diese Empfehlungen unterteilt und von welchem Beurteilungswert gehen diese aus? „Empfehlungen zum Nachweis und zur Bewertung von Listeria monocytogenes in Lebensmitteln im Rahmen der amtlichen Lebensmittelüberwachung“ ausgesprochen durch das BgVV (BfR) vom Juli 2000 Kategorisierung der LM in 4 Kategorien: 1) LM, deren Behandlung während der Herstellung die Abtötung gewährleistet, keine Rekontamination möglich (z.B. Säuglingsnahrung) dürfen keine Listerien enthalten 2 2) LM, die eventuell kontaminiert sind und in denen eine Vermehrung von Listerien möglich ist (z.B. die meisten nicht konservierten LM) dürfen am Ende des MHD max. 10 hoch 2 Listerien/g enthalten 3) LM, die eventuell kontaminiert sind und in denen keine Vermehrung von Listerien möglich ist (z.B. Joghurt) dürfen max. 10 hoch 2 Listerien/g enthalten 4) LM, die vor dem Verzehr bestimmungsmäßig erhitzt werden (z.B. Braten) keine Grenzwerte wenn Grenzwerte überschritten (CAVE: Empfehlung! Kein Gesetzescharakter) nicht zum Verzehr geeignet 10. Welche Bewertungsgrundlagen können Sie für mikrobiologische Untersuchungsergebnisse heranziehen, für die keine rechtlichen Grenzwerte existieren? Gibt es keine rechtliche verankerten Grenzwerte, so können mikrobiologische Richtwerte für Hygienestandards der CMA (zentrale Marketinggesellschaft für Agrarwirtschaft), Richt- und Warnwerte der DGHM (Deutsche Gesellschaft für Hygiene und Mikrobiologie) oder andere wissenschaftlich ermittelten Werte, wie z.B. die minimale Infektionsdosis, in die Bewertung mit einbezogen werden. Letztlich muss die sensorische Prüfung entscheiden. 11. Definieren Sie den Begriff „Zoonosen“! Zoonose = Krankheiten und Infektionen, deren Erreger natürlicherweise zwischen Wirbeltier und Mensch übertragen werden kann (WHO-Definition aus Pschyrembel) Zooanthroponosen: Erkrankung oder Infektion beim Tier, Übertragung auf Menschen Anthropozoonosen: Erkrankung oder Infektion beim Menschen, Übertragung auf Tier 12. Nennen Sie 8 bakterielle Zoonose-Erreger! Escherichia coli, v.a. EHEC, O157/H7 Salmonella enterica sub. enterica ser. Typhimurium/Enteritidis/Dublin Listeria monocytogenes Mycobacterium tuberculosis/bovis Brucella abortus/suis/melitensis/canis Bacillus anthracis Coxiella burnettii Leptospira interrogans ser. canicola/icterohaemorrhagicae Yersinia pseudotuberculosis/pestis Campylobacter jejuni 13. Welche Clostridium spp. sind lebensmittelhygienisch von Bedeutung? C. botulinum Typ A: Gemüse- & Fleischkonserven C. botulinum Typ B: Fleischerzeugnisse C. botulinum Typ E: Fisch/-erzeugnisse C. botulinum Typ F: Fleisch-/Fischerzeugnisse C. sporogenes: Bombagen bei Konserven C. butyricum/tyrobutyricum/sporogenes: Spätblähung bei Käse C. butyricum/tyrobutyricum: Frucht-/Gemüsekonserven C. sporogenes/butyricum: pasteurisierte Feinkosterzeugnisse C. thermosaccharolyticum/felsineum/pasteuriarum/scatalogenes 14. Welche Formen der Erkrankung sind Ihnen bei Clostridium botulinum bekannt? orale Aufnahme des exogen im LM gebildeten Toxins (Botulinum-Toxin, BotulinumNeurotoxin) bei Verzehr von kontaminierten Konserven oder Fleisch- und Fischerzeugnissen 3 Säuglingsbotulismus: Toxinbildung im Darm nach Verzehr von Säuglingsnahrung, die mit kontaminiertem Honig zubereitet und nicht sofort verzehrt wurde Wundbotulismus: klassische Symptomatik nach Wundinfektion Botulismus unbekannter Ätiologie: beim Erwachsenen ohne erkennbare Wunden Es werden 7 Toxovare (A-G) unterschieden, wobei Typ A am toxischsten ist und v.a. in den USA und Typ B in Europa im Rahmen von LM-Vergiftungen nachgewiesen werden. Typ E steht im Zusammenhang mit dem Verzehr von Fisch und Fischerzeugnissen. Typ C und D kommen auf Kadavern vor. 15. Warum ist eine gründliche Reinigung in Lebensmittel verarbeitenden Betrieben wichtig? Erfolgt sie vor oder nach einer Desinfektion (Begründung)? Durch eine gründliche Reinigung werden schon viele fakultativ pathogene Mikroorganismen beseitigt, die sonst die LM kontaminieren könnten. Die Reinigung muss vor der Desinfektion erfolgen, damit das Desinfektionsmittel optimal wirken kann. Anderenfalls werden Keime unter einer schützenden Schmutzschicht nicht erreicht, bzw. die Einwirkzeit des Desinfektionsmittels auf die Keime ist verkürzt. Saure oder alkalische Desinfektionsmittel werden durch Protein, Fette oder Säuren und Laugen neutralisiert und dadurch in ihrer Wirksamkeit gemindert. 16. Welche 4 Faktoren sind laut dem „Sinner’schen Kreis“ Vorraussetzung für eine wirksame Reinigung? 1) Zeit: Dauer des Reinigungsprozesses 2) Chemie: Art und Konzentration des Reinigungsmittels 3) Mechanik: z.B. Art des Putzlappens, Dampfstrahlgerät etc. 4) Temperatur: z.B. Mindesttemperatur bei Desinfektionsprozessen alle 4 Faktoren beeinflussen sich gegenseitig 17. Nach welchem Kriterium werden Reiniger in Lebensmittel verarbeitenden Betrieben eingeteilt? Gegen welche Arten von „Schmutz“ bzw. Ablagerungen wirken die beiden Haupttypen? es werden saure, alkalische und Neutral-Reiniger unterschieden saure Reiniger wirken gegen anorganische Ablagerungen (z.B. Essigreiniger gegen Kalk) alkalische Reiniger wirken gegen organische Verschmutzungen, wie z.B. Eiweiß und Fett (mäßig alkalische Reiniger zur allgemeinen Betriebsreinigung, starke alkalische Reiniger für erhebliche Eiweiß- und Fettverschmutzungen) Neutralreiniger wirken dagegen gegen anorganische Ablagerungen gar nicht und gegen organische Verschmutzungen deutlich schwächer als alkalische Reiniger (zur Entfettung und manuellen Reinigung) 18. Welche rechtlichen Zulassungsverfahren sind für Desinfektionsmittel im Bereich der Lebensmittelverarbeitung vorgeschrieben? Wo finden sich für den Bereich der LM-Verarbeitung empfehlenswerte Desinfektionsmittel? es gibt keine verbindlichen rechtlichen Zulassungsverfahren für Desinfektionsmittel im Bereich der LM-Verarbeitung. Im Prinzip kann ein Hersteller jedes Desinfektionsmittel auf den Markt bringen, ohne es vorher testen zu lassen. In der MilchVO und der FischHVO sind „geeignete Mittel“ vorgeschrieben, also solche, die in den entsprechenden Listen aufgeführt sind. Empfehlenswerte Desinfektionsmittel sind in der DVG-Desinfektionsmittelliste aufgeführt. Diese Mittel sind vorher auf ihre Wirksamkeit getestet worden. Ebenfalls gibt die DVG die Desinfektionsmittelliste für den Bereich Tierhaltung heraus. Die DLG testet Reinigungs- und Desinfektionsmittel in der Milchwirtschaft, für Euterhygiene, Silier- und 4 Stalldesinfektionsmittel und verleiht ein Gütezeichen für die getesteten Produkte. Getestete Händedesinfektionsmittel finden sich in der Liste der DGHM. 19. In der DVG-Desinfektionsmittelliste sind pro Produkt nicht nur 1, sondern bis zu 32 Anwendungskonzentrationen angegeben. Welchen Einflussfaktoren wird dabei Rechnung getragen? Welcher Wirkstoffgruppe gehören die Mehrzahl der DVG-gelisteten Desinfektionsmittel an? Die angegebenen Anwendungskonzentrationen sind abhängig von: Anwendungstemperatur: je kälter, desto höher die benötigte Konzentration (Kältefehler) Einwirkzeit: Die Konzentrationen werden für Langzeit- (60 Min) und Kurzzeit- (30 Min) Desinfektionen angegeben Ob LM tierischer Herkunft außer Milch oder Milchprodukte in dem Betrieb verarbeitet werden Ob eine Bakterizidie oder eine Fungizidie erreicht werden soll Ob das Desinfektionsmittel an einem weniger belasteten oder einem belasteten Bereich angewendet wird Die Mehrzahl der DVG-gelisteten Desinfektionsmittel sind quaternäre Ammoniumverbindungen (QAV) 20. Erläutern Sie die Vermehrungsfähigkeit von Yersinia enterocolitica in Lebensmitteln in Bezug auf die Temperatur! Yersinia enterocolitica ist ein gramnegatives, psychrotrophes, kapselloses Stäbchen mit einer durchschnittlichen Länge von 1-3 μm und einer Breite von 0,5-0,8 μm. Bei Temperaturen bis 28°C ist das Bakterium beweglich, da es peritrich Geißeln an der Oberfläche ausbildet. Das Wachstum ist aerob und fakultativ anaerob. Es vermehrt sich bei Temperaturen von 2°C-42°C. Sein Temperaturoptimum liegt bei ca. 28°C. Das bedeutet, dass sich das Bakterium sogar in gekühlten LM vermehren kann. 21. Beschreiben Sie das klinische Bild einer Yersinia enterocolitica-Infektion des Menschen! Diarrhoe, abdominale Schmerzen, Fieber, Erbrechen, mesenteriale Lymphadenitis und terminale Ileitis (Pseudoappendicitis) 22. Was stellt das Reservoir von Yersinia enterocolitica dar? Welche Lebensmittel traten bisher als Vektor in Erscheinung? Reservoir: Tiere sind häufiger Träger, insbesondere Schweine, aber auch Rind, Schaf, Ziege u.a. Erregerübertragung bisher v.a. über Rohmilch, Schweinefleisch wird als Überträger vermutet, Fleisch insgesamt, aber auch Wasser (1976 Ausbruch durch Schokoladenmilch post process contamination) 23. Welche Campylobacter-Spezies spielen die größte Rolle als Lebensmittelerreger? Welche Tierarten bilden das Hauptreservoir? Beschreiben Sie die Entwicklung der Campylobacter-Infektionen-Meldungen nach Infektionsschutzgesetz! C. jejuni (80%) >> C. coli, C. laridis, C. upsaliensis In absteigender Reihenfolge: Geflügel, Schweine, Nagetiere, Schafe, Brieftauben und Wildvögel, Hunde, Katzen Erkrankungen durch Campylobacter jejuni gehören zu den häufigsten Durchfallerregern in Europa und Amerika. Zahlen darüber liegen nur aus 11 Bundesländern vor. Erst seit Januar 2001 besteht für diesen Erreger Meldepflicht nach den §§ 6 und 7 IfSG. In den Jahren 19982000 wurden in 11 Bundesländern je knapp 30000 Fälle von Campylobacter-Infektionen 5 gemeldet. 2001 lagen ca. 58000 Meldungen vor. Campylobacter-Infektionen sind somit nach den Salmonellen-Enteritiden die häufigsten meldepflichtigen Darminfektionen nach IfSG. 24. Erläutern Sie die Vermehrungsfähigkeit von Campylobacter jejuni in Lebensmitteln und stellen Sie diese in Relation zur Dosis infectiosa minima! Im Gegensatz zu Salmonellen reichert sich Campylobacter jejuni in LM in der Regel nicht an, was mit seinen höheren Temperaturansprüchen (Temperatur: minimal 30°C, maximal 45°C, Optimum 37°C-42°C termophil) in Verbindung steht. Da die minimale Infektionsdosis > 5 x 10 hoch 2 KbE aber extrem gering ist, sind Ausbrüche dennoch sehr häufig 25. Nennen Sie die wichtigsten Übertragungswege von Campylobacter jejuni und Escherichia coli. Welche Lebensmittel treten häufig als Vektor in Erscheinung? Campylobacter jejuni: die größte Rolle spielen Geflügelfleisch und Innereien. Die Übertragung kann auch über Fleisch anderer Tierarten, Trinkwasser oder Eier erfolgen E. coli: der Erreger wird über Trinkwasser und Badeseen, nicht durchgegarte Rindfleischprodukte (Hamburger), Streichelzoos und Haustiere sowie Rohmilch und durch infizierte Menschen (person to person) übertragen 26. Nennen Sie 2 mögliche Folgen einer Campylobacter-Enteritis! reaktive Arthritis, Reiter’s Syndrom (Urethritis, Conjunctivitis, Arthritis der Knie- und Fußgelenke), Guillan-Barré-Syndrom (Parästhesien bis zur Tetraplegie), Erythema nodosum 27. Definieren Sie den Begriff „coliforme Keime“! Welche Bedeutung haben diese in der Lebensmittelhygiene? Unter coliformen Keimen versteht man Laktose-positive Enterobacteriaceae, dazu zählen E. coli, Citrobacter, Enterobacter, Klebsiella und Kluyvera. Im Gegensatz dazu stehen die Nichtcoliformen Keime, d.h. die Laktose-negativen Enterobacteriaceae. Hierzu zählen Salmonellen, Proteus und Yersinia. Serratia und Haffnia nehmen eine Zwischenstellung ein. In der Lebensmittelhygiene haben sie eine Bedeutung als Indikatorkeime für die hygienische Behandlung von LM und als Indexkeime für die fäkale Kontamination von Wasser 28. Grenzen Sie folgende Begriffe voneinander ab: Verotoxin-bildende Escherichia coli, Shigatoxin-bildende E. coli, Enterohämorrhagische E. coli, E. coli O157:H7! VTEC bilden ein Zytotoxin mit enterotoxischer Wirkung und unter anderem nekrotoxischer Wirkung. Im Verozelltest führen diese Toxine zu einer irreversiblen Schädigung dieser Zellen. Daher erklärt sich der Name Verotoxin. Inzwischen wurde die strukturelle Identität mit dem Shigatoxin, gebildet von Shigella dysenteriae Typ 1, festgestellt. Heute werden die Begriffe VTEC und STEC synonym verwendet. Eine Untergruppe der VTEC bzw. STEC sind die EHEC (Diarrhoe, HUS, HC, TTP). Sofern der Stamm Verotoxinbildungsvermögen, d.h. das VT/Stx-Gen, sowie das eae-Gen, besitzt, handelt es sich um potentielle EHEC, sobald sie von einem erkrankten Menschen isoliert wurden, um EHEC. E. coli O157:H7 ist ein Serovar der EHEC, der so genannte Prototyp, der öfter bei schweren Erkrankungen in den USA isoliert wurde. 29. Welche Subtypen des Verotoxins kennen Sie und wie ist deren Bedeutung für das Krankheitsgeschehen bei Mensch und Tier einzuschätzen? Es wird zwischen VT1/Stx1 und VT2/Stx2 unterschieden, die einzeln oder auch gleichzeitig bei einem Bakterienstamm vorkommen können. Sie werden überwiegend durch temperente Bakteriophagen codiert (exklusive VT2e/Stx2e, Ödemkrankheit der Absatzferkel, chromosomal codiert). VT1/Stx1 zeigen keine Kreuzreaktion mit VT2/Stx2. 6 Unterschiedliche VT/Stx-Varianten: VT1c/Stx1c und VT2d/Stx2d meist ohne eae, noch nie bei schwerem Krankheitsverlauf isoliert VT2c/Stx2c bindet am Gb3-Rezeptor beim Menschen und verursacht schwere Erkrankungen (HC, HUS) VT2e/Stx2e bindet an Gb4-Rezeptor beim Schwein und verursacht dort die Ödemkrankheit, nicht humanpathogen VT2f/Stx2f Taubentoxin, nicht humanpathogen 30. Welches zusätzliche Virulenzgen neben dem Verotoxinbildungsvermögen weisen die meisten klinischen EHEC-Isolate auf und wie trägt der dadurch codierte Virulenzfaktor zur EHEC-Pathogenese bei? eae-Gen (E.coli-attaching-and-effacing-Gen). Es ist verantwortlich für die Bildung von Intimin und die Ausbildung eines so genannten „attachin-and-effacing“-Komplexes, d.h. das Anheften und Zerstören von Darm-Endothelzellen. Dadurch kommt es zur hämorrhagischen Diarrhoe. 31. Welche verschiedenen klinischen Manifestationen können bei Mensch und Tier nach Infektion mit VTEC beobachtet werden, welche Gruppen sind jeweils prädisponiert? Inkubationszeit: 3 Tage Geringe Infektionsdosis: ca. 100 Keime Klinik: HC (hämorrhagische Kolitis): Durchfälle, Bauchkrämpfe, eventuell Fieber, nach 2 bis 3 Tagen kann der Durchfall blutig werden, Vomitus (ca. 50%), nach 6-10 Tagen Symptomrückgang, lange Zeit Ausscheider Komplikationen: HUS (Hämolytisch-Urämisches-Syndrom, v.a. bei Kindern) Hämolytische Anämie, Haematurie, Proteinurie, Oligurie oder Anurie, Nierenversagen, Thrombotische Mikroangiopathie, Thrombozytopenie TTP (Thrombotisch-thrombozytopenische Purpura, v.a. Erwachsene) Thrombozytopenie, Hautblutungen, Hämolytische Anämie, Kolitis, Lungenödem, Myocardinfektion, neurologische Störungen Risikogruppe: YOPIS (Young, Old, Pregnant, Immunocompromissed Segment of the public) 32. Was gilt als Reservoir der VTEC und welche 3 Hauptübertragungswege auf den Menschen gibt es? Reservoir: Darm von Wiederkäuern Übertragung auf den Menschen vor allem durch: Lebensmittel: Wasser (Trinkwasser, Badeseen), unzureichend erhitztes Rindfleisch („hamburger disease“), Rohmilch Tiere: Streichelzoos, Haustiere Infizierte Menschen: person to person 33. Wie häufig können VTEC in deutschen Rinderbeständen nachgewiesen werden und welche Serotypen treten auf? in den USA sind 2-5% der Rinderbestände mit O157 infiziert, in Deutschland treten eher andere Serovare auf (O22:H8; O113:H21, O171:H2). Serovare, die Krankheiten auslösen sind in Deutschland eher selten. Nach WEBER et. al., 1997 ist bei der Untersuchung von 13 Rinderherden 7,7% O157, 76% nicht O157 gefunden worden. Nach RICHTER et. al., 1997 sind bei 204 Rindern 0 Tiere gefunden worden, die O157 und 97 die keine O157 hatten 7 Nach einer Übersicht von Prof. Bülte aus dem Jahr 2002 besteht eine Prävalenz von VTEC in Europa bei Wiederkäuern (Rinder, kl Wdk, Wildwdk) von 18 – 71,3%. (Quellenangabe im Sinell!). 34. Auf welchen Prinzipien beruhen Nachweismethoden für E. coli O157 bzw. VTEC? immunologischer Nachweis der Verotoxine aus klinischen Proben und Kulturen mittels ELISA Nachweis der Verotoxingene mittels PCR Nachweis von VTEC aus LM durch Voranreicherung Anreicherung PCR-Screening ↓ ↓ wenn positiv MacConcey-Agar Kolonie-DNAHybridisierung ↓ Bestätigung und Charakterisierung der Isolate Untersuchung auf VTEC O157 nach §35 LMBG und ISO: Probe Anreicherung (mTSB+N) nach 6 und 24 Std. IMS (Immunomagnetische Separation) Ausstrich auf 2 Medien, eins davon CT-SMAC, das andere wahlweise, z.B. HC-Agar diese Medien enthalten Sorbit; EHEC werden daran erkannt, dass sie meist kein Sorbit verwerten können (im Gegensatz zu anderen E. coli) 35. Welche Listerien-Spezies kennen Sie und welche treten als Krankheitserreger beim Menschen in Erscheinung? Die Gattung Listeria umfasst 6 verschiedene Arten: L. monocytogenes, L. ivanovii, L. innocua, L. seeligeri, L. welshimeri und L. grayi Prinzipiell können alle Listerien Erkrankungen beim Menschen verursachen, es kommen aber fast nur L. monocytogenes vor. Beim Menschen kommen v.a. die Serovare 1/2a, 1/2b und 4b vor. 36. Erläutern Sie Vorkommen und Verbreitung von Listerien sowie wichtige Übertragungswege von L. monocytogenes auf den Menschen! Der Kontakt mit Listerien, auch mit pathogenen, ist häufig. Die Listeriose ist eher selten. Meist erkranken so genannte YOPIS. Listerien sind in der Erde heimisch, ubiquitär auch vorhanden auf Pflanzen, die mit Erde bedeckt sind (Salate, etc.). Tiere nehmen die Listerien auf und beherbergen sie in ihrem Darm. Der Mensch infiziert sich hauptsächlich über infizierte tierische und pflanzliche LM. Rohe LM stellen dabei die Hauptursache dar, v.a. Käse, auch Fleisch, Salate, etc. Ausreichend erhitzte LM sind meist frei von Listerien oder wurden sekundär kontaminiert (Kondenswasser, Abwassergullys hoch belastet!). 37. Erläutern Sie die beim Menschen auftretenden Krankheitsbilder nach einer Listeria monocytogenes-Infektion sowie eventuelle Prädispositionen! Klinik: Sepsis, Meningitis/Enzephalitis, Abort, Frühgeburt, Totgeburt In einzelnen Organen können Listerien eitrige Entzündungen hervorrufen, gelegentlich Endokarditis, Pneumonie, Konjunktivitis, Arthritis, Osteomyelitis, papulöse/pustulöse Hautläsionen nach Hautkontakt Neonatale Listeriose (Frühinfektion = diaplazentar; Spätinfektion = während oder kurz nach der Geburt) Prädisposition: YOPIS 8 38. Nennen Sie 4 typische Lebensmittel, die häufig mit Listerien kontaminiert sein können! Weichkäse, wie Romadur, Roquefort, Camembert, Brie Rohes Fleisch, Tatar, speziell Geflügelfleisch Salate, Pflanzen (Kartoffeln, Rettich) Rohe unpasteurisierte Milch und deren Produkte Sauermilch, Schaf- und Ziegenmilchkäse Räucherfisch 39. Wie ist der Nachweis von Listeria innocua zu werten? Listeria innocua ist apathogen, aber als Indikatorkeim für Listeria monocytogenes zu werten, da sie eine kürzere Regenerationszeit hat und so L. monocytogenes in der Probe überwachsen kann. Rechtlich hat der Nachweis von L. innocua keine Konsequenzen. 40. Was bedeutet die Abkürzung HACCP, wo ist dieses Konzept international verankert und wer hat es ursprünglich entwickelt? Hazard analysis and critical control point = System, das Gefahren identifiziert, bewertet und kontrolliert Eine international verbindliche Version des HACCP-Konzeptes befindet sich im Regelwerk des FAO/WHO Codex Alimentarius (Alinorm 97/13A) und ist Bestandteil der „Allgemeinen Grundsätze der Lebensmittelhygiene“ (RL 93/43/EWG) Die Entwicklung des so genannten „Hazard analysis ans critical control point“-Konzeptes (HACCP-Konzept) kommt aus den USA. Das Konzept wurde im Jahre 1959, als ein amerikanischer Lebensmittelhersteller von der NASA beauftragt wurde, ein weltraumgeeignetes Lebensmittel herzustellen, welches hundertprozentige Sicherheit beinhalte, entwickelt. Dieses präventive Konzept wurde dann mit der NASA weiter entwickelt und im Jahre 1971 in den USA als HACCP-Konzept veröffentlicht und dokumentiert. Seit Mitte der 70er Jahre arbeitet auch eine Kommission der FAO/WHO Codex Alimentarius auf dem Gebiet der Lebensmittelhygiene Empfehlungen aus und gibt spezifische Definitionen zum HACCP-Konzept aus. 41. Nennen Sie die 7 Prinzipien des HACCP-Konzeptes nach Codex Alimentarius! 1) eine Gefahrenanalyse durchführen (hazard analysis) 2) die „critical control points“ bestimmen 3) Grenzwert(e) festlegen (critical limits) 4) Ein System zur Überwachung der CCPs festlegen (monitoring) 5) Festlegung von Korrekturmaßnahmen, die vorzunehmen sind, wenn die Überwachung (monitoring) anzeigt, das ein CCP nicht mehr fehlerfrei funktioniert (corrective actions, Havariekonzept) 6) von Verifizierungsverfahren, die bestätigen, dass das HACCP-Konzept erfolgreich arbeitet 7) Einführung einer Dokumentation, die alle Vorgänge und Aufzeichnungen berücksichtigt und diesen Prinzipien und deren Anwendung entspricht 42. Erläutern Sie die Vorgehensweise bei einer Gefahrenanalyse (Hazard analysis) im Rahmen eines HACCP-Konzeptes! hazard identification: Auflistung sämtlicher potentieller Gefahren risk assessment: Bewertung der Gefahrenanalyse Handlungsbedarf festlegen Das Codex Papier beschreibt die „Hazard analysis“ als einen „Vorgang, bei dem Informationen über Gefahren und Situationen, die diese hervorrufen können, gesammelt und 9 bewertet werden, um zu entscheiden, welche für den Gesundheitsschutz bedeutsam und daher in den HACCP-Plan einzubeziehen ist“ 43. Was ist unter „CCP“ zu verstehen, welche Eigenschaften muss ein Verfahrensschritt aufweisen, um als CCP ausgewählt werden zu können? ein CCP muss alle folgenden Eigenschaften aufweisen: die festgestellte Gefahr spezifisch ansprechen zur Beherrschung durchgeführte Maßnahmen sollen die Gesundheitsgefahr ausschalten, vermeiden oder auf ein vertretbares Maß reduzieren es muss ein geeignetes Monitoringsystem mit Grenzwerten existieren es müssen geeignete Korrekturmaßnahmen existieren Verifizierung, Dokumentation CCP’s werden im Codex Alimentarius als „Stufen bezeichnet, an denen es möglich und notwendig ist, eine Gefahr zu vermeiden, auszuschalten oder auf ein vertretbares Maß zu reduzieren. (Stufe ist hierbei ein Punkt, ein Verfahren, ein Arbeitsvorgang, oder ein Abschnitt in der LM-Produktionskette (inkl. Rohmaterialien!) von der Anfangsproduktion bis zum endgültigen Verbrauch.) 44. Benennen Sie CCP’s bei der üblichen Herstellung von Brühwurst und Rohschinken (Begründung)! CCP’s bei Brühwurstherstellung: Erhitzung beim Brühen: kann kontinuierlich mittels Temperatur-Zeit-Schreiber kontrolliert werden, erneutes Erhitzen bei Nichteinhalten der Grenzwerte. CCP’s bei Rohschinken: keine! pH-Wert und aw-Wert des Rohmaterials sind nicht kontinuierlich zu kontrollieren, man kann keine Grenzwerte definieren, die die Mikroorganismen definitiv abtöten, Kühlung gehört zu den allgemeinen Hygienemaßnahmen 45. Was versteht man unter einer nachteiligen Beeinflussung von Lebensmitteln? nach §2, Nr.2 LMHV: „nachteilige Beeinflussung = eine Ekel erregende oder sonstige Beeinträchtigung der einwandfreien hygienischen Beschaffenheit von Lebensmitteln, wie durch Mikroorganismen, Verunreinigungen, Witterungseinflüsse, Gerüche, Temperaturen, Gase, Dämpfe, Rauch, Aerosole, tierische Schädlinge, menschliche und tierische Ausscheidungen sowie durch Abfälle, Abwässer, Reinigungs- und Desinfektions-, Pflanzenschutz- und Schädlingsbekämpfungsmittel oder ungeeignete Behandlungs- und Zubereitungsverfahren…“ 46. Für welche Lebensmittelbetriebe gelten die Bestimmungen der LMHV nicht? Betriebe, die der Lebensmittelgewinnung dienen §1 LMHV, Absatz 1: „Diese VO gilt für die hygienischen Anforderungen an das gewerbsmäßige Herstellen, Behandeln und Inverkehrbringen von LM, mit Ausnahme des Gewinnens von LM.“ Bei §1 LMHV (Geltungsbereich) wird die Direktvermarktung landwirtschaftlicher Produkte miterfasst, nicht jedoch die „Urproduktion“ von Lebensmitteln. Ausgenommen vom Anwendungsbereich des Gesetzes ist außerdem der häusliche und private Bereich. 47. Welche Bedeutung haben Sporenbildner für die Lebensmittelhygiene? Nennen Sie einige Spezies als Beispiele! Sporenbildner haben in der LM-Hygiene eine große Bedeutung, da die Sporen durch eine normale Erhitzung nicht abgetötet werden. Unter günstigen Bedingungen können sie später auskeimen und LM-Vergiftungen oder LM-Intoxikationen auslösen. Insbesondere im Rahmen 10 des Warmhaltens von Speisen spielt dies eine wichtige Rolle, wenn die Speisen nicht warm genug (65°C) gehalten werden. Genus Bacillus: grampositiv, Katalase-positiv, stäbchenförmig, hitzeresistente Endosporen, aerobes Wachstum B. anthracis Krankheitserreger (Milzbrand); B. cereus Lebensmittelvergifter (Herstellung v. Enzymen, Nachweis v. Antibiotika); B. subtilis Lebensmittelvergifter, Verderbniserreger (Herst. V. Enzymen, Nachweis v. Anti-/Probiotika); B. licheniformis Lebensmittelvergifter (s.B.subtilis); Geo-B. stearothermophilus Verderbniserreger (Kontrollstamm); B. polymyxa Verderbniserreger; B. thuringiensis Schädlingsbekämpfung Genus Clostridium: grampositiv, Katalase-negativ, stäbchenförmig, Endosporen, anaerobes Wachstum Aktive LM-Verderber: C. sporogenes Bombagen bei Fleischerzeugnissen; C. butyricum & C. sporogenes Spätblähung bei Käse, Bombagen bei pasteurisierten Feinkosterzeugnissen; C. butyricum & C. tyrobutyricum Frucht- & Gemüsekonserven; C. botulinum LMIntoxikationen (Botulismus); 48. Erläutern Sie Toxintypen und klinisches Bild von Bacillus cereus (-Erkrankungen)! Welche Lebensmittel sind häufig involviert? Toxintypen: Diarrhoe-Toxin: Bildungsort Darm, Aktivierung der Adenylatcyclase. Hitzelabil, instabil bei 4°C, Aktivitätsverlust bei pH<4, Inaktivierung durch Trypsin Emetisches Toxin: Bildungsort LM, Wirkungsmechanismus ungeklärt, hitzestabil, stabil bei Kühllagerung, stabil bei pH 2-11, keine Inaktivierung durch Trypsin Klinisches Bild: Diarrhoe-Typ: häufiger vorkommend, Inkubationszeit 6-12 Std., wässriger Durchfall, Bauchschmerzen, Bauchkrämpfe, selten Erbrechen, Fieber, Dauer der Symptome: 12-24 Std.; beteiligte LM: Fleisch, Gulasch, Suppen, Pudding, Soßen Erbrechen-Typ: Selten vorkommend, Inkubationszeit 1-5 Std., Erbrechen, selten Durchfall (25%, 15 Min. – 11 Std.), Dauer der Symptome: 6-24 Std., beteiligte LM: nur Reis u. (v.a.) Nudeln 49. Warum ist das Warmhalten von Speisen bei der Gemeinschaftsverpflegung kritisch? Welche Empfehlungen können ausgesprochen werden? Beim Warmhalten von Speisen werden diese häufig auf Temperaturen abgekühlt, bei denen sich pathogene LM-Vergifter anreichern können bzw. Sporen auskeimen können. Deswegen gilt grundsätzlich für das Heißhalten von Speisen: Speisen, die auf Vorrat gekocht werden (Suppen, Saucen, Puddings, Gemüse, Beilagen usw.), sind nach dem Durcherhitzen so rasch wie möglich abzukühlen, wobei der kritische Temperaturbereich (10°C-55°C) so rasch wie möglich durchschritten werden sollte. (Faustregel: Abkühlen auf 10°C in höchstens 90 Min, dann sofortige Kühlung bei 4°C!) Dies kann durch Teilung in kleinere Portionen, Wasserkühlung oder Einbringen in kühle Räume erreicht werden. Heiße Speisen dürfen nur dann in Kühlräume gegeben werden, wenn sicher gestellt ist, dass es nicht zu einem Temperaturanstieg und Kondenswasserbildung kommt. Gekühlte Speisen, die warm gegessen werden, sollten vor dem Verzehr auf mindestens 75°C (Kerntemperatur) für 10 Minuten erhitzt werden. Speisen, die zur Ausgabe warm gehalten werden, sollten mindestens bei 65°C für maximal 2 Std. aufbewahrt werden 11 50. Erläutern Sie die so genannte „Botulinum-Kochung“! D-Wert: Zeit, die erforderlich ist, um eine Bakterienpopulation bei vorgegebener Temperatur auf ein Zehntel ihres Ausgangswertes zu vermindern (C. botulinum = 0,21 min; D121,1) z-Wert: Temperaturerhöhung, die erforderlich ist, um D auf ein Zehntel zu verringern (C. botulinum = 10°C) F-Wert: Summe aller Letaleffekte, die bei 121,1°C im Verlauf einer Minute der Erhitzung einwirken (F=1) Bei bekannten D- und z-Werten lässt sich die zur Inaktivierung einer jeden Mikrobenart angemessene Temperatur-Zeit-Kombination errechnen. Man hat nun als Maß für die Summe aller Letaleffekte, die im Verlauf einer Erhitzung auf eine Mikrobenpopulation einwirken, eine weitere Größe eingeführt, den F-Wert. 1F = Summe aller Letaleffekte, die bei 121, 1°C im Verlauf einer Minute der Erhitzung einwirken. Um die Zeiten zu berechnen, die bei Temp. > oder < 121,1°C erforderlich sind, um eine Wärmemenge zu vermitteln, die 1F äquivalent ist, müsste man einen z-Wert zugrunde legen. Man nimmt hierfür den Wert 10°C (= z-Wert von C. botulinum). Also F = 0,1 bei 111,1°C = Erhitzung muss 10 Minuten dauern! (Absenkung um 1z = D verzehnfacht sich) Soll nun die Ausgangskontamination um 1 Billionstel verringert werden, bedeutet das den 12fachen D-Wert (Merke: „12 D-Konzept in der Konservenindustrie“). Der D-Wert für Cl. botulinum: D121,1 = 0,21 min. (auf Deutsch: Erhitzt man ein Lebensmittel bei 121,1°C für 0,21 Minuten, hat man die Ausgangskontamination mit C. botulinum um 1 Zehntel reduziert) Um nur noch 1 Billionstel der angenommenen Ausgangskontamination zu erreichen, muss man 12 x den D-Wert annehmen, d.h. 12 x D = 12 x 0,21 = ca. 2,5 Minuten (F=2,5). Die Erhitzung von 121,1 °C (gemessen am kältesten Punkt der Konserve) für 2,5 Minuten wird als „Botulinum-Kochung“ bezeichnet. Das zu Grunde liegende Prinzip ist das „12 D-Konzept“. 51. Welche klinischen Erscheinungen werden beim Menschen durch Clostridium botulinum-Intoxikation hervorgerufen und welche C. botulinum-Typen kennen Sie? Welche(r) spielt/spielen bei Fischerzeugnissen eine größere Rolle? Klinische Erscheinungsformen: Klassischer Botulismus durch Aufnahme der im Lebensmittel vorgebildeten Toxine. Tritt ca.12-36 h(4h-4d) nach Aufnahme toxinhaltiger Speisen auf. Symptome sind Müdigkeit, Kopfschmerzen, Übelkeit, Erbrechen, Lähmungserscheinungen (Augen-, Schluck- und Zungenmuskulatur → Seh- und Sprachstörungen, Speichelsekretion), Tod durch Atemlähmung am 3. – 6. Tag. Säuglingsbotulismus nach Besiedelung des Darmes bei Kindern. Hervorgerufen durch Kindernahrung, die mit Honig zubereitet und nicht sofort verbraucht wird. Wundbotulismus bei Bildung der Toxine in Wunden. Botulismus unbekannter Ätiologie bei Erwachsenen ohne erkennbare Wunden Typen: Gruppe I proteolytische Stämme, äußerst hitzeresistente Sporen, Verderb: Bildung zahlreicher sensorisch wahrnehmbarer Fäulnisprodukte (H2S, NH3) Typ A: Gemüse und Fleischkonserven, z.T. Typ B: Fleischerzeugnisse, z.T. Typ F: Fleisch- und Fischerzeugnisse; Gruppe II nicht-proteolytische Stämme (saccharolytisch), Typ E und bestimmte Stämme von Typ B und F, hitzeempfindlicher, können sich aber im Gegenteil zu Gruppe I noch unter 10°C vermehren und Toxin produzieren, geringe Verderbniserscheinungen, z.B. Rohschinken: Vermehrung Typ B bei 8°C, Typ E: Fisch- und Fischerzeugnisse, z.T. Typ B,F: Fleischerzeugnisse; Gruppe III Typ C1, C2 und D, Erkrankungen bei Tieren, Bildung von Toxin C1 und D phagengesteuert, C2 wird erst bei der Sporulation gebildet; Gruppe IV Toxintyp G, bisher nicht bei Mensch und Tier als Botulismuserreger aufgetreten 12 52. In welche Subtypen lassen sich Clostridium perfringens-Stämme unterteilen? Welche(r) davon ist/sind lebensmittelhygienisch von Bedeutung (Begründung)? Cl. perfrigens-Typen: A,B,C,D,E Von Bedeutung für die LM-Hygiene ist v.a. Typ A, selten kommen Typ C und D vor. Cl. perfringens Typ A: Lebensmittelintoxikationen (häufig) Cl. perfringens Typ C: Enteritis necroticans (sporadisch) Cl. perfringens Typ D: Gastroenteritis (sporadisch) Da Typ A ubiquitär (Boden, Staub, Darm) verbreitet ist (andere sind nur Darmbewohner) sind LM-Kontaminationen relativ häufig (Schlachthygiene!). 53. Erläutern Sie Pathogenese und klinische Erscheinung einer Clostridium perfringens Typ A Infektion des Menschen! Wie hoch ist die Dosis infectiosa minima? Pathogenese: Für das Auslösen von LM-Intoxikationen beim Menschen durch Cl.perfringens Typ A ist ein Enterotoxin(CpE) verantwortlich. Das Toxin wird nach Aufnahme der vegetativen Zellen im Dünndarm durch Sporulation gebildet (das Toxin wird nicht direkt mit der Nahrung aufgenommen!). Dann folgt die Bindung von CpE an die Darmwand. Die Folgen: 1. Erhöhte Sekretion von Wasser, Na+- und Cl—Ionen ins Darmlumen 2. Hemmung der Glucoseabsorption 3. Direkte Enterozytenschädigung Klinik: Wässriger Durchfall (seltener Erbrechen) und abdominale Krämpfe, Todesfolgen sind nur in Ausnahmefällen bei älteren und geschwächten Patienten zu verzeichnen. Inkubationszeit: 6 – 12 Std. Krankheitsdauer: 24 – 48 Std. Dosis infectiosa minima: > 106 KbE / g LM 54. Warum haben im LM-Gewerbe beschäftigte Personen nach Aufenthalten in exotischen Urlaubsländern besonderen Grund zur Beachtung der lebensmittelhygienischen Prinzipien? LM werden z.T. weniger hygienisch behandelt als bei uns, LM sind häufiger kontaminiert, LM werden oft vorgekocht und nicht richtig durcherhitzt bzw. bei nicht ausreichender Temperatur warm gehalten; dort kommen Krankheitserreger vor, die wir nicht gewohnt sind, d.h. gegen die wir nicht immun sind. Erregerausscheidung oft auch vor oder noch nach dem Auftreten klinischer Symptome. Häufige Erreger: Shigella dysenteriae, Noroviren, Rotaviren, Hepatitis A- und E-Viren 55. Stellen Sie den Temperaturverlauf in einem Gulasch/einer Erbsensuppe von der Herstellung bis zur Ausgabe am Mittag des folgenden Tages dar, der sicherstellt, dass bakteriell bedingte Lebensmittelinfektionen bei den Konsumenten ausgeschlossen werden können! Unter allen Umständen sollte der Temperaturbereich zwischen 65°C und 15°C so schnell wie möglich durchlaufen werden, d.h. nach der Herstellung schnell (innerhalb von max. 90 Minuten) abkühlen (keine großen Portionen, das dauert zu lange). Die Lagertemperatur über Nacht sollte ≤ 7°C sein. Vor der Ausgabe sollte das LM gut durcherhitzt werden (75°C für 10 Minuten). Bei der Ausgabe sollte eine Temperatur niedriger als 65°C vermieden werden, um ein mikrobielles Wachstum zu verhindern. Aber auch zu langes Warmhalten bei 65-80°C, d.h. länger als 2 Std. ist nicht gut. 13 56. Warum ist eine konsequent praktizierte Händehygiene von so überragender Bedeutung für die Sicherung gesundheitlich unbedenklicher Lebensmittelqualität? Der Mensch ist die Haupteintragsquelle für Keime in LM. Um Gefahren durch Kontakt zwischen LM und Mensch zu minimieren, ist eine konsequente Händehygiene sinnvoll. Staph. aureus kommt auf der menschlichen Haut vor, und auch nach Besuch der sanitären Einrichtungen ist es von herausragender Bedeutung auf eine Handwäsche und –desinfektion zu achten, um eine Kontamination der LM mit Erregern, die fäkal-oral übertragen werden, zu verhindern. 57. Wie muss die Handwascheinrichtung in einer Metzgerei beschaffen sein, um eine Händehygiene praktizieren zu können, die die wirksame Unterbrechung potentieller Infektionsketten (Salmonellen, Virushepatitis A) ermöglicht? Sinngemäß steht in der FlHV Anlage 2 (Kap. I u. II): In den Räumen müssen möglichst nah und in ausreichender Anzahl Einrichtungen zur Reinigung und Desinfektion der Hände mit handwarmem, fließendem Wasser, Reinigungsund Desinfektionsmittel sowie hygienischen Mitteln zum Händetrocknen vorhanden ein. Die Wasserhähne dürfen nicht von Hand zu betätigen sein (Lichtschranke, Knie, …). Ferner müssen Toilettenanlagen mit Handwaschgelegenheiten, die genauso beschaffen sind wie oben genannt, vorhanden sein. Die Einrichtungsgegenstände (Waschbecken) müssen ständig sauber und in einwandfreiem Zustand gehalten werden. Am Ende eines jeden Arbeitstages müssen sie gereinigt und desinfiziert werden. Außerdem müssen diese Einrichtungsgegenstände aus einem korrosionsbeständigem Material (z.B. Alu) bestehen, glatt und leicht zu desinfizieren sein. Handwaschbecken müssen getrennt sein von Einrichtungen zum Reinigen von LM. 58. Welche Risiken verbinden sich im Bereich der Gastronomie/des Partyservice mit dem Angebot kalt-warmer Buffets? Die Gefahren, die in kalt-warmen Buffets lauern, sind vielfältig. Kalte Speisen wie unkonservierte Salate, Feinkost, Rohkost, Aufschnittplatten und Desserts (Tiramisu, …) müssen mindestens 7°C kalt sein. Warme Speisen sollten nicht kälter als 65°C vorgehalten werden. Wird dies nicht eingehalten, können sich bestimmte Keime wie z.B. Salmonellen, andere Enterobacteriaceae, Cl. perfringens Typ A, Staph. aureus u.v.m. im LM vermehren bzw. Sporenbildner auskeimen, was zu LM-Infektionen und LM-Intoxikationen führen kann. Diese Gefahr darf nie unterschätzt werden, denn oft sind die Kühl- bzw. Warmhaltevorrichtungen nur unzureichend. 59. In einer Einrichtung zur Gemeinschaftsverpflegung werden alle Kühlmöbel/räume einmal täglich bezüglich ihrer Funktion geprüft (Vergleich der tatsächlich vorherrschenden Temperatur mit der Sollwertvorgabe) und die gemessenen Temperaturen dokumentiert. Stellt diese Kontrolle die Beherrschung eines CCP’s im Sinne des Codex Alimentarius dar? Nein, denn diese Maßnahmen stellen Tätigkeiten dar, die zur allgemeinen Betriebshygiene bzw. zu den räumlichen und technischen Voraussetzungen zählen. Eine einmal tägliche Kontrolle stellt außerdem kein Monitoring im Sinne des HACCP-Konzeptes dar, weil die Kontrolle kontinuierlich erfolgen sollte. Sie stellt deshalb keine Beherrschung eines CCP dar. 60. Welche rechtsverbindlichen Vorgaben existieren für die Hygieneschulung des Personals im Lebensmittelbereich? Schulungspflicht der Mitarbeiter seit 8. August 1998: § 4 (2) LMHV „Wer Lebensmittel herstellt, behandelt oder in Verkehr bringt, hat im Rahmen betriebseigener Maßnahmen zu gewährleisten, daß Personen, die mit Lebensmitteln umgehen, entsprechend ihrer Tätigkeit 14 und unter Berücksichtigung ihrer Ausbildung in Fragen der Lebensmittelhygiene unterrichtet oder geschult werden.“ LMHV enthält keine näheren Angaben zu Häufigkeit oder Inhalten der Schulung! § 43 (4) IfSG „Personen dürfen gewerbsmäßig die ... Tätigkeit erstmalig nur dann ausüben, wenn sie durch das Gesundheitsamt über die Tätigkeitsverbote nach §42 belehrt wurden... Der Arbeitgeber hat Personen ... nach Aufnahme ihrer Tätigkeit im Weiteren jährlich ... zu belehren. Die Teilnahme an der Belehrung ist zu dokumentieren...” 61. Welche lebensmittelhygienisch relevanten Sachverhalte finden sich im Bundesinfektionsschutzgesetz? §6 namentliche Meldung bei Verdacht/ Erkrankung/ Tod §7 namentliche Meldung bei Erregernachweis §18 Behördlich angeordnete Entseuchungen, Entwesungen, Bekämpfung von Krankheitserreger übertragenden Wirbeltieren §42 Tätigkeits- und Beschäftigungsverbote: beim Herstellen, Behandeln und Inverkehrbringen von LM dürfen Personen mit bestimmten Krankheiten nicht beschäftigt werden §43 Belehrung, Bescheinigung des Gesundheitsamtes: Vor erster Aufnahme einer Tätigkeit im LM-Bereich sind die beschäftigten Personen vom Gesundheitsamt zu belehren, danach jährlich durch den Verantwortlichen 62. Was regelt der §3 der LMHV? § 3 der LMHV (Stand 1997; zuletzt geändert 2001): Allgemeine Hygieneanforderungen: „Lebensmittel dürfen nur so hergestellt, behandelt oder in den Verkehr gebracht werden, daß sie bei Beachtung der im Verkehr erforderlichen Sorgfalt der Gefahr einer nachteiligen Beeinflussung nicht ausgesetzt sind. Sie dürfen dazu nur 1. in Betriebsstätten nach § 2 Nr. 1 a [z.B. Herstellungsbetriebe] unter Einhaltung der Anforderungen von Kapitel 1, 2 und 4 der Anlage oder nach § 2 Nr. 1 b [Marktstände, Automaten etc.] unter Einhaltung der Anforderungen von Kapitel 3 und 4 und 2. unter Einhaltung der Anforderungen von Kapitel 5 der Anlage hergestellt, behandelt oder in den Verkehr gebracht werden.“ Anlage zu § 3 LMHV: Kapitel 1: Anforderungen an Betriebsstätten im Sinne des § 2 Nr. 1 a Kapitel 2: Anforderungen an Räume, Vorrichtungen und Geräte in Betriebsstätten Kapitel 3: Anforderungen an Betriebsstätten im Sinne des § 2 Nr. 1 b (ortsveränderliche oder nichtständige Einrichtungen) Kapitel 4: Kapitel 5: Anforderungen an Gegenstände und Ausrüstungen Anforderungen beim Umgang mit Lebensmitteln und an das Personal 63. Was versteht man unter dem Begriff „risk assessment“ im Lebensmittelbereich? Im Rahmen des HACCP – Konzeptes bedeutet „risk assessment“ die Bewertung mikrobiologischer Risiken und stellt somit die Voraussetzung für die Festlegung eines eventuellen Handlungsbedarfs dar. Nach der Gefahrenidentifizierung (hazard identification) ist die Gefahrenbewertung (risk assessment) der zweite Schritt der Gefahrenanalyse (hazard analysis). Ergebnisse: 1. Abschätzung der Effizienz von Steuerungsmaßnahmen 2. Kosten – Nutzen – Analysen 3. Risikoabschätzung 15 64. Welche Säulen der Hygiene gibt es im Bereich der Lebensmittelproduktion? Das Untermann`sche (Züricher) Haus: Basis: räumliche Voraussetzungen Säulen: Betriebshygiene (Reinigung, Desinfektion, Schädlingsbekämpfung); Personalhygiene (Schutzkleidung, Händehygiene); Produktionshygiene (Trennung von Arbeitsgängen, Temperatur, Luftfeuchtigkeit) Dach: HACCP-Konzept 65. Nennen Sie 3 bedeutsame Schädlinge im Lebensmittelbereich und schildern die spezifischen Bekämpfungsstrategien! Dörrobstmotten: Aussortieren und Vernichten aller befallenen LM, Behandlung der Einrichtungsgegenstände (Reinigung, Langzeitinsektizid), Vernebelung nach Abdecken der Produkte, wöchentliche Kontrolle von Pheromonfallen Fliegen: Fliegengitter an Fenstern/Türen/anderen baulichen Öffnungen; Klebefallen; Insektizide Schaben: Ritzen und Spalten verschließen, Ködergele mit ATPase-Hemmstoffen, Lieferanten überprüfen, permanente Schädlingsüberwachung Nagetiere: Ratten/Mäuse: Verschließen von Löchern; sachgerechte Abfall-Lagerung und Entsorgung; Giftköder (z.B. Cumarinderivate) eng auslegen 66. In welcher Verordnung sind die Schädlingsbekämpfungsmaßnahmen geregelt? LMHV § 3 Allgemeine Hygieneanforderungen Kapitel 5 Nr. 4 der Anlage: „Schädlingsbefall ist durch geeignete Verfahren zu kontrollieren; nach dem Stand der Technik zu bekämpfen“ Gefahrstoffverordnung Anlage V Nr. 6 67. In welchem Regelungswerk ist der Stand der Technik für Schädlingsbekämpfungsmaßnahmen beschrieben? Durchführung von Schädlingsbekämpfungsmaßnahmen beschrieben in der GefahrstoffVerordnung Anhang V Nr. 6 Der Stand der Technik für die Schädlingsbekämpfung findet sich in den Technischen Regeln für Gefahrstoffe (TRGS) 523 68. Was versteht man unter „risk management“ im Lebensmittelbereich? „risk management“ bezeichnet die Diskussion, Bewertung und Anwendung von Präventionsund Kontrollmaßnahmen im Rahmen eines HACCP-Konzeptes. (Dies entspricht in etwa den HACCP-Grundsätzen 2.-7.: Festlegung der CCP’s, critical limits, Monitoring, corrective actions, Verifikation, Dokumentation) 69. Welche Erkrankungen können durch viruskontaminierte Lebensmittel verursacht werden? Enteritis: Noroviren (Caliciviren): akute Gastroenteritis, meist kein Fieber Rotaviren: akute Enteritis, v.a. Kleinkinder; bei Erwachsenen selten, als Reisekrankheit Hepatitis: Hepatitis A (Picornavirus): meist subklinisch, unspez. gastrointestinale Symptome, Organmanifestation mit Ikterus (durch Immunantwort), Lebervergrößerung Hepatitis E (Calicivirus): ähnlich Hepatitis A, in 40-60% aber schwerer 16 70. Wie gelangen Viren in Lebensmittel? primäre Kontamination: z.B. Muscheln: Akkumulation von Viren (Faktor 100) aus Abwasser, v.a. Noroviren sekundäre Kontamination (durch menschliche Ausscheider während der LM-Gewinnung und -Verarbeitung): Lebensmittel, die manuell bearbeitet und anschließend nicht ausreichend erhitzt wurden (z.B. Obst, Gemüse, Salate, Sandwichs, Desserts) tertiäre Kontamination: nach dem Verarbeitungsprozess 71. Welche Methoden werden angewandt, um Viren in Lebensmitteln nachzuweisen? (RT-) PCR, aber kein Nachweis für Infektiosität ELISA, aber Sensitivität gering, antigene Vielfalt (v.a. Noroviren) (Immun-) Elektronenmikroskopie, aber Sensitivität gering Zellkultur, aber Noroviren nicht anzüchtbar, Hepatitis-A-Viren schwierig anzüchtbar Nachweis von coliformen Keimen als Indikatororganismen (Eignung fraglich) => kein routinemäßiger Nachweis in Lebensmitteln 72. Nennen Sie 3 wichtige humanpathogene Viren, bei denen die Übertragung über Lebensmittel eine Rolle spielt! Noroviren = Norwalk-like-Viruses (Caliciviren): Infektion fäkal – oral; akute Gastroenteritis, Übelkeit, Erbrechen, Kopfschmerz, Mattigkeit, meist kein Fieber; Dauer 12-72 h; v.a. YOPIS Rotaviren (Rotaviridae): akute Enteritis, v.a. bei Kleinkindern, bei Erwachsenen als Reisediarrhoe Hepatitis A-Viren (Picornaviren): meist subklinisch, unspez. gastrointestinale Symptome, Organmanifestation mit Ikterus (durch Immunantwort), Lebervergrößerung; besonderes Risiko für Infektion sind Schalentiere (Anreicherung der Viren durch Filterapparat bis zum 100fachen) Hepatitis E (Calicivirus): ähnlich Hepatitis A, aber in 40-60% der Fälle schwerer Verlauf 73. Nennen Sie 3 Gründe, warum die Untersuchung auf coliforme Keime eine geringe Aussagekraft über die virale Belastung von Muscheln hat! Bakterien im Gegensatz zu Viren in der Umwelt vermehrungsfähig; Bakterienbelastung von Muscheln sinkt schneller als virale Belastung; Unterschiedliche Resistenzen gegenüber Umwelteinflüssen; Unterschiedliche Eintragsquellen: relevante Viren humane Fäzes, Coliforme auch Fäzes von warmblütigen Tieren. 74. Warum ist der Nachweis von Viren in Lebensmitteln schwierig? geringe Kontamination niedrige dosis infectiosa minima (< 100 Virionen) hohe Sensitivität erforderlich Noroviren nicht anzüchtbar, Hepatitis A–Viren schwierig anzüchtbar Antigene Vielfalt (v.a. Noroviren) Kein Nachweis für Infektiosität durch PCR 75. Nennen Sie typische Lebensmittelgruppen, die mit humanpathogenen Viren belastet sein können (mit Begründung!)! Muscheln: Akkumulation um Faktor 100, Gewässerverunreinigung mit humanen Fäzes, häufig Muschelanzucht in Flußmündungen, virale Belastung bleibt lange Garnelen und andere Seetiere: aus kontaminierten Gewässern Obst, Gemüse, Salate: manuell bearbeitet und möglicherweise infiziert, danach nicht ausreichend erhitzt oder mit verunreinigtem Wasser gewaschen Sandwichs, Desserts: nicht ausreichend erhitzt 17 76. Nennen Sie 4 Eigenschaften der Noroviren, die ihre Verbreitung bei einer Epidemie begünstigen! geringe Infektionsdosis: < 102 Virionen Tröpfcheninfektion, person-to-personÜbertragung, sekundäre Ausbreitung, Verbreitung durch LM-Händler verlängerte asymptomatische Ausscheidung: < 2 Wochen erhöhtes Risiko für sekundäre Ausbreitung Stabilität in der Umwelt: überlebt < 10 ppm Chlor, Kühl- und Gefrierbehandlung, Dekontamination von Wasser erschwert, Virus überlebt in Eis und gedämpften Austern Große Stammdiversität: verschiedene genetische und antigene Typen erfordert umfangreiche Diagnostik, Reinfektion durch unterschiedliche Antigen-Typen möglich, Prävalenz leicht zu unterschätzen fehlende Langzeitimmunität: Reinfektion möglich Infektionen im Kindesalter schützen nicht vor Erkrankung als Erwachsener, Entwicklung eines Impfstoffs mit lebenslanger Schutzwirkung schwierig 77. Was ist TSE? Nennen Sie die wichtigsten Charakteristika des Erregers! TSE = Transmissible spongiforme Enzephalopathie Es handelt sich bei den Erregern um Prionen: proteinaceous infectious particles keine Nukleinsäure; nicht verdaubar durch Proteinase K; β-Faltblattstruktur; unlöslich; intrazellulär in Neuronen; verursachen Konformationsänderung von zellulären PrP 78. Wie kann man TSE nachweisen? phänotypische, proteinbasierende Verfahren: Immunhistochemie, Western Blot/Immunoblot, ELISA, Gaschromatographie genotypische Verfahren: konventionelle PCR, quantitative PCR (z.B. Kapillarelektrophorese, Real Time PCR) Verdauungsversuch mit Proteinase K Nachweis der Amyloidfibrillen 79. Welche transmissiblen spongiformen Enzephalopathien wurden bislang bei Tieren beschrieben? Scrapie: Schaf, Ziege TME (transmissible Nerz-Enzephalopathie): Zuchtnerze CWD (Chronic Wasting Disease): Mulehirsch, Elch BSE (bovine spongiforme Enzephalopathie): Rinder Spongiforme Enzephalopathie der exotischen Huftiere: Nyala, Oryxantilope, Kudu FSE (feline spongiforme Enzephalopathie): Katzen, Großkatzen 80. Prione – worin unterscheiden sich PrPc von PrPsc? PrP = normales, zelluläres Protein: α-Helix-Struktur, Proteinase K instabil, auf der Neuronenoberfläche, löslich PrPsc = modifiziertes, infektiöses Protein/Prion: β-Faltblatt-Struktur, Proteinase K stabil, intrazellulär in Neuronen, unlöslich c 81. Nennen Sie 2 hereditäre spongiforme Enzephalopathien! FFI (Fatale Familiäre Insomnie): Insomnie = Schlaflosigkeit GSS (Gerstmann-Sträussler-Scheinker-Krankheit) CJK (Creutzfeld-Jakob-Krankheit; familiäre Form) 18 82. Was ist allen prion-bedingten spongiformen Enzephalopathien gemeinsam (2 Charakteristika)? fortschreitende, bilateral symmetrische, nichtentzündliche Zerstörung der grauen Substanz des ZNS, die sich mikroskopisch als spongiöse Veränderungen darstellen astrozytäre Gliose und elektronenmikroskopisch darstellbare Scrapie-assoziierten Fibrillen (SAF = Aggregationen aus PrPSc) 83. In welchen 3 Formen kann die Creutzfeld-Jakob-Krankheit auftreten? familiäre Form: vererbbar iatrogene Form: übertragbar sporadische Form: weder a) noch b) kommen als Ursache in Betracht (vCJK= neue Variante der CJK mit anderem Krankheitsbild: deutlich jüngere Patienten, längerer Krankheitsverlauf, für CJD untypische Amyloidablagerungen im Gehirn, 19 Fälle von 20 traten in GB auf) 84. Welche pathohistologischen Differentialdiagnosen gibt es zu spongiformen Enzephalopathien? postmortale Autolyse; Hirnödem (Vakuolen in der Glia); Artefakte (falsche Probenbehandlung, mangelnde Entfettung); Hypoxie, Intoxikationen; angeborene Veränderungen, Hypoplasie; beim Rind in bestimmten Bereichen (Ncl. Ruber) physiologisch 85. Nennen Sie die Ursachen und Manifestationen von DFD! Die Bezeichnung kommt von dark, firm, dry. Dieser Defekt tritt selten bei Schweinen und öfter bei Rindern (meist Mastbullen) auf. Der Mechanismus für die Entstehung ist ähnlich wie für PSE-Fleisch mit dem Unterschied, dass hier das Lactat während dem Transport gebildet und noch abtransportiert und über den Urin ausgeschieden wird. Dadurch ist bei der Schlachtung ermüdungsbedingt kaum noch Glykogen im Muskel vorhanden und es kommt nur zu einer ungenügenden Säuerung. Der End-pH-Wert ist zu hoch (>6,2) 1. Das Fleisch erscheint dunkel 2. Die Haltbarkeit ist durch den hohen pH-Wert verringert 3. Das Fleisch ist von leimiger Konsistenz 4. Das Fleisch zeigt ein hohes Wasserbindungsvermögen 5. Göfo-Wert: über 75 6. Keine Säuerung, da Laktatbildung ungenügend 86. Nennen Sie die Ursachen und Manifestationen von PSE! Genetisch bedingte Streßanfälligkeit (Defekt im Ryanodin-Rezeptor), gesteigerte Calziumfreisetzung insuffizienter Muskelstoffwechsel langes Intervall zwischen Betäubung und Schlachtung Belastung vor der Schlachtung starke MuskelKatecholaminsekretion kontraktionen Betäubung, Hängen während dem Entbluten 1. Das Fleisch erscheint hell 2. Die Haltbarkeit ist durch die nasse Oberfläche evtl. verringert 3. Das Fleisch wird beim Erhitzen zäh und schrumpft stark 4. Das Fleisch zeigt einen Verlust des Wasserbindungsvermögens 5. starke und überstürzte Säuerung, da Laktatakkumulation schon vor der Schlachtung 19 87. Charakterisieren Sie den Einfluss des Geschlechts auf die Fleischqualität bei Rind und Schwein! Ochsen: umgänglicher im Handling, tgl. Zunahme nicht so gut; neigen zur Verfettung, d.h. Futterverwertung schlechter; intramuskuläres Fett d.h. Fleischqualität besser, aber heute verlangt der Verbraucher zunehmend Magerfleisch. Färsen: wie Ochsen; Schlachtgewicht ca.10% geringer Bullen: intensivere Fütterung; höheres Endgewicht; schnellere Zunahme; entspricht wegen dem höheren Magerfleischanteil eher dem Wunsch des Verbrauchers Eber (kastriert): fetter als Sauen, Kastration in den ersten 4 Wochen, um dem Ebergeruch des Fleisches vorzubeugen. Mast am besten getrenntgeschlechtlich, da die männlichen Tiere schneller verfetten. Eber (nicht kastriert): magerer als Sauen 88. Nennen Sie die Verlaufsformen (gewichtet nach der Häufigkeit), Diagnosen und Erreger bei der Salmonellose beim Rind! Klinisch inapparente Ausscheidung; chronischer Verlauf; Akute Enterokolitis ohne/mit Störung des Allgemeinbefindens; Septikämie mit Endotoxämie, Fieber, Tachykardie, Injektion der Episkleren, subsklerale Blutungen, Anorexie, Mattheit, Dyspnoe, Milchrückgang Erreger: S. Typhimurium (über 80 %), S. Dublin, S. Enteritidis 89. Nennen Sie die Verlaufsformen (gewichtet nach der Häufigkeit), Diagnosen und Erreger bei der Salmonellose beim Schwein! Klinisch inapparent/subklinisch: 2-5% aller Schweine in Deutschland Enterokolitis: v.a. S. typhimurium (70%) Akute Septikämie durch S. Cholerasuis 90. Weshalb wurden in Deutschland vor allem Milchaustauscher für die Verbreitung des BSE-Erregers verantwortlich gemacht? In Deutschland nahm man an, dass der BSE-Erreger auch über tierische Fette übertragen werde. Diese befinden sich auch in Milchaustauschern als Ersatz für das Milchfett. Wiederkäuer wurden in Deutschland ansonsten kaum mit Tierkörpermehl ernährt, was als Hauptübertragungsweg in Großbritannien angesehen wird. Außerdem wird Tierkörpermehl in Deutschland nach einem als sicher angesehenen Verfahren hergestellt. 91. Welches sind die 6 wichtigsten klinischen Symptome bei Rindern mit BSE? gestörtes Sensorium, Ängstlichkeit, Nervosität, Muskelzittern, Leistungsrückgang, Aggressivität 1. 2. 3. 4. 92. Welche Maßnahmen beinhaltet der spezielle Untersuchungsgang auf BSE nach BRAUN? klinische u. neurologische Untersuchung Verhalten beobachten Bewegung: Führen über Kotgraben, Führen durch die Stallöffnung, Führen auf dem Hof, Freilaufen auf der Weide Sensibilität: Manipulationen an Kopf und Hals mit Hand und Kugelschreiber, Reaktion auf Lärm ( klatschen), Reaktion auf Licht (Taschenlampe im Dunklen anmachen ), Besenprobe (gegen Hinterfüsse) 20 93. Welche Beziehungen bestehen zwischen der BSE-Prävalenz und der diagnostischen Aussagekraft (Validität) der klinischen Befunde? Klinische Symptome haben bei hoher Prävalenz einen hohen prädiktiven Wert, bei der tatsächlichen niedrigen Prävalenz jedoch nur einen niedrigen prädiktiven Wert. 94. Welche Erkrankungen sind beim Rind zu BSE differentialdiagnostisch in Betracht zu ziehen? Weidetetanie; nervöse Ketose; hypocalcämische Gebärparese; traumatisch bedingtes Festliegen (Brüche, Muskelabrisse, ...); Weaver-Syndrom (progressive, degenerative Myeloenzephalopathie, autosomal-rezessiv vererbt); Bleivergiftung; Neuromykotoxikosen; Hirn-Listeriose; Tollwut; AK; Botulismus; Chlamydien-bedingte sporadische HirnRückenmarks-Entzündung; Borna; Zeckenenzephalitis; Hepatoenzephales Syndrom; andere Hirnhautentzündungen 95. Was versteht man unter einer „Kohortenkeulung“? Abweichend von der Keulung aller Rinder in einem Betrieb, aus dem ein BSE-positives Rind stammt, kann auch die Keulung von Geburts- und Fütterungskohorte angeordnet werden. Zusätzlich werden bei weiblichen Tieren immer auch die Nachkommen gekeult. Geburtskohorte: alle Rinder, die zwölf Monate vor oder nach dem erkrankten Tier in dem Bestand geboren wurden Fütterungskohorte: Rinder, die bis zum 12. Lebensmonat zu irgendeinem Zeitpunkt mit dem erkrankten Tier aufgezogen wurden und möglicherweise das gleiche Futter aufgenommen haben 96. Wodurch wird die Bekämpfung der Salmonellose beim Rind geregelt? VO zum Schutz gegen die Salmonellose des Rindes, basierend auf dem Tierseuchengesetz 97. Welches sind die beiden häufigsten Salmonellenserovare beim Rind? Salmonella enterica subsp. enterica ser. dublin und typhimurium In Lebensmitteln kommt immer mehr Salmonella ent. sub. ent. ser. enteritidis vor. 98. Welche Faktoren beeinflussen den Verlauf einer Salmonelleninfektion beim Rind? Stressfaktoren, die die Immunitätslage des Tieres beeinflussen (Transport, Trächtigkeit, Geburt, andere Infektionen, Parasitosen [besonders Leberegel]). Weitere Faktoren sind das Alter des Tieres (mit zunehmendem Alter nimmt die Schwere der Erkrankung i.A. ab) und die Erreger-Spezies (an die Tierart angepasste Arten lösen i.A. schwerere Krankheitsverläufe aus als nicht-angepasste Arten). 99. Nennen Sie 5 Möglichkeiten, wie Salmonellen in einen Rinderbestand eingeschleppt werden können! Kontaminierte Düngung der Weiden, Infektion der Futtermittel (Fischmehl), Verschleppung durch Vögel, Zukauf infizierter Tiere, Tränke mit kontaminiertem Wasser (Fluß/Bach) 100. Welches sind die 4 wichtigsten Verlaufsformen der Salmonelleninfektion beim Rind? akut, chronisch, septikämisch, latent (als Dauerausscheider) 101. Welches sind häufige Symptome bei Rindern mit akuter Salmonellose? Fieber, Diarrhoe mit Blut und Fibrinfetzen, Inappetenz, Leistungsabfall, angestrengte Atmung, Tod nach 5-7 Tagen 21 102. Welche Faktoren können bei latent infizierten Rindern zur Salmonellenausscheidung mit oder ohne Durchfälle führen? Stressfaktoren (Transport, Trächtigkeit, Geburt, andere Infektionen, Leberegelbefall) 103. Welche Symptome finden sich bei Rindern mit chronischer Darmentzündung bedingt durch eine Salmonelleninfektion? Abort bei trächtigen Tieren, selten Arthritis, Tendovaginitis, Mastitis, Diarrhoe, sinkender Appetit 104. Nennen Sie 5 vorbeugende Maßnahmen zur Verminderung von Salmonelleninfektionen in Rinderbeständen! frühzeitige Diagnosesicherung; Quarantäne neu zugekaufter Tiere; regelmässige Reinigung und Desinfektion; Orale Immunisierung von Jungtieren und Muttertieren; Dekontamination der Futtermittel (Pelletierung, Schutz vor Vögeln); Desinfektion von Dung und Gülle; Tiere nur mit unkontaminiertem Wasser tränken 105. Welchen Stellenwert hat die Infektion des Menschen über direkten Kontakt mit Salmonellen-ausscheidenden Rindern im Gesamtkomplex der humanen Salmonellose? Sehr geringer Stellenwert, da fast nur Infektionen durch kontaminierte Nahrungsmittel (insbesondere Eier und Hähnchenfleisch) und unsauberes Arbeiten in der Küche erfolgen 106. Definieren Sie die Begriffe „Sensorik“ und „Organoleptik“! Sensorik ist der Einsatz menschlicher Sinnesorgane zu Prüf- und Messzwecken (§35 LMBG) durch geschulte Personen (objektiv) Anforderungen an den Prüfer: Kenntnisse über das zu prüfende LM und dessen Technologie; Fähigkeiten (physische und psychische Eignung), sensorische Eindrücke zu erfassen und Wiederzugeben; Kenntnisse auf dem Gebiet der Sensorik; Erfahrung in der sensorischen Beurteilung von LM Organoleptik ist dagegen das subjektive Urteil über Sinneseindrücke durch ungeschulte Personen. 107. Welche Untergruppen zählen bei sensorischen Untersuchungen zu den „haptischen Eindrücken“? haptische Eindrücke = Empfindungen der Hände bzw. Zunge/Mundhöhle/Rachen, an denen keine Geschmacksreize beteiligt sind taktile + kinästhetische Eindrücke taktile Eindrücke: sind statisch (Berührungseindrücke, z.B. Oberflächenbeschaffenheit (rauh, glatt,...)); kinästhetische Eindrücke: sind dynamisch (durch Hand-/Kaubewegungen entstandene Eindrücke, z.B. Knacken von Bockwurst, Crunchen von Chips) 108. Nennen Sie 5 wichtige sensorische Prüfmethoden nach der Amtlichen Sammlung gemäß §35 des LMBG! bewertende Prüfung mit Skale-Prüfverfahren: zuvor festgelegte Merkmale von Produkten werden anhand einer Skala bewertet, so prüft die DLG Rangordnungsprüfung: verschiedene Ausführungen eines Produkts werden in eine Reihenfolge gebracht einfach beschreibende Prüfung: wertneutrale Begriffe bei der Beschreibung verwenden Dreiecksprüfung: geringe Unterschiede zwischen 2 Proben müssen festgestellt werden Schwellenprüfung: Bestimmung der persönlichen Geschmacksempfindlichkeit einer Person, Auswahl und Schulung von sensorischen Prüfern 22 109. Definieren Sie die Begriffe „Aroma“ und „Flavour“! Aroma = olfaktorische+gustatorische Eindrücke; olfaktorisch: nasaler und retronasaler Geruch (durch Lösung von Stoffen beim Kauen); gustatorisch: Geschmack (süß/sauer/salzig/ bitter/umami) Flavour = olfaktorische+gustatorische+temperaturbedingte+chemästhetische+haptische Eindrücke; chemästhetisch: trigeminal (z.B. Kältegefühl bei Menthol, Zusammenziehen bei Säure, stechend); haptisch: taktile+kinästhetische Eindrücke 110. Was ist bei sensorischen Prüfungen unter „Neutralisation“ zu verstehen? Nennen Sie Beispiele! Nach jeder Probe müssen die in den Geschmacksknospen verbeliebenden Stoffe „ausgespült“ werden, damit die folgende Probe korrekt (ohne Nachgeschmack der vorigen Probe) bewertet werden kann. Zur „Nullung“ oder Neutralisation der Geschmackszellen dient z.B. geschmacksarmes salzarmes Weißbrot, salzarmes Wasser, schwach aromatisierter schwarzer Tee oder geschmacksarmer Alkohol (Schnaps: neutralisiert, löst in der Mundhöhle verbliebenes Fett und regt die Durchblutung an). Nach einigen Proben sollte eine Pause eingelegt werden. 111. Erklären Sie kurz das Prinzip der sensorischen Prüfung der DLGQualitätswettbewerbe für Fleischerzeugnisse! Fleischerzeugnisse werden unterteilt in verschiedene Kategorien (Rohwurst, Brühwurste, Kochwürste, Fertiggerichte,...) und getrennt geprüft mit jeweils an die Kategorie angepaßtem Prüfschema. Es gibt immer die 4 Merkmalsbereiche: Äußeres, Zustand des Behältnisses (Faktor x 1) Konsistenz (Faktor x 2) Aussehen, Farbe, Farbhaltung, Zusammensetzung (Faktor x 3) Geruch und Geschmack (Faktor x 4) Für jeden Merkmalsbereich wird eine Gesamtpunktzahl berechnet (von 0-5), die je nach Merkmalsbereich nochmal mit einem Faktor zwischen 1 und 4 gewichtet wird. Aus der Summe der gewichteten Bewertungen wird dann durch die Formel: Summe der gewichteten Bewertungen = Summe der Gewichtungsfaktoren 10 = Qualitätszahl die Qualitätszahl errechnet. Es wird der Mittelwert aus den Bewertungen der Prüfer gebildet bzw. die Prüfer müssen sich auf eine Bewertung einigen. Für eine Qualitätszahl 5,00 (Maximalpunktzahl) erhält das Produkt den goldenen DLG-Preis, für 4,50-4,99 den silbernen und für 4,00-4,49 den bronzenen DLG-Preis. 112. Skizzieren Sie Lage und Aufbau einer Geschmacksknospe! Epithelzellen Geschm ac ksporus Sinneszelle Basalzellen Stützzellen Syna psen 23 113. Welche Geschmacksqualitäten gibt es und wie ist das Erregungsmuster? salzig: Na-Ionen dringen durch Ionenkanäle in Sinneszelle, Verringerung des Spannungsgefälles an der Außenmembran der Zelle, Depolarisation, Ca-Ionen strömen in Zelle, Neurotransmitter werden durch Ca abgegeben, Neurotransmitter werden von benachbarten Nervenzellfortsätzen aufgenommen, Weiterleitung an Gehirn, Öffnung von KKanälen an Sinneszelle, Repolarisation sauer: H-Ionen dringen in Sinneszelle, blockieren K-Kanäle und lagern an Kanäle, wodurch mehr positiv geladene Ionen eindringen, Depolarisation, Ca-Ausschüttung, Abgabe Neurotransmitter süß: Bindung an G-Protein-gekoppelte Rezeptoren (Gustducine), Aktivierung eines benachbarten Enzyms, welches Vorläufermolekül in sekundären Botenstoff umwandelt, Botenstoff schließt K-Kanäle, Auslösung weiterer Abläufe bitter: Erregung über G-Protein-gekoppelte Rezeptoren und sekundäre Botenstoffe, Botenstoffe setzen Ca aus ER frei, Depolarisation, Ca-Efflux, Ausschüttung neuronaler Botenstoffe Aminosäuren („Umami“): Bindung an G-Protein-gekoppelte Rezeptoren, Aktivierung sekundärer Botenstoffe, unklarer Mechanismus bis zur Ausschüttung von Neurotransmittern 114. Skizzieren Sie den Verlauf der Geschmacksbahn! Ze n tra le G esc hm a c ksb a h n Nc l. Sa liva torius sup . & in f. G l. Pte ryg o p a la tin um N. Lin g ua lis G l. Oticu m G l. Ge nic uli Ba hn zu d e n m im isc he n & Sc h lu c k-/Ka um u ske ln VII IX Sü ß Sa lzig Sa ue r Ch ord a tym p a n i X Nc l. Tra c tus so lita rii VII Bitte r 2/3 der Nervenfasern verlaufen im N. lingualis(VII) -> durch Chorda tympani -> über Ganglion geniculi -> zum Nucleus tractus solitarii; 1/3 im N. glossopharyngeus (IX) -> zum Nc. tractus solitarii; von dort über die zentrale Geschmacksbahn ins Großhirn (Fuß der Gyrus postzentralis, Insel); außerdem gehen vom Nc. tractus solitarii aus Bahnen zum Nc. salivatorius und zu den mimischen, der Schluck- und der Kaumuskulatur 115. Rinderfinnenbandwurm – Charakterisieren Sie kurz den Erreger (Infektionsstadien, Vorkommen)! Adulte: Taenia saginata im Endwirt (Mensch) Finne: Cysticercus bovis: im Zwischenwirt (Rind) Zyklus: Adulte (6-12m) im oberen Dünndarm des Msch. Abgabe von beweglichen Proglottiden (in jeder Proglottide ca. 250.000 Eier, können mehrere Monate überleben) orale Aufnahme durch Rd. (Kontamination der Weiden durch menschliche Faeces/ Kläranlagenschlamm) Oncosphäre bohrt sich aus Dünndarm aus Transport übers Blut in die Muskulatur (Skelettmuskulatur + Herz), nach ca. 14 Wochen hat er sich zu infektiösen Cysticercus entwickelt (Rd. symptomlos) orale Aufnahem durch Msch., wenn er rohes oder ungenügend gegartes Fleisch ißt; Vorkommen: in Entwicklungsländern Prävalenz Msch. 20%, Schlachttiere 30-60%, bei uns Prävalenz Schlachttiere < 1% 24 116. Trichinella spp. – Stellen Sie kurz Epidemiologie und Entwicklungszyklus dar! Wirtsspektrum (breit): Schwein, Mensch, Pferd, Sumpfbieber, Braunbär, Nager etc. Besonderheit: Endwirt kann auch Zwischenwirt sein Zyklus: Adulte (1-3mm) im Dünndarm des Endwirt Kopulation Larvenproduktion (W sind vivpar) L1 wandern aus Darm aus über die Lymphe ins Blut, Transport in die Muskulatur Eindringen in Muskelzelle diese werden zu Ammenzellen, das Streckstadium geht in ein Aufrollstadium über. Die Larve wird abgekapselt und kann > 25 Jahre überleben der ZW infiziert sich durch orale Aufnahme von rohem bzw. unzureichend erhitztem Fleisch (oder über frischen Kot) im Magen wird die Kapsel durch Verdauung aufgelöst, die L1 wird frei und dringt in die Darmschleimhaut ein innerhalb von 36 Std. erfolgen 4 Häutungen, die Adulten kehren ins Darmlumen zurück und erreichen nach 5-6 Tagen die Fertilität. Vorkommen in D: bei Hausschw. zuletzt 1994 3 Fälle, bei Wildschw. jährlich ca. 13 Fälle, beim Msch. 0-10 Fälle/Jahr (v.a. Importerkrankungen) in letzter Zeit v.a. nach Verzehr von Pferdefleisch (Infektionsweg beim Pfd. noch unklar); häufiges Vorkommen in Nord/Mittelamerika, Argentinien, Ostafrika, Südostasien; Abtöten der Larven nur durch ausreichende Erhitzung oder ausreichend lange Kältebehandlung (min. -15 °C) möglich (nur bei Kältebehandlung darf die Trichinellenuntersuchung entfallen); Pökeln, Trocknen, Räuchern tötet die Larven nicht sicher ab. 117. Trichinellose des Menschen – Charakterisieren Sie das klinische Bild, Diagnose und Therapie! Infektion durch orale Aufnahme von nicht/ungenügend erhitztem Fleisch von Schw./Pfd. Mindestinfektionsdosis: ca. 70 Larven Inkubationszeit: 5-14 Tage klinische Symptome beim Msch.: oft asymptomatischer Verlauf bei stärkerem Befall: nach 2-7 Tagen: enterale Phase: Durchfall, abdominale Schmerzen; nach 1 Woche: Migrationsphase: Fieber, Schüttelfrost, Myalgien, periorbitale Ödeme, außerdem können allergische Exantheme und Petechien auftreten; bestimmte Manifestationen können zum Tod führen: Mypharditis, Encephalitis, Bronchopneumonie, Sepsis, Niereninsuffizienz mögliche Spätfolge: fokale neurologische Symptome durch im ZNS enkapsulierte Larven bei Überleben der akuten Phase Abnehmen der Symptome nach 2-3 Wochen; pro Jahr treten beim Msch. ca. 0-10 Fälle auf, meist als Importerkrankung Diagnose: Anamnese + Klinik + Labor Labor: Muskelenzymerhöhung; Eosinophilie (v.a. in der Anfangsphase); AK-Nachweis (ELISA, Immunoblot); Parasitennachweis in venösem Blut oder in MuskelbiopsieQuetschpräparaten; PCR Therapie: Benzimidazole (Mebendazol, Albendazol); wirken auf intestinale Stadien, nicht sicher auf enzystierte Larven; symptomatische Therapie mit Antipyretika und Analgetika, bei schweren Erkrankungen Glucokortkoide 118. Toxoplasma gondii – Beschreiben Sie die Epidemiologie der Toxoplasmose! Infektion des Endwirtes (Feliden): Infektion mit sporulierten Oozysten führt zur extraintestinalen Entwicklung: Auswandern der Sporozoiten ins Blut Befall aller kernhaltiger Zellen Bildung von Endozoiten/ Tachyzoiten sekundär Einwandern von Tachyzoiten ins Darmepithel und Bildung von Oozysten 25 Infektion mit Gewebszysten (Bradyzoiten) führt zur intestinalen Entwicklung: Mehrfachschizogonien im Epithel des Dünndarms Hohe Teilungsrate Bildung von Tachyzoiten Gamogonie unter Druck des Immunsystems Bildung von Oozysten Ausscheidung Infektion des Zwischenwirtes (alle warmblütigen Lebewesen): Infektion mit sporulierten Oozysten oder Gewebszysten anderer Zwischenwirte führt zur extraintestinalen Entwicklung: Auswandern der Sporozoiten ins Blut Befall aller kernhaltigen Zellen Entwicklung dünnwandiger Zysten mit sich langsam entwickelnden Merozoiten (Bradyzoiten) Durchseuchungsgrad in Deutschland: sehr hoch mit regionalen Schwankungen. Die angeborene Form beim Menschen ist meldepflichtig nach IfSG. 119. Toxoplasmose des Menschen – Krankheitsbild und Verlauf beim Menschen! asymptomatischer Verlauf: häufigste Form, führt nicht zur Erkrankung. akuter-subakuter Verlauf: Lymphknotenschwellung, Lymphadenitis besonders am Hals, uncharakteristisch Fieber, Angina, grippeähnliche Symptome, bei schweren Fällen Kopfschmerz, Meningoenzephalitis chronischer Verlauf: selten, schubweise Fieber, evtl. Gelenkbeschwerden, Kopfschmerzen, psychische Alterationen, Organmanifestation in Lnn, Leber, Milz, Auge (Iridozyklitis, Chorioretinitis), ZNS Schwangerschaft: Abort; Frühgeburten; Mißbildungen (Hydrocephalus, Chorioretinitis, Verkalkungen im Gehirn, Ikterus, Splenohepatomegalie) 120. Erläutern Sie die Untersuchungsvorschriften für Finnen laut Fleischhygieneverordnung! FlHV Anl. 1 Kap II: über 6 Wochen alte Rinder, in Gattern gehaltenes Schalenwild mit Ausnahme von Wildschweinen: äußere Kaumuskeln nach zwei Anschnitten parallel zum Unterkiefer (bei nicht-enthäuteten Köpfen von Kälbern kann auf äußere Kaumuskeln verzichtet werden, falls keine Finnen im restlichen Fleisch und das Kalb aus registriertem Betrieb ist); innere Kaumuskeln nach einem Anschnitt; Zunge: Schnitt in Unterzungenmuskulatur, Durchtasten der Zunge; Herz: Längsschnitt zur Eröffnung der Kammern und Durchtrennen der Kammerscheidewand sowie ein weiterer Schnitt von Herzohren zur Herzspitze; Besichtigung des Zwerchfells nach Lösung der serösen Überzüge Kälber unter 6 Wochen: Längsschnitt durch das Herz (Öffnung der Kammer, Durchtrennung der Scheidewand); Durchtasten der Zunge; Besichtigung des Zwerchfells Schweine: Besichtigung der Zunge; Längsschnitt durch das Herz; Besichtigung des Zwerchfells; Zusatzuntersuchung: Freigelegte Muskelflächen, insbesondere an Schenkeln, Zwerchfellpfeilern, Zwischenrippenmuskeln, Herz, Zunge, Kehlkopfmuskulatur und falls erforderlich, die Bauchwand und die vom Fettgewebe befreite Lendenmuskulatur besichtigen Schaf/Ziege: wie Kälber unter 6 Wochen, Herzschnitt jedoch nur im Zweifelsfall Pferd: Besichtigung der Zunge; Längsschnitt durch das Herz; Besichtigung des Zwerchfells 121. Erläutern Sie die rechtliche Beurteilung bei Finnenbefall bei Rind, Schwein und Wildwiederkäuer! Welche Finnen werden bei diesen Spezies hauptsächlich gefunden? Schwachfinnige Rinder und Schweine (bis 10 Finnen je geschlachtetem Tier) [FlHV Anl. 1 Kap. IV Nr. 3.1]: tauglich nach Brauchbarmachung (Kältebehandlung nach Anlage 6 Nr. 2) Ausnahme Leber, Milz, Magen, Darm, Gehirn, RM, Euter und Fett, sofern finnenfrei, sowie die von Weichteilen befreiten Knochen 26 Starkfinnige Rinder und Schweine [FlHV Anl. 1 Kap. IV Nr. 7.4]: untauglich (ebenfalls untauglich sind schwachfinnige Rinder und Schweine, falls nicht brauchbar gemacht) Rind: Cysticercus bovis (Taenia saginata); Schwein: Cysticercus cellulosae (Taenia solium); Wildwiederkäuer: Cysticercus cervi (Taenia cervi) 122. Erläutern Sie die fleischhygienerechtliche Beurteilung folgender Befunde bei der Fleischuntersuchung: Hepatitis interstitialis parasitaria multiplex chronica, Fasciola hepatica, Echinococcus hydatidosus! Hepatitis interstitialis parasitaria multiplex chronica: Leber: viele Narben: untauglich nach FlHV Anl. 1 Kap. IV Nr. 9; wenige Narben: tauglich nach Entfernung, siehe auch FlHV Anl. 1 Kap. IV Nr. 11.12 Tierkörper: tauglich nach FlHV Anl. 1 Kap. IV Nr. 2.2 (Veränderungen auf Teile beschränkt und Krankheitserreger in den unveränderten Teilen nicht zu erwarten) Fasciola hepatica: Leber: untauglich nach FlHV Anl. 1 Kap IV Nr. 9 Tierkörper: tauglich nach FlHV Anl. 1 Kap. IV Nr. 2.2 Echinococcus hydatidosus: Alle zystenhaltigen Organe: untauglich nach FlHV Anl. 1 Kap IV Nr. 9 Tierkörper: tauglich nach FlHV Anl. 1 Kap. IV Nr. 2.2 123. Bei welchen Tieren muss eine Trichinellenuntersuchung vorgenommen werden und wo ist die entsprechende Vorschrift zu finden? Erläutern Sie eventuelle Ausnahmen! [FlHG § 1 (3)]: Schweine und Einhufer, deren Fleisch zum Genuß des Menschen verwendet werden soll; Wildschweine, Bären, Füchse, Sumpfbiber, Dachse und andere fleischfressende Tiere, die Träger von Trichinen sein können, wenn das Fleisch zum Genuß für Menschen verwendet werden soll. Ausnahmen: Keine Untersuchung notwendig, bei Hausschweinen, Einhufern und Sumpfbibern, wenn das Fleisch einer zugelassenen Kältebehandlung unter Aufsicht der zuständigen Behörde unterzogen worden ist. Keine Ausnahmen für wildlebende Tiere, weil sie andere (kälteresistentere) Trichinellen als T. spiralis beherbergen können. 124. Welche Probennahmestellen sind laut Fleischhygieneverordnung bei den verschiedenen Tierarten für die Untersuchung auf Trichinellen vorgeschrieben? Wie wird verfahren, wenn diese Stellen nicht mehr vorhanden sind? Untersuchungsstellen [FlHV Anl. 1 Kap III Nr. 1.2] Hausschwein: mind. 1 g Zwerchfellpfeiler Einhufer: mind. 5 g Zungen- oder Kaumuskulatur Sumpfbiber: mind. 1 g Zwerchfellpfeiler Rest: mind. 0,5 g Unterarmmusk. + mind. 1 g Zwerchfellmusk. Falls Stellen nicht mehr vorhanden [FlHV Anl. 1 Kap III Nr. 1.3]: Doppelte Anzahl gleichgewichtiger Proben von Stellen, an denen Skelettmuskulatur in sehnige Teile übergeht. Beim Einhufer, soweit möglich, aus der Zwerchfellmuskulatur 125. Unter welchen Voraussetzungen kann zur Untersuchung auf Trichinellen die „Kompressoriumsmethode“ angewendet werden? Zulassung durch Behörde notwendig: AVVFlH Kap IV Nr. 1.6.: "Die zuständige Behörde kann bei Hausschweinen im Einzelfall die trichinoskopische oder mikroskopische Untersuchung von Quetschpräparaten nach Nr. 1.6 zulassen" [....] 27 "Bei Wildschweinen kann die zuständige Behörde im Einzelfall die trichinoskopische oder mikroskopische Untersuchung von Quetschpräparaten nach Nr. 1.6 dann zulassen, wenn die Abgabe des Fleisches nach § 10 Abs.7 FlHV* erfolgt." *§ 10 Abs. 7 FlHV: Abgabe einzelner Tierkörper 1. unmittelbar oder auf einem nahengelegenen Wochenmarkt (nicht Reisegewerbe oder Versandhandel) an Verbraucher 2. an nahegelegene be- oder verarbeitende Betriebe zur Abgabe an Verbraucher zum Verzehr an Ort und Stelle und an Einzelhandelsgeschäfte zur Abgabe an Verbraucher zur Verwendung im eigenen Haushalt kleine Mengen an frischem Fleisch an einzelne natürliche Personen zum eigenen Verbrauch. 126. Welche fleischhygienerechtliche Beurteilung wird bei Nachweis von Trichinellen ausgesprochen? Wie häufig werden in der BRD Trichinellen beim Schwein nachgewiesen? Untauglich! FlHV Anl. 6 Nr. 3: Brauchbarmachung von Fleisch zur Befreiung von der Untersuchung auf Trichinen (Kältebehandlung), gilt aber nicht, wenn bei einer Untersuchung Trichinellenlarven gefunden wurden! Bei Hausschweinen sind zuletzt 1994 3 Fälle aufgetreten, bei Wildschweinen werden jährlich ca.13 Fälle festgestellt, beim Mensch jährlich 0-10 Fälle (hauptsächlich Importerkrankungen). In Deutschland werden im Schnitt 1 Tier pro 30 Mio. Schlachtschweinen gefunden. 127. Erklären Sie den Begriff „Hürdenkonzept“ und nennen Sie zwei typische Lebensmittel! Die Vermehrung von Mikroorganismen wird durch verschiedene Faktoren gehemmt, die nacheinander oder gleichzeitig in einem LM auftreten: Temperatur, aw-Wert, pH-Wert, Eh-Wert, Konservierungsstoffe, Konkurrenzflora, Strahlen „Hürden“ für Mikroorganismen Kombination: Hürdeneffekt/Hürdenkonzept Hürdentechnologie Traditionelle Fleischerzeugnisse: Rohwurst (Nitrit Eh-Wert Konkurrenzflora pH-Wert aw-Wert) Rohschinken ( pH-Wert Kühltemperatur aw-Wert) 128. Erklären Sie das Hürdenkonzept am Beispiel der Rohwurst! Nitrit durch Mikroorganismen-Vermehrung Reduktion des Eh-Wertes Konkurrenzflora durch Vermehrung der Laktobazillen Senkung des pH-Wertes durch Trocknung sinkt langsam der aw-Wert 129. Was sind „shelf-stable products”? Wie werden sie eingeteilt und welchen Vorteil haben sie? Definition: Erzeugnisse, die durch gezielten Einsatz der Hürdentechnologie in einem hermetisch geschlossenen Behältnis nur mild erhitzt werden müssen und trotzdem ohne Kühlung haltbar sind. Unterscheidung nach aw-SSP, F-SSP und pH-SSP, je nachdem welche Hürde für die mikrobiologische Stabilität von entscheidender Bedeutung ist. 130. Nennen und erläutern Sie 4 „intrinsic factors“! Faktoren, die vom LM selbst ausgehen und die Haltbarkeit beeinflussen. Die dem LM innewohnenden physikalischen, chemischen bzw. biochemischen Eigenschaften aw-Wert: (activity of water, frei verfügbares Wasser) Maß für das ungebundene Wasser eines Lebensmittels, das den Mikroorganismen für die Vermehrung zur Verfügung steht. Mikroorganismen benötigen für ihre Vermehrung frei verfügbares Wasser, es gibt empfindlichere und unempfindlichere Keime, unter 0,7 erlischt jegliche Aktivität von Mikroorganismen 28 pH-Wert: Die Mikrorganismen tolerieren für Sie extreme pH-Werte nur bei sonst optimalen Bedingungen. Grampositive Keime sind resistenter als gramnegative. Eh-Wert: (Redoxpotential, Sauerstoffverfügbarkeit) Mikroorganismen sind aerob, mikroaerophil oder anaerob und können sich nur in entsprechendem Milieu vermehren; Maß für den Grad der Oxidation in einem LM Inhaltsstoffe und Struktur der Lebensmittel 131. Was ist der aw-Wert, welche Formel liegt ihm zugrunde und welche Werte kann er annehmen? Maß für das ungebundene Wasser eines LM, das den Mikroorganismen für die Vermehrung zur Verfügung steht aw = Wasserdampfdruck des LM/Dampfdruck des destillierten Wassers relative Feuchte (%) = aw-Wert x 100 Allgemein gilt: aw-Wert >0,96 leicht verderbliche LM (Brühwurst); 0,95-0,92 mittelgradig verderbliche LM (Kochwurst); <0,85 kaum verderbliche LM (Rohwurst) 132. Was ist der Eh-Wert und in welcher Einheit wird er angegeben? In welcher Hinsicht beeinflusst er die Vermehrung von Mikroorganismen und welche Mikroorganismen können sich in Lebensmitteln mit negativem Eh-Wert besonders vermehren? Der Eh-Wert gehört zu den “intrinsic factors“. Er ist das Redoxpotential oder Sauerstoffverfügbarkeit und wird in mV gemessen. Das Wachstum der Mikroorganismen beeinflusst er in der Hinsicht, dass er vorgibt, ob ein aerobes, mikroaerophiles oder anaerobes Keimspektrum wächst. Bei negativem Eh-Wert vermehren sich besonders gut die anaeroben (Clostridium botulinum) und fakultativ anaeroben Keime (Salmonella spp. und Campylobacter spp.) 133. Was sind „extrinsic factors“ und welche Faktoren gehören hierzu? = äußere Faktoren, die die Haltbarkeit von Lebensmitteln beeinflussen Temperatur: Mikroorganismen können auf Grund ihres Vermehrungsverhaltens bei unterschiedlichen Temperaturen in Gruppen klassifiziert werden termophil, mesophil, psychrophil, psychrotroph Atmosphärische Einflüsse: Luftfeuchte, Partialdruck von Gasen 134. Was sind „implicit parameters“? = Wechselwirkungen zwischen Mikroorganismen Wachstumsrate ist abhängig von den Lebensbedingungen, d.h. von „intrinsic“ und „extrinsic factors“, sowie von „process factors“ durch die Be- und Verarbeitung. Zwischen den Mikroorganismen gibt es Synergismen, Antagonismen und Kommensalismus. Synergismus bedeutet einen gegenseitigen positiven Einfluß zweier verschiedener Mikrobenpopulationen zu deren beider Vorteil; Antagonismus bedeutet einen gegenseitigen negativen Einfluß auf eine oder beide Arten der Mikroorganismen; Kommensalismus bedeutet weder ein negativer noch ein positiver Einfluß für die eine oder die andere Art 135. Erläutern Sie das Prinzip eines BSE-Schnelltests! 1. Immunoblotting-Test auf der Grundlage eines Western-Blotting-Verfahrens. Er dient zum Nachweis des proteaseresistenten Fragments PrPSc 2. Chemolumineszenz-ELISA auf der Grundlage eines verstärkten Chemolumineszenz Reagens 3. Immunoassay (Sandwich-ELISA) zum PrPSc-Nachweis - Bsp. des Immunblotting-Tests: Es bestehen 5 verschiedene Schritte: 29 1. Auftrennung der Proteine mittels Elektrophorese (z.B. Gelelektrophorese) nach ihrer elektrischen Ladung und Größe 2. Transfer der aufgetrennten Proteine auf eine Membran (z.B. Nitrocellulose) 3. Absättigung der freien Proteinbindungsstellen (z.B. bovines Serumalbumin) 4. Inkubation mit Antikörpern, die gegen das Antigen gerichtet sind und mit markierenden Enzymen konjugiert sind (z.B. Peroxidase) 5. Visualisierung der Antikörperreaktion (Inkubation eines Substrates, dass mit dem Enzym eine Lichtreaktion auslöst) 136. Welche Risikokategorien existieren gemäß WHO bezüglich der relativen Infektiosität von Rindergeweben? Geben Sie für alle Kategorien jeweils 2 Beispiele an! Hohe Infektiosität: Gehirn, Augen, Rückenmark Mittlere Infektiosität: Milz, Mandeln, Darm, Lymphknoten, Rückenmarksflüssigkeit, Hirnanhangsdrüse Geringe Infektiosität: periphere Nerven, Nasenschleimhaut, Thymus, Knochenmark, Leber, Lunge, Bauchspeicheldrüse Kein nachgewiesene Infektiosität: Skelettmuskulatur, Herz, Milchdrüse, Milch, Niere, Blutserum, Knorpelgewebe, Haare, Haut, Fettgewebe, Bindegewebe, Kot, Speicheldrüse, Speichel, Eierstöcke, Hoden 137. Welche beiden Serovare werden am häufigsten bei Salmonelleninfektionen des Menschen nachgewiesen? Wie lautet deren korrekte vollständige taxonomische Bezeichnung? Salmonella enterica subsp. enterica serovar enteritidis Salmonella enterica subsp. enterica serovar typhimurium 138. Welches Salmonellenserovar wird am häufigsten bei Konsumeiern gefunden, welches auf Rotfleisch und welches auf Geflügelfleisch? Konsumeier: S. Enteritidis (57,7%) Rotfleisch: S. Typhimurium (45,3%) Geflügelfleisch: S. Enteritidis (25,1%) 139. Erläutern Sie die Nachweisverfahren von Salmonellen gemäß der amtlichen Sammlung von Untersuchungsverfahren nach § 35 des LMBG! Voranreicherung: gepuffertes Peptonwasser Selektive Anreicherung: RV(S)-Bouillon Rappaport-Vassiliadis-Anreicherungsbouillon (mit Sojamehlpepton) Magnesium-Malachitgrün-Medium, sehr selektiv; pH 5,2 SC-Bouillon Selenit-Cystin-Bouillon (wird demnächst ersetzt durch TT-Bouillon) Selenit hemmt Wachstum coliformer Bakterien und Enterokokken; pH 7,0 TT-Bouillon Tetrathionat-Anreicherungsbouillon nach MÜLLER-KAUFFMANN Tetrathionat hemmt Coliforme und andere Darmbakterien; pH 7,6 Isolierung (aus der Anreicherung auf Selektivagar) BPLS Brillantgrün-Phenolrot-Lactose-Saccharose-Agar Nährboden enthält Laktose, deren Abbau zu Säure durch einen Farbumschlag des pH Indikators Phenolrot nach Gelb angezeigt wird; Nährboden ist im basischen Bereich tiefrot (Salmonellen: Laktose-negativ); Brillantgrün hemmt grampositive Begleitflora weitgehend; Salmonellen: blassrosa durchsichtige Kolonien mit rotem Hof; E. coli, Enterobacter u.a.: gelbgrün, opak, mit gelbgrünem Hof 30 XLT 4 Xylose-Lysin-Tergitol 4-Agar Detergens Tergitol 4 wirkt als Inhibitor; Differenzierung von anderen Enterobacteriaceae auf Basis der Kohlenhydratfermentierung, Lysindecarboxylierung (Salmonellen +) und Schwefelwasserstoffproduktion (Salmonellen +); pH-Indikator Phenolrot; Salmonellen: Schwarzfärbung im Zentrum mit gelbem Hof, H2S-negative Stämme: rosafarbene Kolonien Citrobacter, Enterobacteriaceae u.a.: gelbe Kolonien Rambach-Agar: Natriumdesoxycholat hemmt grampositive Begleitflora, Abgrenzung von anderen Enterobacteriaceae aufgrund von Metabolisierung von Propylenglykol und der Bildung und Aktivität von ß-Galaktosidase demnächst (voraussichtlich in 2004) wird als 1. Selektivmedium der XLD-Agar vorgeschrieben (Xylose-Lysin-Desoxycholat-Agar) s. Frage 140 serologische Identifizierung: nach Ausschluss selbstagglutinierender Stämme werden Einzelkolonien von Reinkulturen auf einfachem Nähragar durch Agglutination mit omnivalentem Salmonella-Antiserum serologisch bestätigt. Agglutinierende Isolate werden zur endgültigen Bestimmung und weitergehenden Feintypisierung (Faktorenseren) z.B. dem BfR, Berlin zugesandt Biochemische Identifizierung: z.B. mit api 10 S, ein standardisiertes System zur Identifizierung von Enterobacteriaceae und anderer einfacher gramnegativer Stäbchen mit Hilfe von 12 (z.B. api 10 S) oder auch mehr biochemischen Reaktionen (Salmonellen-BunteReihe) 140. Nachweis von Salmonellen: Erläutern Sie das Funktionsprinzip des BPLSund XLD-Agars! BPLS Brillantgrün-Phenolrot-Lactose-Saccharose-Agar Nährboden enthält Laktose, deren Abbau zu Säure durch einen Farbumschlag des pHIndikators Phenolrot nach Gelb angezeigt wird; Nährboden ist im basischen Bereich tiefrot (Salmonellen: Laktose-negativ); Brillantgrün hemmt grampositive Begleitflora weitgehend; Salmonellen: blassrosa durchsichtige Kolonien mit rotem Hof; E. coli, Enterobacter u.a.: gelbgrün, opak, mit gelbgrünem Hof XLD-Agar: Xylose-Lysin-Desoxycholat-Agar Abbau von Xylose, Lactose und Saccharose zu Säure Farbumschlag des Phenolrots zu gelb Thiosulfat & Eisen(III)salz zeigen H2S-Bildung durch Ausfällung schwarzen Eisensulfids in den Kolonien; Mikroorganismen, welche Lysin zu Cadaverin decarboxylieren erkennt man an einer purpurroten Farbe um die Kolonien infolge einer Erhöhung des pH-Wertes; Agar unbebrütet = klar & rot; Bebrütung 48 Std. bei 37°C Also wichtiger Unterschied BPLS & XLD XLD zeigt H2S-Bildung an, deshalb ist er beim Nachweis von Salmonellen wesentlich selektiver & aus diesem Grund auch als zweiter Agar beim Salmonellennachweis vorgeschrieben 141. Nachweis von Salmonellen: Erläutern Sie die Bedeutung von Voranreicherung und selektiver Anreicherung! Voranreicherung: gepuffertes Peptonwasser, subletal geschädigte Organismen werden gestärkt; Selektivmedien würden sie noch nicht überstehen Selektive Anreicherung: nach „Erholung“ der MO durch die Voranreicherung RV(S)-Bouillon Rappaport-Vassiliadis-Anreicherungsbouillon (mit Sojamehlpepton) Magnesium-Malachitgrün-Medium, sehr selektiv; pH 5,2 SC-Bouillon Selenit-Cystin-Bouillon (wird demnächst ersetzt durch TT-Bouillon) Selenit hemmt Wachstum coliformer Bakterien und Enterokokken; pH 7,0 TT-Bouillon Tetrathionat-Anreicherungsbouillon nach MÜLLER-KAUFFMANN Tetrathionat hemmt Coliforme und andere Darmbakterien; pH 7,6 31 142. Erläutern Sie die Vorschriften zum Einsatz elektrischer Treibhilfen auf dem Schlachthof! laut TierSchlV § 5 (2): „Treibhilfen dürfen nur zum Leiten der Tiere verwendet werden. Die Anwendung elektrischer Treibgeräte ist verboten. Abweichend von Satz 2 ist die Anwendung von elektrischen Treibgeräten bei gesunden und nicht verletzten über ein Jahr alten Rindern und über vier Monate alten Schweinen, die die Fortbewegung im Bereich der Vereinzelung vor oder während des unmittelbaren Zutriebs zur Fixationseinrichtung verweigern, zulässig. Sie dürfen nur insoweit und in solchen Abständen angewendet werden, wie dies zum Treiben der Tiere unerlässlich ist; dabei müssen die Tiere Raum zum Ausweichen haben. Stromstöße dürfen nur auf der Hinterbeinmuskulatur und mit einem Gerät verabreicht werden, das aufgrund seiner Bauart die einzelnen Stromstöße automatisch auf höchstens zwei Sekunden begrenzt.“ 143. Welche Vorschriften hinsichtlich Tränke, Fütterung und Melken gelten für Schlachtvieh auf dem Schlachthof, das nicht sofort der Schlachtung zugeführt wird? nach TierSchlV § 7 (2): „Tiere, die nach ihrer Ankunft nicht sofort der Schlachtung zugeführt werden, sind 1. mit jederzeit zugänglichem Wasser in ausreichender Qualität zu versorgen und 2. mit geeignetem Futter zu versorgen, wenn die Tiere nicht innerhalb von sechs Stunden nach der Anlieferung der Schlachtung zugeführt werden.“… nach TierSchlV § 8 (3): „Milchgebende Tiere, die nach ihrer Ankunft nicht sofort der Schlachtung zugeführt werden, ist unter Berücksichtigung des Zeitpunktes des letzten Melkens in Abständen von höchstens 15 Stunden unter Vermeidung von Schmerzen die Milch zu entziehen.“ 144. Wie hoch ist die erlaubte Höchstdauer zwischen Betäuben und Entbluten bei der Bolzenschussbetäubung des Rindes bzw. der Elektrobetäubung des Schweins? nach TierSchlV Anlage 2 zu § 13 Abs. 3: Bolzenschuss bei Rindern: 60 Sekunden; Elektrobetäubung warmblütiger Tiere: 10 Sek. bei Liegendentblutung, 20 Sek. bei Entblutung im Hängen 145. Welche Betäubungs- und Tötungsverfahren sind für Rinder, welche für Schweine erlaubt? laut TierSchlV Anlage 3 zu § 13 Abs. 6: Rinder: Bolzenschuss, Kugelschuss zur Nottötung, elektrische Durchströmung, Verabreichen eines Stoffes mit Betäubungseffekt Schweine: Bolzenschuss zur Nottötung und bei Hausschlachtungen, Kugelschuss zur Nottötung, elektrische Durchströmung, Kohlendioxidexposition, Kopfschlag zur Betäubung bei bis zu 10 kg KGW, Verabreichung eines Stoffes mit Betäubungseffekt 146. Welche Betäubungs- und Tötungsverfahren sind für Schafe und Ziegen erlaubt? laut TierSchlV Anlage 3 nach § 13 Abs. 6: Bolzenschuss, Kugelschuss zur Nottötung, elektrische Durchströmung, Kopfschlag (Schafe bis 30 kg KGW, Ziegen bis 10 kg KGW), Verabreichung eines Stoffes mit Betäubungseffekt 32 147. Wie lange muss die vorgeschriebene Stromstärke bei der Elektrobetäubung mindestens gehalten werden, welche Körperteile müssen durchströmt werden? laut TierSchlV Anlage 3 Teil II: Besondere Maßgaben, 3. elektrische Durchströmung, 3.2: „Außer bei der Hochvoltbetäubung muss diese Stromstärke mindestens vier Sekunden lang gehalten werden. Werden Schweine zur Betäubung nicht einzeln ruhiggestellt, so soll die Stromflusszeit verdoppelt werden.“ 3.3: „bei Rindern über sechs Monate und bei Tötungen ohne Blutentzug muss im Anschluss an die Betäubung durch eine mindestens acht Sekunden andauernde elektrische Herzdurchströmung ein Herzstillstand hervorgerufen werden. Abweichend von Satz 1 kann bei Hausgeflügel eine Ganzkörperdurchströmung durchgeführt werden.“ 3.4: „Bei der Betäubung oder Tötung von Hausgeflügel im Wasserbad … mindestens eine Stromflusszeit nach … möglich sein.“ (Truthuhn 4/10 Sekunden [Tötung mit/ohne Blutentzug]; Ente, Gans 6/15 Sek.; Haushuhn 4/10 Sek.; Wachtel 4/10 Sek.) 148. Kohlendioxidbetäubung: Für welche Tierart ist sie erlaubt, welche CO2Konzentration muss eingesetzt werden, wie lange müssen die Tiere darin verbleiben? erlaubt nach Anlage 3 zu § 13 Abs. 6 TierSchlV für Schweine, Puten, Eintagsküken, Salmoniden; Konzentration und Dauer nach Anlage 3, Teil II, 4. Kohlendioxidexposition 4.1: Die zum Betäuben von Schweinen eingesetzte Kohlendioxidkonzentration muss am ersten Halt und am letzten Halt vor dem Auswurf in einer Kohlendioxidbetäubungsanlage in Kopfhöhe der Tiere mindestens 80% betragen; 4.3: zur Betäubung mindestens 100 Sekunden, zur Tötung ohne Blutentzug mind. 10 Minuten 4.9: Hausgeflügel einschließlich Eintagsküken darf durch Kohlendioxid nur getötet werden, indem die Tiere eingebracht werden in eine Gasatmosphäre mit einer Kohlendioxidkonzentration von mind. 80 Vol%, die aus einer Quelle 100%igen Kohlendioxids erzeugt wird und darin bis zum Eintritt ihres Todes, mindestens jedoch 10 Minuten, verbleiben. 149. Welche Handelsklassen für Schweinehälften kennen Sie, auf welchen Kriterien beruht die Einteilung, welche rechtlichen Grundlagen gelten hierfür? Zielsetzung nach §1 (1) Handelsklassengesetz: übersichtlicher Handel, objektive Kriterien für die Bezahlung, übersichtliche, nach dem Schlachtwert gestufte Notierung, Förderung der Qualität; Die Qualitätskontrollen für Schweinefleisch beruhen auf der VO über gesetzliche Handelsklassen für Schweinehälften. Die Einstufung nach Handelsklassen erfolgt bei Schweinen nach Muskelfleischanteilen, zu deren Ermittlung Ultraschall- und Sondengeräte eingesetzt werden. Betriebe mit einer Schlachtung bis zu 200 Schweinen wöchentlich können das so genannte Zwei-Punkte-Verfahren anwenden; Das Handelsklassensystem gilt für den Gewichtsbereich von 50kg bis einschließlich 120kg. Von diesem Gewichtsbereich sind Schlachtkörper von vollfleischigen und anderen Sauen, sowie Schlachtkörper von Ebern und Altschneidern ausgenommen Handelklassen und deren Merkmale E = 55% und mehr U = 50% und mehr, jedoch weniger als 55% R = 45% und mehr, jedoch weniger als 50% O = 40% und mehr, jedoch weniger als 45% P = weniger als 45% M1,M2 = Schlachtkörper von vollfleischigen (M1) und anderen Sauen (M2) V = Schlachtkörper von Ebern und Altschneidern 33 150. Nennen Sie 3 Verfahren zur Ermittlung des Muskelfleischanteils von Schweinehälften! Fat-O-Meter = pistolenähnliche Sonde mit Lichtgeber und Fotozelle, PC-Terminal zur Dateneingabe und Drucker; Muskelfleisch und Fettgewebe reflektieren das ausgesandte Licht unterschiedlich; vorgeschriebene Messstellen nach Anl. 3 HkVO Schlachtkörper-Klassifizierungsgerät = Messpistole mit Potentiometer, Messschablone, Messstab und Ablesemarkierung und PC-Terminal; Erfasst die Messwerte im Schinkenbereich: Lendenspeckdicke über dem M. glutaeus medius (an der dünnsten Stelle), Schinkenbreite an der stärksten Stelle, Taillenbreite an der schwächsten Stelle, Schinkenwinkel in Abweichungsgraden zur Waagerechten Zwei-Punkte-Verfahren: Messwerte können mit einfachen Geräten (Lineal, Schublehre) oder geeigneten elektronischen Messgeräten erfasst werden; vorgeschriebene Messstellen nach Anl. 4 HkVO 151. Welche Kategorien und Handelsklassen für Rindfleisch kennen Sie? Kategorieneinteilung: KA = Kalbfleisch, Zweihälftengewicht JR = Jungrindfleisch, bis 3 Jahre JB/A = Jungbullenfleisch; Kriterium: Verknöcherungsgrad der Dornfortsatzkappen B/C = Bullenfleisch; beeinflusst durch Rasse, Haltung, Fütterung (und Kastration) D = Kuhfleisch E = Färsenfleisch Handelsklassen: E = vorzüglich U = sehr gut R = gut O = mittel P = gering Fettgewebeklassen: 1 = sehr gering 2 = gering 3 = mittel 4 = stark 5 = sehr stark 152. Pseudomonaden als Verderbniserreger: Schildern Sie Bedeutung, Vorkommen, Temperaturanforderungen sowie typische stoffliche Umsetzungen! Pseudomonaden: gramnegative, gerade oder gekrümmte, bewegliche (polare Begeißelung), strikt aerobe Stäbchen; Katalase-positiv, überwiegend Cytochromoxidase-positiv; Vermehrung bei Temperaturen von 4°C bis 43°C; Gattung Pseudomonas: untere Wachstumstemperatur -5°C; Minimaler aw-Wert 0,98/0,95 und minimaler pH-Wert 5,3 Psychrotrophe Vertreter: Pseudomonas fluorescens, Pseudomonas fragi; ubiquitäre Keime, bevorzugtes Vorkommen an „feuchte Stellen“, Vermehrung bei Kühlschranktemperaturen (psychrotrophe Mikroorganismen), überwiegend lipolytische und proteolytische Aktivität, unterschiedliche Pigmentbildung (Fluorescein, Pyocyanin, Pyorubin) kann zur Verfärbung von LM führen, bedeutendster Verderbniserreger für alle vom Tier stammenden LM 153. Welche Bedeutung haben Laktobazillen für die Lebensmittelhygiene? Laktobazillen: grampositive, mikroaerophile bis anaerobe Stäbchen ohne Sporenbildung, Katalase- und Cytochromoxidase-negativ; Unterteilung der Gattung in obligat homofermentative, obligat heterofermentative und fakultativ heterofermentative Laktobazillen 34 Optimaltemperatur zwischen 30-40°C; optimaler pH-Wert 5,5-6,2; minimaler aw-Wert 0,90 und minimaler pH-Wert 3,0; Vorkommen am häufigsten auf der Oberfläche von Pflanzen; physiologische Flora von Mundhöhle, Darmtrakt und Scheide; Verwendung in der Lebensmittel verarbeitenden Industrie aufgrund aktiver Säurebildung und der damit verbundenen konservierenden Wirkung; Lactobacillus curvatus und Lactobacillus sake sind besonders gut an das Fleischmilieu angepasst; Wichtige Mikroorganismen bei der Rohwurstreifung (u.a. Lactobacillus plantarum); Hauptverderbniserreger vakuumverpackter Fleischerzeugnisse Nachteilige Eigenschaften sind u.a. Grünfärbung von Fleischerzeugnissen, Geschmacksbeeinträchtigung bei Brüh-, Kochwurst und Räucherwaren 154. Nennen Sie 3 typische Beispiele für nicht-mikrobiellen Verderb! Verderb durch originäre Enzyme: Alterungsprozess Eier wegen Erschlaffung der Chalazeen, Fettverderb, stickige Reifung des Fleisches Verderb durch physiologische Ursachen: Ebergeruch, bebrütete Eier Verderb durch chemisch-physikalische Ursachen: Rückstandsbildung, Übertragung von Fremdgeruch, technologische Fehler, mechanische Einwirkung, Vorhandensein von Fremdkörpern 155. Wie sind verdorbene Lebensmittel lebensmittelrechtlich zu beurteilen (Begründung)? Das LMBG in Verbindung mit der VO (EG) 178/2002 ist die horizontale Basisnorm §8 LMBG §17 LMBG §17 (1), Nr. 1 LMBG: „Es ist verboten, zum Verzehr nicht geeignete LM (…) gewerbsmäßig in den Verkehr zu bringen“ §17 (1) Nr. 2b LMBG: „Es ist verboten (…) LM, die hinsichtlich ihrer Beschaffenheit von der Verkehrsauffassung abweichen und dadurch in ihrem Wert, insbesondere in ihrem Nähr- oder Genusswert oder in ihrer Brauchbarkeit nicht unerheblich gemindert sind (…) ohne ausreichende Kenntlichmachung gewerbsmäßig in den Verkehr zu bringen“ 156. Schildern Sie die Nährstoff- bzw. Milieuanforderungen von S. aureus hinsichtlich Wachstum und Toxinbildung! keine großen Nährstoffansprüche; begünstigend: hoher Eiweiß- und Wassergehalt, mittlere bis warme Temperaturen (Toxinbildung zwischen 6,7°C und 45,5°C möglich, Wachstum noch bei einem aw-Wert von 0,86, Toxinproduktion bis 0,89); hohe Säuretoleranz (optimaler pH-Wert 6,5-7,3; in Experimenten aber Bildung von SEC bis pH 4,0); gewerbeübliche Salzund Pökelstoffkonzentrationen hemmen Toxinbildung nicht (allerdings abhängig von reichlicher Sauerstoffzufuhr); Vermehrung auch unter Sauerstoffausschluss, jedoch keine Toxinproduktion 157. Schildern Sie das typische klinische Bild einer S. aureus-Intoxikation (Inkubationszeit, Symptome, Dauer, Letalität)! Inkubationszeit: 2-4 Std. Symptome: Übelkeit, Erbrechen, Durchfall, Kreislaufsymptome bis zum Schock, sehr häufige Durchfälle führen zu Exsikkose (Blut und Schleim im Stuhl), häufig Untertemperatur Dauer: normalerweise nicht länger als 24 Std. Todesfälle selten (Gefahr allerdings bei seuchenhaften Staphylokokken-Enteritiden bei Säuglingen Minimale Infektionsdosis: 105 bis 106 KbE/g oder ml 35 158. Ab welchem S. aureus-Gehalt in Lebensmitteln kann eine Gesundheitsgefahr gegeben sein, wieso ist der Begriff „minimale Infektionsdosis“ in diesem Zusammenhang nicht anwendbar? Keimzahlen von > 106/g begründen starken Verdacht (hier Toxinproduktion, aber nur unter bestimmten Milieubedingungen), beweisend für die Gesundheitsschädlichkeit einer Probe ist aber allein der direkte Toxinnachweis. Nicht völlig inaktiviertes Toxin (im Rahmen der Erhitzung des LM) kann sich in LM innerhalb von 24 Std. bei 25°C zumindest teilweise rekonstruieren. Auch wenn die Keimzahl sehr gering ist, kann sie ausreichend für die Toxinbildung sein. Ist Toxin vorhanden, bleibt es auch noch intakt, wenn die Keime bereits abgetötet sind. Insofern ist es nicht möglich eine minimale Infektionsdosis festzusetzen, da selbst, wenn diese theoretisch unterschritten würde, das noch nicht hieße, dass das LM gesundheitlich unbedenklich wäre, da Toxin vorhanden sein kann. SEA wirkt ab einer Dosis von 1 μg emetisch, SEB ab einer Dosis von 20-25 μg. 159. Welcher Kontaminationsweg ist typisch für S. aureus in Lebensmitteln, welcher weitere Hygienefehler ermöglicht dann das Zustandekommen von S. aureus-Lebensmittelintoxikationen? 2 Vorraussetzungen: Kontamination des LM: intravitale Infektion (toxinhaltige Milch), i.d.R. aber Staphylokokken tragender Mensch, der LM direkt oder indirekt kontaminiert (mangelnde Küchen-/ Arbeitshygiene); Vermehrung des Erregers: häufig kontaminierte LM fertige Fleischgerichte, Pasteten, gekochter Schinken, Milch und –Erzeugnisse, Eiprodukte, eihaltige Zubereitungen, Salate, Cremes u.a. Weiterer Hygienefehler: nach Erhitzung des LM keine sachgerechte Abkühlung, Stehenlassen bei Raumtemperatur; Prädisponierend sind Produkte, die erst nach einer antimikrobiellen Behandlung mit S. aureus kontaminiert werden, da sich die S. aureus wegen des Fehlens einer kompetitiven Begleitflora mit ihrer eigentlich niedrigen Wachstumsrate ungehemmt vermehren können und bald die für die Toxinproduktion kritische Zahl erreichen 160. Koagulase-positive Staphylokokken und S. aureus: Grenzen Sie beide Begriffe voneinander ab und erläutern Sie deren Bedeutung bzw. Entstehungsweise! Die Koagulasereaktion ist ein Hilfsmittel zur Speziesdifferenzierung innerhalb der Gattung Staphylokokkus. Das von manchen Arten gebildete Enzym Koagulase enthält Fibrinogenrezeptoren und kann eine Verklumpung von Kaninchen-Blutplasma auslösen. Koagulase ist ein Virulenzfaktor! Man unterscheidet hinsichtlich des Vorhandenseins oder Fehlens in Koagulase-positive Staphylokokken (pathogen, Krankheitserreger oder Lebensmittelvergifter, z.B. S. aureus oder S. intermedius) und Koagulase-negative Staphylokokken (i.d.R. apathogen, aber immer stärkere Rolle bei Hospitalismus; z.B. S. epidermidis). Staph. aureus ist eine Staphylokokken-Art und gehört zu den Koagulasepositiven Staphylokokken. Der Gattungsname kommt von der oft traubenförmigen Anordnung der Bakterien unterm Mikroskop, der Artname (aurum, lat.: Gold) beschreibt die goldgelbe Pigmentierung der Kolonien auf der Agarplatte (nicht bei allen Stämmen). 161. Welche Toxine rufen das klinische Bild der S. aureusLebensmittelintoxikation hervor, nach welchem Prinzip werden sie bezeichnet, welches ist das häufigste? klinisches Bild durch : SEA, SED, SEB, SEC (daneben noch SEF Toxic Shock Syndrome) Prinzip: S = Staphylococcus, E = Enterotoxin, Buchstabe A, B, C, …= nach Zeit der Entdeckung häufigstes Toxin ist SEA 36 162. Erläutern Sie Zweck und Aussagekraft des Thermonukleasenachweises in Zusammenhang mit S. aureus! Thermonuklease ist ein thermostabiles extrazelluläres Protein, bei dessen Nachweis auf eine Mindestkeimzahl von 105 bis 107/g od. ml geschlossen werden kann; Nachweisgrenze liegt bei 0,1-1 ng/g; Hohe Spezifität für S. aureus (mit wenigen Ausnahmen serologisch abgrenzbar); der Thermonukleasenachweis dient als Screening-Test und wird bei einer unspezifisch-positiven Reaktion des ELISA hinzugezogen. Thermonuklease befindet sich i.d.R. in allen Substraten, in denen sich toxinbildende S. aureus vermehrt haben. Falschpositive Ergebnisse sind selten. 163. In aufgeschnittenem Kochschinken wird S. aureus in einer Konzentration von 10 hoch 8 KbE/g nachgewiesen. Wie würden Sie dieses Lebensmittel lebensmittelrechtlich beurteilen? Keimzahlen > 106 /g sind verdächtig, wenn auch nicht beweisend für eine Toxinproduktion der S. aureus. Eine feste Höchstgrenze für das Vorkommen von Koagulase-positiven Staphylokokken gibt es nur bei Hackfleisch. Da aber Kochschinken zum bestimmungsgemäßen Gebrauch nicht mehr erhitzt werden muss und selbst eine Erhitzung das Enterotoxin nicht sicher abtötet, muss das Lebensmittel als potentiell gesundheitsschädlich eingestuft werden. Es ist damit nach §8 LMBG nicht verkehrsfähig. 164. Was versteht man unter Fang-Fischerei und Aquakultur? Aquakultur: die Bewirtschaftung von aquatischen Organismen und zwar Fischen, Weichtieren, Krebsen und Wasserpflanzen. Bewirtschaftung setzt einen gewissen Eingriff in den Aufzuchtprozess voraus, um die Produktion zu fördern, wie regelmäßigen Besatz, Fütterung, Schutz vor Räubern etc. (Definition laut WHO). Aquakultur ist ein Teil der Meereskunde und läßt sich in die Bereiche Marikultur (Salzwasser) und Limnokultur (Süßwasser) unterteilen. Fang-Fischerei: weltweiter Fischfang aus Meer, Seen und fließenden Gewässer; hier erfolgt die Abschöpfung der unter natürlichen Bedingungen gewachsenen Fische 165. Wo wird das Lebensmittel Fisch gewonnen mit einer kurzen Beschreibung der Haltungsmethoden? Binnenfischerei: Fluss- und Seenfischerei regionale Vermarktung Aquakultur: Karpfenteichanlagen: Naturnahrung und Beifütterung, 3-jähriger Umtrieb, Hälterung in Frischwasser vor der Schlachtung, hauptsächlich Lebendvermarktung Forellenteiche, Fliesswasseranlagen: hochintensive Fliesskanalanlagen, reine Pelletfütterung, Astaxantin- oder Cantaxantin-haltiges Futter für Rotfleischigkeit (Lachsforelle), vereinzelt noch Lebendvermarktung, meist geschlachtet auf Eis ganz oder filettiert, Betäubung durch abschlagen, elektrisch oder mit CO2 mit anschließender Schlachtung Netzgehege: an Schwimmern befestigte Netztaschen, hauptsächlich im maritimen Bereich Kreislaufanlage: geschlossenes System, Wasserkörper entstammt Grundwasser, nur künstliches Futter, vor Schlachtung Hälterung in Frischwasser Weitere Produktionszweige: Muschelkultur, Garnelenkultur, Thunfischzucht 166. Welche physiologischen Prozesse führen zur Totenstarre und welche Auswirkung hat sie für den Fisch? sofort nach dem Tod wird in der Muskulatur des Fisches unter Freiwerden von Energie ATP zu ADP dephosphoryliert und ein Teil des anfallenden ADP wird durch Gykolyse des in der Muskulatur vorhandenen Glykogens wieder zu ATP resynthetisiert. Das Glykogen wandelt sich dabei in Milchsäure um. Nach dem Tod nimmt daher der ATP- und Glykogengehalt im 37 Fisch ab und der Gehalt an Milchsäure zu. Die Folge ist ein Absinken des normalen pHWertes von 7,05-7,35 im Organismus des Fisches auf 6,5-5,9. Danach steigt in Abhängigkeit von der Temperatur, der Art des Fanges und der Tötungsart der pH-Wert im Fisch wieder auf über 7 an. Die Folge der pH-Wertsenkung im Organismus des Fisches ist der Eintritt der Totenstarre. Die Totenstarre verläuft beim Fisch vom Kopf zum Schwanz. Je kräftiger die Muskulatur des Fisches ist, umso stärker ist die eintretende Totenstarre. Bei jungen Fischen beginnt und endet die Totenstarre daher eher als bei älteren, großen Fischen. Gut ernährte Fische mit einem intensiven Stoffwechsel erstarren schneller. Der Eintritt der Totenstarre wird durch hohe Belastungen der Fische vor dem Tode, hohen Temperaturen und anderen stoffwechselaktivierenden Einflüssen beschleunigt. Durch Sauerstoff wird die Totenstarre gehemmt, durch Bewegungen der Muskulatur aufgehoben. Bei stark geschädigten oder erkrankten Fischen tritt die Starre daher meistens sehr schnell ein. Die Zeit bis zum Eintritt der Totenstarre wird bei folgenden Fischarten größer: Forelle<Hecht<Blei<Karpfen<Schleie. Während der Totenstarre tritt eine mikrobielle Zersetzung der Fische in der Regel nicht ein. Erst wenn im Organismus des Fisches der pH-Wert wieder ansteigt und die Gewebe infolge fortschreitender Autolyse durch körpereigene Enzyme zerstört werden, setzt eine zunehmende mikrobielle Zersetzung ein. 167. An welchen Merkmalen lassen sich frischer und älterer Fisch unterscheiden? Ohmscher Widerstand; Basische Stickstoffsubstanzen (NH3, TMA, TVB-N, TMA-O); Volatile Reducing Substances; Haut: Farbe, Schleim, Schuppen; Augen: Wölbung, Hornhaut, Pupille; Kiemen: Farbe, Blättchen, Schleim; Muskulatur: Aussehen, Konsistenz, Oberfläche, Färbung entlang der Mittelgräte; Ablösbarkeit der Mittelgräte; Leibeshöhle: Nieren, Blut, Organreste, Blut in Aorta; Geruch: Haut, Kiemen, Leibeshöhle 168. Welche Problemstellungen in Bezug auf die Lebensmittelgewinnung sind den verschiedenen Aquakulturformen zuzuordnen? Karpfenteichanlage: Geschmacksbeeinträchtigung durch Algenblüten und gründeln der Fische im Schlamm; erhöhter Fleischsaftverlust und geringe Haltbarkeitsdauer durch Entfernung der Zwischenmuskelgräten nach der Schlachtung; Kontamination durch Kot und Futterreste von Geflügel und Schwein bei praktizierter Polykultur (v.a. Asien) Forellenteiche, Fliesswasseranlagen: erhöhtes Infektionsrisiko durch Fliesskanalanlagen, dadurch Rückstände von eingesetzten Therapeutika; äußerliche Kontamination mit pathogenen Erregern von Warmblütern über Abwässer; Geschmacksbeeinträchtigung über Einleitung (Mineralöl) oder Algenblüten im Sommer Netzgehege: Gefahr der Kontamination mit für Warmblüter pathogenen Keimen (v.a. in Nähe von Abwassereinleitungen); Geschmacksbeeinträchtigungen durch Algenblüten oder Wasserverunreinigungen; Rückstände (aber Vermeidung von Antibiotika durch Vakzinierung) Kreislaufanlagen: eigentlich spezifisch-pathogenfreier Fischbesatz; vor Schlachtung muss Hälterung in Frischwasser erfolgen, da sonst durch biologischen Abbau von Futterkomponenten Huminsäuren entstehen, die zu einer Geschmacksbeeinträchtigung der Fische führen 169. Wie werden in der tierischen Produktion anabol wirksame Stoffe definiert? FlHV Anl.1 Kap. IV Nr. 7.6: „Stoffe mit thyreostatischer, östrogener, androgener, gestagener Wirkung, ß-Agonisten…“ 38 170. Welche Wirkstoffe werden zurzeit in zahlreichen nicht der EU zugehörigen Ländern als Masthilfsmittel eingesetzt? - Diethylstilböstrol: USA 171. Nach welcher Vorschrift ist in der BRD die Anwendung sexualhormonwirksamer Verbindungen beim lebensmittelliefernden Tier geregelt? Wo werden höhere Testosteronwerte in essbarem Gewebe gemessen, in der Bullenmast oder nach vorschriftsmäßiger Verabreichung eines 200mg Testosteron enthaltenden Implantates? Die Anwendung von „Stoffen mit östrogener, androgener oder gestagener Wirkung oder betaAgonisten mit anaboler Wirkung“ bei Lebensmittel liefernden Tieren ist in §2 der Verordnung über Stoffe mit pharmakologischer Wirkung geregelt. Dort werden Bedingungen für die Anwendung und Ausnahmen vom generellen Anwendungsverbot in §1 Absatz 1c) der „Verordnung über das Verbot bestimmter Stoffe bei der Herstellung von Arzneimitteln zur Anwendung bei Tieren“ genannt. Die feststellbaren Testosteronwerte im Muskelfleisch von Mastbullen liegen 7 bis 8 mal höher als bei der Anwendung eines Implantates, da die körpereigene Hormonproduktion in wesentlich stärkerem Masse Hormone freisetzt, als ein Implantat, welches kontinuierlich geringe Mengen in den Organismus abgibt. 172. Bei welcher Mastform lassen sich die deutlichsten anabolen Effekte erzielen? Wie kann das begründet werden? Anabol wirksame Stoffe steigern v.a. beim Rind die Mastleistung, beim Schwein ist die Wirkung geringer, bei Geflügel durch die Fortschritte der Genetik vollkommen überholt. Die besten Leistungssteigerungen erzielt man in der Ochsenmast, da die künstlichen Steroide die körpereigenen Hormone substituieren. Auch Mastkälber sprechen gut auf Anabolika an, da bei ihnen noch keine körpereigenen Sexualhormone gebildet werden. 173. Wie ist die Hauptübertragungsroute von Noroviren? Wie beurteilen Sie deren Tenazität? Verläuft die Norovirusinfektion fieberhaft? Übertragung überwiegend fäkal-oral, auch aerogen-oral, minimale Infektionsdosis 10-100 Viruspartikel hochinfektiös!!! Hauptausscheidung mit dem Stuhl, Infektion kann auch von Erbrochenem ausgehen; Hauptsächlich Übertragung über Meeresfrüchte, insbesondere Muscheln, sowie LM, die während der Produktion, der Behandlung & Zubereitung kontaminiert werden, aber keinem Erhitzungsprozess mehr unterliegen; Noroviren sind hochkontagiös und haben eine hohe Tenazität = außerordentlich resistent (überleben < 10 ppm Chlor, Kühl- und Gefrierbehandlung reduziert sie nicht; bei pH 2,7-3 nach Stunden noch infektiös), hingegen werden sie bei üblichen Hitzebehandlungsverfahren sehr schnell inaktiviert; einmal in die Umgebung ausgeschieden, können Noroviren Wochen bis Monate infektiös bleiben; Erkrankung ist durch leichtes Fieber, Erbrechen, Diarrhoe und Kopfschmerzen für 2-3 Tage geprägt und zumeist selbstlimitierend; es wird keine belastbare Immunität aufgebaut 174. Nennen Sie die Erreger der „Reisehepatitis“! Werden Rotaviren vom Rind auf den Menschen übertragen? Reisehepatitis = Hepatitis A Virus Nein! Hauptsächlicher Übertragungsweg fäkal-oral, Reservoir: Mensch; Hauptursache für schwere Durchfallerkrankungen bei Kindern zwischen 6 Monaten und 2 Jahren (>70%), bei Erwachsenen meist milde Formen (Ansteckung an erkrankten Kindern, Reisediarrhoe, Ausbrüche in Altersheimen) 39 175. Nennen Sie mögliche Maßnahmen, mit denen im Bereich der Veterinärmedizin die Antibiotika-Resistenzsituation verbessert werden kann! Resistenzmonitoring; Monitoring des AB-Verbrauches bei landwirtschaftlichen Nutztieren; Anwendungsverbote bzw. Zulassungsbeschränkungen; Restriktiver Einsatz zugelassener Chemotherapie; Optimierung von Hygiene und Haltung („Management“); Vermehrter Einsatz immunprophylaktischer Maßnahmen; Erregerspezifische Eradikationsprogramme; Entwicklung und Einsatz neuer Therapie- und Prophylaxekonzepte (z.B. Prä- und Probiotika); Entwicklung und Einsatz neuer antimikrobieller Wirkstoffe 176. Nennen Sie mögliche Maßnahmen, um den Einsatz von Antibiotika bei Tieren sinnvoll zu beschränken (entsprechend der „Leitlinien für den sorgfältigen Umgang mit antimikrobiell wirksamen Tierarzneimitteln der Bundestierärztekammer, der Arbeitsgemeinschaft der Leitenden Veterinärbeamten und des Bundesverbandes für Tiergesundheit“)! Antibiotika nie zur Korrektur von Hygiene- und Haltungsfehlern; Verschreibung und Anwendung nur vom Tierarzt; Anwendung nur auf den konkreten Fall; „kalkulierte“/ “gezielte“ Chemotherapie Antibiotikaeinsatz nur nach strenger Indikation erneuter Erregernachweis und Antibiogramm erforderlich bei: Wechsel des AB, wiederholtem oder längerfristigem Einsatz in Tiergruppen, Kombination von Antibiotika, Umwidmung nur geeignete AB anwenden Zulassungsbedingungen einhalten Schmalspektrum-AB bevorzugen AB-Einsatz auf das notwendige Minimum beschränken AB-Einsatz in ausreichender Dosis und Dauer, keine Unterbrechungen; schriftliche Dokumentation des ABEinsatzes 177. Wie ist die gegenwärtige Antibiotika-Resistenzsituation bei Salmonellen? Hauptsächliche Resistenz gegen Sulfonamide, noch relativ gute Wirkung von Aminoglykosiden; Salmonellen sind am häufigsten resistent gegen Streptomycin, Ampicillin, Tetracyclin, Chloramphenicol und Florfenicol (in absteigender Reihenfolge). 178. Bei welchen humanpathogenen Krankheitserregern stellt die Resistenz gegen antimikrobielle Wirkstoffe gegenwärtig ein großes Problem dar und wie bewerten Sie jeweils den Einsatz antimikrobieller Wirkstoffe bei Tieren für deren Entstehung/Ausbreitung (Nennen Sie mindestens 5 Keime)? Salmonellen, Campylobacter: Verbindung zum Tier nachgewiesen; E.coli (EHEC): möglich; Vancomycin-resistente Enterokokken: Übertragung auf den Menschen durch roh verzehrte Lebensmittel eventuell möglich; Methicillin-resistente Staph. aureus, Mycobact. tuberculosis, Str. pneumoniae: keine Verbindung zum Tier, da Resistenzprobleme entweder nur in der Humanmedizin bestehen, oder die in der Humanmedizin eingesetzten Antibiotika nie bei Tieren angewendet wurden; andere Erreger wie Neisseria meningitidis oder N. gonorrhoea kommen beim Tier gar nicht vor 179. Welche Folgen hat der Einsatz antimikrobieller Wirkstoffe bei Tieren im Hinblick auf die Entstehung/Ausbreitung Antibiotika-resistenter humanpathogener Krankheitserreger? (Nennen Sie Beispiele!) Es wurden Keime, die ein Problem in der Humanmedizin darstellen, isoliert und gleichzeitig Keime bei Tieren isoliert. Bei den Tieren fanden sich die gleichen Keime, wie beim Menschen. Allerdings zeigten Gensequenzstudien, dass die Sequenzen der Erreger, die beim Tier isoliert wurden nicht mit den Sequenzen der humanpathogenen übereinstimmten, woraus gefolgert werden kann, dass diese Erreger nicht im Zusammenhang mit einer 40 Resistenzübertragung vom Tier auf den Menschen stehen. Z.B.: Methicillin-resistente Staph. aureus, Mycobact. tuberculosis, Str. pneumoniae 180. Welche hauptsächlichen Wirkungsmechanismen von Antibiotika bzw. Chemotherapeutika kennen Sie? Hemmung der Zellwandsynthese; Störung der Permeabilität der Zytoplasma(zell)membran (z.B. Penicilline); Hemmung der Proteinsynthese (z.B. Tetracycline, Streptomycin, Macrolide, Chloramphenicol, Lincosamide, Aminoglykoside); Hemmung der Nukleinsäuresynthese (z.B. Chinolone, Sulfonamide, Trimethoprim, Ansamycine, Novobiocin) 181. Was versteht man unter natürlicher Resistenz? natürliche Resistenz: aufgrund spezifischer Eigenschaften des Chemotherapeutikums kann ein Bakterium nicht angegriffen werden (z.B. Benzylpenicillin kann bei gramnegativen Bakterien die äußere Zellmembran nicht durchqueren) 182. Nennen Sie mobile genetische Elemente mit Bedeutung für die Ausbreitung antibiotischer Resistenzen bei Bakterien! Insertionssequenzen; Transposons; Genkassetten und Integrons 183. Nennen Sie Formen des horizontalen Gentransfers zur Übertragung antibiotischer Resistenzen! Transformation: freie DNA wird von einem kompetenten Rezipienten aufgenommen, es erfolgt eine Rekombination der Bakterien-DNA, Ende ist ein rekombinantes Bakterium Transduktion: durch Bakteriophagen wird Phagen-DNA mit bakterieller Sequenz aufgenommen, es erfolgt die Rekombination Konjugation: ein plasmidhaltiger Donor überträgt per Sexpili das Plasmid auf den plasmidfreien Rezipienten, es erfolgt die Rekombination im Rezipienten 184. Beschreiben Sie die Erzeugung (nicht die Technologie der Gewinnung) des Honigs in kurzen Sätzen! Trachtbienen sammeln Nektar bzw. Honigtau, bei Aufnahme bereits Zugabe körpereigener Stoffe, im Bienenstock Übernahme des Sammelgutes durch Stockbienen, „Entwässerung“, Anreicherung mit körpereigenen Substanzen, „Lagerung“ bis Reifeprozess abgeschlossen, bei Erreichen einer gewissen Reife „Verdeckelung“ der Wabenzellen (Verdeckelung ist Anzeichen für Reife), Entdeckelung, Schleudern oder Pressen, Sieben, Abschäumen, Rühren, Verflüssigen, Mischen verschiedener Sorten, Abfüllen 185. Nach welchen Kriterien werden Honige eingeteilt? Anlage 1, Abschnitt 1 der HonigVO: nach Herkunft; nach Angebotsform; nach Zweckbestimmung; nach Gewinnungsart; (Blütenhonig oder Nektarhonig, Honigtauhonig, Wabenhonig oder Scheibenhonig, Honig mit Wabenanteilen oder Wabenstücke in Honig, Schleuderhonig, Presshonig, gefilterter Honig, Backhonig) 186. Dürfen Honigen Stoffe zugesetzt oder honigeigene Bestandteile entzogen werden? Honig-VO, Anlage 2, Abschnitt 1: „Honig dürfen weder Stoffe zugesetzt noch honigeigene Stoffe entzogen werde…“ Darüber hinaus ist die Beschaffenheit von Honig festgelegt Honige mit diversen Zusätzen dürfen gar nicht „Honig“ heißen 41 187. Welche Anforderungen müssen Trachthonige (z.B. Rapshonig, Lindenblütenhonig) erfüllen? HonigVO §3, Absatz 3, Nr. 1: „Die … Bezeichnungen können … ergänzt werden durch Angaben zur Herkunft aus Blüten oder lebenden Pflanzenteilen, wenn der Honig vollständig oder überwiegend den genannten Blüten oder Pflanzen entstammt und die entsprechenden organoleptischen, physikalisch-chemischen und mikroskopischen Merkmale aufweist…“ 188. Unter welchen Bedingungen dürfen Honige mit geographischen Angaben (z.B. Schwarzwaldhonig, kanadischer Honig) in den Verkehr gebracht werden? HonigVO §3, Absatz 3, Nr. 2: „Die … Bezeichnungen können … ergänzt werden durch folgende Angaben … zur regionalen, territorialen oder topographischen Herkunft, wenn der Honig ausschließlich die angegeben Herkunft aufweist…“ 189. Schreiben Sie die Hauptbestandteile des Honigs auf! Einfachzucker Glucose und Fructose (70-80% in Blütenhonigen; Fructose 31-41%, Glucose 28-35%); Evtl. Maltose (5-15%); Saccharosegehalt sehr gering, abhängig von InvertaseAktivität (laut Honig-VO scheinbarer Saccharose-Gehalt höchstens 5%); Wasser (16-19%, höchstens 21% laut Honig-VO); Pollen; Mineralstoffe, überwiegend Kalium (höchstens 0,6%); Geformte Bestandteile; Stickstoffhaltige Substanzen (Proteine, Peptide, Aminosäuren); Enzyme; Vitamine; Organische Säuren; Aromastoffe u.a. 190. Nennen Sie 2 Varroa-Bekämpfungsmittel! Flumethrin auf Kunststoffstreifen; Brompropylat (Räuchermittel, werden in der Beute verglimmt); Coumaphos (wird den Bienen aufgetropft); Cymiazol (Auftropfverfahren wie Coumaphos); Ameisensäure auf Krämerplatte oder Illertisser Milbenplatte (Verdunstungsmittel); Ätherische Öle (aber starker Geruch, der auch später dem Honig anhaftet) 191. Ein Honig soll auf Rückstände untersucht werden. Welche Rückstände kommen allgemein in Frage? Pestizide, Herbizide oder Antibiotika (Streptomycin!) aus der landwirtschaftlichen Produktion; Arzneimittel von Behandlungen: Antibiotika, Antiparasitika; Schädliche Substanzen aus der Umwelt: Schwermetalle, Dioxine, PCB, Radionuklide 192. In einer Honigprobe wurden erhöhte Mengen an Streptomycinrückständen festgestellt. Wie gelangen derartige Rückstände in den Honig? In welcher Verordnung ist dies lebensmittelrechtlich geregelt? Streptomycin wird zur Bekämpfung des Befalls von Obstbäumen mit Rostpilzen eingesetzt. Die Bienen nehmen die Substanz mit dem Nektar aus den Blüten auf. Rechtliche Regelung nach HonigVO §5: Rückstandsuntersuchungen 193. Welche genetisch veränderten Pflanzen (GVP) gibt es, welche Eigenschaften wurden verändert und welchen Pflanzen/Eigenschaften kommt in welchen Anbauländern die größte aktuelle Bedeutung zu? Zuchtziele: Ertragssicherheit Krankheitsresistenz (!!!), Schädlingsresistenz, Stresstoleranz; Produktqualität Fettsäuremuster, Begleitstoffe, Aminosäuren-zusammensetzung, Kleber, Zucker, Stärke; Ertragshöhe Körner, Grünmasse, Rüben, Knollen Mais: Resistenz gegen den Maisbohrerkäfer mit Hilfe eines Gens aus Bacillus thuringiensis Baumwolle Sojabohne: Resistenz gegen das Unkrautvernichtungsmittel „Round-up“ Raps: besonderes Fettsäuremuster 42 Getreide: Resistenz gegen Mycotoxin-produzierende Pilze Länder mit den größten Anbauflächen für GVPs in absteigender Reihenfolge: USA, Argentinien, Kanada, China, Brasilien 43