Mechanismus der sauren Hydrolyse von Saccharose
Werbung

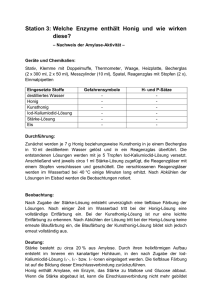
Hinweis: Dieses Protokoll stammt von der Seite www.chids.de (Chemie in der Schule). Dort können unterschiedliche Materialien für den Schulunterricht heruntergeladen werden, unter anderem hunderte von Experimentalvorträgen so wie der vorliegende: http://online-media.uni-marburg.de/chemie/chids/veranstaltungen/uebungen_experimentalvortrag.html Die Biene als Chemielaborantin Inhalt 1. Geschichte des Honigs ____________________ 1 2. Rohstoffe des Honigs und deren Verarbeitung _____ 5 3. Chemische Betrachtung von Honig ____________ 9 4. Verwendung von Bienenprodukten 5. Experimenteller Teil ___________ 22 _____________________ 23 6. Schulrelevanz _________________________ 32 7. Literatur _____________________________ 33 1. Geschichte des Honigs Bienen bevölkern schon seit 40-50 Millionen Jahren unseren Planeten, wie man aus Bernsteinfunden weiß. Den Menschen der Jetztzeit gibt es dagegen erst seit 200.000 Jahren und erst vor 40.000 Jahren entdeckte er Feuer und Honig. Bereits 7000 v. Chr machte der Mensch Aufzeichnungen über die Sammlung des goldenen Süß. Höhlenmalereien in der La Aranas – Höhle zeugen von der schwierigen Ernte. In allen Hochkulturen der Antike wird von der wundersamen Fähigkeit der Biene, Honig zu machen, berichtet. Honig wurde verehrt und genoss als Nahrungs-, Schönheits- und Heilmittel größte Wertschätzung. Der berühmte Arzt Hippokrates (466 bis 377 v. Chr.) verordnete Honig bei Fieber, Verletzungen, Geschwüren und eiternden Wunden. Bei den olympischen Spielen tranken die Athleten Honigwasser um schnell wieder zu Kräften zu kommen. Honig diente als Opfergabe, als Grabbeigabe für die Reise ins Jenseits und wurde als Zahlungsmittel eingesetzt. Honig war selten, schwierig zu ernten und gehörte zu den begehrtesten süßen Lebensmitteln, denn Zucker gab es noch nicht. Für die Juden war Honig Symbol für Überfluss und Reichtum. Darum auch ihre Klage auf der Flucht aus Ägypten: „Ist’s zu wenig, dass Du uns aus dem Lande geführt hast, darin Milch und Honig fließt, dass Du uns tötest in der Wüste? Du musst auch noch über uns herrschen?“ (4. Moses 16,13). Erst die sesshaften Bauern und Siedler schafften es, die Bienen, die den Honig erzeugen, zum „Haustier“ zu machen. Auch die Ernteerträge der Obstbauern stiegen, wenn die Bienenvölker in Gebiete gebracht wurden, in denen intensive Landwirtschaft betrieben wurde. Sie schufen ganze Honig-Plantagen und schafften es, den Honig zu ernten und zu veredeln. Bereits um 600 v. Chr. gab es in Griechenland eine voll entwickelte und gesetzlich geregelte Imkerei. Aristoteles (384 bis 322 v. Chr.) verfasste das erste Fachbuch über die Bienenzucht. Einen großen Auftrieb bekam die Imkerei durch Karl den Großen: Er befahl, dass jeder Gutshof einen Imker und einen Metbauern, also einen Hersteller von Met (Honigwein), haben müsse. Zudem erließ er viele Gesetze zum Schutz der Imkerei. Auch die Kirche war ein eifriger Förderer der Bienenzucht, denn die Bienenstöcke lieferten das Wachs für die Kerzen. Alternativen zu Honig als Süßungsmittel gab es lange nicht: Zucker aus Zuckerrohr kam erst ab dem späten Mittelalter nach Europa und war ein unerschwinglicher Luxus, den sich selbst reiche Bürger und Fürsten nur selten leisten konnten. Erst im 19. Jh. gelang die Herstellung von Zucker aus den Wurzeln der Zuckerrübe und mit dem vermehrten Anbau der Zuckerrübe wurde Zucker bezahlbar. Der Zucker löste den Honig als Süßungsmittel ab – nicht aber als Genussmittel. 2. Rohstoffe des Honigs und deren Verarbeitung Im Wesentlichen besteht der Honig aus drei Rohstoffen, die von den Bienen gesammelt werden und denen er seine chemische Zusammensetzung und seine Wirkeigenschaften verdankt. Den Nektar gewinnt die Biene aus den Nektarien der Blüte. Nektarien sind pflanzliche Drüsengewebe, die zuckerhaltigen Saft aussondern, um Insekten zur Bestäubung anzulocken. Dieser Pflanzensaft besteht zu 20% aus Zucker und zu 80% aus Wasser, wobei diese Werte schwanken können, da es sich um ein Naturprodukt handelt. Honige, die ausschließlich aus diesem Rohstoff gewonnen werden, nennt man Blütenhonige. Waldhonig wird auf eine besondere Art und Weise von den Bienen gewonnen. Sie sammeln die Ausscheidungen von pflanzensaugenden Insekten, den Lachniden. Dieser Honigtau enthält zuckerhaltige Reste des Siebröhrensaftes der Pflanze. Hierbei steuert die Pflanze nicht aktiv den Ausscheidungsprozess und damit die Abgabeprodukte. Neben der Zuckerlösung werden der Pflanze auch Mineralstoffe und sonstige Stoffwechselprodukte entzogen. Der dritte Rohstoff, den die Biene sammelt, ist der Pollen, der männliche Erbgutträger der Pflanze. Dieser bleibt bei den Blütenflügen der Bienen an deren behaarten Hinterbeinen hängen und wird so zum Bienenstock transportiert. Er ist sehr Protein- und Vitaminreich und trägt somit zur Nahrungsqualität eines Honigs bei. Außerdem dient er den Bienen selbst als Lipidquelle, dem sogenannten Bienenbrot. Enthält ein Honig mehr als 45% einer Pollensorte, dient die entsprechende Pflanze als Namensgeber (Lindenhonig, Sonnenblumenhonig). Die ätherischen Öle, die der Pollen außerdem enthält, sorgen später für den charakteristischen Geschmack der verschiedenen Honigsorten. Wenn die Biene ihre Rohstoffe gesammelt hat, macht sie sich auf den Rückflug zum Stock, wo sie ihre Fracht an die Arbeiterinnen (Stockbienen) übergibt. Diese sind schließlich für die weitere Verarbeitung zuständig. Die Rohstoffe werden mit dem Speichel der Transportbienen versetzt und von den Stockbienen durch Fächeln vorgetrocknet. In den sogenannten Waben aus Wachs lagert die Honigvorstufe und trocknet bis auf einen bestimmten Wassergehalt aus. Bei diesen Vorgängen versetzen sowohl die Sammlerinnen als auch die Stockbienen den Honig mit Enzymen und Fermenten, die den Honig „reifen“ lassen und ihm seine besondere Zusammensetzung verleihen. Zuletzt wird die Wabe mit einem Deckel aus Wachs luftdicht verschlossen. Bei der Ernte muss der Imker die Waben entdeckeln und den Honig, der nun zu einer goldgelben, zähflüssigen Masse geworden ist, herausschleudern. Diese Vorgänge unterliegen mittlerweile strengen lebensmittelrechtlichen Auflagen. Der Honig darf zum Beispiel nur einen maximalen Wassergehalt von 18% haben, da sich sonst seine Haltbarkeit (Schimmel) verringert . Wird der Honig nachträglich durch den Imker erhitzt, werden wichtige Enzyme, die im Honig enthalten sind, beschädigt oder wirkunfähig gemacht. Unsachgemäßes Erhitzen kann durch Bildung charakteristischer Stoffe chemisch nachgewiesen werden. Stichprobenartige Kontrollen durch den Imkerbund sollen „schwarze Schafe“ in der Imkerzunft entlarven. Durch im Ausland produzierte Billighonige, kann jedoch bald keine Gewährleistung mehr für die eigentlich hohe Qualität des Honigs gegeben werden. Deutsche Imker können die Preise der Discounter nicht halten, daher gehen immer mehr qualifizierte Imkerein zu Grunde, so dass die Imkerei mehr und mehr zum Hobby degradiert wird. 3. Chemische Betrachtung von Honig Im Wesentlichen besteht Honig aus verschiedenen Zuckern wie Saccharose, Fructose und Glucose, sowie Wasser. H CH2OH O H O HO OH OH H O OH CH2OH HOH2C H CH2OH O H OH HO H HO HO HO H O H O OH HO CH2OH HOH2C β-D-Glucopyranose β-D-Fructofuranose H H Saccharose Diese organischen Grundbausteine des Honigs lassen sich durch verschiedene qualitative und quantitative Nachweise bestimmen. Bei der Verkohlung von Honig und verschiedenen anderen Zuckern in Reinform durch Schwefelsäure werden alle OH-Gruppen des Zuckers protoniert, wobei Wasser abgespalten wird, welches als Wasserdampf entweicht. Durch die stark exotherme Reaktion scheidet sich Kohlenstoff ab, der durch Wasserdampf aufgebläht wird. Es handelt sich dabei um eine Säure/Base-Reaktion. Wichtig ist hier der Vergleich der entstandenen Produkte, der einen ersten Rückschluss auf die Edukte zulässt. In allen Fällen entsteht mehr oder weniger schnell ein poröser, schwarzer Rückstand und Wasserdampf. Um die Edukte im Honig genauer zu bestimmen, bedient man sich gezielter Nachweisreaktionen. Die quantitative Bestimmung der Konzentrationen von Zucker im Honig könnte zum Beispiel gravimetrisch erfolgen, indem man sich die Reaktion von reduzierenden Zuckern wie Glucose oder Fructose mit Fehlingscher Lösung zunutze macht. Aufgrund des Vermögens zur Halbacetalöffnung (Ringöffnung) wird das Aldehyd (offenkettige Glucose) zur Säure (Glucoronsäure) oxidiert. Die Kupferionen werden zum Kupfer(I)oxid reduziert, welches als roter Niederschlag ausfällt. So wird unter Wärmeeinwirkung quantitativ das Kupfer(II)-Ion durch den Zucker reduziert. Wegen der Verknüpfung über die halbacetalischen Hxdroxylgruppen, durch die der Carbonylcharakter der Monosaccharide blockiert wird, ist die Saccharose ein nichtreduzierender Zucker und liefert eine negative Reaktion mit Fehling. O spH2 H H OH HO HO HO H H OH H OH CH2OH O OH HOH2C OH sp3 OH OH H O H H OH OH CH 2OH α-D-Glucopyranose β-D-Glucopyranose Oxidation: CH2OH CH2OH OH O OH OH OH OH +1 OH CHO OH OH CH2OH OH OH +3 COOH OH OH Reduktion: 2 Cu 2+ + 2 e - 2 Cu + (Cu2O rot) Dass die Saccharose im Honig trotz positiver Fehling-Reaktion im Honig vorhanden ist, zeigt der Reife-Prozess des Honigs, der auf enzymatischen Vorgängen beruht. Die Honigsaccharase hat zwei Eigenschaften. Neben der hydrolytischen Eigenschaft treten auch noch ihre Transglucosidierungs- oder Transfructosidierungs-Eigenschaften in Kraft. Bei der Hydrolyse von Saccharose wird der Glucosylrest auf Wasser übertragen, wobei Fructose und Glucose (oben nachgewiesen) entstehen. Wird die Glucose auf Saccharose übertragen, entsteht Erlose. Bei der Übertragung auf ein anderes Glucose-Molekül entsteht Maltose (Transglucosidierung). Enzymatische Spaltung von Saccharose Die Saccharose wird hier locker an bestimmte Strukturen des Enzyms gebunden, wobei das glycosidisch gebundene Sauerstoffatom durch die Aminosäuren katalytisch protoniert wird. Nach der sich anschließenden Spaltung verlassen die Produkte das aktive Zentrum des Moleküls. Eine Nachahmung des enzymatischen Prozesses ist die Herstellung von Kunsthonig, wobei Haushaltszucker (Saccharose) protonenkatalysiert in Glucose und Fructose gespalten wird. Mittels Zitronensaft, dessen enthaltene Säuren (z. B. Zitronensäure) die nötigen Protonen liefert, wird die in Wasser gelöste Saccharose unter Wärmeeinwirkung hydrolysiert. Man erhält eine klare, sirupartige Flüssigkeit, die beim Erkalten nicht mehr kristallisiert. Die honigartige Konsistenz wird also durch die Hydrolyse von Saccharose erzielt, wobei Erlose zusätzlich als Kristallisationshemmer fungiert. Der Honig (eigentliche Nahrung für die Bienen) ist so sicherlich leichter zu handhaben, als eine Flüssigkeit. Außerdem können Monosaccharide leichter verdaut werden und liefern eine höhere Energieausbeute als Disaccharide. Mechanismus H HO HO der sauren H Hydrolyse von Saccharose H CH2OH O HO HO H OH CH2OH O H OH H O O OH OH HO OH H O HO CH2OH HOH2C H Saccharose H CH2OH HOH2C H H H HO HO OH H CH2 OH O CH2 OH O HO HO H OH Oxoniumion (Halbsessel) H H H β-D-Fructofuranose H CH2 OH O HO HO + -H CH2 OH O H OH H OH OH OH2 α-D-Glucopyranose Wie bei der enzymatischen Hydrolyse wird ein Proton an den glycosidischen Sauerstoff gebunden, der so aktiviert wird. Die Abgangsgruppe ist Fructose, wobei nun ein mesomeriestabilisiertes Oxoniumion in Halbsesselkonfiguration vorliegt. Durch die Anlagerung von Wasser und Abspaltung eines Protons entsteht Glucose. Seine Wirkeigenschaften verleihen dem Honig kleine Mengen an Enzymen wie Phosphatase, Diastase, Glucoseoxidase. Diastase (Amylase) spaltet -Amylose in Maltose-Einheiten. So wird der Pollen verarbeitet, der Stärke als Energiespeicherstoff besitzt. Die Amylase ist ein Indikator für unsachgemäßes Erhitzen. Ab einer Temperatur von über 50° wird das Enzym irreversibel denaturiert. Durch Bildung eines Iod-Stärke-Clathrats kann die Aktivität der Amylase im Honig photometrisch (Stärke-Abbau/Zeit) bestimmt werden. Es handelt sich ebenfalls um eine protonenkatalysierte Hydrolyse H CH2OH O H CH2OH O O HO H OH O HO H HO CH2OH HOH2 C Carbokation H HO HO OH OH H O OH O . Ausschnitt von -Amylose mit -1,4 glycosidisch gebundener -Glucose. Hier ist eine Maltose-Einheit gezeigt. blaues Iod-Stärke-Clathrat Ein weiteres wichtiges Enzym im Honig ist die Glucose-Oxidase. Sie hat die Aufgabe Glucose zu Glucoronsäure und Wasserstoffperoxid zu oxidieren. Die Säurewirkung der Glucoronsäure hemmt Bakterienwachstum und macht den Honig haltbarer. Das Nebenprodukt Wasserstoffperoxid ist verantwortlich für die heilsame Wirkung des Honigs bei Erkältungs-krankheiten. Der Honig ersetzt dabei das Gurgeln mit medizinischem Wasserstoffperoxid. Die sirupartige Konsistenz des Honigs bewirkt die Linderung von Hustenreiz und der Vitamingehalt sorgt für schnellere Genesung. Getestet wird die Aktivität der Glucoseoxidase mit Hilfe von Teststäbchen, die den Peroxidgehalt messen. Fakt ist, dass dieses Enzym durch Hitze geschädigt werden kann und sein Arbeitsmaximum bei 40° hat. Man sollte also bei Erkältung keinen heißen, sondern lauwarmen Tee mit Honig trinken. Substruktur (FAD) der Glucose-Oxidase, Flavin-Adenin-Dinukleotid (rot = aktives Zentrum) Oxidation zu Gluconsäure O Riboflavinteil H 3C N H 3C N NH N O Reduktion H 3C H N Oxidation H 3C N R CH2 H OH H OH H OH N O O O P O P O CH2 O NH N H NH2 CH2 O O O N N N H H HO OH + 2 Elektronen 0 -1 +3 +1 - 2 Elektronen Gluconsäure Zwei Wasserstoffatome werden der Glucose entzogen und in komplizierten radikalischen Prozessen mit Hilfe des Enzyms auf Disauerstoff übertragen. O Honig ist außerdem eine Phenylalanin- und Prolinquelle, er liefert also essentielle Aminosäuren, die vom Menschen nicht synthetisiert werden können. NH3 H N OH OH O O Prolin Diese freien Phenylalanin Aminosäuren können mit der Ninhydrin-Reaktion nachgewiesen werden. Dieser Methode bedienten sich schon frühe Gerichtsmediziner um Fingerabdrücke (menschlicher Schweiß und Haut enthalten Aminosäuren) sichtbar zu machen. Der Farbstoff, der bei der Reaktion von Ninhydrin mit Aminosäuren entsteht, wird Ruhemannscher Purpur genannt. Der komplizierte Mechanismus ist bis heute noch nicht bis ins Detail aufgeklärt, daher handelt sich bei den Vorschlägen in den Fachbüchern größtenteils um Annahmen. Sicher ist jedoch, dass zwei Ninhydrin-Moleküle über ein Stickstoff-Atom verknüpft werden, sodass der blau-violette Farbstoff gebildet wird. O OH 2 H COO O C R H2N CH CO2 R N OH O +OH -H2O O O O O Die Aminosäuren haben zudem die Aufgabe dem Honig seinen typischen Ninhydrin Purpur Geruch zu verleihen. Die Reaktion reduzierender ZuckerRuhemannscher mit Aminosäuren (Hydrat des Triketons) (blau-violetter Farbstoff) führt zu solchen Düften. Verschiedenste Acetaldehyde sorgen für den Trachttypischen Geruch. Vor allem Prolin und Phenylalanin tragen zu dieser Reaktion bei. Die Aminosäuren stammen meist aus Honigtau. Zur Geruchsbildung tragen komplizierte Reaktionen von Aminosäuren mit reduzierenden Zuckern bei. => Bildung von N - Glycosiden, CH2OH O NHR OH H HO OH => Umlagerung zu Aminozuckern CH2OH OH NHR OH H HO O => Hydrolyse, Wasserabspaltung CH2OH OH H OH O HO O Wichtigstes Zwischenprodukt: α - Diketon der Glucose Reaktion mit AS im Strecker-Abbau Nach der Reaktion mit Glucose riechen die Proben von: Phenylalanin Prolin Valin nach Veilchen / Flieder / Honig Popkorn Krokant COOH R1 R2 C O C O R1 H2N CH CH2 R2 O C COOH C CH N R1 -CO2 R2 CH2 OH C C N CH CH2 α-Diketon aus Glucose H 2O Phenylalanin O R1 R2 OH C C H C CH2 NH2 Phenylacetaldehyd Der hohe Gehalt an Mineralien, vor allem von Waldhonig, garantierte schon den frühen Olympioniken die Erhaltung ihres Elektrolyt-Haushaltes. Sein Vitamingehalt sorgt für einen guten Stoffwechsel, der angenehme Duft für Wohlbefinden. Inhaltsstoffe im Überblick Honig – Inhaltsstoffe Einfachzucker Enzyme Vitamine (Fermente) Vitamin Mineralien C Kalium Säuren Gluconsäure Traubenzucker Glucoseoxidase Vitamin B1 Natrium Phosphatase Vitamin B2- Calcium (Glucose) und andere organische Invertase Komplex Phosphor Fruchtzucker Diastase Vitamin B6 Schwefel Apfelsäure, (Fructose) Katalase Vitamin H Chlor Citronensäure, Eisen Milchsäure Magnesium Wasser und Mehrfachzucker Disaccharide, z.B. Säuren, Maltose weitere Spurenelemente z.B. Trisaccharide, Aminosäuren Hormone Inhibine Aromastoffe z.B. Erlose Prolin Acetylcholin Flavonoide Carbonsäure Leucin/Isoleucin Glucoseoxidase/ und Ester z.B. Aspareaginsäure Wasserstoff- Phenylessig- Glutaminsäure peroxid säureester Phenylanalin und Threonuin Bactericide Alanin Arginin Histidin Glycin Lysin Serin Valin Cystin weitere Acetaldehyde 4. Verwendung von Bienenprodukten Honig: Brotaufstrich, Kosmetika, Süßungsmittel Vergärung zu Met C6H12O6 H2O C2H5OH CO2 Wachs: 80 % Ester und Säuren, Smp: 63°C Kosmetika, Möbelpflege, Kerzen O C30H61 H31C15 O Hauptbestandteil des Bienenwachs: ungesättigter Fettsäureester mit primärem Fettalkohol Gelee Royal: Futtersaft der Königinnen Medizin, Kosmetika 5. Experimenteller Teil Versuch 1 Verkohlung organischer Substanzen mit Schwefelsäure. Material: 4 Bechergläser (200 ml), Drahtnetz Chemikalien: halbkonz. Schwefelsäure, Glucose, Fructose, Saccharose, Zellulose, Honig Entsorgung: Die schwefelsaure Lösung wird neutral kanalisiert, der Rückstand gelangt trocken in den Hausmüll. Durchführung: Ein Becherglas wird mit je einem Kohlenhydrat so befüllt, dass der Boden gut bedeckt ist. Auf alle Proben gibt man nun gut 5 mL der Schwefelsäure. Die Bechergläser werden zur Vorsicht auf ein Drahtnetz gestellt. Beobachtung: Nach kurzer Zeit beginnt der Zucker, bzw. Honig sich schwarz zu färben. Im Becherglas steigt die Masse schnell und vor allem plötzlich auf. Wenn die Reaktion fast beendet ist, bleibt von den Proben nur noch eine poröse, schwarze Masse übrig. Es riecht nach verbranntem Caramel. Auswertung: Es findet eine Säure/Base-Reaktion statt. Die starke Schwefelsäure protoniert sofort die Hydroxy-Gruppen der Zucker. Aus dem gebildeten Wasser entstehen durch erneute Protonierung Hydronium-Ionen. Zudem ist die Reaktion so stark exotherm, dass entstehendes Wasser sofort als Wasserdampf entweicht und die entstandene Kohlenstoffmasse aufbläht. C6H12O6 + H2SO4 C6 + 6-n H2O + H2SO4 · n H2O Versuch 2 Nachweis reduzierender Zucker Material: 5 Reagenzgläser (RG), Brenner, RG-Klammer, Feuerzeug, Spatel Chemikalien: Haushaltszucker, Glucose, Fructose, Honig, Fehlingsche Lösung I + II, Wasser Entsorgung: Die restlichen Zucker werden dem Hausmüll zugeführt, die mit Fehlingscher Lösung versetzen Zucker werden neutral in die Schwermetallabfälle entsorgt. Durchführung: In die Reagenzgläser werden jeweils Daumendick die Zucker und in eines der Honig eingefüllt und in wenig Wasser gerade gelöst. In einem weiteren RG werden jeweils 10 mL Fehling I und II gemischt (I: 7 g CuSO45 H2O in 100 ml Wasser, II: 35 KNa-Tartrat + 10 g NaOH in 100 ml Wasser). Vom so entstandenen Nachweisreagenz gibt man einige ml zu den 4 Proben und erhitzt kurz über dem Brenner. Nach dem Abkühlen beobachtet man den Bodensatz. Beobachtung: Durch Mischen der blauen Fehlingschen Lösung I und der klaren Lösung II entsteht der dunkelblaue Tartart-Komplex des Kupfers. Schon beim Erwärmen ist bei allen Proben, außer bei Saccharose ein braunroter Niederschlag entstanden. Auswertung: In allen Proben außer bei Saccharose sind reduzierende Zucker enthalten, die mit den Kupferionen reagieren. Reaktionen siehe Seite 6. Na O C O H C OH 2+ Cu K H C O O C O O C O O C H C H C O HO O Kalium-Natrium-Tartrat-Komplex des Kupfers Versuch 3 Herstellung von Kunsthonig Material: Becherglas 200 mL, Magnetrührer mit Heizplatte, Rührfisch Chemikalien: Haushaltszucker, Zitrone, Wasser Entsorgung: Alle Stoffe können in Wasser gelöst in den Ausguss entsorgt werden. K Na Durchführung: In 100 ml Wasser wird der Haushaltszucker bis zur Sättigung gelöst. Die Lösung wird unter Rühren langsam erwärmt und mit einem Spritzer Zitronensaft schließlich zum Kochen gebracht. Nochmals wird etwas Zucker hinzugefügt. Nach einigen Minuten prüft man die Konsistenz der Lösung. Ist sie flüssig, wird nochmals aufgekocht. Ansonsten kühlt man auf null Grad ab. Beobachtung: In 100 ml Wasser lösen sich 200 g Haushaltszucker, die Löslichkeit nimmt mit der Temperatur zu (500 g/100 ml bei 100°C). Die anfangs gesättigte Lösung kann beim Kochen noch zusätzlichen Haushaltszucker aufnehmen, sprich lösen. Nachdem der Zitronensaft hinzugegeben wurde, nahm die Lösung relativ schnell eine gelbliche Farbe an. Schon im Kochprozess verändert die Lösung langsam ihre Konsistenz und wird zäher. Beim Abkühlen jedoch erstarrt die Lösung zu einer festen aber klaren Masse. Auswertung: Die polaren Hydroxygruppen der Saccharose ermöglichen ihr eine gute Löslichkeit in Wasser. Durch die katalytisch wirkenden Protonen des Zitronensaftes werden die Saccharose-Moleküle in Fructose und Glucose gespalten. Das Verhältnis dieser Spaltprodukte bestimmt die Konsistenz einer Lösung (zum Beispiel im Honig). Diese Lösung erstarrt, ohne dass die Zucker auskristallisieren. Lässt man sie einige Zeit stehen, bilden sich jedoch Saccharose-Kristalle und sinken zu Boden. Diesen Vorgang kann man auch beim Honig beobachten. Mechanismus siehe Seite 7. Die Produkte können mit Fehling nachgewiesen werden. Versuch 4 Nachweis der Amylaseaktivität Material: 2 Reagenzgläser, Glasstab, Wasserbad mit Magnetrührer und Thermometer Chemikalien: Honig, Kunsthonig, lösliche Stärke, Wasser, KI-Lösung Entsorgung: Alle Lösungen können zusammen mit viel Wasser im Abguss entsorgt werden. Durchführung: Die Reagenzgläser werden mit einer wässrigen Lösung von Honig und Kunsthonig befüllt. Zu beiden Reagenzgläsern gibt man eine Spatelspitze lösliche Stärke, außerdem wenige Tropfen Jod-Kaliumiodid-Lösung, sodass eine deutliche Blaufärbung zu sehen ist. Die Proben werden gut geschüttelt und in ein Wasserbad mit einer Temperatur von 37-39°C gestellt. Dort verbleiben sie mehrere Minuten, bis die Blaufärbung verschwindet. Beobachtung: Nach Zugabe der Stärke erscheinen die Proben trübe. Sobald die KILösung hinzu kam, bildete sich ein blauschwarzer Komplex, der mit der Zeit im Wasserbad verschwand. Die Probe mit dem Kunsthonig blieb jedoch blau gefärbt. Auswertung: Der Honig besitzt Enzyme, die verschiedene Aufgaben haben. So spaltet zum Beispiel die Amylase Stärke in Disaccharid-Einheiten, nämlich Maltose. Die blaue Farbe der Lösung beruht auf einem zwischen Stärke und der KI/I2-Lösung gebildetem Komplex, der natürlich nicht mehr gebildet werden kann, wenn alle Stärke durch die Amylase abgebaut wurde. Versuch 5 Wirksamkeit von heißem Tee mit Honig Material: Bechergläser 200 mL, 3 Kontaktthermometer, 3 Magnetrührer mit Heizplatte, Teelöffel Chemikalien: Wasser, Honig, Peroxid-Teststäbchen Entsorgung: Die Lösungen können dem Abwasser beigegeben werden, die Teststäbchen gibt man in den Hausmüll Durchführung: Auf drei Magnetrührern wird 150 mL Wasser auf 20°C, 40°C und 60°C erhitzt. Die Temperatur wird mit Hilfe der Kontaktthermometer eingestellt, sie regeln die Heizplatten. Allen drei Bechergläsern werden nun zwei Teelöffel eines hochwertigen Honigs zugegeben. (Discount-Honig lieferte nachweislich nur sehr wenig Enzm-Aktivität). Nach 2-3 Minuten langsamen Rührens wird mit einem Schnelltest auf Wasserstoffperoxid geprüft. Beobachtung: Der Schnelltest zeigte in der 20°C-Probe einen sehr geringen Gehalt an H2O2 an, in der 60°C-Probe war kein Wasserstoffperoxid enthalten. Die Probe mit 40°C hatte den höchsten Gehalt. Auswertung: Das Enzym welches hier für die Wasserstoffperoxidproduktion verantwortlich ist, heißt Glucose-Oxidase und oxidiert Glucose zu Glucoronsäure, welche den pH-Wert des Honigs bestimmt. Dabei wird gleichzeitig, wahrscheinlich Wasserstoff auf gelösten über radikalische Zwischenstufen, der Sauerstoff übertragen, wobei das Peroxid entsteht. Die Tester reagieren auf die Anwesenheit mittels eines Redoxindikators. Versuch 6 Nachweis freier Aminosäuren mit Ninhydrin Material: 3 Reagenzgläser, 2 Tropfflaschen, Brenner Chemikalien: entionisiertes Wasser, Ninhydrinlösung (w = 0,25% in Propanol), Natronlauge (c = 1mol/l), Honiglösung, Kunsthoniglösung, Aminosäurelösung (Valin) Entsorgung: Die Lösungen werden neutral in die organische Abfälle gegeben. Durchführung: Ninhydrin färbt die Hände intensiv violett, man arbeitet deshalb mit Handschuhen. Saubere Reagenzgläser werden jeweils etwa 1 cm hoch mit Honig-, Kunsthonig- und Aminosäurelösung gefüllt. Nun werden 5 Tropfen Natronlauge und 5 Tropfen der Ninhydrinlösung zugefügt. Über der Brennerflamme wird schwach erhitzt. Beobachtung: Die Honig- und Aminosäurelösungen färben sich nach Erhitzen mit alkalischer Ninhydrinlösung violett. Die Kunsthoniglösung zeigt keine Reaktion mit dem Reagenz. Auswertung: Ninhydrin bildet mit Aminosäuren unter Decarboxylierung ein, über ein Stickstoffatom verknüpftes, Dimer. So entsteht ein violetter Farbstoff, der Ruhemannsche Purpur. Versuch 7 Herstellung von Honigaromen Material: 3 Reagenzgläser, Spatel, Wasserbad, Reagenzglasklammer, Brenner Chemikalien: versch. Aminosäuren (Prolin, Phenylalanin, Valin), Glucose, entionisiertes Wasser Entsorgung: Alle Lösungen werden verdünnt in den Abguss gegeben. Durchführung: In einem Reagenzglas werden je eine Spatelspitze der ausgewählten Aminosäure und Glucose mit einem Spatel gemischt, 5 Tropfen Wasser zugetropft und vorsichtig im kochenden Wasserbad erwärmt. Nun wird noch gelinde in der Brennerflamme erhitzt. Nach Abkühlen wird der Geruch und die Farbe der Proben notiert. Beobachtung: Die Proben haben schon nach kurzer Zeit im Wasserbad einen spezifischen Geruch. Die Farbe der Proben ändert sich während des Erhitzens im Brenner von weiß nach gelb (Nichtenzymatische Bräunungsreaktion) Aminosäure Aroma (Wasserbad) Aroma (Brenner) Prolin Frisches Brot Backaroma Phenylalanin Veilchen Flieder Valin Roggenbrot Schokolade Auswertung: Geschmacksvermittelnd sind die Monosaccharide, die Glucoronsäure sowie Prolin. Prolin (aber auch andere Aminosäuren) reagiert als sekundäres Amin bei den herrschenden Stocktemperaturen und dem sauren pH-Wert mit reduzierenden Zuckern in der Maillard-Reaktion. Diese nichtenzymatische Bräunungsreaktion bildet gelb bis braun gefärbte, duftende Verbindungen. 6. Schulrelevanz Durch den Hohen Alltagsbezug des Themas Honig und des vielfältigen Einsatzes aller Sinne, eignet sich das Thema hervorragend für Lernzirkel oder Projekttage. Das Thema behandelt gängige Reaktionen und viele Grundlagen der organischen Chemie, sodass eine vielfältige Chemie möglich ist. Die verständlichen Vergleichsreaktionen erlauben ein umfassendes Begreifen der Dinge. Da fast ausschließlich ungiftige Reagenzien verwendet werden, eigent sich das Thema Honig hervorragend für den Unterricht und ist sogar noch ausbaufähig. Zucker- und Aminosäurechemie, sowie Carbonsäuren und Oxidationsmittel könnten vertieft werden. Nachteil: Oftmals komplizierte bzw. noch ungeklärte Mechanismen Keine genauen Konzentrationsangaben – kaum reproduzierbare Werte. 7. Literatur Deifel, A.: Chemie in unserer Zeit, 1989, 23, 25 - 33. Mortimer, C.E.: Chemie, 6. Aufl., Georg Thieme Verlag, Stuttgart/New York 1996 Gerstner, E.: Skriptum zum anorganisch-chemischen Praktikum, 3. Aufl., Marburg 2003 Aurich, H.G., P. Rinze: Chemisches Praktikum für Mediziner, 5. Aufl., Teubner Verlag, Stuttgart, Leipzig, Wiesbaden 2001 Lipp J.: Naturwissenschaftliche Rundschau, 1988, 185 - 189. Bayer, H.; Walter, W.: Lehrbuch der organischen Chemie, S. Hirzel Verlag, Stuttgart, 1998. Peter/Vollhardt/Schore; Organische Chemie, VHC, Weinheim, 1995. Bader, H.J., Flint, A.: Beiträge zur Didaktik der Chemie. Bd. 2, Verlag, Harri Deutsch, 1999 Frings, Hans Joachim: Experimentelle Bienenkunde in der Schule. Aus vorhandenen Unterlagen fertiggestellt von Gerhard Winkel [Schulbiologiezentrum Hannover und Verein zur Förderung des Schulbiologiezentrums Hannover e.V.], Verein zur Förderung des Schulbiologiezentrums, 1994) Schwedt, Georg: Experimente mit Supemarktprodukten, Wiley VCH, 2001 Wörn, A., Lühken,A., Melle, J.: Honig, Chemieunterricht an einem interessanten Lebensmittel, PdN-Ch 6/46, S. 9ff, 1997