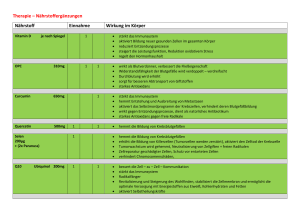
Spi-Ba 2
Werbung

Pharmakologische und Toxikologische Sicherheitsprüfung: o akute LD50 und LD90-Einmalgabe o chronische Mehrfachdosis (30 – 90 Tage) o Multigenerationstoxizität ( folgen für 2. oder Nachfolgegenerationen) o Umwelttoxiztät Auswirkungen auf Umwelt Nutztiere, Abbaubarkeit o Immunotoxizität / Allergenes Potential o Einfluss auf Lebensmittelherstellung o Karzinogenität (Teratogenität) o Mutagenität o Foetotoxizität (Wirkung auf Embryos und Foeten) „in vitro“- Toxizitätstest: billiger, schneller Cytotoxicität Photometrischer Test: Aufnahme (Neutralrot) ( Aufnahme nur von lebenden/toten Zellen) oder Synthese eines Farbstoffes nur lebende Zellen können synthetisieren (Formazan) in lebenden Zellen Ames- Test (Mutagenität): Bakterienwachstum: Entstehung von Revertanten ( Rückmutation) aus Mangelmutanten (metabolischer Defekt) Zellkommunikation (HG-PRT) Wachstum von Tumorzellen; wenn resistente und sensitive (nicht kranke) Zellen nebeneinander wachsen Zell-Zell-Kommunikation sensitive geben Schwäche weiter, Gegenmittel wirkt Limulus Test (Pyrogene): Gel-Bildung mit Lectinen Lectine aus Limulus reagien mit Endotoxinen gramneg. Bakterien Schwesterchromatid-Austausch Chromosomenschäden Austausch von DNA- Strängen nach BrdU Markierung, Untersuchung bei Zellteilung ob richtig weitergegeben (Semikonservativ) „Limb bud“ Test Embryotoxizität Isolierte Extremitätenknospen werden untersucht normale Entwicklung? Mikronukleus- Test Chromosenarrangement: Mikronuklei werden bei fehlerhafter Zellteilung vermehrt gebildet Aktivität: wie lang aktiv unter Feldbedingungen Abbauzeit (Ernte) Routineverfahren zum Rückstandsnachweis Wartezeit Angestrebte Eigenschaften: o wenig Behandlungen Arbeitsaufwand o vollständig abbaubar <-> Wirkdauer o problemlose Beseitigung von Resten Sondermüll, Kosten Unterschiede zwischen Mensch (Säuger) und Arthorpoden Bsp.: Endoskelett – Exoskelett Aufbau Exoskelett: Epicuticula: Wachsschicht dichtet Insekt ab Zerstörung führt zu Wasserverlust nicht letal Exo/Endocuticula Proteinmatrix mit Chitinfasern (sind von Proteinen umgeben, die mit Matrix vernetzt sind) Schichtdicke variiert, Sperrholzähnlicher Aufbau hohe Festigkeit bei geringem Gewicht; teilweise Metalleinlagerungen (willkürlich, Dotierungen höhere Festigkeit, Schärfe etc.) Epidermis scheidet Cuticula aus, bildet Cuticula für Häutung Chitinsynthese: Trehalose Glucose Glucose-6-P Fructose-6-P Glucosamin-6-P NAcetylglucosamin-6-P N-Acetylglucosamin-1-P Uridindiphosphat-N-Acetylglucosamin Aufklärung eines Stoffwechselwegs: Radioaktiv markierter Stoff der am Startpunkt der Synthese steht (z.B. Trehalose) wird verfüttert Radioaktivität läuft durch Stoffwechsel: wird in ein Zwischenprodukt nach dem anderen eingebaut sobald es unübersichtlich wird, Zufütterung von kalter Trehalose, verdrängt uneingebaute radioaktive Trehalose Pulse Chase labeling Vorraussetzung: genauer Start mit Stoffwechselanfang Probleme: Produkt muss nachweisbar sein Einbau in das richtige Makromolekül vgl. Chemischer Eigenschaften Glykoproteine: Nachweis über Verwendung von Proteasen / Basen lösen Proteine auf Glykolipide: werden durch alkalisches Medium zerstört Cellulose-Chitin: auflösen in Monomere Messung Massenspektroskopie Chitin: Resistent gegen KOH, Proteasen Abbau durch Säuren, Chitinasen besteht nur aus N-Acetylglucosaminmonomeren Testsystem: Zellkulturen Angriff auf Exoskelettproduktion UDP-Glucosamin wird polymerisiert ähnlicher Stoff zur kompetitiven Hemmung (z.B. Polyoxin D, Nikkomycin Z) andere Chitinsynthese bei Pilzen und Hefen niedermolekulares Chitin in einzelnem Polymerisationsschritt bei Insekten in Zelle: Bildung von Oligomeren, Polymerisation außerhalb der Zelle mehrstufiger Prozess, Membrangebundene Enzyme aber: Ähnlichkeit zur Wirbeltier-Glykoproteinsynthese darf nicht gehemmt werden (Bsp.: Tunicamycin: kompetitive Hemmung hemmt die Bildung von Chitin und Glycoproteinen) Benzoyl-Phenyl-Harnstoff: hemmt Chitinsynthese bei Arthropoden aber nicht bei Pilzen und die Glycoproteinsynthese hemmt vermutlich am Transport zur Zellmembran (GolgiVesikel spezifischer Zwischenschritt) Zufallsentdeckung, Entwicklungsstadien werden angegriffen, Adultformen nicht Entwicklungsinhibitor z.B. Plumbagin, Avemectin (Wurmmittel), Triazin (sehr reaktiv) weiterer Vorteil: keine Rückstände Harnstoffe hydrolisierbar Enzymtests für Chitinasen ohne Chitinauflösung keine Häutung einfacher Test ob Chitinasen nach Testmittel noch in der Lage sind Chitin aufzulösen 1. Zugabe von N-Acetylglucosamin-O-Farbstoff bei Exochitinase gebunden farblos, bei Spaltung bunt/fluoriszierend 2. Zugabe von N-Acetylglucosaminoligomeren bei Endonukleasen gleiches Prinzip wie bei 1 3. Zugabe von radioaktiven Chitin molekulare Spaltstücke Herstellung Chemisch: Glucosamin + Acetanhydrid* N-Acetylglucosamin* kompetitive Inhibition: PUCNACTM funktioniert nicht im Feld (nicht Umweltstabil) Chitin kann über unterschiedliche Wege abgebaut werden z.B. Versuch Aminozucker zur kompetetiven Hemmung des Substratumsatzes nicht Feldstabil Hemmung mit Allosamidin hemmt Endochitinasen Problem ist die komplizierte Synthese (2 Aminozucker und 5er Heterocyclus) Riesenaufwand Herstellung von (einfacheren) Derivaten und Überprüfung der Effektivität anhand der Leitstruktur 1 Zucker kann eingespart werden Abwandlung der Struktur und Vergleich der Wirkungskurven Detektion der für die Wirksamkeit wichtigen Strukturen Berechnung sehr kompliziert Enzym-Substrat-Komplex gegenseitige Verformung Züchten von Proteinkristallen Strukturaufklärung Röntgenstrukturanalyse Untersuchung der Substratbindungsstelle kein Wasser fixierte Struktur nicht realistisch Einsatz der NMR-Spektroskopie realistischer aber niedrige Auflösung Einsatz aller 3 Methoden ist sinnvoll, genauste Auswertung wenn alle drei verwendet Allosamidin breites Wirkspektrum aber nicht marktreif (nicht Feldstabil, Großsynthese) Styloguanidin Bakteriensyntheseprodukt keine Insektizide cyclische Dipeptide z.B. von Bacillus, Saccharomyces instabil, nicht für Feldeinsatz Chitinase-Hemmer: gute Ansätze, aber keine verwendbaren Substanzen