Klassenarbeit I,2: Chemie 13GE
Werbung
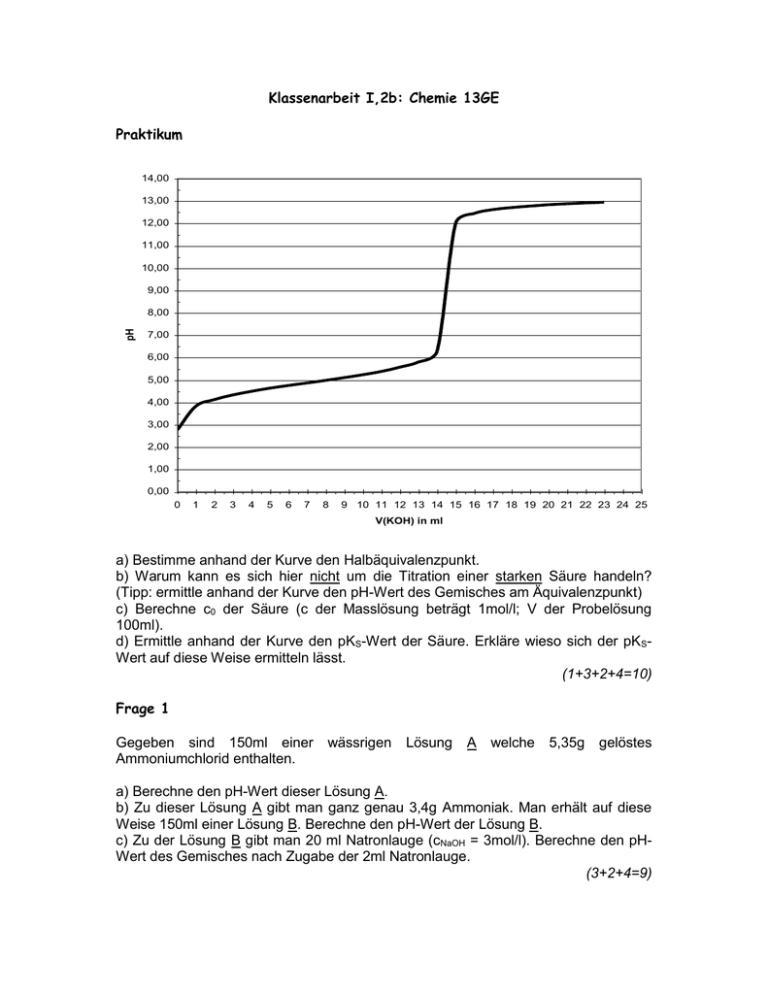
Klassenarbeit I,2b: Chemie 13GE Praktikum 14,00 13,00 12,00 11,00 10,00 9,00 pH 8,00 7,00 6,00 5,00 4,00 3,00 2,00 1,00 0,00 0 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 V(KOH) in ml a) Bestimme anhand der Kurve den Halbäquivalenzpunkt. b) Warum kann es sich hier nicht um die Titration einer starken Säure handeln? (Tipp: ermittle anhand der Kurve den pH-Wert des Gemisches am Äquivalenzpunkt) c) Berechne c0 der Säure (c der Masslösung beträgt 1mol/l; V der Probelösung 100ml). d) Ermittle anhand der Kurve den pKS-Wert der Säure. Erkläre wieso sich der pKSWert auf diese Weise ermitteln lässt. (1+3+2+4=10) Frage 1 Gegeben sind 150ml einer Ammoniumchlorid enthalten. wässrigen Lösung A welche 5,35g gelöstes a) Berechne den pH-Wert dieser Lösung A. b) Zu dieser Lösung A gibt man ganz genau 3,4g Ammoniak. Man erhält auf diese Weise 150ml einer Lösung B. Berechne den pH-Wert der Lösung B. c) Zu der Lösung B gibt man 20 ml Natronlauge (cNaOH = 3mol/l). Berechne den pHWert des Gemisches nach Zugabe der 2ml Natronlauge. (3+2+4=9) Frage 2 Bromthymolblau ist ein sogenannter Zweifarbenindikator. Die “Säureform” ist gelb, die “Baseform” blau. Der pKS-Wert von Bromthymolblau lautet 7,1. a) Gib das Protolysegleichgewicht mit Wasser von Bromthymolblau (HIn) an. b) Wieso ist die Farbe dieses Indikators in Wasser (pH=7,1) “grün”? Erkläre anhand der Henderson-Hasselbalch Gleichung. c) Erkläre anhand von a) wieso sich die Farbe von Bromthymolblau verändert, wenn man zu einer wässrigen Lösung von Bromthymolblau Natronlauge gibt. Welche “Farbe” ist dann zu erkennen? d) Hätte man Bromthymolblau als Indikator bei der unter “Praktikum” angegebenen Titration verwenden können? Begründe. Wie lautet am Äquivalenzpunkt (pH = 9) das Verhältnis c(Base)/c(HIn)? (1+3+3+2+2=11) Frage 3 a) Stelle ausgehend von der Basekonstante KB einer schwachen Base A- die Formel auf, welche die Berechnung des pH-Wertes einer wässrigen Lösung von Aermöglicht. Gib verwendete Näherungen an. b) 120ml einer Lösung welche 20mg reine Salpetrige Säure enthalten weist einen pH-Wert auf von 2,9. Berechne den Dissoziationsgrad α der Säure. Was passiert wenn man zu dieser Lösung Wasser gibt? Wird daduch α grösser oder kleiner? Erkläre. (4+6=10) Frage 4 Folgende Reaktionen laufen spontan unter Standardbedingungen ab: 1. A + 2B3+ A2+ + 2B2+ 2. 4B3+ + C- 4B2+ + C3+ 3. 2A2+ + C- C3+ + 2A 4. 4D- + C- 4D2- + C3+ a) Ermittele für jede Reaktion die beteiligten Redoxpaare. b) Stelle eine Redoxreihe auf. c) Läuft folgende Reaktion unter Standardbedingungen spontan ab? Erkläre. C3+ + 4B2+ 4B3+ + CFrage 5 (2+3+2=7) Reagieren die Lösungen folgender Salze sauer, basisch oder neutral? Erkläre anhand von Protolysegleichungen: a) Natriumhydrogenphosphat b) Ammoniumformiat c) Aluminiumnitrat (3+3+3=9)