Chemie_24.03.2011_Gruppe_B
Werbung

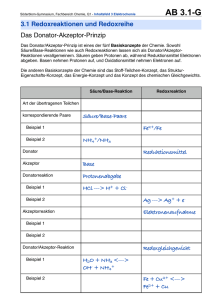
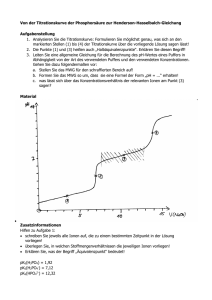
Prof. Dr. Angelika Brückner Dr. Thomas Werner 24. März 2010 Klausur zur Vorlesung – Grundlagen der Chemie – AÖ und LKU Gruppe B Vorname: _______________________________________________________ Name: _______________________________________________________ Matrikelnummer: _______________________________________________________ Studiengang: _______________________________________________________ Zum bestehen der Klausur werden 50 Punkte benötigt. Punkten zum Bestehen; Bewertung für diese Studiengänge: 1,0 100–98 1,3 1,7 2,0 2,3 2,7 3,0 3,3 3,7 4,0 97–95 94–90 89–85 84–80 79–75 74–69 68–63 62–57 56–50 Ergebnis: Aufgabe 1 Punkte Aufgabe 2 Punkte Aufgabe 3 Punkte Aufgabe 4 Punkte Aufgabe 5 Punkte Aufgabe 6 Punkte Aufgabe 7 Punkte Aufgabe 8 Punkte Aufgabe 9 Punkte Aufgabe 10 Punkte Aufgabe 11 Punkte Summe: Punkte 5,0 49–0 Note: _______ 1 Aufgabe 1 (insgesamt 10 Punkte) A) Geben Sie an zu welcher Stoffklasse die folgenden Verbindungen gehören (je 1 Punkt). Alkohol (1 P) Carbonsäure (1 P) Ester (1 P) Amin (1 P) Aldehyd (1 P) Amid (1 P) B) Geben Sie die Hybridisierung der durch einen Pfeil markierten Kohlenstoffatome an (je 1 Punkt). Hybridisierung des Kohlenstoffatoms: a: sp3 (1 P) b: sp (1 P) c: sp2 (1 P) d: sp2 (1 P) 2 Aufgabe 2 (insgesamt 10 Punkte) A) Zeichnen Sie alle Konstitutionsisomere der Summenformel C3H6Br2 und benennen Sie diese mit systematischen Namen (8 Punkte). B) Eines ist chiral, welches? Zeichnen Sie das R-Enantiomer (2 Punkte). 3 Aufgabe 3 (insgesamt 10 Punkte) Zeichnen Sie die Produkte folgender Reaktionen (jeweils 2,5 Punkte)! 4 Aufgabe 4 (insgesamt 10 Punkte) A) Fügen Sie bei den folgenden nucleophilen Substitutionsreaktionen die Formeln des fehlenden Produktes bzw. des fehlenden Eduktes ein (je 2 Punkte). Geben Sie auf den Reaktionspfeilen an, ob es sich jeweils um eine SN1- oder SN2-Reaktion handelt (je 1 Punkt). B) Methyliodid reagiert mit Magnesium zu einer Grignard-Verbindung, die mit Acetylbenzol nach Hydrolyse einen Alkohol liefert. Ergänzen Sie die Formeln der Grignard-Verbindung und des Alkohols (je 2 Punkte). 5 Aufgabe 5 (insgesamt 10 Punkte) A) In einer Sequenz von zwei elektrophilen Substitutionsreaktionen wird Benzol zunächst alkyliert und dann sulfoniert. Geben Sie die Konstitution des Zwischenproduktes und des Endproduktes an (je 2 Punkte). Achten Sie dabei auf die Regiochemie des Endproduktes. B) Bei den folgenden Reaktionen handelt es sich um typische Reaktionen von Carbonsäuren bzw. –derivaten. Geben Sie jeweils das Reaktionsprodukt an (jeweils 2 Punkt). 6 Aufgabe 6 (10 Punkte) Ergänzen Sie die folgende Tabelle durch die zugehörigen chemischen Formeln bzw. Namen der Verbindungen. Name Formel Formel Name Soda Na2CO3 K2HPO4 Kaliumhydrogenphosphat Salzsäure HCl NaOCl Natriumhypochlorit Perchlorsäure HClO4 H2O2 Wasserstoffperoxid Natriumhydrogensulfat NaHSO4 CaH2 Calciumhydrid Stickstoffmonoxid SO3 Schwefeltrioxid NO Je 1 Punkt pro Formel/Name 7 Aufgabe 7 (10 Punkte) Ermitteln Sie die fehlenden Werte in den Spalten 3 – 5 der folgenden Tabelle aus den gegebenen Werten (auf 3 Stellen genau). 1 2 4 5 Verbindung Molmasse M [g/mol] pH-Wert 13,37 Stoffmengenkonzentration c [mol/Liter] 0,25 g/Liter 53,49 Salpetersäure 63,01 78,76 1,25 -0,1 Essigsäure 60,05 48,42 0,81 2,42 Kaliumhydroxid 56,11 44,88 0,8 13,9 Ameisensäure 6,9 0,15 2,28 NH4Cl 3 5,18 (pKS = 9,75) (pKS = 4,75) 46,03 (pKS = 3,75) Je 1 Punkt pro Wert 8 Aufgabe 8 (12 Punkte) Ergänzen Sie folgende Aussagen: a) Schwache Brønstedsäuren liegen in Wasser unvollständig dissoziiert vor. 1 b) Die Lösung einer schwachen Säure und ihrer konjugierten Base nennt man Pufferlösung. 1 c) Man verwendet solche Lösungen um den pH- Wert konstant zu halten. 1 d) Die Beziehung zwischen dem pKS-Wert einer Säure und dem pKB-Wert der konjugierten Base lautet wie folgt: pKS + pKB = pKw = 14 1 e) Formulieren Sie die Reaktionsgleichung für das Protolysegleichgewicht von NH3 in wässriger Lösung. NH3 + H2O NH4+ + OH1 Geben Sie die Gleichungen für das Massenwirkungsgesetz (MWG) und die Basenkonstante (KB) an. MWG = [NH4+][OH-]/[NH3][H2O] 1 KB = [NH4+][OH-]/[NH3] Wie groß ist die Basenkonstante, wenn pKB = 4,75 beträgt ? KB = 1,78 x 10-5 mol/L 1 1 f) Geben Sie an, ob das jeweils unterstrichene Teilchen in den folgenden Reaktionsgleichungen eine Säure oder eine Base ist und unterstreichen Sie die korrespondierende Base bzw. Säure Das unterstrichene Teilchen ist eine HCO3- + OH- CO32- + H2O Säure 1 NH4+ + OH- NH3 + H2O Base 1 H2S + H2O HS- + H3O+ Base 1 HCOO- + H2O HCOOH + OH- Säure 1 9 Aufgabe 9 (9 Punkte) Vervollständigen Sie folgende Redoxgleichungen. Geben Sie die Teilgleichungen für die Reduktion und die Oxidation an. Beachten Sie die jeweilige Reaktionslösung! a) Auflösung von Aluminium in Salzsäure 2 Al + 6 H+ 2 Al3+ + 3 H2 2 Teilgleichung für die Oxidation: Al Al3+ + 3 e- 1 Teilgleichung für die Reduktion: 2 H + + 2 e - H2 1 b) Reaktion von Iod in basischer Lösung zu Iodid und Iodat 3 I2 + 6 OH- IO3- + 5 I- + 3 H2O 2 Teilgleichung für die Oxidation: ½ I2 + 6 OH- IO3- + 3 H2O + 5 e- 1 Teilgleichung für die Reduktion: ½ I2 + e - I- 1 Wie nennt man diesen Reaktionstyp? Disproportionierung 1 10 Aufgabe 10 (2 Punkte) Wie groß ist die Löslichkeit von HgS in Wasser bei 25°C (Löslichkeitsprodukt KL = 10-54 mol2/L2) Löslichkeit = [Hg2+] = [S2-] = 3,16 x 10-27 mol/L 11 Aufgabe 11 (7 Punkte) a) In welchen der folgenden Stoffe tritt überwiegend a) Ionenbindung oder b) Atombindung (kovalente Bindung) auf ? P4O10 KBr CaH2 NO 4 Ionenbindung KBr CaH2 P4O10 Atombindung NO b) Schreiben Sie die Lewis-Formeln (Valenzstrichformeln) für folgende Verbindungen auf. Berücksichtigen Sie dabei alle Valenzelektronen. HOCl SO3 NH4+ 3 |O| S O H O N+ H H H O H Cl| 12