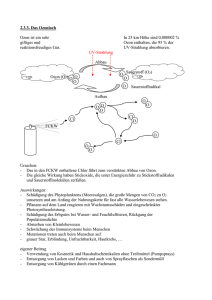
Protokoll ()
Werbung

Philipps-Universität Marburg Fachbereich Chemie Sommersemester 2008 Datum: 26.06.2008 Hinweis: Dieses Protokoll stammt von der Seite www.chids.de (Chemie in der Schule). Dort können unterschiedliche Materialien für den Schulunterricht heruntergeladen werden, unter anderem hunderte von Experimentalvorträgen so wie der vorliegende: http://www.chids.de/veranstaltungen/uebungen_experimentalvortrag.html Protokoll zum Experimentalvortrag Einführung in die Halogenalkane von Elmar Schneider Elmar Schneider Inhalt: 1. Vorbemerkung......................................................................Seite 3 2. Allgemeines.........................................................................Seite 4 3. Physikalische Eigenschaften der Halogenalkane.........................Seite 5 4.Möglichkeiten der Weiterreaktion von Halogenalkanen................Seite 8 5. Synthese von Halogenalkanen..............................................Seite 14 6. Bedeutung der Halogenalkane in unserem Alltag.....................Seite 17 7. Umweltproblematik.............................................................Seite 20 8. Versuchsvorschriften...........................................................Seite 28 9. Schulrelevanz.....................................................................Seite 44 10. Quellen............................................................................Seite 46 2 1. Vorbemerkung Das Thema Halogenalkane taucht im Lehrplan erst ab der zehnten Jahrgangsstufe auf. Das Thema an sich halte ich für den Unterricht sehr wichtig. Mit Hilfe dieses Themas kann man meiner Meinung nach die wichtigsten schulrelevanten Reaktionsmechanismen zeigen. Dazu gehören die Mechanismen der Substitution, Eliminierung und Addition. Außerdem kann man auf die Umweltproblematik einiger Fluorchlorkohlenwasserstoffe (kurz FCKW) hinweisen. Hierbei kann man im Unterricht wunderbar auf den Abbau der Ozonschicht in der Stratosphäre durch FCKW eingehen. Außerdem bilden die Halogenalkane die Grundlage der Synthese von industriell sehr wichtigen Chemikalien, wie z. B. bei der Herstellung von Alkoholen. Hierauf soll im Folgenden aber noch genauer eingegangen werden. Gerade, weil ich persönlich das Thema für die Schule, wie schon gesagt, sehr interessant und spannend finde und mir spontan schon einige Versuche zu diesem Thema eingefallen sind, habe ich mich entschlossen, dieses Thema in einem Experimentalvortrag etwas genauer zu beleuchten. 2. Allgemeines 3 Halogenalkane (Alkylhalogenide) sind Verbindungen, in denen ein Wasserstoff-Atom eines Alkans durch ein Halogen-Atom (also: durch Fluor, Chlor, Brom oder Iod) ersetzt wurde. Sie werden in primäre, sekundäre und tertiäre Halogenalkane unterteilt, je nach Substitutionsgrad des Kohlenstoff-Atoms, an dem das Halogen-Atom gebunden ist. Die Vinylhalogenide werden häufig als vierte Alkylhalogenid-Klasse bezeichnet. Die gebräuchliche Benennung der Alkylhalogenide stellt die Alkyl-Gruppe nach vorn, gefolgt vom Namen des Halogens. Die systematische IUPAC-Nomenklatur (angegeben in Klammern) behandelt die Halogenalkane als subsituierte Alkane, d.h. das jeweilige Halogen besitzt den gleichen Rang wie eine Alkyl-Gruppe. Die Substituenten werden (wie gewöhnlich) alphabetisch geordnet. Bei der Benennung von ungesättigten Halogeniden haben die Doppelbzw. Dreifachbindungen Vorrang vor den Halogensubstituenten. 4 Einige häufig verwendete chlorierte Lösungsmittel sind unter ihren Trivialnamen bekannt, beispielsweise Tetrachlorkohlenstoff (CCl4), Chloroform (CHCl3) und Methylenchlorid (CH2Cl2). Nachweisen lassen sich die Halogene in den Halogenalkanen durch die Beilsteinprobe (Versuch 1). 3.Physikalische Eigenschaften der Halogenalkane Halogenalkane unterscheiden sich in ihren physikalischen Eigenschaften deutlich von den entsprechenden Alkanen. Bindungsstärken, Bindungslängen, Dipolmomente und Siedepunkte werden stark von den unterschiedlichen Größen der Halogenatome und von der Polarität der Kohlenstoff-Halogen-Bindung beeinflusst. Die C-X-Bindungsstärke nimmt mit zunehmender Größe von X ab. Die Bindung zwischen einem Kohlenstoffatom und einem Halogenatom kommt durch die Überlappung eines sp3-Hybridorbitals des Kohlenstoffatoms mit einem p-Orbital des Halogenatoms zustande. Da in der siebten Gruppe die Größe von Fluor zu Iod zunimmt, kann das p-Orbital, welches dadurch auch immer größer wird, nicht mehr so gut mit dem Kohlenstofforbital überlappen. Dies hat zur Folge, dass die C-XBindung immer länger und schwächer wird. 5 Halogenalkan (Alkylhalogenid) Bindungslänge (pm) 138.5 178.4 192.9 213.9 Dipolmoment (D) 1.85 1.87 1.81 1.62 Dissoziationsenergien (kJ/mol) 461 356 297 239 Tab.1 Charakteristisch für die Halogenalkane ist die polare C-X-Bindung. Halogene sind elektronegativer als Kohlenstoff. Deshalb ist die Elektronendichte entlang der C-XBindung in Richtung des Halogens verschoben, das Halogen trägt eine partielle negative Ladung (-) und das Kohlenstoffatom eine partielle positive Ladung (+). Der Bereich um das Halogen ist elektronenreicher, als der um das an das Halogen gebundene Kohlenstoffatom. Dadurch wird dieses Kohlenstoffatom elektrophiler. Deshalb kann es leichter von Nucleophilen, wie z. B. Anionen und anderen elektronenreichen Verbindungen, angegriffen werden. Polarer Charakter der C-X-Bindung Abb. 1 In der Schule kann man zur Verdeutlichung des Dipolcharakters von Molekülen Demonstration 1 vorführen. Der polare Charakter der C-X-Bindung ist hauptsächlich dafür verantwortlich, dass Halogenalkane einen höheren Siedepunkt haben als die entsprechenden Alkane. Die Dipolstruktur der Halogenalkane führt nämlich in flüssiger Phase zu Dipol-Dipol-Wechselwirkungen. Dipol-Dipol-Wechselwirkung Abb. 2 6 Außerdem nehmen die Siedepunkte mit steigender Größe des Halogenatoms zu. Dies wird durch die größere molare Masse und die stärkeren London-Kräfte bedingt. Die London-Kräfte werden größer, je stärker polarisierbar ein Molekül ist. Bei Molekülen, die schwere Atome der höheren Perioden enthalten können die Elektronen vom Kern nicht mehr so stark angezogen werden. Dadurch sind diese Moleküle stärker polarisierbar. Tab. 2: Siedepunkte von Alkanen und Halogenalkanen (R—X) (in °C) 4. Möglichkeiten der Weiterreaktion von Halogenalkanen Nucleophile Substitution 7 Halogenalkane reagieren oft mit Verbindungen, die ein ungepaartes Elektronenpaar aufweisen, meist mit einem Anion wie Hydroxid (OH-), oder einem neutralen Teilchen wie Ammoniak (NH3). Solche Reagenzien können das Halogenalkan angreifen und den Halogensubstituenten ersetzen. Dieser Vorgang wird als nucleophile Substitution bezeichnet. Wie bereits erwähnt, erzeugt die Polarität der positive C-X-Bindung Partialladung Kohlenstoffatom, eine am wodurch es elektrophil wird. Das elektrophile Kohlenstoffatom möchte elektronenreichen, Verbindungen verlässt mit nucleophilen, reagieren. ein Dabei Halogenid-Ion das Halogenalkan-Molekül. Die nucleophile Substitution ist sehr variationsreich. Viele Stoffe können mit Hilfe der nucleophilen Substitution hergestellt werden (siehe Tabelle 3,rechts). Man unterscheidet, Reaktionskinetik, Arten der je folgende nach zwei Nucleophilen Substitution: SN1: Nucleophile Substitution erster Ordnung SN2: Nucleophile Substitution zweiter Ordnung Im folgenden sei nur kurz auf die wesentlichen, schulrelevanten Unterschiede dieser beiden Reaktionstypen eingegangen. Würde man sich noch genauer mit den Reaktionsmechanismen beschäftigen, so würde dies den Rahmen des Vortrags, sowie den Rahmen dieser Verschriftlichung sprengen. 8 4.1 SN1: Nucleophile Substitution erster Ordnung Als Beispiel sei hier folgende Reaktion betrachtet: Im Falle von tertiären Halogenalkanen wie t-Butylbromid verhindern die drei Alkylgruppen aufgrund ihrer räumlichen Ausdehnung den Angriff des Hydroxid-Ions von der Brom-Atom gegenüberliegenden Seite. Man spricht dabei von einer sogenannten sterischen Hinderung. Dadurch kommt es im ersten Reaktionsschritt zur Abspaltung eines Bromid-Ions unter Bildung eines Carbenium-Ions als Zwischenstufe. Dessen Bildung wiederum wird dadurch begünstigt, dass es sich um ein relativ stabiles tertiäres Carbenium-Ion handelt. Darüber hinaus wird der SN1-Mechanismus durch polare Lösungsmittel begünstigt, da diese durch Solvatation das Carbenium-Ion zusätzlich stabilisieren können. Der erste Reaktionsschritt ist monomolekular. Da dieser Reaktionsschritt der langsamste und somit geschwindigkeitsbestimmende Schritt ist, verläuft die Gesamtreaktion nach einem Geschwindigkeitsgesetz erster Ordnung. Als starke Lewis-Säure lagert das Trimethylcarbenium-Ion schnell das nucleophile Hydroxid-Ion an. Da das Carbenium-Ion planar ist, kann die Anlagerung des OH--Ions von beiden Seiten erfolgen. Verglichen zur ursprünglichen Anordnung der Methyl-Gruppen in der tertiären Alkyl-Gruppe können die Methyl-Gruppen nach der Reaktion die gleiche Orientierung haben wie vor der Reaktion, oder sie können umgeklappt sein. Dieser Aspekt ist bei chiralen Molekülen von Bedeutung. 9 4.2 SN2: Nucleophile Substitution zweiter Ordnung Als Beispiel sei hier folgende Reaktion betrachtet: Das nucleophile Hydroxid-Ion, eine Lewis-Base, greift das partiell positiv geladene Kohlenstoff-Atom an und verdrängt das Bromid-Ion. Das Hydroxid-Ion greift dabei von der zum Brom-Atom entgegengesetzten Seite an. In dem Maße, wie es sich dem Kophlenstoff-Atom nähert, beginnt sich eine kovalente Bindung zwischen dem Sauerstoff- und dem Kohlenstoff-Atom auszubilden. Gleichzeitig wird die C-BrBindung geschwächt, bis das Bromid-Ion abgespalten ist. Im Übergangszustand sind beide nucleophilen Gruppen partiell an das Kohlenstoff-Atom gebunden. Die geometrische Anordnung der Wasserstoff-Atome wird bei der Reaktion invertiert, indem die H-Atome so ähnlich umklappen wie ein Schirm bei starkem Wind. Die Bezeichnung SN2 steht für die nucleophile Substitution zweiter Ordnung, da der geschwindigkeitsbestimmende Schritt, die Bildung des Übergangszustandes, bimolekular ist. Polar aprotische Lösungsmittel sind bei SN2-Reaktionen sehr nützlich. Das Nucleophil wird von dieser Art Lösemittel weniger fest solvatisiert, da hier keine Wasserstoffbrückenbindungen ausgebildet werden können, wodurch seine Reaktivität gesteigert wird. 10 In dem Zusammenhang mit der nucleophilen Substitution sollten den Schülern folgende Sachverhalte meiner Meinung nach genauer vermittelt werden, da sie selbst von Schülern leicht nachvollzogen werden können: - Primäre Halogenalkane reagieren nach dem SN2-Mechanismus und tertiäre nach dem SN1-Mechanismus. Dies hängt einerseits mit der sterischen Abschirmung der dem X-Atom gegenüberliegenden Seite und der Stabilität des sich bei der SN1-Reaktion bildenden Carbenium-Ions andererseits zusammen. Über sekundären Halogenalkanen den Reaktionsmechanismus von lässt sich nur schwer eine Aussage machen. - Gerade im Zusammenhang mit den Halogenalkanen kann man auch genauer auf den Einfluss der Abgangsgruppe bei der nucleophilen Substitution eingehen. Die Abgangsgruppe in einer nucleophilen Substitution ist häufig negativ geladen. Daher lässt sich die relative Leichtigkeit, mit der sie substituiert wird, mit ihrer Fähigkeit, eine negative Ladung zu stabilisieren, korellieren. Bei den Halogenen nimmt das Austrittsvermögen von Fluor zu Iod hin zu. Ob Halogenide gute oder schlechte Abgangsgruppen sind lässt sich anhand ihrer Basenstärke erkennen. Je schwächer basisch X- ist, d. h. je stärker die konjugierte Säure HX ist, desto besser fungiert X- als Abgangsgruppe. 4.3 Eliminierung 11 Halogenalkane sind nicht nur in der Lage, nucleophile Substitutionsreaktionen einzugehen. Je nach Reaktionsbedingungen können sie auch Eliminierungsreaktionen durchlaufen. Eliminierungen verlaufen ähnlich wie nucleophile Substitutionsreaktionen. Die nucleophile Gruppe wird jedoch nicht angelagert, sondern sie bewirkt eine Ablösung eines Protons (die nucleophile Gruppe reagiert also als Base). Im Falle von tertiären Halogenalkanen ist bei der Eliminierung der erste Reaktionsschritt der gleiche wie bei der SN1-Reaktion, d. h. die monomolekulare Heterolyse zum Carbenium-Ion. Als Beispiel diene nochmals die Reaktion von t-Butylbromid mit Hydroxid-Ionen. Dieser Reaktionsverlauf wird E1-Mechanismus genannt. Der E1-Mechanismus läuft bevorzugt dann ab, wenn das zwischenzeitlich auftretende Carbenium-Ion relativ stabil und das Medium sauer ist. Bei Anwesenheit von Basen (z. B. OH-) macht dagegen der E2-Mechanismus das Rennen. Dabei verläuft die Bindungsbildung und -spaltung genau so wie beim SN2-Mechanismus. Im Unterschied zur SN2-Substitution reagiert die nucleophile Gruppe jedoch nicht mit dem Kohlenstoff-Atom, das die Abgangsgruppe trägt, sondern mit einem Proton. Wie in den gezeigten Beispiel stammt das abgespaltene Proton meistens vom benachbarten -C-Atom. Deshalb spricht man hier auch von einer -Eliminierung. Als Reaktionsprodukt erhält man ein Alken. In der Schule sollten sich die Schüler über folgendes im Klaren sein: 12 - Nucleophile Substitutionsreaktionen und Eliminierungsreaktionen stehen meistens in Konkurrenz zueinander. Bei einer Substitution ist die Anzahl der Teilchen vor und nach einer Reaktion gleich groß. Bei einer Eliminierung ist die Zahl der Teilchen nach der Reaktion größer. Damit nimmt die Unordnung im System zu, die Reaktionsentropie S ist positiv. Gemäß G = H - TS begünstigt eine hohe Temperatur die Eliminierungsreaktion. Einen genaueren Überblick wann ein Halogenalkan nach welchem Mechanismus reagiert soll folgende Tabelle liefern: Typ des Nucleophils (Base) Typ des Halogenalkans schwach schwaches stark basisches, basisches, Nu ungehindertes Nustarkes Nu(z.B. H2O) (z.B. CH3O-) (z.B. I-) stark basiches, gehindertes Nu(z.B. (CH3)3CO-) Methyl - SN2 SN2 SN2 primär - SN2 SN2, E2 E2 sekundär langsame SN1, E1 SN2 E2 E2 tertiär SN1, E1 SN1, E1 E2 E2 Tab. 4 5. Synthese von Halogenalkanen Um Halogenalkane herzustellen gibt es mehrere Möglichkeiten. Sie lassen sich nämlich durch Additions- bzw. Substitutionsreaktionen herstellen: 13 - Durch Addition der Hydrogenhalogenide HCl, HBr und HI (HX) an Alkene sind monohalogenierte Alkane leicht zugänglich. Hierbei handelt es sich um die sogenante Markovnikov-Addition (Markovnikov-Regel: Das Wasserstoff-Atom geht dort hin, wo schon die meisten Wassterstoff-Atome vorhanden sind. Nach heutigen Erkenntnissen würde man sagen, dass sich das intermediär stabilste Kation bildet.). Die Addition von Brom und Chlor ergibt die entsprechenden 1,2-Dihalogenalkane (Versuch 2). Genauere Erklärungen kann man in den Versuchsvorschriften nachlesen. Hier noch ein kurzes Beispiel zu den unterschiedlichen Additionen: - Eine weitere Möglichkeit der Halogenalkan-Synthese ist die radikalische Substitution eines Alkans mit Chlor oder Brom (Versuch 3). Diese Methode ist aber synthetisch nur begrenzt brauchbar, da als Reaktionsprodukte auch di-, tri- und tetrahalogenierte Alkane entstehen. Als Beispiel sei hier die radikalische Chlorierung von Methan auf der folgenden Seite gezeigt. Wie man sieht entsteht nicht nur Chlormethan, sondern auch Dichlor-. Trichlor- und Tetrachlormethan. Um nur eines der Produkte zu isolieren müsste die entstandene Mischung weiter aufgearbeitet werden. Dies wäre wiederum mit zusätzlichen Kosten verbunden. 14 - In Allyl-Stellung lässt sich dagegen mit N-Bromsuccinimid (NBS) eine gezielte Einfachsubstitution erreichen. Diese Reaktion wurde zuerst von Karl Ziegler im Jahre 1942 beschrieben. In der Schule spielt diese Reaktion in meinen Augen eher eine untergeordnete Rolle. Um Chlor an die Allylposition zu substituieren benötigt man NCS (N-Chlorsuccinimid). Diese Art von Reaktion sei hier nur der Vollständigkeit halber am Beispiel der Bromierung von Cyclohexen erwähnt: - Die Herstellung von Halogenalkanen aus Alkoholen ist die gebräuchlichste Methode. Die einfachste Möglichkeit dabei ist die direkte Umsetzung eines Alkohols mit HCl, HBr oder HI mit OH-. Allerdings verläuft diese Reaktion nur mit tertiären Alkoholen schnell und bei moderaten Temperaturen. Bei primären und sekundären Alkoholen ist die Reaktionsgeschwindigkeit deutlich niedriger, und es muss bei höheren Temperaturen gearbeitet werden. Die Reaktionsgeschwindigkeit bei der Umsetzung von HX mit tertiären Alkanolen ist dagegen häufig so schnell, dass einfach nur reines HCl oder HBr durch den Alkohol geleitet werden muss. Nach wenigen Minuten erhält man schon relativ gute Ausbeuten. Tertiäre Alkohole nehmen bei diesen direkten Substituenten eine Ausnahmestellung ein, weil die schlechten Abgangsgruppen-Eigenschaften der Hydroxy-Gruppe durch das intermediär entstehende tertiäre Carbenium-Ion kompensiert werden bzw. Wasser als gute Abgangsgruppe gebildet wird. Primäre und sekundäre Alkohole, die normalerweise über einen SN2Mechanismus substituiert werden, müssen über den Umweg einer verbesserten Abgangsgruppe in die Alkylhalogenide überführt werden. 15 Geeignet sind Halogenierungsmittel wie Thionylchlorid (SOCl2) oder Phosphortribromid (PBr3). Diese Reaktionen laufen im Regelfall unter milden Bedingungen ab und die Gefahr, dass es zu säurekatalysierten Umlagerungen kommt ist gering. 6. Bedeutung der Halogenalkane in unserem Alltag 6.1 Halogenalkane in der Natur Halogenhaltige organische Verbindungen kommen in der Natur in größerer Anzahl vor und werden beispielsweise in Medizin und Technik eingesetzt. So wird beispielsweise Chlorethan als Hautkühlungsmittel verwendet. Halothan (2-Brom-2chlor-1,1,1-trifluorethan) ist heute ein wichtiges Narkosemittel. Waldbrände, Vulkanausbrüche und maritime Stoffwechselprozesse produzieren etwa 5 Millionen Tonnen Chlormethan pro Jahr, während die industriellen Emissionen bei nur etwa 26.000 Tonnen pro Jahr liegen. Bromtrifluormethan wird z.B. als Löschmittel in Flugzeugen und für elektrische Bauteile benutzt, weil es ohne Rückstand verdampft. Im menschlichen Organismus ist das iodhaltige Hormon Thyroxin (T4) wichtig: Thyroxin-Mangel führt zur so genannten Kropfbildung. Diese Krankheit war besonders in ozeanfernen Gebieten verbreitet, deshalb wurde dort dem normalen Speisesalz Kaliumiodid zugemischt, damit der Körper Thyroxin produzieren konnte. Thyroxin: 16 Halogenhaltige organische Verbindungen sind besonders häufig bei maritimen Salzwasserorganismen (z.B. bei Korallen) zu finden. Da Halogenalkane tendenziell giftig sind, dienen sie vorwiegend zur Abwehr von natürlichen Feinden. 6.2 Halogenalkane in Indusrie und Landwirtschaft Halogenhaltige Kohlenwasserstoff-Verbindungen sind für die chemische Industrie wichtige Grundstoffe und Lösungsmittel: Dichlormethan (CH2Cl2, Methylenchlorid), Trichlormethan (CHCl3, beispielsweise als Chloroform) Lösungs- und und Trichlorethylen Entfettungsmittel (Cl2CCHCl) werden verwendet. Ihre Umweltverträglichkeit ist allerdings problematisch. Sie lösen ebenso Fette der Haut und stehen deshalb in Verdacht, eine Dermatitis auszulösen. In der Landwirtschaft sind Halogenalkane als Herbizide (z.B. 2,4-D) und Fungizide (z.B. Brommethan und Captan) im Einsatz. Das in Deutschland schon seit Jahrzehnten verbotene Insektizid DDT hat in malaria-, typhus- und choleragefährdeten Ländern sehr wirksam die krankheitsübertragenden Insekten bekämpft und somit Millionen von Menschen das Leben gerettet. DDT steht in Verdacht, sich im Fettgewebe von Warmblütern anzureichern und somit schädlich zu wirken - dies führte bereits in den 70er Jahren zu einem Verwendungsverbot in fast allen Industrieländern. Heute 17 ist bekannt, dass DDT nicht krebserregend ist, aber dennoch das Erbgut schädigt. Die Abbildung 3 auf der rechten Seite zeigt brüchige Eierschalen, die durch hohe Konzentrationen von Pestizidrückständen entstanden sind. Gegenwärtig werden mehr als 15.000 halogenierte organische Verbindungen für industrielle Anwendungen produziert. Sie dienen als Grundstoffe für die Herstellung von PVC, von industriellen Schmiermitteln, Pestiziden, Insektiziden und Herbiziden, sind Lösungsmittel u. v. a. m.. Viele Stoffe können kaum oder gar nicht biologisch abgebaut werden. Verbindungen wie Lindan und Chlordan schädigen ebenso wie, die als flüssiges Isoliermaterial für elektrische Geräte eingesetzten, PCBs (polychlorierte Biphenyle) sogar das Erbgut. PCBs wurden schon in den frühen 20er Jahren wie oben beschrieben eingesetzt. Erst 1976 wurden sie verboten. Sie sind ein Hauptverschmutzer in der Region der Großen Seen in den USA. Ein PCB: Decachlorbiphenyl: 18 Fluorchlorkohlenwasserstoffe (FCKW) oder Freone wurden bis Mitte der 1980er Jahre in großen Mengen produziert. Freone sind Alkane, bei denen alle Wasserstoff-Atome durch Chlor- oder Fluor-Atome ersetzt sind. Freone sind kostengünstig in der Herstellung, stabil, ungiftig und weder entflammbar noch korrosiv. Sie galten als die idealen Stoffe für eine Vielzahl von Anwendngen, z.B. als Treibmittel in Deos, als Kühlmittel in Kühl- und Gefrierschränken und Feuerlöschmittel. Unglücklicherweise ist es gerade die Stabilität der FCKW, die sie heute zu einem großen Umweltproblem machen. Sie gelten als Hauptverursacher des Ozonabbaus in der Stratosphäre. Ihre Produktion ist heute weltweit verboten. Dazu jedoch mehr unter dem Kapitel Umweltproblematik. Beispiele für Fluorchlorkohlenwasserstoffe: 7.Umweltproblematik Wie schon gesagt können einige Substanzen nicht oder nur schwer in der Natur abgebaut werden. Dies ist der Grund dafür, dass sie heute noch, Jahrzehnte nach ihrem Verbot in der Natur in signifikanten Mengen nachgewiesen werden können. Zahlreiche Lösungsansätze für das Problem der Nutzung und Entsorgung von chlorierten organischen Verbindungen wurden entwickelt. Beispielsweise kann Kohlendioxid unter leicht erhöhtem Druck und Temperatur verflüssigt werden. Somit 19 kann man Kohlendioxid nutzen, um Coffein aus Kaffeebohnen zu extrahieren, wozu man vorher Dichlormethan verwendet hat. Durch kontrollierte Verbrennung kann man Abfall, der halogenierte Kohlenwasserstoffe enthält, mit nur geringem Schaden für die Umwelt entsorgen. Das größte Problem, die Dekontamination von verseuchtem Gelände, hat man durch zahlreiche neue Technologien in den Griff bekommen. Zur biologischen Dekontamination werden bei den Böden Mikroorganismen eingesetzt, die sich von chlorierten organischen Substanzen ernähren. Schon in den frühen 90er Jahren hatten exotische anaerobe Organismen, die im Bereich des Hudson River natürlich vorkommen, den Hauptteil des Chlors der in den Flusssedimenten abgelagerten PCBs beseitigt, indem sie diese Moleküle in Substanzen umwandelten, die von gewöhnlichen aeroben Organismen leicht abbaubar waren. Leider lässt sich zur Zeit noch nicht abschätzen, ob menschliche Anstrengungen bei der biologischen Dekontamination im großen Maßstab erfolgreich sein werden. Das schon oben angesprochene Problem des Ozonabbaus in der Stratosphäre ist dadurch noch nicht gelöst. Deshalb sei hier nochmals genauer darauf eingegangen. Die Ozonschicht Erdatmosphäre schützt die Erde vor hochintensiver UV-Strahlung. Die besteht aus mehreren Schichten. Die niedrigste Schicht, bis ca. 15 km Höhe, ist die Troposphäre. Innerhalb Troposphäre der finden Prozesse statt, die unser Wetter stärk beeinflussen. Die nächsthöhere Schicht, bis 50 km oberhalb der Erdoberfläche, ist die Stratosphäre. Inmitten der Stratosphäre befindet sich die Ozonschicht, die eine entscheidende Rolle für das Leben auf der Erde spielt. Durch kurzwellige UVStrahlung stehen Ozon(O3) und molekularer Sauerstoff (O2) innerhalb der 20 Stratosphäre im Gleichgewicht. Die Gegenseitige Umwandlung von Ozon und molekularem Sauerstoff in der Stratosphäre sieht folgendermaßen aus: In den ersten beiden Reaktionen wird aus molekularem Sauerstoff Ozon gebildet. Ozon ist ein bläuliches, charakteristisch riechendes giftiges Gas. Gelegentlich kann man die Bildung von Ozon in der Nähe von Hochspannungsgeräten beobachten, wo es aufgrund elektrischer Entladung aus Sauerstoff entsteht. Die Gegenwart von Ozon in der Nähe der Erdoberfläche verursacht schwere Reizungen der Atmungsorgane und der Augen. In der höheren Atmosphäre jedoch absorbiert Ozon UV-Strahlung zwischen 200 und 300 nm. Strahlung dieser Wellenlänge kann komplexe biochemische Moleküle zerstören. Durch die Absorption wird die Rückreaktion ausgelöst, d. h. molekularer Sauerstoff und Sauerstoffatome werden freigesetzt (Versuch 4). Ozon dient als ein natürlicher atmosphärischer Filter, der verhindert, dass schädigende Strahlung dieser Wellenlänge die Erde erreicht. Dadurch wird das Leben auf der Erde vor möglichen Schäden geschützt. Fluorchlorkohlenwasserstoffe sind thermisch stabil geruchlos und ungiftig. Unter ihren vielen Einsatzmöglichkeiten ist die Verwendung als Kühlmittel von Bedeutung, da sie während des Verdampfungsprozesses große Wärmemengen absorbieren können. Komprimierte verflüssigte FCKW fließen als Kühlmittel durch die Kühlschlangen von Kühlschränken, Gefriertruhen und Klimaanlagen. Da das Funktionsprinzip des Kühlschranks für Schüler bestimmt sehr interessant ist, da es mit ihrer eigenen Lebenswelt zutun hat, sei es an dieser Stelle noch einmal erwähnt: 21 Abb. 5 (Aufbau eines Kühlschranks) 1. In der Leitungsschlange im Kühlschrankinneren (1) verringert ein geringer Druck den Siedepunkt des Kühlmittels. Das Kühlmittel verdunstet, wird gasförmig und nimmt dabei die Wärme des Kühlschrankes auf. (Die Verdunstung spielt sich natürlich nur innerhalb der Leitung ab. Das Kühlmittel entweicht nicht etwa in den Innenraum des Kühlschranks. Die Folge: Im Kühlschrank wird es kälter. Diese Form der Kühlung heißt Verdunstungskälte (Demonstration 3). 2. Der Verdichter, oder Kompressor (2) saugt das nun gasförmige Kühlmittel aus dem Inneren des Kühlschrankes ab und erhöht den Druck. 3. Nächste Durchlaufstation sind die Kühlrippen (3) auf der Rückseite des Kühlschranks. Sie haben viele Windungen, zusätzliche Stäbe und damit eine große Oberfläche. Der vom Kompressor verursachte hohe Druck sorgt dafür, dass das Gas kondensiert (Demonstration 2). Dabei wird überschüssige Energie als Wärme über die vielen Kühlrippen und von dort aus über die Lüftungsschlitze (4) nach außen abgegeben. Diese Energie heißt Kondensationswärme. Weil das Gas in den Kühlrippen kondensiert und über 22 die Kühlrippen die Wärme an die Umgebung abgegeben wird, heißen sie auch Kondensator (3) oder Wärmetauscher (3). 4. Am Ende der Kühlrippenleitung drückt die Pumpe des Kompressors die Kühlflüssigkeit durch ein Ventil (5) wieder in die Leitung des Kühlschrankinnenraumes zurück. Hinter dem Ventil herrscht wieder ein geringerer Druck und der Kreislauf beginnt von vorne. Die gewünschte Temperatur regelt ein Thermostat (6) im Innenraum. In den späten 60er und frühen 70er Jahren fand man Beweise für einen Radikalkettenmechanismus, der zu der Überführung zahlreicher Verbindungen, u. a. FCKW, in reaktive Radikale führt, die wiederum Ozon in der Stratosphäre zerstören (Versuch 5). Durch UV-Strahlung kann die schwächere C-Cl-Bindung in Freonen so gebrochen werden, dass atomares Chlor freigesetzt wird. Chloratome reagieren mit Ozon nach dem Mechanismus einer radikalischen Kettenreaktion. Das Ergebnis dieser beiden Schritte ist die Überführung eines Moleküls Ozon und eines Sauerstoff-Atoms in zwei Moleküle Sauerstoff. Da nach Ablauf der Reaktionen immer wieder ein Chloratom zur Verfügung steht reichen schon geringe Konzentrationen an Chlor aus um viele OzonMoleküle zu zerstören. Seit den ersten Messungen der Zusammensetzung der Atmosphäre wurde eine deutliche Abnahme des stratosphärischen Ozons festgestellt. Diese Abnahmen sind 23 abhängig von der Jahreszeit, wobei die deutlichste im Winter erfolgt. 1978 wurde schon eine starke Reduzierung der Ozonschicht über der Antarktis beobachtet. Satellitenmessungen bestätigten 1987, dass der Ozongehalt in diesem Teil der Atmosphäre weniger als die Hälfte des üblichen Wertes betrug. Anschließende Messungen über der Antarktis ergaben, dass in jedem Frühjahr seit 1995 mehr als 85 % des Ozons in der unteren Stratosphäre zerstört werden. Über einigen Regionen der Antarktis gab es überhaupt keine Ozonschicht mehr. Im Oktober 2000 erstreckte sich ein „Ozonloch“ mit der 2,5fachen Größe Europas bis an das südliche Südamerika. Diese Entdeckung veranlasste die chilenische Regierung eine Warnung vor Sonnenbrand mit dem Hinweis, dass die ungeschützte Haut schon nach sieben Minuten in der Sonne verbrennt, an die Einwohner von Punta Arenas und Terra del Fuego herauszugeben. Im Winter 2000 sank die Ozonmenge nördlich des arktischen Polarkreises mit weniger als 40 % unter dem Normalwert unter jeden zuvor gemessenen Wert. Stratosphärische Wolken nehmen, wie nachgewiesen wurde, an der komplexen Kettenreaktion teil, in deren Folge Halogenatome die Ozonlochbildung verursachen. Diese Wolken können sich nur in der extremen Kälte der polaren Regionen bilden. Die Abnahme des Gesamt-Ozons über den gemäßigten Zonen der nördlichen Hemisphäre beträgt im Durchschnitt 6 %. Durch Sattelitenbilder, konnte geklärt werden, dass Chlormonoxid inzwischen fünfhundert mal häufiger als üblich in der Umgebung des arktischen Ozonlochs gefunden werden kann. Außerdem geht man davon aus, dass Chlormonoxid und mindestens 75 % des stratosphärischen Chlors aus FCKWs gebildet wird. Diesen Zusammenhang konnte man durch die Beobachtung entsprechender Mengen gasförmigen Fluorwasserstoffs bestätigen. Weder Fluorwasserstoff noch irgend eine andere gasförmige Fluorverbindung wird bei einem natürlichen chemischen Prozess gebildet. Es ist aber bekannt, dass der FCKW-Abbau in Gegenwart von Kohlenwasserstoffverbindungen HF erzeugt. Diese Beobachtungen zeigen, dass natürliche Quellen wie Vulkanausbrüche, im Vergleich zum FCKW keinen großen Beitrag zur Erzeugung von stratosphärischen Chlor leisten. Das Montreal-Abkommen über die „Ozonschicht zerstörenden Substanzen“, das 1987 unterzeichnet wurde, legte eine Reduzierung des FCKW-Ausstoßes bis 1998 um 50 % 24 fest. Durch weitere alarmierende Berichte über den Ozonabbau kam es 1990 und 1992 zu Zusatzartikeln, die den 31.12.1995 als Frist für den vollständigen Produktionsstop anstelle der Reduzierung festsetzte. Dies bedeutete das Ende der FCKW-Produktion in den Industriestaaten. Inzwischen wurden Ersatzstoffe für FCKWs entwickelt. Hydrierte Chlorfluorkohlenwasserstoffe (HCFC) und hydrierte Fluorkohlenwasserstoffe (HFC) konnten erfolgreich kommerziell eingesetzt werden. HCFC sind chemisch reaktiver als FCKW und werden in stärkerem Maße in den niedrigeren atmosphärischen Schichten abgebaut. Ihre Gefahr für die stratosphärische Ozonschicht ist geringer, da nur kleinere Mengen der Substanzen die notwendige Höhe erreichen. Zur Zeit ersetzt HFC-134a (CH2FCF3) das FCKW Freon-12 in Kühlschränken und in den Kompressoren von Fahrzeug-Klimaanlagen. Hydrierte Fluorkohlenwasserstoffe sind erwiesenermaßen ungefährlich für die Ozonschicht. Jedoch sind HCFC eine potentielle Gefahr für die Ozonschicht und ihre Verwendung ist deshalb auf die Zeit bis 2030 beschränkt. Der Austausch von HCFC und HFC wird bereits versucht. Eine Regenerierung der stratosphärischen Gaskonzentrationen auf ursprüngliche Werte wird bis 2010 erwartet. Die Regenerierung zu diesem Zeitpunkt scheint mir ziemlich früh, da einige FCKW eine hohe Lebensdauer in der Atmosphäre haben (siehe Tabelle). Summenformel Lebensdauer in der Atmosphäre CFCl3 50 Jahre CF2Cl2 102 Jahre C2F4Cl2 300 Jahre Tab. 5 25 8.Versuchsvorschriften Protokoll zur Beilsteinprobe Zeitbedarf (insgesamt): 5 Minuten Chemikalien: Kupferblech: Gefahrensymbol: R-Sätze: S-Sätze: PVC-Schlauch: Gefahrensymbol: R-Sätze: S-Sätze: 26 Entsorgung: Abfälle werden in der Feststofftonne entsorgt. Geräte: Tiegelzange, Bunsenbrenner. Versuchsdurchführung: Das Kupferblech wird zuerst so lange im Bunsenbrenner ausgeglüht, bis keine Flammenfärbung mehr erkennbar ist. Anschließend wird ein Stück PVC-Schlauch auf das Kupferblech gegeben und wieder in der Flamme erhitzt. Beobachtungen: Beim Erhitzen der Substanz zeigt sich eine deutliche grüne Flammenfärbung. Auswertung der Versuchsergebnisse: Durch thermische Anregung kann aus dem PVC HCl-Gas eliminiert werden: Dieses reagiert dann mit Kupferionen zum entsprechenden Kupferchlorid: Kupferchlorid verdampft und die Kupfer-Ionen werden in der Flamme des Brenners atomisiert. Die Kupfer-Atome werden thermisch in einen elektronisch angeregten Zustand überführt. Die so auf ein höheres Energieniveau gehobenen Elektronen fallen auf das niedrigere Energieniveau zurück und senden die dabei frei werdende Energie als Licht aus. Aufgrund der diskreten, für jede Atomsorte unterschiedlichen Energieniveaus ist die bei Kupferionen emittierte Strahlung grün. Benannt ist die Beilsteinprobe nach dem deutsch-russischen Chemiker Friedrich Konrad Beilstein (1838-1906). Eine Gefahr dieses Versuchs besteht jedoch in der möglichen Synthese von „Dioxinen“, genauer 2,3,7,8-Tetrachlordibenzodioxin. 27 Dieses ist spätestens seit dem Seveso-Unfall in Italien 1976 oder der Vergiftung des ukrainischen Präsidentschaftskandidaten Juschtschenko 2004 als hochgiftig bekannt. Vorbedingungen für die Entstehung sind Anwesenheit von C, H, O und Cl und eine Verbrennung bei vergleichsweise niedrigen Temperaturen unter relativer Sauerstoffarmut. All diese Bedingungen sind bei diesem Versuch erfüllt, so dass von einer Entstehung von 2,3,7,8-TCDD ausgegangen werden muss. Aufgrund der geringen Menge ist dies zwar so unkritisch, dass dieser Versuch als Schülerversuch durchgeführt werden kann, aber nur in einem gut funktionierenden Abzug. 28 Protokoll zum Dipolcharakter von Dichlormethan Zeitbedarf (insgesamt): 5 Minuten Chemikalien: Dichlormethan (CH2Cl2): Gefahrensymbol: Xn R-Sätze: 40 S-Sätze:23, 24/25, 36/37 Krebserzeugend: Kat. 3A. Der bisherige MAK-Wert wurde aufgehoben Entsorgung: Das Dichlormethan wird zu den organischen Abfällen gegeben. Geräte: Bürette, Kristallisierschale, Luftballon. Versuchsaufbau/-durchführung: Aus einer Bürette lässt man Dichlormethan in eine Kristallisierschale fließen. In die Nähe des CH2Cl2-Strahls hält man einen Luftballon, den man zuvor etwas an der Kleidung gerieben hat. Beobachtungen/Darstellung Hintergrundes: Der des CH2Cl2-Strahl wird theoretischen vom Luftballon angezogen. Die Oberfläche des Ballons hat sich durch Reibung 29 statisch negativ aufgeladen. Da Dichlormethan ein Dipolmoment besitzt kann der CH2Cl2-Strahl durch die negative Ladung auf der Oberfläche des Luftballons angezogen werden. Gleiche Ladungen stoßen sich ab und ungleiche Ladungen ziehen sich an. Protokoll zur Iodierung von π-Systemen Zeitbedarf (insgesamt): 15 Minuten Chemikalien: Cyclohexan: Gefahrensymbol: F, Xn, N R-Sätze: 11, 38, 65, 67, 50/53 S-Sätze: 2, 9, 16, 25, 33, 60, 61, 62 Cyclohexen: Gefahrensymbol: F, Xn R-Sätze: 11, 21/22 S-Sätze: 16, 23, 33 36/37 Iod: Gefahrensymbol: Xn, N R-Sätze: 20/21, 50 S-Sätze: 2, 23, 25, 61 Kaliumiodid: Gefahrensymbol: R-Sätze: S-Sätze: Entsorgung: Reste werden in die organischen Abfälle gegeben. 30 Geräte: Reagenzgläser, Reagenzglasständer, Spatel Versuchsaufbau: Links: Cyclohexan, Rechts: Cyclohexen, jeweils gemischt mit einer Iod-/ WasserLösung Versuchsdurchführung: In einem Reagenzglas löst man etwas Iod in Wasser (unter Zugabe einer Spatelspitze Kaliumiodid). Einen Teil der Lösung mischt man anschließend in einem Reagenzglas mit einigen Millilitern Cyclohexan in einem anderen Reagenzglas mit etwas Cyclohexen. Die Lösungen werden gut durchgemischt und anschließend einige Minuten stehen gelassen. Beobachtungen: Es bilden sich zwei Phasen. Im Cyclohexan färbt sich die obere Phase violett, im Cyclohexen färbt sich die obere Phase zunächst hellrot, ist nach einigen Minuten aber wieder fast farblos. In beiden Fällen ist die untere Phase gelbbraun gefärbt. Auswertung der Versuchsergebnisse: Bei diesem Versuch bilden sich zwei Phasen, da es sich bei Cyclohexan und Cyclohexen um unpolare, bei Wasser um einen polaren Stoff handelt. Auf Grund der unterschiedlichen Dichten (ρCyclohexan = 31 0,78 g/mL, ρCyclohexen = 0,81 g/mL, ρWasser = 1,0 g/mL) befindet sich die wässrige Phase jeweils unten. Durch das Schütteln löst sich etwas Iod aus der wässrigen Phase in der organischen. Im Falle des Cyclohexens findet zunächst eine leichte Rotfärbung statt, die nach wenigen Minuten jedoch wieder verschwindet. Dies ist auf den Verbrauch des Iods zurückzuführen, da es über eine Anti-Addition an das Cyclohexen gebunden wird: Das Iod wird dabei durch den Angriff der ∏-Bindung polarisiert. Das I2-Molekül wird heterolytisch gespalten und unter Bildung eines Iodonium-Ions an den Ring gebunden. Das dabei entstehende Iodid greift anschließend nucleophil an einen der beiden partiell positiv geladenen Kohlenstoffe an. Als Produkt ergibt sich auf Grund des SN2-artigen Rückseitenangriffs des Iodids das trans-1,2-Diiodcyclohexan. Beim Cyclohexan findet eine Violettfärbung statt, die auch nach einigen Minuten noch vorhanden ist. Dies ist darauf zurückzuführen, dass das Iod auf Grund der fehlenden Doppelbindungen im Cyclohexan nicht mit diesem reagieren kann. Das Iod wird also nicht verbraucht sondern bleibt in Lösung, was zu einer intensiven Violettfärbung führt. 32 Protokoll zur radikalischen Halogenierung von Heptan Zeitbedarf (insgesamt): 15 Minuten Chemikalien: Heptan (C7H16): Gefahrensymbol: F R-Sätze: 11 S-Sätze: 9, 16, 23, 29, 33 Bromwasser Br2 (aq): Gefahrensymbol: T+ ,C R-Sätze: 26, 35 S-Sätze: 7/9, 26, 45 Entsorgung: Bromheptan wird in den organischen Abfall entsorgt. Übrig gebliebenes Bromwasser wird mit Thiosulfat-Lösung versetzt und in den anorganischen Abfällen entsorgt. Geräte: 2 Reagenzgläser, Tropfpipette, UV-Lampe. Versuchsaufbau: 33 + Heptan --> Versuchsdurchführung: Gearbeitet wird im Abzug. Etwas Bromwasser (ca. 1mL) wird in ein Reagenzglas gegeben. In einem anderen Reagenzglas bereitgehaltenes Heptan wird anschließend hinzugegeben (wenige mL). Das Reagenzglas mit den beiden Stoffen wird nun durch die Öffnung mit einer UVLampe bestrahlt. Beobachtungen: Die orange-braune Färbung des Bromwassers verschwindet. Auswertung der Versuchsergebnisse: In Bromwasser ist Brom in Form von Br2 gelöst. Alkane reagieren durch radikalische Substitution (Austausch eines H-Atoms durch ein Br-Atom) dadurch so zu Alkylbromiden: Infolge dessen verschwindet die orange-braune Farbe des Bromwassers. Als weiteres Produkt entsteht noch Bromwasserstoff HBr . Ein genauerer Mechanismus ist den Folien des Vortrags zu entnehmen. Bei dem Versuch sollte man darauf achten, das Reagenzglas mit dem Bromwasser und 34 Heptan von oben durch die Öffnung zu beleuchten, da Glas kein UV-Licht hindurch lässt. Eine andere Möglichkeit besteht darin Quarzglas zu verwenden. Protokoll zur Kondensation bei Druckerhöhung Zeitbedarf (insgesamt): 5 Minuten Chemikalien: Dose mit Feuerzeuggas: Gefahrensymbol: F+ R-Sätze: S-Sätze: Entsorgung: Das Gas lässt man anschließend in die Atmosphäre entweichen. Geräte: 5mL Spritze, Gummistopfen, Adapter für Feuerzeugventile. Versuchsaufbau/-durchführung: Man befüllt eine 5 mL Spritze, mit Hilfe des passenden Adapters, mit Feuerzeuggas. Während des Befüllens übt man ein wenig Druck auf die Spritze aus, so dass sich das Gas wie in einem Feuerzeug im Inneren der Spritze verflüssigt. Man löst dann den Druck und drückt den Kopf der Spritze in einen Gummistopfen. Nun drückt man die Spritze (immer noch fest gegen den Stopfen gedrückt haltend) zusammen. 35 Beobachtungen: Beim Zusammendrücken der Spritze am Gummistopfen verflüssigt sich das Feuerzeuggas wieder. Löst man den Druck so wird aus der Flüssigkeit wieder ein Gas. Darstellung des theoretischen Hintergrundes: Gase lassen sich unter Druck verflüssigen, so lange sie nicht über die kritische Temperatur hinweg erwärmt worden sind. Je höher die Temperatur, je mehr Druck muss aufgewendet werden um ein Gas zu verflüssigen. Abb. 6: Verallgemeinerte Darstellung der Gebiete, wo Gas, flüssige bzw. feste Phase am stabilsten sind. Die feste Phase ist beispielsweise bei niedriger Temperatur und hohem Druck stabil. 36 Protokoll zur Verdunstungskälte Zeitbedarf (insgesamt): 5 Minuten Chemikalien: CO2-Feuerlöscher: Gefahrensymbol: R-Sätze: S-Sätze: Entsorgung: Das entstehende Gas lässt man in die Atmosphäre entweichen. Geräte: CO2-Feuelöscher. Versuchsaufbau/-durchführung: Man betätigt den Feuerlöscher nach Anleitung bis sich ein Feststoff an dem Ausgangsventil gebildet hat. Beobachtungen: Während das Gas entweicht bildet sich am Ausgangsventil ein weißer Feststoff, der nach kurzer Zeit wieder sublimiert. Darstellung des theoretischen Hintergrundes: Im Feuerlöscher befindet sich unter hohem Druck flüssiges Kohlendioxid. Wird der Löscher betätigt, so entweicht das Kohlendioxid als Gas, da der Atmosphärendruck im Vergleich zum Druck im Feuerlöscher sehr gering ist. Das Gas dehnt sich aus. Bei der Expansion wird Arbeit gegen die intermolekularen Anziehungskräfte geleistet. Die dazu notwendige Energie wird der kinetischen Energie der Moleküle entnommen. Es kommt zur Abkühlung. Die 37 Abkühlung ist so stark, dass Trockeneis entsteht. Man spricht dabei vom JouleThomson-Effekt. Protokoll zur Absorption von UV-Strahlung durch Ozon Zeitbedarf (insgesamt): 5 Minuten Chemikalien: Ozon: Gefahrensymbol: R-Sätze: S-Sätze: Entsorgung: Das Ozon lässt man anschließend in den Abzug entweichen. Geräte: „Ozonapparatur“(N2-Bombe mit Druckminderer, U-Rohr mit an Kieselgel adsorbierten Ozon (das Ozon wurde durch einen Ozonisator erzeugt und am Kieselgel mit einem Kältemittel adsorbiert) in Dewar mit Kältemittel, PVC-Schlauch), Stativmaterial, UV-Lampe (Wellenlänge 254 nm), weißes Papier, Abzug. Versuchsaufbau/-durchführung: Man beleuchtet im dunklen Raum mit einer UVLampe (Wellenlänge 254 nm) ein weißes Schreibmaschinenpapier. Dieses dient als Fluoreszenzschirm. Nun bläst man direkt vor das Blatt in den Strahlengang der Lampe Ozon. Beobachtungen/Darstellung des theoretischen Hintergrundes: Ozon lässt kaum UV-Strahlung durchkommen, so dass das Ozon (weil keine Fluoreszenz mehr angeregt wird) einen Schatten in Form von „rosa Wölkchen“ wirft. Durch die Absorption wird folgende Reaktion ausgelöst: Aus dem Ozon entsteht molekularer Sauerstoff und Sauerstoffatome. 38 Protokoll zur Zerstörung von Ozon durch halogenierte Kohlenwasserstoffe Zeitbedarf (insgesamt): 15 Minuten Chemikalien: 50 mL Chloroform: Gefahrensymbol: Xn R-Sätze: 22, 38, 40, 48/20/22 S-Sätze: 36/37 Anmerkungen: Gefahr der Hautresorption, Carc. Cat. 3, Risiko der Fruchtschädigung nur bei Nichteinhaltung von MAK: 0,5mL/m3 Silbernitrat (w = 0,01): Gefahrensymbol: C, N R-Sätze: 34, 50/53 S-Sätze: 26, 45, 60, 61 HNO3 (w = 0,3): Gefahrensymbol: C R-Sätze:35 S-Sätze:23, 26, 36, 45 Entsorgung: Das Ozon lässt man anschließend in den Abzug entweichen. Die anderen Sachen werden zu den organischen Abfällen gegeben. Geräte: „Ozonapparatur“(N2-Bombe mit Druckminderer, U-Rohr mit an Kieselgel adsorbierten Ozon in Dewar mit Kältemittel, PVC-Schlauch), Stativmaterial, pHElektrode mit Anzeige, Pipetten, Reagenzgläser, Abzug. 39 Versuchsaufbau/-durchführung: Man misst den pH-Wert der Chloroform-Lösung, leitet anschließend Ozon ein, schüttelt und misst erneut den pH-Wert. Danach säuert man die Lösung mit Salpetersäure an und gibt ein paar Tropfen Silbernitrat-Lösung hinzu und schüttelt um. Zur Kontrolle wird das Gleiche mit einer Blindprobe ohne Ozoneinleitung wiederholt. Anmerkung: Natürlich kann man den pH-Wert der Chloroform-Lösung nicht messen. Vielmehr wird die Tendenz angezeigt, wie sich das Verhältnis von Hydrogeniumionen vor und nach der Ozoneinleitung verändert. Beobachtungen: Der pH-Wert fällt von 4,1 (vor der Ozoneinleitung) auf _0,7 (nach der Ozoneinleitung) ab. Nach Zugabe der Silbernitrat-Lösung bildet sich ein weißer Niederschlag in der wässrigen Phase. Darstellung des theoretischen Hintergrundes: 40 41 9. Schulrelevanz 9.1 Gesamtthema 10.G2 Einführung in die Kohlenstoffchemie: 2.3 Alternative 1: Halogenkohlenwasserstoffe (Halogenalkane) Nomenklatur; polare Elektronenpaarbindungen; permanente Dipolmoleküle / Tetraedermodell; Struktur-Eigenschafts-Beziehungen; Eigenschaften und Reaktionen / Nachweisreaktion; Umweltgefährdung durch CFKW in der Atmosphäre 9.2 Versuche GK 11.G1 Kohlenstoffchemie I: 1. Eigenschaften und Reaktionen von Kohlenstoff-Wasserstoff Verbindungen: Mechanismus der Addition von Molekülen des Typs X2 LK 11.G1 Kohlenstoffchemie I: 1. Eigenschaften und Reaktionen von Kohlenstoff-Wasserstoff Verbindungen: Typ und Mechanismus der Addition von Molekülen des Typs X2 und HX und der Eliminierung; Orbitalmodell 2. Alkanole: Reaktionstypen (Substitution) 10.G2 Einführung in die Kohlenstoffchemie: 42 2.3 Alternative 1: Halogenkohlenwasserstoffe (Halogenalkane): Eigenschaften und Reaktionen / Nachweisreaktion; Umweltgefährdung durch CFKW in der Atmosphäre 10.G2 Einführung in die Kohlenstoffchemie: 2.3 Alternative 1: gesättigte Kohlenwasserstoffe: Mechanismus der radikalischen Substitution 9.G2 Säuren und Laugen: 2.4 Schwerlösliche Salze: Nachweis ausgewählter Kationen und Anionen durch Fällung 8.G2 Ordnung in der Vielfalt Atombau und Periodensystem: 2.5 Halogene: Verwendung verschiedener Halogene in Alltag und Technik 7.G1 Stoffe unterscheiden und isolieren Strukturen - Eigenschaften 1.2 Aggregatzustände und ihre Übergänge: Unterschiedliche Aggregatzustände eines Stoffes in Abhängigkeit von der Temperatur deuten 10. Quellen 43 Literatur: Peter Sykes: „Wie funktionieren organische Reaktionen“, 2. korrigierte Auflage 1995 GESTIS Stoffdatenbank Butenuth-Skript Beyer-Walter: „Lehrbuch der organischen Chemie“, 24. Auflage, 2004 Chemie und Schule (Salzburg), 2/2003 K. Peter C. Vollhardt, Neil E. Shore: „Organische Chemie“, Vierte Auflage, 2005 WILEY-VCH Verlag GmbH & Co. KGaA Charles E. Mortimer/Ulrich Müller: „Das Basiswissen der Chemie“, 8. Auflage, Thieme 2003 Küster/Thiel: „Rechentafel für die Chemische Analytik“, 105. Auflage, de Gruyter, Berlin – New York 2003 Encarta Enzyklopädie 2005 Ausarbeitung zum chemischen Experimentalvortrag zum Thema Ozon von Gunter Kretschmann an der Philipps-Universität Marburg, Sommersemester 1998 Lehrplan Chemie, Gymnasialen Bildungsgang, Jahrgangsstufen 7G bis 12G, Hessisches Kultusministerium 2005 www.chids.de Peter W. Atkins: „Physikalische Chemie“, 3. Auflage, WILEY-VCH, Weinheim 2001 44 http://www.chemgapedia.de/vsengine/vlu/vsc/de/ch/12/oc/vlu_organik/substitution/ alkylhalogenide/einfuehrung.vlu.html http://www.tip-top.de/de/TipTop/dsl/html/der-kuehlschrank.html Bilder: Abb. 1, S. 240; Abb. 2, S.241; Abb. 3, S.128; Abb. 6, S. 129 aus: K. Peter C. Vollhardt, Neil E. Shore: „Organische Chemie“, Vierte Auflage, 2005 WILEY-VCH Verlag GmbH & Co. KGaA Abb. 4 aus: Microsoft Encarta Enzyklopädie 2005 Abb. 5 aus: http://www.tip-top.de/de/TipTop/dsl/html/der-kuehlschrank.html Abb.6 aus: http://de.wikipedia.org/w/index.php?title=Bild:Phasendiagramme.svg&filetimesta mp=20080829074206 45