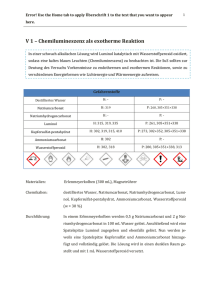
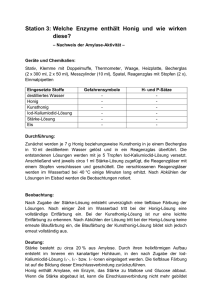
doc - ChidS
Werbung

Philipps-Universität Marburg Fachbereich: Chemie Seminar: Übungen im Experimentalvortrag Leitung: Dr. Philipp Reiß Wintersemester 2007/08 Hinweis: Dieses Protokoll stammt von der Seite www.chids.de (Chemie in der Schule). Dort können unterschiedliche Materialien für den Schulunterricht heruntergeladen werden, unter anderem hunderte von Experimentalvorträgen so wie der vorliegende: http://www.chids.de/veranstaltungen/uebungen_experimentalvortrag.html Experimentalvortrag (AC) Wasserstoffperoxid H2O2 von Andrea Ost Marburg Protokoll zum Vortrag vom 19.07.2007 Inhaltsverzeichnis 1. Einleitung 3 2. Entdeckung und Darstellung von H2O2 4 Darstellung im Labor 4 Versuch 1 „Herstellung und Nachweis von H2O2“ 4 Darstellung in der Technik 6 3. Eigenschaften 7 Physikalische Eigenschaften 7 Chemische Eigenschaften 8 Versuch 2 „Wasserstoffperoxid als Oxidationsmittel“ 9 Versuch 3 „Wasserstoffperoxid als Reduktionsmittel“ 10 4. Anwendungsgebiete 11 Anwendung in der Papierindustrie 12 Demo 1 „De-Inking von Papier“ 12 Anwendung in der Kosmetikindustrie 14 Demo 2 „Blondierung mit H2O2“ 15 Versuch 4 „Elefantenzahnpasta“ 16 Anwendung in der Raumfahrt 18 Versuch 5 „Raketenstart“ 19 Anwendung in der Waschmittelindustrie Versuch 6 „Nachweis von H2O2 in Waschmitteln“ 21 21 5. Vorkommen in der Natur 25 6. Physiologisches 26 Versuch 7 a) und b) „Der H2O2-Killer“ 27 7. Schulrelevanz 29 8. Quellenangaben 30 2 1. Einleitung Wasserstoffperoxid begegnet uns tagtäglich auf mehr oder weniger offensichtliche Art und Weise, doch die wenigsten sind sich dessen bewusst oder können diese Chemikalie beim Namen nennen. Am augenfälligsten ist es, wenn sich der Freund oder die Freundin die Haare gefärbt haben, aber das entdecken die Schüler meistens erst, wenn sie in der Schule angekommen sind. Dabei hatten sie die erste indirekte Begegnung mit Wasserstoffperoxid bereits beim Frühstück, als sie sich aus einem sterilisierten Tetrapack Milch eingeschenkt haben. Offensichtlicher wird es, wenn sie dann in der Schule ihren College-Block aus chlorfrei gebleichtem Papier zücken, um sich Notizen zu machen. Dass das Papier nicht mit Chlor gebleicht wurde, können sie dem Aufdruck entnehmen, aber was steckt sonst hinter dem reinen Weiß des Papiers? Über die strahlend weißen Zähne des Sportlehrers wundert man sich vielleicht und beneidet ihn eventuell auch um diese attraktive Wirkung, dem „wie“ geht man allerdings nicht auf den Grund. Muss man in seinem Unterricht dann auch bei schlechtem Wetter raus und auf dem matschigen Rasenplatz Fußball spielen, tut man das doch relativ unbesorgt: Mama wird die Klamotten schon wieder waschen. Dass die weißen Sachen dann auch wirklich wieder weiß und nicht schmuddelig grau werden, ist bereits eine Selbst-verständlichkeit, über die man erst recht nicht nachdenkt. Interesse wecken die Kriminalkommissare und die Spurensicherung am Abend im Fernsehen, doch wie schaffen sie es nachzuweisen, dass es sich um Blutspuren und nicht um Tomaten-saftflecken handelt? Dieser Vortrag soll eine Einführung zu Wasserstoffperoxid geben, die Vielfältigkeit der Anwendungsmöglichkeiten aufzeigen und durch anschauliche und spannende Versuche das Interesse der Schüler wecken. 3 2. Entdeckung und Darstellung von H2O2 Der Entdecker des Wasserstoffperoxids heißt Louis Jacques Thénard und war französischer Chemiker. Er lebte von 1777 bis 1857 und war zunächst Chemielehrer, später Professor an der Elitehochschule Ecole Polytechnique in Paris und schließlich Vorsitzender des Fachbereichs sowie Mitglied der Akademie gemein-nütziger Wissenschaften.[11] Das Wasserstoffperoxid hat Thénard 1818 durch die Hydrolyse von Barium-peroxid mit Schwefelsäure hergestellt. [8] Abb. 1: L.J. Thénard Da durch Einwirkung von Sonnenlicht auf die Chemikalie die Kolben zerbarsten, arbeitete Thénard mit Bechergläsern und bewahrte die Flüssigkeit in braunen Flaschen auf. Eine weitere bekannte Entdeckung des Chemikers ist das nach ihm benannte Thénards Blau, eine Porzellanfarbe aus Cobaltaluminat. [9] Darstellung im Labor Zur Labordarstellung eignet sich die Hydrolyse von Peroxiden, wie Thénard sie durchgeführt hat, wobei hauptsächlich Natrium- oder Bariumperoxid verwendet werden. Damit die Hydrolyse vollständig abläuft, gibt man Säure zu. Dies soll in Versuch 1 nun näher erklärt werden. [2] 2.1.1 Versuch 1 „Herstellung und Nachweis von H2O2“ [4] Chemikalien: Bariumperoxid Gefahrensymbol: O, Xn; R 8-20/22; S 13-27 Salpetersäure (2 mol/L) Gefahrensymbol: O, C; R 8-35;S 23-26-36-45 Titanylsulfatlösung (konz.) Gefahrensymbol: C; R 35 Geräte: 250-mL-Kelchglas, Glasstab, Spatel 4 Durchführung: Man gibt 3 Spatelspitzen Bariumperoxid in ein Kelchglas, fügt ungefähr 20 ml 2-molare Salpetersäure hinzu und rührt mit einem Glasstab um. Anschließend gibt man Titanylsulfatlösung dazu und beobachtet die Farbreaktion. Beobachtung: Bei Zugabe von Titanylsulfatlösung kann man einen weißen Niederschlag und eine intensive Gelbfärbung der Lösung beobachten. Auswertung: Wasserstoffperoxid kann durch Hydrolyse von beispielsweise Natrium- oder Bariumperoxid gewonnen werden. BaO2 (s) + 2 H2O H2O2 (aq) + Ba2+(aq) + 2 OH-(aq) Das Gleichgewicht liegt hierbei allerdings deutlich auf der Seite der Edukte. Um es zu den Produkten hin zu verschieben, gibt man Salpetersäure hinzu, die die Hydroxidionen aus dem System entfernt und somit das Gleichgewicht nach rechts verlagert. H2O2 (aq) + Ba2+(aq) + 2 NO3-(aq) + 2 H2O BaO2 (s) + 2 H2O + 2 HNO3 (aq) Im Anschluss an die Darstellung von Wasserstoffperoxid wurde dieses durch die Zugabe von Titanylsulfatlösung und die Gelbfärbung der Lösung nachgewiesen. Hierbei entstand das gelbe Peroxotitanylkation [Ti(O2) . aq]2+, das durch die Anlagerung von Wasser einen oktaedrischen Komplex bildet. [Ti(OH)2(H2O)4]2+(aq) + SO42-(aq) + H2O2 (aq) farblos [Ti(O2) · aq]2+(aq) + SO42-(aq) + 6 H2O gelb Durch die Anwesenheit von Sulfationen werden die Bariumkationen als weißes, schwerlösliches Bariumsulfat ausgefällt. Ba2+(aq) + SO42-(aq) BaSO4 (s) ↓ weiß 5 Darstellung in der Technik Früher wurde Wasserstoffperoxid hauptsächlich durch Hydrolyse von Peroxodisulfat hergestellt. Dieses gewinnt man durch elektrolytische Oxidation von SchwefelsäureSulfat-Lösungen. [1] Elektrolyse 2 H2SO4 (aq) O SO3 HO H O SO3 HO H H2S2O8 (aq) + H2 (g) Hydrolyse + 2 H+(aq) H2O2 (aq) + 2 H2SO4 (aq) Abb. 2: Hydrolyse von Peroxodisulfat Heute stellt man H2O2 großtechnisch hauptsächlich nach dem AnthrachinonVerfahren her. Hierbei wird Anthrachinon zunächst mit Hilfe eines Palladium- oder Platin-Katalysators zu Anthrahydrochinon hydriert. Im nächsten Schritt wird Anthrahydrochinon oxidiert, wobei Anthrachinon zurückgebildet wird und Wasserstoffperoxid entsteht. [1] H2 Katalysator (Pt) OH O R R OH Anthrahydrochinon O Anthrachinon H2O2 O2 Abb. 3: Reaktion des Anthrachinon-Verfahrens 6 Im Produktionsprozess fällt Wasserstoffperoxid als wässrige Lösung von 15-40 % an. Es folgt eine Reinigung und daraufhin kann man die erhaltene Lösung destillieren, wobei man 50-70 prozentige Wasserstoffperoxid-Lösung erhält. Nun kann man sie zum Beispiel mit Phosphorsäure oder Stannaten stabilisieren und lagern oder weiter aufkonzentrieren. Dies erreicht man zum einen durch erneute Destillation, strebt man allerdings sehr hohe Konzentrationen an, so muss man auf die Gefrierkristallisation zurückgreifen. Abb. 4: Wasserstoffperoxid-Kristalle 3. Eigenschaften Physikalische Eigenschaften Wasserstoffperoxid ist eine farblose Flüssigkeit, die in dicker Schicht bläulich ist. Aufgrund der sich zwischen den Molekülen ausbildenden Wasserstoffbrückenbindungen ist Wasserstoffperoxid in hoher Konzentration sirupös. Der Siedepunkt der reinen Chemikalie liegt bei 150°C und der Gefrierpunkt bei -0,4°C. Die molare Masse von H2O2 beträgt 34,02 g/mol und es weist eine Dichte von 1,45 g/cm 3 auf. In vielen Eigenschaften ähnelt das Wasserstoffperoxid dem Wasser. [1, 6] Das H2O2-Molekül liegt nicht, wie man denken könnte, als lineare Kette H-O-O-H vor, sondern ist in sich verdrillt. Dies ist durch die gegenseitige Abstoßung der freien Elektronenpaare des Sauerstoffs bestimmt und es resultiert hieraus eine O-O Bindungslänge von 147 pm und eine Bindungsenergie von 144 kJ/mol. Demzufolge ist die O-O Bindung schwach Abb. 5: Wasserstoffperoxid-Molekül 7 und Wasserstoffperoxid eine metastabile Verbindung, die zur Zersetzung neigt. In Abbildung 5 stehen die blauen Kugeln für Wasserstoff und die roten Kugeln für den Peroxidsauerstoff. Der Bindungswinkel beträgt 95° und der Verdrillungswinkel des Moleküls liegt bei 111°. Im Handel ist eine 30-prozentige Lösung unter dem Namen Perhydrol erhältlich. Chemische Eigenschaften Wasserstoffperoxid ist, wie gerade erwähnt, eine metastabile Verbindung, die dazu neigt zu disproportionieren, also in Wasser und Sauerstoff zu zerfallen. 2 H2O + O2 (g) 2 H2O2(aq) H = - 98 kJ/mol Dies erfolgt über eine Radikalkettenreaktion: H2O2 2 OH(aq) H2O2 + OH(aq) HO2 (aq) + H2O2 H = 211 kJ/mol H2O + HO2 (aq) H2O + O2 (g) + OH(aq) Betrachtet man die hohe Aktivierungsenthalpie der Hydroxyl-Radikalbildung, so könnte man fälschlicherweise annehmen, dass Wasserstoffperoxid doch gar nicht so instabil wäre. Allerdings dienen bereits kleinste Verunreinigungen oder Wärme als Katalysator, so dass Spuren von Schwermetallionen, alkalisch reagierende Stoffe oder gar Staub zur Zersetzung und damit verbunden eventuell sogar zu einer plötzlichen Explosion des Wasserstoffperoxids führen können. Als Gegen-maßnahmen gibt man Stabilisatoren wie beispielsweise Phosphorsäure oder Stannate zu. Wasserstoffperoxid ist eine sehr schwache Säure mit einem Ks-Wert von 10-12. Eine weitere interessante Eigenschaft des Wasserstoffperoxids ist seine Redoxamphoterie. In saurer oder alkalischer Lösung fungiert H2O2 gegenüber vielen Verbindungen als Oxidationsmittel. In der Reaktion mit stärkeren Oxidationsmitteln als ihm selbst wirkt Wasserstoffperoxid jedoch reduzierend. Dies soll in den Versuchen 2 und 3 an zwei ausgesuchten Reaktionen verdeutlicht werden. Nachgewiesen werden kann H2O2 als tiefblaues Chromperoxid CrO5 oder als gelbes Peroxotitanylion [TiO2]2+. 3.2.1 Versuch 2 „Wasserstoffperoxid als Oxidationsmittel“ [4] 8 Chemikalien: Mangansulfatlösung (0,5 mol/L) Gefahrensymbol: Xn, N; R 48/20/22-51/53 H2O2- Lösung (30 %ig) Gefahrensymbol: O, C R 5-8-20/22-35; S 17-26-28-36/37/39-45 Natronlauge (0,5 mol/L) Gefahrensymbol: C Geräte: Reagenzglas, Reagenzglasständer, 2 Pipetten Durchführung: Man füllt das Reagenzglas etwa zur Hälfte mit 0,5 molarer Mangansulfatlösung und macht die Lösung durch Zugabe einiger Tropfen 0,5 molarer Natronlauge alkalisch. Anschließend tropft man mit Hilfe einer anderen Pipette H2O2 zu und beobachtet die eintretende Reaktion. Beobachtung: Nach dem Zutropfen von Wasserstoffperoxid setzt eine heftige Reaktion ein und es fällt ein schwarz-brauner Niederschlag aus. Auswertung: Die Mangansulfatlösung muss man zunächst mit einigen Tropfen Natronlauge alkalisch machen, damit das Mangan als Mangandihydroxid in aquatisierter Form vorliegt. MnSO4 (s) + 2 OH-(aq) Mn(OH)2 (aq) + SO42-(aq) Dieses kann danach mit Wasserstoffperoxid weiterreagieren zu Manganoxiddihydroxid, welches als braun-schwarzer Niederschlag ausfällt. +2 -1 Mn(OH)2 (aq) + H2O2 (aq) +4 -2 -2 MnO(OH)2 (s) + H2O braun- schwarz Bei dieser Reaktion handelt es sich um eine Redoxreaktion, bei der Wasserstoffperoxid als Oxidationsmittel fungiert: Das Mangan wird von + 2 zu + 4 oxidiert und gibt dabei 2 Elektronen ab, die den Peroxid-Sauerstoff von - 1 zu - 2 reduzieren. 3.2.2 Versuch 3 „Wasserstoffperoxid als Reduktionsmittel“ [4] 9 Chemikalien: Kaliumpermanganat Gefahrensymbol: O, Xn, N; R 8-22-50/53; S 60-61 Schwefelsäure (2 mol/L) Gefahrensymbol: C; R 35; S 26-30-45 H2O2- Lösung (30 %ig) Gefahrensymbol: O, C R 5-8-20/22-35; S 17-26-28-36/37/39-45 Geräte: 2 Reagenzgläser, Reagenzglasständer, 2 Pipetten Durchführung: In beiden Reagenzgläsern legt man einige Körnchen Kaliumpermanganat vor und füllt bis etwa zur Hälfte mit Wasser auf. Beide Lösungen werden nun mit einigen Tropfen 2 molarer Schwefelsäure angesäuert. Das erste Reagenzglas dient als Vergleichslösung. In das zweite gibt man etwas H2O2 und schüttelt gegebenenfalls bis die Reaktion sichtbar wird. Beobachtung: Tropft man zu der schwefelsauren, violetten Kaliumpermanganat-Lösung Wasserstoffperoxid zu, so wird die Farbe der Lösung zunächst heller, bis sich diese schließlich nahezu ganz entfärbt. Auswertung: Bei der hier durchgeführten Reaktion handelt es sich um eine RedoxReaktion, bei der Wasserstoffperoxid als Reduktionsmittel fungiert. H2O2 selbst wird zu Sauerstoff und Protonen oxidiert: Oxidation: -1 5 H2O2 (aq) 0 5 O2 (g) + 10 H+(aq) + 10 e- Bei der Reduktion werden die vom Wasserstoffperoxid abgegebenen Elektronen dem Mangan im Permanganatanion zur Verfügung gestellt, das von + 7 zu Mn2+(aq) reduziert wird. 10 Reduktion: +7 -2 2 +2 MnO4-(aq) - + 10 e 2 -2 Mn2+(aq) + 8 O2-(aq) Die Gesamtreaktion lautet wie folgt: +7-2 -2 - 2 MnO4 (aq) + 6 H3O -1 + (aq) +2 + 5 H2O2 (aq) violett -2 0 2+ 2 Mn (aq) + 14 H2O + 5 O2 (g) blassrosa Man kann bei der Reaktion beobachten, dass sich die zunächst tiefviolette Lösung bei Zugabe von Wasserstoffperoxid fast vollständig entfärbt und nur wenn man genau hinsieht, kann man erkennen, dass die Lösung eine blassrosa Farbe aufweist. Die violette Farbe ist auf das Permanganat-Ion zurückzuführen, dieses wird jedoch zu blassrosa-farbenem Mn2+(aq) reduziert, wodurch die Lösung seine tiefviolette Farbe verliert und sich scheinbar entfärbt. 4. Anwendungsgebiete Die Anwendungsmöglichkeiten von Wasserstoffperoxid sind vielfältig und umfassen viele verschiedene Sektoren. So liegt der größte Verbrauch an Wasserstoffperoxid bei der Papierindustrie, die diese Chemikalie zur Bleiche von Zellstoff einsetzt, was unter 4.1 eingehender betrachtet werden soll. Einen erheblichen Bedarf hat auch die chemische Industrie, wo Wasserstoffperoxid meist als Oxidationsmittel zum Einsatz kommt. Auch in der Textilindustrie findet H2O2 aufgrund seiner Bleichwirkung Anwendung. Aus demselben Grund findet man es auch als Waschmittelzusatz in Form von Natriumperborat. Aufgrund seiner Desinfektionswirkung kann man Wasserstoffperoxid als Desinfektionsmittel und zur Wasserbehandlung wie beispielsweise in Schwimmbädern einsetzen. In der Kosmetik gibt es ebenfalls viele Anwendungsmöglichkeiten, die unter 4.2 näher erläutert werden. Sogar die Lebensmittelindustrie bedient sich des Wasserstoffperoxids zur Sterilisation von PET Flaschen oder Tetrapacks. Weitere Anwendungen sind die Sauerstoffzufuhr mittels Wasserstoffperoxid in Aquarien oder Nährböden, der Gebrauch einer Mischung aus Schwefelsäure und Wasserstoffperoxid als Ätzmittel in der Mikroelektronik und der Nachweis von Blut in 11 der Forensik. Eine letzte, sehr interessante Einsatzmöglichkeit von H2O2 ist die Verwendung in Raketen- oder U-Boot-Triebwerken, welche unter 4.3 thematisiert wird. Anwendung in der Papierindustrie Die deutsche Papierindustrie ist die Nummer 1 in Europa und nimmt weltweit hinter den USA, China und Japan den vierten Platz ein. Mit 46.000 Mitarbeiten an über 200 Standorten werden in Deutschland pro Jahr 22,6 Millionen Tonnen Papier hergestellt.[24] In der Papierindustrie ist das Wasserstoffperoxid der umweltfreundliche Nachfolger des Chlors und wird hauptsächlich in der Bleichsequenz TCF (total chlorfrei) angewendet. Die Bleiche des im Holz enthaltenen Lignins erfolgt in mehreren Stufen. Als erste Stufe wird eine Sauerstoffdelignifizierung durchgeführt. Dies ist eine Art Vorbleiche, durch die man Bleichmittel und Abwässer einsparen kann. Daran schließt sich die jeweilige Bleichsequenz an. Am häufigsten Anwendung finden die Sequenzen TCF mit den Bleichmitteln Wasserstoffperoxid, Sauerstoff, Ozon oder Persäuren und ECF (elementarchlorfrei), bei der zusätzlich Chlordioxid verwendet wird.[23] Demo 1 soll in vereinfachter Weise veranschaulichen, wie man Papier bleicht, beziehungsweise Altpapier durch Bleiche recyceln kann. 4.1.1 Demo 1 „De-Inking von Papier“ [19] Chemikalien: H2O2- Lösung (30 %ig) Gefahrensymbol: O, C R 5-8-20/22-35; S 17-26-28-36/37/39-45 Natriumcarbonat- Lsg. (5 %ig) Gefahrensymbol: Xi; R 36; S 22-26 Buntes Zeitungspapier (nicht geleimt) Geräte: 1-L-Becherglas, 600-mL-Becherglas, 100-mL-Becherglas, Glasstab, Haushaltssieb, Magnetrührer mit Heizplatte, großer Rührfisch, Pipette 12 Durchführung: Man zerreißt buntes Zeitungspapier in kleine Schnipsel und gibt es in das 1-LBecherglas, das mit 400 mL 5-prozentiger Sodalösung gefüllt ist. Bei diesem Versuch muss man darauf achten, Papier zu verwenden, das nicht glänzt, also am besten Beilagen der Tageszeitung. Hat man alles Papier in die Sodalösung gegeben, so wird gut umgerührt und anschließend einen Moment lang aufgekocht. Wenn möglich sollte man das Papier dann noch über Nacht einweichen lassen. Danach wird das Papier aus der Lösung abgeschöpft, die Probe geteilt und eine Hälfte unbehandelt als Vergleich zurückbehalten. Die andere Hälfte gibt man in ein 600-mL-Becherglas und träufelt mit einer Pipette gleichmäßig insgesamt etwa 100 mL H2O2- Lösung auf die Papiermasse. Dies muss langsam geschehen, man darf auf keinen Fall alles H 2O2 auf einmal zugeben. Beobachtung: Nach dem Einweichen in der alkalischen Sodalösung hat das Papier bereits ein klein wenig an Farbe verloren, die Lösung ist rot gefärbt. Gibt man nun H2O2- Lösung zur Papiermasse, so kann man eine starke Gas- und Wärmeentwicklung beobachten. Man darf die H2O2-Lösung nur langsam zutropfen, da es zu heftigem Aufschäumen kommt. Nach der Behandlung mit Wasserstoffperoxid ist das gebleichte Papier nicht vollkommen weiß sondern eher schmutzig grau, doch man kann beim Vergleich mit der anderen Hälfte der Probe deutlich erkennen, dass die zuvor vorhandenen Farben nahezu vollständig zerstört worden sind. Auswertung: Die Zeitungspapierschnipsel sind zunächst in Soda-Lösung eingeweicht und gekocht worden, wodurch sie mit alkalischer Lösung getränkt sind. Gibt man nun tropfenweise Wasserstoffperoxid auf das bunte Papier, so zersetzt sich die Chemikalie in Anwesenheit von Hydroxidionen zu Wasser und Hydroperoxid-Anionen. -1 H2O2 + -2 OH-(aq) -1 HO2-(aq) -2 + H2O 13 Die Hydroperoxid-Anionen selbst zerfallen in Hydroxidionen und nascierenden Sauerstoff, welcher ein sehr aggressives Oxidationsmittel ist und dadurch eine große Bleichwirkung aufweist. -1 HO2-(aq) -2 0 OH-(aq) + [O] statu nascendi Die zuvor im Zeitungspapier vorhandenen Farben werden folglich nahezu vollständig von dem hier entstandenen nascierenden Sauerstoff gebleicht. Anwendung in der Kosmetikindustrie In der Kosmetikindustrie kommt Wasserstoffperoxid in vielen verschiedenen Produkten zum Einsatz. So basieren beispielsweise Blondierungsmittel auf Wasserstoffperoxid und hier werden Lösungen von 1,9, 3, 6, 9 und 12% verwendet, je nachdem, um wie viele Nuancen das Haar aufgehellt werden soll. Auf die Blondierung soll in der Demo 2 näher eingegangen und die genaue Wirkung des Wasserstoffperoxids erläutert werden. Eine weitere Anwendung ist die als Zahn-bleichmittel. Sets für die Zahnaufhellung sind bis zu einem Wasserstoffperoxidgehalt von 0,1 % frei im Handel erhältlich. Höher konzentrierte Lösungen findet man nur direkt in Zahnarztpraxen. Es gibt verschiedene Möglichkeiten, das H2O2 auf die Zähne aufzutragen: in Form von Gel, das man direkt auf die Zähne aufbringt, durch Streifen zum Aufkleben oder mittels speziell angepasster Schienen, die auf die Zähne aufgesetzt werden. Wasserstoffperoxid dringt ohne große Mühe in die Zähne ein und reagiert mit den angesammelten Verfärbungen unter Oxidation. Der Grad der Aufhellung ist sowohl von der Konzentration als auch von der Einwirkzeit abhängig. Auch in Zahnpasta kann Wasserstoffperoxid mit dem gleichen Ziel enthalten sein, doch in so geringer Konzentration, dass es nicht zu einer Reizung des Mundraumes kommt. Versuch 4 ist als „Spaßversuch“ hier eingefügt, der zwar nicht unmittelbar zum Thema Kosmetik passt, aber sehr effektvoll ist und bei den Schülern Lust am Thema wecken kann. Wasserstoffperoxid ist ebenfalls in Mundspüllösungen enthalten und kann in Reinigungslösungen für Kontaktlinsen zum Einsatz kommen. Neu ist der Zusatz von H 2O2 zu Gesichtscremes, die Poren öffnen und dadurch die Bildung von Pickeln vermeiden sollen. 4.2.1 Demo 2 „Blondierung mit H2O2“ 14 Chemikalien: Blondiermittel (Blondierpulver und Blondierlotion (Wasserstoffperoxid)) Haare (vom Frisör) Wasser Geräte: Plastikschale und Pinsel (Frisörbedarf), Petrischale Durchführung: In der Plastikschale mischt man mithilfe des Pinsels das Blondierpulver mit der Blondierlotion, so dass eine streichfähige Masse entsteht. In eine Petrischale legt man einige Haarsträhnen verschiedener Farbe und bestreicht sie gut mit der blauen Blondiermasse. Nun lässt man mindestens eine halbe Stunde einwirken (verwendet man Wärme, so reduziert sich die Einwirkzeit). Danach werden die Haarsträhnen unter fließendem Wasser abgespült und die Blondiermasse ausgewaschen. Beobachtung: Nach einer Einwirkzeit von 30 min kann man bei hellbraunem Haar bereits eine deutliche Aufhellung beobachten, dunkleres Haar braucht dagegen länger. Auswertung: Unsere Haarfarbe wird durch die zwei verschiedenen Melaninarten Phäomelanin und Eumelanin bestimmt, die je nach Mischung im Haar eine bestimmt Farbe ergeben. Eumelanin ist dunkelbraun bis schwarz und Phäomelanin fungiert als Rot-Gelb-Pigment. Diese beiden Pigmente werden von den in den Haarwurzeln befindlichen Abb. 6: Haarquerschnitt 1 Melanozyten produziert danach als kleinste Pigmentkörnchen in die Faserschicht des Haares eingelagert.[16] 15 und In Abbildung 7 kann man deutlich erkennen, wie eng die Faserschicht gepackt ist und dass die Melaninkörner von außen nicht leicht zugänglich sind. Deshalb ist es bei der Blondierung, der einfachsten Aufhellungs-methode des Haares, notwendig, dass die im Blondiermittel enthaltenen Basen zunächst ins Haar eindringen und es aufquellen. Im alkalischen Milieu kommt es zur Zersetzung des Abb. 7: Haarquerschnitt 2 Wasserstoffperoxids, welches gemeinsam mit Ammoniumpersulfat das Melanin oxidiert. Wird das Haar vollständig blondiert, so kommt es zur gänzlichen Auflösung der Melaninkörner, wird die Blondierung allerdings zu früh abgebrochen, so kann es zu gelben oder roten Farbtönen im Haar kommen.[16] R Das Molekül Eumelanin beispielsweise wird von Hyd- O roperoxidionen aus dem Wasserstoffperoxid angegriffen, wobei es zu einer Ringöffnung kommt. Ist der Ring geöffnet, N H wird die Delokalisation der π- O Elektronen eingeschränkt, was wiederum zu einer R Farbaufhellung führt. Abb. 8: Eumelanin 4.2.2 Versuch 4 „Elefantenzahnpasta“ [18, 26] Chemikalien: Geschirrspülmittel H2O2- Lösung (30 %ig) Gefahrensymbol: O, C R 5-8-20/22-35; S 17-26-28-36/37/39-45 Kaliumiodid Wasser 16 Geräte: Hoher Standzylinder, Kristallisierschale, 100-mL-Becherglas, 50-mL- Becherglas Durchführung: Man stellt den Standzylinder in die Kristallisierschale und gibt einen kräftigen Spritzer Spülmittel in den Standzylinder. In das 100-mL-Becherglas gibt man 50 mL H2O2-Lösung und im 50-mL-Becherglas stellt man eine KaliumiodidLösung aus 5 g Kaliumiodid und 10 mL Wasser her. Die Inhalte der beiden Bechergläser leert man nun gleichzeitig in den Standzylinder und entfernt sich von dessen Öffnung. Beobachtung: Kaum 2 Sekunden nach Zugabe von H2O2- und Kaliumiodid-Lösung schießt eine riesige gelblich-bräunliche Schaumschlange aus dem Standzylinder. Nach kurzer Zeit fällt diese wieder in sich zusammen. Auswertung: Iodidionen katalysieren die Zersetzung von Wasserstoffperoxid in Wasser und Sauerstoff. Findet diese in Anwesenheit von Spülmittel statt, so wird dieses durch den freiwerdenden Sauerstoff und das aufgrund der stark exothermen Reaktion gasförmige Wasser so stark aufgeschäumt, dass dabei eine „Schaumfontäne“ in die Höhe schießt. Es handelt sich hier um eine homogene Katalyse in wässriger Lösung, bei der folgende Reaktionen ablaufen: -1 -1 I-(aq) +1-2 + H2O2 +1 -2 IO-(aq) -2 IO-(aq) -1 + H2O2 + H2O -1 -2 0 I-(aq) + H2O (g) + O2 (g) Es finden auch noch einige Nebenreaktionen statt, wie beispielsweise die Oxidation von Iodidionen zu Iod. Dadurch, dass Iod im Schaum in gelöster Form (I3--Ionen) vorliegt, färbt es diesen leicht gelb-bräunlich. -1 H2O2 + 2 -2 H3O+(aq) -1 +2 I-(aq) -2 0 4 H2O + I2 (aq) 17 4.3 Anwendung in der Raumfahrt Neben vielen anderen Raketentreibstoffen wie Kerosin oder Hydrazin kann auch Wasserstoffperoxid als Flüssigtreibstoff für Raketen verwendet werden. Hier ist aufgrund der leichten Zersetzbarkeit des H2O2 allerdings große Vorsicht geboten. Die Firma Degussa (jetzt Evonik) ist der weltweit zweitgrößte Wasserstoffperoxid-Produzent und produziert ca. 600.000 Tonnen dieser Chemikalie pro Jahr.[3] Mit fast 100-jähriger Erfahrung kann sie bis zu 98 prozentiges, hochreines Wasserstoffperoxid her-stellen, welches auch für die Raumfahrt genutzt werden kann.[3] Ende April 2007 bekam die Degussa von den russischen Weltraumunternehmen TsSKB Progress und TsENKI den Auftrag über 50 Tonnen 82,5 prozentiges Wasserstoffperoxid, das für 5 Sojus-RaketenStarts vom Weltraumbahnhof in Kourou genutzt werden soll.[3] Der Transport der hochreinen Chemikalie über 8000 km stellt eine große Herausforderung dar. Dieser wird mit spezial gebeizten, passivierten und mit Wasserstoffperoxid behandelten Containern begegnet, die auf ihrer langen Reise Temperatur- und GPS-überwacht werden.[3] Beim Start der Sojus-Raketen wird das Wasserstoffperoxid dafür verwendet, Pumpen anzutreiben, die den Triebwerken Kerosin und Sauerstoff zuführen. Norbert Nimmerfroh, der Leiter der Anwendungstechnik beschreibt den Vorgang, der auch anhand der Grafik (Abb. 10) gut nachzuvollziehen ist, folgendermaßen: Abb. 9: Sojus- Rakete „Das flüssige H2O2 zersetzt sich an einem Schwermetallkatalysator unter großer Hitzeentwicklung. Es entstehen gasförmiger Sauerstoff und Wasserdampf. Gemeinsam treiben diese die Turbopumpen an, die mit 20.000 bis 30.000 Umdrehungen pro Minute durch Schaufelräder das Kerosin und den flüssigen Sauerstoff als Oxidator in die Raketentriebwerke drücken.“ [3] 18 O2 + H2O Abb. 10: Schematische Darstellung des Antriebssystems der Sojus- Rakete In Versuch 5 soll der Raketenstart der Sojus-Rakete vereinfacht und im Kleinen nachgestellt werden. Dieser Versuch ist leicht durchzuführen, aber gleichzeitig sehr effektvoll, was die Aufmerksamkeit der Schüler erregen dürfte. Hieran kann man eindrücklich die katalytische Zersetzung des Wasserstoffperoxids erklären. 4.3.1 Versuch 5 „Raketenstart“ [4] Chemikalien: H2O2- Lösung (30 %ig) Gefahrensymbol: O, C R 5-8-20/22-35; S 17-26-28-36/37/39-45 MnO2 Gefahrensymbol: Xn; R 20/22 Geräte: Sektflasche, Klebeband, Gummistopfen, Filterpapier, Spatel, Draht, Tonkarton, Stativmaterial 19 Durchführung: Man schneidet aus Tonkarton zunächst zweimal die Form einer kleinen Rakete aus, legt ein Stück Draht zwischen die beiden und klebt sie aufeinander. Das Drahtende steckt man in einen Gummistopfen. Die Sektflasche wird zur Sicherheit mit Klebeband umwickelt, damit im Falle des Zerberstens der Flasche keine Glassplitter durch den Raum fliegen können, und an einem Stativ befestigt. Nun füllt man 30 mL Wasserstoffperoxid in die Sektflasche und wickelt 1 ½ Spatelspitzen Mangandioxid in ein kleines Stück Filterpapier. Dieses Filterpapier-„Päckchen“ wirft man in die Flasche und verschließt sie sofort mit dem präparierten Gummistopfen. Beobachtung: Hat man das Filterpapier in die Flasche geworfen, so muss man einen kleinen Moment warten. Dann fliegt der Gummistopfen mit der Rakete explosionsartig in die Höhe und man kann in der Flasche eine Gasentwicklung erkennen. Auswertung: Bei der Reaktion von Braunstein mit Wasserstoffperoxid kommt es zur Zersetzung des Letzteren in Wasser und Sauerstoff. Braunstein fungiert hierbei als Katalysator. In einer Zwischenstufe wird „MnO3“ gebildet, welches bei weiterer Reaktion mit H2O2 zu Mangandioxid und den Zerfallsprodukten reagiert. +4 -2 -1 MnO2 (s) + H2O2 +6 -2 -1 "MnO3"(s) + H2O2 +6 -2 -2 "MnO3"(s) + H2O +4 -2 -2 0 MnO2 (s) + H2O + O2 (g) ↑ Durch die Entwicklung von Sauerstoff in der verschlossenen Sektflasche steigt der Druck im Innenraum solange an, bis der Gummistopfen samt der kleinen Rakete wegkatapultiert wird. Die Gesamtreaktion lautet: 2 H2O2 [MnO2 (s)] 2 H2O + O2 (g) ↑ 20 4.4 Anwendung in der Waschmittelindustrie In der Waschmittelindustrie dient Wasserstoffperoxid als Zusatzstoff für Vollwaschmittel. Es wird als Bleichmittel gebraucht um nicht auswaschbare, bunte Flecken zu entfernen. Die erwähnten Vollwaschmittel enthalten Natriumperborat, das bevorzugt bei hohen Temperaturen Wasserstoffperoxid freisetzt. In Versuch 6 soll diese Chemikalie im Waschpulver anhand der sehr empfindlichen Luminol-Reaktion nachgewiesen werden. Früher nutzte man zum Waschen von Kleidung ausschließlich Wasser und mechanische Reibung. Die Wäsche wurde dann zum Ausbleichen in die Sonne gelegt. Die Sumerer als ältestes Kulturvolk stellten allerdings schon Seifen-ähnliche Substanzen her, was auch später Ägypter, Gallier und Germanen taten, wobei die gewonnene Seife zu teuer war, um damit Wäsche zu waschen und folglich nur als kosmetisches Produkt eingesetzt wurde, das zunächst einen Luxusartikel darstellte. Erst durch das Leblanc-Verfahren (1791) und das Solvay-Verfahren (1865) zur Herstellung von Natriumcarbonat wurde Seife schließlich erschwinglicher. Das erste moderne Waschmittel kam 1907 unter dem Namen Persil auf den Markt und enthielt erstmals Natriumperborat und Natriumsilikat, wodurch die Wäsche nach dem Waschgang wieder ansehnlich weiß wurde, ohne dass die Sonne ihr Übriges dazu tun musste. Der Name des Waschmittels war Programm: er setzt sich aus den Silben „Per“ für Perborat und „sil“ für Silikat zusammen. 4.4.1Versuch 6 „Nachweis von H2O2 in Waschmitteln“ [5, verändert] Chemikalien: Luminol Gefahrensymbol: Xn; R 22 Natriumcarbonat Gefahrensymbol: Xi; R 36; S 22-26 Hämin Fluorescein Gefahrensymbol: Xi; R 36/37/38 Waschpulver (Firma Henkel) entionisiertes Wasser 21 Geräte: 1-L-Rundkolben, 500-mL-Rundkolben, 2 Korkringe, 50-mL-Becherglas, Schlangenkühler mit Trichter, Stativmaterial, Spatel Durchführung: Man befestigt den Schlangenkühler an einem Stativ und hängt den 500-mLRundkolben an den Auslauf. In diesem Rundkolben legt man 2 Spatelsitzen Fluorescein vor. Den 1-L-Rundkolben befüllt man mit 1 Liter entionisiertem Wasser und löst ein 50-mL-Becherglas voll Waschpulver darin auf. Außerdem fügt man 0,4 g Luminol und 16 g Natriumcarbonat hinzu und schwenkt so lange, bis alles gelöst ist. Als Letztes gibt man eine halbe Spatelspitze Hämin in die Lösung und gießt sie in den Trichter des Schlangenkühlers, bis der Rundkolben am Auslauf zu zwei Drittel gefüllt ist. Beobachtung: Sobald man das Hämin in die Lösung gibt, beginnt diese blau zu fluoreszieren. Die Lösung, die sich im Rundkolben mit Fluorescein sammelt, leuchtet grün. Auswertung: Im Waschmittel ist Natriumperborat enthalten, das mit Wasser ab einer Temperatur von 40-60°C Wasserstoffperoxid freisetzt. In diesem Versuch war die Waschpulverlösung nicht angewärmt worden, da nur eine geringe Konzentration an Wasserstoffperoxid für die Luminol-Reaktion benötigt wird und diese setzt Natriumperborat auch schon in kaltem Wasser frei. -1 -2 -2 Na2[B2(O2)2(OH)4](s) + 2 H2O -1 2 H2O2 + 2 Natriumperborat sieht wie folgt aus: HO 2 Na+ O O B HO OH 2- B O O 6 H2O OH 22 -2 Na+(aq) + 2 H2BO3-(aq) Gibt man nun Luminol in die alkalische Waschpulver-Natriumcarbonat-Lösung, so wird dieses zunächst deprotoniert. Im nächsten Schritt kommt es zum Angriff von Wasserstoffperoxid auf die freien Elektronenpaare des Stickstoffs. Hierbei wird das Wasserstoffperoxid zu zwei Hydroxid-Anionen reduziert und es kommt zur Bildung von Diazachinon.[21] NH2 O NH2 C C NH NH NH2 O - + 2 OH (aq) - 2 H2O C C O O O NH2 C N N + H2O2 N - 2 OH-(aq) O O O C + O22-(aq) N N N C C O O - N2 (g) Diazachinon Als nächstes greift das Peroxid-Anion an der Carbonylfunktion an, woraufhin unter Umlagerung und Abspaltung eines Stickstoffmoleküls das Aminophtalsäuredianion im angeregten Triplett-Zustand entsteht. Dieser Zustand geht in Sekundenbruchteilen in den Singulett-Zustand über, welcher wiederum unter Photonenabgabe in den stabilen Grundzustand übergeht. Die Photonenabgabe nehmen wir als bläuliches, fluoreszierendes Licht wahr.[21] 23 NH2 O NH2 O O C C O O O C C O O Triplett Dianion (T1) (angeregter Zustand) NH2 NH2 O O C C O O O Aminophtalsäuredianion O - hv C C O O Singulett Dianion (S1) (angeregter Zustand) Singulett Dianion (S0) (Grundzustand) Das Hämin dient bei dieser Reaktion dazu, die Aktivierungsenthalpie herabzusetzen. Aufgrund des schönen Leuchteffektes ist in den Auslaufkolben Fluorescein gegeben worden, dessen Reaktion hier allerdings nicht näher betrachtet werden soll. 24 5. Vorkommen in der Natur Wasserstoffperoxid kommt natürlich sowohl im Wasser als auch in der Luft und sogar in Lebewesen vor. Im Grundwasser ist die Konzentration sehr gering und liegt bei 2 μg/L.[6] Im Flusswasser findet man dagegen bereits 10 μg Wasserstoffperoxid pro Liter und im Meerwasser ist die Konzentration noch um eine Zehnerpotenz höher.[6] In der Luft beträgt die WasserstoffperoxidKonzentration 6 μg/L.[6] Die in Lebewesen festgestellten Konzentrationen sind deutlich höher: in Algen liegen sie bei 50 μg/L, in Gemüse bei 3000 μg/L und der Spitzenreiter der Wasserstoffperoxid-Konzentration ist unanfechtbar der afrikanische Bombardier- käfer, der 28,5%- prozentiges H2O2 produziert.[6] Abb. 11: Afrikanischer Bombadierkäfer Der afrikanische Bombardierkäfer ist nur etwa einen Zentimeter groß, hat aber ein sehr effektives Abwehrsystem gegen Fressfeinde entwickelt. In seinem Hinterleib befinden sich zwei Kammern. Die eine, die sogenannte Sammelblase, ist mit Wasserstoffperoxid und Hydrochinon gefüllt, die der Käfer mit seinen Drüsen produziert. In der zweiten Kammer, Explosionskammer genannt, befinden sich Peroxidasen und Katalasen, die als Katalysatoren fungieren. Sobald sich der Bombardierkäfer bedroht fühlt, entlässt er Wasserstoffperoxid und Hydrochinon aus der Sammelblase in die Explosionskammer, wo die dort befindlichen Enzyme Hydrochinon zu Chinon umsetzen und Wasserstoffperoxid in Wasser und Sauerstoff spalten. Hierbei handelt es sich um exotherme Reaktionen, deren freiwerdende Wärme aus-reicht, um das entstandene Wasser in den gas-förmigen Zustand zu überführen. Dadurch steigt der Druck in der Kammer und der Käfer „explodiert“, wobei er präzise zielt und seinen Angreifer mit einem 100°C heißen Gasgemisch beschießt, das aufgrund des Chinons dunkel Abb. 12: Abwehrsystem des Käfers gefärbt ist.[14] 25 Auch der menschliche Körper produziert Wasserstoffperoxid als Stoffwechselendprodukt, wie im folgenden Kapitel näher erläutert werden soll. In der Leber fallen pro Stunde zum Beispiel 270 mg Wasserstoffperoxid an.[6] Rechnet man anhand dieser Zahl die Wasserstoffperoxid-Produktion aller 6 Milliarden Menschen aus, so kommt man auf 14 Millionen Jahrestonnen.[6] 6. Physiologisches Der Umgang mit Wasserstoffperoxid im Labor muss verantwortungsvoll erfolgen, da diese Chemikalie bei Kontakt die Haut bleicht und die Augen angreift. Bereits ab einer Konzentration von 8 % kann Wasserstoffperoxid in den Augen irreversible Schäden anrichten.[6] Der Mensch ist dem Wasserstoffperoxid aber nicht nur im Labor ausgesetzt, er selbst produziert es täglich als Endprodukt des biologischen Stoffwechsels.[6] Wasserstoffperoxid entsteht beim Abbau des äußerst gefährlichen Hyperoxid-Anions O2-, welches die DNA angreift und zerstört. Das Hyperoxid-Anion wird von dem Enzym Superoxiddismutase in Wasserstoffperoxid und Sauerstoff gespalten. Wasserstoffperoxid stellt ebenfalls eine große Gefahr für den Körper dar, da es leicht in Hydroxyl-Radikale gespalten werden kann, die ihrerseits in der Zelle erheblichen Schaden anrichten können. Damit es nicht dazu kommt, besitzt der menschliche Körper das Enzym Katalase, welches Wasserstoffperoxidmoleküle in zwei Schritten in Wasser und Sauerstoff spaltet, was in Versuch 7 näher erläutert werden wird.[13] Da Wasserstoffperoxid ein Zellgift ist und Mikroorganismen häufig keine Abwehrenzyme dagegen besitzen, kann Wasserstoffperoxid gut als Desinfektionsmittel und zur Wasserreinigung verwendet werden. 26 Versuch 7 a) und b) „Der H2O2- Killer“ [8, 20] Chemikalien: H2O2- Lösung (30 %ig) Gefahrensymbol: O, C R 5-8-20/22-35; S 17-26-28-36/37/39-45 Kartoffel Rinderblut Geräte: 500-mL-Kelchglas, 10-mL-Einwegspritze, Pipette, Messer Durchführung: Versuchteil a: Man schneidet eine Kartoffel frisch in zwei Hälften und beträufelt die eine mit Wasserstoffperoxid. Die andere dient als Vergleich. Versuchteil b: In das 500-mL-Kelchglas füllt man ungefähr 50 mL Rinderblut und verdünnt mit entionisiertem Wasser auf 100 mL. Nun spritzt man mit Hilfe einer Einwegspritze 10 mL Wasserstoffperoxid rasch in die Lösung. Beobachtung: Versuchteil a: Die mit Wasserstoffperoxid behandelte Kartoffelhälfte beginnt an der betroffenen Stelle zu schäumen und wird weiß. Versuchteil b: Sobald man das Wasserstoffperoxid zugespritzt hat, beginnt das Blut zu schäumen, wobei der Schaum deutlich über das Kelchglas hinauswächst. Aufgrund seines Aussehens trägt der Versuch auch häufig den Namen „Eisbecher“. Auswertung: Sowohl in der Kartoffel als auch im Blut ist das Enzym Katalase enthalten. Dieses außerordentlich stabile Molekül enthält Häm-Gruppen und wird im Organismus zur Spaltung von Wasserstoffperoxid benötigt. Die Reaktion läuft am reaktiven Häm-Zentrum der Katalase ab, das sich gut geschützt ganz im Inneren des Enzyms befindet, jedoch über hydrophobe Kanäle zugänglich ist. 27 N N Fe N N O O OH OH Abb. 13: Reaktives Zentrum der Katalase Im ersten Schritt oxidiert ein Wasserstoffperoxid-Molekül das Eisen der HämGruppe von + 3 zu + 4, wobei eine Eisen-Oxo-Porphyryl-Radikal Spezies entsteht.[7] +3 -1 +4 III Por Por Fe + H2O2 + -2 -2 IV Fe =O + H2O Im zweiten Schritt kommt es zur Regenerierung des Enzyms durch ein weiteres Molekül Wasserstoffperoxid, welches als Reduktionsmittel fungiert und dabei selbst in molekularen Sauerstoff umgesetzt wird.[7] +4 Por + -2 -1 IV Fe =O + H2O2 +3 0 -2 III Por Fe + O2 (g) + H2O Die Gesamtreaktion, bei der das Enzym Katalase der Katalysator ist, lautet folgendermaßen: Katalase 2 H2O2 2 H2O + O2 (g) 28 7. Schulrelevanz Die Chemikalie Wasserstoffperoxid kommt selbstverständlich nicht als eigenständiges Thema im Hessischen Lehrplan G8 vor, man findet aber an vielen Stellen Gelegenheit und Berechtigung, Wasserstoffperoxid und seine Reaktionen zum Gegenstand des Unterrichts in Klasse 10, 11 und 12 zu machen. So stehen für die 10. Klasse Redoxreaktionen auf dem Lehrplan, wobei man die Begriffe Oxidation, Reduktion, Oxidations- und Reduktionsmittel einführen soll, was man sehr gut anhand der Reaktionen von Wasserstoffperoxid mit Kaliumpermanganat und Manganhydroxid tun kann. Auch die Oxidationszahlen können anhand der vielfältigen Redoxreaktionen eingeübt werden, an denen das Wasserstoffperoxid beteiligt ist. Im Leistungskursbereich der 11. Klasse gibt es ferner die Möglichkeit, das Thema „Modifizierte Naturstoffe“ zu behandeln, worunter auch das Papier fällt. In diesem Zusammenhang wäre es von großer Wichtigkeit im Zuge der Papier-herstellung auch die chlorfreie Bleiche mit Hilfe von Wasserstoffperoxid zu erläutern und ebenso das PapierRecycling anzusprechen, zu dem Demo 1 gut passt. Im Jahrgang 12 werden unter anderem Nachweisreaktionen behandelt, bei denen man den Nachweis von Wasserstoffperoxid mittels Titanylsulfatlösung als Beispiel einbringen kann. In der 12. Klasse kann ebenfalls über Katalysatoren und Enzym-kinetik gesprochen werden, wobei die katalytische Zersetzung von Wasserstoff-peroxid auf die vielen verschiedenen Arten und Weisen passend ist. Spannend ist an dieser Stelle der Versuch „Elefantenzahnpasta“, bei dem Iodid die Zersetzung des H2O2 katalysiert, sowie der Versuch „Raketenstart“, bei dem Braunstein als Katalysator fungiert. Mindestens ebenso eindrucksvoll ist die Enzym-katalysierte Zersetzung von Wasserstoffperoxid durch Katalase, zu der man Versuch 7 durchführen kann. Im zweiten Halbjahr desselben Jahrgangs stehen großtechnische Verfahren, grenzflächenaktive Substanzen und Umweltchemie auf dem Programm, wozu Wasserstoffperoxid jeweils einen Beitrag zu leisten hat. So kann als Beispiel für ein großtechnisches Verfahren das heute aktuelle AnthrachinonVerfahren genommen werden. Waschmittel sind grenzflächenaktive Substanzen, die Wasser-stoffperoxid in Form von Natriumperborat als Bleichmittel enthalten, worauf laut Lehrplan auch konkret eingegangen werden soll. Hierzu kann man als Lehrerversuch die optisch sehr ansprechende Luminol-Reaktion zum Nachweis von Wasserstoff-peroxid in Waschmitteln zeigen. In der Umweltchemie geht es unter anderem 29 um die Reinigung von Wasser, wozu man zum Beispiel im Schwimmbad, auch Wasserstoff-peroxid einsetzt. 8. Quellenangaben Literaturquellen 1. Riedel, Erwin: Anorganische Chemie, 6. Auflage, Walter de Gruyter, Berlin/New York 2004 2. Holleman- Wiberg: Lehrbuch der anorganischen Chemie, 71.-80. Auflage, Walter de Gruyter, Berlin 1971 3. Folio, Das Mitarbeitermagazin der RAG, 6/2007, Seite 28-29 4. Versuchsbeschreibungen aus der Sammlung von Herrn Donart, PhilippsUniversität Marburg, Marburg 2007 5. Krempel, Nicole: Experimentalvortrag Wasserstoffperoxid, Marburg 2002 6. Nimmerfroh, Norbert: Sicherheitsschulung Wasserstoffperoxid „Degussa and active oxygens“, 2007 7. Vlasits, Jakopitsch, Schwanninger, Holubar, Obinger: Hydrogen peroxide oxidation by catalase-peroxidase follows a non-scrambling mechanism, FEBS Letters 581, 2007 Internetquellen 8. http://www.old.unibayreuth.de/departments/ddchemie/umat/wasserstoffperoxid/wasserstoffperoxid.h tm (24.05.2007) 9. http://www.chemie.uniregensburg.de/Anorganische_Chemie/Pfitzner/demo/demo_ws0405/wasserstoffpero xid.pdf (27.03.2008) 10. http://www.chemievorlesung.uni-kiel.de/grund/07C_H2O2.pdf (24.05.2007) 11. http://de.wikipedia.org/wiki/Louis_Jacques_Th%C3%A9nard (27.03.2008) 30 12. http://de.wikipedia.org/wiki/Wasserstoffperoxid (10.03.2008) 13. http://www.ebi.ac.uk/interpro/potm/2004_9/ (26.03.2008) 14. http://www.wdr.de/tv/quarks/global/pdf/Quarks_Explosion_cwdr2003.pdf (26.03.2008) 15. http://www.wella.de/consumer/home_vb/basic/basic_colour/start.jsp (24.05.2007) 16. http://www.wella-trainingonline.com/reference/tronl_de_06_download_5002_0_sl.pdf 17. http://www.axel-schunk.de/experiment/edm0601.html (10.03.2008) (24.05.2007) 18. http://www.netexperimente.de/netexperimente/index.php?c=chemie&section= 009 (24.05.2007) 19. http://www.chemieunterricht.de/dc2/grundsch/versuche/gs-v-111.htm (24.05.2007) 20. http://www.cci.ethz.ch/experiments/Blut/de/stat.html (24.05.2007) 21. http://www.old.unibayreuth.de/departments/ddchemie/umat/chemolumineszenz/chemolum.htm (01.07.2007) 22. http://www.hannover.de/feuerwehr/aktuell/presse/Pressemitteilungen_April_20 07/Gefahrguteinsatz_in_der_NORD_LB/index.html (27.03.2008) 23. http://www.lindegas.de/international/web/lg/de/like35lgde.nsf/docbyalias/ind_zell_faser2 (29.03.2008) 24. http://www.vdp-online.de/papierindustrie.html (29.03.2008) 25. http://de.wikipedia.org/wiki/Waschmittel#Entwicklung_moderner_Waschmittel (29.03.2008) 26. http://www-organik.chemie.uniwuerzburg.de/fileadmin/08020000/pdf/erlebnis/elefantenzahnpasta.pdf (01.04.2008) 31 Abbildungen Bild Deckblatt: http://ruby.chemie.uni-freiburg.de/Vorlesung/oxide_2_2.html (25.02.2008) Abbildung 1: http://de.wikipedia.org/wiki/Louis_Jacques_Th%C3%A9nard (27.03.2008) Abbildung 2: http://www.old.unibayreuth.de/departments/ddchemie/umat/wasserstoffperoxid/wasserstoffperoxid.h tm (24.05.2007) Abbildung 3: eigene Zeichnung nach Vorbild von (6) Abbildung 4: Nimmerfroh, Norbert: Sicherheitsschulung Wasserstoffperoxid „Degussa and active oxygens“, 2007, Folie 36 Abbildung 5: http://ruby.chemie.uni-freiburg.de/Vorlesung/oxide_2_2.html (25.02.2008) Abbildung 6: (24.05.2007) http://www.wella.de/consumer/home_vb/basic/basic_colour/start.jsp Abbildung 7: (24.05.2007) http://www.wella.de/consumer/home_vb/basic/basic_colour/start.jsp Abbildung 8: eigene Zeichnung Abbildung 9: Folio, Das Mitarbeitermagazin der RAG, 6/2007, Seite 28-29 Abbildung 10: Folio, Das Mitarbeitermagazin der RAG, 6/2007, Seite 28-29 Abbildung 11: Nimmerfroh, Norbert: Sicherheitsschulung Wasserstoffperoxid „Degussa and active oxygens“, 2007, Folie 8 Abbildung 12: (26.03.2008) http://www.wdr.de/tv/quarks/global/pdf/Quarks_Explosion_cwdr2003.pdf Abbildung 13: eigene Zeichnung 32