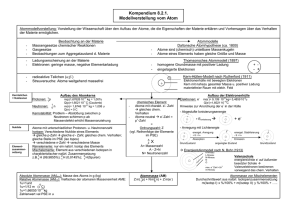
Chemie-Arbeit Nr.1 1. Atommasse Die Atommasse wird in „u
Werbung

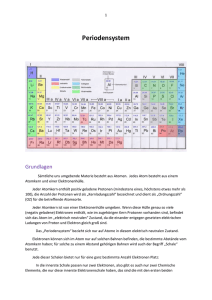
Chemie-Arbeit Nr.1 1. Atommasse Die Atommasse wird in „u“ angegeben. Da Atome sehr klein sind und daher eine sehr geringe Masse haben, gibt man die Atommasse in der Einheit „u“ an. Formel: 6*1023u = 1g oder: 600.000.000.000.000.000.000.000u = 1g Dieser Umrechnungsfaktor wurde vom Chemiker Avogadro entdeckt. 2. Formelsprache/Fachbegriffe Element: Ein Element ist ein Stoff, der nur aus einer Atomsorte besteht (z.B.: nur Natrium (Na), nur Kalium (K),…). Verbindung: Eine Verbindung ist ein Stoff, bei dem zwei oder mehrere verschiedene Atomsorten (= Atome verschiedene Elemente) miteinander verbunden sind [z.B. CaO (= Calciumoxid, besteht aus einem Calcium und einem Sauerstoffatom), KMnO4 (= Kaliumpermanganat besteht aus drei Elementen (Kalium, Mangan, Sauerstoff) KMnO4: 1 K-Atom, 1 Mn-Atom, 4 O-Atome]. Molekül: Ein Molekül besteht aus mindestens zwei oder mehreren miteinander verbundenen Atomen. Die Atome können aus einer oder verschiedenen Atomsorten bestehen [z.B.: O2 (Sauerstoff), O3 (Ozon), CaO, H2] Unterschied: Verbindung und Molekül Verbindungen: Molekül: Ionen: Alle geladenen Teilchen sind Ionen. Kationen: Alle Kationen sind positiv geladen (z.B.: Na+, Mg2+, Ca2+) Anionen: Alle Anionen sind negativ geladen (z.B.: Cl-, SO2-4) Komplexionen: Haben eine Ladung und bestehen aus einer Verbindung (HCO-3) nur unterschiedliche Stoffe (CaO) auch gleiche Atome (O3) 3. Rutherford’sches Atommodell Ein Atom besteht aus Atomkern und Atomhülle. In der Atomhülle befinden sich die Elektronen. Sie können sich in der Atomhülle frei bewegen. Elektronen sind einfach negativ geladen. Abkürzung: e- Elektronen weisen eine sehr geringe Masse auf. Der Atomkern besteht aus Protonen und Neutronen. Protonen sind einfach positiv geladen. Abkürzung: p+ Neutronen sind ungeladen, d.h. neutral. Protonen und Neutronen sind für die Masse des Atoms verantwortlich [die Masse der e- (0,0005u) kann vernachlässigt werden]. Ein Atom ist neutral. Daraus folgt, dass die Anzahl von e- in einem Atom gleich der Anzahl der p+ im Kern sind, d.h. deren Ladungen gleichen sich gegenseitig aus. Die Anzahl der Neutronen kann in einem Atom variieren - man spricht von Isotopen (siehe Punkt 6). 4. Das Atom + - Anzahl p = e Es ist immer dieselbe Anzahl von p+ und evorhanden. p+, e- und n bezeichnet man als Elementarteilchen. Die Atommasse wird von p+ und n bestimmt. p+ und n haben eine Masse von ca. 1u. Die Masse von e- ist so gering, dass sie vernachlässigt werden kann! Die gerundete Masse eines Atoms entspricht der Anzahl von p+ + n. Atommasse = Anz. p+ + Anz. n Die Ordnungszahl gibt die erstens die Stelle eines Elements im PSE an und zweitens die Anzahl der p+, also auch gleichzeitig die Anzahl der e- wieder. OZ = Stelle im PSE, Anz. p+, Anz. eDie Anzahl der Neutronen lässt sich errechnen. gerundete Atommasse - OZ = Anz. n 5. Das Schalenmodell Das Schalenmodell baut auf der Atomvorstellung von Rutherford auf. Bei dem Schalenmodell werden die Aufenthaltsräume der e- nur genauer beschrieben. Beim Schalenmodell wird die Atomhülle in mehrere Schalen eingeteilt. Die Nummer der Periode (Reihen im PSE von links nach rechts) gibt die Schalenanzahl eines Atoms an. Jede Schale kann 2Z² Elektronen aufnehmen. Wobei Z = Periodennummer ist. Demzufolge kann die 1. Schale 2*1² = Elektronen aufnehmen 2. Schale 2*2² = Elektronen aufnehmen 3. Schale 2*3² = Elektronen aufnehmen Die Elektronen werden nach einer bestimmten Reihenfolge besetzt: 1. Zuerst die innere Schale. 2. Dann die folgende Schalen bis diese mit 8 e- besetzt sind. 3. Bleiben noch e- übrig, werden diese ab der 3. Schale nach außen hin aufgefüllt. In der äußersten Schale eines Elements befinden sich immer genauso viele Elektronen, wie die Zahl der Hauptgruppe (HG) ist. Beispiel: Lithium, I. HG, 1 Valenzelektron; Chlor, VII. HG, 7 Valenzelektronen. Die äußerste Schale nennt man auch Valenzschale. Die Schalen werden von innen nach außen mit den Buchstaben K, L, M, N,… Beispiel Lithium: 6. Periodensystem (PSE) Im PSE gibt es zwei Ordnungen. Es gibt die Perioden (Reihen von links nach rechts) und die Hauptgruppen. Die Hauptgruppe gibt an, wie viele Valenzelektronen ein Atom hat. Also: Ist ein Atom in der 6. Hauptgruppe (HG), hat es 6 Valenzelektronen. Die Periode gibt an wie viele Schalen ein Atom hat. Alle Atome in derselben HG haben ähnliche chemische und physische Eigenschaften. Desweiteren haben die Hauptgruppen auch noch andere Bezeichnungen: 1. HG: Alkalimetalle; 2. HG: Erdalkalimetalle; 7. HG: Halogene; 8. HG: Edelgase Der Buchstabe der Periode ist der Name der äußersten Schale, d.h., das ein Atom in der L-Periode als Valenzschale die L-Schale hat. 7. Isotope Isotope sind Atome eines Elements, die sich nur in der Neutronenanzahl unterscheiden. Die Atommasse wird durch die Anzahl von p+ + n angegeben. Protonen und Neutronen besitzen jeweils die Masse von 1u. Daraus folgt, dass die Atome eines Elements eine gerade Zahl aufweisen muss (Da 1u+1u+1u+… niemals eine Kommazahl ergeben kann!). Weshalb steht dann im PSE die Atommasse 35,5 u (Chlor; Cl)? Die meisten Elemente weisen isotope Atome in unterschiedlichem Mengenverhältnis auf. Im PSE ist der Durchschnitt aller Isotope angegeben. D.h. für Chlor: Es gibt Chlorisotope mit der Masse 35 u und mit der Masse 36 u. Anscheinend kommen beide Isotope im gleichen Mengenverhältnis vor (50:50). Daraus ergibt sich die durchschnittliche Masse von 35,5 u. Schreibweise: Nukleonenschreibweise vom lat. nucleus (=Kern) Schreibweise, bei der die Kernteilchen [p+ (OZ) und Masse) dargestellt werden. Beispiel Chlor: 35 36 17Cl 17Cl 8. Gefahrensymbole & R-/S-Sätze 8.1. R-/S-Sätze Die R-/S-Sätze schützen und warnen bei chemischen Versuchen. Es gibt 67 R-Sätze, die die genauere Art der Gefahren angeben. Zudem gibt es 64 S-Sätze, die Empfehlungen geben, um Gesundheitsgefährdenden bei gefährlichen Stoffen zu verhindern. 8.2. Gefahrensymbole Es gibt folgende Gefahrensymbole (siehe AB): - T giftig: beim Verschlucken, Einatmen oder über Hautaufnahmen: kann - T+sehr giftig: bis zum Tod führen - Xn mindergiftig: beim Verschlucken, Einatmen oder über Hautaufnahmen: kann beschränkt Gesundheitsschäden hervorrufen - C ätzend: kann Hautgewebe innerhalb weniger Minuten zerstören - Xi reizend: können auf der Haut nach mehrstündiger Einwirkung deutliche Entzündungen hervorrufen - O brandfördernd: Stoffe, die brennbare Materialen entzünden können oder mit diesen explosive Gemische ergeben - F leichtentzündlich: können nach kurzzeitiger Einwirkung einer Zündquelle entzündet werden oder an - F+ hochentzündlich: der Luft entzündet werden - E explosionsgefährlich: Stoffe die explodieren können - N umweltgefährlich: Stoffe, die Wasser und Boden verseuchen (vergiften; kontaminieren) können 9. Sonstiges 9.1. Dalton Dalton entdeckte das jedes Element aus Atomen besteht. Zu Atomen kann man vier Kernaussagen treffen: 1. Jedes Element besteht aus Atomen, diese sind unzerteilbar. 2. Alle Atome haben die gleiche Größe. Sie unterscheiden sich in den Elementen bei ihrer Masse. 3. Atome sind unzerstörbar 4. Bei chemischen Reaktionen verschiedener Stoffe werden die Atome miteinander verknüpft und neu angeordnet. 9.2. Mendelejew Mendelejew ordnete die Atome im PSE nach ihrer Masse und ihren Eigenschaften. Die Masse wurde von links nach rechts, wie von oben nach unten mehr. Die Atome mit ähnlichen Eigenschaften sortierte er in die gleichen Hauptgruppen. Niklas