Verschiedene Zucker in offenkettiger Form
Werbung
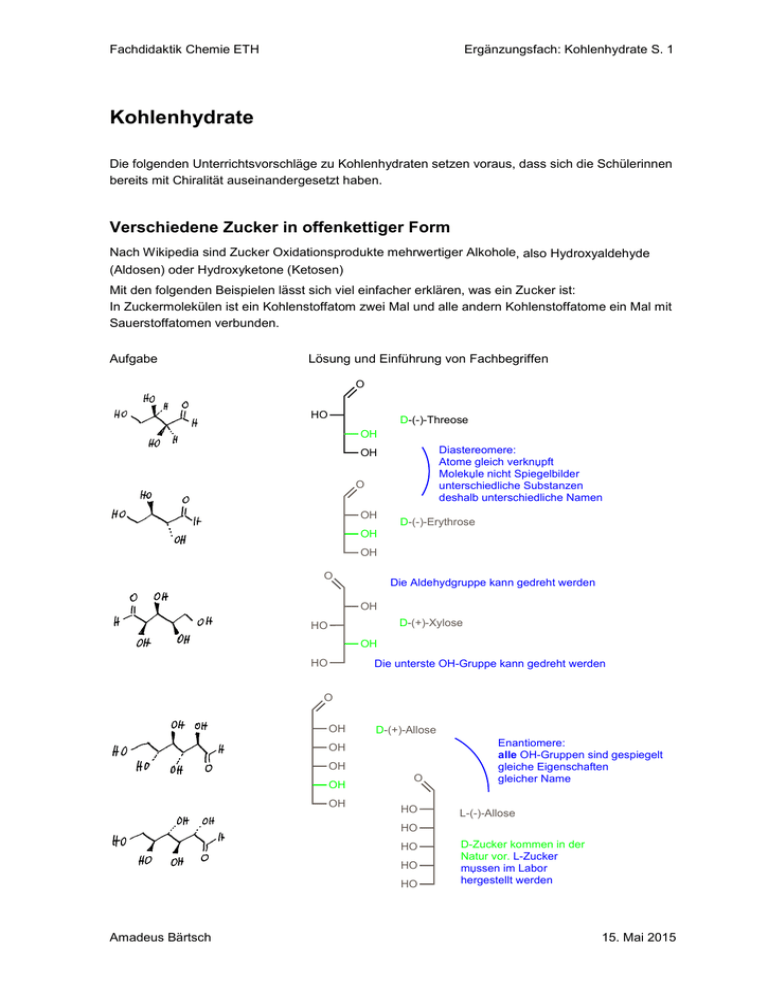
Ergänzungsfach: Kohlenhydrate S. 1 Fachdidaktik Chemie ETH Kohlenhydrate Die folgenden Unterrichtsvorschläge zu Kohlenhydraten setzen voraus, dass sich die Schülerinnen bereits mit Chiralität auseinandergesetzt haben. Verschiedene Zucker in offenkettiger Form Nach Wikipedia sind Zucker Oxidationsprodukte mehrwertiger Alkohole, also Hydroxyaldehyde (Aldosen) oder Hydroxyketone (Ketosen) Mit den folgenden Beispielen lässt sich viel einfacher erklären, was ein Zucker ist: In Zuckermolekülen ist ein Kohlenstoffatom zwei Mal und alle andern Kohlenstoffatome ein Mal mit Sauerstoffatomen verbunden. Aufgabe Lösung und Einführung von Fachbegriffen O HO D-(-)-Threose OH Diastereomere: Atome gleich verknџpft Molekџle nicht Spiegelbilder unterschiedliche Substanzen deshalb unterschiedliche Namen OH O OH D-(-)-Erythrose OH OH O Die Aldehydgruppe kann gedreht werden OH D-(+)-Xylose HO OH HO Die unterste OH-Gruppe kann gedreht werden O OH D-(+)-Allose OH OH OH OH O HO Enantiomere: alle OH-Gruppen sind gespiegelt gleiche Eigenschaften gleicher Name L-(-)-Allose HO HO HO HO Amadeus Bärtsch D-Zucker kommen in der Natur vor. L-Zucker mџssen im Labor hergestellt werden 15. Mai 2015 Fachdidaktik Chemie ETH Ergänzungsfach: Kohlenhydrate S. 2 Lernaufgabe mit den oben stehenden Molekülen 1. Chiralitätszentren einzeichnen 2. Modell bauen. Es ist übersichtlicher, wenn die Wasserstoffatome weggelassen werden 3. Modell gemäss Konvention für die Fischerprojektion halten Demonstration: C-Kette senkrecht wie ein Armband um den Unterarm legen Aldehyd-Gruppe oben Abb. aus Wikipedia 4. Fischerprojektion zeichnen 5. Moleküle durch Vergleich mit dem Zuckerstammbaum – der unten abgebildet ist – benennen Das erste Beispiel als Input vormachen: alle Gedanken laut äussern, Modell bauen und Aufgabe 1:1 vorlösen. Was lernen die Schülerinnen in dieser Aufgabe? Bei den Zuckern kommt es auf die Lage der OH-Gruppen an Fischerprojektion, Modelle bauen und sorgfältig schauen wird geübt Es gibt eine Vielzahl von Zuckern Die Fischerprojektion zeigt die Systematik der Zucker viel besser als die ursprüngliche räumliche Darstellung Enantiomer: alle Hydroxy-Gruppen spiegeln! Amadeus Bärtsch 15. Mai 2015 Fachdidaktik Chemie ETH Ergänzungsfach: Kohlenhydrate S. 3 Nachdem die Fischerprojektionen gezeichnet wurden, können folgende Begriffe erklärt werden: enantiomer und diastereomer D- und L-Zucker (+) und (-) nur D-Zucker in der Natur Ein Marienkäfer hilft beim Zeichnen der Fischerprojektion: Der Zucker steht senkrecht wie eine Blume. Der Aldehyd entspricht der Blüte; H-Atom und OH-Gruppe sind die Blätter. Der Marienkäfer läuft immer zwischen den Blättern den Stängel hoch und gibt die Orientierung der OH-Gruppe an. (Idee: Andreas Häne, Kantonsschule Freudenberg) Fischer-Projektion oder/und absolute Konfiguration unterrichten? Für die Fischer-Projektion spricht: In Büchern werden Zucker in der Fischerprojektion dargestellt. Die natürlichen Zucker liegen in der D-, die natürlichen Aminosäuren in der L-Form vor. Mit der absoluten Konfiguration ist es nicht so einfach: Es gibt natürliche Aminosäuren in der S- und in der R-Form. Mit der Fischerprojektion ist die Systematik der Zucker leicht verständlich: Zuckerstammbaum. Der systematische Name nach IUPAC (2R,3S,4R,5R)-2,3,4,5,6-Pentahydroxyhexanal (als Aldehyd) und (3R,4S,5S,6R)-6-(Hydroxymethyl)oxan-2,3,4,5-tetrol (als Pyranose) ist keine Alternative zu D-Glucose. Im Unterricht habe ich mich bisher auf die Fischer-Projektion beschränkt. Und dies nicht nur aus Zeitgründen. Schülerinnen, die sich das erste Mal mit der räumlichen Darstellung chiraler Substanzen befassen, brauchen eine Methode zur Bezeichnung von Enantiomeren. Sie haben kein Bedürfnis eine zweite Methode kennen zu lernen. Was bringt es, wenn sie beide Varianten kennen? Glucose Ring- und offenkettige Form Der Ringschluss und die Existenz von - und -Glucose ist in Lehrbüchern oft umständlich dargestellt (Abbildung aus Chemie heute SII, Schroedel, Braunschweig, 2009): Beobachtung 1: Schülerinnen haben weniger Mühe einen Ring zu öffnen als aus der offenkettigen die Ringform zu bilden. Konsequenz: Mit einer Übung zur Ringöffnung beginnen Amadeus Bärtsch 15. Mai 2015 Ergänzungsfach: Kohlenhydrate S. 4 Fachdidaktik Chemie ETH Input: -Glucose vorgeben und ohne Modell zeigen wie der Ring zur offenkettigen Form wird. Es ist eine grosse Hilfe, wenn die Kohlenstoffatome numeriert werden. Beobachtung 2: Die Schüler haben Schwierigkeiten die Modelle der Zucker nach dieser Zeichnung zu bauen. Deshalb empfiehlt es sich, wenn Sie in der Klasse zirkulieren, die Modelle bei jeder Gruppe kontrollieren und folgende Aufgabe stellen. Lernaufgabe: D(-)-Ribose D(+)-Galactose D(-)-Fructose 1. Ring öffnen und Molekül in der Fischerprojektion darstellen. Vorgehen: Gegebenes Molekül bauen und auf die Orientierung der OH-Gruppen achten. Ring öffnen, Molekül zur offenkettigen Form umbauen und so halten, dass die Fischerpojektion gezeichnet werden kann. 2. Schliessen Sie den Ring und zeigen Sie, dass es eine zweite Ringform gibt. Am Ende müssen Sie die und die -Form der oben stehenden Moleküle in den Notizen haben. Nach dieser Aufgabe können Sie Desoxyribose, Aldosen und Ketosen thematisieren. Das Thema Zucker ist in mehreren Gründen anspruchsvoll recht grosse Moleküle Ring- und offenkettige Form sehen sehr verschieden aus Kleinigkeiten sind entscheidend alles Wesentliche ist 3-dimensional Notizen und Bücher arbeiten mit Projektionen die Arbeit mit Modelle muss geübt werden: Die Übersetzung von 2 zu 3 Dimensionen und zurück ist nicht trivial Vorschlag: Bei der Prüfung steht ein Modellbaukasten zur Verfügung Amadeus Bärtsch 15. Mai 2015 Fachdidaktik Chemie ETH Ergänzungsfach: Kohlenhydrate S. 5 Stärke und Cellulose (Polysaccharide) Demonstration: Eine kleine Folie, die nur -Glucose zeigt, kann am Hellraumprojektor auf die Stärke gelegt werden. Mit zwei -Glucose-Molekülen kann die Wasserabspaltung gezeigt werden. Eine kleine Folie mit -Glucose passt auf die Cellulose, wenn sie gedreht wird. Diese Abbildung gibt Ihnen Gelegenheit über - und -Glucose, über Polykondensation, 1,4-Verknüpfung, Hydrolyse, Verdauung, Wiederkäuer, Spaghetti, Salat und Kalorien zu sprechen Fazit: -Glucose ist verantwortlich dafür, dass Salat schlank macht. Ein Detail ist entscheidend: die Orientierung der OH-Gruppe am C(1). Amadeus Bärtsch 15. Mai 2015 Ergänzungsfach: Kohlenhydrate S. 6 Fachdidaktik Chemie ETH Schiessbaumwolle (Nitrocellulose) Schülerinnen stellen im Labor Schiessbaumwolle her. Dazu muss Watte in konzentrierte Schwefelund Salpetersäure gelegt werden. Das Experiment ist kein Problem, wenn die Schüler gut instruiert und überwacht werden. Die Anleitung finden Sie auf der Plattform www.fdchemie.pbworks.com H OH Watte H O HO O H HO H H HO H H O2NO H O2NO H HO H H ONO2 H H O O H O H H H O2NO O H O O HO H O2NO H O O O OH H ONO2 Nitrocellulose H O O H H OH H HO O2NO ONO2 O H H O2NO H Schiessbaumwolle verbrennt im eigenen Sauerstoff Die C- und H-Atome bilden den Brennstoff, der mit den Sauerstoffatomen zu CO 2, H2O wird. Die heissen, gasförmigen Produkte CO2, H2O und N2 beanspruchen sehr viel Platz. Da die Sauerstoffatome sehr nahe beim Brennstoff sind, ist die Reaktion schnell und benötigt keinen Sauerstoff aus der Luft. Die Bindung von N zu O ist schwach und lässt Schiessbaumwolle leicht zerfallen. Eine Tabelle mit Bindungsenergien zeigt zudem, dass die Verbrennungsprodukte energiearm sind: Starke Bindungen halten die Atome zusammen. Deshalb ist die Reaktion stark exotherm, was viel zum Volumen der gasförmigen Produkte beiträgt. Demonstration Wenig Watte, dann wenig Schiessbaumwolle auf Petrischale entzünden. Schiessbaumwolle, die schnell abbrennt, kann auf der flachen Hand entzündet werden. Vorher unbedingt mit der vorgesehen Probe testen, ob nicht ein langsam brennender Teil übrig bleibt. Schiessbaumwolle in ein weites Becherglas geben und mit CO 2 überschichten und damit zeigen, dass Schiessbaumwolle auch ohne Luft brennt. Das Entzünden ist nicht ganz einfach, weil ein brennendes Zündholz im Kohlendioxid erlischt. Mit etwas Glück reagiert die Schiessbaumwolle, wenn ein brennendes Zündholz auf die Schiessbaumwolle fällt. Einfacher gelingt die Zündung mit einer Zündschnur oder Funken. Ausgebrannte, kommerziell erhältliche Tischbomben beladen: den unteren Teil zur Hälfte mit loser Schiessbaumwolle füllen und Zündschnur anbringen. Zündschnüre können in einem Waffengeschäft erworben werden. Sprengsätze: Schiessbaumwolle kann mit einer Zündschnur versehen und in Papier eingewickelt werden. Papier mit viel Klebstreifen verstärken. Im Freien entzünden. Vorsicht: genügend Abstand wahren! Die Lehrperson, die die Experimente vorführt, muss die nötigen Vorsichtsmassnahmen treffen. Sie trägt die Verantwortung für die Sicherheit. Amadeus Bärtsch 15. Mai 2015 Fachdidaktik Chemie ETH Ergänzungsfach: Kohlenhydrate S. 7 Eine spezielle Prüfungsfrage Ich hoffe, dass Sie die Formel von Schiessbaumwolle nicht auswendig gelernt haben. Dann ist die folgende Aufgabe sinnvoll: Versuchen Sie die Lewisformel von Schiessbaumwolle zu zeichnen und geben Sie in Stichworten an, worauf Sie geachtet haben. Auch Bruchstücke sind willkommen. Die Aufgabe muss ohne Hilfsmittel gelöst werden. Erwartete Lösung mit Bewertung: Schiessbaumwolle wird aus Cellulose hergestellt. Cellulose besteht aus vielen Glucose-Molekülen (1 Punkt), die in der β-Form vorliegen (1 Punkt). Glucose bildet sechsgliedrige Ringe aus 5 Kohlenund einem Sauerstoffatom (2 Punkte). Schiessbaumwolle enthält viele Sauerstoffatome, weil alle OH-Gruppen nitriert, das heisst mit NO2-Gruppen versehen werden (1 Punkt). Selten werden die Nitratgruppen in der korrekten Orientierung gezeichnet (1 Punkt) und die 1,4-Verknüpfung der Glucose erwähnt (1 Punkt). Die halbe Punktzahl für Beschreibungen ohne eine konkrete Darstellung. Es geht nicht darum, das Molekül photographisch wiederzugeben. Vielmehr können viele Angaben aus allgemeinen Erkenntnissen des Unterrichts abgeleitet werden. Abbaubare Kunststoffe 1. Experiment: Styropor löst sich in Aceton oder Essigester Erkenntnis: Geschäumte Kunststoffe enthalten viel Luft. 2. Experiment: Green-Pac und Styropor in heisses Wasser geben Beobachtung: Green-Pac zerfällt. Es bleibt sehr wenig Material zurück. Styropor verändert sich nicht. Diskussion: Green-Pac besteht aus Maisstärke und viel Luft. Stärke ist hydrophil und abbaubar: die Hydrolyse ist leicht möglich. Styropor dagegen ist lipophil. Die C-C-Bindungen können von Mikroorganismen kaum gespalten werden. Green-Pac ist bei Folag AG Folienwerke in Sempach erhältlich. Kleinste Packung 300 Liter ca. Fr. 60.–. www.folag.com oder http://www.folag.com/index.php?nav=141,535,568,518,591 3. Experiment: Green-Pac und Styropor in den Mund stecken Beobachtung: Green-Pac ist im Gegensatz zu Styropor essbar. 4. Demonstration: Abbaubare Wegwerfartikel bestehen aus Zellulose oder Stärke Wegwerfteller und Wegwerfbesteck "compost it" aus Migros ist ein Stärke-Zellstoffgemisch mit Zusätzen compo-bag Amadeus Bärtsch 15. Mai 2015 Ergänzungsfach: Kohlenhydrate S. 8 Fachdidaktik Chemie ETH Saccharose (ein Disaccharid) Herstellung von Zucker ? ? Vorschlag: Schülerinnen überlegen sich, welche Schritte bei der Isolation von Zucker aus Zuckerrüben nötig sind. Waschen, zerkleinern, Zucker mit Wasser extrahieren und Wasser abdampfen, sind Arbeitsschritte, die im Gespräch mit der Klasse bald gefunden sind. Eine genauere Angabe zur Herstellung findet sich zum Beispiel in Chemie heute SII, Schroedel, Braunschweig, (2009) Bemerkungen Die Rüben werden zuerst gewaschen und dann zerkleinert. Die Schüler werden die Behandlung mit Kalkmilch nicht vorschlagen. Dieser Schritt muss nicht unbedingt erwähnt werden. Der Film "Wie Zucker entsteht" kann gratis bestellt werden: http://www.zucker.ch/de/schweizerzucker/schulen/ Der Film wird für die Primarschule empfohlen, eignet sich aber in Ausschnitten auch für das Gymnasium. Amadeus Bärtsch 15. Mai 2015 Ergänzungsfach: Kohlenhydrate S. 9 Fachdidaktik Chemie ETH Demonstration: Verschiedene Formen von Saccharose zeigen: Kristallzucker, Würfelzucker, Puderzucker, Kandiszucker, Rohrzucker, Rübenzucker, Rohzucker, Vollrohrzucker Exp. 1: In einer Kristallisierschale Rohzucker grob von Coop zwei Mal mit etwas Wasser umschwenken und dekantieren. Beobachtung: Der Zucker wird fast weiss. Interpretation: Rohzucker ist nur aussen gefärbt mit Melasse oder Zuckercouleur. Exp. 2: Vollrohrzucker Jacutinga von Biofarm-Genossenschaft, Kleindietwil aus Bioladen oder Coop. In einer Kristallisierschale Vollrohrzucker mit Wasser versetzen. Es entsteht eine trübe Brühe. Trotz mehrmaligem Waschen, bleibt der Vollrohrzucker braun, weil er miserabel kristallisiert ist und Dreck enthält. Brauner Zucker - eine Alternative? Immer wieder werden Rohzucker oder andere braune Zuckersorten ernährungsphysiologisch als günstiger oder gar gesünder gegenüber Weisszucker angepriesen. Trifft diese Bewertung zu? Rohzucker enthält über 90 % Saccharose, daneben noch Reste an Melasse, die auch seine braune Farbe bewirken. Melasse an sich als Lebensmittel ist wegen ihres bitteren, lakritzähnlichen Geschmacks wenig beliebt. Herstellungsbedingt weist sie neben etwa 60 % Saccharose und unerwünschten Inhaltsstoffen der Zuckerrübe in der Tat noch Mineralstoffe, besonders Kalium, Aminosäuren und Vitamine der B-Gruppe auf. Um diese zu nutzen, müsste man jedoch eine Unmenge an melassehaltigem Rohzucker verzehren. Rohzucker kann auch, je nach Art der Herstellung, verunreinigt sein, z. B. durch Schadmetalle, oder noch reichlich Mikroorganismen enthalten, also hygienisch bedenklich sein. Daher wird manchmal spöttisch, doch zutreffend, gesagt, Rohzucker sei nicht gesünder, dafür aber schmutziger. Auch sensorisch gibt es Einschränkungen: Rohzucker aus Rüben hat einen fischigen Geruch. Braune Zucker werden hergestellt, indem Rohzucker noch weiter, aber nicht vollständig gereinigt oder dem Weißzucker nachträglich Zuckercouleur oder Melasse beigemischt wird. Der Gehalt an weiteren Nährstoffen ist bei den braunen Zuckersorten unbedeutend; auch sie enthalten in erster Linie nur Saccharose. Gegenüber dem Weißzucker liegt die Bedeutung brauner Zucker also nur in ihrem dekorativen Wert und im malzig-karameligen Geschmack. aus: Günter Vollmer et al. Lebensmittelführer, Thieme Verlag Stuttgart, S. 230 (1995) Zwei verschieden Darstellungen der Lewisformel Haworth-Formel räumliche Darstellung Vergleichen Sie die beiden Darstellungen Resultat: Die beiden Monosaccharide werden nur durch ein Sauerstoffatom verbunden. Die Haworth-Formel zeigt zwei Ecken zu viel und ist irreführend. Amadeus Bärtsch 15. Mai 2015 Fachdidaktik Chemie ETH Ergänzungsfach: Kohlenhydrate S. 10 Das Disaccharid Saccharose zerfällt häufig in zwei Monosaccharide Aufgaben: 1. Wie verändert sich das Saccharose-Molekül? 2. Formulieren Sie die Reaktion mit Summenformeln. Honig Lektüre für die Schülerinnen und Schüler (John Emsley: Parfum, Portwein, PVC ..., Chemie im Alltag, Wiley-VCH, Weinheim, S. 40, 1997) Ist Honig wirklich die wesentlich gesündere Alternative zu Zucker? Ein genauerer Blick auf die chemische Zusammensetzung belehrt eines Besseren: Honig ist nicht viel mehr als ein Gemisch verschiedener Zucker. Honig begleitet die Menschen seit Beginn der Zivilisation. Man findet Schilderungen von Honigbienen in alten ägyptischen Aufzeichnungen, die aus der Zeit um 3 000 vor Christus stammen. Die sprichwörtliche Süße von Honig wird auch im Alten Testament mehrfach zitiert. Heutzutage werden weltweit mehr als eine Million Tonnen jährlich produziert. Die größten Mengen exportieren Rußland, China, die USA und Mexiko. In einem guten Jahr produziert ein Bienenvolk bis zu 70 Kilogramm Honig. Weltweit sind Billionen von Bienen unterwegs und nutzen die Nektarvorräte von Billiarden von Blüten. Nektar ist im wesentlichen eine wäßrige Zuckerlösung. In der Honigblase der Biene wird der Zucker zum größten Teil in Glucose und Fructose zerlegt. Dieser Abbauprozeß schreitet um so weiter fort, je öfter der reifende Honig im Bienenstock von einer Wabe zur anderen transportiert wird. Außerdem wird dem Honig dabei überschüssiges Wasser entzogen. Im fertigen Honig befinden sich zusammen 70 % Glucose und Fructose (also Monosaccharide), 10 % Saccharose und Maltose (Disaccharide), und die restlichen 20 % sind Wasser. Alle weiteren Bestandteile - auch diejenigen Substanzen, die dem Honig Geschmack verleihen - sind nur in Spuren vorhanden. Als Spurenbestandteile wurden mehr als zwanzig andere Saccharide identifiziert, außerdem Gluconsäure sowie Proteine und Mineralstoffe, allerdings in solch winzigen Mengen, dass Honig vom Standpunkt des Ernährungswissenschaftlers nur als Kohlenhydratlieferant in Frage kommen kann. Dennoch gilt Honig als hochwertige Reformkost. Es werden ihm beinahe magische Kräfte zugeschrieben. In Gegensatz zu reinem Zucker hat Honig einen angenehmen Duft und charakteristischen Geschmack. Dieser wird von über 120 Aromastoffen getragen, wovon bislang etwa 80 eindeutig identifiziert werden konnten. Einige davon stammen von den nektarliefernden Pflanzen. So kann man sortenreinen Lavendelhonig oder Heidehonig leicht an Duft und Geschmack erkennen. Ein Aromastoff dominiert indessen immer und ist für den typischen Honiggeschmack verantwortlich: es handelt sich um Phenylessigsäureethylester. Honig besteht im wesentlichen aus sogenanntem Invertzucker. Man erhält eine Lösung von Invertzucker, wenn normaler Zucker (Saccharose) in einer wässrigen Lösung unter Mithilfe von Amadeus Bärtsch 15. Mai 2015 Fachdidaktik Chemie ETH Ergänzungsfach: Kohlenhydrate S. 11 etwas Säure in Glucose und Fructose zerlegt wird. Fügt man einen Tropfen Phenylessigsäureethylester (und vielleicht ein wenig Farbstoff) hinzu, so könnte ein Laie das Produkt wohl nur mit Mühe von echtem Honig unterscheiden. Alle Zuckerbestandteile des Honigs können mit Hilfe von Hefe zu Alkohol vergoren werden. Das ist im Prinzip das Rezept für Met, der jahrhundertelang das Getränk der Reichen in nördlichen Gefilden war, wo keine Weintrauben wachsen. Noch im letzten Jahrhundert wurde Met in Russland in großem Umfange hergestellt. Heute wird er vielerorts als Spezialität wiederentdeckt. Experiment: Honig aus den wesentlichen Bestandteilen mischen 2 g Saccharose, 7 g Glucose, 7 g Fructose und 4 ml Wasser in einem Becher mischen. Wenig Lebensmittelfarbe und ganz wenig Phenylessigsäureethylester (Fluka 78500–250ML) zugeben. Gut rühren und im Wasserbad erwärmen. Nach dem Mischen und dem Erwärmen degustieren. Es entsteht eine Produkt, das dem Honig gleicht. Zusammensetzung des Honigs gemäss www.roempp.com/prod/ Amadeus Bärtsch 15. Mai 2015 Fachdidaktik Chemie ETH Ergänzungsfach: Kohlenhydrate S. 12 Experiment: Saccharose ist ein Kohlenhydrat Cm(H2O)n Anleitung: Schutzbrille anziehen. In einem Becherglas (250 ml hohe Form) werden 60 g Saccharose mit 28 ml konzentrierter Schwefelsäure vermischt. Der Zucker wird zuerst gelb, dann braun und schliesslich schwarz. Wenn die Mischung dunkel ist, muss das Becherglas in den fahrbaren Abzug gestellt werden. Sie wird immer heisser. Dampf entweicht und eine schwarze Masse wächst aus dem Becherglas. Der Abzug ist nötig, weil es intensiv und unangenehm nach verbrannter Caramel riecht. Entsorgung: Es gibt viel überschüssige Schwefelsäure, die sich in der schwarzen Masse versteckt. Das Gemisch in Wasser einlegen. Die Schwefelsäure neutralisieren. Die schwarze Masse in einem Plastiksack einschliessen und mit dem Kehricht entsorgen. Die neutralisierte Flüssigkeit in die Kanalisation leeren. Auswertung: Konzentrierte Schwefelsäure nimmt Wasser auf und zerstört die SaccharoseMoleküle. Kohlenstoff bleibt zurück. Das Experiment zeigt, dass Saccharose ein Kohlenhydrat ist. Die Summenformel von Saccharose C12H22O11 kann als Cm(H2O)n geschrieben werden. Das entspricht zwar nicht dem Aufbau des Moleküls, zeigt aber, weshalb der Fachbegriff Kohlenhydrat geprägt wurde. Amadeus Bärtsch 15. Mai 2015 Fachdidaktik Chemie ETH Ergänzungsfach: Kohlenhydrate S. 13 Süssstoffe Vorschlag zum Einstieg: Die folgenden Formeln ohne Titel zeigen. Klassengespräch: Was ist diesen Substanzen gemeinsam? Welche Substanzen kennen Sie? Wenn man Glück hat kennen die Schülerinnen die Zucker und können sie benennen. E 952 E 954 E 967 E 950 Amadeus Bärtsch E 951 15. Mai 2015 Ergänzungsfach: Kohlenhydrate S. 14 Fachdidaktik Chemie ETH Die Entdeckung der Süssstoffe: Das Laborgefäss kochte über. Der deutsche Chemiker Constantin Fahlberg wischte die Pfütze auf und kühlte seine verbrühte Hand mit den Lippen. Überrascht spürte er einen intensiv süssen Geschmack. Fahlberg isolierte den Wirkstoff, erprobte seine Unschädlichkeit im Selbstversuch und brachte ihn 1884 als Zuckerersatz unter dem Namen Saccharin auf den Markt. Fast 60 Jahre später legte der amerikanische Pharmakologe Michael Sveda seine Zigarette an der Kante eines Labortischs ab, auf dem er gerade Versuche mit fiebersenkenden Arzneimitteln machte. Das Zigarettenpapier hatte beim nächsten Zug einen merkwürdig süssen Geschmack. Sveda hatte den Süssstoff Cyclamat entdeckt. Chemiker James Schlatter schüttete sich 1965 im Labor versehentlich Tropfen eines Versuchspräparats gegen Magengeschwüre über die Hand. Als er später zum Auflesen eines Papierschnitzels gedankenlos eine Fingerspitze mit der Zunge befeuchtete, schmeckte der Finger zuckersüss. Die Testsubstanz Aspartam besass, wie sich dann herausstellte, die 200 fache Süsskraft von Zucker. Die Entdeckungsgeschichte der Süssstoffe ist eine Geschichte von Zufällen, die einander verblüffend gleichen. Zufälle waren es deshalb immer wieder, weil man Süssstoffe - ebenso wie andere chemische Wirkstoffe und Arzneimittel - bis heute nicht auf dem Reissbrett konstruieren kann: Allein anhand der chemischen Struktur lässt sich die biologische Wirkung nach wie vor nicht zuverlässig vorhersagen. aus: bild der wissenschaft 2/1985, S. 107 Machen Süssigkeiten dick? Stoff Relative Süsskraft Brennwert je 100 Gramm kJ (kcal) Empfohlene Höchstmenge Gramm pro Tag Zucker (Saccharose) 1 1700 (400) 60 Traubenzucker (Glucose) 0.5 1700 (400) 60 Fruchtzucker (Fructose) 1 1700 (400) 30-60 Xylit 1.1 1000 (240) 30-50 Acesulfam E 950 200 0 (0) 0.6 Aspartam E 951 140 1700 (400) 2.8 Cyclamat E 952 35 0 (0) 0.77 Saccharin E 954 450 0 (0) 0.35 Das gibt Ihnen Gelegenheit folgende Fragen zu diskutieren: Welche Süssstoffe eignen sich zum Abnehmen? Welche Süssstoffe machen keine Karies? Welche Süssstoffe können Diabetiker benützen? Amadeus Bärtsch 15. Mai 2015 Ergänzungsfach: Kohlenhydrate S. 15 Fachdidaktik Chemie ETH Wie gefährlich sind künstliche Süssstoffe? Demonstration: Die Tabletten sind so gemacht, dass sie so süssen, wie ein Würfelzucker. Würfelzucker und die Tabletten der Süssstoffe zeigen. Saccharintabletten sind besonders klein; eine Konsequenz der hohen Süsskraft. Wenn man die Tabletten in je 1 dl Wasser auflöst, kann man den unangenehmen Nachgeschmack von Saccharin erleben. Aspartam dagegen schmeckt fast wie Zucker. ADI Acceptable Daily Intake Masse in 1 Tablette Saccharin 5 mg·kg-1·d-1 12,5 mg Cyclamat 11 mg·kg-1·d-1 40 mg Aspartam 40 mg·kg-1·d-1 18 mg erlaubte Zahl Tabletten pro Tag ADI Acceptable Daily Intake: Einheit: mg Substanz pro kg Körpergewicht pro Tag Im Tierversuch wird die Menge ermittelt, die keinerlei Effekt zeigt, wenn die Substanz lebenslänglich eingenommen wird. Der ADI ergibt sich, wenn dieser No-Effect-Level durch den Sicherheitsfaktor 100 geteilt wird. Bei einem Körpergewicht von 70 kg, kann man 28 Tabletten Saccharin, 19 Tabletten Cyclamat und 156 Tabletten Aspartam essen und ist damit 100 Mal unter dem No-Effekt-Level. Amadeus Bärtsch 15. Mai 2015











