Fachdidaktik II / FS2012 Stefan Sandriesser Übung 2 04.03.2012
Werbung

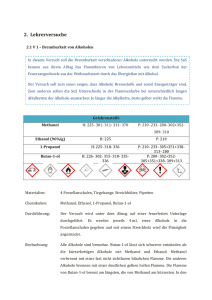
Fachdidaktik II / FS2012 Übung 2 Stefan Sandriesser 04.03.2012 Übung 2: Ausgangsfragen für den Unterricht I. Ethanol & Methanol: der Unterschied zwischen Rausch und Erblinden1 Vorkenntnisse: Lewisformeln, Skelettformeln, Stoffklassen/funktionelle Gruppen (für vertiefte Diskussion der Prozesse: Redox- und Säure-Base-Reaktionen, evt. Funktionsweise von Enzymen, für den zweiten Teil sind Nomenklaturkenntnisse von Vorteil). Beginn der Lektion: Die Summenformeln von Methanol und Ethanol stehen an der Wandtafel. Die SuS werden gefragt, ob sie wissen, um was für Moleküle es sich handelt. Ähnliche Eigenschaften der Stoffe werden diskutiert und an der Wandtafel notiert. Zuletzt erfahren die SuS, dass bereits kleine Mengen Methanol lebensbedrohlich sind, während vergleichsweise hohe Mengen an Ethanol nötig sind, um sich eine Alkoholvergiftung zuzuziehen. Ausgangsfrage: Wie können so ähnliche Moleküle wie Methanol und Ethanol so unterschiedliche Auswirkungen auf den menschlichen Körper haben? Antwort/Erklärung: Das Tafelbild wird im Laufe der Lektion weiter ergänzt. Methanol und Ethanol sind eigentlich für den menschlichen Körper beide ungiftig. Die Produkte, die während dem Abbau entstehen stellen das eigentliche Problem dar. In der ersten Stufe wird der Alkohol im Körper mittels Enzymen zum entsprechenden Aldehyd oxidiert. Im Falle von Ethanol entsteht Acetaldehyd (Falls hier Redox-Reaktionen repetiert werden sollen, kann auch die Art der Reaktion verschwiegen werden. Die SuS werden dann danach gefragt resp. die Oxidationszahlen sollen bestimmt und Änderungen in den Oxidationsstufen identifiziert werden.). Dieses Molekül ist für den sogenannten Kater am nächsten Tag zuständig. Methanol wird in genau derselben Reaktion zu Formaldehyd oxidiert. Dieses Molekül verursacht bereits in geringen Konzentrationen Kopfschmerzen und kann den Sehnerv schädigen, was zu einer Erblindung führt. In grösseren Konzentrationen ist es tödlich. Die Aldehyde werden in einem nächsten Schritt noch einmal mittels Enzyme oxidiert. Dabei entstehen die entsprechenden Carbonsäuren. Acetaldehyd wird hierbei zur Essigsäure oxidiert, welche wenig problematisch ist (vgl. Speiseessig) und ausgeschieden wird. Der Formaldehyd wird hingegen zu bedeutend saureren (ca.10x) und giftigen Ameisensäure 1 Hauptquelle: http://www.chemie-im-alltag.de/articles/0135/index.html Fachdidaktik II / FS2012 Übung 2 Stefan Sandriesser 04.03.2012 abgebaut und ebenfalls ausgeschieden (Hier können Säure-Base-Reaktionen/pKs-Werte repetiert werden). Warum ist das überhaupt ein Problem? Bei der Vergärung von reinem Zucker entsteht nur Ethanol. Bei der Vergärung von heterogener Biomasse entsteht aber eine Vielzahl von Verbindungen, darunter auch Methanol. Aus Kartoffeln gewonnener Alkohol wie zum Beispiel in Wodka hat einen besonders hohen Methanolgehalt. Wir haben zuvor die Siedepunkte der beiden Verbindungen gesehen. Methanol kann ohne weiteres bei der Destillation abgetrennt werden. Aus Gründen der Wirtschaftlichkeit werden aber zum Teil auch die Mischfraktionen illegal verkauft. In der Quelle finden sich detailliertere Informationen zum Ursprung des Methanols in alkoholischen Getränken. Ich verzichte auf weitere Details dazu. Die Behandlungsart für Methanolvergiftungen möchte ich den SuS jedoch keinesfalls vorenthalten: Glücklicherweise oxidiert das entsprechende Enzym im Körper lieber Ethanol zu Acetaldehyd als Methanol zum giftigen Formaldehyd (Affinität ca. 8000:1). D.h. dass Methanol erst umgewandelt wird, wenn bereits das ganze Ethanol abgebaut wurde. Die SuS werden darauf gefragt, ob sie eine Idee haben, wie man eine Methanolvergiftung behandeln könnte (mit dem Hinweis, dass der Körper Methanol langsam ausscheiden kann). Lösung: der menschliche Organismus wird mit Ethanol versorgt bis der gesamte Methanol ausgeschieden wurde (konkret: mehrere Tage auf 1 Promille). Um den SuS zu zeigen, dass es sich bei diesem Thema nicht unbedingt um Spezialwissen handelt, sondern (wie so oft in der Chemie) ein Konzept darstellt, dass weitere interessante Sachverhalte zu beschreiben vermag, finde ich das folgende Beispiel besonders schön: Den SuS werden zunächst folgende Bilder gezeigt: Fachdidaktik II / FS2012 Übung 2 Stefan Sandriesser 04.03.2012 Es handelt sich hierbei um ein Kinderspielzeug, den sogenannten Bindeez. Im Wesentlichen handelt es sich um Kügelchen, die durch Zugabe von Wasser aneinander kleben. Man ordnet sie in der Form an, besprüht sie mit Wasser, lässt das Ganze über Nacht trocknen und am nächsten Tag hat man die entsprechende Form/das entsprechende Bild. In Australien wurden Bindeez zum Spielzeug des Jahres 2007 gekürt. Ein solches Produkt ist natürlich heikel, da die kleinen Teile von Kindern schnell verschluckt werden können. Umso wichtiger, dass das Zeug nicht giftig ist. So wurde es auch designt: unter anderem enthielt das Spielzeug den unbedenklichen Weichmacher 1,5-Pentandiol. Mit Beteiligung der SuS wird der Abbau an der Wandtafel erarbeitet (nur eine OH-Gruppe ist involviert). Die entstehende Carbonsäure ist für den Organismus kein Problem und wird ausgeschieden. Soweit, so gut. Jetzt kommen aber wirtschaftliche Aspekte ins Spiel. Was macht man um ein Produkt billiger herzustellen? Erstens lässt man es in China produzieren, zweitens sucht man billigere Inhaltsstoffe. So fand man heraus, dass 1,4-Butandiol zu dieser Zeit 3-7 mal billiger war als 1,5-Pentandiol. Man nahm an, dass diese ähnlichen Moleküle auch ähnliche Eigenschaften haben. Analog zu 1,5-Pentandiol wird der Abbau im Körper mit den SuS hergeleitet. Die Endverbindung 4-Hydroxybutansäure wird mit den SuS genau angeschaut. Da organische Chemiker ein Faible für griechische Buchstaben haben, gibt es noch eine andere Nomenklatur, bei der die Kohlenstoffatome neben der Carbonsäuregruppe abgezählt werden (natürlich nur als Randbemerkung, das müssen die SuS sicher nicht lernen). Somit wird aus 4-Hydroxybutansäure Gamma-HydroxyButansäure (zunächst werden die SuS gefragt, ob ihnen das Molekül etwas sagt, danach werden die Buchstaben unterstrichen, nun werden sicher ein paar damit etwas anfangen können). Abschliessend wird der Spiegelartikel "Experten finden Vergewaltigungsdroge in China-Spielzeug"2 ausgeteilt/auf Folie gezeigt. Man könnte natürlich auch mit dem Zeitungsartikel starten. Ich finde es aber dramaturgisch schöner, wenn die SuS nicht von Beginn an wissen, dass es sich um GHB handelt. Die SuS lesen den Artikel zur Vertiefung. "Hätten die Verantwortlichen jemanden von Ihnen gefragt und das Szenario durchspielen lassen, wäre die verheerende Wirkung mit Sicherheit im Vornherein entdeckt worden." 2 http://www.spiegel.de/wirtschaft/0,1518,516193,00.html Fachdidaktik II / FS2012 Übung 2 Stefan Sandriesser 04.03.2012 Platzierung im Unterricht: - nach der Einführung von Stoffklassen um die unterschiedlichen Eigenschaften verschiedener funktioneller Gruppen zu unterstreichen. - zur Repetition mehrerer Konzepte (nach Redox- und Säure-Base-Reaktionen) Wandtafelbilder: Fachdidaktik II / FS2012 Übung 2 Stefan Sandriesser 04.03.2012 Fachdidaktik II / FS2012 Übung 2 Stefan Sandriesser 04.03.2012 II. Der Cola-Mentos Geysir3 Vorkenntnisse: Eigenschaften der Kohlensäure Fragen: Wie kommt es zu der heftigen Reaktion von Mentos mit Cola? Antwort/Erklärung: Den SuS wird ein Video4 zu der beschriebenen Reaktion gezeigt. Jeder kennt die Reaktion, bei der Mentos Bonbons in Coca Cola light eingetaucht werden, worauf eine imposante Fontäne aus der Flasche schiesst. Was verbirgt sich dahinter? Hierzu kursieren ominöse Gerüchte. Eines davon wird an der Tafel aufgezeichnet: Das sieht extrem kompliziert aus und die kryptische Substanz Ta9V4 gibt es gar nicht. Es gibt auch keinen Prof. Alexander Mergenthaler. In Wirklichkeit ist die Reaktion viel simpler. Einem Schüler wird ein Mentos Bonbon (Mint, rauh) in die Hand gedrückt. Er soll es beschreiben. Sollte er nicht auf die rauhe Oberfläche zu sprechen kommen, wird ein ihm ein anderes, glattes Mentos zusätzlich gegeben. Wenn die Oberflächenbeschaffenheit geklärt ist, werden die Bonbons weitergegeben und zirkulieren in der Klasse. In der Zwischenzeit wirft die Lehrperson ein glattes Mentos in eine Cola-light Flasche. Es passiert nichts. Die Oberfläche scheint eine entscheidende Rolle zu spielen. Der Grund wird an der Wandtafel entwickelt: 3 4 Hauptquelle: http://www.chemie-im-alltag.de/articles/0097/index.html http://www.youtube.com/watch?v=Wa8iqWOaye0 Fachdidaktik II / FS2012 Übung 2 Stefan Sandriesser 04.03.2012 Gelöstes CO2 in kohlesäurehaltigen Getränken kann sich in den Poren der Mentosoberfläche ansammeln. Der Ausstoss einer konzentrierten Menge vieler Gasmoleküle führt zur beobachteten Heftigkeit der Reaktion. Coca Cola light eignet sich besonders gut, da es mehr Kohlensäure beinhaltet als die zuckerhaltigen Produkte. Fairerweise muss darauf hingewiesen werden, dass es sich hierbei NICHT um eine chemische Reaktion handelt, da keine chemischen Bindungen gebrochen/ausgebildet werden. Es ist ein einfacher, rein physikalischer Prozess. Das richtige Experiment mit dem rauhen Mentos kann im Freien durchgeführt werden. Den SuS werden folgende Punkte deutlich gemacht: - Es muss nicht immer kompliziert sein! Das Ganze ist noch nicht einmal chemischer Natur. (Bis auf den Zerfall der Kohlensäure) - Auch solche Sachverhalte werden erforscht. So gibt es dazu einen Fachartikel im American Journal of Physics.5 Naturwissenschaftliche Forschung kann also durchaus Spass machen! Platzierung im Unterricht: 5 - bei der Diskussion der Kohlesäure im Säure Base Kapitel - bei der Diskussion der Kohlesäure im Zusammenhang mit Kalk http://ajp.aapt.org/resource/1/ajpias/v76/i6/p551_s1?isAuthorized=no Fachdidaktik II / FS2012 Übung 2 Stefan Sandriesser 04.03.2012 III. Koks in der Cola6 Vorkenntnisse: Trennverfahren: Extraktion, Einführung zu Analytischen Methoden Frage: Enthält Cola Kokain? Antwort/Erklärung: Die erste Coca-Cola wurde 1886 auf den Markt gebracht. Unter anderem wurden für den typischen Geschmack unter anderem Extrakte aus den Blättern der Cocapflanze zugesetzt. Diese Blätter enthalten tatsächlich Kokain. Ob das Getränk zu dieser Zeit hohe Mengen an Kokain beinhaltet hat, ist also möglich aber nicht vollständig geklärt. Heutzutage werden nur noch entkokainierte Extrakte verwendet. Dabei wir in einem ersten Schritt gezielt das Kokain aus den Blättern extrahiert. Erst danach gelangen die Blätter zur Extraktion weiterer Stoffe in die Cola Produktion. Das Problem ist, dass keine Extraktion 100% aller Spuren eines Stoffes entfernen kann. Mit zunehmender technischer Entwicklung werden Analyse-Geräte immer leistungsfähiger und erlauben die Detektion immer kleinerer Mengen. Es ist z.B. möglich das Morphium in Mohnsamen zu detektieren. Tatsächlich hat man im Red Bull Cola Spuren von Kokain gefunden, allerdings sehr wenig, nämlich 0.4 Mikrogramm pro Liter. Die Menge, die üblicherweise illegal geschnupft wird liegt bei 20-30 Milligramm. Anders gesagt, müsste man 50'000 Liter Red Bull Cola trinken, um dies zu erreichen. Heutige Analyse-Methoden würden sogar Kokain an unseren Händen detektieren können: Gemäss einer Studie, lassen sich in Deutschland an 90% der im Umlauf befindlichen Euroscheine Kokainspuren finden. Mit den SuS kann anschliessend unter anderem über folgende Punkte diskutiert werden: - Politiker fordern Nulltoleranz von solchen Stoffen in Getränken. Ist das realistisch? Ist das sinnvoll? (In Rom lässt sich Kokain in der Luft nachweisen! Zwar 1000 mal weniger als in Red Bull Cola aber dafür atmet man auch die ganze Zeit.) - Red Bull Cola wirbt damit, 'natürliches Cola ganz ohne Chemie' herzustellen. Welche Probleme ergeben sich daraus? (Grund für erhöhten Kokaingehalt, da weniger Kontrolle der Verfahren? Grund dafür, dass scheinbar jede Dose andere Konzentrationen der Inhaltsstoffe (v.a. Koffein!) enthält? 6 Hauptquelle: http://www.chemie-im-alltag.de/articles/0139/index.html Fachdidaktik II / FS2012 Übung 2 Platzierung im Unterricht: - bei der Diskussion analytischer Verfahren und deren Genauigkeit - beim Thema Drogen Stefan Sandriesser 04.03.2012