Protokoll ()
Werbung

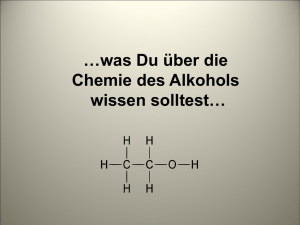
Philipps-Universität Marburg Fachbereich Chemie (FB 15) Wintersemester 06/07 Seminar: Übungen im Experimentalvortag Leitung: M. Bröring, U. Koert, B. Neumüller, P. Reiß Alkohole Gehalten am 20.12.2006 Hinweis: Dieses Protokoll stammt von der Seite www.chids.de (Chemie in der Schule). Dort können unterschiedliche Materialien für den Schulunterricht heruntergeladen werden, unter anderem hunderte von Experimentalvorträgen so wie der vorliegende: http://www.chids.de/veranstaltungen/uebungen_experimentalvortrag.html Vorgelegt von: Volker Wenke Wehrdaer Weg 14 35037 Marburg 0 Inhaltsverzeichnis 1. Struktur und Eigenschaften…………………………….…………..... S. 2 2. Herstellung …………………………………………………………..... S. 5 2.1. Fermentation………………………………………………… S. 5 2.1.1. Batch-Fermentation………………………………..…… S. 5 2.1.2. Kontinuierliche Fermentation……………………...…… S. 5 2.1.3. Fließbett-Fermentation…………………………...…….. S. 6 2.2. Methanolgewinnung aus Synthesegas……………………. S. 6 2.3. Oxosynthese mit Alkenen…………………………….…….. S. 6 2.4. Elektrophile Addition von Wasser……………………..…… S. 6 3. Reaktionen …………………………………………………………….. S. 7 3.1. Vom Alkohol zum Alkan……………………………………...S. 7 3.2. Vom Alkohol zum Ester………………………………………S. 7 3.3. Vom Alkohol zum Halogenalkan…………………………… S. 8 3.4. Vom Alkohol zum Ether oder Alken………………………... S. 9 3.5. Oxidationsprodukte der Alkohole ………………………….. S. 9 4. Verwendung…………………………………………………………… S. 10 4.1. Genussmittel…………………………………………………. S. 10 4.2. Kraftstoff………………………………………………………. S. 10 4.3. Alkohole in der Insustrie…………………………………….. S. 11 4.4. Mehrwertige Alkohole………………………………………. S. 11 5. Schulrelevanz…………………………………………………………. S. 12 6. Quellenangaben………………………………………………………. S. 13 7. Protokolle Versuch 1: Strukturaufklärung von Methanol…………..…. S. 14 Demo1: Hydrophilie und Volumenkontraktion……………. S. 16 Versuch 2: Herstellung eines Schaumweins……………… S. 18 Versuch 3: Veresterung……………………………………... S. 21 Versuch 4: Chlorierung von tert-Butanol………………….. S. 23 Versuch 5: Oxidation verschiedener Alkohole……………. S. 25 Versuch 6: Oxidation von Methanol……………………….. S. 30 1 1. Struktur und Eigenschaften Das Wort Alkohole, was der ältere Name der Alkanole ist, kennen die meisten Menschen im Zusammenhang mit Getränken wie zum Beispiel Bier oder Wein. In diesen ist Ethanol enthalten. Wie aber sieht das Molekül von Ethanol aus? Eine der wichtigsten Methoden der Untersuchung organischer Verbindungen ist die Strukturaufklärung. Geschieht dies heute mit Hilfe modernster Spektroskopiemethoden, so hat Justus von Liebig zu seiner Zeit die quantitative Elementaranalyse entwickelt, mit der man den Aufbau eines Ethanolmoleküls ermitteln kann. Durch vollständige Verbrennung organischer Substanzen entstehen Kohlenstoffdioxid und Wasser, so auch beim Ethanol. Kohlenstoff und Wasserstoff sind also im Ethanol enthalten. Zudem werden erwärmte Magnesiumspäne beim Überleiten von Ethanoldämpfen zu MgO oxidiert, es müssen sich im Ethanol also auch Sauerstoffatome befinden. Nun kann man die Masse an entstehendem CO2, H2O und MgO bestimmen und auf das Verhältnis zurückrechnen, wie sie im Ethanolmolekül vorkommen müssen. Man erhält ein Verhältnis Kohlenstoff zu Wasserstoff zu Sauerstoff von 2:6:1. Eine Molmassenbestimmung führt zu dem Ergebnis, dass ein Ethanolmolekül ein Gewicht von 46 u besitzt, die Verhältnisformel C2H6O also auch gleichzeitig die Strukturformel ist. Als nächstes ist zu klären, wie diese 9 Atome denn miteinander verknüpft sind. Berücksichtigt man die Vierbindigkeit von Kohlenstoff, die Zweibindigkeit von Sauerstoff und die Einbindigkeit von Wasserstoff, so ergeben sich zwei mögliche Varianten: Mögliche Strukturformeln von C2H6O Im rechten Molekül hat ein Wasserstoff durch seine Bindung zu dem Sauerstoff eine Sonderstellung. Elementares Natrium wird unter Paraffinöl aufbewahrt, welches aus Kohlenwasserstoffen besteht und somit viele C-H-Bindungen 2 aufweist. Diese werden vom Natrium nicht angegriffen. Das Metall löst sich allerdings in Ethanol auf und es entsteht elementares Wasserstoffgas, welches durch die Knallgasprobe nachgewiesen werden kann (► Versuch 1). Die logische Erklärung dafür ist, dass Natrium die O-H-Bindung trennen kann und Wasserstoffgas frei gesetzt wird, die linke Struktur muss also die richtige sein. Auch alle anderen Alkanole weisen diese O-H-Bindung auf. Diesen Teil des Moleküls nennt man Hydroxylgruppe. Auf keinen Fall darf man diese Gruppe mit dem Hydroxid-Ion (OH-) verwechseln! Die Hydroxylgruppe ist der einzige Unterschied zwischen den Molekülen der Alkane und der Alkanole und ist somit für die speziellen Eigenschaften verantwortlich. Die Hydroxylgruppe ist stark polar und befähigt Alkanole Wasserstoffbrückenbindungen auszubilden. Daher haben Alkanole eine höhere Viskosität und höhere Siedetemperaturen als Alkane. Die ersten drei Alkohole der homologen Reihe sind in jedem Verhältnis mit Wasser mischbar, mit größerer Kohlenstoffkette nimmt aber der polare Charakter des Moleküls und daher auch die Wasserlöslichkeit ab. Name Summenformel Smp [°C] Sdp [°C] Wasserlöslichkeit Methanol CH3OH -98 (-183) 65 (-161) unbegrenzt Ethanol C2H5OH -115 (-172) 78 (-89) unbegrenzt 1-Propanol C3H7OH -127 (-187) 97 (-42) unbegrenzt 2-Propanol C3H7OH 1-Butanol C4H9OH tert-Butanol C4H9OH 1-Pentanol C5H11OH -78 (-130) 138 (+36) 2,4 cg/g 1-Hexanol C6H13OH -52 (-95) 157 (69) 0,7 cg/g -89 -90 (-138) +26 82 117 (0) 82 unbegrenzt 7,9 cg/g unbegrenzt Eigenschaften einiger Alkohole [2] Je länger ein hydrophober Rest im Alkohol wird, desto mehr Wasserteilchen befinden sich in der Lösung in der Nähe. All diese Wassermoleküle können in eine Richtung keine Wasserstoffbrücken ausbilden, wodurch das System an Energie verliert. Aus diesem Grund ordnen sich die Moleküle der langkettigeren Alkohole so an, dass alle hydrophilen und alle hydrophoben Teile nebeneinander liegen, es kommt also zur Entmischung. 3 Die Wasserstoffbrücken sorgen des Weiteren dafür, dass sich Wasser- und Ethanolmoleküle in einem Gemisch stärker anziehen, als sie es in den reinen Flüssigkeiten tun. Aus diesem Grund kann man den Effekt der Volumenkontraktion beobachten (► Demo 1). Isomerien der Alkohole: In der Tabelle 1 stehen Werte für 2-Propanol und tert-Butanol. Diese Substanzen sind sogenannte Isomere. Am Beispiel Propanol bedeutet das, dass es verschiedene Stellen der Kohlenstoffkette gibt, an die die Hydroxylgruppe gebunden sein kann. 1-Propanol 2-Propanol tert-Butanol 1-Propanol ist ein primärer, 2-Propanol ein sekundärer und tert-Butanol ein tertiärer Alkohol. Primär bedeutet, dass an dem Kohlenstoffatom an der Hydroxylgruppe nur noch eine Bindung zu einem weiteren Kohlenstoffatom besteht. Beim 2-Propanol hat das entsprechende Kohlenstoffatom zwei Bindungen zu anderen Kohlenstoffatomen, beim tert-Butanol drei. Mehrwertige Alkohole: Es gibt Alkohole, die mehr als nur eine Hydroxylgruppe besitzen, zum Beispiel Glycol (1,2-Ethandiol) und Glycerin (1,2,3-Propantriol). Glycol Glycerin Diese beiden Alkohole sind mit Wasser in jeden Verhältnis mischbar und haben wegen des Geschmacks den Namen vom griechischen Wort „glycos“ (dt.: süß). 4 2. Herstellung 2.1. Fermentation (alkoholische Gärung) Ethanol kann durch die alkoholische Gärung gewonnen werden. Dabei wird mit Hilfe von Bioorganismen aus Hefe Zucker (z.B. D-Glucose) in Ethanol umgewandelt. Die Kurzfassung der Reaktionsgleichung lautet C6H12O6(aq) Hef e 2 C2H5OH(aq) 2 CO2(g) Dieser Vorgang muss anaerob verlaufen, da sonst CO2 und Wasser entstehen. C6H12O6(aq) 6 O2(g) Hef e 6 H2O(l) 6 CO2(g) Heutzutage werden drei verschiedene Verfahren der Fermentation angewendet: 2.1.1. Batch-Fermentation [5]: Bei der Batch-Fermentation wird das zuckerhaltige Substrat und die Hefe in einen Behälter gegeben und unter Rühren die Gärung in Gang gebracht. Auch das entstehende Ethanol befindet sich in dem Reaktionsgefäß, was ab einem Alkoholgehalt von etwa 18% die Hefezellen daran hindert, weiteren Zucker zu vergären. Dann müssen Edukte und Produkte in aufwändigen Verfahren voneinander getrennt werden. Skizze eines Reaktors der Batch-Fermentation 2.1.2. Kontinuierliche Fermentation [5]: Das Problem der Hefehemmung kann durch die kontinuierliche Fermentation beseitigt werden. Hierbei befindet sich die Hefe im Reaktionsgefäß, während das zuckerhaltige Substrat eingeleitet wird. Sehr teure Spezialmembranen sorgen dafür, dass auf der einen Seite nur das Substrat hineingelangen, sowie auf der anderen Seite die alkoholhaltige Produktmischung abgeleitet werden kann. Reaktor der kontinuierlichen Fermentation 5 2.1.3. Fließbett-Fermentation [5]: Um die eingesetzte Hefe effizient nutzen zu können wird sie in den neueren Verfahren auf einem Fließbett immobilisiert und die zuckerhaltige Substratlösung von unten nach oben durch das Gefäß geleitet. Dadurch entfallen teure Membranen und aufwändige Trennverfahren. Immobilisiert wird die Hefe durch Einschließen in Alginate (► Versuch 2). Fließbett-Reaktor 2.2. Methanolgewinnung als Synthesegas [6] Mit hohem Druck, hoher Temperatur und Metalloxid-Katalysatoren kann Methanol aus Synthesegas hergestellt werden. 2 0 1 - 2 1 T, [ZnO / Cr2O3 ] 2 H2(g) CO(g) p, H3COH (g) 2.3. Oxosynthese mit Alkenen [6] Mittels Cobalt als Katalysator kann ein Alken mit Synthesegas zu einem Aldehyd reagieren. Diese Substanz kann man anschließend im Wasserstoffstrom zum Alkohol reduzieren. 2 0 2 C2H4(g) H2(g) CO (g) [Co] -3 1 2 / 180 C CH3CH2CHO (g) H 1 -2 CH3CH2CHO 0 CH3CH2CH2OH(g) 2.4. Elektrophile Addition von Wasser [6] Bei der elektrophilen Addition von Wasser an Doppelbindungen benötigt man eine Säure als Katalysator. Durch die Protonierung bildet sich ein Carbeniumion, an das ein Hydroxidion nucleophil angreifen kann. Es bildet sich meist der höher substituierte Alkohol, da das Carbeniumion der Zwischenstufe dann durch Hyperkonjugation besser stabilisiert werden kann. 6 3. Reaktionen Anhand der folgenden Skizze kann man erkennen, dass die Reaktionen der Alkohole sehr vielfältig sind. Fast alle der schulrelevanten Stoffklassen können aus Alkoholen synthetisiert werden. Natürlich können auch aus den meisten Stoffklassen Alkohole hergestellt werden. 3.1. Vom Alkohol zum Alkan [7] Um Alkohole zu Alkanen zu reduzieren gibt es verschiedene Möglichkeiten. Die in der Industrie wichtigste Methode ist ein zweistufiger Prozess. Zunächst wird der Alkohol durch eine säurekatalysierte Eliminierung zu einem Alken umgesetzt. Anschließend hydriert man mittels Schwermetallkatalysatoren (z.B. Nickel) das Alken zum Alkan. 3.2. Vom Alkohol zum Ester [4,6] Alkanole reagieren mit Säuren zu Estern. Auch Säurehalogenide oder Säureanhydride können verwendet werden. Als Nebenprodukt entsteht Wasser oder ein Halogenwasserstoff, es handelt sich bei der Veresterung also um eine Kondensationsreaktion. Entgegengesetzt verläuft die Esterspaltung oder Esterhydrolyse. Diese beiden Reaktionen befinden sich in einem Gleichgewicht, auf das man durch geeignete Zutaten Einfluss nehmen kann. Will man bei der Esterherstellung eine gute Ausbeute erzielen, müssen die Produkte entfernt 7 und somit das Gleichgewicht nach rechts verschoben werden. Entweder man destilliert den Ester ab oder man gibt wasserentziehende Substanzen hinzu. Eine vollständige Hydrolyse kann durch Kochen mit Natronlauge erreicht werden, weil dabei die Säure aus dem Gleichgewicht entfernen wird. Bei der Reaktion wird zunächst der Carbonyl-Sauerstoff protoniert. Das entstehende Carbo-Kation kann nun von einem freien Elektronenpaar des Alkohols nucleophil angegriffen werden. Anschließend wird das Proton des Alkohols abgespalten und verlässt zusammen mit einer Hydroxylgruppe als Wasser das Molekül. Es bildet sich ein Carbo-Kation, das nach einer weiteren Abspaltung eines Protons wieder zu einem Carboxyl-Kohlenstoff wird (► Versuch 3). 3.3. Vom Alkohol zum Halogenalkan [4,6] Mittels einer Halo-Dehydroxylierung kann man aus einem Alkohol ein Halogenalkan gewinnen. Die Hydroxylgruppe des Alkohols wird protoniert und ein Wassermolekül abgespalten. Ein planares Carbo-Kation bildet die Zwischenstufe, die nun von einem Halogenidion nucleophil angegriffen wird. Es entsteht ein Alkylhalogenid. Im Falle der Reaktion von tert-Butanol und Salzsäure entsteht tert-Butylchlorid (► Versuch 4). 8 3.4. Vom Alkohol zum Alken oder Ether [4,6] Wird ein Alkohol protoniert, so spaltet sich Wasser ab und es entsteht ein planares Carbo-Kation. Nun gibt es zwei Möglichkeiten für eine weitere Reaktion: 1. Ein weiteres Alkoholmolekül greift als Nucleophil am Kation an. In diesem Fall wird das Proton der Hydroxylgruppe des angreifenden Alkohols abgespalten und es entsteht ein Ether. 2. Auch eine Eliminierung kann erfolgen. In diesem Fall würde in β-Stellung ein Proton abgespalten werden und sich eine π–Bindung ausbilden. Da die Aktivierungsenergie für die Eliminierung höher ist als die für die Etherbildung, benötigt man Energie in Form von Wärme, um die Eliminierung zu bevorzugen. Man gelangt so zum thermodynamisch stabileren Produkt. Konkurrenzreaktionen: Eliminierung vs. Etherbildung (SN1) 3.5. Oxidationsprodukte der Alkohole [3, 4] Bei der Oxidation muss man primäre, sekundäre und tertiäre Alkohole unterscheiden, denn alle führen zu unterschiedlichen Produkten (► Versuch 5). Primäre Alkohole können zu Aldehyden (► Versuch 6) und dann weiter zu Carbonsäuren reagieren. Sekundäre Alkohole können dagegen nur bis zur Carbonylverbindung, dem Keton, reagieren. Tertiäre Alkohole reagieren nicht nach diesem Mechanismus und können nicht ohne Zersetzung oxidiert werden. Die Tabelle auf der nächsten Seite gibt einen Überblick über die möglichen Oxidationen der Alkohole. 9 primärer Alkohol Alkanal / Aldehyd sekundärer Alkohol Carbonsäure Kein Produkt Alkanon / Keton tertiärer Alkohol Kein Produkt Kein Produkt Oxidationsprodukte der verschiedenen Alkohole [3, 4] Natürlich können alle Alkohole genau wie alle anderen Kohlenwasserstoffe durch eine vollständige Oxidation zu Kohlendioxid und Wasser oxidiert werden. 4. Verwendung 4.1. Genussmittel [5] Alkohole finden auf viele verschiedene Arten und Weisen Verwendung. Die bekannteste Form von Alkoholen sind sicherlich alkoholische Getränke. Bier und Wein werden zum Beispiel durch alkoholische Gärung hergestellt. Da man wie in 2.1.1. erwähnt auf diese Art nur einen Alkoholgehalt von etwa 18% erhält, muss man die Produkte destillieren („brennen“), um höhere Alkoholanteile zu erhalten. Durch diese Methode werden z.B. Korn, Rum und Whisky hergestellt. 4.2. Kraftstoff [8] Reines Ethanol kann als Kraftstoff verwendet werden. Neben den Vorteilen einer hohen Oktanzahl (110), erhöhter Motorleistung und einer guten Umwelt10 verträglichkeit hat es jedoch die Nachteile eines hohen Verbrauchs und schlechter Kaltstarteigenschaften. Aus diesem Grund benutzt man eine Mischung aus 15% „Super“ und 85% Ethanol. Dieses Kraftstoffgemisch ist unter dem Namen „E 85“ auf dem Markt. Es wird gelobt als umweltfreundlicher Kraftstoff für die Zukunft, jedoch hat es auch Nachteile, die nicht verschwiegen werden dürfen. Da in Zukunft also verstärkt Zuckerrohr, Zuckerrüben und Mais für Kraftstoffe statt für Lebensmittel angebaut werden, ist es wahrscheinlich, dass die Lebensmittelpreise steigen werden. Auch ist es nicht ausgeschlossen, dass dieser Mangel an Anbauflächen zu verstärkter Abholzung des Regenwaldes führt. 4.3. Alkohole in der Industrie [2, 3, 4] Alkohole werden in der Industrie häufig als Lösemittel verwendet. Ob in chemischen Synthesen, in Medikamenten oder in Duftstoffen, die Palette der Produkte ist vielfältig. Besonders beliebt sind dabei Ethanol oder Ether, da diese sich durch ihre hohen Dampfdrücke relativ schnell verflüchtigen. Aber auch als Edukte in Synthesen kommen Alkohole zum Einsatz. Beispiele dafür sind die Herstellung von Formaldehyd, Essigsäure oder Aceton. Auch Ester spielen eine große Rolle und können mit Alkoholen gewonnen werden. 4.4. Mehrwertige Alkohole [3, 4] Glykol wird als Frostschutz- und Korrosionsschutzmittel verwendet. Glycerin, das auch als Frostschutzmittel eingesetzt wird, hat noch sehr viele weitere Anwendungsmöglichkeiten. Kunststoffe, Harze, Schmiermittel, Feuchthaltemittel in Kosmetika, Sprengstoffe (Nitroglyzerin) sind nur einige. Die Natur verwendet Glycerin als Grundbaustein für Fette. Glucitol (Sorbitol, C6H14O6) dient als Zuckerersatzstoff in Süßigkeiten, sowie als Komponente in Nährböden in der Medizin. 11 5. Schulrelevanz Im hessischen Lehrplan (G8) werden die Alkanole als Thema in der Klasse 10 bei der Einführung der Kohlenstoffchemie als Alternative zu den Halogenalkanen vorgeschlagen. Ausführlich sollten sie dann in Klasse 11 besprochen werden. Geklärt soll dabei zunächst die Struktur der Alkanole, insbesondere des Ethanols (V1). Anschließend wird auf die Eigenschaften eingegangen, die durch die Hydroxylgruppe hervorgerufen werden (D1). Besonderheiten wie Isomerien oder die Unterscheidung in primären, sekundären und tertiären Alkanolen sollen aufgezeigt werden. Auch die Herstellung von Alkanolen soll besprochen werden, speziell die alkoholische Gärung (V2). Anschließend kann auf die Reaktionen eingegangen werden, z.B. die Veresterung (V3), die nucleophile Substitution (V4) oder die verschiedenen Oxidationen (V5, V6). Die Verwendung der Alkohole sollte auch nicht zu kurz kommen. Auch die mehrwertigen Alkohole wie Glycol und Glycerin sollten besprochen werden. Bei der Behandlung der alkoholischen Getränke sollten natürlich auch gesellschaftliche und gesundheitliche Aspekte angesprochen werden. 12 6. Quellenangaben 1. Becker, Heinz G.O. et al.: Organikum. Wiley-VCH-Verlag; 21. Auflage, 2004 2. Mortimer, Charles E.: Chemie – Das Basiswissen der Chemie. Georg Thieme Verlag, Stuttgart 2001 3. Botsch, W., Höfling, E., Mauch J.: Chemie in Versuch, Theorie und Übung. Moritz Diesterweg Verlag, Franfurt a.M. 1984 4. Vollhardt, K.P.C., Shore, N.E.: Organische Chemie. Wiley-VCH Verlag GmbH, 3. Auflage, Weinheim 200 5. Marburger, Anke: Immobilisierte Hefezellen. In: Praxis der Naturwissenschaften; Chemie in der Schule. Jahrgang 52 2003, Heft 6, Seiten 6 ff 6. Mitschrift der Vorlesung „Organische Chemie 2“ Prof. Dr. Hilt. Philipps Universität Marburg, WS 04/05 7. Brückner, Reinhard: Reaktionsmechanismen. Springer-Verlag Berlin Heidelberg 2007, 3. Auflage. 8. http://www.ethanol-statt-benzin.de/mid370_E85.html (17.12.07) 13 Versuch 1: Strukturaufklärung von Ethanol Geräte Reagenzgläser, 1x Normalgröße, 1x Miniaturglas, durchbohrter Stopfen, Glasrohr, Stativmaterial, Messer, Tiegelzange, Toilettenpapier Chemikalien: Ethanol (ca. 5 ml), Natrium Sicherheitshinweise: Ethanol: F. leichtentzündlich R11: leichtentzündlich S7: Behälter geschlossen halten S16: von Zündquellen fernhalten, nicht rauchen. Natrium: F: leichtentzündlich C: ätzend R15: Reagiert mit Wasser unter Bildung hochentzündlicher Gase R34: verursacht Verätzungen Durchführung: Ein normales Reagenzglas mit Ethanol wird mit dem Stativmaterial fixiert. Anschließend entfernt man von einem etwa erbsengroßen Stück Natrium mit dem Messer die Oxidschicht und gibt es in den Alkohol. Man verschließt das Reagenzglas mit dem Stopfen und Glasrohr und fängt mit dem kleinen Reagenzglas das entweichende Gas auf. Durch die KnallgasProbe überprüft man, ob es sich dabei um Wasserstoff handelt. Beobachtung: Gibt man das elementare Natrium in den Alkohol, so setzt Blasenbildung ein und das Metall löst sich auf. Hat mein kurze Zeit gewartet kann man das aufgefangene Gas mit einem Pfeiffton verbrennen, die Knallgasprobe ist also positiv. Entsorgung: Die neutralisierte Lösung kann im Behälter für organische Lösemittelabfälle entsorgt werden. 14 Auswertung: Natrium reagiert mit Alkoholen unter Bildung von elementarem Diwasserstoff und Natriumalkoholat. 1 0 2 C2H5 OH(l) 2 Na (s) 2 C2H5 O (aq) 1 2 Na (aq) 0 H2(g) Da Alkoholate starke Basen sind, erhöht sich bei dieser Redoxreaktion der pH-Wert sehr stark. Das Natrium wird dabei oxidiert und die Kationen solvatisiert, es löst sich also in der Flüssigkeit auf. Hat man eine ausreichende Menge von dem Diwasserstoffgas aufgefangen, so kann man durch Anzünden die Knallgasprobe durchführen. Ein pfeiffender Ton ertönt, falls es sich um H 2 handelt, das mit dem Luftsauerstoff zu Wasser reagiert. 0 0 1 -2 Δ 2 H2(g) O2(g) 2 H2O (g) Der Versuch dient der Strukturaufklärung von Ethanol, bei dem man zwischen folgenden beiden Isomeren zu entscheiden hat: Elementares Natrium wird unter Paraffinöl aufbewahrt, das aus Kohlenwasserstoffen besteht und somit viele C-HBindungen aufweist. Diese werden vom Natrium nicht angegriffen. Das Metall löst sich aber in Ethanol auf und es entsteht elementares Wasserstoffgas. Die einzige Erklärung dafür muss sein, dass Natrium die O-H-Bindung trennen kann und so Wasserstoffgas bildet. Die linke Struktur ist also richtig. 15 Demo 1: Hydrophilie und Volumenkontraktion Geräte 2 Messzylinder (100 ml), 2 Bechergläser gleicher Größe Chemikalien: Ethanol, Oktanol, Sudanrot, Wasser Sicherheitshinweise: Ethanol: F. leichtentzündlich R11: leichtentzündlich S7: Behälter geschlossen halten S16: von Zündquellen fernhalten, nicht rauchen. Oktanol: Xi: reizend R36: reizt die Augen S26: bei Berührung mit den Augen sofort gründlich mit Wasser abspülen und Arzt konsultieren Sudanrot: Xn: gesundheitsschädlich R40: Verdacht auf krebserzeugende Wirkung R43: Sensibilisierung durch Hautkontakt möglich R53: kann in Gewässern längerfristig schädliche Wirkung haben S22: Staub nicht einatmen. S24/25: Berührung mit den Augen und der Haut vermeiden Durchführung: Mit dem Sudanrot färbt man je 50 ml der beiden organischen Flüssigkeiten und gibt sie jeweils in einen der Standzylinder, in denen man vorher 50 ml Wasser vorgelegt hat. Beobachtung: Das rot gefärbte Ethanol vermischt sich mit dem Wasser und es entsteht eine homogene, rötliche Lösung. Das Volumen beträgt etwa 98 ml. Das Oktanol entmischt sich nach kurzer Zeit wieder vom Wasser. Es entsteht ein Zweiphasensystem, in dem die organische Phase rot, die wässrige Phase farblos ist. Das Volumen beträgt 100 ml. Entsorgung: Nach Neutralisierung können die Flüssigkeiten in die organische Lösemittelabfälle gegeben werden. 16 Auswertung: Sudanrot ist ein Azo-Farbstoff, der zwar eine Hydroxylgruppe besitzt, aber sich trotzdem wegen seines überwiegend unpolaren Moleküls nur mit den organischen Flüssigkeiten vermischt und diese somit farbig erscheinen lässt. Das Ethanol hat ebenfalls eine Hydroxylgruppe. In diesem Fall ist der Einfluss derselben jedoch stark, da der unpolare Rest des Moleküls sehr klein ist. Aus diesem Grund löst sich das Ethanol und somit auch das Sudanrot im Wasser. Die Wasserstoffbrücken sorgen dafür, dass sich Wasser- und Ethanolmoleküle in dem Gemisch stärker anziehen, als sie es in den reinen Flüssigkeiten tun würden, deswegen kann man eine Volumenkontraktion beobachten. Beim Oktanol erfolgt keine Vermischung mit Wasser, daher gibt es auch keine Volumenkontraktion. Oktanol hat einen sehr langen hydrophoben Teil im Molekül, in dessen Nachbarschaft sich viele Wasserteilchen befinden. All diese Wassermoleküle können in die Richtung des organischen Moleküls keine ausbilden. Wasserstoffbrücken Aus diesem Grund versucht das System, die Teilchen so anzuordnen, dass sich alle Wassermoleküle neben möglichst vielen Teilchen gleicher Art befinden. Daher kommt es zur Entmischung von Wasser und Oktanol, um durch möglichst viele Wasserstoffbrückenbindungen Energie zu gewinnen. 17 Versuch 2: Herstellung eines Schaumweins Geräte Magnetrührer, Becherglas, Sieb, Stativmaterial, Tropftrichter, Thermometer, Reagenzglas, durchbohrter Gummistopfen, Gärröhrchen. Chemikalien: Hefe, 2 g Natriumalginat, CaCl2-Lösung (c=0,2 mol·l-1) , ges. Ca(OH)2-Lösung, 50 ml Weißwein, 2,4 g Saccharose, Sicherheitshinweise: Ca(OH)2: Xi: reizend R36/38: reizt die Augen und die Haut R41: Gefahr ernster Augenschäden S2: Darf nicht in die Hände von Kindern gelangen S24: Berührung mit der Haut vermeiden S25: Berührung mit den Augen vermeiden S26: bei Berührung mit Augen oder Haut gründlich mit Wasser abspülen und Arzt konsultieren. Durchführung: Zunächst muss man die Hefe immobilisieren. Dazu werden in einem 250ml-Becherglas 90 ml Wasser auf ca. 70° C erwärmt und durch den Magnetrührer ein Vortex erzeugt. Auf diesen gibt man sehr langsam 2 g Natriumalginat. In das entstehende Gel rührt man anschließend die Hefe ein und lässt es langsam in die CaCl2-Lösung tropfen. Die Kügelchen können nach etwa 2 Stunden abfiltriert werden. Des Weiteren wird ein Wasserbad von etwa 38° C vorbereitet. Die Saccharose und der Weißwein werden mit Wasser auf 100 ml aufgefüllt und von dieser Lösung 15 ml in ein Reagenzglas gegeben. Dieses wird anschließend mit den Kügelchen mit immobilisierter Hefe gefüllt. Man verschließt das Reagenzglas mit einem Stopfen und einem Gärröhrchen, in dem sich frisch angesetzte, gesättigte Ca(OH)2-Lösung befindet. Zuletzt stellt man das Reagenzglas ins Wasserbad. 18 Beobachtung: Gibt man das Alginat in das erwärmte Wasser, so wird es mit zunehmender Menge immer viskoser und schließlich gelartig. Die Hefe-Alginat-Kügelchen bekommen in der CaCl2-Lösung eine feste Konsistenz. Anhand der Veränderung der Flüssigkeitspegel im Gärröhrchen kann man erkennen, dass bei der Reaktion ein Gas entsteht; das Kalkwasser trübt sich. Nach einiger Zeit beginnen die Hefekügelchen, an die Flüssigkeitsoberfläche zu steigen. Entsorgung: Nach Neutralisierung können die Flüssigkeiten kanalisiert und die Alginatkügelchen in den Feststoffabfall gegeben werden. Auswertung: Alginat besteht aus Zuckern (β-D-Mannuronat und α-D-Guluronat), die sich durch 1,4-Verknüpfung zu Makromolekülen verbunden haben. Der Polymerisationsgrad liegt meistens zwischen 100 und 3000. Das Alginat bildet mit den Ca2+-Ionen Komplexe und bekommt daher eine starre Struktur. Die Hefe ist nun in dieser festen Matrix eingeschlossen, sie ist immobilisiert. Sie ist allerdings nicht so stark eingeschlossen, dass in alkoholischer Lösung die Substratmoleküle nicht mit ihr in Kontakt kommen könnten. Aus diesem Grund kann die immobilisierte Hefe zuckerhaltige Substrate vergären. C6H12O6(aq) Hef e 2 C2H5OH(aq) 2 CO2(g) Es entsteht neben dem Alkohol auch viel CO2, welches teilweise am Alginat adsorbiert wird und nach einer gewissen Zeit die Kügelchen zum Schwimmen bringt. Nicht adsorbiertes CO2 gelangt in das Kalkwasser im Gärröhrchen und trübt es. 19 CO2(g) Ca(OH) 2(aq) CaCO3(s) H2O Dies ist eine Nachweisreaktion für Kohlendioxid. Man kann also erkennen, dass der Zucker wirklich vergärt wurde. Der ausführliche Mechanismus ist folgender: Alkoholische Gärung (s. Beyer, Seite 346 f.) Quellen: - Marburger, Anke: Immobilisierte Hefezellen. In: Praxis der Naturwissenschaften; Chemie in der Schule. Jahrgang 52, 2003, Heft 6, Seiten 6 ff - Beyer, Hans: Lehrbuch der organischen Chemie. S.Hirzel Verlag, Leipzig 1968 20 Versuch 3: Veresterung Geräte Bunsenbrenner, Dreifuss mit Drahtnetz, Becherglas, Tiegelzange, Becherglas (100 ml) Chemikalien: Rizinusöl, Zitronensäure Sicherheitshinweise: Zitronensäure: Xi: reizt die Augen R36: reizt die Augen S24/25: Berührung mit den Augen und der Haut vermeiden Durchführung: In einem Becherglas auf dem Drahtnetz werden mit dem Bunsenbrenner 4,5 g Zitronensäure und 10 g Rizinusöl so lange erhitzt, bis sich aus ihnen ein zähflüssiges Harz gebildet hat. Beobachtung: Die vorher recht wenig viskosen Flüssigkeiten reagieren zu einem gelblichen, dickflüssigem Harz. Entsorgung: Der Harz kann im Feststoffabfall entsorgt werden. Auswertung: Rizinusöl ist ein Fett, welches im Durchschnitt etwa zwei Hydroxylgruppen an den Fettsäureresten besitzt. Man kann also sagen, Rizinus ist ein Diol. Zitronensäure dagegen besitzt mehrere Carboxylgruppen und ist somit eine Polycarbonsäure. Beim Erhitzen kommt es zwischen diesen beiden Substanzen zur Veresterung. Da sich in den Molekülen nicht nur je eine funktionelle Gruppe befindet, entsteht ein langkettiges und 21 zähflüssiges Polyesterharz nach folgendem Reaktionsmechanismus: Zunächst wird der Carbonyl-Sauerstoff protoniert. Das entstehende Carbo-Kation kann nun von einem freien Elektronenpaar des Alkohols nucleophil angegriffen werden. Anschließend wird das Proton des Alkohols abgespalten und verlässt zusammen mit einer Hydroxylgruppe als Wasser das Molekül. Es bildet sich ein Carbo-Kation, das nach einer weiteren Abspaltung eines Protons wieder zu einem CarboxylKohlenstoff wird. Insgesamt ergibt sich ein Makromolekül, das man aufgrund der Entstehung durch Veresterung auch Polyester nennt. Ausschnitt aus dem Polyesterharz von Rizinusöl und Zitronensäure Quellen: http://www.axel-schunk.net/experiment/edm0203.html (1.12.07) 22 Versuch 4: Chlorierung von tert-Butanol Geräte Stativmaterial mit Stativring, Scheidetrichter mit Stopfen Chemikalien: Salzsäure(konz), tert-Butanol, Sudanrot Sicherheitshinweise: HCl(konz): C: ätzend R35: verursacht schwere Verätzungen R37: Reizt die Atmungsorgane S26: Bei Berührung mit den Augen gründlich mit Wasser abspülen und Arzt konsultieren S45: Bei Unfall oder Unwohlsein sofort Arzt zuziehen (wenn möglich, dieses Etikett vorzeigen) tert-Butanol: F: leichtentzündlich Xn: gesundheitsschädlich R11: Leichtentzündlich R20: Gesundheitsschädlich beim Einatmen S9: Behälter an einem gut gelüfteten Ort aufbewahren S16: Von Zündquellen fernhalten - Nicht rauchen Sudanrot: Xn: gesundheitsschädlich R40: Verdacht auf krebserzeugende Wirkung R43: Sensibilisierung durch Hautkontakt möglich R53: kann in Gewässern längerfristig schädliche Wirkung haben S2: darf nicht in die Hände von Kindern gelangen S22: Staub nicht einatmen. S24/25: Berührung mit den Augen und der Haut vermeiden Durchführung: In den Scheidetrichter gibt man 25 ml Konzentrierte Salzsäure und 10 ml mit Sudanrot angefärbtes tert-Butanol. Man schüttelt die Lösung einige Male und entlüftet ab und zu das System, um den Druck nicht zu stark ansteigen zu lassen. 23 Beobachtung: Die zunächst homogene Lösung wird durch das Sudanrot nur schwach rötlich gefärbt. Nach dem Schütteln bildet sich auf der Oberfläche eine zweite, stark rötlich gefärbte Phase. Entsorgung: Nach Neutralisation können die Flüssigkeiten in den Müll für organische Lösemittel gegeben werden. Auswertung: Die Salzsäure reagiert mit dem tert-Butanol in einer SN1-Reaktion. Die Hydroxylgruppe des Alkohols wird protoniert und ein Wassermolekül wird abgespalten. Ein planares Carbo-Kation bildet die Zwischenstufe, die nun von einem Chloridion nucleophil angegriffen wird. Es entsteht tert-Butylchlorid. Das Produkt ist hydrophob und setzt sich somit an der Wasseroberfläche ab. Da sich der organische Farbstoff Sudanrot besser in unpolaren Phasen löst, erscheint die obere, organische Phase intensiv rot. Quellen: Becker, Heinz G.O. et al.: Organikum. Wiley-VCH-Verlag; 21. Auflage, 2004 24 Versuch 5: Oxidation verschiedener Alkohole Geräte 3 Petrischalen, 4 Bechergläser, 3 Pipetten, Overheadprojektor Chemikalien: 1-Propanol, 2-Propanol, tert-Butanol, KaliumpermanganatLösung (verd.), NaOH-Lösung (c = 1 mol·l-1) Sicherheitshinweise: 1-Propanol: F: leichtentzündlich Xi: reizend R11: leichtentzündlich R41: Gefahr ernster Augenschäden R67: Dämpfe können Schläfrigkeit und Benommenheit verursachen S7: Behälter dicht geschlossen halten S16: Von Zündquellen fernhalten - Nicht rauchen S24: Berührung mit der Haut vermeiden S26: Bei Berührung mit den Augen gründlich mit Wasser abspülen und Arzt konsultieren S39: Schutzbrille/Gesichtsschutz tragen 2-Propanol: F: leichtentzündlich Xi: reizend R11: leichtentzündlich R36: Reizt die Augen R67: Dämpfe können Schläfrigkeit und Benommenheit verursachen S16: Von Zündquellen fernhalten - Nicht rauchen S24/25: Berührung mit der Haut und mit den Augen vermeiden S26: Bei Berührung mit den Augen gründlich mit Wasser abspülen und Arzt konsultieren tert-Butanol: F: leichtentzündlich Xn: gesundheitsschädlich R11: leichtentzündlich R20: gesundheitsschädlich beim Einatmen S9: Behälter an einem gut gelüfteten Ort aufbewahren S16: Von Zündquellen fernhalten - Nicht rauchen 25 KMnO4: Xn: gesundheitschädlich O: brandfördernd N: umweltgefährlich R8: Feuergefahr bei Berührung mit brennbaren Stoffen R22: Gesundheitsschädlich beim Verschlucken R50/53: Sehr giftig für Wasserorganismen, kann in Gewässern längerfristig schädliche Wirkung haben S60: Dieser Stoff und sein Behälter sind als gefährlicher Abfall zu entsorgen S61: Freisetzung in die Umwelt vermeiden. Besondere Anweisung einholen / Sicherheitsdatenblatt zu Rate ziehen Durchführung: Die Kaluimpermanganatlösung wird mit etwa gleichem Volumen der Natronlauge versetzt und auf die drei Petrischalen aufgeteilt, so dass der Boden jeder Schale komplett bedeckt ist. Die Schalen können noch auf dem Unterboden in Spiegelschrift mit „primär“, „sekundär“ und „tertiär“ beschriftet werden, bevor man sie auf den Overheadprojektor stellt. Es wird in jede Schale je eine Pipettenfüllung eines Alkohols gegeben. Beobachtung: Die Lösungen sind zunächst alle violett. Beim 1-Propanol und 2-Propanol wechselt die Farbe bald nach grün, bevor sie beim primären Alkohol ins braune überschlägt und feste, braune Flocken entstehen. Entsorgung: Die Permanganatreste können mit Oxalsäure versetzt und pH-neutral in den Schwermetallabfall gegeben werden. Die alkoholischen Lösungen werden neutral in den Abfall für organische Lösemittel entsorgt. 26 Auswertung: Der primäre Alkohol wird durch das Kaliumpermanganat zunächst zum Butanal I I R C OH R CHO 2 e 2 H Ox: VII VI 2 MnO 4 2 e 2 MnO 4 Red: 2 und dann weiter zur Buttersäure oxidiert VI I III 2 IV R CHO MnO 4 2 H R COOH MnO 2 H2O . Bei dieser Reaktion wird das Mangan von der Oxidationsstufe +VII bis zu +IV reduziert. Braunstein (MnO2) wird gebildet und wie der Name schon sagt wird die Lösung braun. Der sekundäre Alkohol 2-Propanol kann nur bis zum Aceton oxidiert werden. II 0 H3 C HC OH CH3 H3 C C O CH3 2 e 2 H VII VI 2 MnO 4 2 e 2 MnO 4 2 Um jetzt die Manganionen weiter zu reduzieren müsste das C-Atom der Carbonyl-Gruppe weiter oxidiert werden, das bedeutet, es müsste mindestens die Oxidationszahl +III erhalten. Das würde geschehen, wenn es eine Doppelbindung und eine Einfachbindung zu Sauerstoffatomen ausbilden würde, aber dann müsste wegen eine C-C-Bindung gespalten werden. Dies ist energetisch nicht möglich. Hier bleibt die Reaktion also stehen, wenn Mangan in der Oxidationsstufe +VI vorliegt. MnO42- -Ionen sind in Lösung grün. Beim tertiären tert-Butanol findet keine Reaktion statt, denn der Carbonyl-Kohlenstoff hat die Oxidationszahl +I. Um auf +II zu kommen müsste es zwei Bindungen zu Sauerstoffatomen ausbilden und eine Bindung zu einem anderen Kohlenstoffatom spalten. Die Lösung bleibt violett. 27 Bei Oxidationen mit Kaliumpermanganat gilt die Faustregel „je saurer das Milieu desto stärker wirkt das Oxidationsmittel“. KMnO4 alleine ist schon ein starkes Oxidationsmittel und wenn noch H3O+-Ionen anwesend wären, würden nicht nur die funktionellen Gruppen sondern auch endständige Methylgruppen oxidiert. Dadurch würde das Permanganat weiter reduziert und man würde in allen drei Petrischalen eine Braunfärbung feststellen. Der Mechanismus der Oxidation ist folgender: Der Alkohol greift mit dem Hydroxyl-Sauerstoff nucleophil am positivierten Mangan an. Es wird das Proton der OH-Gruppe abgespalten und ein Sauerstoffatom des Permanganats protoniert. Durch die Base wird diese Gruppe wieder deprotoniert. Das sich nun am Manganatom befindliche negativ geladene Sauerstoffatom eliminiert ein Proton aus dem Alkohol-Rest. Auch diese OH-Gruppe wird anschließend von der Base deprotoniert, bevor durch Bildung einer C-ODoppelbindung MnO42- das Molekül verlässt. Es ist auch möglich, dass die Base direkt am Proton des Kohlenstoffs angreift und durch eine Eliminierung den Aldehyden bildet. 28 Die Reaktion vom Alkanal zur Carbonsäure verläuft analog, nur ist noch eine Addition von Wasser vorgeschaltet. Bei einem sekundären Alkohol kann in diesem Fall kein weiteres Proton am Kohlenstoff abgespalten werden, die letzte Reaktion kann daher nicht erfolgen. Aus ebendiesem Grund kann ein tertiärer Alkohol gar nicht durch diesen Mechansimus oxidiert werden. Quellen: Brückner, Reinhard: Reaktionsmechanismen. Springer Verlag Berlin Heidelberg, 3. Auflage 2007, Seite 742. http://chids.online.uni-marburg.de/dachs/experimente/ 005oxidierbarkeit_prim_sek_ter_alkohole.xml (13.12.06) 29 Versuch 6: Oxidation von Methanol Geräte Magnetrührer, Weithals-Erlenmeyerkolben (500 ml), Platindraht (spiralförmig), Bunsenbrenner. Chemikalien: 50 ml Methanol Sicherheitshinweise: Methanol: F: leichtentzündlich T: giftig R11: leichtentzündlich R23/24/25: Giftig beim Einatmen, Verschlucken und bei Berührung mit der Haut R39/23/24/25: Giftig: Ernste Gefahr irreversiblen Schadens durch Einatmen, Berührung mit der Haut und durch Verschlucken S7: Behälter dicht geschlossen halten S16: Von Zündquellen fernhalten - Nicht rauchen S36/37: S45: Bei Unfall oder Unwohlsein sofort Arzt zuziehen (wenn möglich, dieses Etikett vorzeigen). Durchführung: Etwa 50 ml Methanol werden auf dem Magnetrührer auf etwa 60° C erwärmt. Dann wird eine Platinspirale mit dem Bunsenbrenner bis zum Glühen erhitzt und möglichst schnell in den Erlenmeyerkolben gehangen. Der Raum sollte während des Experimentes verdunkelt werden, um den Effekt besser sichtbar zu machen. Beobachtung: Der Platindraht hört auf zu glühen, wenn man ihn aus der Bunsenbrennerflamme nimmt und ihn in den Kolben hängt. Ab hier verläuft das Experiment periodisch: Nach einigen Sekunden beginnt der Draht erneut, aufzuglühen. Kurze Zeit danach entzündet sich das Gas im Kolben mit grüner Flamme. 30 Währenddessen erlischt das Glühen des Platindrahtes. Nachdem dann auch die grüne Flamme erlischt beginnt der Draht erneut, zu glühen und die Abfolge beginnt von Neuem. Entsorgung: Das Methanol wird im organischen Lösemittelabfall entsorgt. Auswertung: Das Methanol hat bei etwa 60° C einen recht hohen Gasdruck, die Athmosphöre im Weithals-Erlenmeyerkolben ist also sehr methanolhaltig. Gibt man nun einen erhitzten Platindraht in den Kolben, so fungiert dieser als Katalysator für die Oxidation von Methanol zu Methanal. 2 0 0 -2 2 H3COH(g) O2(g) [Pt] 2 HCHO(g) 2 H2O Diese Reaktion ist exotherm und somit heizt sich der Platindraht auf. Die Zündtemperatur von Methanol beträgt 455° C und sobald der Draht diese Temperatur erreicht entzündet er das gasförmige Methanol. -2 0 4 - 2 Δ 2 H3COH(g) 3 O2(g) 2 CO 2(g) 4 H2O(g) Nun kommt die Reaktion an der Katalysatoroberfläche zum Erliegen, das Glühen hört auf. Die Verbrennung läuft so lange, bis im Erlenmeyerkolben nicht mehr genug Luftsauerstoff vorhanden ist. Die Flamme erlischt und Sauerstoff strömt nach. Nun erfolgt wieder die katalytische Oxidation, bis erneut die Zündtemperatur erreicht ist … Quellen: http://www.experimentalchemie.de/versuch-012.htm (15.12.06) 31