Name Eigenschaften Vorkommen Darstellung Verwendung
Werbung
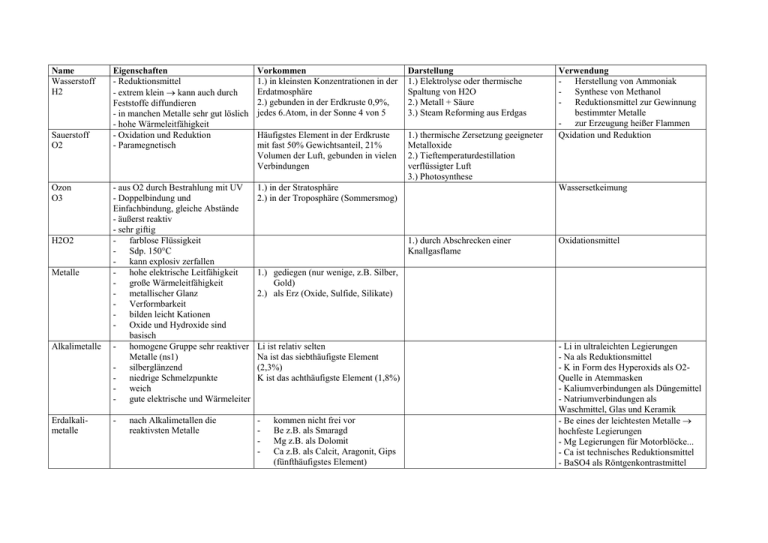
Name Wasserstoff H2 Sauerstoff O2 Ozon O3 H2O2 Metalle Alkalimetalle Erdalkalimetalle Eigenschaften - Reduktionsmittel - extrem klein kann auch durch Feststoffe diffundieren - in manchen Metalle sehr gut löslich - hohe Wärmeleitfähigkeit - Oxidation und Reduktion - Paramegnetisch Vorkommen 1.) in kleinsten Konzentrationen in der Erdatmosphäre 2.) gebunden in der Erdkruste 0,9%, jedes 6.Atom, in der Sonne 4 von 5 Darstellung 1.) Elektrolyse oder thermische Spaltung von H2O 2.) Metall + Säure 3.) Steam Reforming aus Erdgas Häufigstes Element in der Erdkruste mit fast 50% Gewichtsanteil, 21% Volumen der Luft, gebunden in vielen Verbindungen 1.) thermische Zersetzung geeigneter Metalloxide 2.) Tieftemperaturdestillation verflüssigter Luft 3.) Photosynthese - aus O2 durch Bestrahlung mit UV - Doppelbindung und Einfachbindung, gleiche Abstände - äußerst reaktiv - sehr giftig - farblose Flüssigkeit - Sdp. 150°C - kann explosiv zerfallen - hohe elektrische Leitfähigkeit - große Wärmeleitfähigkeit - metallischer Glanz - Verformbarkeit - bilden leicht Kationen - Oxide und Hydroxide sind basisch - homogene Gruppe sehr reaktiver Metalle (ns1) - silberglänzend - niedrige Schmelzpunkte - weich - gute elektrische und Wärmeleiter 1.) in der Stratosphäre 2.) in der Troposphäre (Sommersmog) - - nach Alkalimetallen die reaktivsten Metalle Verwendung - Herstellung von Ammoniak - Synthese von Methanol - Reduktionsmittel zur Gewinnung bestimmter Metalle - zur Erzeugung heißer Flammen Qxidation und Reduktion Wassersetkeimung 1.) durch Abschrecken einer Knallgasflame Oxidationsmittel 1.) gediegen (nur wenige, z.B. Silber, Gold) 2.) als Erz (Oxide, Sulfide, Silikate) Li ist relativ selten Na ist das siebthäufigste Element (2,3%) K ist das achthäufigste Element (1,8%) kommen nicht frei vor Be z.B. als Smaragd Mg z.B. als Dolomit Ca z.B. als Calcit, Aragonit, Gips (fünfthäufigstes Element) - Li in ultraleichten Legierungen - Na als Reduktionsmittel - K in Form des Hyperoxids als O2Quelle in Atemmasken - Kaliumverbindungen als Düngemittel - Natriumverbindungen als Waschmittel, Glas und Keramik - Be eines der leichtesten Metalle hochfeste Legierungen - Mg Legierungen für Motorblöcke... - Ca ist technisches Reduktionsmittel - BaSO4 als Röntgenkontrastmittel Kohlenstoff CO: farb- und geruchloses, sehr giftiges Gas CO2: farbloses, gut lösliches Gas 1.) 2.) 3.) 4.) 5.) Stickstoff - - Phosphor - WP: wachsartig weich, farblos, Schmelztemp. 44°C, Siedepunkt 280°C, selbstentzündlich an Luft, sehr giftig Schwefel - typisches Nichtmetall gelb unlöslich in Wasser - - Fluor elektronegativstes Element Fluorwasserstoff und Flußsäure greifen Glas an Halogenwasserstoffe: gut wasserlöslich, farblose Gase - Halogene - leicht löslich reaktionsträge - - als Diamant (selten) verunreinigt als Graphit CO2 Salze der Kohlensäure organische C-Verbindungen CO: 1.) in der Technik: Verbrennung von Kohle unter Luftmangel 2.) im Laboratorium: Wasserabspaltung aus Ameisensäure Elementarer N ist häufigstes, durch fraktionierte Destillation freies Element: 75% der Masse der flüssiger Luft Erdatmosphäre gebunden in Nitraten größte Menge in Apatiten - Erhitzen von phosphathaltigem weißer Phosphor (WP) Gestein mit Sand und Koks roter Phosphor (RP) (1500°C) schwarzer Phosphor (SP) häufiges Element mit Anteil von 0,05% an der Erdkruste kommt elementar vor in größeren Mengen chemisch gebunden: Erze, Bleiglanz, Zinkblende, Sulfate, in organischen Verbindungen F2 als Flußspat Cl2 im Meer, als Steinsalz Br2 im Meer I2 im Meer - Erzeugung einer nicht oxidierenden Atmosphäre bei technischen Prozessen - Kühlmittel - Zündhölzer - Phophatdünger - Waschmittel - Backpulver - Säure in Getränken - in Kohle und Erdöl