docx - ChidS
Werbung
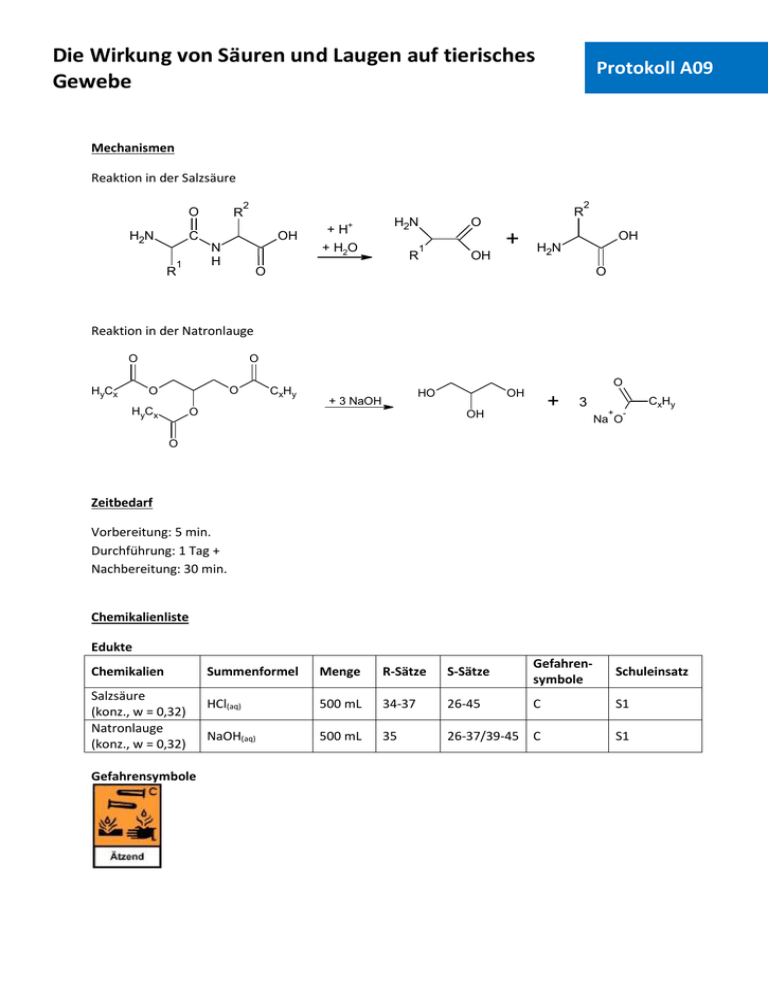
Die Wirkung von Säuren und Laugen auf tierisches Gewebe Protokoll A09 Mechanismen Reaktion in der Salzsäure O H2N R 2 C R OH + H2O N H 1 + H+ H2N R R O 1 + OH 2 OH H2N O O Reaktion in der Natronlauge O HyCx O O O HyCx CxHy O HO + 3 NaOH O OH + OH CxHy 3 + Na O - O Zeitbedarf Vorbereitung: 5 min. Durchführung: 1 Tag + Nachbereitung: 30 min. Chemikalienliste Edukte Chemikalien Salzsäure (konz., w = 0,32) Natronlauge (konz., w = 0,32) Gefahrensymbole Summenformel Menge R-Sätze S-Sätze Gefahrensymbole Schuleinsatz HCl(aq) 500 mL 34-37 26-45 C S1 NaOH(aq) 500 mL 35 26-37/39-45 C S1 Die Wirkung von Säuren und Laugen auf tierisches Gewebe Protokoll A09 Materialien und Geräte 2 Bechergläser (500 mL), Tiegelzange, Glasplatte, 2 Schweinepfoten Versuchsaufbau Abb. 1: Schweinepfoten in Natronlauge (links) und Salzsäure (rechts) Durchführung Augenschutz benutzen Schutzhandschuhe benutzen Schutzkleidung benutzen Der Versuch sollte in einem Abzug durchgeführt werden. In ein Becherglas werden 500 mL Salzsäure, in das andere Becherglas 500 mL Natronlauge gefüllt. Dann wird jeweils eine Schweinepfote in die Bechergläser gegeben und die Reaktion über 24 Stunden beobachtet. Am nächsten Tag werden die Schweinepfoten mit der Tiegelzange aus den Bechergläsern geholt und auf die Glasplatte gelegt. Beobachtungen In dem Becherglas mit der Salzsäure sind bereits nach 2-3 Minuten braune Verfärbungen am Gewebe zu erkennen. Das Fleisch der Schweinepfote löst sich langsam auf und die Knochen kommen zum Vorschein. Nach einem Tag hat sich fast das gesamte Gewebe abgelöst. Um die Knochen herum ist nur noch eine schleimige, labberige Masse vorhanden. Innerhalb der ersten 2-3 Stunden sind die stärksten Effekte zu sehen, da sich die Lösung in dem Becherglas mit der Salzsäure danach stetig dunkler und schließlich schwarz verfärbt. Die Wirkung von Säuren und Laugen auf tierisches Gewebe Protokoll A09 Die Schweinepfote in der Natronlauge wird hingegen nur wenig angegriffen. Das Gewebe löst sich kaum auf, es sind nur leichte Risse in der Haut zu sehen. Allerdings bildet sich auf der Hautoberfläche ein seifiger, glitschiger Film. Abb. 2: Die Schweinepfoten nach 2 Stunden Abb. 3: Die Schweinepfoten und Lösungen nach 24 Stunden Nach etwa einer Woche ist von der Schweinepfote in der Salzsäure nur noch eine labberige Masse übrig, welche auf der Lösung schwimmt. Die Schweinepfote in der Natronlauge ist sehr labil geworden und fällt beim Versuch, sie mit einer Tiegelzange aus dem Becherglas zu holen auseinander. Letztendlich bleiben hier Gewebereste und die Knochen über. Die Lösung ist leicht rötlich verfärbt. Die Lösungen, vor allem die Salzsäure, verbreiten einen sehr unangenehmen, leicht ätzenden, modrigen Geruch. Entsorgung Die restlichen Feststoffe werden abfiltriert, unter fließendem Wasser abgespült, anschließend getrocknet und in die Feststofftonne entsorgt. Die Lösungen werden neutralisiert und in den Ausguss entsorgt. Fachliche Analyse Tierisches, wie auch menschliches Gewebe (Haut, Knochen etc.) besteht hauptsächlich aus Proteinen und Fetten. Proteine sind aus den 20 essentiellen Aminosäuren aufgebaute Polypeptide (eine oder mehrere Ketten bilden ein Protein), welche in wesentlichem Maße am Zellaufbau beteiligt sind. Ihre räumliche Anordnung wird durch vier Strukturarten erklärt. Die Primärstruktur bezeichnet ganz einfach die Reihenfolge der Aminosäuren, aus welchen die Polypeptidketten bestehen. Die Sekundärstruktur wird durch die Anziehungskräfte zwischen den verschiedenen funktionellen Gruppen der Proteine beeinflusst. Dabei sind vor allem die Wasserstoffbrückenbindungen zwischen den NH- und COOH-Gruppen zu nennen. Durch diese Wechselwirkungen werden zwei Arten von Strukturen gebildet: α-Helix und β-Faltblatt. Die so gebildete Struktur kann sich nun noch einmal falten, was zu einer neuen, räumlichen Orientierung Die Wirkung von Säuren und Laugen auf tierisches Gewebe Protokoll A09 des Moleküls führt. Diese wird als Tertiärstruktur bezeichnet. Schließlich können sich auch mehrere Proteine zu einer größeren Einheit zusammenlagern (z.B. Hämoglobin). Die Ausrichtung in dieser Einheit nennt man dann Quartärstruktur. Die Proteine können unterteilt werden in sogenannte Sphäroproteine, welche im Organismus verschiedene Funktionen ausüben, und fibrilläre Proteine, welche vorrangig Gerüst- und Stützfunktionen besitzen. Im Versuch wurden diese Proteine von der Säure angegriffen und zerstört (denaturiert). Das heißt ihre räumlichen Orientierungen wurden verändert und die großen Zellstrukturen aufgelöst. Dadurch gehen die stützenden Funktionen der fibrillären Proteine verloren und das Gewebe fällt auseinander. Des Weiteren wurden die Polypeptidketten aufgelöst, indem die einzelnen Aminosäuren nach dem folgenden Mechanismus (säurekatalysierte Hydrolyse) voneinander getrennt wurden: O H2N R H 2 O C R OH N H 1 + H+ N H + 1 OH + + H2O R OH O H2N H2N R O O H - H+ + OH N H + O H R O 1 2 OH C 1 2 O H2N R R 1 OH R O H2N C R H H 2 + H2N O R 2 OH H2N O Der Carbonyl-Sauerstoff wird von der Säure protoniert, wodurch sich ein Carbokation bildet. An diesem kann das in der Salzsäure enthaltene Wasser nucleophil angreifen. Im Anschluss nimmt der Stickstoff ein Proton des Wassers auf, wodurch er die Bindung zum ehemaligen Carbonyl-Kohlenstoff aufgeben muss. Nach der Trennung der beiden Aminosäuren wird das Proton der Säure wieder abgespalten und die Aminosäuren liegen nun getrennt vor. Lediglich das Fett wird von der Säure verschont und schwimmt zum Schluss als labberige Masse auf der Lösung. Die Natronlauge hingegen greift nicht in erster Linie das Gewebe an, sondern neutralisiert durch seine basische Wirkung den natürlichen Säureschutzmantel der Haut und zerstört ihn. Anschließend greift sie das darunter befindliche Fett an. Fette bestehen aus Glycerolestern (Glyceriden) verschiedener Carbonsäuren mit bis zu 20 Kohlenstoff-Atomen. Je drei Carbonsäuren sind hier mit Glycerin verestert. Im menschlichen und tierischen Organismus haben sie die Aufgaben der Energiespeicherung und Erzeugung, der Wärmeisolation und der Umhüllung von Organen. Werden sie mit Natronlauge behandelt, so zersetzen sie sich, wobei zunächst Glycerin und die Natriumsalze der entsprechenden Carbonsäuren entstehen. Dieses sind Seifen, welche durch Zugabe von Natriumchlorid ausgefällt werden können. Sie werden so in der Industrie hergestellt und dienen dann als Reinigungsmittel. Aufgrund dieser Tatsachen heißt der Mechanismus der ablaufenden Reaktion auch Verseifung. Die Wirkung von Säuren und Laugen auf tierisches Gewebe O + O Na O HyCx O HyCx + NaOH O O O - O CxHy O HyCx Protokoll A09 O O HyCx CxHy OH O O O O O HyCx O O O + + Na HyCx HyCx CxHy O O OH + + Na O HO HyCx O CxHy - O O HO OH OH + CxHy 3 + Na O - Zunächst greift ein Hydroxidmolekül den Carbonyl-Kohlenstoff nucleophil an. Der CarbonylKohlenstoff löst daraufhin die Bindung zum Sauerstoff und es entsteht die Carbonsäure. In einer folgenden Säure-Base-Reaktion wird das Proton der Säure durch das Natrium-Kation substituiert und es bildet sich das Natriumsalz der Carbonsäure. Nach zwei weiteren Durchläufen entstehen das Glycerol und drei Seifenmoleküle. Die Lauge erscheint hier harmloser als die Säure, aber dennoch ist große Vorsicht geboten. Natronlauge, vor allem konzentrierte, kann bei Augenkontakt sehr schnell zu Erblindung führen. Auch auf der Haut kann sie gefährlich werden, da sie meist recht schnell eine seifige Konsistenz annimmt und dann nur schwer mit Wasser abzuwaschen ist. Methodisch didaktische Analyse Einordnung Nach dem hessischen Lehrplan G8 ist der Versuch in die Stufe 8G.2 im Thema „Ordnung in der Vielfalt, Atombau und Periodensystem“ zum Unterthema „2.4 Alkalimetalle“ einzuordnen. Im Zuge der Behandlung von Alkalimetallverbindungen, z.B. Natriumhydroxid, sollte auch auf dessen wässrige Lösung, die Natronlauge (und ihr gedankliches Pendant, die Salzsäure) eingegangen werden. Der Bezug zum Alltag ist hier eindeutig, da die Schüler im Unterricht selbst einmal mit Säuren und Laugen arbeiten werden. Darüber hinaus sind Säuren und Laugen auch in manchen Haushaltsreinigern oder Lebensmitteln anzutreffen. Daher ist der Versuch auch für diesen Bereich geeignet (9G.2: „Säuren und Laugen“, „2.1 Herstellung und Eigenschaften von Laugen und/oder Säuren“), um die Schüler auf die möglichen Gefahren und eine vorsichtige, aber nicht ängstliche Arbeitsweise hinzuweisen. Allerdings sollte die Theorie einer didaktischen Reduktion unterzogen werden, da die Auswertung erst in der Organischen Chemie der Oberstufe (z.B. die Verseifung in der 11G.1) vollständig thematisiert werden könnte. Die Wirkung von Säuren und Laugen auf tierisches Gewebe Protokoll A09 Aufwand Der Materialaufwand ist sehr gering. Die Schweinepfoten bekommt man kostenlos oder für wenig Geld im Schlachthof oder beim Metzger. Allerdings müssen mindestens 2-3 Stunden eingeplant werden, um den Verlauf sinnvoll beobachten zu können. Die Chemikalien werden auch in relativ hohen Mengen verbraucht, sind aber sehr günstig. Durchführung Der Versuch funktioniert sehr gut, die Effekte sind deutlich zu sehen, aber man muss etwas Zeit einplanen. Laut HessGISS sind die Chemikalien für Schülerversuche zugelassen, aber es sollten nur Schüler damit arbeiten, die bereits über eine gewisse Erfahrung beim Experimentieren verfügen. Aufgrund des üblen Geruchs muss der Versuch auf jeden Fall in einem Abzug durchgeführt werden. Besser ist es, der Lehrer zeigt den Versuch oder das Video, da hier der Effekt auch schneller auftritt. Im Vorfeld sollte auch geklärt werden, ob die Schüler eventuell Übelkeit beim Anblick des verätzten Gewebes überkommen könnte. Fazit Der Versuch verdeutlicht gut die Gefährlichkeit bei der Arbeit mit konzentrierten Säuren und Laugen. Allerdings muss darauf geachtet werden, ob Schüler in der Klasse sind, denen beim Anblick von verätztem Gewebe übel wird. Literaturangaben Versuchsquelle Sommer, S.: netexperimente 2.0. Versuch 91: Wirkung von starken Säuren und Laugen. Zu finden unter URL: http://www.netexperimente.de/chemie/91.html. Letzter Zugriff am 12.04.2010. Sekundärliteratur [1] Hessisches Kultusministerium: Lehrplan Chemie Gymnasialer Bildungsgang Jahrgangsstufen 7G bis 12G. 2008. Zu finden unter URL: http://www.kultusministerium.hessen.de/irj/HKM_Internet?uid=3b43019a-8cc6-1811-f3efef91921321b2. Letzter Zugriff am 09.04.2010. [2] Latscha, H. P., Kazmaier, U., Klein, H. A.: Organische Chemie. Seiten 430ff, 436ff. Sechste, vollständig überarbeitete Auflage. Berlin, Heidelberg: Springer-Verlag. 2008. [3] Unfallkasse Hessen; Hessisches Kultusministerium: Hessisches Gefahrstoffinformationssystem Schule - HessGISS. Version 13. 2008/2009.











