PowerPoint-Präsentation
Werbung

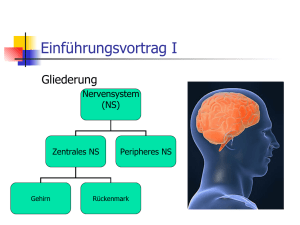
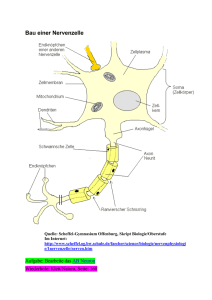
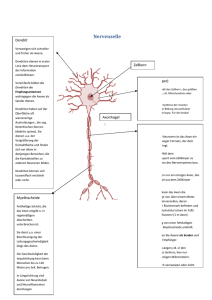
Nervensystem • ist übergeordnete Steuerungs- und Kontrollinstanz des Körpers • besteht aus Nervenzellen und Stützzellen (z. B. Glia) • hat drei Hauptfunktionen • Reizaufnahme • Reizintegration, Interpretation, Handlungsplanung • Bewegungssteuerung Elementare Aufgaben des ZNS bzgl. Außenwelt Aufbau des Nervensystems • ZNS besteht zu 80 % aus Zellen, 20 % Extrazellulärsubstanz • Zentrales Nervensystem (ZNS) • Gehirn • Rückenmark • peripheres Nervensystem • Hirnnerven • Spinalnerven --------------------------------------• sensorische Nerven (afferent) • somatisch • viszeral • motorische Nerven (efferent) • somatisch • autonom (viszeral) Organisationsebenen des ZNS Autonomes und (somatisches) Nervensystem Stützzellen (Glia) im PNS 2 Typen in Peripherie (PNS), 4 Typen im ZNS • Aufgaben: Ernährung der Nervenzellen / Stützstrukturen / Elektrische Isolation / Leitstrukturen während Wachstum • Schwann-Zellen • umgeben größere Nervenfasern • erzeugen Myelin-Scheiden • funktionell ähnlich den Oligodendrozyten • essentiell für Regeneration peripherer Nerven • Satelliten-Zellen • umhüllen Neurone in Ganglien • Funktion weitgehend ungeklärt Stützzellen (A): Schwann‘sche Zellen & Satellitenzellen Stützzellen (Neuroglia) im ZNS • • • • Astrozyten (ZNS) • sternförmig • häufigster Typ • wichtig für Stoffaustausch mit Kapillaren, als Leitstrukturen, K+- und Neurotransmitter-Deaktivierung; Signalweiterleitung über ‚gapjunctions‘ und intrazelluläre Ca-Pulse Mikroglia • ‚dornen‘besetzte Fortsätze • eliminieren Mikroorganismen & tote Nervenzellen (-> Makrophagen; (Phagocytose)) [Immunsystem ohne Zugang zum ZNS] Ependymale Zellen • kleiden Liquorräume von Gehirn und Rückenmark aus Oligodendrozyten • produzieren Myelin-Scheiden im ZNS Stützzellen (B): Astrozyten und Mikroglia Stützzellen (C): Ependym-Zellen und Oligodendrozyten Nervenzell-Histologie • Nervenzellen übermitteln Information mittels elektrischer Prozesse • sind extrem langlebig, d. h. > 100 Jahre • sind amitotisch - kein Ersatz bei Tod (Ausnahme: olfaktorische Neurone, einige Hippokampus-Neurone) • sehr hohe Stoffwechselrate, benötigen ständig reichhaltige Zufuhr von Glukose und Sauerstoff (wenn Zufuhr fehlt, Zelltod nach wenigen Minuten) • sind in der Regel große, reich verzweigte Zellen, mit z. T. ca. 1 m langen Ausläufen (Axonen) • bestehen i. d. R. aus Dendrit (Eingang), Zellkörper (Integration) und Axon (Ausgang) Struktur eines motorischen Neurons (Nerven-)Zellkörper • Synonyme: Zellkörper = Perikaryon = Soma • Durchmesser: 5 bis 140 µm • enthält Nukleolus -> Biosynthese/Zytoplasma/übliche Organellen außer Centriolen • sehr stark ausgeprägtes rauhes endoplasmatisches Retikulum (‚NisslSubstanz‘) • Zellansammlungen im ZNS heißen ‚Nucleus‘ (Kern) • Zellansammlungen im PNS heißen ‚Ganglion‘ Nervenzell-Fortsätze (a) ZNS = hauptsächlich Zellkörper • PNS = hauptsächlich Zell-Fortsätze • Bündel von Fortsätzen = Trakt (ZNS) bzw. Nerv (PNS) • Dendriten • in der Regel kurz (insb. bei Motor-Neuronen oft mit .Spines‘) • leiten graduierte Potentiale • enthalten fast alle Organellen-Typen • Ausdehnung bestimmt das rezeptive Feld • Nervenzell-Fortsätze (b) • Axone • i. d. R. nur 1 Axon/Nervenzelle; u. U. lang & verästelt (Axon-Kollateralen) • beginnt am Axonhügel (dort Entstehung des Aktionspotentials) • enden in bis zu 10.000 Axon-Terminalen (‚Buttons‘) • enthalten gleiche Organellen wie Soma & Dendrit, außer Golgi & Nissel (-> keine Protein-Synthese) • Versorgung vom Kern (aktiver axonaler Transport) mit Membran-Ersatz, Mitochondrien, Enzymen ect. • Kinderlähmung/Herpes simplex/Tetanus-Toxin: werden durch retrograden Transport zum Kern gebracht Myelin-Scheiden • • • • • • • • • insb. für dicke Nervenfortsätze (Axone) weißliches Lipo-Protein als elektrische Isolation Beschleunigung der Nervenfortleitung bis ca. Faktor 100 -> bis 150 m/s durch Schwann-Zellen gebildet (rollen sich um Axon) Membranen enthalten keine „Kanäle“/wenig Protein -> gute Isolation äußerste Lage der Schwann-Zellen = Neurilemma in regelmäßigen Abständen (ca. 1 mm) Myelin-freie Axonbereiche = Ranvier‘sche Schnürringe (dort Kollateralen) Nervenfasern, die von Schwann-Zellen ohne Einrollung umhüllt werden, heißen ‚unmyelinisiert‘ (bis 15 Axone/Schwannzellen) im ZNS Myelin-Scheiden gebildet durch Oligodendrozyten (nicht Schwann-Z.). Dort bis zu 60 Neurone/Oligodendrozyt, Schnürringe in größerem Abstand, kein Neurilemma, ‚weiße Substanz‘. Schwann‘sche Zelle und Axon im peripheren Nerv Klassifikation von Nervenzellen strukturell • • • funktionell multipolar (99 % aller Neurone) • • drei oder mehr Fortsätze (1 Axon, > 1 Dendriten) bipolar (in Sinnesorganen) • • zwei Fortsätze (Axon, Dendrit) unipolar (oder: pseudounipolar) • T-förmiger Fortsatz: nur Axon • hpts. in peripherem senso• rischem Ganglion sensorisch (= afferent = zum ZNS) • überwiegend unipolar, Zellkörper liegen nicht im ZNS motorisch (= efferent = vom ZNS weg) • zu Muskeln & Drüsen • meist multipolar, Zellkörper im ZNS Interneurone (hpts. im ZNS) • 99 % der Neurone des Körpers • multipolar Vergleich von Neuronen-Typen (A) Vergleich von Neuronen-Typen (B) Vergleich von Neuronen-Typen (C) Grundlagen der Bio-Elektrizität • Nervenzellen erzeugen passiv fortgeleitete oder aktive Aktions-Potentiale • Körper ist insgesamt elektrisch neutral, besitzt aber unterschiedlich geladene ‚Kompartimente‘ (vgl. Batterie) • Potential-Differenz wird in V oder mV (= 0,001 V) gemessen • Stromfluss (I) nimmt zu mit Potential-Differenz (V) und nimmt ab mit Widerstand (R) (Ohm‘sches Gesetz: I = V/R) • im Körper beruht Stromfluss i. d. R. auf Bewegung von Ionen, nicht von freien Elektronen, normalerweise durch Membranen hindurch • Membran-Kanäle (passiv <-> aktiv (= ‚gated‘)) lassen i. d. R. nur einen Ionen-Typ passieren • Ionen bewegen sich entlang chemischer und elektrischer Gradienten Funktionsweise gesteuerter Kanäle (A) Funktionsweise gesteuerter Kanäle (B) Potentialdifferenz zwischen Neuron und Umgebung Ruhepotential • • • • • Innenseite der Nervenmembran ist relativ zur Außenseite ca. -40 mV bis -90 mV geladen • geringere Na+ und höhere K+-Konzentration als außen • innen mehr negative Proteine (A-) außen mehr Clbedingt durch Na/K-Pumpe und differenzielle Permeabilität der Nervenmembran (in Ruhe 75fach permeabler für K+ als für Na+, frei permeabel für Cl-; alle potentialabhängigen Kanäle geschlossen) • K+ (und Na+) folgt osmotischem Gradienten • innen weniger positive Ionen = negative Ladung hängt ab von Membran-Permeabilität und Ionen-Konzentrationen Depolarisation = Reduktion des Membranpotentials (weniger negativ/bzw. positiv) Hyperpolarisation = Verstärkung des negativen Potentials Grundlagen des Ruhepotentials Signal-Potentiale • • • • Graduierte Potentiale -> lokal (Dendriten/Rezeptoren), kurzlebig (z. B. Generator-Potentiale, postsynaptische P.) • Ausbreitung innen und außen entlang der Membran • schneller Abfall mit Entfernung vom Entstehungsort Aktionspotentiale (in Nerven- und Muskelzellen) (Dauer: ca. 1 ms.) • kurzdauernde Umkehr des Membranpotentials (von -70 mV auf + 30 mV) • vorübergehende Erhöhung der Na+-Permeabilität (Depolarisation; erster von 2 Na-Kanälen), gefolgt von • Wiederherstellung der Na+-Impermeabilität und • kurzzeitige Erhöhung der K+-Permeabilität (Repolarisation/Hyperpolarisation/ Refraktär-Periode) Schwelle für Aktionspotential (= Selbst-Verstärkung der Depolarisation): ca -50 bis -55 mV (Na+ Permeabilität: 1000fach höher als in Ruhe) Na+-Einstrom für Schwelle: ca. 0,01 % Konzentrationsänderung der intrazellulären Na+-Konzentration -> durch Na+/K+- schnell kompensiert Depolarisation & Hyperpolarisation der Membran Fortleitung des Aktionspotentials • Umkehr des Membranpotentials führt zu Ionenverschiebungen zu/von benachbarten Membranabschnitten • dadurch Depolarisation benachbarter Membranabschnitte -> Generierung eines Aktionspotentials bei Erreichen der Schwelle (‚Domino-Effekt‘) (Nicht in den kurz zuvor depolarisierten Abschnitten: Refraktärzeit) • Aktionspotential-Fortleitung folgt völlig anderem Prinzip als Leitung von Strom in (elektrischen) Leitungen -> wesentlich langsamer • ‚Alles oder Nichts‘-Prinzip der Membranerregung: Schwelle muss erreicht werden (K+-Strom entspricht Na+-Strom), d. h. Eingangsreiz muss ausreichend stark sein (ähnlich Feuer-Anzünden) -> Frequenz-Kodierung der Reizstärke Lokale Depolarisation der Membran Weiterleitung der lokalen Membran-Depolarisation Abfall der lokalen Depolarisation mit der Entfernung Vier Phasen des Aktions-Potentials (AP) Fortleitung eines Aktionspotentials (A) Fortleitung eines Aktionspotentials (B) Fortleitungsgeschwindigkeit • • • • • • hängt ab von Axondurchmesser (Längswiderstand) und Myelinisierung (Isolation) • schnellste Fasern (z. B. Körperstabilisierung): 150 m/s • langsame Fasern (z. B. Darmsteuerung): 1 m/s saltatorische Fortleitung: • Stromfluss quer zur Membran an Schnürringen • geringerer Abfall der Potentialdifferenz mit Abstand als ohne Isolation drei Klassen von Fasern • A = bis 150 m/s; überwiegend somatosensorisch/motorisch; sehr dick • B = ca. 15 m/s; dünne somatosensorische Fasern (Berührung/Schmerz) • C = 1 m/s oder weniger; sehr dünn, nicht myelinisiert Multiple Sklerose (MS), eine Auto-Immun-Erkrankung, zerstört MyelinScheiden -> Verzögerung bis Verhinderung der Impuls-Fortleitung (Axone selbst bleiben intakt) Verzögerung der Fortleitung durch Alkohol/Sedativa/Anästhetika/Druck/Kälte durch Verminderung der Na+-Permeabilität der Membran Verzögerung der Fortleitung an Synapsen für 0,3 - 5 ms. Reizstärke und Entladungsfrequenz Saltatorische Reizfortleitung Typen chemischer Synapsen Elektrische Synapsen • • • Synapsen im allgemeinen meist zwischen Axon (präsynaptisch) und Dendrit/Soma (postsynaptisch) (Axo-denritisch, Axo-somatisch) selten Axon -> Axon, Dendrit -> Dendrit / Dendrit -> Soma Elektrische Synapsen (seltener) (= ‚gap-junctions‘) • enthalten Protein-Kanäle, die Zytoplasma benachbarter Zellen verbinden • bewirken sehr schnelle elektrische Kopplung der Zellen • verbreiteter in embryonalen Gehirnen; bei Erwachsenen z. B. für Sakkaden-Generierung Chemische Synapsen • • funktionieren mittels Neurotransmittern, die auf Ionenkanäle einwirken (keine elektrische Koppelung) -> Einbahnstraße • Ca+-Kanäle öffnen sich im präsynaptischen Axon-Terminal als Folge des Aktionspotentials (zusätzlich zu Na+-Kanälen) • Ausschüttung von Neurotransmitter durch Exozytose (ca. 300 Vesikel), Elimination von intrazellulärem Ca+ • Neurotransmitter bindet an postsynaptische Rezeptoren • Ionen-Kanäle in der postsynaptischen Membran öffnen sich -> Erregung (EPSP) oder Hemmung (IPSP), abhängig vom Typ der Rezeptoren • Beendigung der Neurotransmitter-Wirkung durch enzymatischen Transmitter-Abbau/Wiederaufnahme (Astrozyten/Präsynapse)/Diffusion bestehen aus präsynaptischem Axon-Terminal mit synaptischen Vesikeln und postsynaptischer Rezeptoren-Region (auf Dendrit oder Zellkörper). Dazwischen synaptischer Spalt (30-50 nm breit) Folgen der Depolarisation einer Synapse Postsynaptische Potentiale Postsynaptische Potentiale (PSP) • postsynaptische Rezeptoren: öffnen spez. Kanäle = Umwandlung chemischer in elektrische Signale • postsynaptische Potentiale sind relativ unempfindlich gegenüber Membranpotential ( Aktionspotential) -> keine positive Rückkoppelung • Graduierte Potentiale, Größe abhängig von Transmittermenge • Exzitatorische postsynaptische Potentiale (EPSPs) • Depolarisation der postsynaptischen Membran durch Öffnung eines Kanals, der für K+ und Na+ permeabel ist • • keine Refraktär-Periode!, aber zeigt postsynaptische Summation • kein Aktionspotential, Depolarisation max. bis 0 Volt Inhibitorische postsynaptische Potentiale (IPSPs) • Unterschied zu EPSPs: Öffnung von (weiteren) K+ (und/oder Cl-)-Kanälen -> Hyperpolarisation der postsynaptischen Membran bis ca. -90 mV Integration an Synapsen • • • • • • • • mehr als 1 EPSP erforderlich für Aktionspotential Summation über Synapsen (Raum) und Zeit Integration von EPSPs und IPSPs am Axonhügel Effektivität von Synapsen hängt ab vom Abstand vom Axonhügel ‚Über-lineare‘ Summation = Synaptische Potenzierung (1+1 = 3) vermutlich über Ca++ in Prä- und Postsynapse NMDA-Rezeptoren-vermittelt • möglicherweise Substrat von Lernen • zusätzliche Effizienzerhöhung dendritischer Eingänge (über RückwärtsAktionspotential) nach Erzeugung eines Aktionspotentials Präsynaptische Modulation: über axo-axonale Synapsen -> weniger TransmitterAusschüttung Neuromodulation: Transmitter bewirkt (langsame) Veränderungen im Stoffwechsel der Zielzelle (Transmitter-Synthese/Freisetzung/Wiederaufnahme) Integration von EPSPs und IPSPs Neurotransmitter • • • • • z. Z. ca. 50 verschiedene Neurotransmitter (oder NT-Kandidaten) bekannt viele Neurone produzieren zwei oder mehr verschiedene Transmitter! verschiedene Transmitter für unterschiedliche Reizfrequenzen Klassifikation aufgrund chemischer Struktur • Acetylcholin (ACh) (z. B. motorische Endplatte, autonomes NS) • Biogene Amine (z. B. Katecholamine (Dopamin / Adrenalin / Noradrenalin / Serotonin / Histamin)) • Aminosäuren (GABA/Glyzin/Glutamat/Aspartat, nur im ZNS) • NO (Stickoxid); ATP; CO (NO evtl. für Rückmeldung an Präsynapse: Hebb!) Klassifikation aufgrund von Funktion • erregend versus hemmend: in Abhängigkeit vom Rezeptor kann Wirkung eines Transmitters sich umkehren • direkt (Öffnen von Ionen-Kanälen) versus indirekt (über intrazellulären second messenger) Syntheseweg einiger Neurotransmitter Neurotransmitter: Rezeptor-Mechanismus Neuronale Integration • • • Neuronenverbände haben unterschiedliche Verschaltungsmuster • Divergenz/Konvergenz • rückgekoppelt/oszillierend (-> Rhythmische Aktivität) • parallel mit Nach-Erregung serielle Verarbeitung • hierarchisch • oft ohne Rückkoppelung, z. B. Reflexe parallele Verarbeitung • mehrere parallele, gleichberechtigte Verarbeitungswege Verschaltungstypen (A): Divergenz Verschaltungstypen (B): Konvergenz Verschaltungstypen (C): Rückgekoppelt/ Parallel Einfacher Reflexbogen