Titel - ChidS
Werbung

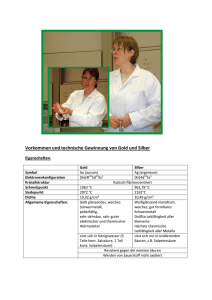
Gliederung 1. Einleitung 2. Geschichte 3. Vorkommen 4. Darstellung 5. Verwendung 6. Elementares Silber 7. Silberverbindungen 8. Alltagsrelevanz – Schulrelevanz? 1. Einleitung • Ag (lat. argentum) • Namensgebend für Argentinien • Alchemie: Halbmond als chem. Symbol (der Mondgöttin Luna geweiht) • Cu, Ag, Au: Münzmetalle • Cu, Ag, Au und Platingruppenmetalle: Edelmetalle 2. Geschichte • 4000 v. Chr.: Silberentdeckung, Nebenprodukt bei der ägypischen Goldgewinnung • 3400 v. Chr.: Au/ Ag-Ringe als Zahlungsmittel • 700 v. Chr.: Beginn der Münzprägung in Griechenland • 16. Jh. n. Chr.: Blütezeit der mitteldeutschen Silberproduktion (Freiberg) • Um 1540: Entdeckung der Silbervorkommen in Südamerika • 19. Jh.: USA wird zweitgrößter Silberproduzent 2. Geschichte Versuch 1: Nachweis von Silber in Legierungen Oxidation: Reduktion: +1 0 6 Ag( s) 6Ag ( aq) 6e +6 Cr 2 O 2 7 ( aq) 14 H3O ( aq) +3 6e 2 C r(3aq ) 21 H2O Chromat-Dichromat-Gleichgewicht: 2CrO24(aq) 2H3O(aq) Cr2O72(aq) 3H2O Fällung von schwerlöslichem Silberchromat Ag2CrO4 (braunrot) und Silberdichromat Ag2Cr2O7 (rot) Rautenförmige Kristalle 3. Vorkommen • Silbergehalt der Erdkruste: 0,1 g/t (0,1 ppm) „Silberlocke“ • Gediegen • Silbererze: Ag2S (Silberglanz, Argentit) CuAgS (Kupfersilberglanz) Argentit AgCl (Hornsilber) • Silberhaltige Erze: Silber, kristallin PbS (Bleiglanz) enthält 0,01-1% Silber in Form von Ag2S CuFeS2 (Kupferkies) Hornsilber 3. Vorkommen 3. Vorkommen • Hauptlagerstätten: Kanada Russland Japan USA Mexiko China Peru Bolivien Australien Chile • Weltjahresbedarf: 25 000 t 6200 t Recycling 9300 t Erzförderung 4650 t Silberbergwerke Defizit: 4850 t (aus Lagerbeständen) 4. Darstellung • Aus Silbererzen: Cyanidlaugerei Rohsilber • Aus Blei- und Kupfererzen: „Parkesieren“ „Pattinsonieren“ Kupellation Rohsilber • Feinreinigung: Elektrolytische Raffination Feinsilber • Rückgewinnung von Silber aus Sekundärrohstoffen 4. Darstellung Cyanidlaugerei • Ausgangsmaterial: Silbererze (Ag, AgCl, Ag2S) • Gemahlenes Erz wird mit 0,1 - 0,2 %-iger heißer Natriumcyanidlösung unter Einblasen von Luft ausgelaugt: 0 +1 0 -2 2Ag(s) 4CN (aq) 21 O2(g) H2O 2 Ag (CN)2 (aq) 2OH(aq) EAg / Ag -0,31V 0,059 E0 log Ag(aq) 1 0V 0,80V Ag/[Ag(CN)2]- H2/2H+ 0,40V 2OH-/O2 (pH 14) Ag/Ag+ 4. Darstellung Cyanidlaugerei • Hornsilber: AgCl( s) 2 CN(aq) Ag (CN) 2 ( aq) Cl(aq) • Silberglanz: -2 Ag 2S ( s) 4 CN ( aq) 0 2 O2( g) 2 Ag CN 2 ( aq) +6 -2 SO 24( aq) • Zementation: +1 2 Ag (CN) 2 ( aq) 0 Zn( s) Zn (CN) +2 2 4 ( aq) 0 2 Ag( s) Rohsilber 4. Darstellung Parkesieren • Gebräuchliche Methode, nach A. Parkes (seit 1842) • Ausgangsmaterial: Ag-haltige Pb-Schmelzen (0,01-1%) „Zinkschaum“ 10% Silber nach Anreicherung Pb-Schmelze (Ag-haltig) Ag Ag Ag Ag • Extraktion aus Pb-Schmelze mit flüssigem Zn • Ag in Zn besser löslich als in Pb (Verteilungskoeffizient ~300) • Produkt: „Zinkschaum“ mit Silber und Bleiresten 4. Darstellung Pattinsonieren • Nach H. L. Pattinson (1833) • Abkühlen einer Ag-haltigen Pb-Schmelze • Produkt: Eutektisches Gemisch mit 2,5% Silber (Smp 304°) Smp. Ag 906°C Schmelze Ag(l)/Pb(l) Ag(s)/Schmelze Smp. Pb 327°C Eutektikum 304°C Pb(s)/Schmelze Ag(s)/Pb(s) 100% 0% 2,5% Ag 0% 100% Pb Ag 4. Darstellung Isolierung des angereicherten Silbers: • Ausgangsmaterial: Produkte des Parkesierens bzw. Pattinsonierens • Treibarbeit („Kupellation“) überführt Pb in PbO, dieses wird flüssig abgezogen • Zink wird durch Destillation entfernt (Sdp. Zn: 908,5 °C, Sdp. Ag: 2212°C) Rohsilber (95%) 4. Darstellung Elektrolytische Feinreinigung Möbius-Verfahren: Kathode (Edelstahl) Anode (Rohsilber) Anodensack Anodenschlamm Elektrolyt: salpetersaure AgNO3-Lösung Anode: Ag(s) Ag(aq) e Rohsilber Silberkristalle Kathode: Ag(aq) e Ag(s) Feinsilber 4. Darstellung Versuch 2: Fraktale Silberstrukturen • Anode: • Kathode: -2 ( aq) 2OH +1 ( aq) 2Ag 0 O2(g) H2O 2e 1 2 0 2e 2Ag(s) 4. Darstellung Feinsilber und Legierungen „Feinheit“ = Anteil des Silbers am Gesamtgewicht in Promille Feinsilber-Qualitäten: Feinheit 835 (83,5 %): 835 Teile Feinsilber, 165 Teile Legierungsmetalle Feinheit 925 (92,5 %): „Sterling-Silber“ Feinheit 999 (99,9 %): Reines Feinsilber Preis: ca. 6 $ pro Feinunze (ca. 200 €/kg) 1 Feinunze (oz) = 31,104 g 5. Verwendung Hartlote 6% Silberwaren und Schmuck 9% Elektro- und Elektronikindustrie 23% offizielle Münzen 4% Fotoindustrie 35% Investment 23% 6. Elementares Silber 47 107,87 Eigenschaften: • 1. Nebengruppe (11.Gruppe) • Isotope: 107 Ag (51,83%) und 109 Ag (48,17%) Ag Silber • Smp. 960,8°C, Sdp. 2212°C • Kubisch dichteste Kugelpackung • Sehr duktil (Silberfolien, dünne Drähte) • Beste elektrische und Wärmeleitfähigkeit unter den Metallen [Kr] 4d10 5s1 6. Elementares Silber Silber als Edelmetall • E0 (Ag/Ag+) = +0,7991 V • Oxidationsbeständig gegenüber Luft-O2 • Bildung einer passivierenden, durchsichtigen Ag2O-Schicht (10-20 nm) • Löst sich nur in oxidierenden Säuren (HNO3) • „Anlaufen“ von Silber an der Luft unter Einwirkung schwefelhaltiger Spurengase 6. Elementares Silber Versuch 3: Sulfidieren einer Silbergabel • Reaktionsverlauf: 0 ( aq) 2Ag(s) HS 0 +1 -2 21 O2(g) Ag2S(s) OH(aq) schwarz • Unter Einwirkung schwefelhaltiger Spurengase: 0 0 +1 -2 2Ag( s) H2S( g) 21 O2( g) Ag2S( s) H2O • Begünstigte Adsorption und Reaktion der Spurengase an der Ag2OSchicht Ag2O(s) H2S(g) Ag2S(s) H2O(g) (E 0) 6. Elementares Silber Versuch 4: Reinigen einer angelaufenen Silbergabel Passivierung des Aluminiums wird aufgehoben: Al2O3( s) 2OH(aq) 3H2O 2Al(OH) 4 ( aq) Oxidation des Aluminiums (E0 (Al/Al3+)= -1,7V): 0 Al( s) 4OH ( aq) Al(OH) 4 ( aq) 3e +3 Reduktion von Ag2S: +1 0 Ag2S(s) 2e 2Ag(s) S(2aq ) Wasserstoffentwicklung: +1 ( aq) H2O e OH 0 21 H2(g) 6. Elementares Silber Antibakterielle Wirkung • Verunreinigungen (Lokalströme) und Ag2O-Schicht führen zur Löslichkeit des Silbers • Ag+ wirkt bakterizid, fungizid, antiseptisch • 2 g Ag+ sterilisieren 1 Mio. Kubikmeter Wasser Oligodynamische Wirkung • Wirkung: Blockade von Thioenzymen • Anwendungen: Chirurgische Instrumente Medikamente Essbesteck und -geschirr Trinkwasserreinigung 6. Elementares Silber Versuch 5: Nachweis von Silber in Trinkwasserfiltern • Trinkwasserfilter: mechanischer Filter Ionenaustauscher Aktivkohle Silber (als keimtötende Substanz) Aufschluss mit HNO3: 0 +5 ( aq) 3 Ag(s) HNO 3(aq) 3H3O +2 0 +4 -2 NO ( g) 21 O2( g) NO 2( g) braun Nachweis als AgCl: Ag(aq) Cl(aq) AgCl(s) +1 ( aq) 3 Ag +2 NO(g) 5H2O farblos 6. Elementares Silber Versilbern • Galvanisches Versilbern von Metallgegenständen: Kathodische Abscheidung von Ag aus einer Lösung von K[Ag(CN)2] • Stromloses Versilbern: Bei unedleren Metallen möglich • Glasversilberung: Auf chemischem Wege, zur Spiegelherstellung 6. Elementares Silber Versuch 6: Stromlose Versilberung • Redoxreaktion: +1 ( aq) 2Ag 0 0 +2 Cu(s) 2Ag(s) Cu(2aq ) E0(Ag/Ag+) = +0,7991 V E0(Cu/Cu2+) = +0,337 V • Cu2+-Nachweis: Cu(2aq ) 4NH3( aq) Cu(NH3 ) 4 ( aq) 2 blau 6. Elementares Silber Versuch 7: Herstellung eines Silberspiegels Öffnung der Glucose zur Aldehyd-Form: O H C H C OH H OH O HO H H OH H CH2OH H HO H H OH H OH OH CH2OH Bildung des Silberspiegels (Tollens-Reaktion): O +1 H C H OH +1 HO H + 2 Ag+ + 3 OH(aq) (aq) H OH OH H CH2OH NH3(aq) O +3 O C H OH HO H H OH OH H CH2OH 0 + 2 Ag(s) + 2 H2O Spiegel 6. Elementares Silber Spiegelherstellung – Historisches • Altes Ägypten: polierte Bronze- und Kupferspiegel • Die Römer: Glas mit Gold und Lack beschichtet • Mittelalter (ab 13. Jh.): Zinn-Amalgam-Spiegel • 1835, Justus v. Liebig: Silberspiegel • Heute: Silberspiegel mit Schutzschicht aus Kupfer oder nur mit Schutzlack 7. Silberverbindungen • Stabilste Oxidationsstufe: +1 • Oxidationsstufen +2, +3 sind selten (Bsp.: AgIIF2, AgIAgIIIO2) 0,7991V 1,980 V Ag Ag Ag2 • Elektronenkonfiguraton des Ag+: 4d10 • Farblos und diamagnetisch • Koordinationszahl in Ag(I)-Komplexen: 2 (lineare Anordnung der Liganden, Bsp.: [Ag(CN)2]-) • Lösliche Ag(I)-Salze: AgF, AgNO3, AgClO4 • Der Rest: schwerlöslich (relevant: Silberhalogenide) 7. Silberverbindungen Silbernitrat – AgNO3 • Wichtigstes Silbersalz • Ausgangsprodukt zur Herstellung aller anderen Silberverbindungen • Gut wasserlöslich (215g/100g Wasser bei 20°C) • Darstellung: Auflösen von Silber in Salpetersäure: 0 +5 ( aq) 3Ag(s) HNO 3 3H3O +1 ( aq) 3Ag +2 NO(g) 5H2O • Wirkt auf der Haut oxidierend und ätzend, bildet schwarze Flecken. „Höllenstein“: Anwendung in der Medizin zur Entfernung von Warzen und Wucherungen Bildung von Ag (schwarz) und HNO3 7. Silberverbindungen Schwerlösliche Silberhalogenide Darstellung: - Aus den Elementen - Durch Fällung aus AgNO3-Lösung mittels Halogenid Eigenschaften: Farbe Löslichkeitsprodukt KL [mol2/L2] AgCl Weiß 1,7 ·10-10 AgBr Hellgelb 5 ·10-13 AgI 8,5 ·10-17 Gelb • Kovalenter Charakter nimmt mit zunehmender OZ zu (HSAB): abnehmende Löslichkeit Farbvertiefung (Charge-Transfer) • Lichtempfindlichkeit 7. Silberverbindungen Versuch 8: Lichtempfindlichkeit von AgBr • Kolloidale AgBr-Lösung (in Gelatine): Kein Licht +1 -1 AgBr( s) Licht h (100 ,4kJ / mol) 0 0 Ag( s) 21 Br2( aq) • Anwendung in der Schwarz-Weiß-Fotografie 8. Alltagsrelevanz – Schulrelevanz? Akkumulatoren Fotografie Recycling (Röntgenfilme, Elektroschrott) Elektronik, Elektrotechnik Haushalt (Trinkwasserfilter, Besteck) Schmuck Medizin – Ende –