IUGR
Werbung
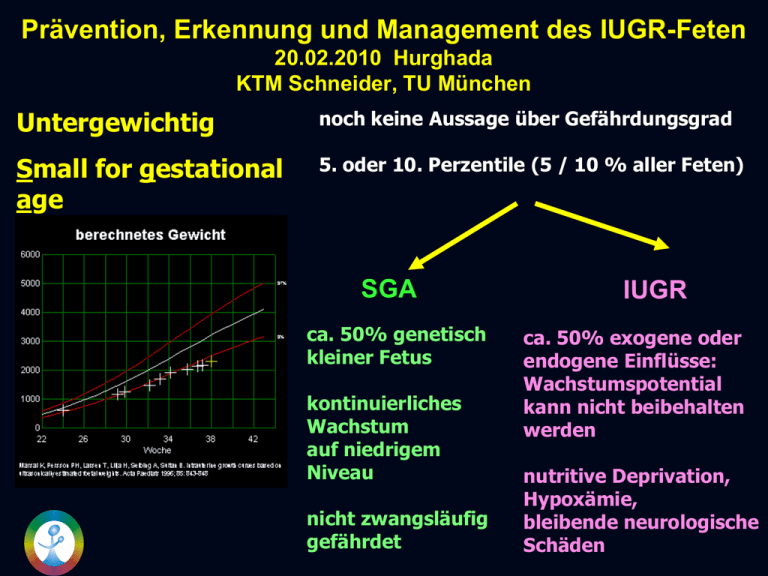
Prävention, Erkennung und Management des IUGR-Feten 20.02.2010 Hurghada KTM Schneider, TU München Untergewichtig noch keine Aussage über Gefährdungsgrad Small for gestational age 5. oder 10. Perzentile (5 / 10 % aller Feten) SGA ca. 50% genetisch kleiner Fetus kontinuierliches Wachstum auf niedrigem Niveau nicht zwangsläufig gefährdet IUGR ca. 50% exogene oder endogene Einflüsse: Wachstumspotential kann nicht beibehalten werden nutritive Deprivation, Hypoxämie, bleibende neurologische Schäden IUGR symmetrisch / asymmetrisch Zellhyperplasie Zellhypertrophie Zellgröße > 16. SSW Zellzahl - 16.SSW (irreversibel) Intelligenzdefekte Symmetrische IUGR (30%) Asymmetrische IUGR (70%) (reversibel) Hemmung der Zellproliferation Chron. Zentralisation Chromosomale Aberrationen Fehlbildung virale Infektionen (CMV) Drogen, Alkohol mütterliche Erkrankung – gefäßrelevant Path. Plazentaveränderungen Praeeklampsie FW-Menge Intrauterine Retardierung (IUGR) Kurzzeitmorbidität Langzeitmorbidität Hypoxie / Azidose KHK* Wachstumsdefizit . (20%) Polyglobulie Art. Hypertonie Sprachentwicklung (30%) Diabetes m. II Neurol. Defizite (40%) Metabol.Syndrom Hypoglykämie Letalität 4 - 8 fach *Barker DJ. The long-term outcome of retarded fetal growth. Clin Obstet Gynecol 1997; 40:853-63 Präventivansatz: Untergewichtigenrate und Mutteralter* % Jahre * Daten der PAG 1995-1997, n= 1.7 Millionen, Voigt und Schneider, 2001, Geburtsgewicht ≤ 2499 g Gebäralter > 35 Jahre * % * Daten der PAG 1981-2005 Rauchen und Untergewichtigenrate* % 14,3 15 11,3 9,6 10 8,4 6,2 5 Nichtraucher 64.426 79.142 29.094 35.109 1-5 6 -10 11 - 15 16 - 20 0 8.509 21 – 60 Zig./Tag * Daten der PAG 1995-1997, n= 216.280 Raucherinnen vs. 716.112 Nichtraucherinnen in der Schwangerschaft, Voigt und Schneider, 2000 Erkennung des SGA - Feten mittels Ultraschall* UItraschallparameter Pos. Prädiktionswert Plazentagrading Femurlänge 16 % 19 % Biparietaler Kopfdurchmesser 33 % Fetales Schätzgewicht 45 % Oligohydramnion 55 % Kopf- / Abdomenumfang 62 % Metaanalyse aus prospektiven Studien (1975-2010) Verbesserte Erkennung des SGA - Feten * Individuelle Schätzgewichte unter Einbeziehung von: • Mütterl. Länge • Mütterl. Ausgangsgewicht FP-Rate - 25% • Fetales Geschlecht FN-Rate - 25% • Ethnische Herkunft Gardosi et al. Lancet, 1992 Materno - fetale Gefäßanbindung A. uterina niederer Widerstand Trophoblastinvasion DS Arteria uterina Prefumo Human Reprod 2004; 19(1):206-9 High-Risk Erkennung Doppler-Screening in den Aa. ut. high risk ca. 20. SSW Autor Jahr Harrington 1996 1326 Frusca 1997 456 Mires et al. 1998 Kurdi et al. 1998 Jacobovitz 1998 n SSW notch 19-21/24 bilat. 77% Sens. (PPIH), PPV 29% 20-24 bilat. In 78% adverse outcome 6579 18-20/22-24 bilat. In 52%, pers: 72%, PPV: 27% 1092 19-21 ø OR 0.11 (PPIH) bilat. OR 12.8 (PPIH) unilat. In 42% adverse outcome bilat. In 95% adverse outcome ø In 3% adverse outcome 492 3. Trim. Präeklampsie, IUGR Albaiges et al. 2000 1780 23 bilat. In 32% PPIH, in 21% IUGR Papageorghiou 2004 7851 22-24 bilat. In 12% PPIH, 30% IUGR Gomez 2006 870 11-22 bilat. / PI OR 10.7 (PPIH) •Overall: ca. 21.000 bilat. Sens. 72-95%, PPV bis 32% IUGR Wahrscheinlichkeit 6 x erhöht SIH > PE > IUGR > FG IUGR Prävention mit low dose ASS Präeklampsie 17 % (12-25 %) high risk 27 % (17-36 %) mod. risk 15 % Erkrankungsbeginn verzögert 8% schwere Krankheitsverläufe reduziert perinatale Mortalität vermindert 14 % SGA/IUGR 10 % Plazentalösung n.s. *Cochrane database Syst Rev 2010 N: 36500 51 trials (FG<37+0) High risk Low dose aspirin nach path. Art ut. Doppler 20. SSW Design: Prospektive, randomisierte Managementstudie* n =1022 Art ut. DS 17-23 SSW 216 pathol. 103 100 mg ASS 113 Kontrolle IUGR < 3. P. / Präeklampsie n.s. Schwere Kompl. OR 0.43 (CI 0.21-0.84) Alle Kompl. OR 0.41 (CI 0.35-0.45) •Harrington K, Kurdi W, Aquilina J, England P, Campbell S, Ultrasound Obstet Gynecol 2000;15:13-8 ASS ab ersten Trimenon? n = 139 high risk Schwangerschaften Bilat. Notch / PI > 90. P. 14-16 SSW 74 100 mg ASS 19% IUGR 8% schwere Form Ebrashi et al. Croat Med J. 2005 Oct;46(5):826-31 65 Plazebo 32% IUGR 22% schwere Form Frühzeitige Erkennung des SGA - Feten (1. Trimenon)* 11-14 SSW prospektiv n=3010 Einlingsschwangerschaften 377 spätere SGA < 10th Perz. Aa. ut. Path. 2445 SS ut. DS: o.B. SGA - PE (n=252) IUGR + PE (n=27) IUGR > 37 SSW (n=62) IUGR < 37 SSW(n=36) ROC 0.602 0.776 0,687 Vorhersage IUGR + Präeklampsie = besser als SGA / IUGR alleine ! Melchiorre et al. Ultrasound Obstet Gynecol. 2009 May;33(5):524-9. 0.708 Uteriner Doppler III. Trimenon bei IUGR N = 217 IUGR Feten Median 38 SSW (25-42)* PI bzw. RI / notch in Aa. ut. bester Parameter für Prädiktion schlechtes outcome *Gosh et al. J Matern Fetal Neonatal Med. 2006 Sep;19(9):551-5 Notch im 3. Trimester & outcome* N = 570 Schwangere mit Präeklampsie: Doppelseitiger notch bzw. Widerstandserhöhung in Aa. ut. korrelieren mit ungünstigem outcome Aber: Nur 1/3 der Präeklampsiepatienten weisen diese Veränderungen im 3. Trimenon auf!! Li et al. Ultrasound Obstet Gynecol. 2005 May;25(5):459-63 Outcome Prognose in Abhängigkeit von RI Art. umb. + Aa.ut* Prospektive Untersuchung an 353 FGR - Feten Path. Aa. ut. DS in 120 (33.4%) Fällen Path. Art. umb. in 102 (28.4%) Fällen Beide Gefäßpathologien korrelierten gleichermaßen mit schlechtem “perinatal outcome” auch in den Fällen in denen nur die Aa. uterinae pathologisch waren! Gosh et al. BJOG. 2009 Anpassungsmaßnahmen des IUGR - Feten Maßnahme Konsequenz Utilisierung der Leber Glykogenreserven Abnahme Bauchumfang Reduktion Bewegungsdauer Energieeinsparung Blutumverteilung Erhalt der Vitalfunktionen Retikulozytenvermehrung mehr Sauerstoffträger Behandlungsansätze bei IUGR* „Side effects“ Methode Wirkprinzip Hämodilution Mikrozirkulation Niedrige HWZ, Lungenödem, RES 1 TNS / PDA Sympathikolyse Kurzfristig, RR NO Perfusion RR Glukose Substratangebot O2-Verbrauch , Lactat Aminosäuren Substratangebot Harnstoff , NH3 , pO2 ,pH Proteine Substratangebot FG und PNM O2 Oxygenierung VO2 nach Absetzen, Blutumvert. IVH? 7 2 3 , pH 4 5,8 6 1 Klein et al. 1991 5 Lawrence et al. 1982, Karsdorp et al. 1982, Philipps et al. 1984 2 Kubista et al. 1989, Schneider et al. 1992 6 Benny et al. 1978, Metcoff et al. 1981, Carlton et al. 1984 3 Campbell et al. 2000 7 Bekedam et al. 199, Arduini et al. 1992 4 Rush et al. 1989 8 Winer et al. 2009 Fetale Hypoxämie / Azidose ZNS-Dysfunktion Chemorezeptorenstimulation Spätdezelerationen Motorik Fetale Atmung Fetale Bewegung Hypotonie Blutflußumverteilung Blutflußabnahme Blutflußzunahme Nieren (Oligurie) Lunge Darm Gehirn Herz Nebenniere Ermittlung des Amniotic fluid index (AFI) 1 cm 4 cm AFI = 8 cm < 5 = path. 1 cm 2 cm IUGR Management Trial: DS versus CTG* Parameter DS (n = 214) CTG (n = 212) P Untersuchungsanzahl 4.2 8.2 p<0.01 Hospitalisation (ø Tage) 31.3 45.5 p<0.01 Einleitung 10.3% 21.7% p<0.01 Sectio (fetal distress) 5.1% 14.2% p<0.01 NICU 35.5% 43.4% p<0.01 *Schwedische Multicenterstudie, Almström et al. Lancet 1992 ;340:936-40 Dopplersonographie bei Risikoschwangerschaften 36.2% BAQ Daten 2008 Kineto – Cardiotokogramm (K-CTG) - Algorhythmus Kindsbewegungen durch US verifiziert Fetale Körperbewegungen Fetale Armbewegungen Fetale Beinbewegungen Fetale Atembewegungen Fetale Kopfbewegungen Fetales Kindsbewegungsprofil K-CTG 32+5 SSW K-CTG 37+6 SSW Materno - fetal Feto - maternal Arteria uterina Arteria umbilicalis Fetal Aorta Arteria cerebri media Ductus venosus Vena umbilicalis A. uterina Spätes I. Trimenon RI / PI Signifikant Notch bilateral Notch (verzögerte oder einseitige Normalisierung) PE SGA / IUGR FG / IUFT Geburtsgewicht Vorzeitige Lösung Kein Notch SIH, IUGR, (I.Trimenon) 1/3 Normkollektiv Harrington 1997 Martin 2001 Hollis 2003 Vorzeitige Lösung Carbillon 4/03 Chronische Hypoxämie Chemorezeptoren Aortenbogen Kreislaufzentralisation (physiologische Blutumverteilung, Autoregulation) „SPARING“ Vaskulärer Widerstand diastolische Flußgeschwindigkeit Verbesserte Perfusion Gehirn cerebrale Durchblutung z.T. nur intermittierend Myokard Coronargefäße Nebenniere -gefäße Darstellbar, anhaltend „sparing“: später Indikator Brainsparing IUGR A. cerebri media nur intermittierend Brainsparing dann „Normalisierung“ = Dekompensation Hinweis auf terminalen Breakdown der Autoregulation A. cerebri anterior Brainsparing persistierend besser korreliert mit perinatal outcome (Frontalhirn anhaltend bevorzugt perfundiert) Dubiel UOG 2002; 10:117-121 Überwachungsinstrumente - chron. Dekompensation US Wachstum Fruchtwassermenge Plazentamorphologie Behavioral states Westergard et al. Ultrasound Ob Gyn 2001 Zeitsequenz der Testpathologie vor der Dekompensation - 21 Tage path. art. Doppler red. Kindsbewegungsdauer red. Fruchtwassermenge - 14 Tage Brain sparing Effekt - 7 Tage path. CTG, zero flow red. KBW-Zahl - 3 Tage n= 52 IUGR Feten < 5. Perzentile Gnirs, Schneider 1996 red. Tonus Einschlusskriterien EUROGRIT-Studie • Gestationsalter zwischen 24. und 36. SSW • Wachstumsretardierter, gefährdeter Fet • Unsicherheit des Geburtshelfers sofortige Entbindung: Ja? Nein? EUROGRIT – Ergebnisse* • randomisiert 548 Mütter (15**) 588 Kinder (18**) • sofortige Entbindung 296 • aufgeschobene Entbindung 292 • 2-Jahres-Outcome erhalten 573 • sofortige /verzögerte Entb. Dt 4,7 d 2,3 d * Lancet 2004;364:513-20. The GRIT Study group * *Patienten, Abteilung Perinatalmedizin r. d. Isar; München 24.-30. SSW 31.-36. SSW EUROGRIT Entbindungsmodus und Kurzzeit follow up Entbindung sofort aufgeschoben Sectio 93% 81% Apgar 5 min< 7 7 % 5 % Totgeburt + neonat. Tod 12% 11% Mortalität vor Entlassung 9,1% 8,3% * Lancet 2004;364:513-20. The GRIT Study group Neonatale Morbidität EUROGRIT-Studie Entbindung sofort aufgeschoben Intubation 30% 19% NEC 6% 4% Hirnblutungen 24,5% 23,5% Krampfereignisse 2% 1% PVL/ Ventrikulomegalie 16% 14% * Lancet 2004;364:513-20. The GRIT Study group Follow up nach 2 Jahren EUROGRIT Studie* Entbindung sofort aufgeschoben (n=290) (n=283) Mortalität 12% (9,1%) 11% (8,3%) normale Entwicklung 81% 84% schwere Behinderung 7% 4% Cerebralparese 5% 1% Griffith´s DQ < 70 5% 4% * Lancet 2004;364:513-20. The GRIT Study group Beeinflussung von zero flow in der Art. umb. durch Corticosteroide* 92 IUGR Feten mit zero flow + Corticosteroidgabe 63% passager zero flow Mütterl . Vorerkrankung Beatmung Beatmungsdauer (Tage) O2-Bedarf (Tage) Robertson et al. ObGyn 2009 37% persist. zero flow 24% 73% 4 4 Effekt hält 24-48 h an! 59% 94% 30 45 Doppler CRT Art. umb. in „high risk“ Kollektiven Erstautor Jahr Trudinger Perinatale Mort. n Sign. 1987 289 p=0.17 Tyrell 1990 789 p=0.33 Hofmeyr 1991 1686 p=0.27 Newnham 1991 2231 p=0.26 Almstrom 1992 2657 p=0.13 Johnstone 1993 4986 p=0.11 Pattison 1994 5198 p=0.10 Omzigt 1994 6838 p=0.01 0 Metaanalyse n=8 0.5 1 1.5 2 24.674 sign. Reduktion der PNM im high risk Kollektiv Prospektive randomisierte, klinisch kontrollierte Studien Follow up in Abhängigkeit der Flußmusterpathologie (Art. umb., ACM) Autor Jahr n Muster Nachbeob. Baschat et al. 2009 20 REDF 2 Jahre r=0.53 neurol. Dysfunktion Gerber et al. 2006 69 ARED 5 Jahre 18% neurol. Dysfunktion Kutschera et al. 2002 16/14 ARED/ACM 3-6 Jahre identisch schlechtes outcome Wienerroither et al. 2001 23 /38 ARED 7 Jahre Sign. Schlechtere intellekt. u. neuromot. Entwicklung gg.über Kontrollgruppe Skrablin et al. 2000 114 path. DS 3 Jahre 16% neurol. Dysfunktion Montenegro et al. 1998 88 ARED 5 Jahre 14% neur. Handicap Scherjon et al. 1996 105 ACM, UA 6 Mon beschleunigte Myelinisierung Valcomonico et al. 1994 ARED 18 Mon. 12% bei zero-, 35% bei reverse flow neurol. Handicap 20/40 Ergebnisse Leber: Intrahepatische Zweige Ductus venosus der Pfortader 3/4 des Blutvolumens (III.Trim.) 1/4 - 1/3 des Blutvolumens Weniger glatte Muskulatur Nährstoffe Fetaler Stress -Weniger Hypoxämie: a-adrenerge Rezeptoren Katecholamine Konstriktion der Gefäße Verminderter Blutfluss Blutvolumenfluss durch Leber Adaptationsmechanismus Vermehrter Blutfluss durch DV Hirn und Myokard Tschirikov M, Schröder H, Hecher K. 2006 Ultrasound Obstst Gynecol 27:452-461 •Bild A-wave Messun etc IUGR Dekompensation A wave (atriale Kontraktion) Geschwindigkeit reduziert negativ / reverse flow Doppler-flow Muster bei Hypoxie* Fetale Gefäße A.c.m. (distal) A.c.m. (proximal) Ac.ant. A.c. post. Carotis int. Carotis int. comm. Aorta A.umb. A.renalis A.iliaca ext. A. femoralis Pulmonal valve Aortic valve Mitral valve Tricuspidal valve Vena cava inf. Ductus venosus Vena umb. silent state early redistrib. late redistrib. decompens. (ADF) (RDF) (ADF) (RDF) (RDF) (Puls.) ARED flow - Begleitpathologie* n = 60; 24-34 SSW; ∆ t Diagnose Entbindung: 6 Tage (0-68) Tage ACM 97% IUGR 87% Art. ut. notch 85% AFI 80% Hyperechogener Darm 43% PE, HELLP D.V. ARED 35% 31% Art.umb. Zero flow 50% PNM 16 % Hayna et al. Dissertation Charite´Berlin 2003 D.V. ARED 31% PNM 22 % Art.umb. reverse flow 50% PNM 49 % Schwere IUGR Patholgisch relativ kurz vor Dekompensation, A.c.m.. A. umb / AEDF etwa gleichzeitig DV A. umb. / RF DV / RF Ao IUGR - Mortalität/Morbidität Abhängigkeit vom Gestationsalter Überleben Gesundes Überleben 2% Überleben 1% > 26 SSW über 50%, 2 Wo. später als AGA Gesundes Überleben > 28 SSW über 80% Überlebensrate in frühen Wochen steigt um 2% / Tag (<27.SSW) Entbindung möglichst ≥ 28.SSW Baschat ea Obstet Gynecol 2007;109,2,253-261 Zeitsequenz pathol. Dopplerbefunde bei IUGR* Studiendesign: prospektiv Kollektiv: 26 IUGR < 5. Perz. < 32 SSW Doppler: Art. umb. Art. cer. media, Ductus ven. CTG: Comput. System (Dawes Redman Kriterien) Entbindung: STV < 2.2 > 120 Min Frühe Veränderungen Späte Veränderungen (4-5 Tage) (15-16 Tage) Art. umb. RI (100%) Ductus ven. RF 40% Art. c.m. RI (90%) UA RF 38% Ductus ven. RI 18% 10% PNM Ferrazzi et al. Ultrasound Obstet Gynecol 19:140-46;2002 58% PNM IUGR - Überwachung CTG: Kurzzeitvariation - STV Abnahme physiolog. Fluktuation des autonomen Nervensystems verminderte Modulation der vagalen Aktivität •3,75 sec fetale Pulsintervaldifferenz Über 3,75 sec gemittelt (1/16 min) Geringe Kurzzeitvariation (msec): • metabolische Azidose • schlechtes Outcome • IUFT < 3 msec Indikator für hohes Risiko Fallbeispiel • 45-jährige Schwangere, 29+4 SSW • IV-Gravida, III-Para • 2 unauffällige Spontangeburten + • 1 Frühgeburt 25. SSW vor 8 Jahren wegen vorz. Blasensprung, Kind völlig gesund • Jetzt SIH Fetale Aufnahmebefunde Ultraschall • Unauffällige Morphologie • Biometrie mit Wachstum < 3. Perzentile • Fruchtwassermenge unauffällig Doppler • RI A. umb. 95. Perzentile • RI A. cerebri med. normal • RI Ductus venosus 90.Perzentile STV • unauffällig Passagerer Nullfluss Umbilicalarterie + passager pulsatile Umbilicalvene Kurzzeitvariation (Dawes Redman) SSW 29+4 29+5 29+6 30+0 30+1 30+2 PI A. umb. Nullfluss Perzentile 95 nein 30+3 30+4 30+5 30+6 31+0 31+1 31+3 31+3 31+4 31+5 31+6 32+0 32+1 32+2 IUFT PI A. cer. med. PI Duct. venosus Perzentile Perzentile 95 60 90 nein 80 nein 10 5 90 passager 60 nein 50 95 75 nein 50 50 20 90 20 70 30 50 90 50 5 70 10 85 >95 passager 90 nein 95 nein >95 passager 70 nein 70 passager V. umb. CTG-STV ms pulsatil 6,9 6,1 nicht pulsatil nicht pulsatil 6,6 nicht pulsatil 5,9 6,8 pulsatil 5,6 nicht pulsatil 4,6 6,9 pulsatil 8,1 7,5 4,9 7,9 nicht pulsatil 7,2 8,3 nicht pulsatil 6,1 nicht pulsatil 5,3 5,5 pulsatil 7,8 6,2 nicht pulsatil 7,6 32+2 SSW Diagnose eines intrauterinen Fruchttods Pathologischer Befund: • Dystropher Fet ohne Fehlbildungen • Plazenta mit ausgedehnten, teils frischen Infarktbereichen Schlussfolgerung: • Völliges Versagen der STV Kurzzeitvariation • Art. Doppler und Ductus venosus nicht grenzwertig bzw. dauerhaft pathologisch • Passager pulsatile Nabelvene höher gewichten? Iatrogene Fehler in der Therapie / Überwachung des IUGR -Feten Cave ! Blutdrucksenkung medikamentös Spinalanästhesie Tokolyse mit Fenoterol Langzeitergebnisse zum Einsatz venöser Gefäße on going work TRUFFLE Study Trial of Rreduced U mbilical and F etal F low in L E urope - Study Teilnehmer 20 Europäische Zentren Studiendesign Randomisierte Interventionsstudie Kollektiv Kompromittierte IUGR – Feten 26-34 SSW Untersuchungsparameter STV (CTG) + frühe / späte Ductus venosus Pathol. Hauptzielkriterium Griffiths Entwicklungs - Score (Alter 2 Jahre ) Evidenzbasierte Überwachungsempfehlung für den IUGR - Feten (Cochrane)* Studiendesign: Metaanalyse random. Studien (2) Prüfparameter: BPS, NST, DS Art. umb., ACM, Aa. ut. A Vorgehen: Ergebnisse: 2 x wö. B 4 - tägig SSW Geburt + 4 Tage sign Einleitung + 25% sign Alle anderen outcome Parameter: n.s. *Grivell et al. Cochrane Database Syst Rev. 2009 Jan 21;(1):CD007113 SGA / IUGR - Überwachung SGA < 10. Perz. Biometrie, FW-Metrik, Doppler o.B. Doppler IUGR < 10. Perz. DS Acm, A.ut., venös? Doppler A.umb. RI > 90.P. Vorstellung Perinatalzentrum Trends - individueller Kurvenverlauf Ko 2 Wo. Ko. 1 Wo. Jeder Fet ist seine eigene Kontrolle ! Brain sparing, ARED flow stationär !!!, tägl. Kontrollen Vorgehen bei IUGR (TUM) Stationäre Aufnahme ab Brain sparing Erweiterte Diagnostik IntensivÜberwachung Karyotyp ? 2-3x K-CTG / STV (Oxford) Infektion ? 1xtägl. Doppler art. + venös Fehlbildung ? 1x wö. US (AFI; Biometrie) Lungenreifung 2x12 mg Celestan (ab 24.SSW) Sympt. Maßnahmen Bettruhe / Haes ? Nikotinverzicht Keine Fenoterol Tokolyse ! Echokardiogr. Entbindung insbes. bei > 28. SSW ARED - flow Entbindung insbes. bei: < 28. SSW pathol. venösem flow • Kurzzeitvariation<3.0msec bzw. Truffle - Studie • persist. Spätdez. Zusammenfassung IUGR Erkennung und Monitoring* Prävention Früherkennung (belastete Anamn.) Jüngeres Gebäralter, Rauchverzich früher ASS-Einsatz Uterine DS Biometrie 2.+3. Screening, DS Art. ut. Monitoring antepartual Doppler, AFI, STV KBW, Biometrie Outcome-Verbesserung Optimierung des Entb.zeitpunktes * Ergebnisse von CRT, eigene Untersuchungen, Cochrane Perinatal Database, 2010











