AC I (AC) – HS 2011 – Übungen + Lösungen – Serie 10
Werbung
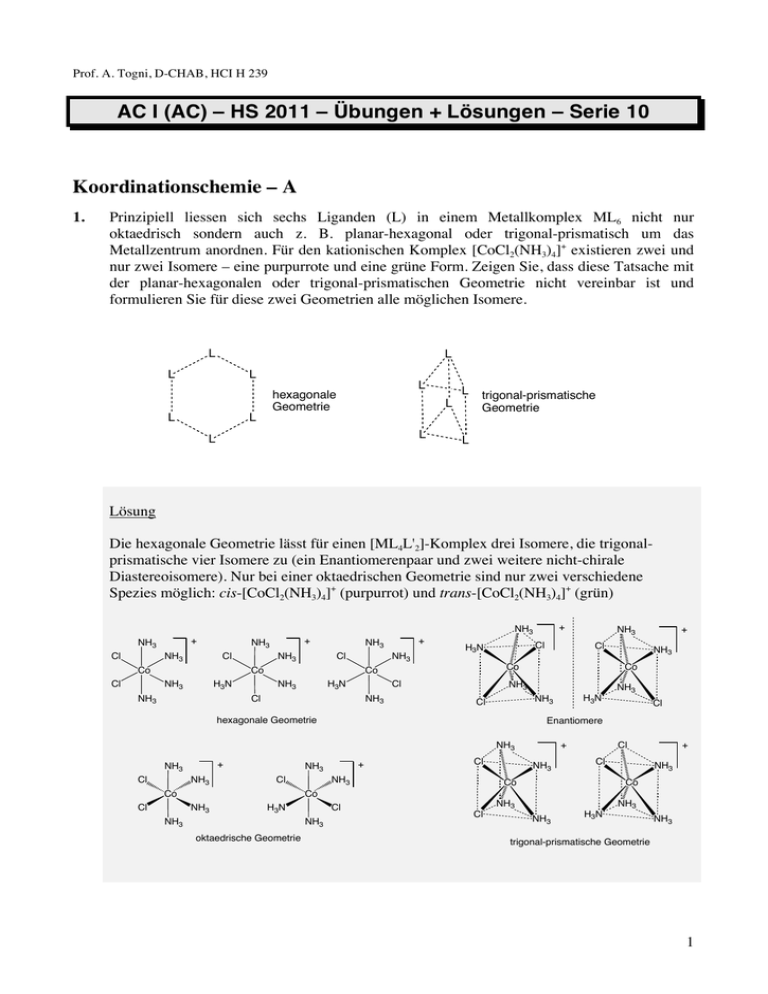
Prof. A. Togni, D-CHAB, HCI H 239 AC I (AC) – HS 2011 – Übungen + Lösungen – Serie 10 Koordinationschemie – A 1. Prinzipiell liessen sich sechs Liganden (L) in einem Metallkomplex ML6 nicht nur oktaedrisch sondern auch z. B. planar-hexagonal oder trigonal-prismatisch um das Metallzentrum anordnen. Für den kationischen Komplex [CoCl2(NH3)4]+ existieren zwei und nur zwei Isomere – eine purpurrote und eine grüne Form. Zeigen Sie, dass diese Tatsache mit der planar-hexagonalen oder trigonal-prismatischen Geometrie nicht vereinbar ist und formulieren Sie für diese zwei Geometrien alle möglichen Isomere. L L L L L L hexagonale Geometrie L L L L L trigonal-prismatische Geometrie L Lösung Die hexagonale Geometrie lässt für einen [ML4L'2]-Komplex drei Isomere, die trigonalprismatische vier Isomere zu (ein Enantiomerenpaar und zwei weitere nicht-chirale Diastereoisomere). Nur bei einer oktaedrischen Geometrie sind nur zwei verschiedene Spezies möglich: cis-[CoCl2(NH3)4]+ (purpurrot) und trans-[CoCl2(NH3)4]+ (grün) + NH3 + NH3 Cl NH3 Cl NH3 H3N Co Cl + NH3 NH3 Cl NH3 H3N NH3 Co NH3 + NH3 Cl NH3 Cl Co Co Cl Cl H3N NH3 + NH3 NH3 Co Cl + NH3 Cl Cl Enantiomere + NH3 Cl H3N NH3 hexagonale Geometrie NH3 Co NH3 Cl + NH3 Cl NH3 NH3 + Cl Cl Co NH3 Co Co NH3 H3N NH3 Cl NH3 oktaedrische Geometrie NH3 Cl NH3 NH3 H3N NH3 trigonal-prismatische Geometrie 1 2. Die zwei Ionen A und B weisen eine oktaedrische Geometrie an den Zentralatomen Co bzw. P auf. A und B, ein Kation und ein Anion, können ein Salz der Zusammensetzung AB bilden. Wieviele solche Salze gibt es und in welcher stereochemischen Beziehung stehen sie jeweils zueinander? – O + H2N O O NH2 O O Co O O P NH2 O O H2N O A B Lösung Die zwei Ionen sind chiral. Damit existieren je zwei enantiomere Formen, A und A' bzw. B und B'. Wenn ein Salz AB gebildet wird, ergeben sich vier Kombinationen, d.h. zwei diastereomere Enantiomerenpaare: AB und A'B' bzw. AB' und A'B sind enantiomer. Merke die Analogie zur Situation eines organischen Moleküls mit zwei unabhängigen, konstitutionell unterschiedlichen, stereogenen Zentren. O + H 2N O NH2 Co O O + NH2 NH2 O O Co NH2 NH2 H 2N O O NH2 A: chiral, 2 Enantiomere möglich (A und A') – – O O O O P O O O P O O O O O B: chiral, 2 Enantiomere möglich (B und B') 3. Verbindung 1 verhält sich als tetradentater Ligand. a) Machen Sie Aussagen über die Struktur der Komplexe mit der Zusammensetzung [CuCl(1)]+ (2), [FeCl2(1)] (3), [(Cu(1))2Br]+ (4), und [(FeF(1))2O]2+ (5), und geben Sie die Oxidationsstufe der Metallzentren an. b) Gibt es bei diesen Komplexen mögliche Isomere? Können sie chiral sein? Warum? N N N N 1 2 Lösung Komplex [2]+ zeigt eine trigonal-bipyramidale Geometrie mit dem zentralen Aminstickstoffatom des Liganden und dem Chloroliganden in axialer Position. Eine prinzipiell denkbare aber nicht beobachtete isomere Form hätte den Chloroliganden trans zu einem Pyridinylstickstoffatom. Das wäre aber eine stark verzerrte Struktur (keine 120°Winkel in der Ebene der trigonalen Pyramide möglich). + N N N Cu N N Cu N Cl + N N Cl 2, Cu(+II), trigonal bipyramidal Die Abbildung zeigt die Struktur des Kations 2 in Kristallen von [2]PF6 (siehe K. D. Karlin et al., Inorg. Chem. 1982, 21, 4106). Durch das Molekülion können drei Spiegelebenen gelegt werden. Diese Ebenen werden durch das Aminstickstoffatom, das Kupferatom und eines der drei Pyridinylstickstoffatome definiert. Das Vorhandensein von molekülinternen Spiegelebenen bedeutet, dass das Molekül nicht chiral ist. Komplex [3] nimmt eine oktaedrische N Geometrie an. Die zwei Chloroliganden N N können nur cis zueinander stehen. Auch N Fe Cl dieses Molekül ist achiral. Die einzige Cl interne Spiegelebene wird durch das Eisenatom, die zwei Chloratome und zwei 3, Fe(+II), oktaedrisch trans-ständigen Stickstoffatome definiert. (Abgebildete Kristallstruktur: D. Mandon et al., Inorg. Chem. 2002, 41, 5364) Bei Komplex [4]+ liegt eine sehr ähnliche strukturelle Situation vor, wie bei [2]+. Zwei identische spiegelsymmetrische Cu(1)-Einheiten teilen sich einen verbrückenden Bromoliganden. Die Kristallstruktur des Salzes [4]BPh4 zeigt, dass die Cu-Br-Cu-Einheit gewinkelt ist (117.5°, siehe W. T. Eckenhoff, T. Pintauer, Inorg. Chem. 2010, 49, 10617). Durch Rotation um die Cu–Br-Bindungen sind Konformationen zugänglich, die den ganzen Komplex spiegelsymmetrisch, d.h. achiral machen. + N N N Cu N Br N N Cu N N 4, Cu(+I), trigonal bipyramidal, µ2-Br 3 Komplex [5]2+ hat strukturelle Gemeinsamkeiten mit [3] und [4]+. Er zeigt eine oktaedrische Geometrie an den zwei Fe(+III)-Zentren und enthält einen verbrückenden Oxoliganden (O2–). Die Atome O und F stehen jeweils cis zueinander, können aber innerhalb einer Einheit in ihrer Position gegeneinander vertauscht werden. Das ergibt drei mögliche Isomere mit dem Oxoliganden trans zum Aminstickstoffatom oder trans zu einem Pyridinylstickstoffatom. Die drei Möglichkeiten können in diesem Sinne als (trans,trans), (cis,cis), (trans,cis) und (cis,trans) bezeichnet werden, wobei die Isomere (trans,cis) und (cis,trans) äquivalent sind. Jede FeF(1)Einheit ist spiegelsymmetrisch. In Analogie zu Komplex [4]+ sind auch hier Konformationen zugänglich, die gesamtspiegelsymmetrisch sind, also auch achiral. In der Kristallstruktur von [5](BF4)2 findet man nur die (trans,cis)-Form, die eine nahezu lineare Fe–O–Fe-Einheit mit einem Fe-O-Fe-Winkel von 176.1° aufweist (siehe K. S. Min et al., Inorg. Chim. Acta 2007, 360, 1854). Die abgebildete statische Konformation des Molekülions 52+ im Kristall kann zwar als achiral angesehen werden, eine Drehung um eine Fe–O-Bindung würde aber die einzige interne Spiegelebene durch F-Fe-O-Fe-F aufheben und somit eine chirale Struktur ergeben. 4. Welche Komplexe sind chiral? CH3 – H3C Re ON OC PPh3 Cl I OC 1 Anmerkung: Fe O Fe Li O Br O Ph 2 M O CH3 Ph 3 4 bedeutet M(η5-C5H5), siehe Folie 7, Komplexe Lösung 1 ist chiral, das Re-Atom ist stereogen, analog zu einem stereogenen Kohlenstoffatom. Die vier verschiedenen Liganden sind tetraedrisch angeordnet. 2 ist nicht chiral, obwohl die vier Liganden tetraedrisch angeordnet sind, wie in 1. Zwei sind allerdings identisch (CO). Eine interne Spiegelebene wird durch die Atome Fe, I und das Zentrum des Cp-Liganden definiert. 3 ist chiral, es enthält keine interne Spiegelebene. Strukturell verhält sich dieser Komplex wie eine organische spiro-Verbindung. 4 4 ist chiral. Auch hier ist keine interne Spiegelebene vorhanden. Man spricht bei solchen 1,2disubstituierten Ferrocenen von “planar-chiralen” Verbindungen. 5. Bei Platin in der Oxidationsstufe 0 lassen sich mit Phosphinliganden Komplexe herstellen und isolieren, die unterschiedliche Koordinationszahlen (KZ) aufweisen. Tricyclohexylphosphin (PCy3), Triethylphosphin (PEt3) und Trimethylphosphin (PMe3) bilden die Komplexe [Pt(PCy3)2] (1), [Pt(PEt3)3] (2) und [Pt(PMe3)4] (3). Erklären Sie, warum die verschiedenen Phosphine zu verschiedenen bevorzugten KZ führen und machen Sie Aussagen über die Geometrie der Komplexe 1-3. Lösung Die verschiedenen bevorzugten Koordinationszahlen bei Pt(0)-Komplexen mit Phosphinliganden sind auf den sterischen Anspruch (Grösse) der Ligaden zurückzuführen. Der sterische Anspruch nimmt hier von PCy3 zu PEt3 zu PMe3 ab. Entsprechend kann die Koordinationszahl zunehmen. 1 ist linear (Winkel(P-Pt-P) = 180°). 2 ist trigonal planar (Winkel(P-Pt-P) = 120°). 3 ist tetraedrisch. 5