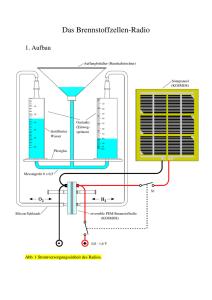
Brennstoffzelle Chemische Reaktion Das Prinzip der Brennstoffzelle
Werbung

Brennstoffzelle Eine Brennstoffzelle ist eine galvanische Zelle, die die chemische Reaktionsenergie eines kontinuierlich zugeführten Brennstoffes und eines Oxidationsmittels in elektrische Energie wandelt. Im Sprachgebrauch steht Brennstoffzelle meist für die WasserstoffSauerstoff-Brennstoffzelle. Eine Brennstoffzelle ist kein Energiespeicher, sondern ein Wandler. Die Energie zur Stromproduktion wird in chemisch gebundener Form mit den Brennstoffen zugeführt. Eine Brennstoffzelle besteht aus Elektroden, die durch eine Membran voneinander getrennt sind. Die Elektrodenplatten bestehen meist aus Metall. Sie sind mit einem Katalysator beschichtet, zum Beispiel mit Platin oder mit Palladium. Als Elektrolyten können beispielsweise gelöste Laugen oder Säuren dienen. Die Energie liefert eine Reaktion von Sauerstoff mit Wasserstoff. Beide Reaktionspartner werden über die Elektroden kontinuierlich zugeführt. Die gelieferte Spannung liegt theoretisch bei 1,23 V für die Wasserstoff-Sauerstoff-Zelle bei einer Temperatur von 25 °C. In der Praxis werden jedoch nur Spannungen von 0,5–1 V (experimentell auch darüber) erreicht. Die Spannung ist vom Brennstoff, von der Qualität der Zelle und von der Temperatur abhängig. Um eine höhere Spannung zu erhalten, werden mehrere Zellen zu einem Stapel in Reihe geschaltet. Unter Last bewirken die chemischen und elektrischen Prozesse ein Absinken der Spannung. Chemische Reaktion Das Prinzip der Brennstoffzelle wurde 1838 von Christian Friedrich Schönbein anhand der Reaktion 2H2 + O 2 → 2H2O erfunden. Viele Brennstoffzellentypen nutzen heutzutage diese Reaktion als „kalte Verbrennung“ zur Gewinnung elektrischer Energie. Eine solche Brennstoffzelle verwendet in der Regel Wasserstoff als Energieträger und erreicht einen Wirkungsgrad von etwa 60 %. Das Kernstück ist eine Polymermembran, die ausschließlich für Protonen durchlässig ist . Das Oxidationsmittel, für gewöhnlich Luftsauerstoff, ist dadurch räumlich vom Reduktionsmittel getrennt. Der Brennstoff, hier Wasserstoff, wird an der Anode katalytisch unter Abgabe von Elektronen zu Protonen oxidiert. Diese gelangen durch die Ionen-AustauschMembran in die Kammer mit dem Oxidationsmittel. Die Elektronen werden aus der Brennstoffzelle abgeleitet und fließen über einen elektrischen Verbraucher, z.B. eine Glühlampe, zur Kathode. An der Kathode wird das Oxidationsmittel, hier Sauerstoff, durch Aufnahme der Elektronen zu Anionen reduziert, die unmittelbar mit den Wasserstoffionen zu Wasser reagieren. Brennstoffzellen mit einem solchen Aufbau heißen PolymermembranBrennstoffzellen, PEMFC (für Polymer Electrolyte Membrane Fuel Cell) oder auch PEFC (für Proton Exchange Membrane Fuel Cell). Die verwendeten Membranen sind saure Elektrolyten. Quelle(http://de.wikipedia.org/wiki/Brennstoffzelle)