gute gründe für nOXAfIL
Werbung

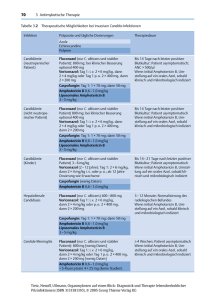
5 gute Gründe für NOXAFIL Noxafil®: Ihr starker Partner in der Prophylaxea und Therapieb von Pilzinfektionen a.Prophylaxe invasiver Mykosen für Risikopatienten mit Remissions-induzierender Chemotherapie bei akuter myeloischer Leukämie (AML) oder myelodysplastischen Syndromen (MDS) mit erwarteter längerfristiger Neutropenie oder bei Hochdosis-Immunsuppressions-Therapie bei Graft-versus-Host Disease (GvHD) nach hämatopoetischer Stammzelltransplantation (HSCT). Fachinformation Stand Oktober 2011. b.Behandlung von: invasiver Aspergillose bei Therapieresistenz oder Unverträglichkeit gegen Amphotericin B oder Itraconazol; Fusariose bei Therapieresistenz oder Unverträglichkeit gegen Amphotericin B; Chromoblastomykose und Myzetom bei Therapieresistenz oder Unverträglichkeit gegen Itraconazol; Kokzidioidomykose bei Therapieresistenz oder Unverträglichkeit gegen Amphotericin B, Itraconazol oder Fluconazol. Primärtherapie der oropharyngealen Candidose bei schwer erkrankten oder immunsupprimierten Patienten mit erwartetem schwachem Ansprechen auf topische Therapie. Fachinformation Stand Oktober 2011. 1.Grund Wirkspektrum von Noxafil®2 ns a lbic Noxafil®: Breites Wirk- und Indikationsspektrum1,2 C. a ta ra lab C. g ei rus C. k alis ic op . tr C 1. Candida-Spezies Zulassungsstatus von Noxafil®1 • Prophylaxe von invasiven Pilzinfektionen bei Risikopatienten mit AML/MDS • Prophylaxe von invasiven Pilzinfektionen bei Risikopatienten mit GvHDd • First-Line-Therapie tus iga m . fu c A p. sp cor Mu • Second-Line-Therapie Ein guter Grund für Noxafil®: Starke Wirksamkeit in der Prophylaxea und Therapie von Pilzinfektionenb bei klinisch relevanten Stämmen ger ni A. . pp ms iu sar Fu 3. Seltene Keime Sensibel Intermediär Grafik erstellt von MSD nach Daten aus 2. NOXAFIL darf nicht zusammen mit Arzneimitteln verabreicht werden, die Substrate für CYP3A4 sind und bekanntlich das QTc-Intervall verlängern. 1.NOXAFIL® Fachinformation. Stand Oktober 2011 2.Lichtenstern C et al. Antimykotische Therapie in der Intensivmedizin, Intensivmedizin up2date, 3: 21-40, ThiemeVerlag 2007. c.Zugelassen zur Prophylaxe invasiver Mykosen für Risikopatienten mit Remissions-induzierender Chemotherapie bei akuter myeloischer Leukämie (AML) oder myelodysplastischen Syndromen (MDS) mit erwarteter längerfristiger Neutropenie. d.Zugelassen bei Patienten nach hämatopoetischer Stammzelltransplantation, die aufgrund einer Graft-versus-Host Disease (GvHD) mit Hochdosis-Immunsuppressionstherapie behandelt werden. e.Oropharyngeale Candidose: Als Therapie der ersten Wahl bei Patienten, die eine schwere Erkrankung haben oder immunsupprimiert sind und bei denen ein schwaches Ansprechen auf eine topische Therapie erwartet wird. f.Second-line Zulassung für die Behandlung von invasiver Aspergillose, Fusariose, Chromoblastomykose und Myzetom, Kokzidioidomykose. us rre te A. 2. Aspergillus-Spezies bei oropharyngealer Candidosee bei invasiver Aspergillose, Fusariose, Chromoblastomykose und Kokzidioidomykosef s vu fla A. C. l e sis silo nia ta usi C. ap par 2.Grund Signifikant geringere Inzidenz an invasiven Pilzinfektionen3 Noxafil®: Starke Wirksamkeit in der antimykotischen Prophylaxe bei AML/MDS-Patienten3,g 10% p < 0,001 Inzidenz 8% Ein guter Grund für Noxafil®: Eine klinische Studie zeigte: Signifikant geringere Inzidenz an invasiven Pilzinfektionen (- 73%) und Aspergillosen (- 90%) im Vergleich zu Patienten mit Fluconazol/Itraconazol-Therapie.3 8,4% p < 0,001 (25/298) 6% 6,7% (20/298) 4% 2% 2,3% (7/304) 0% Alle invasiven Pilzinfektionen* Noxafil® 200 mg 3x täglich Grafik erstellt von MSD nach Daten aus 3. 0,7% (2/304) NOXAFIL ® 200 m 3x täglich mit d Mahlzeiten Fluconazol 400 1x täglich oder der Itraconazol 2x täglich Invasive Aspergillose Mittlere Therapiedauer: NOXAFIL ® 29d, Flu/Itra 25d Fluconazol 400 mg 1x täglich oder Itraconazol 200 mg 2x täglich * Nachgewiesene oder wahrscheinliche invasive Pilzinfektionen. Schwere Nebenwirkungen, die von den Prüfärzten als möglicherweise oder wahrscheinlich mit der Behandlung in Zusammenhang gebracht wurden, traten bei 19 Patienten (6%) in der Posaconazol-Gruppe auf sowie bei 6 Patienten (2%) in der Fluconazol oder Itraconazol Gruppe (p = 0.01) auf. Die häufigsten behandlungsbedingten Nebenwirkungen in beiden Gruppen waren gastrointestinale Beschwerden. 3. Cornely OA et al. N Engl J Med 2007; 356: 348-359. Posaconazole vs. Fluconazole or Itraconazole Prophylaxis in Patients with Neutropenia. Randomisierte Multizenterstudie zur antimykotischen Prophylaxe bei AML/MDS-Patienten (13 Jahre oder älter) mit prolongierter Neutropenie unter Chemotherapie. Von 602 Patienten erhielten 304 Posaconazol 3 x 200 mg/d, 240 Fluconazol 1 x 400 mg/d und 58 Itraconazol 2 x 200 mg/d. Mittlere Dauer der Prophylaxe: Posaconazol 29 Tage, Flu/Itra 25 Tage. Die Patienten wurden 100 Tage nach Randomisierung bzw. 30 Tage nach der letzen Dosis beobachtet. Primärer Endpunkt war das Auftreten einer bestätigten bzw. wahrscheinlichen invasiven Pilzinfektion. Die Studie zeigte, dass unter Noxafil signifikant weniger invasive Pilzinfektionen bzw. Aspergillosen auftraten im Vergleich zur Therapie mit Fluconazol/Itraconazol. g. Fachinformation Noxafil Stand Oktober 2011: Zugelassen zur Prophylaxe invasiver Mykosen bei Patienten, die eine Remissions-induzierende Chemotherapie bei akuter myeloischer Leukämie (AML) oder myelodysplastischen Syndromen (MDS) erhalten, die erwartungsgemäß zu einer längerfristigen Neutropenie führt, und bei denen ein hohes Risiko für die Entwicklung invasiver Mykosen besteht. 3.Grund Inzidenz an invasiven Pilzinfektionen4 Noxafil®: Starke Wirksamkeit in der antimykotischen Prophylaxe bei GvHD-Patienten4,h 10% p = 0,006 9,0% 8% (27/299) Inzidenz Ein guter Grund für Noxafil®: NOXAFIL® Patienten zeigten eine signifikant geringere Inzidenz an Aspergillosen (- 67%) im Vergleich zu Patienten mit Fluconazol-Therapie.4 p = 0,07 7,0% 6% (21/299) 5,3% 4% (16/301) 2% 2,3% (7/301) 0% Alle invasiven Pilzinfektionen* Noxafil® 200 mg 3x täglich Grafik erstellt von MSD nach Daten aus 4 NOXAFIL ® 200 m 3x täglich mit d Mahlzeiten Fluconazol 400 1x täglich Invasive Aspergillose Mittlere Therapiedauer: NOXAFIL ® 80 d, Fluconazol 77d Fluconazol 400 mg 1x täglich * Nachgewiesene oder wahrscheinliche invasive Pilzinfektionen bis Tag 112. Die gleichzeitige Verabreichung von NOXAFIL und Rifamycinantibiotika (Rifampicin, Rifabutin), bestimmten Antiepileptika (Phenytoin, Carbamazepin, Phenobarbitol, Primidon), Efavirenz, Vincaalkaloide und ähnliche Induzierer (z.B. Carbamazepin, Phonobarbital, Primidon) und Cimetidin sollte vermieden werden, sofern die Vorteile für den Patienten das Risiko nicht überwiegen. 4. Ullmann AJ et al. N Engl J Med. 2007; 356: 335-347: Posaconazole or Fluconazole for Prophylaxis in Severe Graft-versus-Host Disease. Randomisierte, doppelblinde Multizenterstudie zur antimykotischen Prophylaxe bei Patienten nach allogenetischer Stammzelltransplantation (13 Jahre oder älter und einem minimalen Körpergewicht von 34 kg) mit GvHD oder Immunsuppressionstherapie. Von 600 Patienten erhielten 301 Patienten Posaconazol 3 x 200 mg/d, 299 Fluconazol 1 x 400 mg/d. Mittlere Therapiedauer: Posaconazol 80 Tage, Fluconazol 77 Tage. Nach der Randomisierung wurden die Patienten 112 Tage bzw. bis zum Auftreten eines Protokoll-spezifischen Endpunktes behandelt. Primärer Endpunkt war das Auftreten einer bestätigten bzw. wahrscheinlichen invasiven Pilzinfektion. Die Studie zeigte, dass unter Noxafil-Therapie signifikant weniger Aspergillosen auftraten als unter Fluconazol-Therapie. Posaconazol war gleich effektiv wie Fluconazol in der Prophylaxe aller invasiven Pilzinfektionen. h. Fachinformation Noxafil Stand Oktober 2011: Zugelassen zur Prophylaxe invasiver Mykosen bei Empfängern einer hämatopoetischen Stammzelltransplantation (HSCT), die eine Hochdosis-Immunsuppressions-Therapie bei einer Graft-versus-Host Disease erhalten und bei denen ein hohes Risiko für die Entwicklung invasiver Mykosen besteht. 4.Grund Ein guter Grund für Noxafil®: Noxafil® zeigte eine signifikant höhere Ansprechrate von 42% im Vergleich zur Kontrollgruppe (26%, p = 0,006) bei der Therapie der refraktären invasiven Aspergillose.5 50% Ansprechrate (partiell oder komplett) Noxafil®: Starke Wirksamkeit in der antimykotischen Therapie der refraktären invasiven Aspergillose5,i Signifikant höhere Ansprechrate (n = 193)5 p = 0,006 40% 42% n =107 30% 26% 20% n = 86 10% 0% NOXAFIL ® Orale Suspension Externe Kontrollgruppe 5 800 mg/ Tag (in geteilten Dosen) Noxafil® orale Suspension, 800 mg/Tag (in geteilten Dosen) Externe Kontrollgruppe Grafik erstellt von MSD nach Daten aus 5. 47 (44%) der 107 Patienten in der Posaconazol Gruppe hatten Nebenwirkungen, die als Behandlungs-bedingt gewertet wurden. Diese inkludierten gastrointestinale Beschwerden, hepatische Nebenwirkungen und Ausschlag (4%). 5.Walsh TJ et al. Clin Infect Dis. 2007; 44: 2-12. Treatment of Invasive Aspergillosis with Posaconazole in Patients Who Are Refractory to or Intolerant of Conventional Therapy: An Externally Controlled Trial. Offene Multizenterstudie bei Patienten mit refraktärer invasiver Aspergillose und anderen Mykosen. 107 Patienten erhielten Posaconazol 800 mg/Tag (in geteilten Dosen). Die externe, retrospektiv zusammengestellte Kontrollgruppe (n = 86) wurde vor allem mit Amphotericin B, Amphotericin B-Lipidformulierungen und Itraconazol behandelt, was der Standardtherapie in den Jahren 1996-2001 (Zeitraum der Studie) entsprach. Per Protokoll wurden die Patienten für bis zu 372 Tage behandelt. Primärer Endpunkt war das Gesamt-Ansprechen nach Behandlungsende. In dieser Studie zeigte Noxafil eine signifikant höhere Ansprechrate im Vergleich zur Kontrollgruppe bei der Therapie der refraktären invasiven Aspergillose. i. Fachinformation Noxafil Stand Oktober 2011: Zugelassen zur Behandlung von invasiver Aspergillose bei Patienten, deren Erkrankung therapieresistent ist gegenüber Amphotericin B oder Itraconazol bzw. bei Unverträglichkeit dieser Arzneimittel. Second-line Zulassung für die Behandlung von invasiver Aspergillose 5.Grund CYP3A4 Azol-Antimykotikum Noxafil®: Gute Verträglichkeit und gutes Interaktionsprofil1 Inhibitor Substrat CYP2C9 Inhibitor Substrat CYP2C19 Inhibitor Substrat NOXAFIL®1 Posaconazol Diflucan®6 Fluconazol Einfache Anw endung in der K Gute Verträglichkeit in klinischen Studien • Sicherheitsdaten aus klinischen Studien von mehr als 2.400 Patienten.1 Keine Dosisanpassung bei Patienten • mit Nieren- bzw. leichter bis moderater Leberinsuffizienz.1 Gutes Interaktionsprofil durch geringe Wechselwirkungen mit CYP450-Enzymen1,6-8 *Zu weiteren Wechselwirkungen lesen Sie bitte die NOXAFIL® Fachinformation. 1. NOXAFIL® Fachinformation, Stand Oktober 2011. 6. DIFLUCAN® Fachinformation, Stand September 2011. 7. SPORANOX® Fachinformation, Stand September 2011. 8. VFEND® Fachinformation, Stand Juni 2011. ause. linik und zu H SPORANOX®7 Itraconazol Vfend®8 Voriconazol • Die Konzentrationen von Posaconazol werden wahrscheinlich nicht durch Inhibitoren von CYP450-Enzymen verändert.1* Hepatische Reaktionen (z. B. leicht bis mäßig erhöhte ALT, AST, alkaline Phosphatase, Gesamtbilirubin und/oder klinische Hepatitis) wurden während der Behandlung mit Posaconazol berichtet. Ein guter Grund für Noxafil®: Patientenfreundliche Anwendung, gute Verträglichkeit1, gutes Interaktionsprofil.1 Zur Optimierung der Absorption von NOXAFIL® Einnahme von Noxafil gemeinsam mit Aus guten Gründen von internationalen Fachgesellschaften empfohlen: Fetthaltiger Nahrung falls nicht möglich Nahrung falls nicht möglich Nahrungsergänzungsmittel / Sondernahrung falls nicht möglich Kohlensäurehältigen Getränken (zB. Cola) falls nicht möglich ECIL10 NCCN11 IDSA12 Neutropenische Patienten mit akuter myeloischer Leukämie (AML) oder myelodysplastischem Syndrom (MDS) AI 1 AI Patienten mit Graft-versus-HostReaktion (GvHD) nach hämatopoetischer Stammzelltransplantation (HSCT) AI 1 AI NOXAFIL® Prophylaxe gegen Schimmel- bzw. Hefepilze Weitere Option Empfehlung Keine Einnahme von Protonenpumpeninhibitoren, wenn möglich adaptiert nach 9. Krishna et al. Antimivrob Agents Chemother. 2009; 53:958-966. 9. Krishna G et al. Antimicrob Agents Chemother. 2009;53:958-966. 10. ECIL=European Conference on Infections in Leukemia. Maertens et al., Bone Marrow Transplantation 2011; 46: 709–718. 11. NCCN=National Comprehensive Cancer Network. 12. IDSA=Infectious Disease Society of America. Pappas et al., CID 2009; 48:503-535. Fachkurzinformation: Bezeichnung des Arzneimittels: Noxafil 40 mg/ml Suspension zum Einnehmen. Qualitative und quantitative Zusammensetzung: 1 ml Suspension zum Einnehmen enthält 40 mg Posaconazol. Dieses Arzneimittel enthält etwa 1,75 g Glucose pro 5 ml Suspension. Liste der sonstigen Bestandteile: Polysorbat 80, Simeticon, Natriumbenzoat (E211), Natriumcitrat-Dihydrat, Zitronensäure-Monohydrat, Glycerol, Xanthangummi, flüssige Glukose, Titandioxid (E171), künstliches Kirscharoma mit Benzylalkohol und Propylenglycol, gereinigtes Wasser. Anwendungsgebiete: Noxafil ist angezeigt zur Behandlung der folgenden Mykosen bei Erwachsenen: - Invasive Aspergillose bei Patienten, deren Erkrankung therapieresistent ist gegenüber Amphotericin B oder Itraconazol bzw. bei Unverträglichkeit dieser Arzneimittel; - Fusariose bei Patienten, deren Erkrankung therapieresistent ist gegenüber Amphotericin B bzw. bei Unverträglichkeit von Amphotericin B; - Chromoblastomykose und Myzetom bei Patienten, deren Erkrankung therapieresistent ist gegenüber Itraconazol bzw. bei Unverträglichkeit von Itraconazol; - Kokzidioidomykose bei Patienten, deren Erkrankung therapieresistent ist gegenüber Amphotericin B, Itraconazol oder Fluconazol bzw. bei Unverträglichkeit dieser Arzneimittel; - Oropharyngeale Candidose: Als Therapie der ersten Wahl bei Patienten, die eine schwere Erkrankung haben oder immunsupprimiert sind und bei denen ein schwaches Ansprechen auf eine topische Therapie erwartet wird. Therapieresistenz ist definiert als Progression der Infektion oder Ausbleiben einer Besserung nach mindestens 7 Tagen unter einer wirksamen antimykotischen Therapie in therapeutischer Dosierung. Noxafil ist ebenfalls bei folgenden Patienten zur Prophylaxe invasiver Mykosen angezeigt: - Patienten, die eine Remissions-induzierende Chemotherapie bei akuter myeloischer Leukämie (AML) oder myelodysplastischen Syndromen (MDS) erhalten, die erwartungsgemäß zu einer längerfristigen Neutropenie führt, und bei denen ein hohes Risiko für die Entwicklung invasiver Mykosen besteht; - Empfänger einer hämatopoetischen Stammzelltransplantation (HSCT), die eine Hochdosis Immunsuppressions-Therapie bei einer Graft-versus-Host Disease erhalten und bei denen ein hohes Risiko für die Entwicklung invasiver Mykosen besteht. Gegenanzeigen: Überempfindlichkeit gegen den Wirkstoff oder einen der sonstigen Bestandteile. Gleichzeitige Anwendung von Mutterkornalkaloiden. Gleichzeitige Anwendung der CYP3A4-Substrate Terfenadin, Astemizol, Cisaprid, Pimozid, Halofantrin oder Chinidin, da dies zu einer Erhöhung der Plasma¬konzentration der genannten Arzneimittel und dadurch zu einer QTc-Verlängerung und in seltenen Fällen zum Auftreten von Torsades de Pointes führen könnte. Gleichzeitige Anwendung der HMG-CoA-Reduktase-Inhibitoren Simvastatin, Lovastatin und Atorvastatin. Fertilität, Schwangerschaft und Stillzeit: Es liegen keine ausreichenden Informationen über die Anwendung von Posaconazol in der Schwangerschaft vor. Tierexperimentelle Studien haben eine Reproduktionstoxizität gezeigt. Das potenzielle Risiko für den Menschen ist nicht bekannt. Frauen im gebärfähigen Alter müssen während der Behandlung eine zuverlässige Verhütungsmethode anwenden. Posaconazol darf in der Schwangerschaft nicht angewendet werden, sofern nicht der Nutzen für die Mutter das potenzielle Risiko für den Fetus eindeutig überwiegt. Stillzeit: Posaconazol wird in der Milch säugender Ratten ausgeschieden. Der Übertritt von Posaconazol in die menschliche Muttermilch wurde nicht untersucht. Vor Beginn der Therapie mit Posaconazol muss abgestillt werden. Fertilität: Posaconazol hatte keine Auswirkung auf die Fertilität von männlichen Ratten bei einer Dosis bis zu 180 mg/kg (1,7-Faches des 2-mal täglichen Dosierungsregimes von je 400 mg basierend auf Steady-state-Plasmakonzentrationen bei gesunden Freiwilligen) oder weiblichen Ratten bei einer Dosis bis zu 45 mg/kg (2,2-Faches des 2-mal täglichen Dosierungsregimes von je 400 mg). Es liegen keine klinischen Erfahrungen in Bezug auf den Einfluss von Posaconazol auf die Fertilität beim Menschen vor. Inhaber der Zulassung: Merck Sharp & Dohme Ltd, Hertforad Road, Hoddesdon. Hertfordshire EN11 9BU. Vereinigtes Königreich. Abgabe: Rezept- und apothekenpflichtig. Pharmakotherapeutische Gruppe: Antimykotika zur systemischen Anwendung – Triazol-Derivate. ATCCode: J02A C04. Stand der Information: 06. November 2011. Weitere Angaben zu Dosierung, Art und Dauer der Anwendung, Warnhinweisen und Vorsichtsmaßnahmen für die Anwendung, Wechselwirkungen mit anderen Mitteln, Auswirkung auf die Verkehrstüchtigkeit und das Bedienen von Maschinen, Nebenwirkungen, Überdosierung, pharmakologische Eigenschaften und pharmazeutische Angaben sind der veröffentlichten Fachinformation zu entnehmen. Vor Verschreibung beachten Sie bitte die vollständige Fachinformation. Merck Sharp & Dohme Ges.m.b.H. EURO PLAZA Gebäude G, 5. Stock, Am Euro Platz 2, A-1120 Wien ® Eingetragene Handelsmarke © Urheberrechtlich geschützt für Merck Sharp & Dohme Corp., ein Unternehmen von Merck & Co., Inc., Whitehouse Station, NJ, U.S.A. 07-14-AINF-1047135-0000. Erstellt im Juli 2012. ® Aufteilung der Noxafil Dosis; 4 x 5 ml statt 2 x 10 ml täglich