NMR-Demobeispiele
Werbung
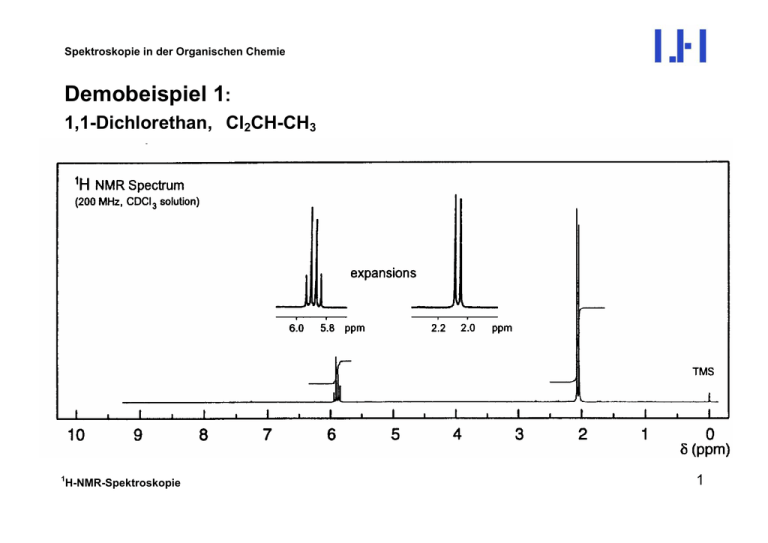
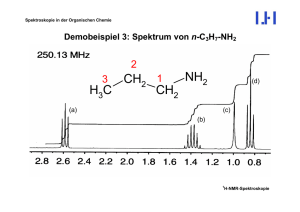
Spektroskopie in der Organischen Chemie Demobeispiel 1: 1,1-Dichlorethan, Cl2CH-CH3 1 H-NMR-Spektroskopie 1 Spektroskopie in der Organischen Chemie Demobeispiel 2: 1 H-NMR-Spektrum von Ethylether Et O CH2 CH2 linkes Signal: Integration für 2H; Multiplizität: Quartett (q) Æ 3 Kopplungspartner CH3 CH3 rechtes Signal: Integration für 3H; Multiplizität: Triplett (t) Æ 2 Kopplungspartner 1 H-NMR-Spektroskopie Spektroskopie in der Organischen Chemie Demobeispiel 3: Spektrum von n-C3H7-NH2 2 NH2 CH2 1 H3C CH2 3 (a) (d) (c) (b) 1 H-NMR-Spektroskopie Spektroskopie in der Organischen Chemie Signalzuordnung und Interpretation Beschreibung der vorhandenen Signale: (a) Triplett bei δ = 2.59, Integral entspricht 2H (b) Sextett bei δ = 1.338, Integral entspricht 2H (c) Singulett (verbreitert) bei δ = 0.99, Integral entspricht 2H (d) Triplett bei δ = 0.83, Integral entspricht 3H Es ist offensichtlich, dass Signal (d) der Methylgruppe (3) entspricht. Die Multiplizität zeigt, dass die Methylprotonen zwei Nachbar-Protonen, die an der Methylengruppe (2), haben (Triplett: m = 3 Æ n = 2). Signal (a) mit der mit Abstand größten chemischen Verschiebung sollte wegen der Elektrononegativität des Stickstoffatoms zu den Protonen der Methylengruppe (1) gehören. Auch dieses Signal ist ein Triplett; es gibt also auch hier zwei Nachbar-1H-Kerne (2). 1 H-NMR-Spektroskopie Spektroskopie in der Organischen Chemie Das Signal (b) (Methylengruppe 2) hat eine Mulitplizität von 6 (Sextett), hat also die erwarteten 5 Nachbarn. 2 NH2 CH2 1 H3C CH2 (2) 3 3J(1,2) 3J(2,3) Allerdings wird man nur dann ein Sextett erwarten, wenn beide Kopplungskonstanten, 3J(1,2) und 3 J(2,3) gleich sind (was hier der Fall ist). Wenn aber 3J(1,2) ≠ 3J(2,3), was häufig vorkommen kann, sollte das Signal ein dreifaches Quartett bzw. ein vierfaches Triplett sein, insgesamt also 12 Linien aufweisen. Bei 3J(1,2) = 3J(2,3) entartet dieses 12-Liniensignal jedoch zu dem beobachteten Sextett (siehe Abbildung links). 1 H-NMR-Spektroskopie Spektroskopie in der Organischen Chemie Bleibt die Frage, warum das Signal (c), das den beiden Protonen der Aminogruppe zuzuordnen ist, ein Singulett ist, obwohl es zwei erreichbare Kopplungspartner in der Methylgruppe (1) besitzt. Die Antwort liegt in der Tatsache, dass die Protonen einer Aminogruppe (ebenso wie in einer Hydroxygruppe) sehr schnell intermolekular austauschen. Das heißt, dass die Verweildauer eines Protons am N so kurz ist, dass ein Kopplungspartner den Spinzustand dieses NH-Protons nur eindeutig erkennen und nur den Durchschnittswert reflektiert. Das bedeutet, dass eine Kopplungsaufspaltung nicht erkennbar ist. Allerdings äußert sich der schnelle Austausch häufig in einer Verbreiterung des NH- (bzw. OH-) Signals. Intermolekularer Austausch kann durch ein stark komplexierendes Lösungsmittel, wie z. B. Dimethylsulfoxid-d6, so weit verlangsamt werden, dass alle zu erwartenden Kopplungsaufspaltungen sichtbar werden. 1 H-NMR-Spektroskopie Spektroskopie in der Organischen Chemie Signale von NH- und OH-Protonen können auch daran erkannt werden, dass sie während eines NMR-Experiments gegen Deuterium ausgetauscht werden können. NMR-Röhrchen (a) (b) D2O D2O + HDO Ausschütteln R-NH2 + CDCl3 R-ND2 + CDCl3 Bereich der Messspule Man misst zunächst (a) alle Signale einschliesslich die der NH- (OH-) Protonen. Danach schüttelt man das Probenröhrchen aus, damit diese Protonen durch Deuteriumatome aus D2O ausgetauscht werden. Nach dem Absetzen der beiden Flüssigkeitsphasen misst man erneut und findet praktisch keine NH- (OH-) Signale mehr. 1 H-NMR-Spektroskopie Spektroskopie in der Organischen Chemie Demobeispiel 4: 2-Methylpyridin N 1 H-NMR-Spektroskopie CH3 1 Spektroskopie in der Organischen Chemie Demobeispiel 5: 1H-NMR Spektrum von C3H3-CN (Acrylnitril) HA H C C C HB CN 1 H-NMR-Spektroskopie Spektroskopie in der Organischen Chemie Das Spektrum weist entsprechend den drei nichtäquivalenten Protonen A, B und C des Acrylnitrils drei separate Signale auf, was auch an den Signalstufen erkennbar ist. Bei allen drei Signalen handelt es sich um doppelte Dubletts (dd), weil jedes Proton mit den beiden anderen koppelt und alle drei Kopplungskonstanten ungleich sind. Signal bei δ = 6.20: J = 17.8 und 0.9 Hz Signal bei δ = 6.06: J = 11.7 und 0.9 Hz Signal bei δ = 5.65: J = 17.8 und 11.7 Hz In Vinylsystemen sind geminale Kopplungskonstanten (2J) üblicherweise sehr klein (< 2 Hz), wogegen vicinale Kopplungskonstanten (3J) sehr viel größer sind und eine stereochemische Komponente aufweisen. cis-Kopplung 3J: 11 - 14 Hz (Torsionswinkel 00) trans-Kopplung 3J: 16 - 18 Hz (Torsionswinkel 1800) (Man beachte die Analogie zur KARPLUS-Abhängigkeit vicinaler Kopplungskonstanten) 1 H-NMR-Spektroskopie Spektroskopie in der Organischen Chemie Damit lässt sich eine eindeutige Zuordnung treffen: 11.7 Hz HA 0.9 Hz HC B A C C C HB CN 17.8 Hz 1 H-NMR-Spektroskopie Spektroskopie in der Organischen Chemie Obwohl die Signale eindeutige Dachschrägen aufweisen, wurde das Spinsystem wie 1. Ordnung ausgewertet. Es ist die Frage, ob das berechtigt ist. Dazu müssen alle vorhandenen Spinpaare auf ihre ∆ν/J-Verhältnisse geprüft werden: A und B: ∆δ = δB - δA = 6.20 - 6.06 = 0.14 ∼ 35 Hz; 2J(A,B) = 0.9; ∆ν/J > 38 A und C: ∆δ = δA - δC = 6.06 - 5.65 = 0.41 ∼ 103 Hz; 3J(A,C) = 11.7; ∆ν/J ≈ 9 B und C: ∆δ = δB - δC = 6.20 - 5.65 = 0.55 ∼ 138 Hz; 2J(A,B) = 17.8; ∆ν/J ≈ 8 Die Tatsache, dass die beiden letzteren Verhältnissen (und nur diese!) unter 10 liegen, ist die Ursache der deutlichen Dachschrägen. Aber in einem Übergangsbereich 7 < ∆ν/J < 10 ist es dennoch zulässig, das Spinsystem wie eines 1. Ordnung zu behandeln. Der dabei unvermeidliche Fehler ist so gering, dass er angesichts der üblichen Messgenauigkeit toleriert werden kann. Man beachte: Obwohl die Signale von A und B im Spektrum relativ nahe beieinander stehen, sind sie nach dem hier diskutierten Kriterium weit voneinander entfernt (∆ν/J > 38). 1 H-NMR-Spektroskopie Spektroskopie in der Organischen Chemie Demobeispiel 6: 1H-NMR Spektrum von C6H5-NO2 (Nitrobenzol) NO2 H H H H ortho meta H para 1 H-NMR-Spektroskopie Spektroskopie in der Organischen Chemie Es gibt drei Signale entsprechend den chemisch nichtäquivalenten Kernsorten: ortho-, meta- und para-Protonen. Die relativen Intensitäten (Integralstufen) sind 2:1:2. Damit ist klar, dass das Signal bei δ = 7.69 mit dem Integral 1 dem para-Proton zuzuordnen ist. Das Signal hat eine gewisse Triplettstruktur. Obwohl das gesamte Spinsystem höherer Ordnung ist, nicht ohne Simulation ausgewertet werden kann und Kopplungskonstanten grundsätzlich nicht zu entnehmen sind, lässt die Triplettform dennoch die Aussage zu, dass dieses Proton zwei benachbarte Protonen hat (zwei ortho-Kopplungen mit 3J ≈ 8 Hz). Das Signal bei δ = 7.54 hat ebenfalls Triplettstruktur. Es muss sich also um die meta-Protonen handeln, die ebenfalls zwei ortho-Nachbarprotonen haben. Das Signal bei δ = 8.22 hat Dublettstruktur, zeigt also nur einen einzigen Nachbarn an. Dies passt zu den ortho-Protonen. Damit ist es möglich, auch ohne eine detaillierte Spektrenanalyse eine eindeutige Signalzuordnung zu erhalten. 1 H-NMR-Spektroskopie