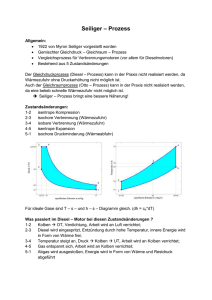
1 – 2: isotherm 2 – 3
Werbung

261. a) Es laufen folgende Zustandsänderungen ab: 1 – 2: isotherm 2 – 3: isochor 3 – 4: isotherm 4 – 1: isochor Der erste Hauptsatz der Wärmelehre lautet: ∆U= W +Q Die Änderung der inneren Energie einer abgeschlossenen Gasmenge ist die Summe der Volumenarbeit und der Wärme. In den beiden Fällen 2 – 3 und 4 – 1 bleibt das Volumen des Gases konstant. das heißt, es wird weder am System noch vom System Volumenarbeit verrichtet. Damit gilt: ∆U=0 +Q ∆U=Q Die Änderung der inneren Energie entspricht der zugeführten oder angegebenen thermischen Energie (Wärme) Die Wärme berechnet sich durch Q = m⋅cV ⋅ ∆ T Die beiden Zustandsänderungen verbinden im Diagramm zwei Isothermen. Damit ist die Temperaturdifferenz in beiden Zustandsänderungen vom Betrag her gleich groß und damit auch die Wärmen Q23 und Q41. c) Volumenarbeit wird nur in den Zustandsänderungen 1 – 2 und 3 – 4 verrichtet. In Teil 1 – 2 verrichtet das System Arbeit (es dehnt sich aus) und im Teil 3 – 4 wird am System Arbeit verrichtet (es wird zusammengepresst) Die Volumenarbeit berechnet sich mit V2 W =− ∫ p(V) dV V1 Daraus wird mit p ⋅V p(V) = 1 1 V dann V2 W = − p1 ⋅ V1 ∫ V1 1 dV V V W = [ − p1 ⋅ V1 ⋅ ln V ]V2 1 W = − p1 ⋅ V1 (ln V2 − ln V1 ) Aus dem Diagramm werden die benötigten Größen abgelesen: V1 = 0,008m3 p1 = 8 ⋅105 Pa V2 = 0,025m3 und die Volumenarbeit V12 berechnet W12 = − 8 ⋅105 Pa ⋅ 0,008m3 ⋅ ln0,025m3 − ln0,008m3 ( ) W12 = − 7292 J Für V34 erfolgt das auch V3 = 0,025 m3 p3 = 1,6 ⋅105 Pa V4 = 0,008m3 W34 = − 1,6 ⋅105 Pa ⋅ 0,02m3 ⋅ ln0,008m3 − ln0,025m3 ( ) W34 = 3646 J Die Nutzarbeit ist dann W = W12 + W34 W = − 7292 J + 3646 J W = − 3646kJ Die zugeführte Wärme Q12 entspricht der abgegebenen Arbeit W 12, denn der Vorgang läuft isotherm ab. damit ist die Änderung der inneren Energie aber 0 und die zugeführte Wärme wird nach dem ersten Hauptsatz vollständig in Volumenarbeit umgewandelt. Q12 = − W12 Q12 = 7292 J Der Wirkungsgrad ist dann 3646 J η= 7292 J η = 0,5 η = 50%