Innere Energie, Reaktionswärme, Enthalpie mit
Werbung

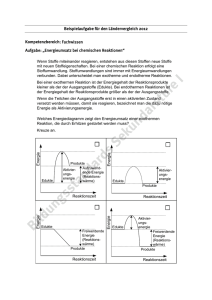
3. Semester Innere Energie, Reaktionswärme, Enthalpie Unterrichtsreihe: Energetik Seite im Hefter: ....... Datum: …………… www.chemiezauber.de Bei einer chemischen Reaktion werden die Ausgangsstoffe als Edukte und die Endstoffe als Produkte bezeichnet. Dabei weisen die Produkte andere chemische und physikalische Eigenschaften als ihre Edukte auf. Der Unterschied gilt auch für die Innere Energie U. Jede chemische Substanz besitzt eine innere Energie, sie ist jedoch nicht mit der Temperatur (Bewegungsenergie = Thermische Energie = kinetische Energie = Translationsenergie) der kleinsten Teilchen gleichzusetzen! Die Thermische Energie ist eine Teilmenge der Inneren Energie. Bei einem Zusammenstoß von Teilchen kann es zu einer chemischen Reaktion kommen. Dabei verändert sich neben der stofflichen Zusammensetzung auch die innere Energie des Gesamtsystems. Bindungen werden gespalten, neue Bindungen entstehen. Ist die Gesamtsumme der Energien der Reaktionsprodukte kleiner als die der Ausgangsstoffe, so liegt eine exotherme Reaktion vor (griech.: exo: heraus). Bei derartigen Reaktionen wird Energie freigesetzt. Dies kann in Form von Wärme, der so genannten Reaktionswärme Q oder/und Lichtabstrahlung erfolgen. Die Reaktionsprodukte besitzen also einen geringeren Energieinhalt. Ist jedoch die Gesamtsumme der Energien der Produkte größer als die der Edukte, so handelt es sich um eine endotherme Reaktion (griech.: endo: hinein). Um eine solchen Energie ablaufen zulassen muss Energie zugeführt werden. Erfolgt die Reaktion bei konstantem Volumen (also in geschlossenen, nicht adiabatischen Systemen), entspricht die Änderung der inneren Energie des Systems ausschließlich der Reaktionswärme: ∆U = QV. Die meisten Reaktionen führt der Chemiker aber in offenen (oder adiabatischen) Systemen durch. In diesem Fall erfolgt die Reaktion also bei konstantem Druck. Bei vielen Reaktionen findet eine Änderung des Volumens ∆V - durch das Entstehen von Gasen - statt. Es wird bei konstantem Druck Volumenarbeit verrichtet. W = -p · ∆V. Da Volumenarbeit vom System abgegeben wird, erhält sie vereinbarungsgemäß ein negatives Vorzeichen. ∆U = Qp - p · ∆V bzw. Qp = ∆U + p · ∆V Die Zustandsgröße, die das chemische System bei konstantem Druck betrachtet, nennt man Enthalpie H (griech.: thalpein: erwärmen). In ihr ist die Volumenarbeit enthalten. ∆H = ∆U + p · ∆V Die Enthalpie wird in der Einheit Joule (J) angegeben. Da man keine absoluten Enthalpiewerte bestimmen kann, sondern nur Veränderungen der Enthalpie, wurden die Enthalpien der Elemente als Bezugspunkt willkürlich mit einer Enthalpie von 0 versehen. Misst man also die Reaktionswärmen bei dem Beispiel auf der Vorderseite (Reaktion von Zink mit Salzsäure), so ist die Reaktionswärme bei konstantem Druck Qp, also die Enthalpieänderung ∆H, etwas geringer, als die Reaktionswärme bei konstantem Volumen QV, da Energie in Form von Volumenarbeit an die Umgebung abgegeben wird. Bei Reaktionen ohne Volumenänderungen, kann man die innere Energie mit der Enthalpie gleichsetzen. Derartige Reaktionen sind Festkörperreaktionen oder Reaktionen in Lösungen. Arbeitsaufträge: Zeichnen Sie entsprechende Diagramme und formulieren Sie die Reaktionsschemata für die 1. Wassersynthese 2. Ammoniakzerlegung 3. Fotosynthese