View
Werbung

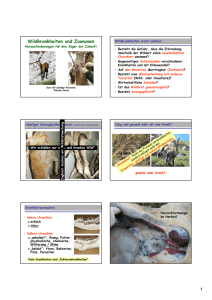
Teil 2/3 Zoonosen Spezial Zoonosen Spezial | 23 Teil 2/3 en Zoonos l Spezia Zoonosen in der Rinderpraxis In diesem Überblick wird sowohl auf die Infektionsmöglichkeiten durch Rinder wie auch auf das Infektions- und Intoxikationsrisiko, welches von Lebensmitteln vom Rind (Fleisch, Milch) ausgehen kann, eingegangen. von OVR Univ. Doz. Dr. Armin Deutz Tierärzte gelten hinsichtlich des Erwerbs von Zoonosen aufgrund ihrer beruflichen Tätigkeit nicht nur als besonders exponierte Berufsgruppe, sondern sie tragen auch eine große Verantwortung in der Kontrolle der Nutztierbestände auf Zoonosen sowie in der Aufklärung der Tierhalter und Konsumenten über Infektions- und Intoxikationsmöglichkeiten. Die in Österreich häufige Direktvermarktung von Milch- und Fleischprodukten erhöht den Informationsbedarf aller Beteiligten. Wichtige in Mitteleuropa vorkommende Zoonosen beim Rind 1. Bakterielle Zoonosen: Borreliose (Borrelia burgdorferi), Brucellose (Brucella abortus), Campylobacteriose (thermophile Camylobacter spp.), Leptospirose (Serovare von Leptospira interrogans), Milzbrand (Bacillus anthracis), Q-Fieber (Coxiella burnetii), Chlamydiose (Chlamydia psittaci), Salmonellose, Tuberkulose (Mycobacterium bovis, M. tuberculosis, best. Serovare von M. avium) 2. Mykotische Zoonosen: Trichophytie (Trichophyton verrucosum) 3. Parasitäre Zoonosen: Babesiose (Babesia divergens), Fasziolose (Fasciola divergens), Kryptosporidiose (Cryptosporidium parvum, C. muri), Zystizerkose (Taenia saginata) 4. Virale Zoonosen: Frühsommermeningoenzephalitis, Melkerknoten, Stomatitis papulosa (Parapockenviren), Metzgerpappilom (Papillomvirus 7), Rindergrippekomplex (Adeno- und Parainfluenza-3, RSV, Ö) 5. Humanpathogene Mikroorganismen in Rohmilch: Staphylococcus aureus, Streptococcus pyogenes, S. agalactiae, Coxiella burnetii, E. coli, Salmonella ssp., Yersinia enterocolitica, Campylobacter jejuni, Listeria monocytogenes, Brucella ssp., Mycobacterium ssp. usw. Tierärzte haben Anzeigepflicht In der Rinderpraxis sind ne- ben bakteriellen, mykotischen, parasitären und viralen Zoonosen zunehmend Infektionen im Zusammenhang mit dem Konsum von Rindfleisch und von Rohmilch von Interesse. Nach dem Epidemiegesetz BGBl. Nr. 186/1950 i.d.g.F. sind u.a. Tierärzte zur Anzeige verpflichtet bei Milzbrand, Psittakose, Rotz, Puerperalfieber, Wutkrankheit und Bissverletzungen durch wutkranke oder wutverdächtige Tiere, Tularämie, Bangscher Krankheit, Trichinose, Leptospirose, Tuberkulose, hervorgerufen durch M. bovis und Infektionen mit dem Influenzavirus A/H5N1 oder einem anderen Vogelgrippevirus, wenn sie in Ausübung ihres Berufes von der erfolgten Infektion eines Menschen oder dem Verdacht einer solchen Kenntnis erlangen. 1. Bakterielle Zoonosen Von der Vielzahl bakterieller Zoonosen sind im Zusammenhang mit der Rinderpraxis in unseren Breiten folgende von Bedeutung: Q-Fieber, Chlamydiose, Leptospirose und Borreliose. Daneben muss mit dem Ausbruch längst erloschener Tierseuchen, wie z.B. Milzbrand, Tuberkulose oder Brucellose, gerechnet werden. Diese Tierseuchen wurden jahrzehntelang hauptsächlich wegen ihrer Übertragbarkeit auf den Menschen bekämpft. Die großen Erfolge in Europa zeugen von einer konsequenten Tierseuchenbekämpfung sowie von strengen Importbestimmungen in der Vergangenheit. In der Umstellung auf den freien Warenverkehr innerhalb europäischen Gemeinschaft mit dem Ersatz tierärztlicher Grenzkontrollen durch Kontrollen des Herkunftsbestandes und stichprobenweisen Kontrollen am Transport bzw. am Bestimmungsort ist in der nationalen Überwachung darauf zu achten, dass dieser mühsam und teuer erworbene günstige Seuchenstatus Österreichs erhalten bleibt. Milzbrand Am Milzbrand konnte Robert Koch 1876 erstmals die Ätiologie einer Infektionskrankheit beweiskräftig klären, nachdem bereits Ende des 18. Jahrhunderts in München Übertragungsversuche durchgeführt wurden. Rein empirisch erkannte man schon viel früher die Übertragbarkeit, was beispielsweise schon 1732 in Sachsen zu Bekämpfungsvorschriften führte. Ein Risiko von Neuausbrüchen geht hauptsächlich von alten Verscharrungsplätzen, Wasenmeistereien und Gerbereistandorten aus, daneben ist auch die Einschleppung über importierte Tierfelle, -haare und Knochen möglich. In den „alten Bundesländern“ der BRD erkrankten von 1962 bis 1980 113 Menschen an Milzbrand, wobei es sich seit 1968 um max. 1 bis 5 Fälle/Jahr handelt und auch nur mehr Hautmilzbrand und nicht Darm- oder Lungenmilzbrand nachgewiesen wurde (Selbitz u. Bisping, 1995). Im Dezember 2005 erkrankte ein Landwirt in Südtirol, nachdem er akut erkrankte Rinder ohne Schlachttieruntersuchung selbst schlachtete (Kreidl et al., 2007). Milzbrand ist auch im Zusammenhang mit „Biowaffen“ und bioterroristischen Anschlägen zu berücksichtigen. 24 | Zoonosen Spezial 1 Zoonosen Spezial | 25 2 3 Trichophythie Abb. 1: Rinder in ganzjähriger Stallhaltung erkranken häufiger an Trichophythie. Abb. 2: Für Kinder ist die Infektionsgefahr hoch. Abb. 3: Schwerer Fall einer Trichophythie mit Sekundärinfektionen. Brucellose Die erfolgreiche Seuchenbekämpfung konnte die Rinderbrucelllose in Europa nahezu vollständig zurückdrängen, sie ist aber in Mittel- und Südamerika und in einigen Ländern Afrikas noch immer eine der wichtigsten Zoonosen. Das Erkrankungsrisiko für Tierärzte durch Brucella abortus betrug früher in Deutschland 17% (Dedie et al., 1993), wobei Serumtiter noch häufiger auftraten. In einer Untersuchung von steirischen Tierärzten konnten keine Seroreagenten detektiert werden, obwohl ein Tierarzt anamnestisch eine länger zurückliegende Brucellose angab. Vordergrund stehen, sind die klinischen Symptome und Organveränderungen stärker ausgeprägt als bei Tieren. Seltener wurden zentralnervale Störungen und Encephalitiden beobachtet (Ladurner et al., 1975). Das akute Q-Fieber heilt meist nach 1-2 Wochen aus, seltener chronische Fälle können zu Hepatitiden und Endocarditiden führen. Bei rund der Hälfte der Infizierten ist der Verlauf inapparent, vor allem nach oraler Infektion. In Thüringen waren unter exponierten Berufsgruppen u.a. bei Melkern (19%) und Tierpflegern (14%) die häufigsten Q-Fieber-Reagenten zu finden (Lange u. Hunstock, 1993). Q-Fieber Die in der Untersuchung von steirischen Tierärzten Borreliose Die Borreliose oder Lyme-Krankheit ist eine Zo- festgestellte Prävalenz von 9% zeichnet Tierärzte, vornehmlich Kollegen in der Großtier- und Gemischtpraxis, als exponierte Berufsgruppe gegenüber Q-Fieber aus. Dem besonderen Risikofaktor „Nachgeburtabnahme ohne Schutzhandschuhe“ sollte unbedingt durch die Verwendung von Schutzhandschuhen und die Einhaltung einer entsprechenden Arbeitshaltung begegnet werden. Coxiella burnetii, der Erreger des Q-Fiebers, hat ein sehr breites Wirtsspektrum vom Menschen über zahlreiche Säugetier- und Vogelspezies bis zu Zecken- und Insektenarten (Dedie et al., 1993). Von den Haustieren sind hauptsächlich Wiederkäuer, aber auch Hunde, befallen. In Westösterreich reagierten in einer Untersuchung 7,2% der Rinder seropositiv (Khaschbi et al., 1996). Der häufigste Infektionsweg für den Menschen mit dem zugleich schwersten Krankheitsverlauf ist die aerogene Infektion über Staub- und Tröpfchenaerosole (Lochialsekret, Wollstaub, Rinderhäute usw.), wobei die Erreger im Staub bis zu 2 Jahre infektionsfähig bleiben. Daneben finden Infektionen über erregerhältige Milch von Kühen und seltener Schafen sowie über Zeckenkot statt (Dedie et al., 1993; Weber, 1991). Der kutane Infektionsweg ist umstritten und beim Menschen nur bei Hautverletzungen zu erwarten (Tiergeburtshilfe!). Beim Menschen, wo die interstitielle Pneumonie und heftige Kopfschmerzen im onose, bei der Zecken als Vektoren zwischen den eigentlichen Erregerreservoiren, nämlich Nagetieren, Wild- und Haustieren, fungieren. Bei Hunden, den exponiertesten Haustieren, sind vorwiegend Arthritiden beschrieben, Pferde können rezidivierende Lahmheiten zeigen, von Rindern sind ebenfalls Lahmheiten und Abortusfälle bekannt. Bei Rindern konnte der Erreger Borrelia burgdorferi in Milch und Urin nachgewiesen werden. Beim Menschen zeichnet sich die Borreliose durch ein sehr variables Symptombild aus, sie hat damit mittlerweile die Syphilis in der Rolle als „Chamäleon unter den Infektionskrankheiten“ abgelöst (Maiwald, 1994). Nach einer Lokalinfektion (Erythema migrans, Acrodermatitis chronica atrophicans) kann es über eine Phase der Erregergeneralisation zu Organmanifestationen kommen. Abhängig von der Infektionsrate unter den Zecken tritt in Mitteleuropa eine erhebliche regionale Variabilität in der Befallsrate der Bevölkerung auf. So waren in Endemiegebieten, wie z.B. einigen Gebiete Süddeutschlands, über ein Drittel der Probanden seropositiv, allgemein wird in Deutschland mit einer Durchseuchungsrate von 10% der Bevölkerung gerechnet (Künzer u. Künzer, 1990). Im Vergleich dazu liegt eine 7%ige Seroprävalenz unter Tierärzten in der Steiermark darunter. Bei Jägern in Südostösterreich konnte dagegen eine Seroprävalenz von 48% festgestellt werden (Deutz et al., 2003). 2. Mykotische Zoonosen Eine der wohl häufigsten rinder- assoziierten Zoonosen unserer Breiten stellt die Trichophytie, eine durch Pilze (Trichophyton verrucosum) hervorgerufene ansteckende Infektion der oberen Hautschichten, Haarwurzeln und Haarschäfte, dar. Die Trichophytie verursacht beim Rind charakteristische runde und haarlose Hautveränderungen mit asbestartig-krustösen oder schuppenden Belägen vorwiegend an Kopf und Hals. In einer Erhebung, die 67 österreichische Praxisgebiete umfasste, wurden rund 400 Humanfälle erhoben und der Anteil Rinderbestände mit Trichophytie auf 10% geschätzt, wobei Betriebe mit ganzjähriger Stallhaltung überwogen (Deutz, 1991). Wegen der bekannten Selbstheilungstendenz wird diese überwiegende Jungtierkrankheit nicht oder unzureichend therapiert. Neben den Hautschäden und Leistungseinbußen beim Rind müsste die Infektionsgefahr für den Menschen – insbesondere für Kinder – ausreichend Grund für eine Prophylaxe und Therapie sein. Beim Menschen, der wesentlich schwerer als das Rind erkranken kann, unterscheidet man zwischen einer „oberflächlichen“ und einer „tiefen“ Trichophytie. Die mildere oberflächliche Trichophytie (Syn.: Herpes tonsurans, H. circinatus, Tinea corporis) verläuft anfänglich als Follikulitis mit späterer Exsudation, Verkrustung und Schuppenbildung. Bei der tiefen Trichophytie (Syn.: Kerion celsi, Sykosis, Tinea barbae, Tinea capitis) kommt es beim Menschen zu heftigen, bis in die Subkutis reichenden Entzündungen mit der Ausbildung abszedierender, stark sezenierender, schmerzhafter und knotig-tumoröser Infiltrate, die häufig von Schwellung der regionären Lymphknoten, Fieber und Abgeschlagenheit begleitet werden (Krauss u. Weber, 1986). Besonders bei der Trichophytie ist die Verantwortung der Tierärzte im Zusammenhang mit der Aufklärung der Tierhalter über das Infektionsrisiko (Kinder!) sehr hoch. 3. Parasitäre Zoonosen Diese sind im Zusammenhang mit dem Rind in Mitteleuropa von untergeordneter Bedeutung. Taeniasis saginata Für Taenia saginata ist der Mensch der einzige Endwirt, wobei er durch den Parasitismus kaum einen Schaden erleidet. Dieser Umstand wird einer langen, erfolgreichen Evolution dieses Bandwurms in der Anpassung an seinen Wirt zugeschrieben (Auer u. Aspöck, 1995). Die in Österreich seit 1852 vorgeschriebene Schlachttier- und Fleischuntersuchung verhindert heute weitgehend, dass finniges Rind- oder Schweinefleisch (T. solium) in Verkehr gelangt. Dennoch werden in Österreich alljährliche Fälle von Infestationen mit T. saginata oder T. solium bei In- und Ausländern diagnostiziert (Auer u Aspöck, 1995). T. saginata kann im Menschen solitär als 4 bis 12 m langer Bandwurm 30 bis 40 Jahre parasitieren. Weltweit rechnet man mit ca. 40 Million T. saginata-Trägern (Krauss u. Weber, 1986). Bei Auslandsaufenthalten in hochendemischen Gebieten (z.B. Ostafrika) ist das Übertragungsrisiko durch die Aufnahme von unzureichend gegartem Rindfleisch beträchtlich. Babesiose Die bisher vereinzelt nachgewiesenen Babesiosen beim Menschen traten in den USA, Mexico sowie in Europa (Frankreich, Irland, Schottland, UdSSR, ehemaliges Jugoslawien) auf und wurden mit den Spezies B. microti, B. divergens, B. bovis und B. equi in Zusammenhang gebracht (Krauss u. Weber, 1986). Obwohl B. divergens im Untersuchungsgebiet endemisch vorkommt, wurden in einem Seroscreening unter 137 steirischen Tierärzten keine Reagenten ermittelt. Fasziolose Infestationen mit Fasciola hepatica treten beim Menschen selten auf. Insgesamt wurden in der Abteilung für Med. Parasitologie des Klinischen Institutes für Hygiene der Universität Wien in 40 Jahren 13 klinische Fälle von Fasziolose beim Menschen registriert. Als Infektionskrankheit für den Menschen kommen hauptsächlich mit Metazerkarien kontaminierte Salate, Wasserkresse und Fallobst und nicht der direkte Tierkontakt infrage (Auer u. Aspöck, 1994). 26 | Zoonosen Spezial Zoonosen Spezial | 27 Teil 2/3 en Zoonos l Spezia 4. Virale Zoonose Aus der Vielzahl viraler Zoonosen soll im Zusammenhang mit der Rinderpraxis nur auf die Melkerknoten (Parapockenviren), die Stomatitis papulosa (Parapockenviren), das Metzgerpapillom (Papillomvirus 7) sowie den Rindergrippekomplex exemplarisch eingegangen werden. Melkerknoten Euterpocken vom Rind manifestieren sich beim Menschen nach Erregerübertragung in Form der Melkerknoten. Nach einer Kontaktinfektion treten an den Händen Bläschen und Papeln auf, wobei teilweise die axillaren Lymphknoten mitreagieren. Selten treten Läsionen auch an den Unterarmen oder am übrigen Körper auf. Bei Ausbleiben einer Sekundärinfektion bilden sich die Läsionen innerhalb einiger Wochen ohne Narbenbildung zurück. Durch den engen Kontakt zwischen Menschen und Tauben in Städten sind Infektionen über Staub und Tröpfchen leicht möglich. Eine quantitative Risikoabschätzung scheitert an verlässlichen Querschnittsuntersuchungen von Tauben und an vermutlich hohen Dunkelziffern von Krankheitsfällen in der Humanmedizin. Stomatitis papulosa Diese erosive oder prolieferative Stoma- titis des Rindes, die meist ohne Störung des Allgemeinbefindens abläuft, kann beim Menschen den Melkerknoten ähnliche Hautveränderungen hervorrufen. Die Infektion erfolgt über kleine Hautwunden z.B. bei der Untersuchung der Maulhöhle von infizierten Rinden. Nach einer Inkubationszeit von 3 bis 6 Tagen entstehen an den Händen Bläschen und warzenähnliche Knötchen, die sich nach 3 bis 4 Wochen zurückbilden, wobei aber nach Monaten rekurrierende Läsionen auftreten können. Metzgerpapillom Bei dieser ausschließlich bei Metzgern, Tierärzten und Landwirten angetroffenen Warzenform wird aus epidemiologischen Gründen angenommen, dass es sich um eine Zoonose handelt. Der Erreger, das menschliche Papillomvirus 7 (HPV 7), wurde in anderen Warzen oder bei anderen Berufsgruppen noch nie nachgewiesen. Bisher fehlt aber ein Erregernachweis beim Rind oder bei anderen Haustieren. Differentialdiagnostisch ist das Metzgerpapillom von durch andere Papillomviren hervorgerufene Warzen nicht zu unterscheiden. Weltweit kommen bei 35% der Fleischhauer sog. Metzgerpapillome vor (Krauss u. Weber, 1986). Rindergrippekomplex Viele praktizierende Tierärzte leiden während Rinder- oder Schweinegrippeausbrüchen selbst unter grippalen Infekten. In der serologischen Diagnostik ist es nicht immer möglich, Virusstämme menschlichen oder tierischen Ursprungs zu differenzieren. In der serologischen Untersuchung von steirischen Tierärzten auf Zoonosen fielen jedoch hohe Seroprävalenzen gegenüber Parainfluenza-3-Virus (95%) und Respiratorisches Syncytialvirus (59%) auf, wobei keine statistisch signifikanten Unterschiede zwischen den Arten der Praxisausübung festzustellen waren. Dies lässt auf eine sehr weite Verbreitung dieser Grippeerreger schließen. Im Falle der Seroprävalenzen gegenüber dem Schweineinfluenza-Virus H1N1 (9%) konnte aber epidemiologisch ein signifikanter Zusammenhang mit der Ausübung der Schweinepraxis nachgewiesen werden. 5. Zoonoseerreger in Rinderkot Das Vorkommen von hu- manpathogenen Keimen in Rinderkot ist sowohl aus fleischhygienischen, als auch aus milchhygienischen Überlegungen von Straßentauben als Infektionsrisiko? Melkerknoten heilen meist komplikationslos ab (Foto: W. Obritzhauser). Selbst für gesunde Menschen kann Taubenfüttern ein Infektionsrisiko bedeuten. VON OVR UNIV. DOZ. DR. ARMIN DEUTZ größtem Interesse für den Verbraucherschutz. Kontaminationen von Fleisch oder Rohmilch mit humanpathogenen Keimen sind eine potenzielle Infektionsquelle für Foodborne Diseases wie Campylobacteriose, Salmonellose, VTEC (Verotoxinbildende E. coli)Infektionen, Yersiniosen und Listeriosen. In einem Projekt in der Steiermark wurden Kotproben von 627 Kühen und 247 Kälberkotproben aus 77 Betrieben gezogen und auf das Vorkommen von Campylobacter spp., Salmonella spp. und verotoxinbildende E. coli bakteriologisch untersucht. Aus einem weiteren Projekt an 7 Schlachthöfen gelangten von 212 Rindern Kotproben auf Campylobacter spp. und Salmonella spp. zur Untersuchung. Weiters liegen Untersuchungsergebnisse von 145 Rohmilchproben und Rohmilchprodukten aus der Direktvermarktung vor. Proben aus 19 Milchviehbetrieben zur Untersuchung auf Listeria ssp. wurden aus Silage, Einstreu frisch und gebraucht sowie aus Milchfiltern und Tankmilch gezogen. Nach einem Massenausbruch von Campylobacteriose in einem Jugendschülerheim wurden Stuhlproben erkrankter Kinder und Kotproben von Kühen des milchliefernden Betriebes untersucht und die Campylobacter-Stämme verglichen. Je nach Untersuchungsdurchgang und Art des Probenmaterials konnten in bis 2 % der Proben Campylobacter spp. (Sammelproben Rinderkot), in bis 87% Listeria ssp. (gebrauchte Einstreu) und in einem hohen Anteil der Betriebe VTEC nachgewiesen werden. Salmonellen waren nicht nachweisbar. Der Massenausbruch in einem Jugendschülerheim, bei dem 38 von 64 Kindern an akuter Campylobacteriose erkrankten, konnte durch den Nachweis identer Stämme in den Stuhlproben erkrankter Kinder und im Rinderkot aus Kühen eines milchliefernden Betriebes auf Rohmilchkonsum (Rohmilch in Müsli) zurückgeführt werden. Die teilweise hohen Nachweisraten humanpathogener Keime in Rinderkot verlangen die Einhaltung hygienischer Maßnahmen in der Milch- und Fleischgewinnung. Rohmilchkonsum und Verzehr von unzureichend gegartem Rindfleisch stellen ein potenzielles Infektionsrisiko hinsichtlich Foodborne Diseases dar. Zoonoseträger Straßentauben können biologische oder me- verlaufen und andererseits, weil Tauben als Reservoir von Zoonoseerregern wenig bekannt sind. chanische Träger von Zoonoseerregern sein. Seit den 1940er Jahren wurden Straßentauben auf Zoonosen untersucht und dabei insgesamt 109 humanpathogene Krankheitserreger nachgewiesen (Haag-Wackernagel, 2006). Für sieben dieser Zoonoseerreger existieren Fallberichte über eine tatsächliche Übertragung auf den Menschen (Salmonella enterica Kiambu, Chlamydophila psittaci, Aspergillus sp., Candida parapsilosis, Cryptococcus neoformans, Histoplasma capsulatum, Toxoplasma gondii). Gefährliche Stäube Von den 230 bisher evidenten Erkran- kungsfällen erfolgten vermutlich 229 (99,6%) als aerogene Infektionen. Ein Fall einer perkutanen Infektion wurde bei einem HIV-positiven Mann beschrieben, der von einer Straßen­taube verletzt wurde und in der Folge eine seltene primär kutane Kryptokokkose entwickelte (Gatti et al., 1997). Orale Infektionen (Schmierinfektionen) sind bislang nicht bekannt. Erkrankungsrisiko Wesentliche Faktoren der Krankheitsü- bertragung sind die Pathogenität des Erregers, die Infektionsdosis und der Immunstatus der Exponierten. Hohe Infektionsdosen sind vor allem bei starker Staubentwicklung oder bei intensivem direktem Körperkontakt mit Straßentauben zu erwarten. Tauben beherbergen oft aber Varianten eines Erregers, die für den Menschen nicht oder nur schwach pathogen sind (z.B. Yersinia pseudotuberculosis, Salmonella enterica subsp. enterica Serovar Typhimurium var. Copehagen, PT 99). Der einzige Fall einer vermuteten Salmonellaübertragung von Straßentauben auf den Menschen wurde auf Salmonella enterica serovar Kiambu 1 zurückgeführt (Haag-Wackernagel, 2006). Den wenigen bisher publizierten Erkrankungsfällen durch Taubenkontakte dürfte aber eine große Dunkelziffer von Fällen gegenüberstehen. Dies einerseits deshalb, da einige Zoo­ nosen (z.B. Chlamydiose) ähnlich einem grippalen Infekt Vorbeugemaßnahmen Die Betrachtung der Tätigkeiten, die zu einer Krankheitsübertragung von Straßentauben auf den Menschen führten, zeigt, dass viele Infektionen durch entsprechende Vorsichtsmaßnahmen hätten vermieden werden können. Bei beruflicher Exposition mit Tauben und ihren Ausscheidungen können Infektionen durch das Tragen von Schutzbekleidung (bei Staubentwicklung inklusive Mundschutz) weitgehend verhindert werden. Immunsupprimierte Personen müssen über die Infektionsrisiken durch direkte und indirekte Kontakte mit Straßentauben aufgeklärt werden, damit sie diese Infektionsquelle meiden. Im Bereich von Spitälern sind Ansammlungen von Tauben sowie deren Brutaktivitäten möglichst zu verhindern. Generell sollte darüber informiert werden, dass Kontakte mit kranken Sraßentauben und auch das Taubenfüttern selbst für Gesunde ein Infektionsrisiko bergen. Bei prädisponierten Menschen können von Tauben stammende Allergene eine „Taubenzüchterlunge“ auslösen. Personen mit einer bekannten Prädisposition für diese Krankheit müssen jeglichen Kontakt mit Tauben und deren Ausscheidungen vermeiden. Neben den Schäden an Gebäuden durch die Verschmutzung mit Taubenkot sind Tauben auch als Überträger von Zoonosen von gesundheitspolitischem Interesse. Die Größe der urbanen Taubenpopulationen wird durch die ganzjährige Fütterung maßgeblich mitbestimmt. Damit kann das „Taubenproblem“ in Städten auch nur durch eine Senkung der Nahrungsgrundlage gelöst werden. Ausgewählte Literatur Haag-Wackernagel, D. (2006): Gesundheitsgefährdung durch die Straßentaube Columba livia. Amtstierärztl. Dienst u. Lebensmittelkontrolle 13, 262-272. 28 | Zoonosen Spezial Zoonosen Spezial | 29 Teil 2/3 en Zoonos l Spezia Hepatitis E und Schweinekontakt Eine zu den „neuen Zoonosen“ gerechnete Erkrankung ist Hepatitis E, für die das Schwein ein potentes Infektionsrisiko und Erregerreservoir darstellen dürfte. Eine aktuelle österreichische Untersuchung untermauert diese Hypothese. VON OVR UNIV. DOZ. DR. ARMIN DEUTZ Haus- und Wildschweine können das Hepatitis-E-Virus ausscheiden (Foto: A. Schwinger). Schweinekontakt ist ein Risikofaktor hinsichtlich Hepatitis E. Verbreitung Hepatitis E ist eine seit den 1980er Jahren be- mittel, Übelkeit, Erbrechen, Juckreiz, Muskel-, Kopf-, und Gelenkschmerzen sowie leichtes Fieber auf. In der zweiten Krankheitsphase können Symptome wie Ikterus, heller bis lehmfarbiger Stuhl und dunkler Harn hinzukommen. Laborchemisch fällt die Erhöhung der Transaminasen auf. In der überwiegenden Zahl der Fälle tritt eine Genesung ohne Behandlung nach 2 bis 3 Wochen ein, es gibt aber auch Krankheitsverläufe von bis zu drei Monaten. Aktuelle Untersuchung In einer aktuellen Querschnitts- kannte Krankheit, von der man ursprünglich annahm, dass sie auf Entwicklungsländer beschränkt sei. So traten Fälle vorwiegend in Zentral- und Südostasien, Nord- und Westafrika, Mexiko und gehäuft im Sudan und Irak auf. Der Erreger ist das Hepatitis-E-Virus (HEV), das bis vor Kurzem den Caliciviren, heute aber der Familie der Hepeviridae, zugeordnet wird und eine hohe Tenazität aufweist. Neuere Untersuchungen ergaben, dass Hepatitis E bei Weitem nicht nur in Entwicklungsländern auftritt, sondern mit recht hohen Prävalenzen auch in Industrieländern nachweisbar ist, wobei in industrialisierten Ländern die Infektion zumeist subklinisch verläuft. In Deutschland wurden im Jahr 2006 insgesamt 52 Fälle gemeldet, die überwiegend noch auf importierte Infektionen aus Endemiegebieten zurückzuführen waren. Es mehren sich jedoch Berichte über sporadische Infektionen in Europa ohne Reiseanamnese (Johne et al., 2007). Schwedische Schweinehalter waren in einem Serosreening zu 13% seropositiv (Olsen et al., 2006). Übertragung Das Virus wird üblicherweise durch kontami- nierte Gegenstände (wie Toilettenspülungen, Wasserhähne, Türgriffe usw.), Nahrung und Wasser, besonders unter unhygienischen Bedingungen sowie zur Regenzeit übertragen („Fecal-oral route of transmission“). Mit hoher Wahrscheinlichkeit ist zusätzlich anzunehmen, dass es sich bei der Hepati- Zur Vorbeugung von Hepatitis E sollte auf Reisen immer die Grundregel „Cook it, boil it, peel it or forget it“ gelten. Schwangere gefährdet Die Erkran- kung verläuft i.d.R. moderat mit einer Letalitätsrate von 0,5 bis 4%. Bei Schwangeren, besonders am Ende der Schwangerschaft, werden jedoch auch fulminante Verläufe mit einer Letalität bis zu 25% infolge akuten Leberversagens beobachtet. Hepatitis E hat eine Inkubationszeit von zumeist 30 bis 40 Tagen und ist klinisch nicht von Hepatitis A zu unterscheiden. Als erste Beschwerden treten Appetitlosigkeit, Abneigung gegen bestimmte Nahrungs- tis E um eine Zoonose handelt, wobei vor allem Schweine und Wildtiere asymptomatisch infiziert sind und das Virus im Kot ausscheiden. Ähnliche Viren wurden bei Affen, Rehen, Mäusen und Schafen nachgewiesen. Auch Berichte, wonach sich Erkrankungsfälle nach dem Verzehr von nicht erhitzter Leber von Wildtieren ereignet hätten, legen ein zoonotisches Potenzial von HEV nahe. HEV wurde auch bei der Untersuchung von Wildtieren in Deutschland nachgewiesen (Johne et al., 2007). untersuchung unter prädisponierten Berufsgruppen (639 Probanden) in der Steiermark konnten hohe Seroprävalenzen bei Schweinehaltern, Tierärzten und Schlachthofarbeitern sowie bei IgM-positiven Probanden auch Hepatitis E-Antigen (Genotyp 3 HEV) mittels RT-PCR nachgewiesen werden (Gorgach et al., 2007). Auffallend waren beispielsweise die großen Unterschiede in der Seroprävalenz zwischen Schlachthofarbeitern in der Schweine- und Geflügelschlachtung. Diese Untersuchung untermauert die Hypothese, dass es sich bei Hepatitis E um eine Zoonose handelt und dass Kontakte mit Schweinen und Rohprodukten vom Schwein ein Risiko darstellen. Zudem sollte es zu einem Überdenken der Kategorisierung in „endemische“ und „nicht-endemische“ Gebiete kommen. Die relativ hohen Seroprävalenzen bei nicht oder wenig exponierten Personen können einerseits von weiteren Landwirte, Tierärzte und Schlachthofarbeiter sind exponierte Berufsgruppen. Reservoiren (Wildtiere?) herrühren und sollen andererseits auch zu einem Vergleich der Testmethoden anregen. Vorbeugemaßnahmen Da ein Impfstoff gegen Hepatitis E erst klinisch getestet wird, sind hygienische Vorbeugemaßnahmen im Umgang mit Lebensmitteln (inkl. Wasser), Gegenständen des täglichen Bedarfs und mit Tieren die einzige wirkungsvolle Prophylaxe. Auf Reisen sollte auch die reisemedizinische Grundregel „Cook it, boil it, peel it or forget it“ gelten. OVR Univ. Doz. Dr. Armin Deutz Bezirkshauptmannschaft Murau – Veterinärreferat, Bahnhofviertel 7, 8850 Murau, E-Mail: [email protected] Ausgewählte Literatur Gorgach, P., Bakonyi, T., Deutz, A., Nowotny, N. (2007): Prevalence of Hepatitis E Virus Antibodies in Occupational Groups with Different Exposure to Swine. Proc. Int. Meeting on Emerging Diseases and Surveillance, February 23-25, Vienna, p. 85 Johne, R., Kaci, S., Nöckler, K. (2007): Hepatitis E – eine über Lebensmittel übertragbare virale Zoonose in Deutschland? Amtstierärztl. Dienst u. Lebensmittelkontrolle, Abstract-Band zur 48. Arbeitstagung des Arbeitsgebietes Lebensmittelhygiene, 25.–28.9., Garmisch-Partenkirchen, S. 32.