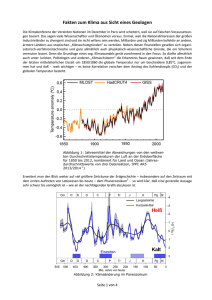
Antimikrobielle Wirksamkeit von chemischen Einzelkomponenten
Werbung

Bibliografische Informationen der Deutschen Bibliothek Die Deutsche Bibliothek verzeichnet diese Publikation in der Deutschen Nationalbibliografie; Detaillierte bibliografische Daten sind im Internet über http://dnb.ddb.de abrufbar. 1. Auflage 2009 © 2009 by Verlag: Deutsche Veterinärmedizinische Gesellschaft Service GmbH, Gießen Printed in Germany ISBN 978-3-941703-46-9 Verlag: DVG Service GmbH Friedrichstraße 17 35392 Gießen 0641/24466 [email protected] www.dvg.net Tierärztliche Hochschule Hannover Antimikrobielle Wirksamkeit von chemischen Einzelkomponenten ätherischer Öle gegenüber ausgewählten Lebensmittelverderbniserregern INAUGURAL – DISSERTATION zur Erlangung des Grades einer DOKTORIN DER VETERINÄRMEDIZIN - Doctor medicinae veterinariae (Dr. med. vet.) vorgelegt von Christiane Rüben Frechen Hannover 2009 Wissenschaftliche Betreuung: Univ.-Prof. Dr. Günter Klein Institut für Lebensmittelqualität- und Sicherheit 1. Gutachter: Univ.-Prof. Dr. Günter Klein 2. Gutachter: Univ.-Prof. Dr. Waldemar Ternes Tag der mündlichen Prüfung: 19. November 2009 Diese Arbeit wurde aus Mitteln der Eberhard Lienhop Stiftung gefördert Meiner Familie Inhaltsverzeichnis 1 Einleitung ............................................................................................................. 1 2 Wissenschaftliches Schrifttum .......................................................................... 3 2.1 Haltbarkeit von Lebensmitteln ....................................................................... 3 2.1.1 Mikrobielle Verderbnis ................................................................................ 3 2.1.1.1 Enterobacteriaceae ............................................................................ 5 2.1.1.2 Pseudomonas spp. ............................................................................ 6 2.1.1.3 Brochothrix thermosphacta ................................................................ 7 2.1.1.4 Aeromonas spp. ................................................................................. 8 2.1.2 Beeinflussung des Verderbs von Lebensmitteln ......................................... 9 2.2 2.1.2.1 Grundlagen ........................................................................................ 9 2.1.2.2 Verfahren zur Haltbarkeitsverlängerung........................................... 10 Gewürze ...................................................................................................... 12 2.2.1 Gewürzpflanzen........................................................................................ 12 2.2.2 Ätherische Öle .......................................................................................... 14 2.3 2.2.2.1 Funktion und Zusammensetzung ätherischer Öle ............................ 14 2.2.2.2 Antimykotische Aktivität von ätherischen Ölen ................................. 18 2.2.2.3 Antibakterielle Aktivität von ätherischen Ölen .................................. 20 2.2.2.4 Antibakterielle Aktivität von Inhaltstoffen ätherischer Öle................. 25 2.2.2.5 Mechanismen der antibakteriellen Aktivität ätherischer Öle ............. 27 Bestimmung der antimikrobiellen Aktivität von Gewürzen und ätherischen Ölen in vitro ................................................................................................. 29 2.3.1 Agardiffusion............................................................................................. 30 2.3.2 Bouillondilution ......................................................................................... 31 2.3.3 Bioimpedanzmessung .............................................................................. 33 3 Eigene Untersuchungen ................................................................................... 35 3.1 Material........................................................................................................ 35 3.1.1 Inhaltsstoffe ätherischer Öle ..................................................................... 35 3.1.2 Verwendete Bakterienstämme.................................................................. 35 3.1.3 Nährmedien .............................................................................................. 36 3.1.4 Lösungen .................................................................................................. 36 3.1.5 Technische Geräte und Verbrauchsmaterialen ........................................ 37 3.2 Methoden .................................................................................................... 37 3.2.1 Kultivierung und Sicherung der Bakterienstämme .................................... 37 3.2.2 Einzelstoffe ............................................................................................... 38 3.2.2.1 Ermittlung der Konzentrationen von Inhaltsstoffen ätherischer Öle ................................................................................................... 38 3.2.2.2 Herstellung und Lagerung von Stammlösungen der Inhaltsstoffe ätherischer Öle ............................................................ 42 3.2.2.3 Vorbereitung der Keimsuspension ................................................... 44 3.2.2.4 Belegung der Mikrotiterplatte ........................................................... 45 3.2.2.5 Beobachtung des Bakterienwachstums ........................................... 51 3.2.2.6 Bestimmung der Keimzahl ............................................................... 51 3.2.3 Stoffkombinationen ................................................................................... 52 3.3 3.2.3.1 Kombinationen mit Thymol............................................................... 53 3.2.3.2 Kombinationen mit Carvacrol ........................................................... 54 3.2.3.3 Herstellung und Lagerung der Stammlösungen ............................... 56 3.2.3.4 Versuchsablauf ................................................................................ 56 Auswertung ................................................................................................. 56 4 Ergebnisse ......................................................................................................... 59 4.1 Proben ohne Zusatz von Inhaltsstoffen ätherischer Öle .............................. 59 4.2 Antimikrobielle Wirksamkeit der Einzelstoffe ............................................... 60 4.2.1 Thymol...................................................................................................... 60 4.2.2 Carvacrol .................................................................................................. 65 4.2.3 Linalool ..................................................................................................... 71 4.2.4 1,8-Cineol ................................................................................................. 77 4.2.5 α-Pinen ..................................................................................................... 83 4.2.6 α-Terpineol ............................................................................................... 88 4.3 Antimikrobielle Wirksamkeit der Stoffkombinationen ................................... 94 4.3.1 Thymol und Carvacrol .............................................................................. 94 4.3.2 Thymol und Linalool ............................................................................... 101 4.3.3 Thymol und 1,8-Cineol ........................................................................... 107 4.3.4 Thymol und α-Pinen ............................................................................... 114 4.3.5 Thymol und α-Terpineol.......................................................................... 120 4.3.6 Carvacrol und Linalool ............................................................................ 126 4.3.7 Carvacrol und 1,8-Cineol ........................................................................ 132 4.3.8 Carvacrol und α-Pinen ............................................................................ 138 4.3.9 Carvacrol und α-Terpineol ...................................................................... 144 5 Diskussion ....................................................................................................... 150 5.1 Eignung von Material und Methode ........................................................... 150 5.1.1 Auswahl der Bakterien............................................................................ 150 5.1.2 Auswahl der Inhaltsstoffe ätherischer Öle .............................................. 151 5.1.3 Stammlösungen...................................................................................... 152 5.1.4 Messung der optischen Dichte ............................................................... 153 5.1.5 Definition der antimikrobiellen Wirksamkeit ............................................ 153 5.1.6 Statistische Auswertung ......................................................................... 154 5.1.7 Vergleichbarkeit der Ergebnisse ............................................................. 155 5.2 Einzelstoffe ................................................................................................ 156 5.3 Stoffkombinationen .................................................................................... 161 5.4 Bedeutung der Ergebnisse für die Einschätzung der antimikrobiellen Wirksamkeit von Gewürzen ...................................................................... 164 5.5 Einschätzung der zu erwartenden antimikrobiellen Wirksamkeit von Gewürzen in Lebensmitteln....................................................................... 165 5.6 Kombination von Gewürzen und anderen Verfahren zur Haltbarmachung von Lebensmitteln ..................................................................................... 167 5.6.1 Gewürze und Schutzkulturen.................................................................. 167 5.6.2 Gewürze und konservierende Zusatzstoffe ............................................ 169 5.6.3 Gewürze und physikalische Verfahren zur Haltbarmachung .................. 171 6 Schlussfolgerungen ........................................................................................ 173 7 Zusammenfassung .......................................................................................... 175 8 Summary .......................................................................................................... 178 9 Schriftumsverzeichnis .................................................................................... 181 10 Anhang ............................................................................................................. 196 10.1 Tabellenanhang ......................................................................................... 196 10.1.1 Keimzahlen Einzelstoffe ......................................................................... 196 10.1.2 Trübungsmesswerte der Einzelstoffe ..................................................... 202 10.1.3 Keimzahlen Stoffkombinationen ............................................................. 211 10.1.4 Trübungsmesswerte der geprüften Stoffkombinationen ......................... 220 10.2 Technische Geräte und Verbrauchsmaterialien ........................................ 229 10.3 Tabellenverzeichnis ................................................................................... 233 10.4 Abbildungsverzeichnis ............................................................................... 245 10.5 Abkürzungsverzeichnis .............................................................................. 252 1 Einleitung 1 Einleitung Eine möglichst lange Haltbarkeit von Lebensmitteln ist heute aufgrund ihrer weiträumigen Distribution von großer Bedeutung. Bisher wird eine verlängerte Haltbarkeit von Lebensmitteln vornehmlich durch technologische Maßnahmen sowie Zusatz von Konservierungsstoffen erreicht. Aufgrund der zunehmend kritischen Einstellung des Verbrauchers gegenüber synthetischen Konservierungsstoffen und der stetig steigenden Nachfrage nach unbehandelten „natürlichen“ Lebensmitteln sind Gewürze mit mikrobiologischer Hemmwirkung als mögliche Alternative zu Konservierungsstoffen interessant. Bereits seit Jahrtausenden werden Gewürze zur Aromatisierung von Lebensmitteln und Getränken verwendet. Viele Gewürze und Kräuter besitzen zudem eine nachgewiesene antimikrobielle Wirksamkeit. Das Ausmaß der antimikrobiellen Aktivität der Gewürze hängt stark von der Menge und Zusammensetzung ihres ätherischen Öls ab, die zum Teil erheblichen Schwankungen unterworfen sind. Ihre antibakterielle Wirksamkeit lässt sich daher nicht zuverlässig vorhersagen. Verfügbare Daten über die antimikrobielle Wirksamkeit beziehen sich vor allem auf ätherische Öle, seltener auf einzelne Inhaltsstoffe ätherischer Öle. Die antibakterielle Aktivität von Kombinationen unterschiedlicher Ölkomponenten wurde bisher nur in geringem Umfang untersucht. Zudem wurde in vielen Studien die antimikrobielle Wirksamkeit ätherischer Öle bzw. ihrer Inhaltsstoffe ausschließlich qualitativ bestimmt. Weiterhin wurde überwiegend die antimikrobielle Wirksamkeit von ätherischen Ölen bzw. deren Einzelkomponenten gegenüber Lebensmittelinfektionsund –intoxikationserregern überprüft. Daher liegen nur wenige Informationen über die Wirksamkeit von ätherischen Ölen und deren Einzelkomponenten gegenüber Lebensmittelverderbniserregern vor. Im Hinblick auf eine mögliche Nutzung von Gewürzen zur Haltbarmachung von Lebensmitteln ist jedoch eine zuverlässige Vorhersagbarkeit ihrer antibakteriellen Wirksamkeit gegen Lebensmittelverderbniserreger nötig. 1 1 Einleitung Im Rahmen der vorliegenden Arbeit wurden daher zunächst sechs einzelne Inhaltsstoffe ätherischer Öle in unterschiedlichen Konzentrationen auf ihre antimikrobielle Wirksamkeit gegenüber verschiedenen Mikroorganismenspezies geprüft. Anschließend wurden diese Inhaltsstoffe in unterschiedlichen Konzentrationen miteinander kombiniert, um mögliche synergistische bzw. antagonistische Effekte gegenüber den ausgewählten Mikroorganismen ermitteln zu können. Als Methode für die eigenen Untersuchungen wurde die Bouillonmikrodilution in Kombination mit Messung der optischen Dichte und Bestimmung der Keimzahl mittels Tropfplattenverfahren gewählt. Auf diese Weise können quantitative Aussagen über die antimikrobielle Aktivität von einzelnen Inhaltsstoffen ätherischer Öle bzw. ihrer Kombinationen getroffen werden. Die Ergebnisse sollen nach Kenntnis der Menge und Zusammensetzung eines ätherischen Öls Rückschlüsse auf die keimhemmende Wirksamkeit des Gewürzes gegenüber den ausgewählten Lebensmittelverderbniserregern ermöglichen. 2 2 Wissenschaftliches Schrifttum 2 Wissenschaftliches Schrifttum 2.1 Haltbarkeit von Lebensmitteln Die Haltbarkeit von Lebensmitteln ist definiert als der Zeitraum, über den ein Lebensmittel gelagert werden kann, ehe es verdirbt (BORCH et al. 1996). Verderb ist charakterisiert durch das Auftreten jeglicher Veränderungen, die das Lebensmittel in sensorischer Hinsicht ungenießbar machen (GRAM et al. 2002). Diese Veränderungen können durch physikalische Schädigung, chemische Veränderungen sowie Vermehrung und Stoffwechselaktivität von Mikroorganismen hervorgerufen werden. Der mikrobielle Verderb stellt die mit Abstand häufigste Ursache des Lebensmittelverderbs dar (GRAM et al. 2002). Insgesamt hängt die Haltbarkeit wesentlich von Art, Anzahl und folgender Vermehrung der in einem Lebensmittel vorhandenen Mikroorganismen, insbesondere der Bakterien, ab. (BORCH et al. 1996). 2.1.1 Mikrobielle Verderbnis In stark proteinhaltigen Lebensmitteln wie Fleisch, Fisch, Milch sowie in einigen Milchprodukten schreitet der mikrobielle Verderb am deutlichsten und schnellsten voran. Diese Lebensmittel besitzen einen neutralen bis leicht sauren pH-Wert und weisen einen hohen Gehalt an Nährstoffen sowie Feuchtigkeit auf. Diese Zusammensetzung stellt eine optimale Vorraussetzung für das Wachstum eines breiten Spektrums von Mikroorganismen dar (HUIS IN`T VELD 1996). Jedes Produkt besitzt eine spezifische Mikroflora, deren Zusammensetzung in Abhängigkeit von Rohmaterial, Verarbeitungsprozess, Konservierung oder Lagerungsbedingungen variiert (GRAM et al. 2002). Nach HUIS IN`T VELD (1996) können Lebensmittelverderbniserreger grob schematisch in Gruppen eingeteilt werden: Gram-negative stäbchenförmige Bakterien, Gram-positive sporenbildende Bakterien, Milchsäure bildende Bakterien, andere Gram-positive Bakterien sowie Hefen und Schimmelpilze. 3 2 Wissenschaftliches Schrifttum Der Verderb von gekühltem und unter Normalatmosphäre gelagertem Fisch, Gefügelfleisch, rotem Fleisch sowie Milch- und Milchprodukten wird von aeroben, psychrotrophen stäbchenförmigen Bakterien bestimmt (CRAVEN u. MACAULY 1992, BORCH et al. 1996, UPMANN et al. 2000). Verschiedene Arten von Pseudomonas, Photobacterium, Aeromonas, Shewanella und einige Stämme der Enterobacteriaceae sind die am häufigsten vorkommenden Bakterien, wobei die aerobe Verderbnisflora unter Kühltemperaturen überwiegend von Pseudomonas (Ps.) spp. dominiert wird (HUIS IN`T FELD 1996, UPMANN et al. 2000a, GRAM et al. 2002). Bei Temperaturen über 5 – 10 °C dominieren jedoch Enterobacteriaceae über Pseudomonas spp. (HUIS IN`T VELD 1996). Die Eliminierung von Sauerstoff und/oder die Beimischung von Kohlenstoffdioxid in der Atmosphäre führt zu einer Unterdrückung der Pseudomonas spp. und zu einer Verschiebung des Milchsäurebildner, Gleichgewichts der Enterobacteriaceae Verderbnisflora und auf Brochothrix (B.) die Seite der thermosphacta (DAINTY u. MACKEY 1992, GRAM et al. 2002). Bei einer Temperatur von 5 °C dominiert B. thermosphacta die Gram-positive Mikroflora von Hackfleisch (KÖPKE, 2002). Mit abnehmender Temperatur, beginnend bei 4 °C, werden B. thermosphacta und Enterobacteriaceae jedoch zunehmend in ihrem Wachstum gehemmt. Eine drastische Reduktion der Anzahl von B. thermosphacta und der Enterobacteriacae kann erst bei – 1,5 °C beobachtet werden (BORCH et al. 1996). Milchsäurebildner wie Lactobacillus, Streptococcus, Leuconostoc und Pediococcus spp. wachsen bei Kühltemperaturen langsam und werden unter aeroben Bedingungen von Pseudomonaden unterdrückt (HUIS IN`T VELD 1996). Jedoch können sie ebenso wie B. thermosphacta die Verderbnisflora von vakuumverpacktem Fleisch dominieren und scheinen auch für den Verderb von wenig konservierten Fischprodukten verantwortlich zu sein (BORCH et al. 1996, HUIS IN`T VELD 1996). Gemüse stellt aufgrund seiner Nährstoffzusammensetzung einen Sonderfall dar. Der relativ hohe pH-Wert im Gemüse begünstigt das Wachstum von Gram-negativen Bakterien, der Verderb wird jedoch vornehmlich von Pektin und Polymer zersetzenden Mikroorganismen verursacht (LIAO et al. 1997). Gewöhnlich handelt 4 2 Wissenschaftliches Schrifttum sich dabei um verschiedene Pilzarten, Pseudomonas spp. und Erwinia spp. (PITT u. HOCKING 1997). Mikrobieller Verderb äußert sich durch geruchliche und geschmackliche Veränderungen, Farbabweichungen, Schleimbildung, Gasproduktion, pH-WertErhöhung und sichtbarem Wachstum von Bakterienkolonien (BORCH et al. 1996, HUIS IN`T VELD 1996). Diese Veränderungen werden vor allem durch Produkte des bakteriellen Metabolismus hervorgerufen. B. thermosphacta, Enterobacteriaceae und homofermentative Laktobazillen produzieren durch Glycolyse Acetoin, Diacetyl und 3-Methylbutanol, welche dem Fleisch einen käsig-sauren Geruch verleihen (DAINTY u. MACKEY 1992). Ein fruchtiger Geruch kann bei Fisch und Fleisch durch Produktion von Estern durch Ps. fragi und Ps. putida verursacht werden (MILLER et al. 1973, CORMIER et al. 1991). Shewanella putrefaciens und Aeromonas spp. führen durch Bildung von Trimethylamin zu einem unangenehm fischigen Geruch bei Fisch, Shewanella putrefaciens verursacht zudem schwefligen Geruch bei Fleisch und Fisch durch Bildung von Schwefelwasserstoff (CHAI et al. 1968, SHAW u. SHEWAN 1968, GRAM et al. 1990). Aufgrund ihrer Bedeutung beim Verderb von Lebensmitteln, insbesondere solcher tierischer Herkunft, B. thermosphacta soll und auf Pseudomonas Aeromonas spp. spp. als Enterobacteriaceae, Vertreter potentieller Lebensmittelinfektionserreger näher eingegangen werden. 2.1.1.1 Enterobacteriaceae Enterobacteriaceae sind Gram-negative, Oxidase-negative und fakultativ anaerobe Stäbchen, die Nitrat zu Nitrit reduzieren und Glucose fermentieren (HOLZAPFEL et al. 2004). Angehörige der Familie der Enterobacteriaceae finden sich vor allem als Bestandteil der Mikroflora des menschlichen und tierischen Darminhalts. Daher wird die Anwesenheit von Enterobakteriazeen auf Lebensmitteln oft als Indikator für fäkale Kontamination, mangelnde Hygiene bei der Herstellung von Lebensmitteln, 5 2 Wissenschaftliches Schrifttum Rekontamination nach der Herstellung sowie unzureichende Kühlung gewertet (HUIS IN`T VELD 1996, HOLZAPFEL et al. 2004). Einige Arten der großen Familie der Enterobacteriaceae kommen jedoch regelmäßig im Erdboden, Wasser und auf Pflanzen vor (HOLZAPFEL et al. 2004). Enterobacteriaceae spielen eine Rolle als Lebensmittelverderbniskeime, Lebensmittelinfektions- und -intoxikationserreger. Salmonella und Shigella spp. sind obligat pathogene Mikroorganismen; Escherichia, Citrobacter, Klebsiella, Proteus und Serratia spp. hingegen sind fakultativ pathogene Bakterien (STILES et al 1989, MAURELLI u. LAMPEL 1997, TSCHÄPE u. BOCKEMÜHL 2002). Einige Stämme von Escherichia (E.) coli, Salmonellen, Shigellen und Yerisinia (Y.) enterocolitica sind zudem als Lebensmittelintoxikationserreger bedeutsam (MEAD et al. 1999). Angehörige der Familie der Enterobacteriaceae wachsen insbesondere auf gekühltem Fleisch unter aeroben Bedingungen sehr gut, sind aber auch in vakuumverpacktem Fleisch gut vermehrungsfähig. In vakuumverpacktem Fleisch sind insbesondere Hafnia (H.) alvei, Serratia (Se.) liquefaciens und Enterobacter spp. zu finden (BORCH et al 1996). Bei Temperaturen unter – 1,5 °C wird das Wachstum d er Enterobakteriazeen stark reduziert, Temperaturen ab 4 °C bewirken eine stark e Zunahme des Wachstums. Während bei – 1,5 °C Se. liquefaciens unter den Enterobacteriaceae in der Flora des gekühlten Fleisches dominiert, dominiert bei + 4 °C H. alvei (BORCH et al. 1996). Die Bildung von Hydrogensulfid ruft einen fauligen Geruch bei verdorbenem Fleisch hervor, zudem verursachen die Eneterobakteriazeen durch Produktion von 3-Methylbutanol, Diacetyl und Acetoin aus Glucose einen käsigen Geruch bei verdorbenem Fleisch (DAINTY u. MACKEY 1992, BORCH et al. 1996). 2.1.1.2 Pseudomonas spp. Pseudomonas spp. sind Gram-negative, Oxidase-negative, polar begeißelte und obligat aerobe Kurzstäbchen (HOLZAPFEL et al. 2004). Einige Arten bilden gelbgrüne oder blaugrüne Farbstoffe, die unter UV-Licht lebhaft fluoreszieren. Pseudomonaden dominieren die Mikroflora von gekühltem, aerob gelagertem Fleisch (DAINTY u. MACKEY 1992). Des Weiteren kommen Pseudomonaden im 6 2 Wissenschaftliches Schrifttum Oberflächen-, Grund- und Trinkwasser, gewaschenen Salaten, Mischsalaten sowie insgesamt häufig in gekühlten, proteinreichen Lebensmitteln vor (HOLZAPFEL et al. 2004). Auch in gepökelten Rohfleischprodukten sind Pseudomonas spp. zu finden. Neben ihrer Bedeutung als Lebensmittelverderbniserreger besitzen einige Pseudomonaden auch eine Bedeutung als pathogene Keime. Insbesondere Ps. aeruginosa spielt als Erreger eitriger Entzündungen in der Humanmedizin eine Rolle (LYCZAK et al. 2000). Pseudomonaden verursachen durch mehrere Mechanismen den Verderb von Lebensmitteln. Im frühen Stadium des Verderbs von Lebensmitteln tierischer Herkunft werden zunächst Nicht-Protein-Stickstoffe zersetzt. Anschließend folgt die Produktion von Lipasen und Proteasen, die zur Freisetzung von Fett- und Aminosäuren führen. Die Metabolisierung von Fett- und Aminosäuren führt zu geruchlichen und geschmacklichen Abweichungen (HUIS IN`T VELD 1996). So verursachen Pseudomonaden, insbesondere Ps. fragi, durch Produktion von Ethylestern und schwefelhaltigen Verbindungen einen fruchtig-süßlichen bzw. fauligen Geruch bei verdorbenem Fleisch (BORCH et al. 1996). Im Rahmen des fortschreitenden Verderbs werden eine extrazelluläre Schleimbildung sowie das Wachstum von sichtbaren Pseudomonas-Kolonien, oft pigmentiert, sichtbar (HUIS IN`T VELD 1996). Da es sich bei Pseudomonas spp. um obligat aerobe Keime handelt, führt eine Abnahme an Sauerstoff in der Atmosphäre zu einer drastischen Abnahme der Pseudomonaden in der Mikroflora von gekühlten, proteinreichen Lebensmitteln (GRAM et al. 2002). Ab einem aw-Wert von < 0,97 sind Pseudomonaden nicht mehr vermehrungsfähig (BORCH et al. 1996). Eine Absenkung des Wassergehalts oder Zugabe von Salz führt daher zu einer Abnahme der Pseudomonaden in der Mikroflora (TRUELSTROP-HANSEN u. HUSS 1998). 2.1.1.3 Brochothrix thermosphacta B. thermosphacta ist ein Gram-positives, nicht bewegliches und fakultativ anaerobes kokkoides Stäbchen (HOLZAPFEL et al. 2004). Die Morphologie ändert sich jedoch 7 2 Wissenschaftliches Schrifttum mit zunehmendem Alter der Kolonien von überwiegend stäbchenförmig hin zu kettenbildenden Kokken (RATTANASOMBOOM et al. 1999). Neben Pseudomonas spp. und Enterobacteriaceae dominiert B. thermosphacta die Mikroflora in gekühlt gelagertem Fleisch (BORCH et al. 1996). Die Temperaturgrenzen für das Wachstum von B. thermosphacta liegen nach SKOVGAARD (1985) zwischen 0 °C und 30 °C, JEREMIAH et al. (1993) beobachteten noch bei – 1,5 °C ein Keimwachstum. Be i 5 °C ist B. thermosphacta der vorherrschende Verderbniserreger in der Gram-positiven Mikroflora in Hackfleisch (KÖPKE, 2002). Bei pH-Werten ≤ 5,8 ist B. thermosphacta nicht mehr vermehrungsfähig (GRAU 1981), wächst jedoch bei einem Gehalt von 100 % CO2 (JEREMIAH et al. 1993). In Vakuum- oder unter modifizierter Schutzatmosphäre verpackten Fleischprodukten dominiert B. thermosphacta die Keimflora (GARDNER 1981, HUIS IN`T VELD 1996). Unter aeroben Bedingungen zersetzt B. thermosphacta sowohl Glukose als auch Glutamat, unter anaeroben Bedingungen jedoch nur Glukose (GRAU 1981). Im Rahmen des Stoffwechsels von B. thermosphacta entstehen die Metaboliten Acetoin, Diacetyl und 3-Methylbutanol, die zu einem käsigen Geruch des Lebensmittels führen (DAINTY u. MACKEY 1992). 2.1.1.4 Aeromonas spp. Aeromonas (A.) spp. sind Gram-negative, unbewegliche Stäbchen und gehören zur Familie der Vibrionaceae (MERINO et al. 1995). NEYTS et al. (2000) untersuchten Lebensmittel auf das Vorkommen von Aeromonaden. Insgesamt befanden sich in 26 % der Gemüseproben, 72 % der Shrimps- und Fischproben und 70 % der Fleischproben Aeromonaden, wobei A. hydrophila am häufigsten vertreten war. Die optimale Wachstumstemperatur für Aeromonaden beträgt 28 °C, es gibt jedoch zahlreiche psychrotrophe Stämmen, die auch bei Temperaturen von 0 – 5 °C Wachstum zeigen. Aeromonas spp. vermehren sich gut in Lebensmitteln mit einem pH-Wert > 6, ein Gehalt von maximal 0,5 % NaCl im Lebensmittel wird toleriert (MERINO et al. 1995). Da Aeromonaden auch unter anaeroben Bedingungen 8 2 Wissenschaftliches Schrifttum vermehrungsfähig sind, sind sie auch in vakuumverpacktem Fleisch zu finden (LAMBERT et al. 1991; MERINO et al. 1995). Aeromonas spp. reduzieren im aeroben Stoffwechsel Trimethylaminoxid zu Trimethylamin und verursachen so einen unangenehm „fischigen“ Geruch bei Fisch (GRAM u. DAALGARD 2002). A. hydrophila und A. veronii sobria gelten als enteropathogene Stämme. Durch Toxinbildung verursachen sie gelegentlich Gastroenteritiden, wobei insbesondere Kleinkinder, ältere und immunsupprimierte Menschen betroffen sind (MERINO et al. 1995, KRÄMER 2007). 2.1.2 Beeinflussung des Verderbs von Lebensmitteln Der Verderb von Lebensmitteln und Getränken ist häufig das Ergebnis mikrobieller Aktivität. Dabei sind die Zusammensetzung sowie das Wachstum der Mikroflora eines bestimmten charakteristischen Lebensmittels Eigenschaften, oder Getränkes Bedingungen abhängig während der von dessen Lagerung des Lebensmittels und dem Verfahren, mit dem das Lebensmittel hergestellt wurde (HUIS IN`T VELD 1996). 2.1.2.1 Grundlagen Parameter, die das Wachstum von Mikroorganismen in Lebensmitteln beeinflussen, werden in mehrere Gruppen aufgeteilt: Intrinsic und Extrinsic factors, Implicit factors sowie Process factors. Diese Faktoren bestimmen sowohl Art als auch die Geschwindigkeit des Verderbs (MOSSEL et al. 1995). Intrinsic factors sind die physikochemischen und strukturellen Eigenschaften, die sowohl Gestaltung als auch Wachstumsgeschwindigkeit der Mikroflora beeinflussen. Zu diesen Faktoren gehören pH-Wert, Wasseraktivität, Redoxpotential, Gehalt an verfügbaren Nährstoffen und Vorkommen von natürlichen antimikrobiell wirksamen Stoffen im Lebensmittel (MOSSEL et al. 1995, HUIS IN`T VELD 1996). Unter Extrinsic factors versteht man äußere, gezielt beeinflussbare Parameter, die Vermehrung und Lebensbedingungen von Mikroorganismen in Lebensmitteln entscheidend beeinflussen. Temperatur, 9 Partialdrücke von Gasen und 2 Wissenschaftliches Schrifttum atmosphärische Einflüsse werden dieser Gruppe zugeordnet (HUIS IN`T VELD 1996, HOLZAPFEL et al. 2004). Process factors sind physikalische sowie chemische Behandlungen während des Herstellungsprozesses, die Veränderungen der Eigenschaften des Lebensmittels zur Folge haben und sich somit auf Intrinsic factors und Extrinsic factors auswirken (HUIS IN`T VELD 1996). Implicit factors sind das Ergebnis bakteriellen Wachstums im Lebensmittel und können synergistische sowie antagonistische Wirkungen auf die Aktivität anderer Mikroorganismen im Lebensmittel entfalten (MOSSEL et al. 1995). Synergistisch wirkende Implicit factors können Stoffwechselprodukte einer Mikroorganismenart sein, die essentielle Nährstoffe für eine andere darstellen oder durch den Stoffwechsel einer Bakterienart verursachte Änderungen des pH-Werts, wodurch einem anderen Mikroorganismus das Wachstum erst ermöglicht wird (HUIS IN`T VELD 1996). Von Bakterien produzierte, antimikrobiell wirksame Stoffe, z.B. Bacteriocine, gehören zu den antagonistisch wirkenden Implicit factors (ABEE et al. 1996). 2.1.2.2 Verfahren zur Haltbarkeitsverlängerung Zur Haltbarkeitsverlängerung von Lebensmitteln eingesetzte Verfahren sollten sowohl pathogene Keime als auch Verderbniskeime abtöten oder hemmen, während das Lebensmittel für den Verbraucher gesundheitlich unbedenklich bleibt. Zudem darf das Verfahren zur Haltbarkeitsverlängerung die Qualität des Lebensmittels nicht negativ beeinflussen und muss die charakteristischen Eigenschaften des Rohmaterials - soweit möglich - erhalten (LAMBERT et al. 1991). Verfahren, die den mikrobiellen Verderb verzögern oder verhindern, können in drei Klassen eingeteilt werden (FEHLHABER et al. 2005, KRÄMER 2007). Physikalische Verfahren verhindern den Verderb mittel- oder langfristig durch Wärmeentzug (Kühlen, Tiefgefrieren), Wärmebehandlung, Schutzgasverpackung (MAP = modified atmosphere packaging) oder ionisierende Strahlung (KRÄMER et al. 2007). 10 2 Wissenschaftliches Schrifttum Bei den chemischen Verfahren werden die Mikroorganismen durch Zusatz von Konservierungsstoffen, Pökeln, Säuern oder Räuchern in ihrem Wachstum gehemmt oder abgetötet (FEHLHABER et al. 2005). Die biologischen Verfahren zur Haltbarmachung von Lebensmitteln umfassen die alkoholische und die Milchsäuregärung (KRÄMER 2007). Häufig reicht eine einzige konservierende Maßnahme, um ein Lebensmittel sicher vor mikrobiologischem Verderb zu schützen (KRÄMER 2007). Allerdings birgt dieses Vorgehen die Gefahr einer massiven Veränderung der sensorischen und ernährungsphysiologischen Qualität des Lebensmittels sowie einer Beeinträchtigung der gesundheitlichen Unbedenklichkeit des Lebensmittels (KRÄMER 2007). Durch Kombination von zwei Maßnahmen kann jedoch die Intensität der einzelnen Maßnahme reduziert werden (LEISTNER 1986). Ebenso können Einflüsse, die einzeln nicht zu einer Haltbarkeitsverlängerung eines Lebensmittels führen, in Kombination miteinander weitaus bessere konservierende Eigenschaften entfalten (LAMBERT et al. 1991). Die kombinierte Anwendung mehrerer haltbarkeitsverlängernder Maßnahmen wird als Hürdenprinzip bezeichnet (LEISTNER 1986). Das Hürdenprinzip besagt, dass eine ausreichende Anzahl von „inhibitorischen Faktoren“ (=Hürden) in einer ausreichenden Konzentration in ihrer Summe ein Lebensmittel optimal konservieren können, auch wenn ein einzelner dieser Faktoren das Wachstum der Mikroorganismen nicht reduzieren oder verhindern kann (LAMBERT et al. 1991). So kann durch Kombination von Kühllagerung und MAP die Haltbarkeit von rohem Fleisch deutlich verlängert werden. Werden zusätzlich chemische Dekontamination des Rohmaterials und gering dosierte Bestrahlung eingesetzt, führt dies zu einer weiteren Haltbarkeitsverlängerung von rohem Fleisch (LAMBERT et al. 1991) 11 2 Wissenschaftliches Schrifttum 2.2 Gewürze 2.2.1 Gewürzpflanzen Als Gewürz bezeichnet man naturbelassene Pflanzenteile der verschiedenster Art meist getrocknet- die sich durch einen Gehalt an aromatischen oder scharf schmeckenden Inhaltsstoffen auszeichnen und daher zur geschmacklichen Beeinflussung von Lebensmitteln eingesetzt werden. Die Qualität eines Gewürzes wird nach seinem Gehalt an aromatisch oder scharf schmeckenden Stoffen beurteilt, der hauptsächlich von dem Gehalt an ätherischen Ölen abhängt. Von 345 000 Pflanzenarten enthalten nur etwa 2 300 ätherische Öle, davon wiederum wird nur ein Bruchteil zum Würzen verwendet (GERHARDT 1994). Gewürze werden nach GERHARDT (1994) nach Art der Pflanzenteile, aus denen sie gewonnen werden, eingeteilt. Danach ergeben sich folgende Gruppen: Samen und Früchte (Semina, Fructi): Pfeffer, Piment, Muskatnuss, Chilie, Senf, Kümmel, Paprika, Vanille, Wacholderbeeren, Anis, Kardamom, Fenchel, Koriander, Dill. Kräuter und Blätter (Herba, Folia): Bohnenkraut, Oregano, Rosmarin, Majoran, Thymian, Basilikum, Salbei, Melisse, Sellerie, Dill, Estragon, Petersilie. Blüten und Blütenteile (Flores): Zimtblüten, Nelken, Safran, Kapern. Wurzeln (Radices): Ingwer, Curcuma, Zitwer, Galgant, Liebstockwurzel, Meerrettich, Kalmus. Rinden (Cortices): Zimtrinde. Zwiebeln (Bulbi): Zwiebeln, Knoblauch. 12 2 Wissenschaftliches Schrifttum Bereits seit Jahrhunderten ist bekannt, dass viele Pflanzen mit aromatischen Eigenschaften auch medizinische, konservierende, antioxidative und antimikrobielle Eigenschaften besitzen (PARRY 1953). In der Medizin wird Kümmel aufgrund seiner karminativen Wirkung, Rosmarin aufgrund seiner Eigenschaften spasmolytischen, geschätzt. Thymian choleretischen wird und insbesondere hepatoprotektiven aufgrund seiner bronchospasmolytischen, sekretomotorischen und expektorierenden Fähigkeiten in der Behandlung von Atemwegserkrankungen eingesetzt (KRAFT 2000). Des Weiteren verfügen antimykotische und Rosmarin, antivirale Thymian und Eigenschaften Kümmel über gegenüber antibakterielle, humanpathogenen Mikroorganismen (KRAFT 2000). Die antimikrobielle Aktivität von Gewürzen gegenüber Lebensmittelverderbniserregern ist ebenfalls schon seit Jahrhunderten bekannt (SHELEF 1983, DEANS u. RITCHIE 1987). Zudem wiesen DORMAN et al. (2000) eine antioxidative Wirkung von Nelken und Muskat nach. In Untersuchungen von BARATTA et al. (1998) entfalteten Rosmarin und Majoran eine stärkere antioxidative Wirkung als α-Tocopherol. Aufgrund des zunehmenden Wunsches der Verbraucher nach möglichst naturbelassenen Lebensmitteln und hoher Lebensmittelsicherheit bei gleichzeitig zunehmender Ablehnung chemisch-synthetischer Zusatzstoffe hat sich das Interesse an Gewürzen als antimikrobiell wirksamer Zusatz zu Lebensmitteln verstärkt (FALEIRO et al. 2005, HOLLEY u. PATEL 2005). So wurden unter anderem bei Thymian, Oregano, Basilikum und Rosmarin eine antibakterielle Wirksamkeit gegenüber Lebensmittelverderbniserregern und auch antimykotische Eigenschaften nachgewiesen (QUATTARA et al. 1997, BARATTA et al. 1998, MARINO et al. 1999, DORMAN u. DEANS 2000, ALIGIANNIS et al. 2001). Geschmackliche, antimikrobielle und antioxidative Eigenschaften der Gewürze sowie deren Nutzen in der Phytotherapie werden von Menge und Zusammensetzung ihrer ätherischen Öle bestimmt (GERHARDT 1994, DORMAN u. DEANS 2000, DORMAN et al. 2000, BOZIN et al. 2006). 13 2 Wissenschaftliches Schrifttum 2.2.2 Ätherische Öle Nach GERHARDT (1994) handelt es sich bei ätherischen Ölen um ein in pflanzlichen Speicherzellen vorliegendes, weitgehend von Beimengungen befreites, flüchtiges, öliges Stoffwechselprodukt unterschiedlicher chemischer Zusammensetzung mit einem für jede Pflanze charakteristischen Geruch und Geschmack. Sie werden in der Regel durch Destillation, meist Dampf- oder Hydrodestillation, aus den nichthölzernen Pflanzenteilen gewonnen (DORMAN u. DEANS 2000). Da ätherische Öle nicht direkt bei der Assimilation gebildet werden, sondern erst durch Umwandlung aus primären Assimilaten entstehen, gehören sie zu den sekundären Pflanzeninhaltsstoffen. Insgesamt kann man die Bildung von ätherischen Ölen als Begleiterscheinung des intensiven Stoffwechsels in der Pflanze ansehen (GERHARDT 1994). In der Pflanze werden ätherische Öle abseits der normalen physiologischen Prozesse im Extrazellulärraum oder in Drüsen gespeichert. Dies lässt vermuten, dass sie keine Bedeutung für die notwendigen physiologischen Prozesse in der Pflanze besitzen (DEANS u. WATERMAN 1993). Der Gehalt an ätherischen Ölen in Gewürzpflanzen kann stark variieren. So enthält Oregano etwa 2,42 % bis 5,73 % ätherisches Öl (RUSSO et al. 1998). Der Ölgehalt von Thymian schwankt etwa zwischen 0,75 % und 6,3 % (THOMPSON et al. 2003). Aus Rosmarin lassen sich 1 % bis 2,5 %, aus Majoran bis zu 3,5 % ätherisches Öl gewinnen (KRAFT 2000). Lorbeer enthält 1 % bis 3 % ätherisches Öl (KOVACEVIC et al. 2007). 2.2.2.1 Funktion und Zusammensetzung ätherischer Öle Ätherische Öle erfüllen in der Pflanze eine Vielzahl von Funktionen. Einerseits können sie als Lockmittel für bestäubende Insekten dienen, anderseits als Abwehr gegen Pflanzenfresser. So kann das Sesquiterpen Juvabion, welches im ätherischen Öl von Basilikum vorkommt, anscheinend die Entwicklung einiger Insekten zum Adultstadium verhindern (DEANS u. WATERMAN 1993). 14 2 Wissenschaftliches Schrifttum Des Weiteren stellt die antibakterielle und fungizide Wirkung der ätherischen Öle einen bedeutenden Schutz des pflanzlichen Gewebes gegenüber pathogenen Mikroorganismen nach Schädlingsbefall oder nach mechanischer Schädigung der Pflanze dar. Viele Produkte des sekundären Pflanzenstoffwechsels gelangen in den Erdboden, wo sie das Auskeimen von Samen verzögern oder sogar verhindern können. Dieser so genannte allelopathische Effekt kann einer Pflanze einen Vorteil bei der Konkurrenz mit anderen Pflanzenarten verschaffen (DORMAN u. WATERMAN 1993). Ätherische Öle stellen eine komplexe Mixtur aus einer Vielzahl chemischer Verbindungen dar. Der größte Teil der chemischen Ölkomponenten sind Terpene, insbesondere Monoterpene (C10) und Sesquiterpene (C15). Daneben enthalten sie eine Vielzahl an Verbindungen mit geringem Molekulargewicht, z. B. Hydrocarbone, Säuren, Alkohole, Aldehyde oder Lactone. In seltenen Fällen enthalten ätherische Öle auch Cumarine oder Stickstoff- und schwefelhaltige Verbindungen (DORMAN u. DEANS 2000). Der Gehalt an ätherischem Öl in der Pflanze und dessen Zusammensetzung ist von mehreren endogenen und exogenen Faktoren abhängig. So haben genetisch determinierte Eigenschaften der Pflanze, klimatische Bedingungen und Bodenbeschaffenheit des Pflanzenstandorts, der Erntezeitpunkt, das Verfahren zur Trocknung des Pflanzenmaterials und die Lagerungsbedingungen Einfluss auf die Zusammensetzung des ätherischen Öls (DEANS u. RITCHIE 1987, COSENTINO et al. 1999, DAFERERA et al. 2000). Die antimikrobielle Wirksamkeit eines ätherischen Öls hängt wesentlich von seiner Zusammensetzung sowie Struktur und funktionellen Gruppen der Verbindungen im Öl ab (DORMAN u. DEANS 2000). Dabei ist die Gruppe der Terpene verantwortlich für Geruch, Geschmack und antimikrobielle Wirkung eines ätherischen Öls. Insbesondere phenolische Verbindungen mit Hydroxylgruppen entfalten eine starke antimikrobielle Aktivität (DORMAN u. DEANS 2000). 15 2 Wissenschaftliches Schrifttum Die Phenole Thymol, Carvacrol und Eugenol zeigten in mehreren Studien eine starke antimikrobielle Wirkung, wobei sie abhängig von Dosis und Bakterium einen bakteriziden oder bakteriostatischen Effekt hervorriefen (KIM et al. 1995, SIVROPOULOU et al. 1996, BAGAMBOULA et al. 2004, DORMAN u. DEANS 2000, ALIGIANNIS et al. 2001). Thymol und Carvacrol scheinen für die sehr gute antimikrobielle Wirksamkeit von Thymian- und Oreganoöl verantwortlich zu sein. BOZIN et al. (2006) prüften die antimikrobielle Aktivität des ätherischen Öls von Thymian, Oregano und Basilikum auf verschiedene Bakterien. Thymian- und Oreganoöl zeigten eine wesentlich stärkere antibakterielle Wirksamkeit als Basilikumöl, welches nur einen geringen Gehalt an Carvacrol aufwies und frei von Thymol war. Die gleiche Beobachtung machten DADALIOĞLU und EVRENDILEK (2004), als sie die antimikrobielle Aktivität gegenüber Lebensmittelinfektionserregern von Oreganoöl mit derjenigen von Lavendel, Lorbeer und Fenchel verglichen. PENALVER et al. (2005) untersuchten die antibakterielle Aktivität von fünf ätherischen Ölen gegen verschiedene Arten der Familie Enterobacteriaceae. Auch in dieser Studie zeigten Öle mit einem höheren Gehalt an Thymol und Carvacrol ein größeres inhibitorisches Potential als Öle mit einem geringeren Anteil der beiden Phenole. Eine ebenfalls beachtenswerte antimikrobielle Wirkung entfalten Verbindungen aus der Gruppe der Alkohole und Aldehyde. So weisen die beiden Monoterpen-Alkohole Linalool und α-Terpineol eine gute antibakterielle Aktivität gegen verschiedene Lebensmittelverderbniserreger (z. B. B. thermosphacta, Lactobacillus plantarum) sowie einige pathogene Bakterien (z. B. Listeria monocytogenes, Staphylococcus aureus) auf (KIM et al. 1995, DORMAN u. DEANS 2000). Angehörige der Gruppe der Hydrocarbone besitzen keine bzw. nur schwach ausgeprägte antibakterielle Eigenschaften. So konnten ALIGIANNIS et al. (2001), COX et al. (2001) sowie COSENTINO et al. (1999) keine antibakterielle Wirkung der beiden Hydrocarbone para-Cymen und γ-Terpineol gegenüber den geprüften 16 2 Wissenschaftliches Schrifttum Bakterien nachweisen, α-Pinen hingegen wies noch eine mäßige antimikrobielle Wirksamkeit auf (DORMAN u. DEANS 2000). Ketone, z.B. Menthon, weisen ebenfalls nur moderate antimikrobielle Fähigkeiten auf (DORMAN u. DEANS 2000). Beginnend mit der Komponente ätherischer Öle, welche das breiteste Spektrum antimikrobieller Aktivität in ihrer Studie aufwies, reihten DORMAN und DEANS (2000) Inhaltsstoffe wie folgt: Thymol erwies sich als Inhaltsstoff mit dem breitesten Spektrum antimikrobieller Aktivität, gefolgt von Carvacrol, α-Terpineol, Terpinen-4-ol, Eugenol, Linalool, σ-3-Caren, Thujon, cis-hex-3-en-1-ol, Geranylacetat, Citral, Nerol, Geraniol, Menthon, β-Pinen, Limonen, α-Pinen, Borneol, Sabinen, γ-Terpinen, Carvacrolmethylether, Citronellal, Myrcen, Terpinolen, β-Caryophyllen, 1,8-Cineol, α-Bisbolol, Bornylacetat, α-Phellandren, α-Humulen, β-Ocimen, Aromadendren und para-Cymen. Synergistische und antagonistische Effekte zwischen einzelnen Inhaltsstoffen in Bezug auf die antimikrobielle Aktivität ätherischer Öle wurden bereits beobachtet. So zeigten sich synergistische antibakterielle Effekte auf einige Bakterien bei der Kombination von Thymol und Carvacrol (DIDRY et al. 1993). Ein hoher Gehalt an p-Cymen im ätherischen Öl hingegen scheint einen antagonistischen Effekt auf die antimikrobielle Wirksamkeit der phenolischen Komponenten auszuüben (COSENTINO et al. 1999). Teebaumöl besitzt keine antibakteriellen Eigenschaften gegenüber Ps. aeruginosa. Dieser Tatsache liegt nach COX et al. (2001) ein antagonistischer Effekt zwischen Inhaltsstoffen des Teebaumöls zugrunde. Während die Hauptkomponente Terpinen4-ol alleine noch eine gute keimhemmende Leistung gegen Ps. aeruginosa erbringt, ist bei Kombination von Terpinen-4-ol mit den ebenfalls im Teebaumöl vorkommenden Stoffen p-Cymen oder γ-Terpinen keine Wirkung auf Ps. aeruginosa mehr nachweisbar (COX et al. 2001). LACHOWISZ et al. (1998) stellten fest, dass das ätherische Öl von Basilikum eine stärkere antimikrobielle Aktivität entfaltete als die beiden Hauptkomponenten Linalool und Methyl-Chavicol alleine oder in Kombination. Diese Beobachtung ist vermutlich 17 2 Wissenschaftliches Schrifttum auf synergistische Effekte zwischen Linalool und Methyl-Chavicol einerseits und weiteren Inhaltsstoffen des Basilikumöls zurückzuführen. In einer Studie von PINA-VAZ et al. (2004) wurde ein synergistischer Effekt bezüglich der antifungalen Wirkung von Thymol bei Kombination von Thymol mit p-Cymen oder 1,8-Cineol beobachtet. Insgesamt liegen bisher jedoch wenige Informationen bezüglich möglicher Interaktionen zwischen den unterschiedlichen Inhaltsstoffen ätherischer Öle vor (HOLLEY u. PATEL 2005). 2.2.2.2 Antimykotische Aktivität von ätherischen Ölen Hefen und Schimmelpilze besitzen die Fähigkeit, in fast jedem Lebensmittel zu wachsen. Neben dem sichtbaren Wachstum verursachen sie geschmackliche, geruchliche sowie farbliche Veränderungen des Lebensmittels. Schimmelpilze besitzen zudem die Fähigkeit, für Mensch und Tier gefährliche Mykotoxine zu bilden (HOLLEY u. PATEL 2005). Gewürze und deren ätherischen Öle besitzen antimykotische Eigenschaften (SIVROPOULOU et al. 1996) und stellen so auch in Bezug auf den durch Pilze hervorgerufenen Verderb von Lebensmitteln eine interessante Alternative zu herkömmlichen chemisch - synthetischen Zusätzen dar. Einige Pilzarten verursachen systemische oder lokale Mykosen bei Mensch und Tier. Da nur wenige Pharmaka mit antifungaler Wirkung bekannt sind und sich die Resistenzlage zunehmend verschlechtert, stellen Gewürze und ätherische Öle auch in der Medizin eine bedeutende Alternative zu herkömmlichen Antimykotika dar (PINA-VAZ et al. 2004). Screeninguntersuchungen zeigten, dass ätherische Öle bereits in geringen Konzentrationen eine antifungale Wirkung aufweisen (DEANS u. WATERMAN 1993). Insgesamt besitzen ätherische Öle sogar eine stärkere antimikrobielle Wirkung gegenüber Pilzen als gegenüber Gram-positiven Bakterien (SHELEF 1993). Die ätherischen Öle von Zimt, Ylang-Ylang, Basilikum, Zitrone und Majoran hemmten das vegetative Wachstum von Aspergillus niger bei Konzentrationen von weniger als 18 2 Wissenschaftliches Schrifttum 1000 ppm, Rosmarin und Zitronengrasöl ab einer Konzentration von 1000 ppm (BARATTA et al. 1998) Thymian, Anis und Zimtöl konnten in einer Konzentration von 2 % die Bildung von Aflatoxinen, Ochratoxin A und Fumonisin verhindern. Anisöl entfaltete in einer Konzentration von 500 ppm einen fungiziden Effekt auf Aspergillus flavus, Aspergillus parasiticus, Aspergillus ochraceus und Fusarium moniliforme. Die Öle von Kümmel und Fenchel hemmten diese vier Pilze in einer Konzentration von 2000 ppm (SOLIMAN u. BADEAA 2002). BIONDI et al. (1993) testeten Oregano, Thymian und Salbei gegen fünf Pilze bzw. Hefen (Aspergillus niger, Aspergillus terreus, zwei Stämme von Candida albicans, Fusarium spp.) und stellten fest, dass Oregano und Thymian die stärkste antimykotische Wirkung entfalteten. BOZIN et al. (2006) prüften die antimykotische Wirksamkeit von Thymian, Oreganound Basilikumöl gegenüber mehreren pathogenen Hefe- und Pilzarten (Candida albicans, Epidermophyton floccosum, Microsporum canis und drei Trichophyton spp.). Das Öl von Thymian und Oregano zeigte wiederum die beste antimikrobielle Aktivität. Einige ätherische Öle hemmen nicht nur das vegetative Wachstum von Pilzen. So verhinderten 250 – 400 ppm der Öle von Thymian, Oregano und Majoran das Mycelwachstum von Penicillium digitatum, das Auskeimen der Konidien schon bei 250 ppm. Lavendel, Rosmarin und Salbeiöl hemmten das myceliale Wachstum ab einer Konzentration von 1000 ppm (DAFERERA et al. 2000). Nach FARAG et al. (1989) basiert die hervorragende antimykotische Aktivität von Thymian und Oregano wahrscheinlich auf der Bildung von Wasserstoffbrückenbindungen zwischen Hydroxylgruppe von Phenolen (Thymol, Carvacrol) im ätherischen Öl einerseits und dem aktiven Zentrum von Enzymen des Mikroorganismus andererseits. Über die antimykotische Wirksamkeit von Gewürzen bzw. deren ätherischen Ölen im Lebensmittel liegen zum Teil widersprüchliche Abgeben vor. Insgesamt scheint die antimykotische Wirksamkeit natürlicher 19 Hemmstoffe gegenüber Pilzen im 2 Wissenschaftliches Schrifttum Lebensmittel weitaus geringer ausgeprägt zu sein als unter Laborbedingungen (LOPEZ-MALO et al. 2002). Allerdings testeten KUNZ et al. (1995) elf verschiedene Gewürze auf ihre Schimmelpilz-inhibierende Wirkung gegenüber den in Backwaren vorkommenden Schimmelpilzen Cladosporium herbarum, Euroticum repens, Penicillium expansum und Rhizops stolonifer. Im Vergleich zum ungewürzten Kontrollbrot konnte durch Verbacken von Nelke, Wachstumsverzögerung Bohnenkraut der und genannten Oregano Pilze eine und deutliche somit eine Haltbarkeitsverlängerung erzielt werden. 2.2.2.3 Antibakterielle Aktivität von ätherischen Ölen Zahlreiche Studien belegen, dass Gewürze sowie Kräuter in vitro über eine antibakterielle Wirkung verfügen (DEANS u. RITCHIE 1987, KIVANÇ et al. 1991, BIONDI et al. 1993, HAMMER et al. 1999). Insbesondere Oregano, Thymian, Salbei, Rosmarin, Nelke und Teebaum zeigten signifikante inhibitorische Aktivitäten (HOLLEY u. PATEL 2005). Da Naturgewürze jedoch selbst mit Mikroorganismen kontaminiert sind, die die Resultate beeinflussen Gewürzbestandteilen können, (Öle, Extrakte wurden oder die meisten Versuche Einzelkomponenten) mit durchgeführt. Insgesamt wurde beobachtet, dass Gewürzextrakte eine geringere antimikrobielle Wirksamkeit aufweisen als das ganze Gewürz. Allerdings gibt es nur wenige quantitative Daten, die diese Beobachtung stützen (SHELEF 1983). Die Wirksamkeit von ätherischen Ölen wurde in vitro ausgiebig sowohl an Grampositiven als auch Gram-negativen Lebensmittelverderbnis- und -infektionserregern geprüft. DEANS und RITCHIE (1987) testeten die keimhemmende Wirkung von 50 ätherischen Ölen auf insgesamt 25 verschiedene Mikroorganismen. Die breitesten Wirkungsspektren zeigten die Öle von Zimt, Nelke, Thymian, Majoran, Piment, Bittermandel, Lorbeer und Liebstöckel. Bei Verwendung unterschiedlicher Ölkonzentrationen zeigte sich, dass die antibakterielle Wirksamkeit bei niedrigeren Ölkonzentrationen stark nachließ. 20 2 Wissenschaftliches Schrifttum DORMAN und DEANS (2000) stuften die antimikrobielle Aktivität der geprüften ätherischen Öle in absteigender Reihenfolge folgendermaßen ein: Thymian > Oregano > Nelke > Muskat > schwarzer Pfeffer > Geranie. Die hervorragende Hemmwirkung von Thymian und Oregano wurde auch von anderen Autoren bestätigt. So zeigten Thymian und Oregano eine gute antimikrobielle Wirksamkeit gegenüber Salmonella (S.) typhi, S. Enteritidis, S. Typhimurium, Bacillus (B.) subtilis, B. cereus, Staphylococcus (St.) aureus, E. coli, Listeria (L.) monocytogenes und Proteus (P.) vulgaris sowie den Verderbniskeimen Ps. putida, Ps. fluorescens und Se. marcescens (SIVROPOULOU et al. 1996, MARINO et al. 1999 und 2001; CHORIANOPOULOS et al. 2004; BOZIN et al. 2006). Die Öle von Rosmarin, Basilikum, Salbei, Fenchel und Bohnenkraut entfalteten ebenfalls eine bemerkenswerte antimikrobielle Wirkung. So hemmten Salbei und Bohnenkraut unter anderem das Wachstum von B. cereus, L. monocytogenes, E. coli, St. aureus und Enterococcus faecalis (CHORIANOPOULOS et al. 2004, BOZIN et al. 2006). Basilikumöl zeigte in einer Studie von BARATTA et al. (1998) eine ausgezeichnete antibakterielle Wirkung gegen St. aureus, Rosmarinöl hemmte signifikant das Wachstum von Lactobacillus (Lb.) plantarum, Lb. curvatus, A. hydrophila, Se. marcescens, Se. liquefaciens und B. thermosphacta (QUATTARA et al. 1997, BARATTA et al. 1998). Zur Einschätzung der antimikrobiellen Aktivität ätherischer Öle sowie ihrer Inhaltsstoffe wurden häufig Agardiffusionsmethoden verwendet, die jedoch nur eine qualitative Einschätzung der antimikrobiellen Wirksamkeit zulassen (BURT 2004). In einigen in vitro Studien wurde jedoch eine minimale Hemmstoffkonzentration bestimmt (Tabelle 1). 21 2 Wissenschaftliches Schrifttum Tabelle 1: Minimale Hemmstoffkonzentrationen (MHK) von ätherischen Ölen in vitro Fortsetzung Tabelle 1 Ätherisches Öl Geprüfte Bakterien MHK (µl/ml)a Literaturquelle Koriandergrün L. monocytogenes Ps. fragi St. aureus 0,2 4,7 0,2 DELAQUIS et al. (2002) Koriandersamen A. hydrophila 1,25 L. monocytogenes St. aureus 4,7 4,0 STECCHINI et al. (1993) DELAQUIS et al. (2002) Muskat A. hydrophila 10 STECCHINI et al. (1993) Nelke A. hydrophila 0,5 E. coli L. monocytogenes St. aureus 0,4 0,3 0,4 STECCHINI et al. (1993) SMITH-PALMER et al. (1998) E. coli Ps. aeruginosa St. aureus St. epidermidis 0,28 1,27 0,35 0,38 ALIGIANNIS et al. (2001) Leuconostoc mesenteroides Lb. plantarum 0,15 KIVANÇ (1991) Oregano 0,15 22 et al. 2 Wissenschaftliches Schrifttum Fortsetzung Tabelle 1 Ätherisches Öl Literaturquelle Rosmarin St. aureus S. marcesens S. Typhimurium 10 10 20 HAMMER (1999) et al. Salbei St. aureus S. marcescens S. Typhimurium 10 10 20 HAMMER (1999) et al. E. coli C. jejuni S. Enteritidis > 10 > 10 > 10 SMITH-PALMER et al. (1998) E. aerogenes E. coli P. vulgaris Ps. aeruginosa St. aureus 0,06– 0,125 0,06– 0,125 0,06– 0,125 0,06– 0,125 0,06– 0,125 AZAZ et al. (2004) Campylobacter jejuni L. monocytogenes S. Enteritidis 0,4 SMITH-PALMER et al. (1998) Thymian a MHK (µl/ml)a Geprüfte Bakterien 0,2 0,4 -1 -1 In den Literaturquellen wurden die MHKs in den Einheiten ppm, mg ml , % (v/v) und µg ml -1 angegeben. Für eine bessere Vergleichbarkeit wurden die MHKs in die Einheit µl ml umgewandelt, wobei davon ausgegangen wurde, dass die Dichte ätherischer Öle mit der von Wasser gleichzusetzen ist. Der Fehler beträgt ca. 10 %, wurde jedoch aufgrund der besseren Vergleichbarkeit vernachlässigt. Insgesamt scheinen Gram-negative Bakterien resistenter gegenüber der antibakteriellen Wirkung ätherischer Öle zu sein als Gram-positive Bakterien (SHELEF et al. 1983, SMITH-PALMER et al. 1998, MARINO et al. 2001, DELAQUIS et al. 2002). Hingegen konnten DEANS und RITCHIE (1987) sowie QUATTARA et al. (1997) in ihren Studien keine bemerkenswerten Unterschiede bezüglich der Empfindlichkeit Gram-positiver und Gram-negativer Mikroorganismen gegenüber den getesteten Ölen feststellen. A. hydrophila gehört zu den gegenüber ätherischen Ölen sensibelsten Spezies (STECCHINI et al. 1993, WAN et al. 1998). Pseudomonas spp. 23 2 Wissenschaftliches Schrifttum zeigten die höchste Widerstandskraft gegenüber der antimikrobiellen Wirksamkeit ätherischer Öle (SIVROPOULOU et al. 1996, SMITH-PALMER et al. 1998, GALINDO-CUSPINERA et al. 2003). Insgesamt konnte eine Abhängigkeit der antimikrobiellen Wirksamkeit ätherischer Öle von ihrer chemischen Zusammensetzung nachgewiesen werden (CHORIANOPOULOS et al. 2004, DADALIOĞLU et al. 2004, BOZIN et al. 2006). Während ätherische Öle in vitro eine gute antimikrobielle Wirksamkeit auch bei geringen Gehalten zeigten, ist im Lebensmittel jedoch ein Gehalt von mindestens 1 - 3 % ätherischem Öl nötig, um eine antimikrobielle Wirksamkeit zu erzielen (SHELEF 1983). Diese Menge an ätherischem Öl im Lebensmittel ist oft höher als es in geschmacklicher Hinsicht vertretbar wäre (HOLLEY u. PATEL 2005). GILL et al. (2002) prüften die antibakterielle Aktivität von Koriandergrünöl gegenüber L. monocytogenes unter in vitro-Bedingungen sowie in Schinken. Obwohl das Öl des Koriandergrün in Nährbouillon eine deutliche antilisterielle Wirkung entfaltete, war es in einer Konzentration von 6 % im Gelantinemantel von Schinken wirkungslos. Die ätherischen Öle von Zimt, Nelke und Thymian waren in TSB-Bouillon wirksam gegen S. Enteritidis und L. monocytogenes in Konzentrationen von 0,04 % bis 1 % (SMITH-PALMER et al 1998). Um eine antibakterielle Wirksamkeit gegenüber S. Enteritidis in Käse mit 16 % bzw. 30 % Fettanteil zu erzielen, waren jedoch mindestens 1 % Zimt-, Nelken- oder Thymianöl notwendig. In einer Konzentration von 1 % konnten Nelken, Zimt und Thymian ebenfalls das Wachstum von L. monocytogenes im Käse der Magerstufe hemmen. Bei einem Fettgehalt von 30 % im Käse konnte nur noch Nelke ab einer Konzentration von 1 % eine antilisterielle Wirkung erzielen (SMITH-PALMER et al. 2001). Die geringere antimikrobielle Wirksamkeit ätherischer Öle im Lebensmittel wird wahrscheinlich durch die Anwesenheit von Fetten, Kohlenhydraten und Proteinen im Lebensmittel verursacht. Ebenso wirkt sich ein hoher pH- und niedriger aw-Wert negativ auf die Hemmwirkung der Gewürzöle aus (HOLLEY u. PATEL 2005). Möglicherweise lösen sich die hydrophoben ätherischen Öle im Fettanteil des 24 2 Wissenschaftliches Schrifttum Lebensmittels und können somit Bakterien im wässrigen Anteil des Lebensmittels nicht erreichen (MEJLHOLM u. DAALGAARD 2002). 2.2.2.4 Antibakterielle Aktivität von Inhaltstoffen ätherischer Öle Die antimikrobielle Wirksamkeit ätherischer Öle ist stark von ihrer chemischen Zusammensetzung abhängig (DEANS u. RITCHIE 1987, COSENTINO et al. 1999). Aus diesem Grund wird zunehmend die antimikrobielle Aktivität einzelner Inhaltsstoffe ätherischer Öle geprüft. Im Folgenden werden minimale Hemmstoffkonzentrationen für einzelne Inhaltsstoffe ätherischer Öle aus der Literatur aufgeführt. Die genannten minimalen Hemmkonzentrationen wurden in mg/ml, % (v/v), µl/ml oder µg/ml angegeben. Um die Ergebnisse möglichst leicht vergleichen zu können, wurden alle Angaben in ppm umgerechnet. Die beiden Phenole Thymol und Carvacrol besitzen sowohl das weiteste Wirkungsspektrum antibakterieller Aktivität als auch die stärkste antimikrobielle Wirksamkeit (KIM et al. 1995, COSENTINO et al. 1999, DORMAN u. DEANS 2000, BAGAMBOULA et al. 2004). Y. enterocolitica und E. coli wiesen gegenüber Thymol und Carvacrol die gleiche Empfindlichkeit auf. Thymol und Carvacrol hemmten in einer Konzentration von jeweils 225 ppm das Wachstum der beiden Bakterien. Thymol und Carvacrol entfalteten gegenüber L. monocytogenes in einer Konzentration von 450-500 ppm einen antimikrobiellen Effekt (KIM et al. 1995, COSENTINO et al. 1999). Thymol erwies sich mit minimalen Hemmkonzentrationen von 56, 225 bzw. 450 ppm gegenüber S. Typhimurium, Staph. aureus und B. cereus als wirksamer als Carvacrol, welches gegenüber Staphylococcus spp. ab einer Konzentration von jeweils 450 ppm und gegenüber B. cereus ab einer Konzentration von 900 ppm eine antibakterielle Wirkung zeigte (COSENTINO et al. 1999). Ps. aeruginosa erwies sich als resistent gegenüber Thymol und Carvacrol (SIVROPOULOU et al. 1996, COSENTINO et al. 1999). 25 2 Wissenschaftliches Schrifttum KIM et al. (1995) wiesen gute keimhemmende Eigenschaften von Eugenol und Citral nach. Zur Hemmung von S. Typhimurium waren 500 ppm Eugenol bzw. Citral nötig. Vibrio vulnificus wurde bereits durch 100 ppm Citral bzw. 500 ppm Eugenol in seinem Wachstum gehemmt. Gegenüber L. monocytogenes und E. coli entfaltete Citral mit einer minimalen Hemmkonzentration von 500 ppm eine stärkere antibakterielle Wirkung als Eugenol mit einer minimalen Hemmkonzentration von 1000 ppm. Methyl-Chavicol und Linalool hemmten das Wachstum von A. hydrophila, B. thermosphacta, Lb. plantarum und L. monocytogenes, erwiesen sich gegenüber Clostridium sporogens, Ps. putida, Ps. fluorescens und Ps. fragi jedoch als wirkungslos (WAN et al. 1998). Linalool zeigte gegenüber L. monocytogenes, S. Typhimurium, St. aureus, B. cereus, Y. enterocolitica, E. coli und Vibrio vulnificus mit minimalen Hemmstoffkonzentrationen von mindestens 900 –1000 ppm nur moderate antibakterielle Fähigkeiten (KIM et al. 1995, COSENTINO et al. 1999). In einer Studie von BAGAMBOULA et al. (2004) erwies sich Linalool gegenüber Shigella sonnei und Shigella flexneri ebenfalls nur als eingeschränkt wirksam. COX et al. (2002) überprüften die Wirksamkeit von 1,8-Cineol und Terpinen-4-ol gegen verschiedene Infektionserreger. Mit einer minimalen Hemmkonzentration von 5000 ppm wies Terpinen-4-ol im Gegensatz zu 1,8-Cineol mit einer MHK von > 80000 ppm eine sehr gute Wirksamkeit gegen Ps. aeruginosa auf. E. coli wurde durch 10000 ppm 1,8-Cineol bzw. 1250 ppm Terpinen-4-ol in seinem Wachstum gehemmt. Gegenüber St. aureus entfaltete Terpinen-4-ol bereits in einer Konzentration von 1250 ppm eine antimikrobielle Wirkung, 1,8-Cineol erst in einer Konzentration von 5000 ppm. Eine ähnliche Beobachtung machten CARSON et al. (2002), die für 1,8-Cineol die gleiche MHK gegenüber St. aureus ermittelten, für Terpinen-4-ol jedoch eine MHK von 25000 ppm festsetzten. α-Pinen und α-Terpineol wiesen gegenüber Ps. aeruginosa, St. epidermidis, Y. enterocolitica, L. monocytogenes und St. aureus in den geprüften Konzentrationen keine antibakterielle Wirkung auf (COSENTINO et al. 1999). CARSON et al. (2002) ermittelten eine MHK von 250 ppm für α-Terpineol gegenüber St. aureus. 26 2 Wissenschaftliches Schrifttum S. Typhimurium und E. coli wurden durch α-Pinen nicht in ihrem Wachstum beeinträchtigt. Hingegen hemmte α-Terpineol das Wachstum dieser beiden Bakterien in einer Konzentration von 225 bzw. 450 ppm (COSENTINO et al. 1999). P–Cymen sowie γ-Terpinen zeigten regelmäßig keine oder nur eine sehr geringe antimikrobielle Wirksamkeit gegenüber den getesteten Bakterien (SIVROPOULOU et al. 1996, ALIGIANNIS et al. 2001, COX et al. 2002). 2.2.2.5 Mechanismen der antibakteriellen Aktivität ätherischer Öle Obwohl die antimikrobiellen Eigenschaften ätherischer Öle und ihrer Inhaltsstoffe in der Vergangenheit oft geprüft wurden, wurde deren antimikrobieller Wirkungsmechanismus nicht detailliert erforscht (LAMBERT et al. 2001). In Anbetracht der Vielzahl chemischer Verbindungen in ätherischen Ölen ist es unwahrscheinlich, dass ihre antimikrobielle Wirkung auf nur einen spezifischen Mechanismus zurückzuführen ist. Es gibt jedoch mehrere Angriffspunkte für ätherische Öle an einer Zelle (CARSON et al. 2002, BURT 2004). Hauptangriffspunkt der ätherischen Öle sind Zellwand und zytoplasmatische Membran der Bakterien (COX et al. 2000, LAMBERT et al. 2001, ULTEE 2002). Dies könnte eine Erklärung für die ausgeprägte Empfindlichkeit Gram-positiver Bakterien gegenüber ätherischen Ölen im Vergleich zu Gram-negativen Bakterien sein (FARAG et al. 1989, LAMBERT et al. 2001). Im Gegensatz zu Gram-positiven Bakterien verfügen Gram-negative Bakterien über eine zweite Zellmembran. Diese umgibt die Zellwand Gram-negativer Keime und behindert durch ihre Lipopolysaccharid-Abdeckung die Diffusion hydrophober Verbindungen in die Zelle (VAARA 1992). Andererseits befinden sich in der äußeren Membran Gram-negativer Bakterien Porin-Proteine. Diese können Kanäle in der äußeren Membran bilden, die Verbindungen mit geringem Molekulargewicht in eingeschränktem Ausmaß die Passage in Glycoproteinschicht und zytoplasmatische Membran ermöglichen (HOLLEY u. PATEL 2005). Daher ist die im Vergleich zu Gram-positiven Keimen geringere Empfindlichkeit 27 Gram-negativer Bakterien 2 Wissenschaftliches Schrifttum gegenüber ätherischen Ölen wahrscheinlich auch auf die größere physiko-chemische Komplexität der Zellwand Gram-negativer Keime zurückführen (WALSH et al. 2003). Auch Unterschiede bzgl. metabolischer Fähigkeiten spielen eine Rolle. Laktobazillen sind zwar Gram-positive Bakterien, weisen jedoch eine große Widerstandsfähigkeit gegenüber ätherischen Ölen auf (SHELEF 1983). Sie reagieren im Gegensatz zu anderen Bakterien nach Exposition mit einigen Inhaltsstoffen ätherischer Öle nicht mit einer Abnahme der intrazellulären ATP-Konzentration (COX et al. 2000, GILL u. HOLLEY 2003). Zudem sind sie in höherem Maße fähig, mit osmotischem Stress umzugehen, als andere Bakterien (HOLLEY u. PATEL 2005). Insgesamt scheint die antibakterielle Wirksamkeit der lipophilen ätherischen Öle auf ihrer Fähigkeit zu beruhen, durch die bakterielle Zellmembran und in die Mitochondrien diffundieren zu können, wobei sie die zellulären Strukturen zerstören und so die Permeabilität der Membran erhöhen (KNOBLOCH et al. 1989). Die Erhöhung der Membranpermeabilität wiederum führt zu einem Verlust an Ionen und anderen Zellbestandteilen und damit zum Tod der Zelle (LAMBERT et al. 2001, CARSON et al. 2002). Der Wirkungsmechanismus von Thymol und Carvacrol, den Hauptkomponenten von Thymian bzw. Oreganoöl, wurde bisher am Weitesten geklärt. Die beiden Phenole zerstören die äußere Membran Gram-negativer Bakterien, setzen Lipopolysaccharide frei und erhöhen die Durchlässigkeit der zytoplasmatischen Membran für ATP (BURT 2004). ULTEE et al. (1999) beobachteten nach Exposition von B. cereus mit Carvacrol eine Abnahme des intrazellulären ATP-Gehaltes während die extrazelluläre ATP-Konzentration nicht zunahm. Diese Beobachtung wurde auf eine gesteigerte ATP-Hydrolyse oder verminderte Synthese von ATP zurückgeführt. Messungen des Membranpotentials nach Zugabe von Thymol und Carvacrol zeigten einen plötzlichen Einbruch des Membranpotentials, vermutlich hervorgerufen durch die Störung der Protonenpumpe. Des Weiteren verursachte Carvacrol einen Ausstrom von Kalium-Ionen aus der Zelle (ULTEE et al. 2000). 28 2 Wissenschaftliches Schrifttum Eugenol, Hauptbestandteil des ätherischen Öls der Gewürznelke, scheint die Bildung von Amylasen und Proteasen zu behindern. Ebenso wurden Zellwandschäden und Zunahme der Zelllysis beobachtet (THOROSKI et al. 1989). Cinnamaldehyd hemmt das Wachstum von E. coli O157:H7 und S. Typhimurium fast ebenso effektiv wie Carvacrol und Thymol. Im Gegensatz zu Thymol und Carvacrol zerstört Cinnamaldehyd jedoch weder die Zellmembran noch führt es zu einer Abnahme des intrazellulären ATP-Gehaltes (HELANDER et al. 1998). WENDAKOON und SAKAGUCHI (1993) führten die inhibitorische Wirkung von Cinnamaldehyd gegenüber Enterobacter aerogenes auf die Hemmung einer Aminosäuren spaltenden Decarboxylase zurück. Isothiocyanate, vorkommend in Senföl, entfalten ein weites Spektrum antimikrobieller Aktivität. Nach DELAQUIS und MAZZA (1995) beruht die antimikrobielle Aktivität auf einer Inaktivierung extrazellulärer Enzyme durch Spaltung von Disulfidbindungen. 2.3 Bestimmung der antimikrobiellen Aktivität von Gewürzen und ätherischen Ölen in vitro Wie bei synthetischen Konservierungsstoffen üblich, so wird auch die antimikrobielle Aktivität von Gewürzen, ätherischen Gewürzölen sowie deren Inhaltsstoffen zunächst in Kulturmedien geprüft (SHELEF 1983). Bei den am häufigsten verwendeten Methoden in vitro handelt es sich um verschiedene Variationen des Agardiffusionsund Bouillondilutionsverfahrens. Eine neuere Methode stellt die Bioimpedanzmessung dar (HOLLEY u. PATEL 2005). Die Vielzahl an unterschiedlichen Methoden kann zu widersprüchlichen Ergebnissen bezüglich der antimikrobiellen Aktivität von natürlich vorkommenden antimikrobiellen Wirkstoffen führen (COWAN 1999). Eine einzige standardisierte Methode würde sich jedoch nicht durchsetzen können, da Studien oft unterschiedlichste Zielsetzungen haben und die Versuchsbedingungen auf diese abgestimmt werden müssen (HOLLEY u. PATEL 2005). 29 2 Wissenschaftliches Schrifttum 2.3.1 Agardiffusion Das Prinzip der Agardiffusion in Form der Filterpapierplättchen-Diffusion wird auch heute noch oft angewendet, um die antimikrobielle Wirksamkeit von ätherischen Ölen einzuschätzen (GALINDO-CUSPINERA et al. 2003). Dabei wird das zu untersuchende Bakterium in einen Nähragar inokuliert und ein mit ätherischem Öl getränktes Papierplättchen aufgelegt. Während der Inkubation diffundiert das ätherische Öl in den das Plättchen umgebenden Nähragar. Besitzt das geprüfte Öl antimikrobielle Eigenschaften, so wird das untersuchte Bakterium in dem Bereich um das Papierplättchen nicht wachsen. Die Größe dieses „Hemmhofs“ wird gemessen und zur Einschätzung der antimikrobiellen Aktivität herangezogen (ZAIKA 1988). Ein Nachteil dieser Methode ergibt sich aus der Unberechenbarkeit der Diffusionsrichtungen des ätherischen Öls. Obwohl das ätherische Öl mittels Papierplättchen direkt auf die Agaroberfläche aufgetragen wird, kann es in drei Richtungen diffundieren. Dies ergibt eine hemisphärische Diffusionszone, die schwer zu erfassen ist (DEANS u. RITCHIE 1987). DEANS und RITCHIE (1987) versuchten dieses Problem zu umgehen, indem sie nach Inokulation mit dem Test-Bakterium Vertiefungen einer bestimmten Größe in den Nähragar stanzten. Die Vertiefungen wurden mit ätherischem Öl befüllt. Nach einer 30-minütigen Ruhezeit, während der das ätherische Öl in den Agar diffundieren sollte, folgte die Inkubation. Anschließend wurde der Durchmesser der radiären Hemmhöfe gemessen. Diese Methode wurde auch von einigen anderen Autoren angewandt (BARATTA et al. 1998, BOZIN et al. 2006). Neben der Papierplättchenmethode gibt es einige weitere Methoden, die sich auf das Prinzip der Agardiffusion stützen. BAGAMBOULA et al. (2003) fügten dem Nähragar direkt gemahlene Gewürze und Kräuter bei. Anschließend wurde der Agar verflüssigt und die Oberfläche mit einem Bakterium inokuliert. Nachteil dieser Methode ist, dass durch das Mahlen von Gewürzen deren ätherische Öle nur teilweise freigesetzt werden. Ein Teil des ätherischen Öls verbleibt 30 2 Wissenschaftliches Schrifttum möglicherweise eingeschlossen in zellulären Kompartimenten und kann somit nicht mit dem Mikroorganismus reagieren (HOLLEY u. PATEL 2005). Zudem besitzen gemahlene Gewürze im Vergleich zu unverarbeiteten Gewürzen einen geringeren Anteil an ätherischem Öl, da dieses während des Mahlens zum Teil verdampft (UPMANN u. NOVAK 2001). Ätherische Öle und ihre Inhaltsstoffe sind leicht flüchtig. Dies kann insbesondere bei der Papierplättchen-Agardiffusion zu einer Beeinflussung der Ergebnisse führen. Daher stellt die Überprüfung der antimikrobiellen Aktivität von ätherischen Ölen in dampfförmigen Zustand mittels Agardiffusion in einem geschlossenen System eine interessante Variante dar. So beimpften WARD et al. (1998) Agarplättchen auf einem Glasscheibchen mit den Testbakterien und stellten dieses zusammen mit einem mit Meerrettichöl befüllten Uhrglas in ein Glasgefäß. Das Gefäß wurde verschlossen und der für das Verdampfen des Öls nötigen Temperatur ausgesetzt. Später wurde die Keimzahl auf den Agarplättchen bestimmt. Dieses System ließ auch eine quantitative Aussage über die antimikrobielle Wirksamkeit des Meerrettichöls zu. Die Aussagekraft aller Methoden, die auf dem Prinzip der Agardiffusion beruhen ist begrenzt, da das Ausmaß der antimikrobiellen Aktivität der hydrophoben ätherischen Öle sowie deren Inhaltsstoffe von ihrer Fähigkeit durch den Nähragar zu diffundieren abhängig ist (ZAIKA 1988). Agardiffusionsmethoden ermöglichen zudem nur eine qualitative Einschätzung der antimikrobiellen Aktivität von Gewürzen und ätherischen Ölen (BURT 2004). 2.3.2 Bouillondilution Bei den Bouillondilutionsverfahren handelt es sich um Reihenverdünnungstests in flüssigen Nährmedien, wobei zwischen Mikro- und Makrodilution (in Mikrotiterplatten bzw. Reagenzgläsern) Bouillondilutionsverfahren unterschieden werden wird heute (SCHWARZ am häufigsten et al. 2003). verwendet, Die wobei insbesondere die Mikrodilution, welche auf Verwendung von Mikrotiterplatten beruht, sehr beliebt ist (HOLLEY u. PATEL 2005). 31 2 Wissenschaftliches Schrifttum Bei der Mikrodilution enthält die Mikrotiterplatte sowohl den Testmikroorganismus als auch den potentiell hemmenden Stoff in einer Bouillon. Das Wachstum der Mikroorganismen wird mittels Messung der optischen Dichte der Bouillon verfolgt. Unterschiede zwischen erreichter optischer Dichte der Bouillon mit Inhibitor einerseits und Kontrollreihen ohne Inhibitor andererseits ermöglichen Rückschlüsse auf die antimikrobielle Aktivität des Inhibitors. Allerdings können mittels Messung der optischen Dichte nur Veränderungen der Keimzahl von mehr als 0,5 lg KbE/ml erfasst werden. Nach der Inkubationszeit wird zusätzlich durch Ausstreichen des Wellinhalts auf Nähragarplatten die Keimzahl bestimmt (HOLLEY u. PATEL 2005). Die Bouillonmikrodilution wird ebenfalls häufig zur Ermittlung der minimalen Hemmstoffkonzentration genutzt. Dabei wird Bakterienwachstum durch sogenannte Knopfbildung oder als Trübung des Nährmediums sichtbar. Die minimale Hemmstoffkonzentration entspricht dabei derjenigen Verdünnung der Wirkstoff enthaltenden Ausgangsbouillon, bei der gerade keine Trübung bzw. Knopfbildung des Nährmediums mehr auftritt (COSENTINO et al. 1999, AZAZ et al. 2003, ANGIONI et al. 2004, PENALVER et al. 2005, SOKOVIĆ et al. 2006). Eine interessante Variante dieser Methode zur Bestimmung von MHKs entwickelten (MANN u. MARKHAM 1998). Sie fügten der Bouillon Resazurin bei. Der Farbstoff wurde bei Erreichen einer bestimmten Keimzahl im Well von den Bakterien reduziert und färbte die Bouillon pink. Nachteile ergeben sich vor allem aus der Hydrophobizität ätherischer Öle und ihrer Inhaltsstoffe. Bisher unterschiedlichen wurden Tween80, Konzentrationen Tween20, genutzt, um DMSO ätherische und Öle Ethanol oder in deren Inhaltsstoffe im Testmedium zu dispergieren (ADAM et al. 1998, BARATTA et al., 1998, COSENTINO et al. 1999, HAMMER et al. 1999, ANGIONI et al. 2004, AZAZ et al. 2004). Daher sind Kontrollreihen nötig, die eine mögliche Beeinflussung des Bakterienwachstums durch das jeweilige zur Erhöhung der Wasserlöslichkeit verwendete Agens ausschließen. Wechselwirkungen (z.B. Wirkungsabschwächung) zwischen dem ätherischen Öl bzw. dessen Inhaltsstoffen und dem Lösungsvermittler lassen sich jedoch nicht abschätzen (LAMBERT et al. 2001). Zudem können unvollständig gelöste ätherische Öle bzw. deren Inhaltsstoffe bei Messung der 32 2 Wissenschaftliches Schrifttum optischen Dichte Interferenzen verursachen, welche die Aussagekraft der gewonnen Ergebnisse beeinträchtigt (LAMBERT et al. 2001). Insgesamt eignet sich die Bouillonmikrodilution jedoch sehr gut für das Sreening von ätherischen Ölen und deren Inhaltsstoffe. Es werden nur kleine Reaktionsvolumina (≤ 300 µl/Test) benötigt, die Belegung einer Mikrotiterplatte kann schnell und unkompliziert mit einer Multikanalpipette erfolgen. Zudem können auf einer Mikrotiterplatte mehrere Konzentrationen ätherischer Öle bzw. mehrere ätherische Öle gleichzeitig geprüft werden (HOLLEY u. PATEL 2005). Im Gegensatz zu den Agardiffusionsmethoden erlaubt die Bouillondilution auch eine quantitative Einschätzung der antimikrobiellen Aktivität von Gewürzen bzw. ätherischen Ölen (BURT 2004). 2.3.3 Bioimpedanzmessung Eine neue Entwicklung zur Bestimmung der antimikrobiellen Aktivität von Gewürzen, ätherischen Ölen sowie Ölkomponenten stellt die Bioimpedanzmessung dar. Dabei wird das ätherische Öl in einer Nährbouillon gelöst, die mit dem Testbakterium inokuliert und inkubiert wird. Während der Bebrütungsdauer werden mit Hilfe eines Bactometer Microbial Monitoring System M-128 (Vitek Systems, BioMerieux, USA) Veränderungen der elektrischen Leitfähigkeit der Bouillon gemessen. Das Bactometer erfasst Änderungen in der Leitfähigkeit der Boullion, die auf Produkte des bakteriellen Metabolismus zurückzuführen sind. Der Parameter, anhand dessen die antibakterielle Aktivität des ätherischen Öls quantifiziert und definiert wird, ist die Detektionszeit. Die Detektionszeit ist die Zeit, welche die Bakterienpopulation benötigt, um eine Konzentration im Medium zu erreichen, die eine schnelle Änderung der elektrischen Leitfähigkeit hervorruft. (MARINO et al. 1999, 2001). Die Bioimpedanzmessung hat gegenüber Bouillonmikrodilutionsverfahren, bei denen die antimikrobielle Aktivität eines ätherischen Öls oder seiner Inhaltsstoffe mit Hilfe der Trübungsmessung bewertet wird, einige Vorteile. Mit Hilfe der Detektionszeit können Änderungen der lag–Phase festgestellt werden, lange bevor eine messbare Veränderung der optischen Dichte des Mediums einsetzt (HOLLEY u. PATEL 2005). 33 2 Wissenschaftliches Schrifttum Damit ist die Bioimpedanzmessung sensitiver als die Trübungsmessung. Im Gegensatz zur Trübungsmessung kann anhand dieser Methode auch zwischen bakteriziden und bakteriostatischen Effekten unterschieden werden (MARINO et al. 1999, 2001). 34 3 Eigene Untersuchungen 3 Eigene Untersuchungen 3.1 Material 3.1.1 Inhaltsstoffe ätherischer Öle Alle verwendeten Inhaltsstoffe ätherischer Öle wurden von der Firma Sigma-Aldrich, München, Deutschland, bezogen. Eine Übersicht über die verwendeten Inhaltsstoffe ätherischer Öle gibt die Tabelle 2. Tabelle 2: Übersicht über die verwendeten Inhaltsstoffe ätherischer Öle Inhaltsstoff ätherischer Öle Artikelnummer Fa. Sigma-Aldrich Thymol (> 99,5 %) T0501 Carvacrol (98 %) 282197 Linalool (97 %) L2602 Cineol (99 %) C80601 α-Pinen (98 %) 147520 α-Terpineol W304522-Sample 3.1.2 Verwendete Bakterienstämme Die ausgewählten Bakterienstämme wurden von der DSMZ, Braunschweig, Deutschland bezogen. Pseudomonas fragi, Brochothrix thermosphacta und Aeromonas hydrophila wurden als Lyophilisat, Escherichia coli als Lebendkultur auf Agar geliefert. DSMZ-Nummer sowie Herkunft der einzelnen Bakterienstämme sind in Tabelle 3 aufgeführt. 35 3 Eigene Untersuchungen Tabelle 3: Verwendete Bakterienstämme Genus Spezies DSMZ-Nummer Pseudomonas fragi 3456 Brochothrix thermosphacta Keine Angabe Wurst aus 20171 Aeromonas hydrophila 30187 Escherichia coli 10727 Herkunft Schweinefleisch T Milch Ferkel T: Typstamm 3.1.3 Nährmedien Zur Anzucht der Bakterienstämme wurde Mueller-Hinton-Nährboden mit Blut (PB5007A, Fa. Merck, Darmstadt, Deutschland) verwendet. Die vorübergehende Lagerung der Bakterienstämme sowie die Ermittlung der Gesamtkeimzahl im Tropfplattenverfahren erfolgten auf Standard-І-Nähragar zur Züchtung anspruchsvoller Bakterien (1.07881.5000, Fa. Merck, Darmstadt, Deutschland). 37 g Standard-Ι-Nähragar werden in 1 Liter Aqua dest. durch Erhitzen im siedenden Wasserbad oder im strömenden Dampf gelöst, auf pH 7,5 ± 0,2 bei 25 °C eingestellt und anschließend 15 Minuten bei 1 21 °C autoklaviert. 3.1.4 Lösungen Zur Anfertigung dezimaler Verdünnungsreihen wurde NaCl-Pepton-Lösung verwendet. 8,5 g Natriumchlorid (106400, Fa. Merck, Darmstadt, Deutschland) und 1 g Pepton aus Casein „granuliert“, pankreatisch verdaut (107213, Fa. Merck, Darmstadt, Deutschland), wurden in 1 Liter Aqua dest. gelöst, in Reagenzgläser à 9 ml abgefüllt und 15 Minuten bei 121 °C autoklavie rt. Zur Voranreicherung wurde Hirn-Herz-Bouillon (1.10493, Fa. Merck, Darmstadt, Deutschland) verwendet. 25 g Hirn-Herz-Bouillon wurden in 1 Liter Aqua dest. gelöst, auf pH 7,5 ± 0,2 bei 25 °C eingestellt und anschlie ßend 15 Minuten bei 121 °C autoklaviert. 36 3 Eigene Untersuchungen Zur Herstellung der jeweiligen Stammlösungen mit Inhaltsstoffen ätherischer Öle und zur Verdünnung wurde Nutrient broth Nr. 2 (CM0067, Fa. Oxoid, Wesel, Deutschland). verwendet. 25 g werden in 1 Liter Aqua dest. gelöst, auf pH 7,5 ± 0,2 bei 25 °C eingestellt und abschließend 15 Minuten b ei 121 °C autoklaviert. Um die Wasserlöslichkeit der chemischen Einzelkomponenten ätherischer Öle zu erhöhen, waren bei der Herstellung der Stammlösungen Zusätze nötig. Dabei handelte es sich einerseits um 98 %igen Isopropylalkohol (Art.-Nr. 603.117.00-0, Fa. CG Chemikalien, Laatzen, Deutschland), andererseits um Tween80 (A4743.1000, Fa. AppliChem, Darmstadt, Deutschland) 3.1.5 Technische Geräte und Verbrauchsmaterialen Eine Auflistung weiterer Verbrauchsmaterialien sowie der verwendeten technischen Geräte befindet sich im Anhang (Kapitel 10.2). 3.2 Methoden 3.2.1 Kultivierung und Sicherung der Bakterienstämme Die erste Kultivierung der Bakterienstämme erfolgte zunächst gemäß Anleitung der DSMZ Braunschweig. Die Bakterienstämme wurden anschließend als Reinkulturen in das MikrobankTMSystem nach Anweisung des Herstellers überführt. Der Schraubverschluss des MikrobankTM–Röhrchens wurde unter sterilen Bedingungen geöffnet und der im Röhrchen enthaltene Kryopuffer mit Kolonien aus der Reinkultur inokuliert. Das Inokulum wies einen MacFarland Standard von 3-4 auf. Anschließend wurde das Kryoröhrchen fest verschlossen und durch 4-5-maliges umdrehen gemischt. Durch diesen Mischvorgang wurden die Bakterien an die poröse Oberfläche der Perlen gebunden. Der überstehende Puffer wurde weitgehend abpipettiert, so dass die Perlen frei von überstehender Flüssigkeit waren. Anschließend wurde das Kryoröhrchen fest verschlossen und bei -80 °C ± 0,5 °C eingelagert. Es wurden drei solcher MikrobankTM-Röhrchen pro Bakterienstamm angefertigt. 37 3 Eigene Untersuchungen Zum Anlegen einer Arbeitskultur wurde ein fraktionierter Ausstrich mit jeweils einer Perle auf Mueller-Hinton-Agar mit Schafblut angefertigt und bei einer für das optimale Wachstum des Bakteriums nötigen Temperatur inkubiert. Diese Temperatur betrug 37 °C bei E. coli, 30 °C bei A. hydrophila sowie 25 °C bei B. thermosphacta und Ps. fragi. Die Inkubationsdauer betrug bei E. coli und A. hydrophila 24 h, bei Ps. fragi und B. thermosphacta 48 h. Vor jedem Versuchsdurchgang wurde eine neue Arbeitskultur des jeweiligen Bakteriums auf Standard-Ι-Nähragar angelegt. 3.2.2 Einzelstoffe Zunächst sollte die antimikrobielle Wirksamkeit der einzelnen Inhaltsstoffe gemäß Tabelle 2 in unterschiedlichen Konzentrationen gegenüber den ausgewählten Mikroorganismen gemäß Tabelle 3 geprüft werden. 3.2.2.1 Ermittlung der Konzentrationen von Inhaltsstoffen ätherischer Öle Es sollte untersucht werden, welche Konzentrationen eines Stoffes eine Hemmwirkung aufweisen und ob diese durch Zugabe einer Menge, die üblicherweise zur Aromatisierung von Lebensmitteln eingesetzt wird, erreicht werden kann. Die Schätzung dieser Konzentrationen erfolgte nach Kenntnis der Menge des jeweiligen Inhaltsstoffs ätherischer Öle in der Gewürzart mit dem höchsten Gehalt an diesem Stoff unter Berücksichtigung des Gehaltes an ätherischem Öl in der entsprechenden Gewürzpflanze sowie der üblicherweise zu Würzzwecken verwendeten Menge des Gewürzes. Einen Überblick über die zur Berechnung der Konzentrationen herangezogenen Faktoren geben die Tabellen 4 und 5. 38 3 Eigene Untersuchungen Tabelle 4: Gehalt an ätherischem Öl bei ausgewählten Gewürzpflanzen und Anteil des ausgewählten Inhaltsstoffs im Öl Inhaltsstoff Gewürzpflanze Gehalt ätherisches Öl [%] Gehalt Inhaltsstoff im Öl [%] Thymol Thymian 6,3 a 65 a Carvacrol Oregano 4,0 b 89 e Linalool Thymian 6,3 a 74 a 1,8-Cineol Lorbeer 3,0 c 61 f d 66 g α-Pinen Rosmarin 2,5 α-Terpineol Majoran 3,5 d 7,2 h a: THOMPSON et al. 2003 b:RUSSO et al. 1998 c: KOVACEVIC et al. 2007 d:KRAFT 2000 e: CHORIANOPOULOS 2004 f: DADALIOĞLU 3004 g: ANGIONI et al. 2004 h: KOMAITIS et al. 1992 Tabelle 5: 1 Einsatzbereiche der ausgewählten Gewürzpflanzen und Maximalmenge je kg Lebensmittel für übliche Würzzwecke eingesetzte Gewürzpflanze Einsatzbereich Gewürz1 Maximale Menge des Gewürzes im Lebensmittel [g/kg]1 Thymian Fleischzubereitungen 1 Oregano Pastasaucen 0,5 Lorbeer Suppen 2 Rosmarin Fleischzubereitungen 2 Majoran Wurstwaren 3 persönliche Auskunft von Herrn C. Vogt, Fa. Raps im August 2006. Lebensmittel, die mit einer geschmacklich akzeptablen Menge an Thymian gewürzt wurden, enthielten demnach 40 ppm Thymol bzw. 35 ppm Linalool je Kilogramm. Mit Oregano gewürzte Lebensmittel enthielten 18 mg Carvacrol/kg, mit Lorbeer gewürzte Lebensmittel 37 mg 1,8-Cineol/kg. Durch Zugabe von Rosmarin bzw. Majoran konnten Lebensmittel einen Gehalt von 34 mg α-Pinen/kg bzw. 8 mg α-Terpineol/kg aufweisen. Diese mengenmäßigen Verhältnisse wurden auf das in vitro Reaktionsvolumen übertragen und ergaben die niedrigste Konzentration, die auf ihre antimikrobielle 39 3 Eigene Untersuchungen Wirkung geprüft wurde. Gleichzeitig entsprach diese auch der Konzentration, die durch Zugabe einer sensorisch akzeptablen Menge des jeweiligen Gewürzes zu Lebensmitteln erreicht werden kann. Ausgehend von dieser geringsten Konzentration wurde zunächst bei allen Inhaltsstoffen zusätzlich die 100-fache Konzentration geprüft, bei Thymol und Carvacrol auch die 10-fache Mindestkonzentration. Ergab sich in diesen Mengen keine Hemmwirkung, so wurden höhere Konzentrationen des jeweiligen Stoffs untersucht, die durch seine Löslichkeit im Nährmedium limitiert wurden. Die Tabellen 6 bis 11 geben eine Übersicht über die verschiedenen Stoffkonzentrationen, die auf ihre antibakterielle Wirkung untersucht wurden. Alle Konzentrationen der Inhaltsstoffe ätherischer Öle werden in ppm (mg/L) angegeben. Tabelle 6: Untersuchte Konzentrationen von Thymol in ppm Bakterium A. hydrophila Konzentrationen Thymol [ppm] E. coli 400 Ps. fragi 200 100 40 4 B. thermosphacta Tabelle 7: Untersuchte Konzentrationen von Carvacrol in ppm Bakterium A. hydrophila Konzentrationen Carvacrol [ppm] E. coli Ps. fragi 200 100 B. thermosphacta 40 50 20 2 3 Eigene Untersuchungen Tabelle 8: Untersuchte Konzentrationen von Linalool in ppm Bakterium Konzentrationen Linalool [ppm] A. hydrophila - 1200 720 360 180 3,6 E. coli - 1200 720 360 180 3,6 1600 1200 720 360 - 3,6 - 1200 720 360 - 3,6 Ps. fragi B. thermosphacta Tabelle 9: Untersuchte Konzentrationen von 1,8-Cineol in ppm Bakterium Konzentrationen 1,8-Cineol [ppm] A. hydrophila - 2000 1800 1600 1400 600 360 3,6 E. coli 2800 2000 1800 1600 1400 600 360 3,6 Ps. fragi 2800 2000 1800 1600 1400 600 360 3,6 - 2000 1800 1600 1400 600 360 3,6 B. thermosphacta Tabelle 10: Untersuchte Konzentrationen von α-Pinen in ppm Bakterium Konzentrationen α-Pinen [ppm] A. hydrophila 1200 800 600 400 340 3,4 E. coli 1200 800 - - 340 3,4 Ps. fragi 1200 800 - - 340 3,4 B. thermosphacta 1200 800 600 400 340 3,4 Tabelle 11: Untersuchte Konzentrationen von α-Terpineol in ppm Bakterium A. hydrophila 800 Konzentrationen α-Terpineol [ppm] 600 400 0,8 0,0008 E. coli 800 600 - 0,8 0,0008 Ps. fragi 800 600 - 0,8 0,0008 B. thermosphacta 800 600 400 0,8 0,0008 41 3 Eigene Untersuchungen 3.2.2.2 Herstellung und Lagerung von Stammlösungen der Inhaltsstoffe ätherischer Öle Grundlage aller Stammlösungen war Nutrient broth Nr. 2 (siehe Kapitel 3.1.4). Die nötige Menge Aqua dest. wurde durch einen Filter zugegeben, um das Auftreten von Schwebepartikeln in der Stammlösung zu verhindern. Aus diesem Grund war es auch nötig, sämtliche verwendete Gefäße vor Gebrauch bzw. vor der Sterilisation mit Aqua dest. auszuspülen. Zur verbesserten Löslichkeit von Thymol und Carvacrol wurde der Nährbouillon 0,4 % bzw. 1 % Isopropylalkohol beigefügt, zur Lösung von Linalool, 1,8-Cineol, α-Terpineol und α-Pinen jeweils 0,5 % Tween80. Herstellung der Stammlösungen von Thymol und Carvacrol Zunächst wurde als Grundlage der Stammlösung 1 Liter Nutrient broth Nr. 2 in einer Glasflasche mit Schraubverschluss angefertigt. Der Magnetrührstab, der zum Rühren der Lösung verwendet wurde, verblieb in der Flasche. Anschließend wurde die Nährlösung gemäß Angaben des Herstellers autoklaviert. Zur weiteren Verarbeitung war die sterile Nährboullion etwa handwarm. Vor Einbringen in die Nährbouillon wurden 1000 mg ± 10 mg Thymol bzw. 500 mg ± 5 mg Carvacrol mit Hilfe einer elektronischen Oberschalenwaage abgewogen. Das in kristalliner Form vorliegende Thymol wurde dabei in Wägeschiffchen gefüllt, das in öliger Form vorliegende Carvacrol mittels Mikroliterpipette in einen sterilen Erlenmeyerkolben. Anschließend wurden zur Lösung von 500 mg Carvacrol 10 ml Isopropylalkohol beigefügt und der Erlenmeyerkolben geschwenkt. Das Thymol wurde in einen sterilen Erlenmeyerkolben überführt, 4 ml Isopropylalkohol zugegeben und geschwenkt. Aus der eingangs hergestellten sterilen Nährlösung wurden mittels Glaspipette 10 ml entnommen und in einen sterilen Erlenmeyerkolben überführt. Das Gemisch aus Thymol bzw. Carvacrol und Isopropylalkohol wurde mit Hilfe einer sterilen Glaspipette in die Nährbouillon überführt. Die Wände des Erlenmeyerkolbens wurden mit Nährlösung gespült, um anhaftende Reste des Gemischs zu lösen und die Spülflüssigkeit ebenfalls in die Nährlösung pipettiert. Vor Verschluss der Flache 42 3 Eigene Untersuchungen wurden sowohl Schraubverschluss als auch Flaschenhals durch die Flamme eines Bunsenbrenners gezogen. Anschließend wurde die Flasche fest verschlossen und die Lösung mit einem Magnetrührer ca. 5 Minuten gerührt. Zur vollständigen Lösung von 1000 mg Thymol in 1 Liter Nutrient broth Nr. 2 wurde die Nährlösung über einen Zeitraum von 24 Stunden bei 37 °C alle 8 Stunden für 5 Minuten mittels Magnetrührer gerührt. 500 mg Carvacrol lösten sich in 1 Liter Nutrient broth Nr. 2 nach 12 Stunden bei 37 °C mit Rührabständen von 6 Stunden. Die fertige Thymol-Stammlösung enthielt 0,4 % Isopropylalkohol, die CarvacrolStammlösung 1 % Isopropylalkohol. Herstellung der Stammlösungen von Linalool, 1-8-Cineol, α-Pinen und α-Terpineol Wiederum wurde als Grundlage der Stammlösung 1 Liter Nutrient broth Nr. 2 verwendet. Die für die Herstellung von 1 Liter Nährbouillon nötige Menge Nutrient broth Nr. 2 wurde zunächst in 500 ml Aqua dest. gelöst. Der Lösung wurden 5 ml Tween80 mit Hilfe einer 10 ml Glaspipette unter Rühren zugefügt und anschließend mit Aqua dest. auf 1 Liter aufgefüllt. Der verwendete Magnetrührstab verblieb in der Glasflasche. Die Nährlösung wurde gemäß Angaben des Herstellers autoklaviert. Nach dem Autoklavieren musste die noch heiße Nährlösung 10 Minuten gerührt werden, um den auf dem Boden der Glasflasche anhaftenden Tween80 abzulösen. Zur weiteren Verarbeitung war die sterile Nährlösung etwa handwarm. Die erforderlichen Mengen Linalool, 1,8-Cineol, α-Pinen und α-Terpineol gemäß Tabelle 6 bis 11 wurden mit einer elektronischen Oberschalenwaage auf 1 % genau abgewogen und dabei jeweils in einen sterilen Erlenmeyerkolben überführt. Von der Nährbouillon wurden mit einer sterilen Glaspipette 10 ml abgenommen und in einen sterilen Erlenmeyerkolben gegeben. Linalool, 1,8-Cineol, α-Pinen und α-Terpineol wurden mittels Mikroliterpipette in die Nährbouillon überführt. Der verbliebene Erlenmeyerkolben wurde wiederum mit der abgenommen Nährlösung gespült und die Spülflüssigkeit zu der übrigen Nährlösung pipettiert. Anschließend wurde die Stammlösung 5 Minuten mittels Magnetrührer gerührt. 43 3 Eigene Untersuchungen Linalool löste sich in einer Menge von 4000 mg, 3000 mg und 1800 mg in 1 Liter Nährbouillon mit 0,5 % Tween80 nach 24 Stunden bei 37 °C und weiteren 24 Stunden bei 30 °C, 900 ppm Linalool lösten sich nach 24 Stunden bei 30 °C. Zur Lösung von 3500 ppm bis 7000 ppm 1,8-Cineol, 1500 ppm und 2000 ppm α-Terpineol sowie 2000 ppm und 3000 ppm α-Pinen in 1 Liter Nährlösung mit 0,5 % Tween80 war eine Temperatur von 37 °C über 36 Stund en nötig. Geringere Mengen dieser Stoffe lösten sich innerhalb von 24 Stunden bei 37 °C in 1 Liter Nährbouillon mit 0,5 % Tween80. Die Stammlösungen von Linalool, 1,8-Cineol, α-Pinen und α-Terpineol wurden bis zur Lösung alle 12 Stunden für jeweils ca. 5 Minuten gerührt. Es wurden je eine Stammlösung von Linalool mit 4000 ppm, 3000 ppm, 1800 ppm und 900 ppm hergestellt. Von α-Pinen wurden Stammlösungen mit jeweils 3000 ppm, 2000 ppm und 850 ppm angefertigt, von α-Terpineol Stammlösungen mit einer Menge von jeweils 2000 ppm, 1500 ppm und 2 ppm α-Terpineol. Von 1,8-Cineol wurden insgesamt 7 Stammlösungen mit den Konzentrationen 7000 ppm, 5000 ppm, 4500 ppm, 4000 ppm, 3500 ppm, 1500 ppm und 900 ppm 1,8-Cineol hergestellt. Lagerung der Stammlösungen Die Stammlösungen wurden mit sterilen 10 ml Glaspipetten in Rotabilo® Zentrifugenröhrchen à10-12 ml abgefüllt und bis zur weiteren Verarbeitung bei - 18 °C ± 2 °C gelagert. 3.2.2.3 Vorbereitung der Keimsuspension Zur Herstellung der für die Beimpfung der Mikrotiterplatte benötigten Keimsuspension wurden am Vortag des Versuchs 7 ml BHI-Bouillon mit einer Öse Koloniematerial des entsprechenden Bakteriums beimpft und 20 Stunden bei 25 °C (B. thermosphacta, Ps. fragi), 30 °C ( A. hydrophila) oder 37 °C ( E. coli) inkubiert. Nach erfolgter Inkubation wurde eine dezimale Verdünnungsreihe entsprechend DIN EN ISO 6887-Teil 1 bis zur Verdünnungsstufe 10-3 (A. hydrophila, E.coli) bzw. 10-2 (Ps. fragi, B. thermosphacta) angelegt. 44 3 Eigene Untersuchungen Die Keimsuspension sollte ca. 106 KbE/ml enthalten. Um dieses zu überprüfen, wurde sofort eine dezimale Verdünnungsreihe der Keimsuspension gemäß Kapitel 3.2.2.6 angelegt und im Doppelansatz im Tropfplattenverfahren untersucht und ausgewertet. Die Keimsuspension wurde anschließend sofort wie unter Kapitel 3.2.2.4 beschrieben weiter verarbeitet. 3.2.2.4 Belegung der Mikrotiterplatte Die Wells einer Mikrotiterplatte (83.1835.500, Fa.Sarstedt, Nümbrecht, Deutschland) wurden mit Hilfe einer Mikroliterpipette jeweils mit 50 µl der Keimsuspension nach Kapitel 3.2.2.3 beimpft. Anschließend wurden die Wells mit der Stammlösung des jeweiligen Inhaltsstoffs ätherischer Öle versehen. Um die gewünschte Konzentration des Inhaltsstoffs ätherischer Öle im Well zu erreichen, wurden die Stammlösungen z.T. durch steigende Zugabe von Nutrient broth Nr. 2 verdünnt. Genaue Angaben, auf welche Weise die jeweilige Einzelstoffkonzentration bzw. Stoffkombination durch Beimpfung eines Wells der Mikrotiterplatte erreicht wurde, finden sich in Tabelle 12 und Tabelle 13. So wurde, wie in Tabelle 12 dargestellt, die Einzelstoffkonzentration von 400 ppm Thymol erreicht, indem 100 µl einer Thymollösung mit 1000 ppm Thymol, 100 µl Nutrient broth Nr. 2 ohne Zusätze und 50 µl Keimsuspension gemeinsam in ein Well einer Mikrotiterplatte pipettiert wurden. Wie Tabelle 13 zeigt, wurde die Stoffkombination 100 ppm Thymol mit 1200 ppm Linalool erreicht, indem 50 µl einer Thymollösung mit 500 ppm Thymol, 100 µl einer Linaloollösung mit 3000 ppm Linalool, 50 µl Nutrient broth Nr. 2 ohne Zusätze sowie 50 µl Keimsuspension gemeinsam in ein Well einer Mikrotiterplatte pipettiert wurden. 45 3 Eigene Untersuchungen Tabelle 12: Beimpfung der Mikrotiterplatte zum Erreichen der Einzelstoffkonzentrationen Fortsetzung Tabelle 12 Beimpfung Mikrotiterplatte zum Erreichen Thymol-Konzentrationen Konzentration Beimpfung Well, Angaben in µl [ppm] 400 100 T1000 + 100 Nb2 + 50 KS 200 50 T1000 + 150 Nb2 + 50 KS 100 25 T1000 + 175 Nb2 + 50 KS 40 10 T1000 + 190 Nb2 + 50 KS 4 1 T1000 + 199 Nb2 + 50 KS Beimpfung Mikrotiterplatte zum Erreichen Carvacrol-Konzentrationen Konzentration Beimpfung Well, Angaben in µl [ppm] 200 100 C500 + 100 Nb2 + 50 KS 100 50 C500 + 150 Nb2 + 50 KS 50 25 C500 + 175 Nb2 + 50 KS 20 10 C500 + 190 Nb2 + 50 KS 2 1 C500 + 199 Nb2 + 50 KS Beimpfung Mikrotiterplatte zum Erreichen Linalool-Konzentrationen Konzentration Beimpfung Well, Angaben in µl [ppm] 1600 100 L4000 + 100 Nb2 + 50 KS 1200 100 L3000 + 100 Nb2 + 50 KS 720 100 L1800 + 100 Nb2 + 50 KS 360 100 L900 + 100 Nb2 + 50 KS 180 50 L900 + 150 Nb2 + 50 KS 3,6 1 L900 + 199 Nb2 + 50 KS Beimpfung Mikrotiterplatte zum Erreichen 1,8-Cineol-Konzentrationen Konzentration Beimpfung Well, Angaben in µl [ppm] 2800 100 Ci7000 + 100 Nb2 + 50 KS 2000 100 Ci5000 + 100 Nb2 + 50 KS 1800 100 Ci4500 + 100 Nb2 + 50 KS 1600 100 Ci4000 + 100 Nb2 + 50 KS 1400 100 Ci3500 + 100 Nb2 + 50 KS 600 100 Ci1500 + 100 Nb2 + 50 KS 360 100 Ci900 + 100 Nb2 + 50 KS 180 50 Ci900 + 150 Nb2 + 50 KS 3,6 1 Ci900 + 199 Nb2 + 50 KS 46 3 Eigene Untersuchungen Fortsetzung Tabelle 12 Beimpfung Mikrotiterplatte zum Erreichen α-Pinen-Konzentrationen Konzentration Beimpfung Well, Angaben in µl [ppm] 1200 100 Pi3000 + 100 Nb2 + 50 KS 800 100 Pi2000 + 100 Nb2 + 50 KS 600 50 Pi3000 + 150 Nb2 + 50 KS 400 100 Pi1000 + 100 Nb2 + 50 KS 340 100 Pi850 + 100 Nb2 + 50 KS 3,4 1 Pi850 + 199 Nb2 + 50 KS Beimpfung Mikrotiterplatte zum Erreichen α-Terpineol-Konzentrationen Konzentration Beimpfung Well, Angaben in µl [ppm] 800 100 Te2000 + 100 Nb2 + 50 KS 600 100 Te1500 + 100 Nb2 + 50 KS 400 50 Te2000 + 150 Nb2 + 50 KS 0,8 100 Te2 + 100 Nb2 + 50 KS 0,0008 1 Te2 + 199 Nb2 + 50 KS C: Carvacrol C1000: Stammlösung mit 1000 ppm Carvacrol C500: Stammlösung mit 500 ppm Carvacrol C250: Stammlösung mit 250 ppm Carvacrol Ci: 1,8-Cineol Ci7000: Stammlösung mit 7000 ppm 1,8-Cineol Ci5000: Stammlösung mit 5000 ppm 1,8-Cineol Ci4500: Stammlösung mit 4500 ppm 1,8-Cineol Ci4000: Stammlösung mit 4000 ppm 1,8-Cineol Ci 3500: Stammlösung mit 3500 ppm 1,8-Cineol Ci900: Stammlösung mit 900 ppm 1,8-Cineol KS: Keimsuspension nach 3.2.2.3 L: Linalool L3000: Stammlösung mit 3000 ppm Linalool L1800: Stammlösung mit 1800 ppm Linalool L900: Stammlösung mit 900 ppm Linalool Nb2: Nutrient broth Nr. 2 Pi: α-Pinen Pi3000: Stammlösung mit 3000 ppm α-Pinen Pi2000: Stammlösung mit 2000 ppm α-Pinen Pi850: Stammlösung mit 850 ppm α-Pinen T: Thymol T1000: Stammlösung mit 1000 ppm Thymol T500: Stammlösung mit 500 ppm Thymol Te: α-Terpineol Te3000: Stammlösung mit 3000 ppm α-Terpineol Te1500: Stammlösung mit 1500 ppm α-Terpineol Te2: Stammlösung mit 2 ppm α-Terpineol Tabelle 13: Beimpfung der Mikrotiterplatte zum Erreichen der Stoffkombinationen Fortsetzung Tabelle 13 Beimpfung Mikrotiterplatte zum Erreichen der Linalool-Thymol-Kombinationen Konzentration Beimpfung Well, Angaben in µl [ppm] 100 T + 1200 L 50 T500 + 100 L3000 + 50 Nb2 + 50 KS 100 T + 720 L 50 T500 + 100 L1800 + 50 Nb2 + 50 KS 40 T + 1200 L 10 T1000 + 100 L3000 + 90 Nb2 + 50 KS 40 T + 720 L 10 T1000 + 100 L1800 + 90 Nb2 + 50 KS 40 T + 360 L 10 T1000 + 100 L900 + 90 Nb2 + 50 KS 4 T + 1200 L 1 T1000 + 100 L3000 + 99 Nb2 + 50 KS 4 T + 720 L 1 T1000 + 100 L1800 + 99 Nb2 + 50 KS 4 T + 360 L 1 T1000 + 100 L900 + 99 Nb2 + 50 KS 47 3 Eigene Untersuchungen Fortsetzung Tabelle 13 Beimpfung Mikrotiterplatte zum Erreichen der Linalool-Carvacrol-Kombinationen Konzentration Beimpfung Well, Angaben in µl [ppm] 50 C + 1200 L 50 C250 + 100 L3000 + 50 Nb2 + 50 KS 50 C + 720 L 50 C250 + 100 L1800 + 50 Nb2 + 50 KS 50 C + 360 L 50 C250 + 100 L900 + 50 Nb2 + 50 KS 20 C + 1200 L 10 C500 + 100 L3000 + 90 Nb2 + 50 KS 20 C + 720 L 10 C500 + 100 L1800 + 90 Nb2 + 50 KS 20 C + 360 L 10 C500 + 100 L900 + 90 Nb2 + 50 KS 2 C + 720 L 1 C500 + 100 L1800 + 99 Nb2 + 50 KS 2 C + 360 L 1 C500 + 100 L900 + 99 Nb2 + 50 KS Beimpfung Mikrotiterplatte zum Erreichen der 1,8-Cineol-Thymol-Kombinationen Konzentration Beimpfung Well, Angaben in µl [ppm] 100 T + 2800 Ci 50 T500 + 100 Ci7000 + 50 Nb2 + 50 KS 100 T + 2000 Ci 50 T500 + 100 Ci5000 + 50 Nb2 + 50 KS 100 T + 1800 Ci 50 T500 + 100 Ci4500 + 50 Nb2 + 50 KS 100 T + 1400 Ci 50 T500 + 100 Ci3500 + 50 Nb2 + 50 KS 100 T + 600 Ci 50 T500 + 100 Ci1500 + 50 Nb2 + 50 KS 40 T + 2800 Ci 10 T1000 + 100 Ci7000 + 90 Nb2 + 50 KS 40T + 2000 Ci 10 T1000 + 100 Ci5000 + 90 Nb2 + 50 KS 40T + 1800 Ci 10 T1000 + 100 Ci4500 + 90 Nb2 + 50 KS 40T + 1400 Ci 10 T1000 + 100 Ci3500 + 90 Nb2 + 50 KS 40T + 600 Ci 10 T1000 + 100 Ci1500 + 90 Nb2 + 50 KS 4 T + 1400 Ci 1 T1000 + 100 Ci3500 + 99 Nb2 + 50 KS 4 T + 600 Ci 1 T1000 + 100 Ci1500 + 99 Nb2 + 50 KS Beimpfung Mikrotiterplatte zum Erreichen der 1,8-Cineol-Carvacrol-Kombinationen Konzentration Beimpfung Well, Angaben in µl [ppm] 200 C + 2800 Ci 50 C1000 + 100 Ci7000 + 50 Nb2 + 50 KS 200 C + 2000 Ci 50 C1000 + 100 Ci5000 + 50 Nb2 + 50 KS 100 C + 2800 Ci 50 C500 + 100 Ci7000 + 50 Nb2 + 50 KS 100 C + 2000 Ci 50 C500 + 100 Ci5000 + 50 Nb2 + 50 KS 100 C + 1800 Ci 50 C500 + 100 Ci4500 + 50 Nb2 + 50 KS 50 C + 2800 Ci 50 C250 + 100 Ci7000 + 50 Nb2 + 50 KS 50 C + 2000 Ci 50 C250 + 100 Ci5000 + 50 Nb2 + 50 KS 50 C + 1800 Ci 50 C250 + 100 Ci4500 + 50 Nb2 + 50 KS 50 C + 1400 Ci 50 C250 + 100 Ci3500 + 50 Nb2 + 50 KS 50 C + 600 Ci 50 C250 + 100 Ci1500 + 50 Nb2 + 50 KS 20 C + 2800 Ci 10 C500 + 100 Ci7000 + 90 Nb2 + 50 KS 20 C + 2000 Ci 10 C500 + 100 Ci5000 + 90 Nb2 + 50 KS 20 C + 1400 Ci 10 C500 + 100 Ci3500 + 90 Nb2 + 50 KS 20 C + 600 Ci 10 C500 + 100 Ci1500 + 90 Nb2 + 50 KS 48 3 Eigene Untersuchungen Fortsetzung Tabelle 13 Beimpfung Mikrotiterplatte zum Erreichen der α-Pinen-Thymol-Kombinationen Konzentration Beimpfung Well, Angaben in µl [ppm] 100 T + 1200 Pi 50 T500 + 100 Pi3000 + 50 Nb2 + 50 KS 100 T + 800 Pi 50 T500 + 100 Pi2000 + 50 Nb2 + 50 KS 100 T + 400 Pi 50 T500 + 50 Pi2000 + 100 Nb2 + 50 KS 100 T + 340 Pi 50 T500 + 100 Pi850 + 50 Nb2 + 50 KS 40 T + 1200 Pi 10 T1000 + 100 Pi3000 + 90 Nb2 + 50 KS 40 T + 800 Pi 10 T1000 + 100 Pi2000 + 90 Nb2 + 50 KS 4T + 1200 Pi 1 T1000 + 100 Pi3000 + 99 Nb2 + 50 KS Beimpfung Mikrotiterplatte zum Erreichen der α-Pinen-Carvacrol-Kombinationen Konzentration Beimpfung Well, Angaben in µl [ppm] 200 C + 1200 Pi 50 C1000 + 100 Pi3000 + 50 Nb2 + 50 KS 200 C + 800 Pi 50 C1000 + 100 Pi3000 + 50 Nb2 + 50 KS 100 C + 1200 Pi 50 C500 + 100 Pi3000 + 50 Nb2 + 50 KS 100 C + 800 Pi 50 C500 + 100 Pi2000 + 50 Nb2 + 50 KS 100 C + 400 Pi 50 C500 + 50 Pi2000 + 100 Nb2 + 50 KS 100 C + 340 Pi 50 C500 + 100 Pi850 + 50 Nb2 + 50 KS 50 C + 400 Pi 50 C250 + 50 Pi2000 + 100 Nb2 + 50 KS 50 C + 340 Pi 50 C250 + 100 Pi850 + 50 Nb2 + 50 KS 20 C + 400Pi 10 C500 + 50 Pi2000 + 140 Nb2 + 50 KS Beimpfung Mikrotiterplatte zum Erreichen der α-Terpineol-Thymol-Kombinationen Konzentration Beimpfung Well, Angaben in µl [ppm] 100 T + 800 Te 50 T500 + 100 Te2000 + 50 Nb2 + 50 KS 100 T + 600 Te 50 T500 + 100 Te1500 + 50 Nb2 + 50 KS 40 T + 800 Te 10 T1000 + 100 Te2000 + 90 Nb2 + 50 KS 40 T + 600 Te 10 T1000 + 100 Te1500 + 90 Nb2 + 50 KS 4 T + 800 Te 1 T1000 + 100 Te2000 + 99 Nb2 + 50 KS 4 T + 600 Te 1 T1000 + 100 Te1500 + 99 Nb2 + 50 KS Beimpfung Mikrotiterplatte zum Erreichen der α-Terpineol-Carvacrol Kombinationen Konzentration Beimpfung Well, Angaben in µl [ppm] 200 C + 800 Te 50 C1000 + 100 Te2000 + 50 Nb2 + 50 KS 200 C + 600 Te 50 C1000 + 100 Te2000 + 50 Nb2 + 50 KS 100 C + 800 Te 50 C1000 + 100 Te2000 + 50 Nb2 + 50 KS 100 C + 600 Te 50 C1000 + 100 Te2000 + 50 Nb2 + 50 KS 50 C + 800 Te 50 C1000 + 100 Te2000 + 50 Nb2 + 50 KS 50 C + 600 Te 50 C1000 + 100 Te2000 + 50 Nb2 + 50 KS 50 C + 400 Te 50 C1000 + 100 Te2000 + 50 Nb2 + 50 KS 20 C + 800 Te 50 C500 + 100 Te2000 + 50 Nb2 + 50 KS 20 C + 600 Te 50 C500 + 100 Te1500 + 50 Nb2 + 50 KS 20 C + 400 Te 50 C500 + 50 Te2000 + 100 Nb2 + 50 KS 2 C + 600 Te 1 C500 + 100 Te1500 + 99 Nb2 + 50 KS 2 C + 400 Te 1 C500 + 50 Te2000 +149 Nb2 + 50 KS 49 3 Eigene Untersuchungen Fortsetzung Tabelle 13 Beimpfung Mikrotiterplatte zum Erreichen der Thymol-Carvacrol -Kombinationen Konzentration Beimpfung Well, Angaben in µl [ppm] 100T + 200 C 50 T500 + 100 C1000 + 50 Nb2 + 50 KS 100 T + 100 C 50 T500 + 100 C250 + 50 Nb2 + 50 KS 100 T + 50 C 50 T500 + 50 C250 + 100 Nb2 + 50 KS 40 T + 20 C 10 T1000 + 10 C500 + 180 Nb2 + 50 KS 40 T + 2 C 10 T1000 + 1 C500 + 189 Nb2 + 50 KS 4 T + 20 C 1 T1000 + 10 C500 + 189 Nb2 + 50 KS 4T+2C 1 T1000 + 1 C500 + 198 Nb2 + 50 KS C: Carvacrol C1000: Stammlösung mit 1000 ppm Carvacrol C500: Stammlösung mit 500 ppm Carvacrol C250: Stammlösung mit 250 ppm Carvacrol Ci: 1,8-Cineol Ci7000: Stammlösung mit 7000 ppm 1,8-Cineol Ci5000: Stammlösung mit 5000 ppm 1,8-Cineol Ci4500: Stammlösung mit 4500 ppm 1,8-Cineol Ci4000: Stammlösung mit 4000 ppm 1,8-Cineol Ci 3500: Stammlösung mit 3500 ppm 1,8-Cineol Ci900: Stammlösung mit 900 ppm 1,8-Cienol KS: Keimsuspension nach 3.2.2.3 L: Linalool L3000: Stammlösung mit 3000 ppm Linalool L1800: Stammlösung mit 1800 ppm Linalool L900: Stammlösung mit 900 ppm Linalool Nb2: Nutrient broth Nr. 2 Pi: α-Pinen Pi3000: Stammlösung mit 3000 ppm α-Pinen Pi2000: Stammlösung mit 2000 ppm α-Pinen Pi850: Stammlösung mit 850 ppm α-Pinen T: Thymol T1000: Stammlösung mit 1000 ppm Thymol T500: Stammlösung mit 500 ppm Thymol Te: α-Terpineol Te3000: Stammlösung mit 3000 ppm α-Terpineol Te1500: Stammlösung mit 1500 ppm α-Terpineol Te2: Stammlösung mit 2 ppm α-Terpineol Zur Kontrolle des Bakterienwachstums wurden Wells einer Reihe der Mikrotiterplatte lediglich mit 50 µl der Keimsuspension und 200 µl Nutrient broth Nr. 2 ohne Zusätze versehen. Zusätzlich wurde eine weitere Reihe der Mikrotiterplatte mit Keimsuspension und mit Nutrient broth Nr. 2 beimpft, welcher 0,4 % bzw. 1 % Isopropylalkohol oder 0,5 % Tween80 zugefügt wurde. Für jede getestete Inhaltsstoffkonzentration wurde ein Nullwert angelegt. Dieses Well wurde grundsätzlich ebenso beimpft, wie die übrigen Wells zur Untersuchung der jeweiligen Konzentration des Inhaltsstoffs ätherischer Öle. Abweichend davon wurden bei den Nullwerten die 50 µl Keimsuspension durch 50 µl Nutrient broth Nr. 2 ersetzt. Insgesamt enthielt jedes Well der Mikrotiterplatte 250 µl. Nach erfolgter Belegung wurde die Mikrotiterplatte mit optisch klarer, adhäsiver Folie (AB 1170,Fa. ABgene, Hamburg, Deutschland) verschlossen. Um die Reproduzierbarkeit der gewonnenen Ergebnisse zu gewährleisten wurden je Versuchsablauf drei Mikrotiterplatten identisch belegt und parallel zueinander dem weiteren Versuchsablauf unterzogen. Auf jede Stammlösungsverdünnungsstufe entfielen jeweils sieben Wells je Mikrotiterplatte. 50 3 Eigene Untersuchungen 3.2.2.5 Beobachtung des Bakterienwachstums Nach Belegung und Verschluss der Mikrotiterplatte erfolgte eine sofortige Messung der optischen Dichte des Inhalts eines jeden Wells mit Hilfe eines Spektrophotometers (Infinite 200, Fa. Tecan) bei einer Wellenlänge von 490 nm. Mit E. coli oder A. hydrophila beimpfte Mikrotiterplatten wurden bei einer Temperatur von 30 °C über einen Zeitraum von 7 Stunden inkubie rt. Dabei wurde das Wachstum der Bakterien durch stündliche Messung der optischen Dichte der Wellinhalte verfolgt. Mit Ps. fragi oder B. thermosphacta beimpfte Mikrotiterplatten wurden für eine Dauer von 12 Stunden bei einer Temperatur von 25 °C inkubiert. Die Messung der optischen Dichte erfolgte ab der 6. Stunde. 3.2.2.6 Bestimmung der Keimzahl Unmittelbar nach Beendigung der Inkubation wurde je Mikrotiterplatte von jeder Stammlösungs-Verdünnungsstufe 100 µl des Inhalts eines Wells mittels Mikroliterpipette entnommen, um die nach 7 Stunden (A. hydrophila, E.coli) bzw. 12 Stunden (Ps. fragi, B. thermosphacta) erreichte Keimzahl bestimmen zu können. Dazu wurde eine dezimale Verdünnungsreihe angelegt und anschließend die Keimzahl im Tropfplattenverfahren gemäß DIN EN ISO 6887-Teil 1 bestimmt. Die Verdünnungsstufen wurden jeweils im Doppelansatz mittels Tropfplattenverfahren (50 µl pro Sektor, 4 Sektoren pro Platte) auf Standard-І-Nähragar untersucht. E. coli bzw. A. hydrophila wurden für 18 h ± 2 h bei einer Temperatur von 37 °C ± 0,5 °C bzw. 30 °C ± 0,5 °C inkubiert. Ps. fragi und B. thermosphacta wurden über einen Zeitraum von 48 h ± 2 h bei einer Temperatur von 25 °C ± 0,5 °C bebrütet. Nach erfolgter Inkubation erfolgte eine makroskopische Kontrolle der Kolonien. A. hydrophila wuchs auf Standard-І-Nähragar in runden, schleimigen, leicht erhabenen, scharf umgrenzten, weißlich bis leicht gelblich gefärbten Kolonien mit glatter Oberfläche. Die Kulturen wiesen einen strengen Geruch auf. B. thermosphacta wuchs i.d.R. in leicht erhabenen, runden, feuchten und scharf begrenzten, weißen Kolonien mit glatter Oberfläche. Selten waren die Kolonien flach, 51 3 Eigene Untersuchungen unregelmäßig begrenzt oder hatten eine raue Oberfläche. Die Kulturen wiesen einen säuerlich-käsigen Geruch auf. Ps. fragi bildete auf Standard-1-Nähragar glatte, relativ kleine (ca. 1 mm), trockene, gut umgrenzte, weiße Kolonien. E. coli wuchs in feucht- glänzenden, leicht erhabenen, scharf umgrenzten weiß bis gräulich gefärbten Kolonien mit glatter Oberfläche. Die Auswertung erfolgte nach der in § 64 LFGB vorgesehenen Methode (L06.00-19). 3.2.3 Stoffkombinationen Die Kombination von Inhaltsstoffen ätherischer Öle sollte Aufschluss über mögliche synergistische oder antagonistische Effekte zwischen den einzelnen Inhaltsstoffen ätherischer Öle bzgl. ihrer antimikrobiellen Wirkung geben. Verschiedene Konzentrationen der in den Versuchen gemäß Kapitel 3.2.2 verwendeten Stoffe wurden miteinander kombiniert und auf ihre antimikrobielle Wirksamkeit gegenüber den ausgewählten Mikroorganismen geprüft. Als fester Bestandteil der Kombinationen wurden verschiedene Konzentrationen von Thymol und Carvacrol gewählt, welche jeweils mit mehreren Konzentrationen 1,8-Cineol, Linalool, α-Pinen oder α-Terpineol kombiniert wurden. Die Konzentration von Thymol bzw. Carvacrol sowie die damit kombinierten Konzentrationen der übrigen Inhaltsstoffe ätherischer Öle wurden mit Hilfe der in den Versuchen nach Kapitel 3.2.2 gewonnenen Erkenntnisse gewählt. Es wurden die letzte noch hemmende sowie die erste nicht mehr hemmende Konzentration von Linalool, 1,8-Cineol, α-Pinen und α-Terpineol gewählt und jeweils mit Thymol bzw. Carvacrol kombiniert. Zeigte ein Stoff in keiner Konzentration antibakterielle Wirksamkeit, so wurden die beiden höchsten untersuchten Konzentrationen dieses Stoffs mit Thymol bzw. Carvacrol kombiniert. Von Thymol und Carvacrol wurden ebenfalls die letzte noch hemmende sowie die erste nicht mehr hemmende Konzentration für die Stoffkombination ausgewählt. Abweichend davon wurden bei E. coli als Basis für die Stoffkombinationen mit Thymol eine Konzentration von 250 ppm und 100 ppm Thymol verwendet. Für die Kombination Linalool-Carvacrol wurden bei B. thermosphacta, E.coli und Ps. fragi 52 3 Eigene Untersuchungen sowie in der Kombination 1,8-Cineol-Carvacrol bei E.coli 125 ppm und 50 ppm Carvacrol verwendet. α-Terpineol wurde bei Ps. fragi mit 250 ppm und 125 ppm Carvacrol kombiniert. War bei einer Kombination ein synergistischer Effekt feststellbar, wurden zusätzlich niedrigere Konzentrationen der beiden beteiligten Stoffe kombiniert. 3.2.3.1 Kombinationen mit Thymol Eine Übersicht über die verschiedenen Kombinationen von Thymol mit Carvacrol, Linalool, 1,8-Cineol, α-Pinen und α-Terpineol je Bakterium geben die Tabellen 14 bis 17. Die Menge der Inhaltsstoffe ätherischer Öle wird in ppm angegeben. Tabelle 14: Thymol [ppm] 100 40 4 Tabelle 15: Thymol [ppm] 100 40 4 An A. hydrophila getestete Kombinationen von Thymol mit Carvacrol, Linalool, 1,8-Cineol, α-Pinen und α-Terpineol in ppm Carvacrol [ppm] 50 20 2 20 2 Linalool [ppm] — 720 360 720 360 1,8-Cineol [ppm] — 1400 600 1400 600 α-Pinen [ppm] 800 1200 800 1200 α-Terpineol [ppm] — 600 400 600 400 An E. coli getestete Kombinationen von Thymol mit Carvacrol, Linalool, 1,8-Cineol, α-Pinen und α-Terpineol in ppm Carvacrol [ppm] 200 100 50 20 2 — Linalool [ppm] 1,8-Cineol [ppm] α-Pinen [ppm] α-Terpineol [ppm] 1200 720 2800 2000 1200 800 800 600 1200 720 1200 720 2800 2000 1200 800 800 600 — — — 53 3 Eigene Untersuchungen Tabelle 16: Thymol [ppm] 100 40 4 Tabelle 17: Thymol [ppm] 100 40 An B. thermosphacta getestete Kombinationen von Thymol mit Carvacrol, Linalool, 1,8-Cineol, α-Pinen und α-Terpineol in ppm Carvacrol [ppm] 100 50 20 2 20 2 Linalool [ppm] 1200 720 1200 720 1200 720 1,8-Cineol [ppm] 2000 1800 2000 1800 α-Pinen [ppm] 400 340 400 340 α-Terpineol [ppm] 800 600 800 600 — 400 — An Ps fragi getestete Kombinationen von Thymol mit Carvacrol, Linalool, 1,8-Cineol, α-Pinen und α-Terpineol in ppm Carvacrol [ppm] 100 50 20 2 Linalool [ppm] 1200 720 1200 720 1,8-Cineol [ppm] 2800 2000 2800 2000 α-Pinen [ppm] 1200 800 1200 800 α-Terpineol [ppm] 800 600 800 600 3.2.3.2 Kombinationen mit Carvacrol Eine Übersicht über die auf ihre antimikrobielle Wirksamkeit untersuchten Kombinationen von Carvacrol mit Thymol, Linalool, 1,8-Cineol, α-Pinen und α-Terpineol je Bakterium geben die Tabellen 18 bis 21. Die Menge des jeweiligen Inhaltsstoffs ätherischer Öle wird in ppm angegeben. Tabelle 18: An A. hydrophila getestete Kombinationen von Carvacrol mit Thymol, Linalool, 1-Cineol, α-Pinen und α-Terpineol in ppm Carvacrol [ppm] 100 Thymol [ppm] — 50 200 20 2 40 4 40 4 Linalool [ppm] — 720 360 720 900 720 360 1,8-Cineol [ppm] — 1400 600 1400 600 α-Pinen[ ppm] 800 1200 800 1200 800 — — 54 α-Terpineol [ppm] — 600 400 600 400 600 400 3 Eigene Untersuchungen Tabelle 19: An E. coli getestete Kombinationen von Carvacrol mit Thymol, Linalool, 1,8-Cineol, α-Pinen und α-Terpineol in ppm Carvacrol [ppm] Thymol [ppm] Linalool [ppm] 1,8-Cineol [ppm] 200 100 — — 100 100 — — 50 100 20 40 2800 2000 2800 2000 2 40 1200 720 1200 720 1200 720 Tabelle 20: Carvacrol [ppm] α-Terpineol [ppm] 800 600 800 600 — 800 — — — — An B. thermosphacta getestete Kombinationen von Carvacrol mit Thymol, Linalool, 1,8-Cineol, α-Pinen und α-Terpineol in ppm Thymol [ppm] 100 100 50 100 20 40 2 40 Tabelle 21: — α-Pinen [ppm] 1200 800 1200 800 Linalool [ppm] — 1200 720 1200 720 1200 1,8-Cineol [ppm] 2000 1800 2000 1800 α-Pinen [ppm] 400 340 400 340 α-Terpineol [ppm] 800 600 800 600 — 400 — — — — An Ps. fragi getestete Kombinationen von Carvacrol mit Thymol , Linalool, 1,8-Cineol, α-Pinen und α-Terpineol in ppm Carvacrol [ppm] Thymol [ppm] Linalool [ppm] 200 — — 100 100 — 50 — 20 40 2 40 1200 720 1200 720 — 1,8-Cineol [ppm] 2800 2000 2800 2000 α-Pinen [ppm] 1200 800 1200 800 — — — — — — — — 55 α-Terpineol [ppm] — 800 600 800 600 3 Eigene Untersuchungen 3.2.3.3 Herstellung und Lagerung der Stammlösungen Für die Stoffkombinationen wurden die bereits vorhandenen Stammlösungen von Thymol, Carvcrol, Linalool, α-Pinen, α-Terpineol, und 1,8-Cineol verwendet. Lediglich von Thymol und Carvacrol wurden aufgrund der Begebenheiten bei der Mikrotiterplattenbelegung weitere Stammlösungen mit 500 ppm Thymol, 1000 ppm und 250 ppm Carvacrol hergestellt. Die Herstellung der neuen Stammlösungen von Thymol und Carvacrol erfolgte wie unter Kapitel 3.2.2.2 beschrieben. Die Stammlösungen wurden mit Hilfe steriler Glaspipetten in Rotabilo® Zentrifugenröhrchen à 10-12 ml abgefüllt und bis zur weiteren Verarbeitung bei -18 °C ± 2 °C gelagert. 3.2.3.4 Versuchsablauf Vorbereitung der Keimsuspension, Belegung der Mikrotiterplatte (siehe Tabelle 12), Beobachtung des Bakterienwachstums sowie Bestimmung der Keimzahl erfolgten in gleicher Art und Weise wie in den Kapiteln 3.2.2.3 bis 3.2.2.6 beschrieben. 3.3 Auswertung Durch die stündliche Trübungsmessung konnte das Bakterienwachstum graphisch dargestellt werden. Dazu wurden die vorliegenden Messwerte korrigiert. Zunächst wurde von dem aktuell gemessenen Trübungswert der dazugehörige Nullwert (Bouillontrübung ohne Bakterien, siehe Kapitel 2.2.2.4) subtrahiert. Durch Subtraktion des Nullwerts von der aktuell gemessenen optischen Dichte ergab sich die Trübung, die ausschließlich durch die im Well vorhandenen Bakterien verursacht wurde. Anschließend wurde der bereits um den Nullwert korrigierte Trübungsmesswert des Wellinhalts der jeweiligen Stunde durch Subtraktion um den zur Stunde Null ermittelten Messwert korrigiert, der auf die zugeführten Bakterienkulturen zurückzuführen war. Der sowohl um Nullwert als auch um den Trübungswert zur Stunde Null korrigierte Wert ergab die optische Dichte, die durch Vermehrung des Bakteriums seit dem Zeitpunkt Null verursacht wurde. 56 3 Eigene Untersuchungen Anschließend wurde der Mittelwert der Trübungsmesswerte je Stunde der drei Mikrotiterplatten berechnet und mit dem Faktor 1000 multipliziert. Dieser Wert diente als Grundlage für die graphische Darstellung des Wachstums des jeweiligen Bakteriums während der Inkubationsdauer unter Einfluss eines einzelnen Inhaltsstoffs ätherischer Öle. Für die Aufzeichnung, Berechnungen und Graphische Darstellung der optischen Dichte wurde das Programm Excel® der Fa. MicrosoftTM verwendet Um den Einfluss von Stoffkombinationen auf das Bakterienwachstum wiederzugeben, wurde von dem Trübungsmesswert zur Stunde 7 bzw. 12 der Trübungsmesswert der Kontrolle ohne Zusatz von Ölkomponenten subtrahiert und die Differenz graphisch dargestellt. Betrug die Differenz zwischen optischer Dichte der Kontrollproben und der Einzelstoffkonzentration oder Stoffkombination zur Stunde 7 (E. coli) bzw. Stunde 12 (Ps. fragi, B. thermosphacta) mindestens 100, so wurde die jeweilige Einzelstoffkonzentration bzw. Stoffkombination als keimhemmend eingestuft. Abweichend davon wurde bei A. hydrophila eine Stoffkombination oder Einzelstoffkonzentration erst ab einer Differenz von 200 zur Kontrolle als hemmend eingeschätzt. Die Darstellung der antimikrobiellen Wirksamkeit der sechs Einzelkomponenten ätherischer Öle erfolgt durch graphische Darstellung der Entwicklung der optischen Dichte während der Inkubationszeit (Abbildungen 1 bis 24). Jede Untersuchung zur Bestimmung der Keimzahl wurde im Doppelansatz durchgeführt. Nach den in Kapitel 3.2.2.6 aufgeführten Inkubationstemperaturen und -zeiten wurden die Kolonien ausgezählt und gemäß der nach § 64 LFGB vorgeschriebenen Methode (L 06.00-19) ausgewertet. Die Nachweisgrenze lag bei 2,0 × 102 KbE/ml. Für Proben, deren Keimzahl unterhalb der Nachweisgrenze lag, wurde als absoluter Wert die Hälfte (also 1,0 × 102 KbE/ml) eingesetzt. Für alle weiteren Berechnungen wurden die Keimzahlen zur Basis 10 logarithmiert. Aus den Keimzahlen aller Proben ohne Zusatz von Inhaltsstoffen ätherischer Öle je untersuchter Bakterienart (Kontrollproben) wurden Mittelwert, Standardabweichung sowie die obere und untere Grenze des 95 % Konfidenzintervalls berechnet. 57 3 Eigene Untersuchungen Aus den drei Keimzahlen, die je geprüfter Inhaltsstoff-Konzentration bzw. je Kombination zweier Inhaltsstoffe ätherischer Öle ermittelt wurden, wurden ebenfalls Mittelwert, Standardabweichung sowie obere und untere Grenze des 95 % Konfidenzintervalls berechnet. Die Berechnungen wurden mit Hilfe des Programms SAS, Statistikpaket SAS® Version 9.1.3 Service Pack 4 (Statistic Analysing Systems, SAS Institute®) durchgeführt. Eine Einzelstoffkonzentration bzw. eine Stoffkombination wurde als keimhemmend bzw. bakteriostatisch eingestuft, wenn ihr Konfidenzintervall vollständig außerhalb des Konfidenzintervalls Konfidenzintervalle der wurde Kontrollprobe die lag. jeweilige Bei Überschneidungen Einzelstoffkonzentration der bzw. Stoffkombination als nicht keimhemmend eingestuft. Ein bakterizider Effekt lag vor, wenn der Mittelwert der Keimzahlen von Einzelstoffkombination oder Stoffkombination geringer war als die Keimzahl der inokulierten Keimzahl. Ein synergistischer Effekt lag vor, wenn die unter Einfluss der jeweiligen Stoffkombination erreichte Keimzahl signifikant niedriger war als diejenige Keimzahl, die unter Einfluss der beteiligten einzelnen Inhaltsstoffkonzentration erreicht wurde. Ein antagonistischer Effekt lag vor, wenn die bei Kombination der beiden Stoffkonzentrationen erreichte Keimzahl signifikant höher war als diejenige Keimzahl, die für die Einzelstoffkonzentration mit der besseren antibakteriellen Wirksamkeit ermittelt wurde. 58 4 Ergebnisse 4 Ergebnisse 4.1 Proben ohne Zusatz von Inhaltsstoffen ätherischer Öle Proben ohne Zusatz von Inhaltsstoffen ätherischer Öle wurden bei jeder Mikrotiterbelegung gemäß Kapitel 3.2.2.4 als Kontrolle angelegt. Aus den nach Kapitel 3.2.2.6 bestimmten Keimzahlen dieser Proben wurden Mittelwert, Standardabweichung sowie obere und untere Grenze des 95 % Konfidenzintervalls berechnet. Die der Berechnung zugrunde liegenden Keimzahlen finden sich im Anhang (Kapitel 10.1.1 und 10.1.3). Tabelle 22 zeigt die genannten statistischen Parameter für A. hydrophila (DSMZ 30187T), E. coli (DSMZ 10727), B. thermosphacta (DSMZ 20171) und Ps. fragi (DSMZ 3456). Tabelle 22: Probenanzahl, Mittelwert, Standardabweichung, untere und obere Grenze des Konfidenzintervalls der Proben ohne Zusatz von Inhaltsstoffen ätherischer Öle in lg KbE/ml Bakterium n m s UGK OGK A. hydrophila 51 8,79 0,11 8,76 8,82 E. coli 42 8,74 0,12 8,71 8,78 B. thermosphacta 48 7,81 0,21 7,75 7,87 Ps. fragi 42 7,85 0,10 7,82 7,88 m: Mittelwert n: Probenanzahl OGK: obere Grenze des 95 % Konfidenzintervall UGK: untere Grenze des 95 % Konfidenzintervall 59 4 Ergebnisse 4.2 Antimikrobielle Wirksamkeit der Einzelstoffe Alle Daten, die zur Berechnung und Darstellung der Ergebnisse in Kapitel 4.2 verwendet wurden, finden sich im Anhang (Kapitel 10.1.1 und 10.1.2). 4.2.1 Thymol Aeromonas hydrophila mit Thymol Wie Abbildung 1 zeigt, wirkten sich 400 ppm, 200 ppm, 100 ppm und 40 ppm Thymol hemmend auf das Wachstum von A. hydrophila aus. Die optische Dichte der Proben mit 400 ppm, 200 ppm und 100 ppm erreichte nach 7 Stunden Inkubation bei 30 °C lediglich Werte zwischen 6 und 8. Bei einer Konzentration von 40 ppm Thymol wiesen die Proben nach 7 Stunden eine optische Dichte von 173 auf. Die Kontrolle erreichte in dieser Zeit einen Wert von 430. 500 400 OD 300 200 100 0 -100 0 1 2 3 4 5 6 7 Zeit in Stunden Kontrolle 200 ppm Thymol 4 ppm Thymol 0,4 % Isopropylalk. 100 ppm Thymol 400 ppm Thymol 40 ppm Thymol Abbildung 1: Entwicklung der optischen Dichte bei 490 nm von A. hydrophila – Kulturen in Nutrient broth Nr. 2 mit unterschiedlichen Konzentrationen [ppm] an Thymol über eine Inkubationsdauer von 7 h bei 30 °C (OD = optische Dichte) Die Keimzahl der Proben mit 400 ppm und 200 ppm Thymol lag unterhalb der Nachweisgrenze. Bei einer Konzentration von 100 ppm und 40 ppm Thymol wurden mittlere Keimzahlen von 2,92 lg KbE/ml bzw. 8,19 lg KbE/ml erreicht, die Kontrollproben wiesen hingegen eine mittlere Keimzahl von 8,79 lg KbE/ml auf. Somit wird das Wachstum von A. hydrophila von Thymol in Konzentrationen von 40 ppm und höher gehemmt. 60 4 Ergebnisse Der Ausgangskeimgehalt lag bei 6,3 lg KbE/ml. Damit konnte, wie in Tabelle 23 dargestellt, für die Konzentrationen 400 ppm, 200 ppm und 100 ppm ein bakterizider Effekt nachgewiesen werden. Tabelle 23: Probenanzahl, Mittelwert, inokulierte Keimmenge, obere und untere Grenze des 95 % Konfidenzintervalls der Keimzahlen [lg KbE/ml] von A. hydrophila aus den Proben mit 0,4 % Isopropylalkohol und Thymol in unterschiedlichen Konzentrationen vor und nach der Bebrütung bei 30 °C über einen Zeitraum von 7 Stunden Konzentration Thymol in ppm Inokulierte Keimmenge Kontrollproben 0,4 % Isopropylalk. 400 200 100 40 4 n m UGK OGK 1 6,30 - - - - 51 3 3 3 3 3 3 8,79 9,21 2,00 2,00 2,92 8,19 8,73 8,82 10,71 2,00 2,00 3,11 8,68 10,73 + + + + - + + + - 8,76 7,71 2,00 2,00 2,72 7,69 7,71 bakteriostatisch bakterizid m: Mittelwert n: Probenanzahl OGK: obere Grenze des 95 % Konfidenzintervall UGK: untere Grenze des 95 % Konfidenzintervall Escherichia coli mit Thymol E. coli zeigte, wie in Abbildung 2 dargestellt, nach 7 Stunden in Gegenwart von 400 ppm bzw. 200 ppm Thymol eine optische Dichte von 10 bzw. 9, während die Kontrollprobe eine optische Dichte von 255 erreichte. Demnach beeinflusst Thymol in Konzentrationen von 400 ppm und 200 ppm das Wachstum des Bakteriums negativ. 61 4 Ergebnisse 300 250 OD 200 150 100 50 0 -50 0 1 2 Kontrolle 200 ppm Thymol 4 ppm Thymol 3 4 Zeit in Stunden 5 0,4 % Isopropylalk. 100 ppm Thymol 6 7 400 ppm Thymol 40 ppm Thymol Abbildung 2: Entwicklung der optischen Dichte bei 490 nm von E. coli – Kulturen in Nutrient broth Nr. 2 mit unterschiedlichen Konzentrationen [ppm] an Thymol über eine Inkubationsdauer von 7 h bei 30 °C (OD = optische D ichte) Bei Mengen von 400 ppm bzw. 200 ppm Thymol waren nach der Bebrütungsdauer mikrobiologisch keine lebenden Bakterien mehr nachweisbar. Da insgesamt 6,31 lg KbE/ml inokuliert worden waren, konnte für 400 ppm und 200 ppm Thymol eine bakterizide Wirkung gegenüber E. coli angenommen werden. Bei einer Konzentration von 100 ppm Thymol und darunter war keine hemmende Wirkung gegenüber E. coli mehr nachweisbar (Tabelle 24). Tabelle 24: Probenanzahl, Mittelwert, inokulierte Keimmenge, obere und untere Grenze des 95 %Konfidenzintervalls der Keimzahlen [lg KbE/ml] von E. coli aus den Proben mit 0,4 % Isopropylalkohol und Thymol in unterschiedlichen Konzentrationen vor und nach der Bebrütung bei 30 °C über einen Zeitraum von 7 Stunden Konzentration Thymol in ppm Inokulierte Keimmenge Kontrollproben 0,4 % Isopropylalk. 400 200 100 40 4 n m UGK OGK 1 6,31 - - 42 3 3 3 3 3 3 8,74 8,72 2,00 2,00 8,40 8,77 8,80 8,71 8,41 2,00 2,00 7,97 8,47 8,70 8,82 9,02 2,00 2,00 8,83 9,06 8,90 bakteriostatisch bakterizid - - + + - + + - m: Mittelwert n: Probenanzahl OGK: obere Grenze des 95 % Konfidenzintervall UGK: untere Grenze des 95 % Konfidenzintervall 62 4 Ergebnisse Brochothrix thermosphacta mit Thymol Die optische Dichte der Kontrollproben erreichte nach 12-stündiger Inkubation bei 25 °C einen mittleren Wert von 186. Im Gegensatz da zu wurde in den Konzentrationen 400 ppm, 200ppm und 100 ppm lediglich Werte zwischen -1 und 7 erzielt, was für eine keimhemmende Wirkung von Thymol in diesen Konzentrationen spricht (siehe Abbildung 3). 200 OD 150 100 50 0 -50 0 6 7 8 9 10 11 12 Zeit in Stunden Kontrolle 200 ppm Thymol 4 ppm Thymol 0,4% Isopropylalk. 100 ppm Thymol 400 ppm Thymol 40 ppm Thymol Abbildung 3: Entwicklung der optischen Dichte bei 490 nm von B. thermosphacta – Kulturen in Nutrient broth Nr. 2 mit unterschiedlichen Konzentrationen [ppm] an Thymol über eine Inkubationsdauer von 12 h bei 25 °C (OD = optische Dichte) Die Keimzahlen der Stichproben der Konzentrationen 400 ppm und 200 ppm Thymol befanden sich unterhalb der Nachweisgrenze. Wie Tabelle 25 zeigt, lag die nach 12 Stunden Inkubation erreichte mittlere Keimzahl bei 100 ppm Thymol bei 5,52 lg KbE/ml. Die inokulierte Keimmenge betrug 6,95 lg KbE/ml. Demnach wirkte Thymol in einer Konzentration von 400 ppm, 200 ppm und 100 ppm bakterizid auf B. thermosphacta. In Konzentrationen von 40 ppm und 4 ppm zeigte Thymol keine antibakterielle Wirkung. 63 4 Ergebnisse Tabelle 25: Probenanzahl, Mittelwert, inokulierte Keimmenge, obere und untere Grenze des 95 % Konfidenzintervalls der Keimzahlen [lg KbE/ml] von B. thermosphacta aus den Proben mit 0,4 % Isopropylalkohol und Thymol in unterschiedlichen Konzentrationen vor und nach der Bebrütung bei 25 °C über einen Zeitraum von 12 Stunden Konzentration Thymol in ppm Inokulierte Keimmenge Kontrollproben 0,4 % Isopropylalk. 400 200 100 40 4 n m UGK OGK 1 6,95 - - 48 3 3 3 3 3 3 7,81 7,97 2,00 2,00 5,52 7,77 8,00 7,75 7,90 2,00 2,00 5,34 7,59 8,00 bakteriostatisch bakterizid 7,87 8,04 2,00 2,00 5,70 7,96 8,00 - - + + + - + + + - m: Mittelwert n: Probenanzahl OGK: obere Grenze des 95 % Konfidenzintervall UGK: untere Grenze des 95 % Konfidenzintervall Pseudomonas fragi mit Thymol Wie aus Abbildung 4 ersichtlich, erreichte Ps. fragi in der Kontrolle nach einer Inkubationszeit von 12 Stunden bei 25 °C eine optis che Dichte von 226. Bei einer Konzentration von 400 ppm wies die optische Dichte nach diesem Zeitraum nur einen Wert von 1 auf. Die Proben mit 200 ppm und 100 ppm Thymol wiesen am Ende der Inkubationszeit eine optische Dichte von 8 bzw. 91 auf. 250 200 OD 150 100 50 0 -50 0 6 Kontrolle 200 ppm Thymol 4 ppm Thymol 7 8 9 Zeit in Stunden 0,4 % Isopropylalk. 100 ppm Thymol 10 11 12 400 ppm Thymol 40 ppm Thymol Abbildung 4: Entwicklung der optischen Dichte bei 490 nm von Ps. fragi – Kulturen in Nutrient broth Nr. 2 mit unterschiedlichen Konzentrationen [ppm] an Thymol über eine Inkubationsdauer von 12 h bei 25 °C (OD = optische Dichte) 64 4 Ergebnisse Bei einem Gehalt von 400 ppm Thymol in der Probe waren bei der mikrobiologischen Untersuchung keine lebenden Bakterien mehr nachweisbar. Ebenso lagen die 95 % Konfidenzintervalle der mittleren Keimzahlen aus den Proben von 200 ppm und 100 ppm Thymol deutlich unter dem der Kontrollproben (Tabelle 26). Die inokulierte Bakterienmenge betrug noch 7,0 lg KbE/ml. Damit wirkt Thymol in einer Konzentration von 400 ppm und 200ppm bakterizid gegenüber Ps. fragi. Tabelle 26: Probenanzahl, Mittelwert, inokulierte Keimmenge, obere und untere Grenze des 95 % Konfidenzintervalls der Keimzahlen [lg KbE/ml] von Ps. fragi aus den Proben mit 0,4 % Isopropylalkohol und Thymol in unterschiedlichen Konzentrationen vor und nach der Bebrütung bei 25 °C über einen Zeitraum von 12 Stunden Konzentration Thymol in ppm Inokulierte Keimmenge Kontrollproben 0,4 % Isopropylalk. 400 200 100 40 4 n m UGK OGK 1 7,00 - - 42 3 3 3 3 3 3 7,85 7,92 2,00 6,10 7,36 7,98 8,10 7,82 7,85 2,00 5,67 7,11 7,92 7,67 7,88 7,99 2,00 6,53 7,61 8,05 8,53 bakteriostatisch bakterizid - - + + + - + + - m: Mittelwert n: Probenanzahl OGK: obere Grenze des 95 % Konfidenzintervall UGK: untere Grenze des 95% Konfidenzintervall 4.2.2 Carvacrol Aeromonas hydrophila mit Carvacrol Abbildung 5 zeigt die Entwicklung der optischen Dichte von A. hydrophila in Gegenwart von Carvacrol. Die Kontrollprobe erreichte nach 7 Stunden eine optische Dichte von 426, während die optische Dichte bei 200 ppm und 100 ppm nur auf 13 bzw. 12 anstieg. Bei 50 ppm Carvacrol lag die optische Dichte der Probe bei 167. 65 4 Ergebnisse 500 OD 400 300 200 100 0 0 1 2 3 4 Zeit in Stunden 5 6 7 Kontrolle 1 % Isopropylalk. 200 ppm Carvacrol 100 ppm Carvacrol 50 ppm Carvacrol 20 ppm Carvacrol 2 ppm Carvacrol Abbildung 5: Entwicklung der optischen Dichte bei 490 nm von A. hydrophila – Kulturen in Nutrient broth Nr. 2 mit unterschiedlichen Konzentrationen [ppm] an Carvacrol über eine Inkubationsdauer von 7 h bei 30 °C (OD = optische Dichte) Die abschließend ermittelten Keimzahlen ergaben, dass Carvacrol in Konzentrationen von 200 ppm, 100 ppm und 50 ppm signifikant das Wachstum von A. hydrophila hemmte. Wie aus Tabelle 27 ersichtlich lag die Keimzahl in den Proben mit 200 ppm Carvacrol unterhalb der Nachweisgrenze, in den Proben mit 100 ppm Carvacrol bei 2,93 lg KbE/ml. Die Keimsuspension zur Beimpfung der Mikrotiterplatte wies eine Keimzahl von 6,4 lg KbE/ml auf. Damit zeigte Carvacrol in den beiden höchsten geprüften Konzentrationen einen bakteriziden Effekt. 66 4 Ergebnisse Tabelle 27: Probenanzahl, Mittelwert, inokulierte Keimmenge, obere und untere Grenze des 95 % Konfidenzintervalls der Keimzahlen [lg KbE/ml] von A. hydrophila aus den Proben mit 1 % Isopropylalkohol und Carvacrol in unterschiedlichen Konzentrationen vor und nach der Bebrütung bei 30 °C über einen Zeitraum von 7 Stunden Konzentration Carvacrol in ppm Inokulierte Keimmenge Kontrollproben 1 % Isopropylalk. 200 100 50 20 2 n m UGK OGK 1 6,40 - - 51 3 3 3 3 3 3 8,79 8,59 2,00 2,93 8,12 8,71 8,70 8,76 7,81 2,00 2,69 8,03 7,93 8,28 bakteriostatisch bakterizid 8,82 9,38 2,00 3,17 8,22 9,50 9,12 - - + + + - + + - m: Mittelwert n: Probenanzahl OGK: obere Grenze des 95 % Konfidenzintervall UGK: untere Grenze des 95 % Konfidenzintervall Escherichia coli mit Carvacrol Ohne Zusatz von Carvacrol erreichte E. coli nach 7 Stunden bei 30 °C eine optische Dichte von 262. Davon wichen nur die Proben mit 200 ppm Carvacrol mit einem Wert OD von 8 deutlich ab (Abbildung 6). 300 250 200 150 100 50 0 -50 0 1 2 3 4 5 6 7 Zeit in Stunden Kontrolle 100 ppm Carvacrol 2 ppm Carvacrol 1 % Isopropylalk. 50 ppm Carvacrol 200 ppm Carvacrol 20 ppm Carvacrol Abbildung 6: Entwicklung der optischen Dichte bei 490 nm von E. coli – Kulturen in Nutrient broth Nr. 2 mit unterschiedlichen Konzentrationen [ppm] an Carvacrol über eine Inkubationsdauer von 7 h bei 30 °C (OD = optis che Dichte) 67 4 Ergebnisse Bei Carvacrol konnte in einer Konzentration von 200 ppm eine antibakterielle Wirkung gegenüber E. coli nachgewiesen werden. Da die inokulierte E. coli-Suspension 6,4 lg KbE/ml enthielt, handelte es sich um einen bakteriziden Effekt (Tabelle 28) Tabelle 28: Probenanzahl, Mittelwert, inokulierte Keimmenge, obere und untere Grenze des 95 % Konfidenzintervalls der Keimzahlen [lg KbE/ml] von E. coli aus den Proben mit 1 % Isopropylalkohol und Carvacrol in unterschiedlichen Konzentrationen vor und nach der Bebrütung bei 30 °C über einen Zeitraum von 7 Stunden Konzentration Carvacrol in ppm Inokulierte Keimmenge Kontrollproben 1 % Isopropylalk. 200 100 50 20 2 n m 1 6,40 42 3 3 3 3 3 3 8,74 8,90 4,15 8,64 8,80 8,88 8,87 UGK 8,71 8,73 3,88 8,37 8,68 8,67 8,73 OGK 8,82 9,06 4,41 8,92 8,91 9,08 9,00 bakteriostatisch bakterizid - - + - + - m: Mittelwert n: Probenanzahl OGK: obere Grenze des 95 % Konfidenzintervall UGK: untere Grenze des 95 % Konfidenzintervall Brochothrix thermosphacta mit Carvacrol Das Wachstum von B. thermosphacta wurde durch 200 ppm und 100 ppm Carvacrol deutlich gehemmt, wie Abbildung 7 zeigt. In der Kontrollprobe erzielte das Bakterium einen mittleren Wert von 167. In Anwesenheit von 200 ppm und 100 ppm Carvacrol wies B. thermosphacta am Ende der Inkubationszeit eine optische Dichte von 1 bzw. 15 auf. 68 4 Ergebnisse 200 OD 150 100 50 0 -50 0 6 7 8 9 Zeit in Stunden 10 11 12 Kontrolle 1 % Isopropylalk. 200 ppm Carvacrol 100 ppm Carvacrol 50 ppm Carvacrol 20 ppm Carvacrol 2 ppm Carvacrol Abbildung 7: Entwicklung der optischen Dichte bei 490 nm von B. thermosphacta – Kulturen in Nutrient broth Nr. 2 mit unterschiedlichen Konzentrationen [ppm] an Carvacrol über eine Inkubationsdauer von 12 h bei 25 °C (OD = optische Dichte) Während der 12-stündigen Bebrütungszeit sank die Keimzahl von B. thermosphacta von 7,00 lg KbE/ml in der inokulierten Keimsuspension auf eine Keimzahl von 5,29 lg KbE/ml bei 500 ppm bzw. 6,2 lg KbE/ml bei 100 ppm Carvacrol. 50 ppm Carvacrol oder weniger beeinflussten das Wachstum von B. thermosphacta nicht (Tabelle 29). Tabelle 29: Probenanzahl, Mittelwert, inokulierte Keimmenge, obere und untere Grenze des 95 % Konfidenzintervalls der Keimzahlen [lg KbE/ml] von B. thermosphacta aus den Proben mit 1 % Isopropylalkohol und Carvacrol in unterschiedlichen Konzentrationen vor und nach der Bebrütung bei 25 °C über einen Zeitraum von 12 Stunden Konzentration Carvacrol in ppm Inokulierte Keimmenge Kontrollproben 1 % Isopropylalk. 200 100 50 20 2 n m UGK OGK 1 7,00 - - 48 3 3 3 3 3 3 7,81 7,97 5,29 6,20 7,87 7,92 8,10 7,75 7,55 4,65 5,94 7,60 7,74 8,01 7,87 8,38 5,94 6,47 8,15 8,10 8,20 bakteriostatisch bakterizid - - + + - + + - m: Mittelwert n: Probenanzahl OGK: obere Grenze des 95 % Konfidenzintervall UGK: untere Grenze des 95 % Konfidenzintervall 69 4 Ergebnisse Pseudomonas fragi mit Carvacrol Aus Abbildung 8 wird ersichtlich, dass Carvacrol lediglich in der höchsten geprüften Konzentration das Wachstum von Ps. fragi deutlich beeinflusste. Im Vergleich zur Kontrollprobe mit Werten um 199 wiesen die Proben mit 200 ppm nach 12 Stunden nur eine optische Dichte von 25 auf. 250 200 OD 150 100 50 0 -50 0 6 7 8 9 Zeit in Stunden 10 11 12 Kontrolle 1 % Isopropylalk. 200 ppm Carvacrol 100 ppm Carvacrol 50 ppm Carvacrol 20 ppm Carvacrol 2 ppm Carvacrol Abbildung 8: Entwicklung der optischen Dichte bei 490 nm von B. thermosphacta – Kulturen in Nutrient broth Nr. 2 mit unterschiedlichen Konzentrationen [ppm] an Carvacrol über eine Inkubationsdauer von 12 h bei 25 °C (OD = optische Dichte) Bei der abschließenden Ermittlung der Keimzahl ließ sich nur in der höchsten geprüften Carvacrol-Konzentration eine signifikante Wachstumshemmung gegenüber Ps. fragi nachweisen. Ein bakterizider Effekt war in keiner Konzentration feststellbar (Tabelle 30). 70 4 Ergebnisse Tabelle 30: Probenanzahl, Mittelwert, inokulierte Keimmenge, obere und untere Grenze des 95 % Konfidenzintervalls der Keimzahlen [lg KbE/ml] von Ps. fragi aus den Proben mit 1 % Isopropylalkohol und Carvacrol in unterschiedlichen Konzentrationen vor und nach der Bebrütung bei 25 °C über einen Zeitraum von 12 Stunden Konzentration Carvacrol in ppm Inokulierte Keimmenge Kontrollproben 1 % Isopropylalk. 200 100 50 20 2 n m UGK OGK 1 6,40 - - 42 3 3 3 3 3 3 7,85 7,88 6,83 7,77 7,91 8,27 8,03 7,82 7,64 6,24 7,53 7,76 7,05 7,77 7,88 8,12 7,43 8,01 8,05 9,48 8,29 bakteriostatisch bakterizid - - + - - m: Mittelwert n: Probenanzahl OGK: obere Grenze des 95 % Konfidenzintervall UGK: untere Grenze des 95 % Konfidenzintervall 4.2.3 Linalool Aeromonas hydrophila mit Linalool Linalool hemmte das Wachstum von A. hydrophila in Konzentrationen von 1200 ppm bis 180 ppm, wie Abbildung 9 zeigt. Die Kontrollprobe wies nach 7 Stunden eine optische Dichte von 512 auf. Proben mit 1200 ppm oder 720 ppm Linalool erreichten einen Wert von 1. Die optische Dichte der Proben mit 360 ppm und 180 ppm betrug am Ende der Bebrütungszeit 60 bzw. 285. 71 OD 4 Ergebnisse 600 500 400 300 200 100 0 -100 0 1 2 3 4 5 6 7 Zeit in Stunden Kontrolle 0,5 % Tween80 1200 ppm Linalool 720 ppm Linalool 360 ppm Linalool 180 ppm Linalool 3,6 ppm Linalool Abbildung 9: Entwicklung der optischen Dichte bei 490 nm von A. hydrophila – Kulturen in Nutrient broth Nr. 2 mit unterschiedlichen Konzentrationen [ppm] an Linalool über eine Inkubationsdauer von 7 h bei 30 °C (OD = optische Dichte) Linalool zeigte auch bei Bestimmung der Keimzahl nach der Inkubationszeit in den Konzentrationen 1200 ppm bis einschließlich 180 ppm eine antibakterielle Wirkung gegenüber A. hydrophila. Da die ursprünglich inokulierte Keimmenge, wie in Tabelle 31 dargestellt, 6,32 lg KbE/ml aufwies, konnte den Linalool-Konzentrationen 1200 ppm und 720 ppm ein bakterizider Effekt nachgewiesen werden. Tabelle 31: Probenanzahl, Mittelwert, inokulierte Keimmenge, obere und untere Grenze des 95 % Konfidenzintervalls der Keimzahlen [lg KbE/ml] von A. hydrophila aus den Proben mit 0,5 % Tween80 und Linalool in unterschiedlichen Konzentrationen vor und nach der Bebrütung bei 30 °C über einen Zeitraum von 7 Stunden Konzentration Linalool in ppm Inokulierte Keimmenge Kontrollproben 0,5 % Tween80 1200 720 360 180 3,6 n m UGK OGK 1 6,32 - - 51 3 3 3 3 3 3 8,79 8,68 3,23 5,79 7,42 7,97 8,79 8,76 8,65 3,04 5,73 7,40 7,90 8,58 8,82 8,70 3,54 5,84 7,44 8,04 8,10 bakteriostatisch bakterizid - - + + + + - + + - m: Mittelwert n: Probenanzahl OGK: obere Grenze des 95 % Konfidenzintervall UGK: untere Grenze des 95 % Konfidenzintervall 72 4 Ergebnisse Escherichia coli mit Linalool Nach 7 Stunden wiesen die Kontrollproben eine optische Dichte von 252 auf. Ähnliche Werte wurden auch von den geprüften Linalool-Konzentrationen ≤ 720 ppm erreicht. In einer Konzentration von 1200 ppm hingegen lag die optische Dichte nach OD 7 Stunden nur bei 58 (Abbildung 10). 300 250 200 150 100 50 0 -50 0 1 2 3 4 Zeit in Stunden 5 6 7 Kontrolle 0,5 % Tween80 1200 ppm Linalool 720 ppm Linalool 360 ppm Linalool 180 ppm Linalool 3,6 ppm Linalool Abbildung 10: Entwicklung der optischen Dichte bei 490 nm von A. hydrophila – Kulturen in Nutrient broth Nr. 2 mit unterschiedlichen Konzentrationen [ppm] an Linalool über eine Inkubationsdauer von 7 h bei 30 °C (OD = optische Dichte) Das 95 % Konfidenzintervall der abschließend ermittelten Keimzahlen lag lediglich bei 1200 ppm Linalool unter dem der Kontrollprobe (siehe Tabelle 32). Damit konnte Linalool nur in der höchsten geprüften Konzentration eine antibakterielle Wirksamkeit gegenüber E. coli nachgewiesen werden. Eine bakterizide Wirksamkeit wurde nicht festgestellt. 73 4 Ergebnisse Tabelle 32: Probenanzahl, Mittelwert, inokulierte Keimmenge, obere und untere Grenze des 95 % Konfidenzintervalls der Keimzahlen [lg KbE/ml] von E. coli aus den Proben mit 0,5 % Tween80 und Linalool in unterschiedlichen Konzentrationen vor und nach der Bebrütung bei 30 °C über einen Zei traum von 7 Stunden Konzentration Linalool in ppm Inokulierte Keimmenge Kontrollproben 0,5 % Tween80 1200 720 360 180 3,6 n m UGK OGK 1 6,32 - - 42 3 3 3 3 3 3 8,74 8,72 7,83 8,77 8,70 8,80 8,77 8,71 8,59 7,74 8,70 8,53 8,73 8,70 bakteriostatisch bakterizid 8,82 8,84 7,92 8,83 8,86 8,87 8,83 - - + - - m: Mittelwert n: Probenanzahl OGK: obere Grenze des 95 % Konfidenzintervall UGK: untere Grenze des 95 % Konfidenzintervall Brochothrix thermosphacta mit Linalool Wie Abbildung 11 zeigt, hemmte Linalool das Wachstum von B. thermosphacta nur in einer Menge von 1200 ppm. In dieser Konzentration erreichten die Proben nach 12 Stunden eine optische Dichte von 16. Die Kontrollproben wiesen im Vergleich mit OD 140 eine weit höhere optische Dichte auf. 180 160 140 120 100 80 60 40 20 0 -20 0 6 7 8 9 Zeit in Stunden 10 11 12 Kontrolle 0,5 % Tween80 1200 ppm Linalool 720 ppm Linalool 360 ppm Linalool 3,6 ppm Linalool Abbildung 11: Entwicklung der optischen Dichte bei 490 nm von B. thermosphacta – Kulturen in Nutrient broth Nr. 2 mit unterschiedlichen Konzentrationen [ppm] an Linalool über eine Inkubationsdauer von 12 h bei 25 °C (OD = optische Dichte) 74 4 Ergebnisse Wie in Tabelle 33 dargestellt, belegte auch die mikrobiologische Untersuchung die antibakterielle Wirkung 1200 ppm Linalool gegenüber B. thermosphacta. Da die Keimsuspension ursprünglich noch 7,2 lg KbE/ml enthielt, konnte Linalool in einer Konzentration von 1200 ppm auch eine bakterizide Wirkung nachgewiesen werden. Tabelle 33: Probenanzahl, Mittelwert, inokulierte Keimmenge, obere und untere Grenze des 95 % Konfidenzintervalls der Keimzahlen [lg KbE/ml] von B. thermosphacta aus den Proben mit 0,5 % Tween80 und Linalool in unterschiedlichen Konzentrationen vor und nach der Bebrütung bei 25 °C über einen Zeitraum von 12 Stunden Konzentration Linalool in ppm Inokulierte Keimmenge Kontrollproben 0,5 % Tween80 1200 720 360 3,6 n m 1 7,20 48 3 3 3 3 3 7,81 7,90 6,11 7,49 7,42 7,77 UGK 7,75 7,81 6,10 7,08 6,90 7,72 OGK 7,87 8,00 6,13 7,89 7,94 7,83 bakteriostatisch bakterizid - - + - + - m: Mittelwert n: Probenanzahl OGK: obere Grenze des 95 % Konfidenzintervall UGK: untere Grenze des 95 % Konfidenzintervall Pseudomonas fragi mit Linalool Ps. fragi erreichte in der Kontrollprobe nach 12 Stunden Inkubation eine optische Dichte von 193. Von den geprüften Linalool-Konzentrationen wirkte sich nur die Konzentration 1600 ppm deutlich sichtbar hemmend auf das Bakterienwachstum aus. Die Proben mit dieser Menge an Linalool wiesen am Ende der Inkubationszeit eine optische Dichte von 67 auf, wie aus Abbildung 12 ersichtlich. 75 4 Ergebnisse 250 200 OD 150 100 50 0 -50 0 6 7 Kontrolle 1200 ppm Linalool 3,6 ppm Linalool Abbildung 12: 8 9 Zeit in Stunden 10 0,5 % Tween80 720 ppm Linalool 11 12 1600 ppm Linalool 360 ppm Linalool Entwicklung der optischen Dichte bei 490 nm von B. thermosphacta – Kulturen in Nutrient broth Nr. 2 mit unterschiedlichen Konzentrationen [ppm] an Linalool über eine Inkubationsdauer von 12 h bei 25 °C (OD = optische Dichte) Die Ermittlung der erreichten Keimzahl ergab bei 1600 ppm Linalool eine signifikant geringere Keimzahl als in der Kontrollprobe. Damit konnte Linalool in diesen Konzentrationen eine antibakterielle Wirksamkeit gegenüber Ps. fragi nachgewiesen werden. Bakterizide Effekte konnten nicht beobachtet werden (Tabelle 34). Tabelle 34: Probenanzahl, Mittelwert, inokulierte Keimmenge, obere und untere Grenze des 95 % Konfidenzintervalls der Keimzahlen [lg KbE/ml] von Ps. fragi aus den Proben mit 0,5 % Tween80 und Linalool in unterschiedlichen Konzentrationen vor und nach der Bebrütung bei 25 °C über einen Zeitraum von 12 Stunden Konzentration Linalool in ppm Inokulierte Keimmenge Kontrollproben 0,5 % Tween80 1600 1200 720 360 3,6 n m UGK OGK 1 6,94 - - 42 3 3 3 3 3 3 7,85 7,86 7,31 7,71 7,78 7,75 7,99 7,82 7,75 6,54 7,61 7,57 7,67 7,87 7,88 7,97 8,08 7,82 7,99 7,83 8,11 bakteriostatisch bakterizid - - + - - m: Mittelwert n: Probenanzahl OGK: obere Grenze des 95 % Konfidenzintervall UGK: untere Grenze des 95 % Konfidenzintervall 76 4 Ergebnisse 4.2.4 1,8-Cineol Aeromonas hydrophila mit 1,8-Cineol Wie Abbildung 13 zeigt, entfaltete 1,8-Cineol in den Konzentrationen 2000 ppm, 1600 ppm und 1400 ppm eine hemmende Wirkung auf das Wachstum von A. hydrophila. Während die Kontrollprobe nach 7 Stunden eine optische Dichte von 488 aufwies, betrug die optische Dichte bei 2000 ppm und 1600 ppm 1,8-Cineol nur OD 17. Bei 1400 ppm lag der Wert bei 25. 600 500 400 300 200 100 0 -100 0 1 2 3 4 Zeit in Stunden 5 6 7 Kontrolle 0,5 % Tween80 2000 ppm Cineol 1600 ppm Cineol 1400 ppm Cineol 600 ppm Cineol 360 ppm Cineol 3,6 ppm Cineol Abbildung 13: Entwicklung der optischen Dichte bei 490 nm von A. hydrophila – Kulturen in Nutrient broth Nr. 2 mit unterschiedlichen Konzentrationen [ppm] an 1,8-Cineol über eine Inkubationsdauer von 7 h bei 30 °C (OD = optische Dichte) Die nach 7-stündiger Bebrütung ermittelte Keimzahl war bei 2000 ppm, 1600 ppm und 1400 ppm signifikant geringer als die der Kontrollprobe (Tabelle 35). Folglich entfaltete 1,8-Cineol in diesen Konzentrationen eine antibakterielle Wirkung gegenüber A. hydrophila. Die in der höchsten geprüften Konzentration erreichten Keimzahlen ließen zudem einen bakteriziden Effekt vermuten (Ausgangskeimzahl 6,9 lg KbE/ml). 77 4 Ergebnisse Tabelle 35: Probenanzahl, Mittelwert, inokulierte Keimmenge, obere und untere Grenze des 95 % Konfidenzintervalls der Keimzahlen [lg KbE/ml] von A. hydrophila aus den Proben mit 0,5 % Tween80 und 1,8-Cineol in unterschiedlichen Konzentrationen vor und nach der Bebrütung bei 30 °C über einen Zeitraum von 7 Stunden Konzentration 1,8-Cineol in ppm Inokulierte Keimmenge Kontrollproben 0,5 % Tween80 2000 1600 1400 600 360 3,6 n m UGK OGK 1 6,90 - - 51 3 3 3 3 3 3 3 8,79 8,85 6,32 6,96 7,95 8,79 8,82 8,73 8,76 8,77 6,13 6,61 7,78 8,66 8,80 8,65 8,82 8,92 6,51 7,31 8,12 8,91 8,84 8,81 bakteriostatisch bakterizid + + + - + - m: Mittelwert n: Probenanzahl OGK: obere Grenze des 95 % Konfidenzintervall UGK: untere Grenze des 95 % Konfidenzintervall Escherichia coli mit 1,8-Cineol In den Kontrollproben erreichte die optische Dichte am Ende der Inkubationszeit einen mittleren Wert von 249. Von den geprüften Konzentrationen entfaltete nur 2800 ppm eine hemmende Wirkung auf E. coli. Bei 2800 ppm 1,8-Cineol lag die optische Dichte der Proben bei 124 (Abbildung 14). 78 OD 4 Ergebnisse 300 250 200 150 100 50 0 -50 0 1 2 Kontrolle 2000 ppm Cineol 3,6 ppm Cineol Abbildung 14: 3 4 Zeit in Stunden 5 0,5 % Tween80 600 ppm Cineol 6 7 2800 ppm Cineol 360 ppm Cineol Entwicklung der optischen Dichte bei 490 nm von E. coli – Kulturen in Nutrient broth Nr. 2 mit unterschiedlichen Konzentrationen [ppm] an 1,8-Cineol über eine Inkubationsdauer von 7 h bei 30 °C (OD = optische Dichte) Wie Tabelle 36 zeigt, ergab die Ermittlung der in den jeweiligen Stoffkonzentrationen erreichten Keimzahl lediglich bei 2800 ppm 1,8-Cineol eine signifikant niedrigere Keimzahl als in der Kontrollprobe. Eine bakterizide Wirkung konnte nicht nachgewiesen werden. Tabelle 36: Probenanzahl, Mittelwert, inokulierte Keimmenge, obere und untere Grenze des 95 % Konfidenzintervalls der Keimzahlen [lg KbE/ml] von E. coli aus den Proben mit 0,5 % Tween80 und 1,8-Cineol in unterschiedlichen Konzentrationen vor und nach der Bebrütung bei 30 °C über einen Zeitraum von 7 Stunden Konzentration 1,8-Cineol in ppm Inokulierte Keimmenge Kontrollproben 0,5 % Tween80 2800 2000 600 360 3,6 n m UGK OGK 1 6,78 - - 42 3 3 3 3 3 3 8,74 8,74 8,09 8,44 8,68 8,69 8,77 8,71 8,61 8,04 7,97 8,48 8,50 8,56 8,82 8,87 8,14 8,92 8,87 8,89 8,98 bakteriostatisch bakterizid - - + - - m: Mittelwert n: Probenanzahl OGK: obere Grenze des 95 % Konfidenzintervall UGK: untere Grenze des 95 % Konfidenzintervall 79 4 Ergebnisse Brochothrix thermosphacta mit 1,8-Cineol B. thermosphacta wurde durch 2800 ppm und 2000 ppm 1,8-Cineol in seinem Wachstum beeinflusst. Nach der Inkubationszeit lag die optische Dichte der Proben mit 2800 ppm und 2000 ppm 1,8-Cineol mit Werten von 19 bzw. 76 deutlich unter dem von der Kontrollprobe erreichten Wert von 177 (Abbildung 15). 200 OD 150 100 50 0 -50 0 6 7 8 9 Zeit in Stunden 10 11 12 Kontrolle 0,5 % Tween80 2800 ppm Cineol 2000 ppm Cineol 1800 ppm Cineol 1600 ppm Cineol 360 ppm Cineol 3,6 ppm Cineol Abbildung 15: Entwicklung der optischen Dichte bei 490 nm von B. thermosphacta – Kulturen in Nutrient broth Nr. 2 mit unterschiedlichen Konzentrationen [ppm] an 1,8-Cineol über eine Inkubationsdauer von 12 h bei 25 °C (OD = optische Dichte) 1,8-Cineol zeigte auch im Rahmen der abschließenden Bestimmung der Keimzahl in Konzentrationen von 2800 ppm und 2000 ppm eine antibakterielle Wirkung gegenüber B. thermosphacta. Der Ausgangskeimgehalt betrug 6,81 lg KbE/ml, nach 12 Stunden bei 2800 ppm 1,8-Cineol waren jedoch nur noch 6,24 lg KbE/ml nachweisbar. Daher wurde diese Konzentration als bakterizid wirksam eingestuft (Tabelle 37). 80 4 Ergebnisse Tabelle 37: Probenanzahl, Mittelwert, inokulierte Keimmenge, obere und untere Grenze des 95 % Konfidenzintervalls der Keimzahlen [lg KbE/ml] von B. thermosphacta aus den Proben mit 0,5 % Tween80 und 1,8-Cineol in unterschiedlichen Konzentrationen vor und nach der Bebrütung bei 25 °C über einen Zeitraum von 12 Stunden Konzentration 1,8-Cineol in ppm Inokulierte Keimmenge Kontrollproben 0,5 % Tween80 2800 2000 1800 1600 360 3,6 n m UGK OGK 1 6,81 - - 48 3 3 3 3 3 3 3 7,81 8,01 6,24 7,32 7,77 7,86 8,02 8,06 7,75 7,94 6,10 7,22 7,66 7,76 7,80 7,82 7,87 8,08 6,37 7,42 7,88 7,96 8,23 8,30 bakteriostatisch bakterizid - - + + - + - m: Mittelwert n: Probenanzahl OGK: obere Grenze des 95 % Konfidenzintervall UGK: untere Grenze des 95 % Konfidenzintervall Pseudomonas fragi mit 1,8-Cineol Wie Abbildung 16 zeigt, blieb die optische Dichte bei 2800 ppm 1,8-Cineol deutlich hinter der der Kontrollprobe zurück. Die in der Kontrollprobe erreichte optische Dichte betrug 215, bei 2800 ppm 1,8-Cineol nur 94. Daher wurden 2800 ppm 1,8-Cineol als hemmend eingestuft. 81 4 Ergebnisse 250 200 OD 150 100 50 0 -50 0 6 7 8 9 10 11 12 Zeit in Stunden Kontrolle 0,5 % Tween80 2800 ppm Cineol 2000 ppm Cineol 600 ppm Cineol 360 ppm Cineol 3,6 ppm Cineol Abbildung 16: Entwicklung der optischen Dichte bei 490 nm von Ps. fragi – Kulturen in Nutrient broth Nr. 2 mit unterschiedlichen Konzentrationen [ppm] an 1,8-Cineol über eine Inkubationsdauer von 12 h bei 25 °C (OD = optische Dichte) Auch die Untersuchung der Proben auf ihre Keimzahl ergab eine antibakterielle Wirksamkeit von 2800 ppm 1,8-Cineol. Wie aus Tabelle 38 ersichtlich, war 1,8-Cineol in allen weiteren Konzentrationen unwirksam gegen Ps. fragi. Tabelle 38: Probenanzahl, Mittelwert, inokulierte Keimmenge, obere und untere Grenze des 95 % Konfidenzintervalls der Keimzahlen [lg KbE/ml] von Ps. fragi aus den Proben mit 0,5 % Tween80 und 1,8-Cineol in unterschiedlichen Konzentrationen vor und nach der Bebrütung bei 25 °C über einen Zeitraum von 12 Stunden Konzentration 1,8-Cineol in ppm Inokulierte Keimmenge Kontrollproben 0,5 % Tween80 2800 2000 600 360 3,6 n m UGK OGK 1 7,00 - - 42 3 3 3 3 3 3 7,85 8,21 7,71 7,81 7,90 7,96 7,83 7,82 6,73 7,69 7,78 7,83 7,88 7,78 7,88 9,69 7,74 7,84 7,97 8,05 7,89 bakteriostatisch bakterizid - - + - - m: Mittelwert n: Probenanzahl OGK: obere Grenze des 95 % Konfidenzintervall UGK: untere Grenze des 95 % Konfidenzintervall 82 4 Ergebnisse 4.2.5 α-Pinen Aeromonas hydrophila mit α-Pinen Das Wachstum von A. hydrophila wurde durch α-Pinen in den Konzentrationen 1200 ppm, 800 ppm und 600 ppm beeinflusst, wie Abbildung 17 zeigt. Die Kontrollprobe erreichte einen Wert von 471, bei 1200 ppm α-Pinen lag die optische Dichte nach 7 Stunden lediglich bei 206. Die optische Dichte bei 800 ppm α-Pinen bzw. 600 ppm α-Pinen lag bei 317 bzw. 333. 500 400 OD 300 200 100 0 -100 0 1 2 3 4 Zeit in Stunden 5 6 7 Kontrolle 0,5 % Tween80 1200 ppm Pinen 800 ppm Pinen 600 ppm Pinen 400 ppm Pinen 340 ppm Pinen 3,4 ppm Pinen Abbildung 17: Entwicklung der optischen Dichte bei 490 nm von A. hydrophila – Kulturen in Nutrient broth Nr. 2 mit unterschiedlichen Konzentrationen [ppm] an α-Pinen über eine Inkubationsdauer von 7 h bei 30 °C (OD = optische Dichte) Die Untersuchung der nach 7 Stunden erreichten Keimzahl ergab in den Konzentrationen 1200 ppm, 800 ppm und 600 ppm α-Pinen signifikant niedrigere Werte als in der Kontrollprobe ohne Zusatz von α-Pinen (Tabelle 39). Eine bakterizide Wirkung wurde nicht beobachtet. 83 4 Ergebnisse Tabelle 39: Probenanzahl, Mittelwert, inokulierte Keimmenge, obere und untere Grenze des 95 % Konfidenzintervalls der Keimzahlen [lg KbE/ml] von A. hydrophila aus den Proben mit 0,5 % Tween80 und α-Pinen in unterschiedlichen Konzentrationen vor und nach der Bebrütung bei 30 °C über einen Zeitraum von 7 Stunden Konzentration α-Pinen in ppm Inokulierte Keimmenge Kontrollproben 0,5 % Tween80 1200 800 600 400 340 3,4 n m UGK OGK 1 6,86 - - 51 3 3 3 3 3 3 3 8,79 8,90 8,44 8,43 8,32 8,79 8,86 8,78 8,76 8,75 8,26 8,40 8,04 8,37 8,77 8,53 8,82 9,04 8,62 8,46 8,59 9,21 8,96 9,03 bakteriostatisch bakterizid - - + + + - - m: Mittelwert n: Probenanzahl OGK: obere Grenze des 95 % Konfidenzintervall UGK: untere Grenze des 95 % Konfidenzintervall Escherichia coli mit α-Pinen Aus Abbildung 18 wird ersichtlich, dass α-Pinen in keiner der geprüften Konzentrationen das Wachstum von E. coli beeinflusste. Die optische Dichte der Proben ohne Zusatz von α-Pinen sowie der geprüften Konzentrationen betrug nach 7 Stunden 267 ± 20. 84 4 Ergebnisse 300 250 OD 200 150 100 50 0 -50 0 1 2 3 4 5 6 7 Zeit in Stunden Kontrolle 0,5 % Tween80 1200 ppm Pinen 800 ppm Pinen 340 ppm Pinen 3,4 ppm Pinen Abbildung 18: Entwicklung der optischen Dichte bei 490 nm von E. Coli – Kulturen in Nutrient broth Nr. 2 mit unterschiedlichen Konzentrationen [ppm] an α-Pinen über eine Inkubationsdauer von 7 h bei 30 °C (OD = optische Dichte) Wie aus Tabelle 40 ersichtlich, ergaben auch die ermittelten Keimzahlen keinen signifikanten Unterschied zwischen den getesteten α-Pinen-Konzentrationen und der Kontrollprobe. Somit übte α-Pinen keine antibakterielle Wirkung gegenüber E. coli aus. Tabelle 40: Probenanzahl, Mittelwert, inokulierte Keimmenge, obere und untere Grenze des 95% Konfidenzintervalls der Keimzahlen [lg KbE/ml] von E. coli aus den Proben mit 0,5 % Tween80 und α-Pinen in unterschiedlichen Konzentrationen vor und nach der Bebrütung bei 30 °C über einen Zei traum von 7 Stunden Konzentration α-Pinen in ppm Inokulierte Keimmenge Kontrollproben 0,5 % Tween80 1200 800 340 3,4 n m UGK OGK 1 6,00 - - 42 3 3 3 3 3 8,74 8,75 8,64 8,81 8,75 8,80 8,71 8,71 8,28 8,55 8,67 8,59 8,82 8,79 9,01 9,07 8,83 9,00 bakteriostatisch bakterizid - - - - m: Mittelwert n: Probenanzahl OGK: obere Grenze des 95 % Konfidenzintervall UGK: untere Grenze des 95 % Konfidenzintervall 85 4 Ergebnisse Brochothrix thermosphacta mit α-Pinen Das Wachstum von B. thermosphacta wurde von α-Pinen in Konzentrationen von ≥ 400 ppm gehemmt. Die optische Dichte erreichte bei 1200 ppm bzw. 800 ppm α-Pinen nach 12 Stunden Werte von 19 bzw. 16, bei 600 ppm und 400 ppm α-Pinen einen Wert von 2. Ohne Zusatz von α-Pinen lag die optische Dichte von B. thermosphacta nach 12 Stunden bei 130 (Abbildung 19). 150 OD 100 50 0 -50 0 6 7 8 9 10 11 12 Zeit in Stunden Kontrolle 0,5 % Tween80 1200 ppm Pinen 800 ppm Pinen 600 ppm Pinen 400 ppm Pinen 340 ppm Pinen 3,4 ppm Pinen Abbildung 19: Entwicklung der optischen Dichte bei 490 nm von B. thermosphacta – Kulturen in Nutrient broth Nr. 2 mit unterschiedlichen Konzentrationen [ppm] an α-Pinen über eine Inkubationsdauer von 12 h bei 25 °C (OD = optische Dichte) Die Keimzahlen der α-Pinen-Konzentrationen 1200 ppm, 800 ppm, 600 ppm und 400 ppm waren signifikant niedriger als die der Kontrolle. Zudem konnte α-Pinen, wie in Tabelle 41 dargestellt, in diesen Konzentrationen eine bakterizide Wirkung gegenüber B. thermosphacta nachgewiesen werden (inokulierte Keimmenge 7,0 lg KbE/ml). 86 4 Ergebnisse Tabelle 41: Probenanzahl, Mittelwert, inokulierte Keimmenge, obere und untere Grenze des 95% Konfidenzintervalls der Keimzahlen [lg KbE/ml] von B. thermosphacta aus den Proben mit 0,5 % Tween80 und α-Pinen in unterschiedlichen Konzentrationen vor und nach der Bebrütung bei 25 °C über einen Zeitraum von 12 Stunden Konzentration α-Pinen in ppm Inokulierte Keimmenge Kontrollproben 0,5 % Tween80 1200 800 600 400 340 3,4 n m UGK OGK 1 7,00 - - 48 3 3 3 3 3 3 3 7,81 7,89 4,82 5,31 5,04 5,78 7,76 7,89 7,75 7,66 4,72 4,60 4,94 5,43 7,50 7,74 bakteriostatisch bakterizid 7,87 8,13 4,92 6,02 5,14 6,14 8,02 8,04 + + + + - + + + + - m: Mittelwert n: Probenanzahl OGK: obere Grenze des 95 % Konfidenzintervall UGK: untere Grenze des 95 % Konfidenzintervall Pseudomonas fragi mit α-Pinen Ps. fragi wurde von α-Pinen in keiner der geprüften Konzentrationen beeinflusst, wie Abbildung 20 zeigt. Sowohl ohne als auch mit Zusatz von α-Pinen erreichte Ps. fragi nach 12 Stunden eine optische Dichte von 166 ± 20. 200 OD 150 100 50 0 -50 0 6 7 8 9 10 11 12 Zeit in Stunden Kontrolle 0,5 % Tween80 1200 ppm Pinen 800 ppm Pinen 340 ppm Pinen 3,4 ppm Pinen Abbildung 20: Entwicklung der optischen Dichte bei 490 nm von Ps. fragi – Kulturen in Nutrient broth Nr. 2 mit unterschiedlichen Konzentrationen [ppm] an α-Pinen über eine Inkubationsdauer von 12 h bei 25 °C (OD = optische Dichte) 87 4 Ergebnisse Die nach Ende der Inkubationszeit ermittelten Keimzahlen ergaben ebenfalls keinen signifikanten Unterschied zwischen Proben ohne Zusatz von α-Pinen und Proben mit den geprüften Konzentrationen von α-Pinen (Tabelle 42). Somit konnte eine antibakterielle Wirksamkeit von α-Pinen gegenüber Ps. fragi nicht festgestellt werden. Tabelle 42: Probenanzahl, Mittelwert, inokulierte Keimmenge, obere und untere Grenze des 95 % Konfidenzintervalls der Keimzahlen [lg KbE/ml] von Ps. fragi aus den Proben mit 0,5 % Tween80 und α-Pinen in unterschiedlichen Konzentrationen vor und nach der Bebrütung bei 25 °C über einen Zeitraum von 12 Stunden Konzentration α-Pinen in ppm Inokulierte Keimmenge Kontrollproben 0,5 % Tween80 1200 800 340 3,4 n m UGK OGK 1 7,04 - - 42 3 3 3 3 3 7,85 7,74 7,85 7,77 8,14 7,76 7,82 7,57 7,76 7,44 6,56 7,65 7,88 7,91 7,94 8,10 9,72 7,87 bakteriostatisch bakterizid - - - - m: Mittelwert n: Probenanzahl OGK: obere Grenze des 95 % Konfidenzintervall UGK: untere Grenze des 95 % Konfidenzintervall 4.2.6 α-Terpineol Aeromonas hydrophila mit α-Terpineol Abbildung 21 zeigt den Einfluss unterschiedlicher Konzentrationen von α-Terpineol auf A. hydrophila. Während das Bakterium ohne Zusatz von α-Terpineol eine optische Dichte von 450 erreichte, stieg die optische Dichte bei 800 ppm bzw. 600 ppm α-Terpineol nur auf 11 bzw. 43. Auch in einer Konzentration von 400 ppm bewirkte α-Terpineol noch eine Wachstumshemmung bei A. hydrophila, welches bei dieser Konzentration nach 7 Stunden lediglich eine optische Dichte von 190 aufwies. 88 4 Ergebnisse 500 400 OD 300 200 100 0 -100 0 1 2 3 4 Zeit in Stunden Kontrolle 800 ppm Terpineol 400 ppm Terpineol 0,0008 ppm Terpineol Abbildung 21: 5 6 7 0,5 % Tween80 600 ppm Terpineol 0,8 ppm Terpineol Entwicklung der optischen Dichte bei 490 nm von A. hydrophila – Kulturen in Nutrient broth Nr. 2 mit unterschiedlichen Konzentrationen [ppm] an α-Terpineol über eine Inkubationsdauer von 7 h bei 30 °C (OD = optische Dichte) Die Keimzahlen bei 800 ppm, 600 ppm und 400 ppm α-Terpineol waren signifikant geringer, als diejenigen der Kontrollproben. Somit wirkt α-Terpineol ab einer Konzentration von ≥ 400 ppm antibakteriell gegen A. hydrophila (Tabelle 42). Ein bakterizider Effekt wurde nicht beobachtet. Tabelle 43: Probenanzahl, Mittelwert, inokulierte Keimmenge, obere und untere Grenze des 95 % Konfidenzintervalls der Keimzahlen [lg KbE/ml] von A. hydrophila aus den Proben mit 0,5 % Tween80 und α-Terpineol in unterschiedlichen Konzentrationen vor und nach der Bebrütung bei 30 °C über einen Zeitraum von 7 Stunden Konzentration α-Terpineol in ppm Inokulierte Keimmenge Kontrollproben 0,5 % Tween80 800 600 400 0,8 0,0008 n m UGK OGK 1 6,34 - - 51 3 3 3 3 3 3 8,79 8,95 7,81 8,21 8,71 8,94 8,82 8,76 8,82 7,00 7,85 8,58 8,73 8,44 8,82 9,08 8,61 8,57 8,83 9,16 9,19 bakteriostatisch bakterizid - - + + - - m: Mittelwert n: Probenanzahl OGK: obere Grenze des 95 % Konfidenzintervall UGK: untere Grenze des 95 % Konfidenzintervall 89 4 Ergebnisse Escherichia coli mit α-Terpineol α-Terpineol beeinflusste das Wachstum von E. coli in keiner der geprüften Konzentrationen. Auch bei einer Konzentration von 800 ppm α-Terpineol wich die nach 7 Stunden erreichte optische Dichte mit einem Wert von 189 nicht deutlich von dem von der Kontrollprobe erreichten Wert von 189 ab, wie Abbildung 22 zeigt. 300 250 OD 200 150 100 50 0 -50 0 1 2 3 4 Zeit in Stunden Kontrolle 800 ppm Terpineol 0,8 ppm Terpineol Abbildung 22: 5 6 7 0,5 % Tween80 600 ppm Terpineol 0,0008 ppm Terpineol Entwicklung der optischen Dichte bei 490 nm von A. hydrophila – Kulturen in Nutrient broth Nr. 2 mit unterschiedlichen Konzentrationen [ppm] an α-Terpineol über eine Inkubationsdauer von 7 h bei 30 °C (OD = optische Dichte) Wie aus Tabelle 44 ersichtlich unterschieden sich die abschließend bestimmten Keimzahlen der getesteten α-Terpineol-Konzentrationen jeweils nicht signifikant von derjenigen der Kontrollproben. Somit wirkte α-Terpineol in Konzentrationen ≤ 800 ppm nicht antibakteriell gegen E. coli. 90 4 Ergebnisse Tabelle 44: Probenanzahl, Mittelwert, inokulierte Keimmenge, obere und untere Grenze des 95 % Konfidenzintervalls der Keimzahlen [lg KbE/ml] von E. coli aus den Proben mit 0,5 % Tween80 und α-Terpineol in unterschiedlichen Konzentrationen vor und nach der Bebrütung bei 30 °C über einen Zeitraum von 7 Stunden Konzentration α-Terpineol in ppm Inokulierte Keimmenge Kontrollproben 0,5 % Tween80 800 600 0,8 0,0008 n m UGK OGK 1 6,63 - - 42 3 3 3 3 3 8,74 8,76 8,80 8,71 8,74 8,80 8,71 8,72 8,69 8,64 8,41 8,70 bakteriostatisch bakterizid 8,82 8,79 8,92 8,78 9,07 8,91 - - - - m: Mittelwert n: Probenanzahl OGK: obere Grenze des 95 % Konfidenzintervall UGK: untere Grenze des 95 % Konfidenzintervall Brochothrix thermosphacta mit α-Terpineol B. thermosphacta wurde durch keine der geprüften Konzentrationen von α-Terpineol in seinem Wachstum beeinträchtigt. Ohne Zusatz von α-Terpineol wies B. thermosphacta nach 12-stündiger Inkubation eine optische Dichte von 163 auf, bei Zusatz von 800 ppm α-Terpineol eine ähnliche optische Dichte von 129 (Abbildung 23). 200 OD 150 100 50 0 -50 0 6 7 8 9 10 11 12 Zeit in Stunden Kontrolle 800 ppm Terpineol 400 ppm Terpineol 0,0008 ppm Terpineol Abbildung 23: 0,5 % Tween80 600 ppm Terpineol 0,8 ppm Terpineol Entwicklung der optischen Dichte bei 490 nm von B. thermosphacta – Kulturen in Nutrient broth Nr. 2 mit unterschiedlichen Konzentrationen [ppm] an α-Terpineol über eine Inkubationsdauer von 12 h bei 25 °C (OD = optische Dichte) 91 4 Ergebnisse Die nach Ende der Inkubationszeit ermittelten Keimzahlen der getesteten α-Terpineol-Konzentrationen unterschieden sich nicht signifikant von denen der Korntrollprobe. α-Terpineol entfaltete in Mengen von ≤ 800 ppm keine keimhemmende Wirkung auf B. thermosphacta (Tabelle 45). Tabelle 45: Probenanzahl, Mittelwert, inokulierte Keimmenge, obere und untere Grenze des 95 % Konfidenzintervalls der Keimzahlen [lg KbE/ml] von B. thermosphacta aus den Proben mit 0,5 % Tween80 und α-Terpineol in unterschiedlichen Konzentrationen vor und nach der Bebrütung bei 25 °C über einen Zeitraum von 12 Stunden Konzentration α-Terpineol in ppm Inokulierte Keimmenge Kontrollproben 0,5 % Tween80 800 600 400 0,8 0,0008 n m 1 7,04 48 3 3 3 3 3 3 7,81 7,86 7,90 7,82 7,96 7,91 7,89 UGK 7,75 7,61 7,78 7,79 7,65 7,81 7,46 OGK 7,87 8,10 8,02 7,86 8,27 8,00 8,33 bakteriostatisch bakterizid - - - - m: Mittelwert n: Probenanzahl OGK: obere Grenze des 95 % Konfidenzintervall UGK: untere Grenze des 95 % Konfidenzintervall Pseudomonas fragi mit α-Terpineol Die geprüften Konzentrationen von α-Terpineol zeigten keine Wirkung auf das Wachstum von Ps. fragi, wie Abbildung 24 zeigt. Die optische Dichte von Ps. fragi lag ohne Zusatz von α-Terpineol nach 12 Stunden bei 209. Davon wich der erreichte Wert bei 800 ppm α-Terpineol mit 177 nicht deutlich ab. 92 4 Ergebnisse 250 200 OD 150 100 50 0 -50 0 6 7 8 9 Zeit in Stunden Kontrolle 800 ppm Terpineol 0,8 ppm Terpineol Abbildung 24: 10 11 12 0,5 % Tween80 600 ppm Terpineol 0,0008 ppm Terpineol Entwicklung der optischen Dichte bei 490 nm von Ps. fragi – Kulturen in Nutrient broth Nr. 2 mit unterschiedlichen Konzentrationen [ppm] an α-Terpineol über eine Inkubationsdauer von 12 h bei 25 °C (OD = optische Dichte) Nach 12-stündiger Inkubation unterschied sich die Keimzahl von Ps. fragi mit Zusatz von 800 ppm α-Terpineol nicht signifikant von der Keimzahl der Kontrollproben ohne Zusatz, wie Tabelle 46 zeigt. Demnach entfaltete α-Terpineol in Konzentrationen von ≤ 800 ppm keine antibakterielle Wirkung gegenüber Ps. fragi. Tabelle 46: Probenanzahl, Mittelwert, inokulierte Keimmenge, obere und untere Grenze des 95 % Konfidenzintervalls der Keimzahlen [lg KbE/ml] von Ps. fragi aus den Proben mit 0,5 % Tween80 und α-Terpineol in unterschiedlichen Konzentrationen vor und nach der Bebrütung bei 25 °C über einen Zeitraum von 12 Stunden Konzentration α-Terpineol in ppm Inokulierte Keimmenge Kontrollproben 0,5 % Tween80 800 600 0,8 0,0008 n m UGK OGK 1 6,93 - - 42 3 3 3 3 3 7,85 8,03 7,82 7,92 7,88 7,82 7,82 7,70 7,75 7,63 7,74 7,73 7,88 8,35 7,89 8,20 8,02 7,91 bakteriostatisch bakterizid - - - - m: Mittelwert n: Probenanzahl OGK: obere Grenze des 95 % Konfidenzintervall UGK: untere Grenze des 95 % Konfidenzintervall 93 4 Ergebnisse 4.3 Antimikrobielle Wirksamkeit der Stoffkombinationen Die Darstellung der antimikrobiellen Wirksamkeit erfolgt durch die Abbildungen 25 bis 61. In den Abbildungen wird die Differenz zwischen der nach 7 bzw. 12 Stunden erreichten optischen Dichte der geprüften Stoffkombinationen zur optischen Dichte der Kontrollprobe dargestellt, wobei die Differenz als DiffOD bezeichnet wird. Die Kontrollprobe wird in den Abbildungen nicht aufgeführt. Die zur Darstellung der optischen Dichte verwendeten Trübungsmesswerte und zur Berechnung der statistischen Parameter herangezogenen Keimzahlen finden sich im Anhang, Kapitel 10.1.3 und 10.1.4. 4.3.1 Thymol und Carvacrol Aeromonas hydrophila mit Thymol und Carvacrol Die Kontrollprobe ohne Zusätze von Inhaltsstoffen erreichte nach 7 Stunden eine optische Dichte von 489. A. hydrophila erreichte bei Kombinationen von 40 ppm Thymol mit 20 ppm bzw. mit 2 ppm Carvacrol einen Wert von 8 bzw. 15. Bei Kombination von 4 ppm Thymol und 20 ppm Carvacrol und bei 4 ppm Thymol in Kombination mit 2 ppm Carvacrol war keine Hemmung mehr feststellbar. Abbildung 25 zeigt die Differenzen der jeweiligen Stoffkombinationen zur Kontrollprobe. -500 -450 -400 -350 -300 -250 -200 -150 -100 -50 0 DiffOD 4 ppm T + 2 ppm C 4 ppm T + 20 ppm C 40 ppm T + 2 ppm C 40 ppm T + 20 ppm C 100 ppm T + 50 ppm C 1 % Isopropylalk. Abbildung 25: Differenz zwischen OD der Nährlösung mit Stoffkombinationen und OD der Nährlösung ohne Zusatz (Kontrolle) nach 7 Stunden Inkubation bei 30 °C bei A. hydrophila. (OD = optische Dichte, C = Carvacrol, T = Thymol, Gehalt in ppm) 94 4 Ergebnisse Im Vergleich zu den Wirkungen der Einzelstoffe (Kapitel 4.2.1 und 4.2.2) besteht bei den Kombinationen von 100 ppm Thymol mit 50 ppm Carvacrol, 40 ppm Thymol mit 20 ppm Carvacrol und 40 ppm Thymol mit 2 ppm Carvacrol ein synergistischer Effekt zwischen den beteiligten Einzelkomponenten. Wie bei den Ergebnissen der Trübungsmessung war auch bei der mikrobiologischen Untersuchung in der Kombinationen 4 ppm Thymol mit 20 ppm oder 2 ppm Carvacrol keine Hemmung mehr feststellbar (Tabelle 47). Tabelle 47: Probenanzahl, inokulierte Keimmenge, Mittelwert, obere und untere Grenze des 95 % Konfidenzintervalls der Keimzahlen [lg KbE/ml] von A. hydrophila aus den Proben mit 1 % Isopropylalkohol und den Thymol – Carvacrol – Kombinationen in unterschiedlichen Konzentrationen vor und nach der Bebrütung bei 30 °C über einen Zeitraum von 7 Stund en Konzentration Thymol und Carvacrol in ppm Inokulierte Keimmenge Kontrollproben 1 % Isopropylalk. 100 T + 50 C 40 T + 20 C 40 T + 2 C 4 T + 20 C 4T+2C C: Carvacrol m: Mittelwert 95 % Konfidenzintervall n m UGK OGK 1 6,23 - - 51 3 3 3 3 3 3 8,79 8,76 2,00 6,99 6,92 8,63 8,72 8,76 8,63 2,00 6,26 6,80 8,49 8,18 8,82 8,89 2,00 7,72 7,05 8,77 9,25 synergistisch antagonistisch - - + + + - - n: Probenanzahl OGK: obere Grenze des T: Thymol UGK: untere Grenze des 95 % Konfidenzintervall Escherichia coli mit Thymol und Carvacrol E. coli ohne Zusätze in der Nährlösung wies nach 7-stündiger Inkubation eine optische Dichte von 265 auf. Proben mit 100 ppm Thymol in Kombination mit 200 ppm, 100 ppm oder 50 ppm Carvacrol erreichten eine optische Dichte von maximal 4. Bei Kombination von 40 ppm Thymol mit 20 ppm Carvacrol lag die optische Dichte nach 7 Stunden mit einem Wert von 142 noch deutlich unter dem Wert der Kontrollprobe. Somit wurden die genannten Konzentrationen als hemmend eingestuft. Die Kombination von 40 ppm Thymol mit 2 ppm Carvacrol zeigte keinen hemmenden Einfluß auf das Bakterienwachstum. Abbildung 26 zeigt die Differenzen 95 4 Ergebnisse der optischen Dichte zwischen Stoffkombinationen einerseits und Kontrolle andererseits. -300 -250 -200 -150 -100 -50 0 DiffOD 40 ppm T + 2 ppm C 40 ppm T + 20 ppm C 100 ppm T + 50 ppm C 100 ppm T + 100 ppm C 100 ppm T + 200 ppm C 1 % Isopropylalk. Abbildung 26: Differenz zwischen OD der Nährlösung mit Stoffkombinationen und OD der Nährlösung ohne Zusatz (Kontrolle) nach 7 Stunden Inkubation bei 30 °C bei E. coli. (OD = optische Dichte, C = Carvacrol, T = Thymol, Gehalt in ppm) Wie die mikrobiologische Untersuchung zeigte, wiesen Thymol und Carvacrol bzgl. ihrer antibakteriellen Wirksamkeit gegenüber E. coli einen synergistischen Effekt auf. Wie in Tabelle 48 dargestellt, waren bei den Kombinationen von 100 ppm Thymol mit 200 ppm, 100 ppm oder 50 ppm nach 7 Stunden keine lebenden Keime nachweisbar. Die Kombination von 40 ppm Thymol mit 20 ppm Carvacrol wies ebenfalls noch eine signifikant geringere Keimzahl auf als die Kontrollprobe. 96 4 Ergebnisse Tabelle 48: Probenanzahl, inokulierte Keimmenge, Mittelwert, obere und untere Grenze des 95 % Konfidenzintervalls der Keimzahlen [lg KbE/ml] von E. coli aus den Proben mit 1 % Isopropylalkohol und den Thymol – Carvacrol – Kombinationen in unterschiedlichen Konzentrationen vor und nach der Bebrütung bei 30 °C über einen Zeitraum von 7 Stund en Konzentration Thymol und Carvacrol in ppm Inokulierte Keimmenge Kontrollproben 1 % Isopropylalk. 100 T + 200 C 100 T + 100 C 100 T + 50 C 40 T + 20 C 40 T + 2 C C: Carvacrol m: Mittelwert 95 % Konfidenzintervall n m UGK OGK 1 6,23 - - 42 3 3 3 3 3 8,74 8,79 2,00 2,00 2,00 8,16 8,37 8,71 8,64 2,00 2,00 2,00 8,01 7,90 8,82 8,95 2,00 2,00 2,00 8,31 8,85 synergistisch antagonistisch - - + + + + - - n: Probenanzahl OGK: obere Grenze des T: Thymol UGK: untere Grenze des 95 % Konfidenzintervall Brochothrix thermosphacta mit Thymol und Carvacrol B. thermosphacta erreichte in der Kontrollprobe ohne Zusätze eine optische Dichte von 158. Bei der Kombination 100 ppm Thymol mit 100 ppm Carvacrol betrug die optische Dichte nach 12 Stunden lediglich 8, bei Kombination von 100 ppm Thymol mit 50 ppm Carvacrol wurde nur ein Wert von 6 erreicht. Daher wurden diese Kombinationen als keimhemmend eingestuft. Wie Abbildung 27 zeigt, wies die optische Dichte bei Kombination von 40 ppm Thymol mit 20 ppm bzw. 2 ppm Carvacrol eine hohe Differenz zur optischen Dichte der Kontrolle und damit eine antibakterielle Wirkung auf. Die Kombination von 4 ppm Thymol und 20 ppm bzw. 2 ppm Carvacrol ließ mit optischen Dichten von 134 bzw. 164 keine Beeinträchtigung des Keimwachstums erkennen. 97 4 Ergebnisse -200 -150 -100 DiffOD -50 0 50 4 ppm T+ 2 ppm C 4 ppm T + 20 ppm C 40 ppm T + 2 ppm C 40 ppm T + 20 ppm C 100 ppm T + 50 ppm C 100 ppm T + 100 ppm C 1% Isopropylalk. Abbildung 27: Differenz zwischen OD der Nährlösung mit Stoffkombinationen und OD der Nährlösung ohne Zusatz (Kontrolle) nach 12 Stunden Inkubation bei 25 °C bei B. thermosphacta. (OD = optische Dichte, C = Carvacrol, T = Thymol, Gehalt in ppm) Die abschließende Bestimmung der Keimzahl zeigte einen synergistischen Effekt zwischen Thymol und Carvacrol bzgl. ihrer antimikrobiellen Aktivität gegenüber B. thermosphacta. Bei Kombination von 100 ppm Thymol mit 100 ppm Carvacrol waren nach 12-stündiger Inkubation keine Keime mehr nachweisbar. In Übereinstimmung mit der Trübungsmessung war bei Kombination von 4 ppm Thymol mit 20 ppm und 2 ppm Carvacrol keine antimikrobielle Wirksamkeit nachweisbar (Tabelle 49). 98 4 Ergebnisse Tabelle 49: Probenanzahl, inokulierte Keimmenge, Mittelwert, obere und untere Grenze des 95 % Konfidenzintervalls der Keimzahlen [lg KbE/ml] von B. thermosphacta aus den Proben mit 1 % Isopropylalkohol und den Thymol – Carvacrol – Kombinationen in unterschiedlichen Konzentrationen vor und nach der Bebrütung bei 25 °C über einen Zeitraum von 12 Stunden Konzentration Thymol und Carvacrol in ppm Inokulierte Keimmenge Kontrollproben 1 % Isopropylalk. 100 T + 100 C 100 T + 50 C 40 T + 20 C 40 T + 2 C 4 T + 20 C 4T + 2 C n C: Carvacrol m: Mittelwert 95 % Konfidenzintervall m UGK OGK 1 7,00 - - 48 3 3 3 3 3 3 3 7,81 7,70 2,00 2,68 7,12 7,20 7,74 7,78 7,75 7,60 2,00 2,07 6,87 6,94 7,55 7,60 synergistisch antagonistisch 7,87 7,81 2,00 3,28 7,37 7,47 7,93 7,97 - - + + + + - - n: Probenanzahl OGK: obere Grenze des T: Thymol UGK: untere Grenze des 95 % Konfidenzintervall Pseudomonas fragi mit Thymol und Carvacrol Bei Ps. fragi verursachten lediglich die Kombinationen 100 ppm Thymol mit 100 ppm Carvacrol mit einer optischen Dichte von 2 sowie 100 ppm Thymol mit 50 ppm Carvacrol mit einer optischen Dichte von 26 eine deutliche Differenz zur optischen Dichte der Kontrolle ohne Zusätze und damit eine Keimhemmung (Abbildung 28). Bei 40 ppm Thymol kombiniert mit 20 ppm bzw. 2 ppm wachstumshemmender Einfluss auf Ps. fragi erkennbar. 99 Carvacrol war kein 4 Ergebnisse -200 -150 -100 -50 0 DiffOD 40 ppm T + 2 ppm C 40 ppm T + 20 ppm C 100 ppm T + 100 ppm C 1% Isopropylalk. Abbildung 28: 100 ppm T + 50 ppm C Differenz zwischen OD der Nährlösung mit Stoffkombinationen und OD der Nährlösung ohne Zusatz (Kontrolle) nach 12 Stunden Inkubation bei 25 °C bei Ps. fragi (OD = optische Dichte, C = Carvacrol, T = Thymol, Gehalt in ppm) Die Keimzahlen von 100 ppm Thymol mit 100 ppm Carvacrol und 100 Thymol mit 50 ppm Carvacrol waren, wie Tabelle 50 zeigt, signifikant niedriger als die der Kontrollprobe. Ein synergistischer Effekt bzgl. der antimikrobiellen Wirksamkeit konnte nur in der Kombination 100 ppm Thymol mit 100 ppm Carvacrol nachgewiesen werden. Die bei 100 ppm Thymol in Kombination mit 50 ppm Carvacrol erreichte Keimzahl unterschied sich nicht signifikant von der bei 100 ppm Thymol erreichten Keimzahl (siehe Kapitel 4.2.1). Konzentrationen von 20 ppm und 2 ppm Carvacrol zeigten weder allein noch in Kombination mit 40 ppm Thymol eine antibakterielle Wirksamkeit gegenüber Ps. fragi (siehe Kapitel 4.2.2). 100 4 Ergebnisse Tabelle 50: Probenanzahl, inokulierte Keimmenge, Mittelwert, obere und untere Grenze des 95 % Konfidenzintervalls der Keimzahlen [lg KbE/ml] von Ps. fragi aus den Proben mit 1 % Isopropylalkohol und den Thymol – Carvacrol – Kombinationen in unterschiedlichen Konzentrationen vor und nach der Bebrütung bei 25 °C über einen Zeitraum von 12 Stun den Konzentration Thymol und Carvacrol in ppm Inokulierte Keimmenge Kontrollproben 1 % Isopropylalk. 100 T + 100 C 100 T + 50 C 40 T + 20 C 40 T + 2 C C: Carvacrol m: Mittelwert 95 % Konfidenzintervall n m UGK OGK 1 6,83 - - 48 3 3 3 3 3 7,85 7,87 6,69 7,05 7,90 7,85 7,82 7,74 6,47 6,86 7,69 7,75 7,88 8,01 6,91 7,25 8,12 7,95 synergistisch antagonistisch - - + - - n: Probenanzahl OGK: obere Grenze des T: Thymol UGK: untere Grenze des 95 % Konfidenzintervall 4.3.2 Thymol und Linalool Aeromonas hydrophila mit Thymol und Linalool A. hydrophila erreichte in der Kontrollprobe ohne Zusatz von Inhaltsstoffen nach 7 Stunden eine optische Dichte von 454. Alle geprüften Kombination von Thymol und Linalool führten zu einer Hemmung des Bakterienwachstum. Bei Kombination von 40 ppm Thymol und 720 ppm Linalool wurde eine optische Dichte von 12 erreicht, bei Kombination von 40 ppm Thymol mit 360 ppm Linalool lag die optische Dichte bei 44. Unter dem Einfluss von Linalool in den Konzentration 720 ppm und 360 ppm, kombiniert mit jeweils 4 ppm Thymol, erreichte A. hydrophila nach der 7. Stunde eine optische Dichte von 9 bzw. 175 (Abbildung 29) 101 4 Ergebnisse -500 -450 -400 -350 -300 -250 -200 -150 -100 -50 0 DiffOD 4 ppm T + 360 ppm L 40 ppm T + 360 ppm L 0, 5 %Tween80 + 0,4 % Isopropylalk. Abbildung 29: 4 ppm T + 720 ppm L 40 ppm T + 720 ppm L Differenz zwischen OD der Nährlösung mit Stoffkombinationen und OD der Nährlösung ohne Zusatz (Kontrolle) nach 7 Stunden Inkubation bei 30 °C bei A. hydrophila. (OD = optische Dichte, L = Linalool, T = Thymol, Gehalt in ppm) Während die Wirkung aller geprüften Thymol-Linalool-Kombinationen auch aufgrund der bestimmten Keimzahlen als hemmend einzustufen war, konnte eine synergistische Wirkung nur in den Kombinationen 40 ppm Thymol mit 720 ppm Linalool und 4 ppm Thymol mit 720 ppm Linalool nachgewiesen werden. Die Kombination von 40 ppm Thymol und 360 ppm Linalool führte zwar zu einer Wachstumshemmung von A. hydrophila, jedoch war die Stoffkombination der Wirksamkeit von 40 ppm Thymol bzw. 360 ppm Linalool alleine nicht überlegen. Wie aus Tabelle 51 ersichtlich, wirkte die Kombination von 4 ppm Thymol mit 360 ppm Linalool bzgl. der antibakteriellen Aktivität antagonistisch. 102 4 Ergebnisse Tabelle 51: Probenanzahl, inokulierte Keimmenge, Mittelwert, obere und untere Grenze des 95 % Konfidenzintervalls der Keimzahlen [lg KbE/ml] von A. hydrophila aus den Proben mit 0,4 % Isopropylalkohol und 0,5 % Tween80 sowie den Thymol – Linalool – Kombinationen in unterschiedlichen Konzentrationen vor und nach der Bebrütung bei 30 °C über einen Zeitrau m von 7 Stunden Konzentration Thymol und Linalool in ppm Inokulierte Keimmenge Kontrollproben 0,4% Isopropylalk.+ 0,5 % Tween80 40 T + 720 L 40 T + 360 L 4 T + 720 L 4 T + 360 L L: Linalool m: Mittelwert 95 % Konfidenzintervall n m UGK OGK 1 6,04 - - 51 8,79 8,76 3 8,70 3 3 3 3 2,00 7,80 2,03 8,25 synergistisch antagonistisch - - 8,82 - - 8,59 8,81 - - 2,00 7,48 1,92 8,15 2,00 8,12 2,14 8,36 + + - + n: Probenanzahl OGK: obere Grenze des T: Thymol UGK: untere Grenze des 95 % Konfidenzintervall Escherichia coli mit Thymol und Linalool E. coli wies in der Kontrolle, ohne Zusatz von Linalool und Thymol, nach 7 Stunden Inkubation eine optische Dichte von 260 auf. Alle getesteten Kombinationen von Thymol und Carvacrol führten zu einer deutlichen Hemmung des Wachstums von E. coli, wie Abbildung 30 zeigt. -300 -250 -200 -150 -100 -50 0 DiffOD 4 ppm T + 720 ppm L 40 ppm T + 720 ppm L 100 ppm T+ 720 ppm L 0,5 % Tween80 + 0,4 % Isopropylalk. Abbildung 30: 4 ppm T + 1200 ppm L 40 ppm T + 1200 ppm L 100 ppm T + 1200 ppm L Differenz zwischen OD der Nährlösung mit Stoffkombinationen und OD der Nährlösung ohne Zusatz (Kontrolle) nach 7 Stunden Inkubation bei 30 °C bei E. coli. (OD = optische Dichte, L = Linalool, T = Thymol, Gehalt in ppm) 103 4 Ergebnisse Wie die in Tabelle 52 dargestellten Ergebnisse der mikrobiologischen Untersuchung zeigten, wirkten Thymol und Linalool in jeder der geprüften Konzentrationen gegenüber E.coli synergistisch. Bei Kombination von 100 ppm Thymol und 1200 ppm Linalool, 100 ppm Thymol und 720 ppm Linalool, 40 ppm Thymol und 1200 ppm Linalool sowie4 ppm Thymol und 1200 ppm Linalool lagen die Keimzahlen unter der Nachweisgrenze Tabelle 52: Probenanzahl, inokulierte Keimmenge, Mittelwert, obere und untere Grenze des 95 % Konfidenzintervalls der Keimzahlen [lg KbE/ml] von E. coli aus den Proben mit 1 % Isopropylalkohol und 0,5 % Tween80 sowie den Thymol – Linalool – Kombinationen in unterschiedlichen Konzentrationen vor und nach der Bebrütung bei 30 °C über einen Zeitraum von 7 S tunden Konzentration Thymol und Linalool in ppm Inokulierte Keimmenge Kontrollproben 0,4% Isopropylalk.+ 0,5 % Tween80 100 T + 1200 L 100 T + 720 L 40 T + 1200L 40 T + 720 L 4 T + 1200 L 4 T +720 L L: Linalool m: Mittelwert 95 % Konfidenzintervall n m UGK OGK 1 6,15 - - 42 8,74 8,71 3 8,76 3 3 3 3 3 3 2,00 2,00 2,00 5,93 2,00 7,72 synergistisch antagonistisch - - 8,82 - - 8,70 8,83 - - 2,00 2,00 2,00 5,78 2,00 7,50 2,00 2,00 2,00 6,08 2,00 7,94 + + + + + + - n: Probenanzahl OGK: obere Grenze des T: Thymol UGK: untere Grenze des 95 % Konfidenzintervall Brochothrix thermosphacta mit Thymol und Linalool Die Kontrollprobe von B. thermosphacta wies nach zwölfstündiger Inkubation eine optische Dichte von 167 auf. Wie Abbildung 31 zeigt, wirkten sich bis auf die Kombination von 4 ppm Thymol mit 720 ppm Linalool alle geprüften Kombinationen von Linalool und Thymol hemmend auf das Keimwachstum aus. Während bei 4 ppm Thymol mit 720 ppm Linalool eine optische Dichte von 104 erreicht wurde, wiesen die übrigen geprüften Stoffkombinationen nach 12 Stunden eine optische Dichte zwischen -12 und 39 und damit eine hohe Differenz zur optischen Dichte der Kontrolle auf. 104 4 Ergebnisse -200 -150 -100 -50 DiffOD 4 ppm T + 720 ppm L 40 ppm T + 720 ppm L 100 ppm T + 720 ppm L 0,5 % Tween80 + 0,4 % Isopropylalk. Abbildung 31: 0 4 ppm T + 1200 ppm L 40 ppm T + 1200 ppm L 100 ppm T + 1200 ppm L Differenz zwischen OD der Nährlösung mit Stoffkombinationen und OD der Nährlösung ohne Zusatz (Kontrolle) nach 12 Stunden Inkubation bei 25 °C bei B. thermosphacta. (OD = optische Dichte, L = Linalool, T = Thymol, Gehalt in ppm) Tabelle 53 zeigt die Ergebnisse der mikrobiologischen Untersuchung. Mit Ausnahme der Kombinationen 40 ppm Thymol mit 720 ppm Linalool und 4 ppm mit 720 ppm Linalool hemmten alle geprüften Stoffkombinationen das Wachstum von B. thermosphacta, wobei ein synergistischer Effekt feststellbar war. Tabelle 53: Probenanzahl, inokulierte Keimmenge, Mittelwert, obere und untere Grenze des 95 % Konfidenzintervalls der Keimzahlen [lg KbE/ml] von B. thermosphacta aus den Proben mit 0,4 % Isopropylalkohol und 0,5 % Tween80 sowie den Thymol – Linalool – Kombinationen in unterschiedlichen Konzentrationen vor und nach der Bebrütung bei 25 °C über einen Zeitraum von 12 Stunden Konzentration Thymol und Linalool in ppm Inokulierte Keimmenge Kontrollproben 0,4% Isopropylalk.+ 0,5 % Tween80 100T + 1200 L 100 T + 720 L 40 T + 1200 L 40 T + 720 L 4 T + 1200 L 4 T + 720 L L: Linalool m: Mittelwert 95 % Konfidenzintervall n m UGK OGK synergistisch antagonistisch 1 6,86 - - 48 7,81 7,75 7,87 3 8,30 8,19 8,41 - - 3 3 3 3 3 3 2,10 3,67 2,84 7,07 5,07 7,72 1,68 3,29 1,28 6,31 4,69 7,59 2,53 4,05 4,40 7,84 5,45 7,86 + + + + - - - - - - - n: Probenanzahl OGK: obere Grenze des T: Thymol UGK: untere Grenze des 95 % Konfidenzintervall 105 4 Ergebnisse Pseudomonas fragi mit Thymol und Linalool Nach 12 Stunden wies Ps. fragi ohne Einfluss von Ölkomponenten eine optische Dichte von 185 auf. 1200 ppm Linalool und 720 ppm Linalool, jeweils kombiniert mit 100 ppm Thymol wirkten sich keimhemmend aus. Ps. fragi erreichte lediglich eine optische Dichte von 35 bzw. 44. Auch die Kombination von 40 ppm Thymol und 1200 ppm Linalool führte noch zu einer Wachstumshemmung. Die optische Dichte betrug bei dieser Kombination 67. Bei Kombination von 40 ppm Thymol mit 720 ppm Linalool war jedoch keine antibakterielle Wirkung nachweisbar, die optische Dichte wies im Vergleich zur Kontrolle lediglich eine Differenz von -70 auf, wie Abbildung 32 zeigt. -200 -150 -100 -50 0 DiffOD 40 ppm T + 720 pm L 40 ppm T + 1200 ppm L 100 ppm T + 720 ppm L 100 ppm T + 1200 ppm L 0,5 % Tween80 + 0,4 % Isopropylalk. Abbildung 32: Differenz zwischen OD der Nährlösung mit Stoffkombinationen und OD der Nährlösung ohne Zusatz (Kontrolle) nach 12 Stunden Inkubation bei 25 °C bei Ps. fragi. (OD = optische Dichte, L = Linalool, T = Thymol, Gehalt in ppm) In Übereinstimmung mit der Trübungsmessung war auch bei der abschließenden Bestimmung der Keimzahl für die Kombinationen 100 ppm Thymol mit 1200 ppm bzw. 720 ppm Linalool und 40 ppm Thymol mit 1200 ppm Linalool eine keimhemmende Wirkung erkennbar. Zudem erwiesen sich Thymol und Linalool in den genannten Kombinationen als synergistisch wirksam gegenüber Ps. fragi. 40 ppm Thymol und 720 ppm Linalool führten in Übereinstimmung mit den Ergebnissen der optischen Dichte Messung weder allein noch in Kombination miteinander zu einer signifikanten Wachstumshemmung (Tabelle 54) 106 4 Ergebnisse Tabelle 54: Probenanzahl, inokulierte Keimmenge, Mittelwert, obere und untere Grenze des 95 % Konfidenzintervalls der Keimzahlen [lg KbE/ml] von Ps. fragi aus den Proben mit 0,4 % Isopropylalkohol und 0,5 % Tween80 sowie den Thymol – Linalool – Kombinationen in unterschiedlichen Konzentrationen vor und nach der Bebrütung bei 25 °C über einen Zeitrau m von 12 Stunden Konzentration Thymol und Linalool in ppm Inokulierte Keimmenge Kontrollproben 0,4% Isopropylalk.+ 0,5 % Tween80 100 T + 1200 L 100 T + 720 L 40 T + 1200 L 40 T + 720 L L: Linalool m: Mittelwert 95 % Konfidenzintervall n m UGK OGK 1 6,87 - - 48 7,85 7,82 3 7,89 3 3 3 3 6,90 6,97 6,79 7,76 synergistisch antagonistisch - - 7,88 - - 7,80 7,98 - - 6,81 6,51 6,50 7,49 7,00 7,44 7,09 8,03 + + + - - n: Probenanzahl OGK: obere Grenze des T: Thymol UGK: untere Grenze des 95 % Konfidenzintervall 4.3.3 Thymol und 1,8-Cineol Aeromonas hydrophila mit Thymol und 1,8-Cineol Im Gegensatz zur Kontrollprobe mit einer optischen Dichte von 446 erreichte A. hydrophila bei Kombination von 40 ppm Thymol und 1400 ppm 1,8-Cineol nur einen Wert von 5 und wurde folglich durch diese Stoffkombination im Wachstum beeinträchtigt. Eine ähnlich hohe Differenz zur optischen Dichte der Kontrolle ergab sich bei kombinierter Anwendung von 4 ppm Thymol und 1400 ppm 1,8 Cineol, bei der lediglich ein Wert von 7 erreicht wurde (Abbildung 33). A. hydrophila wies unter Einfluss von 40 ppm Thymol zusammen mit 600 ppm 1,8-Cineol nach 7 Stunden mit einer optischen Dichte von 221 eine deutliche Differenz zur Dichte der Kontrolle auf. Daher wurde diese Stoffkombination als hemmend eingestuft. Bei Kombination von 4 ppm Thymol und 600 ppm 1,8-Cineol mit einem Wert von 318 war keine deutliche Hemmung mehr feststellbar. 107 4 Ergebnisse -500 -450 -400 -350 -300 -250 -200 -150 -100 -50 0 DiffOD 4 ppm T + 600 ppm Ci 4 ppm T + 1400 ppm Ci 40 ppm T + 600 ppm Ci 40 ppm T + 1400 ppm Ci 0,5 % Tween80 + 0,4 % Isopropylalk. Abbildung 33: Differenz zwischen OD der Nährlösung mit Stoffkombinationen und OD der Nährlösung ohne Zusatz (Kontrolle) nach 7 Stunden Inkubation bei 30 °C bei A. hydrophila. (OD = optische Dichte, Ci = 1,8-Cineol, T = Thymol, Gehalt in ppm) Wie aus Tabelle 55 ersichtlich, entfalteten 40 ppm Thymol mit 1400 ppm 1,8-Cineol sowie 4 ppm Thymol mit 1400 ppm 1,8-Cineol eine synergistische antibakterielle Wirkung gegenüber A. hydrophila. Die Kombination von 40 ppm oder 4 ppm Thymol mit 600 ppm 1,8-Cineol führte nicht zu einer gegenseitigen Beeinflussung der antibakteriellen Wirksamkeit. Tabelle 55: Probenanzahl, inokulierte Keimmenge, Mittelwert, obere und untere Grenze des 95 % Konfidenzintervalls der Keimzahlen [lg KbE/ml] von A. hydrophila aus den Proben mit 0,4 % Isopropylalkohol und 0,5 % Tween80 sowie den Thymol - 1,8-Cineol – Kombinationen in unterschiedlichen Konzentrationen vor und nach der Bebrütung bei 30 °C über einen Zei traum von 7 Stunden Konzentration Thymol und 1,8-Cineol in ppm Inokulierte Keimmenge Kontrollproben 0,4 % Isopropylalk.+ 0,5 % Tween80 40 T + 1400 Ci 40 T + 600 Ci 4 T + 1400 Ci 4 T + 600 Ci Ci: 1,8-Cineol m: Mittelwert 95 % Konfidenzintervall n m UGK OGK synergistisch antagonistisch 1 6,04 - - 51 8,79 8,76 8,82 3 8,81 8,75 8,88 - - 3 3 3 3 5,02 8,39 6,22 8,66 4,60 8,24 6,12 8,49 5,44 8,55 6,32 8,83 + + - - - - - - n: Probenanzahl OGK: obere Grenze des T: Thymol UGK: untere Grenze des 95 % Konfidenzintervall 108 4 Ergebnisse Escherichia coli mit Thymol und 1,8-Cineol Nach 7 Stunden erreichte E. coli in der Kontrollprobe mit Nährlösung ohne Zusätze eine optische Dichte von 252. Die Kombination von 100 ppm Thymol und 2800 ppm 1,8-Cineol sowie 100 ppm Thymol und 2000 ppm 1,8-Cineol wiesen mit optischen Dichten von 13 bzw. 17 eine deutliche Differenz zur Kontrolle auf, wie aus Abbildung 34 ersichtlich ist. Daher wurden diese Kombinationen als antibakteriell wirksam eingestuft. 40 ppm Thymol führten zusammen mit 2800 ppm 1,8-Cineol ebenfalls zu einer feststellbaren Hemmung des Keimwachstums. E. coli erreichte bei dieser Kombination nur eine optische Dichte von 37. Bei Kombination von 40 ppm Thymol mit 2000 ppm 1,8-Cineol wurde ein optische Dichte von 116 erreicht. -250 -200 -150 -100 -50 0 50 DiffOD 40 ppm T + 2000 ppm Ci 100 ppm T + 2000 ppm Ci 0,5 % Tween80 + 0,4 % Isopropylalk. Abbildung 34: 40 ppm T + 2800 ppm Ci 100 ppm T + 2800 ppm Ci Differenz zwischen OD der Nährlösung mit Stoffkombinationen und OD der Nährlösung ohne Zusatz (Kontrolle) nach 7 Stunden Inkubation bei 30 °C bei E. coli. (OD = optische Dichte, Ci = 1,8-Cineol, T = Thymol, Gehalt in ppm) 100 ppm Thymol in Kombination mit 2800 ppm bzw. 2000 ppm 1,8-Cineol wurde auch bei der mikrobiologischen Untersuchung eine keimhemmende Wirksamkeit und zudem ein synergistischer antibakterieller Effekt gegenüber E. coli nachgewiesen. Die Kombination von 40 ppm Thymol und 2000 ppm 1,8-Cineol verursachte ebenso wie beteiligten Stoffkonzentrationen allein keine Keimhemmung (Tabelle 56). 109 4 Ergebnisse Tabelle 56: Probenanzahl, inokulierte Keimmenge, Mittelwert, obere und untere Grenze des 95 % Konfidenzintervalls der Keimzahlen [lg KbE/ml] von E. coli aus den Proben mit 0,4 % Isopropylalkohol und 0,5 % Tween80 sowie den Thymol - 1,8-Cineol – Kombinationen in unterschiedlichen Konzentrationen vor und nach der Bebrütung bei 30 °C über einen Zei traum von 7 Stunden Konzentration Thymol und 1,8-Cineol in ppm Inokulierte Keimmenge Kontrollproben 0,4 % Isopropylalk.+ 0,5 % Tween80 100 T + 2800 Ci 100 T + 2000 Ci 40 T + 2800 Ci 40 T + 2000 Ci Ci: 1,8-Cineol m: Mittelwert 95 % Konfidenzintervall n m UGK OGK 1 6,08 - - 42 8,74 8,71 3 8,66 3 3 3 3 4,89 6,69 7,25 8,60 synergistisch antagonistisch - - 8,82 - - 8,58 8,75 - - 4,78 6,60 6,18 8,39 5,00 6,78 8,31 8,80 + + - - n: Probenanzahl OGK: obere Grenze des T: Thymol UGK: untere Grenze des 95 % Konfidenzintervall Brochothrix thermosphacta mit Thymol und 1,8-Cineol In der Kontrollprobe erreichte B. thermosphacta nach 12 Stunden eine optische Dichte von 172. Die Stoffkombinationen 100 ppm Thymol mit 2000 ppm 1,8-Cineol und 100 ppm Thymol mit 1800 ppm 1,8-Cineol wiesen optische Dichten von 7 bzw. 1 auf und verursachten somit eine deutliche Hemmung des Bakterienwachstums. Wie aus Abbildung 35 ersichtlich ist, lag zwischen der bei Kombination von 40 ppm Thymol mit 2000 ppm 1,8-Cineol erreichten optischen Dichte von 62 und der optischen Dichte der Kontrolle eine deutliche Differenz und damit eine antibakterielle Wirksamkeit vor. Die gemeinsame Anwendung von 40 ppm Thymol und 1800 ppm 1,8-Cineol beeinflusste hingegen das Bakterienwachstum nicht. 110 4 Ergebnisse -200 -150 -100 40 ppm T+ 1800 ppm Ci 100 ppm T + 1800 ppm Ci 0,5 % Tween80 + 0,4 % Isopropylalk. Abbildung 35: DiffOD -50 0 50 40 ppm T + 2000 ppm Ci 100 ppm T + 2000 ppm Ci Differenz zwischen OD der Nährlösung mit Stoffkombinationen und OD der Nährlösung ohne Zusatz (Kontrolle) nach 12 Stunden Inkubation bei 25 °C bei B. thermosphacta. (OD = optische Dichte, Ci = 1,8-Cineol, T = Thymol, Gehalt in ppm) Wie die mikrobiologische Untersuchung zeigte, wirkten 100 ppm Thymol und 2000 ppm 1,8-Cineol synergistisch antimikrobiell gegenüber B. thermosphacta. Die Kombination 100 ppm Thymol mit 1800 ppm 1,8-Cineol wirkte ebenfalls antibakteriell gegenüber B. thermosphacta, jedoch entsprach die Hemmwirkung der von 100 ppm Thymol allein. 40 ppm Thymol und 1800 ppm 1,8-Cineol zeigten weder allein noch in Kombination antibakterielle Eigenschaften gegenüber B. thermosphacta, wie Tabelle 57 zeigt. 111 4 Ergebnisse Tabelle 57: Probenanzahl, inokulierte Keimmenge, Mittelwert, obere und untere Grenze des 95 % Konfidenzintervalls der Keimzahlen [lg KbE/ml] von B. thermosphacta aus den Proben mit 0,4 % Isopropylalkohol und 0,5 % Tween80 sowie den Thymol - 1,8-Cineol – Kombinationen in unterschiedlichen Konzentrationen vor und nach der Bebrütung bei 25 °C über einen Zeitraum von 12 Stunden Konzentration Thymol und 1,8-Cineol in ppm Inokulierte Keimmenge Kontrollproben 0,4 % Isopropylalk.+ 0,5 % Tween80 100 T + 2000 Ci 100 T + 1800 Ci 40 T + 2000 Ci 40 T + 1800 Ci Ci: 1,8-Cineol m: Mittelwert 95 % Konfidenzintervall n m UGK OGK 1 6,86 - - 48 7,81 7,75 3 7,86 7,74 3 3 3 3 4,87 5,74 7,76 7,69 4,60 5,51 7,66 7,60 synergistisch antagonistisch - - 7,87 - - 7,99 - - 5,14 5,98 7,86 7,78 + - - n: Probenanzahl OGK: obere Grenze des T: Thymol UGK: untere Grenze des 95 % Konfidenzintervall Pseudomonas fragi mit Thymol und 1,8-Cineol Im Vergleich zur Kontrolle mit einer optischen Dichte von 201 erreichte Ps. fragi nach 12 Stunden bei Kombination von 100 ppm Thymol mit 2800 ppm 1,8-Cineol nur eine optische Dichte von 53 und bei Kombination von 100 ppm Thymol mit 2000 ppm 1,8-Cineol eine optische Dichte von 58. Diese Kombinationen führten demnach zu einer Wachstumshemmung. Auch die gemeinsame Anwendung von 40 ppm Thymol und 2800 ppm 1,8-Cineol wies mit einem Wert von 97 eine deutliche Differenz zur optischen Dichte der Kontrolle und damit eine antibakterielle Wirkung gegenüber Ps. fragi auf (Abbildung 36). 40 ppm Thymol zusammen mit 2000 ppm 1,8-Cineol zeigten keine hemmende Wirkung auf das Wachstum von Ps. fragi. 112 4 Ergebnisse -200 -150 -100 -50 DiffOD 40 ppm T + 2000 ppm Ci 100 ppm T + 2000 ppm Ci 0,5 % Tween80 + 0,4 % Isopropylalk. Abbildung 36: 0 40 ppm T + 2800 ppm Ci 100 ppm T + 2800 ppm Ci Differenz zwischen OD der Nährlösung mit Stoffkombinationen und OD der Nährlösung ohne Zusatz (Kontrolle) nach 12 Stunden Inkubation bei 25 °C bei Ps. fragi. (OD = optische Dichte, Ci = 1,8-Cineol, T = Thymol, Gehalt in ppm) Thymol und 1,8-Cineol hemmten in den Kombinationen 100 ppm Thymol mit 2800 ppm 1,8-Cineol sowie 40 ppm Thymol mit 2800 ppm 1,8-Cineol das Wachstum von Ps. fragi, jedoch zeigten sie in keiner der geprüften Kombinationen einen synergistischen antimikrobiellen Effekt. Wie Tabelle 58 zeigt, entfalteten 40 ppm Thymol und 2000 ppm 1,8-Cineol weder allein noch in Kombination miteinander eine antibakterielle Wirkung gegenüber Ps. fragi. Tabelle 58: Probenanzahl, inokulierte Keimmenge, Mittelwert, obere und untere Grenze des 95 % Konfidenzintervalls der Keimzahlen [lg KbE/ml] von Ps. fragi aus den Proben mit 0,4 % Isopropylalkohol und 0,5 % Tween80 sowie den Thymol -1,8-Cineol – Kombinationen in unterschiedlichen Konzentrationen vor und nach der Bebrütung bei 25 °C über einen Zeitrau m von 12 Stunden Konzentration Thymol und 1,8-Cineol in ppm Inokulierte Keimmenge Kontrollproben 0,4 % Isopropylalk.+ 0,5 % Tween80 100 T + 2800 Ci 100 T + 2000 Ci 40 T + 2800 Ci 40 T + 2000 Ci Ci: 1,8-Cineol m: Mittelwert 95 % Konfidenzintervall n m UGK OGK 1 6,83 - - 48 7,85 7,82 3 7,84 3 3 3 3 7,20 7,78 7,75 7,72 synergistisch antagonistisch - - 7,88 - - 7,80 7,88 - - 6,96 7,73 7,65 7,60 7,43 7,82 7,81 7,84 - - n: Probenanzahl OGK: obere Grenze des T: Thymol UGK: untere Grenze des 95 % Konfidenzintervall 113 4 Ergebnisse 4.3.4 Thymol und α-Pinen Aeromonas hydrophila mit Thymol und α-Pinen A. hydrophila erreichte in der Kontrollprobe nach 7 Stunden eine optische Dichte von 486. Die Kombinationen von 100 ppm Thymol mit 800 ppm α-Pinen und 40 ppm Thymol mit 1200 ppm α-Pinen wiesen einen Wert von 8 bzw. 217 und damit eine wachstumshemmende Wirkung auf. Die optische Dichte bei der Kombination 40 ppm Thymol und 800 ppm α-Pinen erreichte einen Wert 295, bei Kombination von 4 ppm Thymol und 1200 ppm α-Pinen lag die optische Dichte bei 344. Aufgrund der in Abbildung 37 dargestellten geringen Differenz zur optischen Dichte der Kontrolle wurden die beiden Stoffkombinationen als nicht keimhemmend eingestuft. -500 -450 -400 -350 -300 -250 -200 -150 -100 -50 0 DiffOD 4 ppm T + 1200 ppm Pi 40 ppm T + 1200 ppm Pi 0,4 % Isopropylalk. + 0,5 % Tween80 Abbildung 37: 40 ppm T + 800 ppm Pi 100 ppm T + 800 ppm Pi Differenz zwischen OD der Nährlösung mit Stoffkombinationen und OD der Nährlösung ohne Zusatz (Kontrolle) nach 7 Stunden Inkubation bei 30 °C bei A. hydrophila. (OD = optische Dichte, Pi = α-Pinen, T = Thymol, Gehalt in ppm) Bei Kombination von 100 ppm Thymol und 800 ppm α-Pinen war eine synergistische antibakterielle Wirksamkeit feststellbar (Tabelle 59). Bei den übrigen geprüften Stoffkombinationen wurde keine gegenseitige Beeinflussung beobachtet. Die antibakterielle Wirksamkeit der Thymol - α-Pinen – Kombinationen entsprach jener der Einzelstoffkonzentrationen. 114 4 Ergebnisse Tabelle 59: Probenanzahl, inokulierte Keimmenge, Mittelwert, obere und untere Grenze des 95 % Konfidenzintervalls der Keimzahlen [lg KbE/ml] von A. hydrophila aus den Proben mit 0,4 % Isopropylalkohol und 0,5 % Tween80 sowie den Thymol – α-Pinen – Kombinationen in unterschiedlichen Konzentrationen vor und nach der Bebrütung bei 30 °C über einen Zeitrau m von 7 Stunden Konzentration Thymol und α-Pinen in ppm Inokulierte Keimmenge Kontrollproben 0,4 % Isopropylalk.+ 0,5 % Tween80 100 T + 800 Pi 40 T + 1200 Pi 40 T + 800 Pi 4 T + 1200 Pi m: Mittelwert Pi: α-Pinen n m UGK OGK 1 6,11 - - 51 8,79 8,76 3 8,81 3 3 3 3 2,00 8,50 8,79 8,65 synergistisch antagonistisch - - 8,82 - - 8,71 8,90 - - 2,00 8,25 8,38 8,08 2,00 8,76 9,19 9,22 + - - n: Probenanzahl OGK: obere Grenze des 95 % Konfidenzintervall T: Thymol UGK: untere Grenze des 95 % Konfidenzintervall Escherichia coli mit Thymol und α-Pinen Die Stoffkombinationen 100 ppm Thymol mit 1200 ppm α-Pinen und 100 ppm Thymol mit 800 ppm α-Pinen wiesen mit optischen Dichten von 89 und 48 eine deutliche Differenz zur Kontrolle auf, deren optischen Dichte 272 betrug (Abbildung 38). 40 ppm Thymol zusammen mit 1200 ppm α-Pinen sowie 40 ppm Thymol mit 800 ppm α-Pinen erreichten nach 7 Stunden optische Dichten von 331 bzw. 234 und beeinflussten somit das Bakterienwachstum nicht negativ. 115 4 Ergebnisse -250 -200 -150 -100 -50 DiffOD 40 ppm T + 800 ppm Pi 100 ppm T + 800 ppm Pi 0,4 % Isopropylalk. + 0,5 % Tween80 Abbildung 38: 0 50 40 ppm T + 1200 ppm Pi 100 ppm T + 1200 ppm Pi Differenz zwischen OD der Nährlösung mit Stoffkombinationen und OD der Nährlösung ohne Zusatz (Kontrolle) nach 7 Stunden Inkubation bei 30 °C bei E. coli. (OD = optische Dichte, Pi = α-Pinen, T = Thymol, Gehalt in ppm) Wie in Tabelle 60 dargestellt, war in der Kombination 100 ppm Thymol mit 1200 ppm α-Pinen eine antibakterielle Wirksamkeit und ein synergistischer Effekt erkennbar. Die übrigen geprüften Stoffkombinationen bewirkten ebenso wie die jeweiligen Stoffkonzentrationen bei alleiniger Anwendung keine Keimhemmung. Tabelle 60: Probenanzahl, Mittelwert, inokulierte Keimmenge, obere und untere Grenze des 95 % Konfidenzintervalls der Keimzahlen [lg KbE/ml] von E. coli aus den Proben mit 0,4 % Isopropylalkohol und 0,5 % Tween80 sowie den Thymol - α-Pinen – Kombinationen in unterschiedlichen Konzentrationen vor und nach der Bebrütung bei 30 °C über einen Zeitrau m von 7 Stunden Konzentration Thymol und α-Pinen in ppm Inokulierte Keimmenge Kontrollproben 0,4 % Isopropylalk.+ 0,5 % Tween80 100 T + 1200 Pi 100 T + 800 Pi 40 T + 1200 Pi 40 T + 800 Pi m: Mittelwert Pi: α-Pinen n m UGK OGK 1 6,58 - - 42 8,74 8,71 3 8,82 8,73 3 3 3 3 7,93 7,71 8,78 8,75 7,65 7,57 8,71 8,54 synergistisch antagonistisch - - 8,82 - - 8,91 - - 8,20 7,85 8,84 8,97 + - - n: Probenanzahl OGK: obere Grenze des 95 % Konfidenzintervall T: Thymol UGK: untere Grenze des 95 % Konfidenzintervall 116 4 Ergebnisse Brochothrix thermosphacta mit Thymol und α-Pinen B. thermosphacta erzielte nach 12 Stunden in der Nährlösung ohne Zusatz eine optische Dichte von 180. Im Gegensatz dazu erreichte B. thermosphacta unter Einfluss der Kombination 100 ppm Thymol mit 400 ppm α-Pinen nur eine optische Dichte von 1, unter Einfluss von 100 ppm Thymol mit 340 ppm α-Pinen eine optische Dichte von 46. Folglich wurden die beiden Stoffkombinationen als hemmend eingestuft. Wie Abbildung 39 zeigt, wiesen auch die Kombinationen 40 ppm Thymol mit 400 ppm α-Pinen mit einer optischen Dichte von 8 und 4 ppm Thymol mit 400 ppm α-Pinen mit einer optischen Dichte von 12 eine deutliche Differenz zur Kontrolle auf und wirkten daher antibakteriell gegenüber B. thermosphacta. 40 ppm Thymol, kombiniert mit 340 ppm α-Pinen konnten das Bakterienwachstum nicht beeinflussen. -200 -150 -100 -50 0 DiffOD 4 ppm T + 400 ppm Pi 40 ppm T + 340 ppm Pi 40 ppm T + 400 ppm Pi 100 ppm T + 400 ppm Pi 0,4 % Isopropylalk. + 0,5 % Tween80 Abbildung 39: Differenz zwischen OD der Nährlösung mit Stoffkombinationen und OD der Nährlösung ohne Zusatz (Kontrolle) nach 12 Stunden Inkubation bei 25 °C bei B. thermosphacta. (OD = optische Dichte, Pi = α-Pinen, T = Thymol, Gehalt in ppm) 100 ppm Thymol zusammen mit 400 ppm α-Pinen hemmten synergistisch das Wachstum von B. thermosphacta, während bei Kombination von 100 ppm Thymol mit 340 ppm α-Pinen ein antagonistischer Effekt feststellbar war. Bei gemeinsamer Anwendung von 40 ppm Thymol und 400 ppm α-Pinen bzw. 4 ppm Thymol und 400 ppm α-Pinen kam es zu einer Hemmung des Keimwachstums, die allerdings jener von 400 ppm α-Pinen bei alleiniger Anwendung nicht überlegen war. 40 ppm Thymol und 340 ppm α-Pinen hemmten weder allein noch in Kombination miteinander das Wachstum von B. thermosphacta (siehe Tabelle 61). 117 4 Ergebnisse Tabelle 61: Probenanzahl, Mittelwert, inokulierte Keimmenge, obere und untere Grenze des 95 % Konfidenzintervalls der Keimzahlen [lg KbE/ml] von B. thermosphacta aus den Proben mit 0,4 % Isopropylalkohol und 0,5 % Tween80 sowie den Thymol - α-Pinen – Kombinationen in unterschiedlichen Konzentrationen vor und nach der Bebrütung bei 25 °C über einen Zeitraum von 12 Stunden Konzentration Thymol und α-Pinen in ppm Inokulierte Keimmenge Kontrollproben 0,4 % Isopropylalk.+ 0,5 % Tween80 100 T + 400 Pi 100 T + 340 Pi 40 T + 400 Pi 40 T + 340 Pi 4 T + 400 Pi m: Mittelwert Pi: α-Pinen n m UGK OGK 1 6,86 - - 48 7,81 7,75 3 7,77 7,64 3 3 3 3 3 4,81 6,85 6,49 7,72 6,35 4,65 6,76 6,17 7,52 5,70 synergistisch antagonistisch - - 7,87 - - 7,90 - - 4,96 6,94 6,81 7,91 7,00 + - + - n: Probenanzahl OGK: obere Grenze des 95 % Konfidenzintervall T: Thymol UGK: untere Grenze des 95 % Konfidenzintervall Pseudomonas fragi mit Thymol und α-Pinen Während Ps. fragi in der Kontrolle eine optische Dichte von 167 erreichte, lag der Wert bei kombinierter Anwendung von 100 ppm Thymol und 1200 ppm α-Pinen lediglich bei 66. Auch die Stoffkombination 100 ppm Thymol und 800 ppm α-Pinen wies mit einer optischen Dichte von 57 eine deutliche Differenz zu dem Kontrollwert auf und wurde ebenso wie die Kombination 100 ppm Thymol mit 1200 ppm α-Pinen als hemmend eingestuft (Abbildung 40). Die übrigen geprüften Stoffkombinationen entfalteten keine antibakterielle Wirkung gegenüber Ps. fragi. So erzielte die Kombination von 40 ppm Thymol mit 1200 ppm α-Pinen eine optische Dichte von 151, bei Kombination von 40 ppm Thymol und 800 ppm α-Pinen betrug der Wert 154. 118 4 Ergebnisse -150 -100 -50 0 DiffOD 40 ppm T + 800 ppm Pi 40 ppm T + 1200 ppm Pi 100 ppm T + 800 ppm Pi 100 ppm T + 1200 ppm Pi 0,4 % Isopropylalk. + 0,5 % Tween80 Abbildung 40: Differenz zwischen OD der Nährlösung mit Stoffkombinationen und OD der Nährlösung ohne Zusatz (Kontrolle) nach 12 Stunden Inkubation bei 25 °C bei Ps. fragi. (OD = optische Dichte, Pi = α-Pinen, T = Thymol, Gehalt in ppm) Ps. fragi wurde durch die Kombinationen 100 ppm Thymol mit 1200 ppm α-Pinen sowie 100 ppm Thymol mit 800 ppm α-Pinen gehemmt, jedoch war weder in diesen Kombinationen noch in den Kombinationen 40 ppm Thymol mit 1200 bzw. 800 ppm α-Pinen eine wechselseitige Beeinflussung der antimikrobiellen Eigenschaften festzustellen (Tabelle 62). Tabelle 62: Probenanzahl, inokulierte Keimmenge, Mittelwert, obere und untere Grenze des 95 % Konfidenzintervalls der Keimzahlen [lg KbE/ml] von Ps. fragi aus den Proben mit 0,4 % Isopropylalkohol und 0,5 % Tween80 sowie den Thymol - α-Pinen – Kombinationen in unterschiedlichen Konzentrationen vor und nach der Bebrütung bei 25 °C über einen Zeitrau m von 12 Stunden Konzentration Thymol und α-Pinen in ppm Inokulierte Keimmenge Kontrollproben 0,4 % Isopropylalk.+ 0,5 % Tween80 100 T + 1200 Pi 100 T + 800 Pi 40 T + 1200 Pi 40 T + 800 Pi m: Mittelwert Pi: α-Pinen n m UGK OGK 1 6,80 - - 48 7,85 7,82 3 7,86 3 3 3 3 7,74 7,73 7,88 7,71 synergistisch antagonistisch - - 7,88 - - 7,80 7,91 - - 7,64 7,69 7,74 7,57 7,80 7,77 8,03 7,85 - - n: Probenanzahl OGK: obere Grenze des 95 % Konfidenzintervall T: Thymol UGK: untere Grenze des 95 % Konfidenzintervall 119 4 Ergebnisse 4.3.5 Thymol und α-Terpineol Aeromonas hydrophila mit Thymol und α-Terpineol Alle geprüften Thymol - α-Terpineol – Kombinationen hemmten das Wachstum von A. hydrophila. Während A. hydrophila nach der Inkubation in der Kontrollprobe eine optische Dichte von 462 aufwies, lag der Wert bei Kombination von 40 ppm Thymol und 600 ppm α-Terpineol lediglich bei 13. Auch bei den Kombinationen 40 ppm Thymol und 400 ppm α-Terpineol sowie 4 ppm Thymol und 600 ppm α-Terpineol lag mit optischen Dichten von 24 bzw. 64 eine deutliche Differenz zur optischen Dichte der Kontrolle vor (Abbildung 41). Auch durch Kombination von 4 ppm Thymol und 400 ppm α-Terpineol wurde eine negative Beeinflussung des Wachstums von A. hydrophila festgestellt, in dieser Stoffkombination wurde eine optische Dichte von 190 erreicht. -500 -450 -400 -350 -300 -250 -200 -150 -100 -50 0 DiffOD 4 ppm T + 400 ppm Te 40 ppm T + 400 ppm Te 0,5 % Tween80 + 0,4 % Isopropylalk. Abbildung 41: 4 ppm T + 600 ppm Te 40 ppm T + 600 ppm Te Differenz zwischen OD der Nährlösung mit Stoffkombinationen und OD der Nährlösung ohne Zusatz (Kontrolle) nach 7 Stunden Inkubation bei 30 °C bei A. hydrophila. (OD = optische Dichte, Te = α-Terpineol, T = Thymol, Gehalt in ppm) Die anschließende Keimzahlbestimmung zeigte, dass sich Thymol und α-Terpineol in ihrer antibakteriellen Wirksamkeit gegenüber A. hydrophila in den Kombinationen 40 ppm Thymol und 600 ppm α-Terpineol sowie 40 ppm Thymol und 400 ppm αTerpineol unterstützen. In den übrigen geprüften Kombinationen war keine wechselseitige Beeinflussung bzgl. der antimikrobiellen Wirksamkeit zu beobachten, wie Tabelle 63 zeigt. 120 4 Ergebnisse Tabelle 63: Probenanzahl, inokulierte Keimmenge, Mittelwert, obere und untere Grenze des 95 % Konfidenzintervalls der Keimzahlen [lg KbE/ml] von A. hydrophila aus den Proben mit 0,4 % Isopropylalkohol und 0,5 % Tween80 sowie den Thymol – α-Terpineol – Kombinationen in unterschiedlichen Konzentrationen vor und nach der Bebrütung bei 30 °C über einen Zei traum von 7 Stunden Konzentration Thymol und α-Terpineol in ppm Inokulierte Keimmenge Kontrollproben 0,4 % Isopropylalk.+ 0,5 % Tween80 40 T + 600 Te 40 T + 400 Te 4 T + 600 Te 4 T + 400 Te m: Mittelwert T: Thymol n m UGK OGK 1 7,43 - - 51 8,79 8,76 3 8,79 3 3 3 3 6,05 6,87 7,98 8,62 n: Probenanzahl Te: α-Terpineol synergistisch antagonistisch - - 8,82 - - 8,78 8,80 - - 5,79 6,63 7,78 8,37 6,32 7,11 8,18 8,88 + + - - OGK: obere Grenze des 95 % Konfidenzintervall UGK: untere Grenze des 95 % Konfidenzintervall Escherichia coli mit Thymol und α-Terpineol Die Stoffkombination 100 ppm Thymol mit 800 ppm α-Terpineol erreichte nach 7 Stunden eine optische Dichte von 32, bei Kombination von 100 ppm Thymol und 600 ppm α-Terpineol lag die optische Dichte bei 20. Damit wiesen die optischen Dichten dieser Stoffkombinationen eine signifikante Differenz zur Kontrolle und folglich eine antibakterielle Wirksamkeit auf (Abbildung 42). 40 ppm Thymol zusammen mit 800 ppm α-Terpineol erreichten eine optische Dichte von 195, 40 ppm Thymol mit 600 ppm α-Terpineol eine optische Dichte von 210. Daher lag in diesen beiden Stoffkombinationen keine hemmende Wirkung gegenüber E. coli vor. 121 4 Ergebnisse -300 -250 -200 -150 -100 DiffOD 40 ppm T + 600 ppm Te -50 0 50 40 ppm T + 800 ppm Te 100 ppm T + 600 ppm Te 100 ppm T + 800 ppm Te 0,5 % Tween80 + 0,4 % Isopropylalk. Abbildung 42: Differenz zwischen OD der Nährlösung mit Stoffkombinationen und OD der Nährlösung ohne Zusatz (Kontrolle) nach 7 Stunden Inkubation bei 30 °C bei E. coli. (OD = optische Dichte, Te = α-Terpineol, T = Thymol, Gehalt in ppm) Aus Tabelle 64 ist ersichtlich, dass 100 ppm Thymol mit 800 ppm α-Terpineol sowie 100 ppm Thymol mit 600 ppm α-Terpineol einen synergistischen Effekt bzgl. ihrer antimikrobiellen Wirksamkeit entfalteten. Die übrigen Kombinationen ließen weder eine synergistische noch eine antagonistische Wirkung erkennen. Tabelle 64: Probenanzahl, inokulierte Keimmenge, Mittelwert, obere und untere Grenze des 95 % Konfidenzintervalls der Keimzahlen [lg KbE/ml] von E. coli aus den Proben mit 0,4 % Isopropylalkohol und 0,5 % Tween80 sowie den Thymol - α-Terpineol – Kombinationen in unterschiedlichen Konzentrationen vor und nach der Bebrütung bei 30 °C über einen Zei traum von 7 Stunden Konzentration Thymol und α-Terpineol in ppm Inokulierte Keimmenge Kontrollproben 0,4 % Isopropylalk.+ 0,5 % Tween80 100 T + 800 Te 100 T + 600 Te 40T + 800 Te 40 T + 600 Te m: Mittelwert T: Thymol n m UGK OGK 1 6,86 - - 42 8,74 8,71 3 8,76 8,71 3 3 3 3 6,66 6,34 8,60 8,63 6,60 5,14 8,40 8,43 n: Probenanzahl Te: α-Terpineol synergistisch antagonistisch - - 8,82 - - 8,82 - - 6,72 7,54 8,80 8,82 + + - - OGK: obere Grenze des 95 % Konfidenzintervall UGK: untere Grenze des 95 % Konfidenzintervall 122 4 Ergebnisse Brochothrix thermosphacta mit Thymol und α-Terpineol B. thermosphacta erreichte in der Nährlösung ohne weitere Zusätze abschließend eine optische Dichte von 165. Davon wichen die Kombinationen 100 ppm Thymol und 800 ppm α-Terpineol bzw. 100 ppm Thymol und 600 ppm α-Terpineol mit optischen Dichten von 30 und 41 deutlich ab. Im Gegensatz zu dazu zeigten die optischen Dichten bei Kombination von 40 ppm Thymol und 800 ppm α-Terpineol sowie 40 ppm Thymol und 600 ppm α-Terpineol nur eine geringe Differenz zur optischen Dichte der Kontrolle (Abbildung 43). Somit konnte nur in den Kombinationen mit 100 ppm Thymol eine antibakterielle Wirkung beobachtet werden. -150 -100 -50 DiffOD 40 ppm T + 600 ppm Te 100 ppm T + 600 ppm Te 0,5 % Tween80 + 0,4 % Isopropylalk. Abbildung 43: 0 50 40 ppm T + 800 ppm Te 100 ppm T + 800 ppm Te Differenz zwischen OD der Nährlösung mit Stoffkombinationen und OD der Nährlösung ohne Zusatz (Kontrolle) nach 12 Stunden Inkubation bei 25 °C bei B. thermosphacta. (OD = optische Dichte, Te = α-Terpineol, T = Thymol, Gehalt in ppm) Bei Kombination von 100 ppm Thymol und 800 ppm sowie 600 ppm α-Terpineol wurde ein antagonistischer Effekt bzgl. der antibakteriellen Wirksamkeit beobachtet. In den übrigen geprüften Thymol – α-Terpineol – Kombinationen Wechselwirkung zwischen den beiden Stoffen festzustellen (Tabelle 65). 123 war keine 4 Ergebnisse Tabelle 65: Probenanzahl, inokulierte Keimmenge, Mittelwert, obere und untere Grenze des 95 % Konfidenzintervalls der Keimzahlen [lg KbE/ml] von B. thermosphacta aus den Proben mit 0,4 % Isopropylalkohol und 0,5 % Tween80 sowie den Thymol - α-Terpineol – Kombinationen in unterschiedlichen Konzentrationen vor und nach der Bebrütung bei 25 °C über einen Zeitraum von 12 Stunden Konzentration Thymol und α-Terpineol in ppm Inokulierte Keimmenge Kontrollproben 0,4 % Isopropylalk.+ 0,5 % Tween80 100 T + 800 Te 100 T + 600 Te 40 T + 800 Te 40 T + 600 Te m: Mittelwert T: Thymol n m UGK OGK 1 6,89 - - 48 7,81 7,75 3 7,87 7,59 3 3 3 3 6,76 6,99 7,90 7,88 6,16 6,64 7,58 7,81 n: Probenanzahl Te: α-Terpineol synergistisch antagonistisch - - 7,87 - - 8,15 - - 7,36 7,34 8,22 7,95 - + + - OGK: obere Grenze des 95 % Konfidenzintervall UGK: untere Grenze des 95 % Konfidenzintervall Pseudomonas fragi mit Thymol und α-Terpineol 100 ppm Thymol, kombiniert mit 800 ppm α-Terpineol erreichte nach 12 Stunden lediglich eine optische Dichte von 35, so dass eine deutliche Differenz zur optischen Dichte der Kontrolle mit einem Wert von 180 und damit eine Wachstumshemmung vorlag (Abbildung 44). Auch die kombinierte Anwendung von 100 ppm Thymol und 600 ppm α-Terpineol beeinflusste das Wachstum von Ps. fragi negativ; nach 12 Stunden lag die optische Dichte bei 24. Bei den Kombinationen 40 ppm Thymol und 800 ppm α-Terpineol sowie 40 ppm Thymol und 600 ppm α-Terpineol war mit Werten von 155 und 159 im Gegensatz zu den Ergebnissen der mikrobiologischen Untersuchungen keine antibakterielle Wirkung nachweisbar. 124 4 Ergebnisse -200 -150 -100 -50 0 DiffOD 40 ppm T + 600 ppm Te 100 ppm T + 600 ppm Te 0,5 % Tween80 + 0,4 % Isopropylalk. Abbildung 44: 40 ppm T + 800 ppm Te 100 ppm T + 800 ppm Te Differenz zwischen OD der Nährlösung mit Stoffkombinationen und OD der Nährlösung ohne Zusatz (Kontrolle) nach 12 Stunden Inkubation bei 25 °C bei Ps. fragi. (OD = optische Dichte, Pi = α-Pinen, T = Thymol, Gehalt in ppm) Wie Tabelle 66 zeigt, entfalteten Thymol und α-Terpineol in allen geprüften Kombinationen einen synergistischen antibakteriellen Effekt gegenüber Ps. fragi. Tabelle 66: Probenanzahl, inokulierte Keimmenge, Mittelwert, obere und untere Grenze des 95 % Konfidenzintervalls der Keimzahlen [lg KbE/ml] von Ps. fragi aus den Proben mit 0,4 % Isopropylalkohol und 0,5 % Tween80 sowie den Thymol - α-Terpineol – Kombinationen in unterschiedlichen Konzentrationen vor und nach der Bebrütung bei 25 °C über einen Zei traum von 12 Stunden Konzentration Thymol und α-Terpineol in ppm Inokulierte Keimmenge Kontrollproben 0,4 % Isopropylalk.+ 0,5 % Tween80 100 T + 800 Te 100 T + 600 Te 40 T + 800 Te 40 T + 600 Te m: Mittelwert T: Thymol n m UGK OGK 1 6,08 - - 48 7,85 7,82 3 7,80 3 3 3 3 6,86 6,82 7,76 7,75 n: Probenanzahl Te: α-Terpineol synergistisch antagonistisch - - 7,88 - - 7,75 7,85 - - 6,70 6,66 7,71 7,71 7,01 6,97 7,81 7,79 + + + + - OGK: obere Grenze des 95 % Konfidenzintervall UGK: untere Grenze des 95 % Konfidenzintervall 125 4 Ergebnisse 4.3.6 Carvacrol und Linalool Aeromonas hydrophila mit Carvacrol und Linalool A. hydrophila wurde durch alle getesteten Carvacrol – Linalool – Kombinationen in seinem Wachstum gehemmt, wie Abbildung 45 zeigt. Nach 7 Stunden Inkubation wies A. hydrophila in der Kontrolle eine optische Dichte von 426 auf. Bei Kombination von 50 ppm Carvacrol und 720 ppm Linalool wurde nur eine optische Dichte von 4, bei Kombination von 50 ppm Carvacrol mit 360 ppm Linalool eine optische Dichte von 29 erreicht. Unter Einfluss von 20 ppm Carvacrol, kombiniert mit 720 ppm bzw. 360 ppm Linalool erreichte A. hydrophila lediglich eine optische Dichte von 7 bzw. 131. Ebenso war bei 2 ppm Carvacrol mit 720 ppm Linalool und 2 ppm Carvacrol mit 360 ppm Linalool eine hemmende Wirkung zu beobachten, da die optische Dichte Werte von 5 bzw. 167 aufwies. -450 -400 -350 -300 -250 -200 -150 -100 -50 0 DiffOD 2 ppm C + 360 ppm L 20 ppm C+ 360 ppm L 50 ppm C + 360 ppm L 0, 5 % Tween80 + 1 % Isopropylalk. Abbildung 45: 2 ppm C + 720 ppm L 20 ppm C + 720 ppm L 50 ppm C + 720 ppm L Differenz zwischen OD der Nährlösung mit Stoffkombinationen und OD der Nährlösung ohne Zusatz (Kontrolle) nach 7 Stunden Inkubation bei 30 °C bei A. hydrophila. (OD = optische Dichte, L = Linalool, C = Carvacrol, Gehalt in ppm) Bei Kombination von 50 ppm Carvacrol mit 720 ppm Linalool, 50 ppm Carvacrol mit 360 ppm Linalool, 20 ppm Carvacrol mit 720 ppm Linalool und 2 ppm Carvacrol mit 720 ppm Linalool waren wie in Tabelle 67 dargestellt nach 7 Stunden keine lebenden Keime mehr nachweisbar. Damit lag in diesen Kombinationen eine synergistische antibakterielle Wirkung vor. 2 ppm Carvacrol und 360 ppm Linalool wirkten hingegen antagonistisch im Hinblick auf ihre Wirksamkeit gegenüber A. hydrophila. 126 4 Ergebnisse Tabelle 67: Probenanzahl, inokulierte Keimmenge, Mittelwert, obere und untere Grenze des 95 % Konfidenzintervalls der Keimzahlen [lg KbE/ml] von A. hydrophila aus den Proben mit 1 % Isopropylalkohol und 0,5 % Tween80 sowie den Carvacrol – Linalool – Kombinationen in unterschiedlichen Konzentrationen vor und nach der Bebrütung bei 30 °C über einen Zei traum von 7 Stunden Konzentration Carvacrol und Linalool in ppm Inokulierte Keimmenge Kontrollproben 1 % Isopropylalk.+ 0,5 % Tween80 50 C + 720 L 50 C + 360 L 20 C + 720 L 20 C + 360 L 2 C + 720 L 2 C + 360 L C: Carvacrol L: Linalool 95 % Konfidenzintervall n m UGK OGK 1 6,64 - - 51 8,79 8,76 3 8,70 3 3 3 3 3 3 2,00 2,00 2,00 7,80 2,03 8,25 synergistisch antagonistisch - - 8,82 - - 8,59 8,81 - - 2,00 2,00 2,00 7,48 1,92 8,15 2,00 2,00 2,00 8,12 2,14 8,36 + + + + - + m: Mittelwert n: Probenanzahl OGK: obere Grenze des UGK: untere Grenze des 95 % Konfidenzintervall Escherichia coli mit Carvacrol und Linalool Ohne hemmende Zusätze erreichte E. coli nach 7 Stunden eine optische Dichte von 260. Wie Abbildung 46 zeigt, entfalteten alle geprüften Stoffkombinationen eine wachstumshemmende Wirkung auf E.coli. Mit einem Wert von 11 wies die Kombination 2 ppm Carvacrol mit 1200 ppm Linalool die geringste optische Dichte auf. Bei den übrigen geprüften Stoffkombinationen wurden Werte zwischen 18 und 22 erreicht. 127 4 Ergebnisse -300 -250 -200 -150 -100 -50 0 DiffOD 2 ppm C + 720 ppm L 20 ppm C + 720 ppm L 50 ppm C + 720 ppm L 0,5 % Tween80 + 1 % Isopropylalk. Abbildung 46: 2 ppm C + 1200 ppm L 20 ppm C + 1200 ppm L 50 ppm C + 1200 ppm L Differenz zwischen OD der Nährlösung mit Stoffkombinationen und OD der Nährlösung ohne Zusatz (Kontrolle) nach 7 Stunden Inkubation bei 30 °C bei E. coli. (OD = optische Dichte, L = Linalool, C = Carvacrol, Gehalt in ppm) Linalool und Carvacrol zeigten außer in der Kombination 2 ppm Carvacrol mit 720 ppm Linalool in allen geprüften Kombinationen einen synergistischen keimhemmenden Effekt gegenüber E. coli (Tabelle 68). Tabelle 68: Probenanzahl, inokulierte Keimmenge, Mittelwert, obere und untere Grenze des 95 % Konfidenzintervalls der Keimzahlen [lg KbE/ml] von E. coli aus den Proben mit 1 % Isopropylalkohol und 0,5 % Tween80 sowie den Carvacrol – Linalool – Kombinationen in unterschiedlichen Konzentrationen vor und nach der Bebrütung bei 30 °C über einen Zeitraum von 7 S tunden Konzentration Carvacrol und Linalool in ppm Inokulierte Keimmenge Kontrollprobe 1 % Isopropylalk.+ 0,5 % Tween80 50 C + 1200 L 50 C+ 720 L 20 C + 1200L 20 C+ 720 L 2 C + 1200 L 2 C+720 L C: Carvacrol L: Linalool 95 % Konfidenzintervall n m UGK OGK 1 6,15 - - 42 8,74 8,71 3 8,76 3 3 3 3 3 3 2,00 4,78 2,00 6,66 2,00 6,70 synergistisch antagonistisch - - 8,82 - - 8,70 8,83 - - 2,00 4,66 2,00 6,48 2,00 6,61 2,00 4,89 2,00 6,85 2,00 6,80 + + + + + - - m: Mittelwert n: Probenanzahl OGK: obere Grenze des UGK: untere Grenze des 95 % Konfidenzintervall 128 4 Ergebnisse Brochothrix thermosphacta mit Carvacrol und Linalool In der Kontrollprobe erzielte B. thermosphacta nach 12 Stunden eine optische Dichte von 167, während bei Kombination von 50 ppm Carvacrol mit 1200 ppm bzw. 720 ppm Linalool mit einem Wert von 25 bzw. 38 eine deutliche antibakterielle Wirkung vorlag. Auch bei 20 ppm Carvacrol kombiniert mit 1200 ppm bzw. 720 ppm Linalool war mit Werten von 5 bzw. 62 eine Wachstumshemmung feststellbar. Abweichend von dem Ergebnis der mikrobiologischen Untersuchung der Probe zeigte auch die Kombination von 2 ppm Carvacrol mit 1200 ppm Linalool bei Messung der optischen Dichte eine antibakterielle Wirkung gegenüber B. thermosphacta. Wie Abbildung 47 zeigt, betrug die Differenz zur optischen Dichte der Kontrolle -165. -200 -150 2 ppm C + 1200 ppm L -100 DiffOD -50 20 ppm C + 720 ppm L 20 ppm C+ 1200 ppm L 50 ppm C+ 720 ppm L 50 ppm C+ 1200 ppm L 4 % Tween80 + 0,4 % Isopropylalk. Abbildung 47: 0 Differenz zwischen OD der Nährlösung mit Stoffkombinationen und OD der Nährlösung ohne Zusatz (Kontrolle) nach 12 Stunden Inkubation bei 25 °C bei B. thermosphacta. (OD = optische Dichte, L = Linalool, C = Carvacrol, Gehalt in ppm) 50 ppm bzw. 20 ppm Carvacrol mit 1200 ppm Linalool hemmten synergistisch das Wachstum von B. thermosphacta, wie Tabelle 69 zeigt. In den übrigen Kombinationen lag weder eine synergistische noch eine antagonistische Wirkung vor. 129 4 Ergebnisse Tabelle 69: Probenanzahl, inokulierte Keimmenge, Mittelwert, obere und untere Grenze des 95 % Konfidenzintervalls der Keimzahlen [lg KbE/ml] von B. thermosphacta aus den Proben mit 1 % Isopropylalkohol und 0,5 % Tween80 sowie den Carvacrol – Linalool – Kombinationen in unterschiedlichen Konzentrationen vor und nach der Bebrütung bei 25 °C über einen Zeitraum von 12 Stunden Konzentration Carvacrol und Linalool in ppm Inokulierte Keimmenge Kontrollproben 1 % Isopropylalk.+ 0,5 % Tween80 50 C + 1200 L 50C + 720 L 20 C + 1200 L 20 C + 720 L 2 C + 1200 L C: Carvacrol L: Linalool 95 % Konfidenzintervall n m UGK OGK 1 7,04 - - 48 7,81 7,75 3 8,30 8,19 3 3 3 3 3 4,09 7,06 3,17 7,52 6,40 3,89 6,53 2,85 7,39 3,18 m: Mittelwert synergistisch antagonistisch - - 7,87 - - 8,41 - - 4,28 7,58 3,50 7,65 9,62 + + - - n: Probenanzahl OGK: obere Grenze des UGK: untere Grenze des 95 % Konfidenzintervall Pseudomonas fragi mit Carvacrol und Linalool Im Gegensatz zur Kontrollprobe mit einer optischen Dichte von 185 erreichte Ps. fragi sowohl unter Einfluss der Kombinationen 50 ppm Carvacrol mit 1200 ppm Linalool als auch unter Einfluss von 20 ppm Carvacrol mit 1200 ppm Linalool nur eine optische Dichte von 58. Somit war bei diesen Stoffkombinationen eine wachstumshemmende Wirkung feststellbar. Die Kombinationen 50 ppm Carvacrol mit 720 ppm Linalool und 20 ppm Carvacrol mit 720 ppm Linalool wiesen mit einer optischen Dichte von 106 und 137 keine antimikrobielle Wirkung auf (Abbildung 48). 130 4 Ergebnisse -150 -100 -50 0 DiffOD 20 ppm C + 720 ppm L 20 ppm C + 1200 ppm L 50 ppm C + 720 ppm L 50 ppm C + 1200 ppm L 0,5 % Tween80 + 1 % Isopropylalk. Abbildung 48: Differenz zwischen OD der Nährlösung mit Stoffkombinationen und OD der Nährlösung ohne Zusatz (Kontrolle) nach 12 Stunden Inkubation bei 25 °C bei Ps. fragi. (OD = optische Dichte, L = Linalool, C = Carvacrol, Gehalt in ppm) 50 ppm Carvacrol mit 1200 ppm Linalool sowie 20 ppm Carvacrol mit 1200 ppm Linalool wirkten gegenüber Ps. fragi antimikrobiell synergistisch. Bei Kombination von 50 ppm und 20 ppm Carvacrol mit jeweils 720 ppm Linalool konnte weder eine Keimhemmung noch eine wechselseitige Beeinflussung der antimikrobiellen Wirksamkeit beobachtet werden (Tabelle 70). Tabelle 70: Probenanzahl, inokulierte Keimmenge, Mittelwert, obere und untere Grenze des 95 % Konfidenzintervalls der Keimzahlen [lg KbE/ml] von Ps. fragi aus den Proben mit 1 % Isopropylalkohol und 0,5 % Tween80 sowie den Carvacrol – Linalool – Kombinationen in unterschiedlichen Konzentrationen vor und nach der Bebrütung bei 25 °C über einen Zei traum von 12 Stunden Konzentration Carvacrol und Linalool in ppm Inokulierte Keimmenge Kontrollproben 1 % Isopropylalk.+ 0,5 % Tween80 50 C + 1200 L 50 C+ 720 L 20 C + 1200 L 20 C + 720 L C: Carvacrol L: Linalool 95 % Konfidenzintervall n m UGK OGK 1 6,86 - - 48 7,85 7,82 3 7,89 3 3 3 3 6,83 7,85 7,12 7,89 synergistisch antagonistisch - - 7,88 - - 7,80 7,98 - - 6,13 7,85 6,87 7,83 7,52 7,85 7,37 7,94 + + - - m: Mittelwert n: Probenanzahl OGK: obere Grenze des UGK: untere Grenze des 95 % Konfidenzintervall 131 4 Ergebnisse 4.3.7 Carvacrol und 1,8-Cineol Aeromonas hydrophila mit Carvacrol und 1,8-Cineol A. hydrophila erreichte nach 7 Stunden Inkubation in der Kontrollprobe ohne Zusatz von Ölkomponenten eine optische Dichte von 446. Bei den Kombinationen 50 ppm Carvacrol mit 1400 ppm 1,8-Cineol sowie 20 ppm Carvacrol mit 1400 ppm 1,8-Cineol wurden lediglich Werte von 1 bzw. 2 erreicht. Damit wurden diese Stoffkombinationen als antibakteriell wirksam eingestuft. Die Kombination von 50 ppm Carvacrol und 600 ppm 1,8-Cineol zeigte mit einer optischen Dichte von 161 ebenfalls eine Hemmwirkung. Bei Kombination von 20 ppm Carvacrol und 600 ppm 1,8-Cineol wies A. hydrophila mit einer optischen Dichte von 316 keine deutliche Differenz zur optischen Dichte der Kontrolle und somit keine Hemmwirkung auf (Abbildung 49). -500 -450 -400 -350 -300 -250 DiffOD 20 ppm C + 600 ppm Ci 50 ppm C + 600 ppm Ci 0,5 % Tween80 + 1 % Isopropylalk. Abbildung 49: -200 -150 -100 -50 0 20 ppm C + 1400 ppm Ci 50 ppm C+ 1400 ppm Ci Differenz zwischen OD der Nährlösung mit Stoffkombinationen und OD der Nährlösung ohne Zusatz (Kontrolle) nach 7 Stunden Inkubation bei 30 °C bei A. hydrophila. (OD = optische Dichte, Ci = 1,8-Cineol, C =Carvacrol, Gehalt in ppm) Während die Stoffkombination 50 ppm Carvacrol mit 1400 ppm 1,8-Cineol sowie die Kombination 20 ppm Carvacrol mit 1400 ppm 1,8-Cineol einen synergistischen antimikrobiellen Effekt gegenüber A. hydrophila aufwiesen, waren bei Kombination von 600 ppm 1,8-Cineol und 50 ppm oder 20 ppm Carvacrol keine synergistischen oder antagonistischen Effekte zu erkennen (Tabelle 70). 132 4 Ergebnisse Tabelle 71: Probenanzahl, inokulierte Keimmenge, Mittelwert, obere und untere Grenze des 95 % Konfidenzintervalls der Keimzahlen [lg KbE/ml] von A. hydrophila aus den Proben mit 1 % Isopropylalkohol und 0,5 % Tween80 sowie den Carvacrol – 1,8-Cineol – Kombinationen in unterschiedlichen Konzentrationen vor und nach der Bebrütung bei 30 °C über einen Zei traum von 7 Stunden Konzentration Carvacrol und 1,8-Cineol in ppm Inokulierte Keimmenge Kontrollproben 1 % Isopropylalk.+ 0,5 % Tween80 50 C + 1400 Ci 50 C + 600 Ci 20 C + 1400 Ci 20 C + 600 Ci C: Carvacrol Ci: 1,8-Cineol 95 % Konfidenzintervall n m UGK OGK 1 5,95 - - 51 8,79 8,76 3 8,81 3 3 3 3 4,16 8,20 5,33 8,83 synergistisch antagonistisch - - 8,82 - - 8,75 8,88 - - 3,94 7,56 4,67 8,80 4,38 8,83 5,99 8,85 + + - - m: Mittelwert n: Probenanzahl OGK: obere Grenze des UGK: untere Grenze des 95 % Konfidenzintervall Escherichia coli mit Carvacrol und 1,8-Cineol Wie aus Abbildung 50 ersichtlich, wiesen die Stoffkombinationen 50 ppm Carvacrol und 2800 ppm 1,8-Cineol sowie 20 ppm Carvacrol und 2000 ppm 1,8-Cineol mit einer optischen Dichte von 38 bzw. 48 eine deutliche Differenz zu der optischen Dichte der Kontrolle auf. Damit lag bei diesen Stoffkombinationen eine Hemmwirkung gegenüber E. coli vor. Auch die gleichzeitige Anwendung von 50 ppm Carvacrol und 2000 ppm 1,8-Cineol führte zu einer Hemmung des Bakterienwachstums. E. coli erreichte bei dieser Kombination nach 7 Stunden einen Wert von 110. Unter Einfluss der Kombination von 20 ppm Carvacrol und 600 ppm 1,8-Cineol erreichte E. coli eine optische Dichte von 136, so dass abweichend von der in der mikrobiologischen Untersuchung ermittelten Keimzahl bei der Trübungsmessung Stoffkombination eine keimhemmende Wirkung vorlag. 133 in dieser 4 Ergebnisse -250 -200 -150 -100 -50 0 50 DiffOD 20 ppm C + 2000 ppm Ci 20 ppm C + 2800 ppm Ci 50 ppm C + 2000 ppm Ci 50 ppm C + 2800 ppm Ci 0,5 % Tween80 + 1 % Isopropylalk. Abbildung 50: Differenz zwischen OD der Nährlösung mit Stoffkombinationen und OD der Nährlösung ohne Zusatz (Kontrolle) nach 7 Stunden Inkubation bei 30 °C bei E. coli. (OD = optische Dichte, Ci = 1,8-Cineol, C = Carvacrol, Gehalt in ppm) Die Kombinationen 50 ppm Carvacrol und 2800 ppm 1,8-Cineol, 50 ppm Carvacrol und 2000 ppm 1,8-Cineol sowie 20 ppm Carvacrol mit 2800 ppm 1,8-Cineol zeigten in der mikrobiologischen Untersuchung eine synergistische antibakterielle Wirkung gegenüber E. coli. Lediglich bei Kombination von 20 ppm Carvacrol mit 2000 ppm 1,8-Cineol kam es zu keiner gegenseitigen Beeinflussung der antibakteriellen Wirksamkeit, wie Tabelle 72 zeigt. Tabelle 72: Probenanzahl, inokulierte Keimmenge, Mittelwert, obere und untere Grenze des 95 % Konfidenzintervalls der Keimzahlen [lg KbE/ml] von E. coli aus den Proben mit 1 % Isopropylalkohol und 0,5 % Tween80 sowie den Carvacrol – 1,8-Cineol – Kombinationen in unterschiedlichen Konzentrationen vor und nach der Bebrütung bei 30 °C über einen Zeitraum vo n 7 Stunden Konzentration Carvacrol und 1,8-Cineol in ppm Inokulierte Keimmenge Kontrollproben 1 % Isopropylalk.+ 0,5 % Tween80 50 C + 2800 Ci 50C + 2000 Ci 20 C + 2800 Ci 20 C + 2000 Ci C: Carvacrol Ci: 1,8-Cineol 95 % Konfidenzintervall n m UGK OGK 1 6,04 - - 42 8,74 8,71 3 8,66 3 3 3 3 7,14 7,99 7,10 8,61 synergistisch antagonistisch - - 8,82 - - 8,58 8,75 - - 6,58 7,96 6,97 8,48 7,70 8,02 7,23 8,74 + + + - - m: Mittelwert n: Probenanzahl OGK: obere Grenze des UGK: untere Grenze des 95 % Konfidenzintervall 134 4 Ergebnisse Brochothrix thermosphacta mit Carvacrol und 1,8-Cineol B. thermosphacta erreichte nach 12 Stunden in der Kontrollprobe ohne weitere Zusätze eine optische Dichte von 172. Die Kombinationen 100 ppm Carvacrol und 2000 ppm 1,8-Cineol sowie 100 ppm Carvacrol und 1800 ppm Carvacrol erzielten einen Wert von 3 bzw. 6 und wiesen damit eine deutliche Differenz zur optischen Dichte der Kontrolle auf (Abbildung 51). Während in den Kombinationen mit 100 ppm Carvacrol eine negative Beeinflussung des Wachstums von B. thermosphacta feststellbar war, wirkten sich die Kombinationen von 50 ppm Carvacrol und 1,8-Cineol nicht mehr hemmend auf das Keimwachstum aus. So lag die optische Dichte von 50 ppm Carvacrol, kombiniert mit 2000 ppm 1,8-Cineol bei 137, in Kombination mit 1800 ppm 1,8-Cineol bei 81. -200 -150 -100 -50 0 50 DiffOD 50 ppm C + 1800 ppm Ci 100 ppm C + 1800 ppm Ci 0,5 % Tween80 + 0,1 % Isopropylalk. Abbildung 51: In 50 ppm C + 2000 ppm Ci 100 ppm C + 2000 ppm Ci Differenz zwischen OD der Nährlösung mit Stoffkombinationen und OD der Nährlösung ohne Zusatz (Kontrolle) nach 12 Stunden Inkubation bei 25 °C bei B. thermosphacta. (OD = optische Dichte, Ci = 1,8-Cineol, C = Carvacrol, Gehalt in ppm) Übereinstimmung mit den Ergebnissen der Trübungsmessung wurde B. thermosphacta durch die Stoffkombinationen 100 ppm Carvacrol mit 2000 ppm 1,8-Cineol und 100 ppm Thymol mit 1800 ppm 1,8-Cineol in seinem Wachstum gehemmt, wobei keine antagonistische oder synergistische Wirkung zwischen den beiden Stoffen beobachtet werden konnte. Wie in Tabelle 73 dargestellt, wirkte die Kombination 50 ppm Carvacrol mit 2000 ppm 1,8-Cineol nicht antibakteriell und wurde als antagonistisch wirksam eingestuft. 135 4 Ergebnisse Tabelle 73: Probenanzahl, inokulierte Keimmenge, Mittelwert, obere und untere Grenze des 95 % Konfidenzintervalls der Keimzahlen [lg KbE/ml] von B. thermosphacta aus den Proben mit 1 % Isopropylalkohol und 0,5 % Tween80 sowie den Carvacrol – 1,8-Cineol – Kombinationen in unterschiedlichen Konzentrationen vor und nach der Bebrütung bei 25 °C über einen Zeitraum von 12 Stunden Konzentration Carvacrol und 1,8-Cineol in ppm Inokulierte Keimmenge Kontrollproben 1 % Isopropylalk.+ 0,5 % Tween80 100 C + 2000 Ci 100 C + 1800 Ci 50 C + 2000 Ci 50 C + 1800 Ci C: Carvacrol Ci: 1,8-Cineol 95 % Konfidenzintervall n m UGK OGK 1 6,86 - - 48 7,81 7,75 3 7,86 7,74 3 3 3 3 6,23 5,99 7,71 7,70 5,54 5,59 7,51 7,58 synergistisch antagonistisch - - 7,87 - - 7,99 - - 6,92 6,39 7,92 7,82 - + - m: Mittelwert n: Probenanzahl OGK: obere UGK: untere Grenze des 95 % Konfidenzintervall Grenze des Pseudomonas fragi mit Carvacrol und 1,8-Cineol 200 ppm Carvacrol führten sowohl in Kombination mit 2800 ppm als auch in Kombination mit 2000 ppm 1,8-Cineol zu einer deutlichen Hemmung des Wachstums von Ps. fragi. Die Kontrollprobe erreichte nach 12 Stunden eine optische Dichte von 201, wovon die optischen Dichten der Kombinationen mit 200 ppm Carvacrol mit Werten von 1 und 2 deutlich abwichen (Abbildung 52). Ebenso blieb die optische Dichte mit einem Wert von 67 bei kombinierter Anwendung von 100 ppm Carvacrol und 2800 ppm 1,8-Cineol bzw. einem Wert von 58 bei Kombination von 100 ppm Carvacrol und 2000 ppm 1,8-Cineol signifikant hinter der optischen Dichte der Kontrolle zurück. Folglich wurde auch die Stoffkombinationen mit 100 ppm Carvacrol als keimhemmend eingestuft. 136 4 Ergebnisse -250 -200 -150 -100 -50 0 DiffOD 100 ppm C + 2000 ppm Ci 200 ppm C + 2000 ppm Ci 0,5 % Tween80 + 1 % Isopropylalk. Abbildung 52: 100 ppm C + 2800 ppm Ci 200 ppm C + 2800 ppm Ci Differenz zwischen OD der Nährlösung mit Stoffkombinationen und OD der Nährlösung ohne Zusatz (Kontrolle) nach 12 Stunden Inkubation bei 25 °C bei Ps. fragi. (OD = optische Dichte, Ci = 1,8-Cineol, C = Carvacrol, Gehalt in ppm) Bei Kombination von 200 ppm Carvacrol und 2800 ppm 1,8-Cineol waren nach 12 Stunden keine lebenden Keime mehr nachweisbar, bei Kombination von 200 ppm Carvacrol mit 2000 ppm 1,8-Cineol lagen die Keimzahlen im Mittel bei 3,0 lg KbE/ml. Damit wiesen diese Stoffkombinationen ebenso wie die Kombinationen 100 ppm Carvacrol mit 2800 ppm bzw. 2000 ppm 1,8-Cineol eine synergistische antimikrobielle Wirksamkeit gegenüber Ps. fragi auf, wie auch Tabelle 74 zu entnehmen ist. Tabelle 74: Probenanzahl, inokulierte Keimmenge, Mittelwert, obere und untere Grenze des 95 % Konfidenzintervalls der Keimzahlen [lg KbE/ml] von Ps. fragi aus den Proben mit 1 % Isopropylalkohol und 0,5 % Tween80 sowie den Carvacrol – 1,8-Cineol – Kombinationen in unterschiedlichen Konzentrationen vor und nach der Bebrütung bei 25 °C über einen Zei traum von 12 Stunden Konzentration Carvacrol und 1,8-Cineol in ppm Inokulierte Keimmenge Kontrollproben 1 % Isopropylalk.+ 0,5 % Tween80 200 C + 2800 Ci 200 C + 2000 Ci 100 C + 2800 Ci 100 C + 2000 Ci C: Carvacrol Ci: 1,8-Cineol 95 % Konfidenzintervall n m UGK OGK synergistisch antagonistisch 1 6,77 - - 48 7,85 7,82 7,88 3 7,84 7,80 7,88 - - 3 3 3 3 2,00 3,00 7,17 7,70 2,00 2,97 7,12 7,56 2,00 3,09 7,21 7,84 + + + + - - - - - m: Mittelwert n: Probenanzahl OGK: obere Grenze des UGK: untere Grenze des 95 % Konfidenzintervall 137 4 Ergebnisse 4.3.8 Carvacrol und α-Pinen Aeromonas hydrophila mit Carvacrol und α-Pinen Nach der 7-stündigen Inkubationszeit lag die optische Dichte der Kontrollprobe bei 468. Aus Abbildung 53 wird ersichtlich, dass lediglich die Kombination 100 ppm Carvacrol mit 800 ppm α-Pinen mit einer optischen Dichte von 12 und die Kombination 50 ppm Carvacrol und 1200 ppm α-Pinen mit einer Trübung von 205 deutlich von der Kontrollprobe abwichen. Diese Kombinationen wurden als wachstumshemmend eingestuft. Die übrigen getesteten Kombinationen wirkten sich nicht hemmend auf A. hydrophila aus. Bei kombinierter Anwendung von 50 ppm Carvacrol und 800 ppm α-Pinen lag die optische Dichte bei 330. 20 ppm Carvacrol zusammen mit 1200 ppm bzw. 800 ppm α-Pinen erreichte ein Trübung von 332 bzw. 338. -500 -450 -400 -350 -300 -250 -200 -150 -100 -50 0 DiffOD 20 ppm C + 800 ppm Pi 20 ppm C + 1200 ppm Pi 50 ppm C + 800 ppm Pi 50 ppm C + 1200 ppm Pi 100 ppm C + 800 ppm Pi 1 % Isopropylalk. + 0,5 % Tween80 Abbildung 53: Differenz zwischen OD der Nährlösung mit Stoffkombinationen und OD der Nährlösung ohne Zusatz (Kontrolle) nach 7 Stunden Inkubation bei 30 °C bei A. hydrophila. (OD = optische Dichte, Pi = α-Pinen, C = Carvacrol, Gehalt in ppm) Wie durch die Bestimmung der Keimzahl nachgewiesen werden konnte, entfalteten Carvacrol und α-Pinen in allen geprüften Kombinationen einen antagonistischen Effekt bezüglich ihrer antimikrobiellen Wirksamkeit gegenüber A. hydrophila (Tabelle 75). 138 4 Ergebnisse Tabelle 75: Probenanzahl, inokulierte Keimmenge, Mittelwert, obere und untere Grenze des 95 % Konfidenzintervalls der Keimzahlen [lg KbE/ml] von A. hydrophila aus den Proben mit 1 % Isopropylalkohol und 0,5 % Tween80 sowie den Carvacrol – α-Pinen – Kombinationen in unterschiedlichen Konzentrationen vor und nach der Bebrütung bei 30 °C über einen Zei traum von 7 Stunden Konzentration Carvacrol und α-Pinen in ppm Inokulierte Keimmenge Kontrollproben 1 % Isopropylalk.+ 0,5 % Tween80 100 C + 800 Pi 50 C + 1200 Pi 50 C + 800 Pi 20 C + 1200 Pi 20 C + 800 Pi C: Carvacrol m: Mittelwert 95 % Konfidenzintervall n m UGK OGK 1 6,70 - - 51 8,79 8,76 3 8,81 3 3 3 3 3 4,82 8,54 8,75 8,71 8,84 synergistisch antagonistisch - - 8,82 - - 8,74 8,87 - - 4,74 8,42 8,69 8,71 8,73 4,90 8,67 8,81 8,77 8,95 - + + + + + n: Probenanzahl OGK: obere Grenze des Pi: α-Pinen UGK: untere Grenze des 95 % Konfidenzintervall Escherichia coli mit Carvacrol und α-Pinen E. coli wurde durch die Kombination 200 ppm Carvacrol mit 1200 ppm α-Pinen mit einer optischen Dichte von -1 und durch die Kombination 200 ppm Carvacrol mit 800 ppm α-Pinen mit einer optischen Dichte von 12 in seinem Wachstum gehemmt. Bei 100 ppm Carvacrol, kombiniert mit 1200 ppm α-Pinen, wurde ein Trübungswert von 224 erreicht, bei 100 ppm Carvacrol mit 800 ppm α-Pinen ein Wert von 205. Wie aus Abbildung 54 ersichtlich, wiesen diese beiden Kombinationen keine deutliche Differenz zur Kontrolle auf, die eine optische Dichte von 272 erzielte. 139 4 Ergebnisse -300 -250 -200 -150 -100 -50 0 50 DiffOD 100 ppm C + 800 ppm Pi 100 ppm C + 1200 ppm Pi 200 ppm C + 800 ppm Pi 200 ppm C + 1200 ppm Pi 1 % Isopropylalk. + 0,5 % Tween80 Abbildung 54: Differenz zwischen OD der Nährlösung mit Stoffkombinationen und OD der Nährlösung ohne Zusatz (Kontrolle) nach 7 Stunden Inkubation bei 30 °C bei E. coli. (OD = optische Dichte, Pi = α-Pinen, C = Carvacrol, Gehalt in ppm) Die Kombinationen von 200 ppm Carvacrol mit 1200 ppm bzw. 800 ppm α-Pinen unterstützen sich in ihrer antimikrobiellen Wirksamkeit gegenüber E. coli, während die Kombinationen von 100 ppm Carvacrol mit 1200 ppm bzw. 800 ppm α-Pinen weder eine antibakterielle Wirksamkeit noch eine wechselseitige Beeinflussung der antimikrobiellen Aktivität erkennen ließen (Tabelle 76). Tabelle 76: Probenanzahl, inokulierte Keimmenge, Mittelwert, obere und untere Grenze des 95 % Konfidenzintervalls der Keimzahlen [lg KbE/ml] von E. coli aus den Proben mit 1 % Isopropylalkohol und 0,5 % Tween80 sowie den Carvacrol - α-Pinen – Kombinationen in unterschiedlichen Konzentrationen vor und nach der Bebrütung bei 30 °C über einen Zeitrau m von 7 Stunden Konzentration Carvacrol und α-Pinen in ppm Inokulierte Keimmenge Kontrollproben 1 % Isopropylalk.+ 0,5 % Tween80 200 C + 1200 Pi 200 C + 800 Pi 100 C + 1200 Pi 100 C + 800 Pi C: Carvacrol m: Mittelwert 95 % Konfidenzintervall n m UGK OGK 1 6,70 - - 42 8,74 8,71 3 8,87 3 3 3 3 2,00 2,00 8,87 8,82 synergistisch antagonistisch - - 8,82 - - 8,66 9,08 - - 2,00 2,00 8,74 8,49 2,00 2,00 9,00 9,15 + + - - n: Probenanzahl OGK: obere Grenze des Pi: α-Pinen UGK: untere Grenze des 95 % Konfidenzintervall 140 4 Ergebnisse Brochothrix thermosphacta mit Carvacrol und α-Pinen In der Nährlösung ohne weitere Zusätze erreichte B. thermosphacta zur Stunde 12 eine optische Dichte von 180. Im Gegensatz dazu wiesen 400 ppm α-Pinen und 340 ppm α-Pinen, jeweils kombiniert mit 100 ppm Carvacrol eine optische Dichte von nur -1 bzw. 41 auf. Auch die Kombination von 50 ppm Carvacrol mit 400 ppm α-Pinen mit einer optischen Dichte von 8 sowie die Kombination 20 ppm Carvacrol mit 400 ppm α-Pinen mit einer optischen Dichte von 7 zeigten eine deutliche Differenz zur Kontrolle (Abbildung 55). Somit konnten die 4 Stoffkombinationen als antimikrobiell wirksam eingestuft werden. 20 ppm Carvacrol kombiniert mit 340 ppm α-Pinen erwies sich mit einer Trübung von 128 als wirkungslos gegenüber B. thermosphacta. -200 -150 -100 -50 0 DiffOD 20 ppm C + 400 ppm Pi 50 ppm C + 340 ppm Pi 50 ppm C + 400 ppm Pi 100 ppm C + 340 ppm Pi 100 ppm C + 400 ppm Pi 1 % Isopropylalk. + 0,5 % Tween80 Abbildung 55: Differenz zwischen OD der Nährlösung mit Stoffkombinationen und OD der Nährlösung ohne Zusatz (Kontrolle) nach 12 Stunden Inkubation bei 25 °C bei B. thermosphacta. (OD = optische Dichte, Pi = α-Pinen, C = Carvacrol, Gehalt in ppm) Carvacrol und α-Pinen beeinflussten sich in ihrer antibakteriellen Wirksamkeit nur in der Kombination 100 ppm Carvacrol mit 340 ppm α-Pinen, wie Tabelle 77 zeigt. In dieser Kombination war ein antagonistischer Effekt feststellbar. Die Kombinationen 100 ppm Carvacrol mit 400 ppm α-Pinen, 50 ppm Carvacrol mit 400 ppm α-Pinen und 20 ppm Carvacrol mit 400 ppm α-Pinen wirkten antibakteriell, jedoch war kein antagonistischer oder synergistischer Effekt nachweisbar. 141 4 Ergebnisse Tabelle 77: Probenanzahl, inokulierte Keimmenge, Mittelwert, obere und untere Grenze des 95 % Konfidenzintervalls der Keimzahlen [lg KbE/ml] von B. thermosphacta aus den Proben mit 1 % Isopropylalkohol und 0,5 % Tween80 sowie den Carvacrol - α-Pinen – Kombinationen in unterschiedlichen Konzentrationen vor und nach der Bebrütung bei 25 °C über einen Zeitraum von 12 Stunden Konzentration Carvacrol und α-Pinen in ppm Inokulierte Keimmenge Kontrollproben 1 % Isopropylalk.+ 0,5 % Tween80 100 C + 400 Pi 100 C + 340 Pi 50 C + 400 Pi 50 C + 340 Pi 20 C + 400 Pi C: Carvacrol m: Mittelwert 95 % Konfidenzintervall n m UGK OGK 1 6,94 - - 48 7,81 7,75 3 7,77 7,64 3 3 3 3 3 4,97 7,02 6,26 7,67 6,51 4,62 6,74 5,70 7,42 5,98 synergistisch antagonistisch - - 7,87 - - 7,90 - - 5,37 7,30 6,82 7,93 7,04 - + - n: Probenanzahl OGK: obere Grenze des Pi: α-Pinen UGK: untere Grenze des 95 % Konfidenzintervall Pseudomonas fragi mit Carvacrol und α-Pinen Die Kombinationen von 200 ppm Carvacrol mit 1200 ppm bzw. 800 ppm α-Pinen entfalteten ein antibakterielle Wirksamkeit gegenüber Ps. fragi. Während die Kontrollprobe nach der Inkubationszeit eine optische Dichte von 167 aufwies, erreichte Ps. fragi unter Einfluss von 200 ppm Carvacrol und 1200 ppm α-Pinen nur eine optische Dichte von 7, unter Einfluss von 200 ppm Carvacrol und 800 ppm α-Pinen eine optische Dichte von 2. Bei kombinierter Anwendung von 100 ppm Carvacrol und 1200 ppm α-Pinen wurde ein Trübungswert von 87 erreicht, bei Kombination von 100 ppm Carvacrol und 800 ppm α-Pinen ein Wert von 90. Aufgrund der geringen Differenz zur optischen Dichte der Kontrolle wurden diese beiden Kombinationen als nicht hemmend eingestuft (Abbildung 56). 142 4 Ergebnisse -200 -150 -100 -50 0 DiffOD 100 ppm C + 800 ppm Pi 200 ppm C + 800 ppm Pi 1 % Isopropylalk. + 0,5 % Tween80 Abbildung 56: 100 ppm C + 1200 ppm Pi 200 ppm C + 1200 ppm Pi Differenz zwischen OD der Nährlösung mit Stoffkombinationen und OD der Nährlösung ohne Zusatz (Kontrolle) nach 12 Stunden Inkubation bei 25 °C bei Ps. fragi. (OD = optische Dichte, Pi = α-Pinen, C = Carvacrol, Gehalt in ppm) Die Kombination von 200 ppm Carvacrol und 1200 ppm bzw. 800 ppm α-Pinen wirkten, wie in Tabelle 78 dargestellt, antimikrobiell gegenüber Ps. fragi. Zudem wurde die antibakterielle Wirksamkeit dieser Konzentrationen von Carvacrol und α-Pinen durch Kombination gesteigert. 100 ppm Carvacrol in Kombination mit 1200 bzw. 800 ppm α-Pinen ließen weder eine keimhemmende Wirkung noch eine gegenseitige Beeinflussung erkennen. Tabelle 78: Probenanzahl, inokulierte Keimmenge, Mittelwert, obere und untere Grenze des 95 % Konfidenzintervalls der Keimzahlen [lg KbE/ml] von Ps. fragi aus den Proben mit 1 % Isopropylalkohol und 0,5 % Tween80 sowie den Carvacrol - α-Pinen – Kombinationen in unterschiedlichen Konzentrationen vor und nach der Bebrütung bei 25 °C über einen Zeitrau m von 12 Stunden Konzentration Carvacrol und α-Pinen in ppm Inokulierte Keimmenge Kontrollproben 1 % Isopropylalk.+ 0,5 % Tween80 200 C + 1200 Pi 200 C + 800 Pi 100 C + 1200 Pi 100 C + 800 Pi C: Carvacrol m: Mittelwert 95 % Konfidenzintervall n m UGK OGK 1 6,87 - - 48 7,85 7,82 3 7,86 3 3 3 3 4,58 4,08 7,70 7,75 synergistisch antagonistisch - - 7,88 - - 7,80 7,91 - - 3,81 3,99 7,57 7,51 5,35 4,17 7,83 7,99 + + - - n: Probenanzahl OGK: obere Grenze des Pi: α-Pinen UGK: untere Grenze des 95 % Konfidenzintervall 143 4 Ergebnisse 4.3.9 Carvacrol und α-Terpineol Aeromonas hydrophila mit Carvacrol und α-Terpineol In der Kontrolle mit Nährlösung ohne weitere Zusätze erreichte A. hydrophila nach 7 Stunden Inkubation eine optische Dichte von 462. Die optische Dichte der Kombination 50 ppm Carvacrol mit 600 ppm α-Terpineol lag nach dieser Zeit bei 12, die optische Dichte der Kombination 50 ppm Carvacrol mit 400 ppm α Terpineol bei 34. Wie Abbildung 57 zeigt, wiesen auch die Kombination von 20 ppm Carvacrol und 600 ppm α-Terpineol mit einer optischen Dichte von 27, die Kombination von 20 ppm Carvacrol und 400 ppm α-Terpineol mit einer optischen Dichte von 115 sowie die Kombination von 2 ppm Carvacrol und 600 ppm α-Terpineol mit einer optischen Dichte von 41 eine deutliche Differenz zur Kontrolle auf und wurden als keimhemmend eingestuft. Bei 2 ppm Carvacrol kombiniert mit 400 ppm α-Terpineol wurde ein Trübungswert von 281 erreicht. Folglich beeinflusste diese Kombination als einzige der geprüften Stoffkombinationen das Wachstum von A. hydrophila nicht negativ. -500 -450 -400 -350 -300 -250 -200 -150 -100 -50 0 DiffOD 2 ppm C + 400 ppm Te 20 ppm C + 400 ppm Te 50 ppm C + 400 ppm Te 0,5 % Tween80 + 1 % Isopropylalk. Abbildung 57: 2 ppm C + 600 ppm Te 20 ppm C + 600 ppm Te 50 ppm C + 600 ppm Te Differenz zwischen OD der Nährlösung mit Stoffkombinationen und OD der Nährlösung ohne Zusatz (Kontrolle) nach 7 Stunden Inkubation bei 30 ° bei A. hydrophila. (OD = optische Dichte, Te = α-Terpineol, C = Carvacrol, Gehalt in ppm) A. hydrophila wurde durch die Stoffkombinationen 50 ppm Carvacrol mit 600 ppm bzw. 400 ppm α-Terpineol, 20 ppm Carvacrol mit 600 ppm α-Terpineol sowie 2 ppm Carvacrol mit 600 ppm α-Terpineol in seinem Wachstum gehemmt. Eine gegenseitige Beeinflussung konnte in Form eines synergistischen antibakteriellen 144 4 Ergebnisse Effekts bei Kombination von 50 ppm Carvacrol und 600 ppm bzw. 400 ppm α-Terpineol festgestellt werden (Tabelle 79). Tabelle 79: Probenanzahl, inokulierte Keimmenge, Mittelwert, obere und untere Grenze des 95 % Konfidenzintervalls der Keimzahlen [lg KbE/ml] von A. hydrophila aus den Proben mit 1 % Isopropylalkohol und 0,5 % Tween80 sowie den Carvacrol – α-Terpineol – Kombinationen in unterschiedlichen Konzentrationen vor und nach der Bebrütung bei 30 °C über einen Zeitraum von 7 Stunden Konzentration Carvacrol und α-Terpineol in ppm Inokulierte Keimmenge Kontrollproben 1 % Isopropylalk.+ 0,5 % Tween80 50 C + 600 Te 50 C + 400 Te 20 C + 600 Te 20 C + 400 Te 2 C + 600 Te 2 C + 400 Te n C: Carvacrol m: Mittelwert 95 % Konfidenzintervall 95 % Konfidenzintervall m UGK OGK 1 6,75 - - 51 8,79 8,76 8,82 3 8,79 8,78 8,80 - - 3 3 3 3 3 3 6,65 7,30 7,86 8,56 7,81 8,73 6,39 6,89 7,71 8,34 7,63 8,57 6,91 7,70 8,01 8,78 7,99 8,89 + + - - n: Probenanzahl Te: α-Terpineol synergistisch antagonistisch - - - - OGK: obere Grenze des UGK: untere Grenze des Escherichia coli mit Carvacrol und α-Terpineol Während E. coli in der Kontrolle nach 7 Stunden einen Trübungsmesswert von 278 aufwies, lag die optische Dichte bei den Kombinationen 200 ppm Carvacrol mit 800 ppm α-Terpineol und 200 ppm Carvacrol mit 600 ppm α-Terpineol bei 10 bzw. 8. Auch die Kombinationen 100 ppm Carvacrol mit 800 ppm α-Terpineol und 100 ppm Carvacrol mit 600 ppm α-Terpineol wiesen mit optischen Dichten von 120 und 90 eine deutliche Differenz zur Kontrolle auf (Abbildung 58). Somit wurden diese vier Stoffkombinationen als wachstumshemmend eingestuft. Bei gemeinsamer Anwendung von 50 ppm Carvacrol und 800 ppm α-Terpineol konnte mit einer optischen Dichte von 199 keine keimhemmende Wirkung beobachtet werden. 145 4 Ergebnisse -300 -250 -200 -150 -100 -50 0 50 DiffOD 50 ppm C + 600 ppm Te 100 ppm C + 600 ppm Te 200 ppm C + 600 ppm Te 0,5 % Tween80 + 1 % Isopropylalk. Abbildung 58: 50 ppm C + 800 ppm Te 100 ppm C + 800 ppm Te 200 ppm C + 800 ppm Te Differenz zwischen OD der Nährlösung mit Stoffkombinationen und OD der Nährlösung ohne Zusatz (Kontrolle) nach 7 Stunden Inkubation bei 30 °C bei E. coli. (OD = optische Dichte, Te = α-Terpineol, C = Carvacrol, Gehalt in ppm) Wie Tabelle 80 zeigt, wirkten Carvacrol und α-Terpineol mit Ausnahme der Kombination 50 ppm Carvacrol mit 800 ppm α-Terpineol in jeder der geprüften Kombinationen synergistisch antibakteriell gegenüber E. coli. Tabelle 80: Probenanzahl, inokulierte Keimmenge, Mittelwert, obere und untere Grenze des 95 % Konfidenzintervalls der Keimzahlen [lg KbE/ml] von E. coli aus den Proben mit 1 % Isopropylalkohol und 0,5 % Tween80 sowie den Carvacrol - α-Terpineol – Kombinationen in unterschiedlichen Konzentrationen vor und nach der Bebrütung bei 30 °C über einen Zei traum von 7 Stunden Konzentration Carvacrol und α-Terpineol in ppm Inokulierte Keimmenge Kontrollproben 1 % Isopropylalk.+ 0,5 % Tween80 200 C + 800 Te 200 C + 600 Te 100 C + 800 Te 100 C + 600 Te 50 C + 800 Te C: Carvacrol m: Mittelwert 95 % Konfidenzintervall 95 % Konfidenzintervall n m UGK OGK 1 6,70 - - 42 8,74 8,71 8,82 3 8,76 8,71 8,82 - - 3 3 3 3 3 2,00 2,00 8,44 8,11 8,75 2,00 2,00 8,33 7,81 8,72 2,00 2,00 8,56 8,42 8,78 + + + + - - n: Probenanzahl Te: α-Terpineol synergistisch antagonistisch - - - - OGK: obere Grenze des UGK: untere Grenze des 146 4 Ergebnisse Brochothrix thermosphacta mit Carvacrol und α-Terpineol B. thermosphacta erreichte unter Einfluss von 100 ppm Carvacrol und 800 ppm α-Terpineol eine optische Dichte von 112, unter Einfluss von 100 ppm und 600 ppm α-Terpineol eine optische Dichte von 124. Bei Kombination von 50 ppm Carvacrol mit 800 ppm bzw. 600 ppm α-Terpineol lag die optische Dichte nach 12 Stunden bei 132 bzw. 182. Damit wies keine der geprüften Stoffkombinationen eine signifikante Differenz zur Kontrolle mit einer optischen Dichte von 165 auf (Abbildung 59), so dass die geprüften Stoffkombinationen als nicht hemmend gegenüber B. thermosphacta eingestuft wurden. -100 -50 DiffOD 50 ppm C + 600 ppm Te 100 ppm C + 600 ppm Te 0,5 % Tween80 + 1 % Isopropylalk. Abbildung 59: 0 50 50 ppm C + 800 ppm Te 100 ppm C + 800 ppm Te Differenz zwischen OD der Nährlösung mit Stoffkombinationen und OD der Nährlösung ohne Zusatz (Kontrolle) nach 12 Stunden Inkubation bei 25 °C bei B. thermosphacta. (OD = optische Dichte, Te = α-Terpineol, C = Carvacrol, Gehalt in ppm) In Übereinstimmung mit der Trübungsmessung war auch bei der mikrobiologischen Untersuchung bei keiner der geprüften Stoffkombinationen eine antibakterielle Wirkung gegenüber B. thermosphacta nachweisbar. Die Kombination von 100 ppm Carvacrol und 800 ppm bzw. 600 ppm α-Terpineol führte zu einem Verlust der Wirksamkeit von 100 ppm Carvacrol. Daher wurde diese Kombination, wie aus Tabelle 81 ersichtlich, als antagonistisch eingestuft. 147 4 Ergebnisse Tabelle 81: Probenanzahl, inokulierte Keimmenge, Mittelwert, obere und untere Grenze des 95 % Konfidenzintervalls der Keimzahlen [lg KbE/ml] von B. thermosphacta aus den Proben mit 1 % Isopropylalkohol und 0,5 % Tween80 sowie den Carvacrol - α-Terpineol – Kombinationen in unterschiedlichen Konzentrationen vor und nach der Bebrütung bei 25 °C über einen Zeitraum von 12 Stunden Konzentration Carvacrol und α-Terpineol in ppm Inokulierte Keimmenge Kontrollproben 1 % Isopropylalk.+ 0,5 % Tween80 100 C + 800 Te 100 C + 600 Te 50 C + 800 Te 50 C + 600 Te C: Carvacrol m: Mittelwert 95 % Konfidenzintervall 95 % Konfidenzintervall n m UGK OGK 1 6,79 - - 48 7,81 7,75 3 7,87 7,59 3 3 3 3 7,76 7,85 7,84 7,90 7,64 7,58 7,55 7,78 n: Probenanzahl Te: α-Terpineol synergistisch antagonistisch - - 7,87 - - 8,15 - - 7,88 8,11 8,12 8,02 - + + - OGK: UGK: obere untere Grenze Grenze des des Pseudomonas fragi mit Carvacrol und α-Terpineol Die Kombination von 100 ppm Carvacrol und 800 ppm bzw. 600 ppm α-Terpineol wirkte sich hemmend auf das Wachstum von Ps. fragi auf. So wurde bei Kombination von 100 ppm Carvacrol mit 800 ppm α-Terpineol lediglich eine Trübung von 46 erreicht, bei Kombination von 100 ppm Carvacrol und 600 ppm α-Terpineol eine Trübung von 29. Wie Abbildung 60 zeigt, wiesen 50 ppm Carvacrol kombiniert mit 800 ppm α-Terpineol und 50 ppm Carvacrol kombiniert mit 600 ppm α-Terpineol mit optischen Dichten von 155 und 165 keine signifikante Differenz zur optischen Dichte der Kontrolle auf, so dass diese Kombinationen als nicht keimhemmend eingestuft wurden. 148 4 Ergebnisse -200 -150 -100 -50 DiffOD 50 ppm C + 600 ppm Te 100 ppm C + 600 ppm Te 0,5 % Tween80 + 1 % Isopropylalk. Abbildung 60: 0 50 ppm C + 800 ppm Te 100 ppm C + 800 ppm Te Differenz zwischen OD der Nährlösung mit Stoffkombinationen und OD der Nährlösung ohne Zusatz (Kontrolle) nach 12 Stunden Inkubation bei 25 °C bei Ps. fragi. (OD = optische Dichte, Te = α-Terpineol, C = Carvacrol, Gehalt in ppm) Carvacrol und α-Terpineol entfalteten einen synergistischen antimikrobiellen Effekt gegenüber Ps. fragi, wie die in Tabelle 82 dargestellten Ergebnisse der Keimzahlbestimmung zeigten. Die übrigen geprüften Stoffkombinationen wirkten weder antimikrobiell, noch konnte eine gegenseitige Beeinflussung der beteiligten Stoffe beobachtet werden. Tabelle 82: Probenanzahl, inokulierte Keimmenge, Mittelwert, obere und untere Grenze des 95 % Konfidenzintervalls der Keimzahlen [lg KbE/ml] von Ps. fragi aus den Proben mit 1 % Isopropylalkohol und 0,5 % Tween80 sowie den Carvacrol - α-Terpineol – Kombinationen in unterschiedlichen Konzentrationen vor und nach der Bebrütung bei 25 °C über einen Zei traum von 12 Stunden Konzentration Carvacrol und α-Terpineol in ppm Inokulierte Keimmenge Kontrollproben 1% Isopropylalk.+ 0,5 % Tween80 100 C + 800 Te 100 C + 600 Te 50 C + 800 Te 50 C + 600 Te C: Carvacrol m: Mittelwert 95 % Konfidenzintervall 95 % Konfidenzintervall n m UGK OGK synergistisch antagonistisch 1 6,85 - - 48 7,85 7,82 7,88 - - 3 7,80 7,75 7,85 - - 3 3 3 3 7,06 6,97 7,72 7,74 6,84 6,74 7,19 7,64 7,29 7,20 8,25 7,84 + + - - - n: Probenanzahl Te: α-Terpineol - OGK: UGK: 149 obere untere Grenze Grenze des des 5 Diskussion 5 Diskussion 5.1 Eignung von Material und Methode 5.1.1 Auswahl der Bakterien Da die Ergebnisse dieser Arbeit Rückschlüsse auf eine mögliche Eignung von Gewürzen zur Verlängerung der Haltbarkeit von Lebensmitteln ermöglichen sollten, wurde die antibakterielle Wirksamkeit verschiedener Einzelkomponenten ätherischer Öle gegenüber Lebensmittelverderbniserregern geprüft. Enterobacteriaceae sind Bestandteil der Mikroflora des menschlichen und tierischen Darms und kommen bei fäkaler Kontamination, mangelnder Hygiene bei der Herstellung von Lebensmitteln oder unzureichender Kühlung auf Lebensmitteln vor (HUIS IN`T FELD 1996). Stellvertretend für die Familie der Enterobacteriaceae wurde E. coli ausgewählt, der neben seiner Eigenschaft als Verderbniskeim auch fakultativ pathogene Eigenschaften besitzt. Aeromonaden, insbesondere A. hydrophila, sind häufig auf Fleisch, Shrimps, Fisch und Gemüse zu finden (NEYTS et al. 2000). Durch ihren Stoffwechsel unter aeroben Bedingungen verursachen Aeromonaden einen unangenehm „fischigen“ Geruch bei Fischprodukten (GRAM u. DAALGARD 2002). Zudem gelten A. hydrophila und A. veronii sobria als enteropathogene Stämme. Folglich wurde A. hydrophila aufgrund seiner Bedeutung als Verderbniserreger von Fischprodukten sowie wegen seines pathogenen Potentials ausgewählt. Das Gram-positive Bakterium B. thermosphacta ist Bestandteil der Mikroflora von gekühlt gelagertem Fleisch (BORCH et al. 1996) und ist vorherrschender Keim bei Vakuum- oder unter Schutzatmosphäre verpackten Fleischprodukten (GARDNER 1981, HUIS IN`T B. thermosphacta VELD unter 1996). aeroben Durch seinen Bedingungen Stoffwechsel einen käsigen verursacht Geruch bei Lebensmitteln. Aus diesem Grunde und aufgrund seiner Zugehörigkeit zu den Grampositiven Bakterien, erschien es interessant, die Hemmwirkung der sechs Ölkomponenten gegenüber B. thermosphacta zu prüfen. 150 5 Diskussion Pseudomonas fragi wurde stellvertretend für die Familie der Pseudomonaden ausgewählt. Pseudomonaden dominieren unter aeroben Bedingungen zusammen mit den Enterobacteriaceae und B. thermosphacta die Mikroflora von gekühlt gelagerten Fleisch (DAINTY u. MACKEY 1992, BORCH et al. 1996). Insgesamt sind Pseudomonas spp. häufig in gekühlten, proteinreichen Lebensmitteln zu finden (BORCH et al. 1996). Pseudomonaden im Allgemeinen, insbesondere Ps. fragi, rufen durch Metabolisierung von Fett- und Aminosäuren den fruchtig-süßlichen oder fauligen Geruch von verdorbenem Fleisch hervor (BORCH et al. 1996, HUIS IN`T VELD 1996). 5.1.2 Auswahl der Inhaltsstoffe ätherischer Öle Thymian bzw. Oregano werden häufig in Fleischzubereitungen bzw. mediterranen Pastasaucen eingesetzt. Thymian- und Oreganoöl sowie den beiden Hauptkomponenten ihres ätherischen Öls, Thymol und Carvacrol, wurde bereits in einigen Studien eine sehr gute antimikrobielle Wirksamkeit nachgewiesen (KIM et al. 1995, SIVROPOULOU et al 1996, DORMAN u. DEANS 2000). Linalool kann in größeren Mengen im ätherischen Öl von Thymian oder Basilikum vorkommen, α-Terpineol ist wichtiger Bestandteil des Öl von Majoran, welcher häufig zur Würzung von Wurstwaren verwendet wird (siehe Tabelle 5). Sowohl Linalool als auch α-Terpineol besitzen antimikrobielle Eigenschaften (KIM et al. 1995, WAN et al. 1998, CARSON et al. 2002). Ebenso zeigte Rosmarin, verwendet zur Würzung von Fleischzubereitungen, keimhemmende Eigenschaften (QUATTARA et al. 1997, HAMMER et al. 1999a, ANGIONI et al. 2004). 1,8-Cineol, Bestandteil des ätherischen Öls von Lorbeer, wies in Studien von COX et al (2002) und CARSON et al. (2002) ebenfalls eine antibakterielle Aktivität auf. Der Schwerpunkt der Untersuchungen bezüglich der antimikrobiellen Wirksamkeit ätherischer Öle bzw. der Ölkomponenten lag allerdings auf der Untersuchung der Hemmwirkung gegenüber verschiedenen Lebensmittelinfektions- und Intoxikationserregern, so dass nur wenige bzw. keine quantitativen Aussagen über die antimikrobielle Wirksamkeit gegenüber Lebensmittelverderbnisserregern vorlagen. 151 den ausgewählten 5 Diskussion Aufgrund der Verwendung von Thymian, Oregano, Rosmarin, Lorbeer und Majoran zur Aromatisierung verschiedener Lebensmittel und im Hinblick auf ihren möglichen Nutzen für die Haltbarkeitsverlängerung von Lebensmitteln erschien es interessant, die antimikrobielle Wirksamkeit der Hauptkomponenten ihrer ätherischen Öle gegenüber den ausgewählten Verderbniskeimen allein und in Kombination zu untersuchen. 5.1.3 Stammlösungen Aufgrund der schlechten Löslichkeit der Einzelkomponenten ätherischer Öle in wässrigen Medien wurden zur Herstellung der Stammlösungen Stoffe zur Erhöhung der Wasserlöslichkeit der lipophilen Ölkomponenten verwendet. Zur Lösung von Carvacrol wurden 1% Isopropylalkohol, zur Lösung von Thymol 0,4 % Isopropylalkohol verwendet. Linalool, 1,8-Cineol, α-Terpineol und α-Pinen wurden mit Hilfe von 0,5 % Tween80 gelöst. Während eine Beeinflussung des Bakterienwachstums durch die verwendeten Mengen Isopropylalkohol bzw. Tween80 durch Anlegen von entsprechenden Kontrollproben ausgeschlossen wurde, konnte eine Beeinflussung der antibakteriellen Wirksamkeit der Ölkomponenten durch Isopropylalkohol bzw. Tween80 nicht ausgeschlossen werden. BURT et al. (2005) prüften die Beeinflussung der Wirksamkeit von Carvacrol gegenüber E. coli O157:H7 bei Zusatz von Ethanol sowie den Stabilisatoren Agar-Agar und Carragen zum Medium. Alle drei Stoffe führten zu einer Erhöhung der antimikrobiellen Aktivität von Carvacrol, wobei Ethanol die größte Steigerung der antibakteriellen Aktivität bewirkte. Die Verwendung der Emulgatoren Tween80 und Tween20 verursachte regelmäßig eine Abnahme der antimikrobiellen Wirksamkeit ätherischer Öle und ihrer Einzelkomponenten. So bewirkte eine steigende Zunahme von Tween80 zum Nähragar eine fortschreitende Abnahme der antimikrobiellen Wirksamkeit von Thymol, Carvacrol, 1,8-Cineol, α-Terpineol und Linalool bei Anwendung der Agardiffussionsmethode (JUVEN et al. 1994, CARSON u. RILEY 1995). Der Verlust der antimikrobiellen Wirksamkeit der Öle bzw. Ölkomponenten bei Zugabe des Tensids Tween80 wird möglicherweise durch die Aufnahme des antimikrobiellen 152 5 Diskussion Agens in Mizellen verursacht, wodurch das Agens nicht mehr mit den Mikroorganismen reagieren kann (HAMMER et al. 1999b). Ebenso ist eine Förderung des Bakterienwachstums durch Tween80 als Ölsäurequelle denkbar (CARSON u. RILEY 1995). Gemäß Desinfektionsmittelrichtlinie der Deutschen Veterinärmedizinischen Gesellschaft (2007) führt Tween80 in einer Konzentration von 1 % im Medium zu einer Neutralisation von Alkoholen und Phenolen. Da Linalool und α-Terpineol der Gruppe der Terpen-Alkohole zuzuordnen sind, ist eine durch die Verwendung von 0,5 % Tween80 bedingte Abschwächung der antibakteriellen Wirksamkeit nicht auszuschließen. 5.1.4 Messung der optischen Dichte Die Messung der optischen Dichte eignet sich vornehmlich zur qualitativen Einschätzung der antibakteriellen Wirksamkeit der Inhaltsstoffe ätherischer Öle. Rückschlüsse auf die Keimzahl sind möglich, allerdings liegt die Messungenauigkeit bei mindestens 0,5 lg KbE/ml, so dass eine abschließende Bestimmung der Keimzahl mit mikrobiologischen Methoden, z. B. Ausstreichen der Proben auf Nähragar, nötig ist (HOLLEY u. PATEL 2005). Zudem ist durch Messung der optischen Dichte eine Unterscheidung zwischen lebenden und toten Bakterien nicht möglich (MARINO et al. 1999, HOLLEY u. PATEL 2005). Die optische Dichte wurde bei einer Wellenlänge von 490 nm gemessen. Diese Wellenlänge verwendeten bereits UPMANN et al. (2001), die ebenfalls die Trübungsmessung nutzten, um das Wachstum von Pseudomonas spp., E. coli und B. thermosphacta in einer Flüssigkultur unter Einfluss von ätherischen Ölen zu verfolgen. 5.1.5 Definition der antimikrobiellen Wirksamkeit Gemäß KROKER et al. (2002) kann bei der Einwirkung von antibakteriell wirksamen Substanzen auf Bakterien zwischen zwei Grundeffekten unterschieden werden. Werden durch Einwirkung des Chemotherapeutikums Bakterien abgetötet, spricht man von einem bakteriziden Effekt. Überleben die Bakterien, unterliegen jedoch einer Wachstumshemmung, spricht man von einem bakteriostatischen Effekt. 153 5 Diskussion In der vorliegenden Arbeit erfolgte die Einstufung einer Einzelstoffkonzentration bzw. Stoffkombination als bakteriostatisch wirksam (keimhemmend) durch Vergleich von Konfidenzintervallen in Kombination mit dem Ergebnis der Trübungsmessung. War die nach Ende der Inkubationszeit unter Einfluss einer Einzelstoffkonzentration erreichte Keimzahl geringer als die inokulierte Keimzahl, so wurde die Stoffkonzentration als bakterizid wirksam eingestuft (siehe Kapitel 3.3). Die inokulierte Keimzahl wurde durch Bestimmung der Keimzahl in nur einer Stichprobe der Keimsuspension bestimmt. Es besteht daher die Möglichkeit, dass die ermittelte Keimzahl nicht repräsentativ für die gesamte Ausgangs-Keimsuspension war und damit eine Einzelstoffkonzentration fälschlicher Weise als bakterizid eingestuft oder ein bakterizider Effekt übersehen wurde. In Abhängigkeit der verwendeten Methode kann eine Einstufung in bakteriostatisch oder bakterizid auch nach anderen Kriterien erfolgen. So definierten SMITH-PALMER et al. (1998) eine Stoffkonzentration als bakteriostatisch wirksam, die das Wachstum des geprüften Bakteriums in Bouillon verhinderte, das Bakterium bei Ausstreichen der Nährbouillon auf Nähragar jedoch noch vermehrungsfähig war. Konnte auch auf dem Nähragar kein lebendes Bakterium mehr nachgewiesen werden, wurde die Stoffkonzentration als bakterizid eingestuft. Im Vergleich zu der in dieser Arbeit verwendeten Methode zur Unterscheidung zwischen bakterizider und bakteriostatischer Wirkung hat die Methode von SMITH-PALMER et al. (1998) den Nachteil, dass die ursprünglich inokulierte Keimmenge nicht berücksichtigt wurde. Somit besteht die Möglichkeit, dass bakterizide Effekte unentdeckt blieben. 5.1.6 Statistische Auswertung Die statistische Auswertung der Ergebnisse, anhand derer die antibakterielle Wirksamkeit der Einzelstoffe bzw. Stoffkombinationen beurteilt wurde, erfolgte durch Berechnung der 95 % Konfidenzintervalle. Während für die Berechnung der Grenzen der Konfidenzintervalle der Kontrollproben eine Stichprobenanzahl von 42 (E. coli, Ps. fragi), 48 (B. thermosphacta) und 51 (A. hydrophila) zur Verfügung stand, entfielen auf jede geprüfte Einzelstoffkonzentration bzw. Stoffkombination lediglich 3 Stichproben. Die Stichprobenanzahl 154 wirkt sich auf die Größe des 5 Diskussion Konfidenzintervalls aus, wobei eine abnehmende Stichprobenanzahl eine Vergrößerung des Konfidenzintervalls zur Folge hat. Erstrebenswert ist jedoch eine möglichst hohe Stichprobenanzahl, die ein kleines Konfidenzintervall ergibt und eine genaue und aussagekräftige Schätzung erlaubt (SACHS 2003). Aufgrund der geringen Stichprobenanzahl bei der Prüfung der Einzelstoffe bzw. Stoffkombinationen ergaben sich im Gegensatz zu den Kontrollproben mit hoher Stichprobenanzahl große Konfidenzintervalle. Dadurch besteht die Möglichkeit, dass einige Einzelstoffkonzentrationen bzw. Stoffkombinationen hinsichtlich ihrer antimikrobiellen Wirksamkeit falsch eingeschätzt wurden. Zudem liegt bei einem Vertrauensbereich von 95 % eine Irrtumswahrscheinlichkeit von 5 % vor. Dies bedeutet, dass in 5 % aller Fälle der wahre Mittelwert der Stichproben nicht vom Konfidenzintervall umschlossen wird, das Konfidenzintervall also nicht repräsentativ für die Grundgesamtheit ist (SACHS 2003). Damit liegt die Wahrscheinlichkeit, die antimikrobielle Wirksamkeit einer Einzelstoffkonzentration oder Stoffkombination falsch einzuschätzen bei 5 %. Zusätzlich zur Keimzahl, die als Grundlage der statistischen Auswertung diente, wurde auch das Ergebnis der Messung der optischen Dichte zur qualitativen Einschätzung der antimikrobiellen Wirksamkeit herangezogen. Stimmen die Ergebnisse der mikrobiologischen Untersuchung und die Ergebnisse der Messung der optischen Dichte in ihrer Aussage bzgl. der antibakteriellen Wirksamkeit eines Einzelstoffes bzw. einer Stoffkonzentration überein, ist die Gefahr einer Fehleinschätzung gering. Weisen Trübungsmessung und statistische Auswertung der bestimmten Keimzahlen widersprüchliche Ergebnisse auf, ist eine korrekte Einschätzung der antimikrobiellen Wirksamkeit nicht sicher möglich. 5.1.7 Vergleichbarkeit der Ergebnisse Die Ergebnisse bzgl. der antimikrobiellen Aktivität von Gewürzen, ätherischen Ölen oder deren Einzelkomponenten sind aufgrund der unterschiedlichen Versuchsbedingungen oft schwer zu vergleichen (BAGAMBOULA et al. 2004). Je nach Zielsetzung der Studie werden bei den in Kapitel 2.3. beschrieben Methoden unterschiedliche Inkubationstemperaturen (4 – 37 °C ), unterschiedliche pH-Werte 155 5 Diskussion (4 – 8) und Expositionsdauern (Stunden bis Wochen) verwendet (HOLLEY u. PATEL 2005). Bei der Einschätzung der antimikrobiellen Wirksamkeit von Gewürzen und ätherischen Ölen führt die z.T. erheblich schwankende Zusammensetzung zu unterschiedlichen Ergebnissen (ZAIKA et al. 1988). Neben diesen Einflüssen gibt es zahlreiche weitere Faktoren, die sich auf die Ergebnisse einer Prüfung der antimikrobiellen Wirksamkeit eines ätherischen Öls oder einer Ölkomponente auswirken können. Zu diesen Faktoren gehören chemische und physikalische Eigenschaften des getesteten Agens, z.B. Flüchtigkeit, Hydrophobizität und Kompatibilität des Stoffs zu der angewendeten Methode sowie Gehalt an Stärke, Protein und Lipiden im verwendeten Medium (HAO et al. 1998, BURT 2004). Weiterhin wirkt sich die Empfindlichkeit der geprüften Bakteriengattung auf die antimikrobielle Wirksamkeit des Agens aus, wobei neben der Gattung auch Speziesund sogar Stammzugehörigkeit des Bakteriums, sowie Umgang mit der Bakterienkultur und Größe des Inokulums das Ergebnis entscheidend beeinflussen können (GILL et al. 2002, BAGAMBOULA et al. 2004). Daher ist nur ein eingeschränkt aussagekräftiger Vergleich der Ergebnisse dieser Arbeit mit den Ergebnissen anderer Autoren möglich. 5.2 Einzelstoffe In Übereinstimmung mit den Ergebnissen von Studien anderer Autoren zeigten Thymol und Carvacrol die stärkste antimikrobielle Wirksamkeit (COSENTINO et al. 1999, DORMAN u. DEANS 2000, BAGAMBOULA et al. 2004). Ebenso wie in einer Studie von DORMAN und DEANS (2000) war Thymol in seiner Wirksamkeit Carvacrol geringfügig überlegen. KIM et al. (1995) wiesen Carvacrol eine antibakterielle Wirkung gegenüber E. coli O157:H7 in einer Konzentration von 500 µg/ml nach. Im Gegensatz dazu hemmte Carvacrol in einer Studie von COSENTINO et al. (1999) E. coli O157:H7 bereits ab einer Konzentration von 225 ppm, Thymol hemmte E. coli O157:H7 ab einer Konzentration von 450 ppm. In der vorliegenden Arbeit wirkten Carvacrol und Thymol bereits ab 200 ppm antibakteriell gegenüber E. coli. Damit zeigte Carvacrol eine im Gegensatz zu den Ergebnissen der Studie von COSENTINO et al. (1999) 156 5 Diskussion bessere antimikkrobielle Wirksamkeit gegenüber E. coli und eine diesbezüglich gleichwertige Wirksamkeit von Thymol. Da verschiedene Stämme einer Bakterienart sich in ihrer Empfindlichkeit gegenüber ätherischen Ölen unterscheiden können (BAGAMBOULA et al. 2004), ist der beobachtete Unterschied vermutlich auf die Verwendung unterschiedlicher Stämme von E. coli zurückzuführen. Pseudomonas spp. erwiesen sich häufig als resistent gegenüber der antimikrobiellen Wirksamkeit ätherischer Öle (HOLLEY u. PATEL 2005). SIVROPOULOU et al. (1996) und COSENTINO et al. (1999) konnten Thymol und Carvacrol auch in Konzentrationen von 900 ppm keine antimikrobielle Wirkung gegenüber Ps. aeruginosa nachweisen. Im Gegensatz dazu wies Ps. fragi in der vorliegenden Arbeit eine größere Empfindlichkeit gegenüber Thymol und Carvacrol auf. Ps. fragi wurde bereits durch 100 ppm Thymol bzw. 200 ppm Carvacrol in seinem Wachstum gehemmt. Linalool entfaltete nach Thymol und Carvacrol die beste antibakterielle Wirksamkeit. Dieses Ergebnis steht im Gegensatz zu den Ergebnissen der Studien von DORMAN und DEANS (2000) und COSENTINO et al. (1999), die α-Terpineol im Vergleich zu Linalool als antimikrobiell wirksamer gegenüber den ausgewählten Bakterien einstuften. KIM et al. (1995) hingegen wiesen Linalool im Vergleich zu α-Terpineol eine bessere antimikrobielle Wirksamkeit gegenüber L. monocytogenes nach. Den größten antimikrobiellen Effekt erzielte Linalool in der vorliegenden Arbeit gegenüber A. hydrophila, gefolgt von B. thermosphacta. Ps. fragi und E. coli zeigten sich gegenüber Linalool weniger empfindlich. Insgesamt ist die antibakterielle Aktivität von Linalool als wesentlich schwächer im Vergleich zu derjenigen von Thymol oder Carvacrol einzustufen. So konnte Linalool auch von COSENTINO et al. (1999) nur eine moderate antibakterielle Wirksamkeit gegenüber E. coli und den Gram-positiven Keimen L. monocytogenes und St. aureus nachgewiesen werden. In einer Studie unter Verwendung der Agardiffusionsmethode hemmte Linalool das Wachstum von A. hydrophila und B. thermosphacta, erwies sich gegenüber Ps. fragi im Widerspruch zu den Ergebnissen dieser Arbeit als wirkungslos (WAN et al. 1998). 157 5 Diskussion α-Pinen wies im Vergleich zu 1,8-Cineol eine geringfügig bessere antimikrobielle Aktivität auf. 1,8-Cineol zeigte ein breiteres Wirkungsspektrum als α-Pinen, jedoch war die antibakterielle Wirksamkeit von α-Pinen gegenüber A. hydrophila und B. thermosphacta sehr viel stärker ausgeprägt, als die von 1,8-Cineol. Zudem war es aufgrund mangelnder Löslichkeit nicht möglich, die antimikrobielle Wirksamkeit von α-Pinen in ähnlich hohen Dosen wie 1,8-Cineol gegenüber Ps. fragi und E. coli zu testen. DORMAN und DEANS (2000) prüften die antibakterielle Aktivität von α-Pinen und 1,8-Cineol gegenüber 25 Bakterienarten. Dabei wies α-Pinen im Vergleich zu 1,8-Cineol ebenfalls eine bessere antimikrobielle Wirksamkeit auf. COX et al. (2002) prüften die antimikrobielle Wirksamkeit von 1,8-Cineol gegenüber Ps. aeruginosa, St. aureus und E. coli. Das Gram-positive Bakterium St. aureus zeigte sich dabei wesentlich empfindlicher gegenüber der antimikrobiellen Wirksamkeit von 1,8-Cineol als E. coli. Auch in der vorliegenden Arbeit wies das Gram-positive Bakterium B. thermosphacta eine größere Empfindlichkeit gegenüber der antimikrobiellen Wirksamkeit von 1,8-Cineol als E.coli auf. Im Gegensatz zu den Ergebnissen dieser Arbeit konnten DORMAN und DEANS (2000) α-Pinen keine antibakterielle Wirkung gegenüber B. thermosphacta und A. hydrophila nachweisen, jedoch zeigte α-Pinen in dieser Studie eine keimhemmende Wirkung gegenüber E. coli. CARSON et al. (2002) hingegen konnten ebenfalls keinen Einfluss von α-Pinen auf das Wachstum von E. coli feststellen. Im Widerspruch zu Ergebnissen von Studien anderer Autoren zeigte α-Terpineol in der vorliegenden Arbeit die geringste antimikrobielle Wirksamkeit. So konnten DORMAN und DEANS (2000) α-Terpineol eine antimikrobielle Wirksamkeit gegenüber E. coli, A. hydrophila, B. thermosphacta, Ps. aeruginosa sowie weiteren 21 der insgesamt 27 geprüften Bakterien, darunter Lb. plantarum, Y. enterocolitica, St. aureus und Proteus vulgaris nachweisen und stuften α-Terpineol nach Thymol und Carvacrol als die wirksamste Ölkomponente ein. Auch COSENTINO et al. (1999) konnten α-Terpineol eine antibakterielle Aktivität gegenüber E. coli und auch S. Typhimurium nachweisen, gegenüber Ps. fragi, Y. enterocolitica, St. epidermidis 158 5 Diskussion und L. monocytogenes blieb α-Terpineol jedoch wirkungslos. COSENTINO et al. (1999) schätzten α-Terpineol ebenfalls als wirksamsten Inhaltsstoff ätherischer Öle nach Thymol und Carvacrol ein. KIM et al. (1995) beobachteten hingegen eine vergleichsweise geringe antimikrobielle Wirksamkeit von α-Terpineol gegenüber den geprüften Bakterien (u.a. E. coli, L. monocytogenes) und stuften die Ölkomponenten Citral, Carvacrol, Geraniol und Eugenol als antimikrobiell wirksamer ein. Die sehr gering ausgeprägte bzw. fehlende antimikrobielle Aktivität von α-Terpineol in dieser Arbeit könnte auf die Verwendung von 0,5 % Tween80 zurückzuführen sein. Tween80 wurde bei Herstellung der Stammlösung zur Emulsion von α-Terpineol in der Nährlösung verwendet. Da α-Terpineol der Gruppe der Monoterpen-Alkohole zuzuordnen ist (ANGELINI et al. 2003), ist eine negative Beeinflussung der antibakteriellen Wirksamkeit durch die verwendete Menge Tween80 denkbar. So konnten DORMAN und DEANS (2000), die in ihrer Studie Tween80 nicht verwendeten, α-Terpineol ein wesentlich größeres Wirkungsspektrum nachweisen als KIM et al. (1995) und COSENTINO et al. (1999), die in ihrer Studie 0,5 % Tween80 bzw. 1 % Tween20 zur Emulsion von α-Terpineol verwendeten. Ebenso wie ihre beiden Hauptkomponenten Thymol und Carvacrol entfalten auch die Öle von Thymian und Oregano regelmäßig die beste antimikrobielle Wirksamkeit im Vergleich zu den ätherischen Ölen anderer Gewürzpflanzen (SMITH-PALMER et al. 1998, COSENTINO et al. 1999, HAMMER et al. 1999a, DORMAN u. DEANS 2000). Dabei ist die antibakterielle Aktivität der Öle stark von ihrem Gehalt an Thymol bzw. Carvacrol abhängig (ALIGIANNIS et al. 2001, PENALVER et al. 2005, BOZIN et al. 2006). Linalool kommt in größeren Mengen in Thymian vom Linalool-Typ vor und ist ein Hauptbestandteil des ätherischen Öls von Basilikum und Ylang-Ylang (BARATTA et al. 1998, THOMPSON et al. 2003, BOZIN et al. 2006). BOZIN et al. (2006) stellten eine im Vergleich zu Oregano-und Thymianöl etwas geringere antimikrobielle Wirksamkeit von Basilikumöl fest, wobei das Wirkungsspektrum dem von Thymianöl entsprach. BARATTA et al. (1998) verglichen die Wirksamkeit von Ylang-Ylang-Öl mit 14 % Linalool mit der Wirkung zweier Rosmarinöle, wobei eines der Rosmarinöle 41 % α-Pinen enthielt, das andere 47 % 1,8-Cineol. Ebenso wie die beiden 159 5 Diskussion Einzelkomponenten α-Pinen und 1,8-Cineol in der vorliegenden Arbeit waren die beiden Rosmarinöle in ihrer antibakteriellen Wirksamkeit insgesamt gleichwertig. Zudem waren die Rosmarinöle bzgl. ihrer antimikrobiellen Aktivität dem Öl von Ylang-Ylang überlegen, was vermutlich auf den verhältnismäßig geringen Gehalt an Linalool zurückzuführen ist. Lorbeeröl enthält bis zu 61 % 1,8-Cineol, α-Pinen ist bis zu einem Anteil von 34 % in Rosmarinöl zu finden und α-Terpineol ist bis zu einem Anteil von 7 % in Majoranöl enthalten (KOMAITIS et al. 1992, DADALIOĞLU et al. 2004, ANGIONI et al. 2004). Entsprechend den Ergebnissen der Prüfung der antibakteriellen Eigenschaften von 1,8-Cineol, α-Pinen und α-Terpineol zeigte Lorbeeröl eine bessere antimikrobielle Wirksamkeit als Rosmarin- und Majoranöl (SMITH-PALMER et al. 1998, HAMMER et al. 1999a). Alle geprüften Einzelkomponenten ätherischer Öle zeigten in der niedrigsten geprüften Konzentration keinen antibakteriellen Effekt gegenüber den ausgewählten Lebensmittelverderbniserregern. Die für eine Hemmwirkung erforderlichen Konzentrationen lagen deutlich über denjenigen, die bei Zusatz einer zu Würzzwecken üblichen Menge von 1 g/kg Thymian, 0,5 g/kg Oregano, 2 g/kg Lorbeer, 2 g/kg Rosmarin oder 3 g/kg Majoran erreicht werden können. Gegenüber der antimikrobiellen Wirkung der Einzelkomponenten ätherischer Öle war A. hydrophila am empfänglichsten, gefolgt von B. thermosphacta, E. coli und Ps. fragi. Die im Vergleich zu der Empfindlichkeit der Gram-positiven Spezies B. thermosphacta größere Empfindlichkeit der Gram-negativen Spezies A. hydrophila gegenüber den Einzelkomponenten ätherischer Öle steht im Widerspruch zu Ergebnissen einiger Studien, in denen Gram-negative Keime deutlich resistenter waren (WAN et al. 1998, DORMAN u. DEANS 2000, LAMBERT et al. 2001). Andererseits wiesen in Studien anderer Autoren Gram-positive Keime eine geringere Empfindlichkeit gegenüber ätherischen Ölen auf (KIM et al. 1995, QUATTARA et al. 1997). 160 5 Diskussion 5.3 Stoffkombinationen Um mögliche synergistische oder antagonistische Effekte zwischen den eingangs geprüften Einzelkomponenten ätherischer Öle entdecken zu können, wurden unterschiedliche Konzentrationen der Ölkomponenten miteinander kombiniert und ihre antibakterielle Wirksamkeit gegenüber den ausgewählten Mikroorganismen untersucht. Während die antimikrobielle Wirksamkeit für Einzelkomponenten bereits in einigen Studien untersucht wurde, finden sich in der Literatur nur sehr wenige Informationen über Wechselwirkungen zwischen den Inhaltsstoffen ätherischer Öle und deren Auswirkungen auf die antimikrobielle Wirksamkeit (HOLLEY u. PATEL 2005). Thymol und Carvacrol wiesen bzgl. ihrer antimikrobiellen Wirksamkeit gegenüber allen geprüften Bakterien einen synergistischen Effekt auf. In Übereinstimmung mit diesem Ergebnis stellten auch BURT et al. (2005) und LAMBERT et al. (2001) einen synergistischen antimikrobiellen Effekt zwischen Thymol und Carvacrol fest, als sie die antibakterielle Wirksamkeit dieser Kombination gegenüber E. coli, St. aureus und Ps. aeruginosa prüften. Auch in weiteren Studien wurde eine Abhängigkeit der antimikrobiellen Wirksamkeit von Oregano - und Thymianöl von ihrem Gehalt an Thymol und Carvacrol festgestellt. Öle mit einem hohen Phenolgehalt, d.h. mit einem hohen Gehalt an Thymol und Carvacrol waren dabei antimikrobiell wirksamer, als Öle mit einem geringerem Phenolgehalt (ADAM et al. 1998, BOZIN et al. 2006). Im Vergleich zu den anderen geprüften Bakterien erwies sich Ps. fragi gegenüber der der antibakteriellen Wirkung der Kombination von Thymol und Carvacrol als relativ unempfindlich. Lediglich die Kombination 100 ppm Thymol und 100 ppm Carvacrol zeigte eine synergistische antibakterielle Aktivität gegenüber Ps. fragi. In Übereinstimmung mit diesem Ergebnis ist für die Hemmung von Ps. aeruginosa eine höher konzentrierte Kombination von Thymol und Carvacrol nötig, als für die Hemmung von St. aureus (LAMBERT et al. 2001). Insgesamt war die Kombination von Thymol und Carvacrol die bezüglich ihrer Hemmwirkung erfolgreichste Stoffkombination. Gegenüber A. hydrophila und B. thermosphacta trat eine signifikante Hemmwirkung auch in der Kombination 161 5 Diskussion 40 ppm Thymol mit einer sensorisch akzeptablen Menge Carvacol und einer die sensorisch noch akzeptable Menge nur um das 10-fache übertreffenden Menge Thymol auf. Thymol und Linalool sowie Carvacrol mit Linalool wirkten dosisabhängig gegenüber jeder der geprüften Bakterienarten synergistisch bezüglich ihrer antibakteriellen Aktivität. Ein antagonistischer Effekt war nur bei Kombination von 4 ppm Thymol mit 360 ppm Linalool gegenüber A. hydrophila feststellbar. Die größte Steigerung der antimikrobiellen Wirksamkeit durch Kombination von Thymol bzw. Carvacrol mit Linalool konnte gegenüber E. coli verzeichnet werden. SIVROPOULOU et al. (1999) vermuteten ebenfalls einen synergistischen Effekt zwischen dem Phenolanteil von Oreganoöl und Linalool. So wies eines der drei geprüften Oreganoöle trotz eines Phenolgehalts von nur 32 % eine ebenso gute Hemmwirkung gegenüber St. aureus, S. Typhimurium, Ps. aeruginosa und B. subtilis auf, wie die beiden übrigen Oreganöle mit einem Phenolgehalt von 80 % bzw. 60 %. Ursache für die gute Wirksamkeit des Oreganoöls mit dem geringen Gehalt an Phenolen könnte der im Vergleich zu den beiden anderen Ölen hohe Anteil an Linalool und α-Terpineol und damit verbundene synergistische Effekte sein. Thymol und 1,8-Cineol entfalteten gegenüber A. hydrophila, E. coli und B. thermosphacta dosisabhängig einen synergistischen Effekt, gegenüber Ps. fragi konnte keine wechselseitige Beeinflussung festgestellt werden. Im Gegensatz dazu führte 1,8-Cineol in Kombination mit Carvacrol zu einer Steigerung der antimikrobiellen Aktivität gegenüber Ps. fragi. Antagonistische Effekte wurden nicht beobachtet. Thymol und 1,8-Cineol weisen neben dem synergistisch antibakteriellen Effekt auch einen synergistisch antimykotischen Effekt auf (PINA-VAZ et al. 2004). Thymol und α-Pinen wirkten in Abhängigkeit ihrer Konzentration synergistisch antibakteriell gegenüber A. hydrophila, E. coli und B. thermosphacta, gegenüber Ps. fragi wurde keine wechselseitige Beeinflussung der keimhemmenden Wirkung festgestellt. Die Kombination von Carvacrol und α-Pinen verursachte bezüglich der antibakteriellen Wirksamkeit einen synergistischen Effekt gegenüber E. coli und Ps. fragi, gegenüber A. hydrophila jedoch einen antagonistischen Effekt. 162 5 Diskussion In Übereinstimmung mit dem beobachteten Antagonismus zwischen Carvacrol und α-Pinen wiesen ein ätherisches Öl von Thymus capitatus und ein ätherisches Öl von Thymus herba barona trotz ähnlichem Gehalt Phenolen eine unterschiedliche Wirksamkeit gegenüber dem Gram-positiven Bakterium L. monocytogenes auf (COSENTINO et al. 1999). Das Öl von Thymus herba barona mit einem Anteil von nur 2 % α-Pinen wirkte in deutlich geringeren Mengen antimikrobiell gegenüber L. monocytogenes, als das Öl von Thymus capitatus mit einem Gehalt von 25 % α-Pinen. Thymol bzw. Carvacrol und α-Terpineol hemmten in Abhängigkeit von ihrer Konzentration synergistisch das Wachstum von A. hydrophila, E. coli und Ps. fragi. In Übereinstimmung mit diesem Ergebnis zogen BIONDI et al. (1993) in ihrer Studie ebenfalls einen synergistischen Effekt zwischen α-Terpineol und Carvacrol als mögliche Ursache für die gute antimikrobielle Wirksamkeit eines Oreganoöls mit geringem Gehalt an Carvacrol in Betracht. Die gemeinsame Anwendung von Thymol bzw. Carvacrol und α-Terpineol verursachte in der vorliegenden Arbeit eine Abnahme der antimikrobiellen Aktivität gegenüber B. thermosphacta. UPMANN et al. (2001) untersuchten die antimikrobielle Wirksamkeit von Majoran in Hackfleisch und stellten dabei bei der Trübungsmessung einen wachstumsfördernden Einfluss gegenüber B. thermosphacta fest. Da Thymol und α-Terpineol Bestandteil des ätherischen Öl von Majoranöl sind (DAFERERA et al. 2000), spielt bei Entstehung dieses Effekts möglicherweise die Aufhebung der antimikrobiellen Wirksamkeit von Thymol durch α-Terpineol eine Rolle. Insgesamt führte die Kombination der Einzelkomponenten insbesondere bei E. coli, aber auch bei Ps. fragi zur größten Steigerung der antimikrobiellen Eigenschaften. Antagonistische Effekte hinsichtlich der antibakteriellen Wirksamkeit wurden vor allem bei B. thermosphacta beobachtet, seltener auch bei A. hydrophila. So führte die Kombination von Thymol und α-Pinen, Carvacrol und 1,8-Cineol, Carvacrol und α-Pinen sowie Carvacrol und α-Terpineol dosisabhängig zu einer Abschwächung der Hemmwirkung gegenüber B. thermosphacta im Vergleich zur Wirksamkeit der Einzelstoffe. Gegenüber A. hydrophila entfalteten die Kombination von 10 ppm 163 5 Diskussion Thymol mit 360 ppm Linalool, 2 ppm Carvacrol und 360 ppm Linalool sowie alle getesteten Kombinationen von Carvacrol und α-Pinen einen antagonistischen Effekt bezüglich ihrer antimikrobiellen Wirksamkeit 5.4 Bedeutung der Ergebnisse für die Einschätzung der antimikrobiellen Wirksamkeit von Gewürzen Ätherische Öle enthalten neben ihren Hauptkomponenten, die bis zu 85 % des ätherischen Öls ausmachen können, ca. 60 weitere Komponenten. Da Gewürze eine bessere antimikrobielle Aktivität besitzen als Gewürzextrakte und ätherische Öle bessere keimhemmende Wirkung aufweisen, als ihre isolierten Hauptkomponenten, scheinen die Nebenkomponenten für die antimikrobielle Wirksamkeit eines Gewürzes bzw. dessen ätherischen Öls ebenfalls bedeutsam zu sein (SHELEF 1983; LACHOWICZ et al. 1998, BURT et al. 2004). In der eigenen Studie wurden jedoch jeweils nur zwei Inhaltstoffe ätherischer Öle miteinander kombiniert, um mögliche synergistische oder antagonistische Einflüsse ohne Beeinflussung durch weitere Ölkomponentenzu erkennen. Die Ergebnisse erlauben daher Rückschlüsse auf die antimikrobielle Wirksamkeit von Gewürzen nur bei Kenntnis ihrer Menge und Zusammensetzung. Ätherische Öle oder Kombinationen ätherischer Öle mit einem niedrigen Gehalt an Thymol oder Carvacrol und gleichzeitig hohem Gehalt an α-Terpineol oder α-Pinen führen möglicherweise zu einer Abschwächung der antimikrobiellen Wirksamkeit gegenüber B. thermosphacta. Dies gilt auch hinsichtlich der antimikrobiellen Wirksamkeit gegenüber A. hydrophila für Gewürzöle, die einen geringen Anteil Thymol und eine hohen Gehalt an α-Pinen aufweisen. Gewürze bzw. Gewürzmischungen, die über einen hohen Anteil Thymol bzw. Carvacrol und 1,8-Cineol, Linalool, α-Pinen oder α-Terpineol verfügen, wirken vermutlich besser keimhemmend gegenüber E. coli und Ps. fragi, als solche mit einem geringen Anteil an diesen Stoffen. Öle mit einer hohen Konzentration Thymol bzw. Carvacrol bei gleichzeitig hohem Anteil an Linalool, 1,8-Cineol oder α-Terpineol sind gegenüber A. hydrophila wahrscheinlich besser wirksam, als Gewürze bzw. deren Öle mit geringem Gehalt an diesen Stoffen. Gewürze, die eine große Menge 164 5 Diskussion Thymol bei gleichzeitig hohem Gehalt an Linalool oder 1,8-Cineol oder eine große Menge Carvacrol und Linalool aufweisen, entfalten möglicherweise eine gute Hemmwirkung gegenüber B. thermosphacta. Thymol und Carvacrol wiesen bereits in verhältnismäßig geringen Mengen in Kombination miteinander die besten antibakteriellen Eigenschaften auf. Daher ist anzunehmen, dass Gewürze bzw. Kombinationen von Gewürzen mit einem hohen Anteil der beiden Phenole im ätherischen Öl eine bessere antibakterielle Wirksamkeit gegenüber A. hydrophila, E. coli, B. thermosphacta und Ps. fragi entfalten, als Gewürze bzw. Gewürzkombinationen mit einem geringen Anteil an Thymol und Carvacrol. 5.5 Einschätzung der zu erwartenden antimikrobiellen Wirksamkeit von Gewürzen in Lebensmitteln Die Ergebnisse zeigten, dass weder bei alleiniger Anwendung der geprüften Ölkomponenten, noch bei den geprüften Kombinationen der Ölkomponenten eine Hemmwirkung in einer Stoffkonzentration erzielt wurde, wie sie durch Zugabe einer zu Würzwecken üblichen Menge von 1 g Thymian, 0,5 g Oregano, 2 g Rosmarin, 2 g Lorbeer oder 3 g Majoran je kg Lebensmittel erreicht werden kann. Auch die bei den Kombinationen von Linalool, 1,8-Cineol, α-Pinen und α-Terpineol mit Thymol bzw. Carvacrol beobachteten synergistischen Effekte waren nicht ausreichend, um eine Hemmwirkung in einer sensorisch akzeptablen Konzentration beider Stoffe zu erzielen. Dabei war die Kombination von Thymol und Carvacrol am besten wirksam. Die zur Hemmung von A. hydrophila und B. thermosphacta nötige Menge an Thymol überschritt das sensorisch vertretbare Maß um das 10-fache, die Menge Carvacrol hingegen überschritt das vertretbare Maß nicht. Gegenüber E.coli war die Kombination von 40 ppm Thymol und 20 ppm Carvacrol wirksam, beide Stoffe überschritten die geschmacklich vertretbare Menge folglich um das 10-fache. Gegenüber verschiedenen Lebensmittelinfektions- und –intoxikationserregern lagen die für eine Keimhemmung benötigten Konzentrationen von Thymol, Carvacrol, Linalool, 1,8-Cineol, α-Pinen und α-Terpineol ebenfalls deutlich über einer in Lebensmitteln sensorisch vertretbaren Konzentration. So waren zur Hemmung von 165 5 Diskussion Y. enterocolitica 225 ppm Thymol bzw. Carvacrol nötig, L. monocytogenes wurde durch 450 ppm Thymol oder 500 ppm Carvacrol in seinem Wachstum gehemmt (KIM et al. 1995, COSENTINO et al. 1999). Damit scheint die Gram-positive Spezies L. monocytogenes weitaus resistenter zu sein, als die in dieser Arbeit geprüfte, ebenfalls Gram-positive Spezies B. thermosphacta. Bacillus cereus erwies sich als relativ unempfindlich gegenüber der antimikrobiellen Wirkung von Carvacrol. Für eine Hemmung dieses Bakteriums waren 900 ppm Carvacrol nötig (COSENTINO et al. 1999). Linalool konnte erst in Mengen von 900 – 1000 ppm gegenüber Y. enterocolitica, B. cereus, S. Typhimurium und St. aureus eine Hemmwirkung entfalten (KIM et al. 1995). α-Terpineol zeigte ab einer Konzentration von 225 ppm eine keimhemmende Wirkung gegenüber S. Typhimurium und ab einer Konzentration von 250 ppm gegenüber St. aureus (COSENTINO et al. 1999, CARSON et al. 2002). Folglich scheint auch eine Hemmung von anderen als den in dieser Studie verwendeten Bakterien durch eine zu Würzzwecken üblichen Menge Thymian, Oregano, Rosmarin, Lorbeer oder Majoran in Lebensmitteln nicht möglich zu sein. Zur Einschätzung derjenigen Konzentration der Ölkomponente, die auch durch Zugabe einer üblichen Menge des entsprechenden Gewürzes zu Lebensmitteln erreicht werden kann, wurden die in Tabelle 4 und 5 genannten Parameter herangezogen. Dabei wurden jeweils der höchste Gehalt an ätherischem Öl im Gewürz, der höchste Gehalt der jeweiligen Einzelkomponente und die größte Menge des Gewürzes im Lebensmittel angenommen. Die Angaben über die Menge an ätherischem Öl im Gewürz beziehen sich bis auf die Angabe der Menge von Carvacrol in Oregano auf die frische, intakte Pflanze. Zur Aromatisierung von Lebensmitteln werden Gewürze jedoch häufig in getrockneter sowie gemahlener oder gerebelter Form verwendet. Die mechanische Verarbeitung der Gewürzpflanze, z.B. durch Mahlen, führt zu einem Verlust an ätherischem Öl (UPMANN u. NOVAK 2001). Daher ist der tatsächliche Gehalt von Thymol, Linalool, 1,8-Cineol, α-Pinen und α-Terpineol nach Zugabe Oregano, Thymian, Rosmarin, Lorbeer oder Majoran zwecks Aromatisierung des Lebensmittels wahrscheinlich deutlich geringer, als der in dieser Arbeit angenommene Gehalt. 166 5 Diskussion Eine Übertragung der vorliegenden in vitro gewonnenen Ergebnisse bezüglich der antimikrobiellen Wirksamkeit der Einzelkomponenten bzw. ihrer Kombinationen auf Lebensmittel ist nur eingeschränkt möglich. Die Anwesenheit von Fett, Kohlehydraten, Proteinen, Salz, ein geringer aw-Wert und ein hoher pH-Wert führen zu einer Abnahme der antimikrobiellen Wirksamkeit von Gewürzen und deren ätherischen Ölen (HOLLEY u. PATEL 2005). Daher ist je nach Lebensmittel die 10fache bis 100-fache Menge an ätherischem Öl nötig, um im Lebensmittel die gleiche antimikrobielle Wirksamkeit wie unter in vitro Bedingungen zu erreichen (SHELEF 1983, PANDIT u. SHELEF 1994, MENDOZA-YEPES et al. 1997). Eine Haltbarkeitsverlängerung von Lebensmitteln durch alleinige oder kombinierte Anwendung von Thymian, Oregano, Rosmarin, Lorbeer oder Majoran in sensorisch akzeptablen Mengen scheint daher nicht möglich zu sein. Denkbar wäre allerdings ein Einsatz von Gewürzen im Rahmen des Hürdenprinzips (BAGAMBOULA et al. 2004). 5.6 Kombination von Gewürzen und anderen Verfahren zur Haltbarmachung von Lebensmitteln 5.6.1 Gewürze und Schutzkulturen Der Nutzen bestimmter Bakterien hinsichtlich einer positiven geschmacklichen Beeinflussung bei gleichzeitiger Verlängerung der Haltbarkeit von Lebensmitteln ist seit langer Zeit bekannt. In Europa beträgt der Anteil an fermentierten Lebensmitteln am Speiseplan ca. 25 %. Insbesondere Laktobazillen führen durch ihren Stoffwechsel zu einer positiven Beeinflussung des Geschmacks sowie zu einer Verlängerung der Haltbarkeit von Lebensmitteln und werden daher häufig als Starterund Schutzkulturen verwendet (HOLZAPFEL et al. 1995). Schutzkulturen können zugleich als Starterkulturen für den Fermentationsprozess dienen, wie es etwa bei der Herstellung von Rohwürsten der Fall ist (TYÖPPÖNEN et al. 2003). Andererseits können sie zur Haltbarkeitsverlängerung von Lebensmitteln eingesetzt werden, ohne nachteilige organoleptische Veränderungen im Lebensmittel zu verursachen (TYÖPPÖNEN et al. 2003). Die konservierenden Eigenschaften der Laktobazillen 167 5 Diskussion beruhen vor allem auf der Produktion von Säuren, Wasserstoffperoxid, Enzymen, Metaboliten mit geringem Molekulargewicht (z.B. Fettsäuren, Diacetyl) und Bacteriocinen (HOLZAPFEL et al. 1995, HUGAS 1998). Durch die Produktion von Milchsäure oder Essigsäure wird eine Absenkung des pH-Werts hervorgerufen. Ebenso wie herkömmliche Konservierungsstoffe erfahren ätherische Öle bzw. deren Inhaltsstoffe bei niedrigen pH-Werten eine Steigerung ihrer antimikrobiellen Aktivität (BRUL u. COOTE 1999, BURT et al. 2004). Daher könnte eine Kombination von bioprotektiven Milchsäurebakterien und Gewürzen bzw. ätherischen Ölen zu einem synergistischen antimikrobiellen Effekt und damit zu einer Verringerung der für eine Keimhemmung nötigen Menge des Gewürzes führen. DIMITRIJEVIĆ et al. (2007) kombinierten subletale Mengen Milchsäure mit unterschiedlichen Konzentrationen an Thymian- Rosmarin- oder Oreganoöl und untersuchten die antibakterielle Wirksamkeit dieser Kombinationen gegenüber L. monocytogenes. Die geprüften Öle, insbesondere das Öl von Rosmarin gefolgt vom Thymianöl, hemmten nach Zugabe der Milchsäure das Wachstum von L. monocytogenes deutlich besser, als bei alleiniger Anwendung. Die verwendeten Öle von Rosmarin, Thymol und Oregano enthielten größere Mengen Thymol, Carvacrol, 1,8-Cineol und α-Pinen, so dass auch bei Kombination der Einzelkomponenten mit Milchsäure eine synergistische Wirksamkeit zu erwarten ist. Weiterhin sind synergistische antimikrobielle Effekte zwischen ätherischen Ölen bzw. deren Inhaltsstoffen und den von einigen Lactobazillen produzierten Bacteriocinen möglich. Der Mechanismus der antibakteriellen Wirksamkeit von Phenolen wie Carvacrol und Thymol beruht auf Störung der Permeabilität der Zellmembran sowie auf einer Ausschaltung der Protonenpumpe (BURT 2004). Auch die Bacteriocine Nisin und Pediocin JD wirken durch Störung der Zellmembran sowie Ausschalten der Protonenpumpe bakterizid gegenüber Bakterien, wobei sich das Wirkungsspektrum auf Gram-positive Keime beschränkt (TAGG et al. 1976, BRUNO u. MONTVILLE 1993). Die Kombination von 450 ppm Carvacrol bzw. 450 ppm Thymol mit 0,15 ppm Nisin führte gegenüber B. cereus zu einer stärkeren Reduktion der Keimzahl, als bei alleiniger Anwendung der beteiligten Stoffe (PERAGIO et al. 2001). Die in Kombination mit Nisin verwendete Menge Carvacrol bzw. Thymol lag auch in 168 5 Diskussion dieser Studie um das 50 bis 100-fache über der in der vorliegenden Arbeit berechneten sensorisch akzeptablen Menge. B. cereus gehört jedoch zu den gegenüber der Hemmwirkung von Thymol und Carvacrol verhältnismäßig resistenten Keimen (COSENTINO et al. 1999). Daher ist der synergistische Effekt gegenüber dem Gram-positiven Keim B. thermosphacta, der sich in dieser Arbeit als verhältnismäßig empfindlich gegenüber der Hemmwirkung von Thymol und Carvacrol erwies, möglicherweise wesentlich stärker ausgeprägt. Insgesamt wird die kombinierte Anwendung von Schutzkulturen und Gewürzen, ätherischen Ölen sowie deren Einzelkomponenten durch deren antibakterielle Wirksamkeit gegenüber den Schutzkulturen limitiert. Allerdings gehören Laktobazillen zu den gegenüber der antibakteriellen Aktivität von ätherischen Ölen weniger empfindlichen Keimen (HOLLEY u. PATEL 2005), so dass die gemeinsame Anwendung von Gewürzen und Schutzkulturen mit dem Ziel einer Haltbarkeitsverlängerung von Lebensmitteln einen interessanten Ansatz für weitere Untersuchungen darstellt. 5.6.2 Gewürze und konservierende Zusatzstoffe Zu den am häufigsten genutzten Konservierungsstoffen gehören schwache organische Säuren wie Benzoesäure, Benzoat-Ester (Parabene) Sorbinsäure und anorganische Säuren wie Nitrite und Sulphite (GOULD, 1996). FYFE et al. (1998) untersuchten die antibakterielle Wirksamkeit der Konservierungsstoffe Benzoesäure und Methylparaben gegenüber S. Enteritidis und L. monocytogenes alleine sowie in Kombination mit dem ätherischen Öl von Fenchel, Anis und Basilikum. Während Methylparaben und Benzoesäure nach 48 Stunden keine Hemmwirkung gegenüber L. moncytogenes und S. Enteritidis entfalteten, führten die Kombinationen von Fenchelöl und Benzoesäure bzw. Methylparaben sowie die Kombination von Anis mit Methylparaben zu einer Reduktion der Keimzahl um ca. 6,0 lg KbE/ml im Vergleich zur Kontrolle. Als mögliche Ursache für die bessere Hemmwirkung der Kombinationen mit Fenchelöl sahen FYFE et al. (1998) den im Vergleich zum Anisöl und Basilikumöl hohen Gehalt an α-Pinen im Fenchelöl an. Eine ähnliche Beobachtung machten HODGSON et al. (1998), die einen 169 5 Diskussion Steigerung der schwach ausgeprägten antibakteriellen Wirksamkeit von Methylparaben gegenüber E. coli und St. aureus durch Kombination mit Fenchelöl feststellten. Da auch Rosmarin über nennenswerte Mengen an α-Pinen verfügt, wäre eine Steigerung der antimikrobiellen Aktivität bei Kombination von Rosmarin und Methylparaben gegenüber L. monocytogenes, S. Enteritidis, E. coli und St. aureus ebenfalls möglich. In der vorliegenden Arbeit zeigte α-Pinen bei alleiniger Anwendung auch in der höchsten geprüften Konzentration von 1200 ppm keine Wirksamkeit gegenüber E. coli und Ps. fragi, hemmte jedoch das Wachstum von B. thermosphacta in einer Menge von 400 ppm. Möglicherweise könnte durch Kombination von α-Pinen mit Methylparaben oder Benzoesäure eine hemmende Wirkung gegenüber E. coli oder Ps. fragi erzielt werden, sowie eine Hemmwirkung gegenüber B. thermosphacta in einer deutlichen geringeren α-Pinen-Konzentration. Durch gemeinsame Anwendung von Natriumnitrit und Oreganoöl konnte eine Hemmwirkung gegenüber Cl. botulinum erzielt werden, während Oreganoöl auch in einer Menge von 400 ppm keine antimikrobielle Wirksamkeit gegenüber Cl. botulinum aufwies (ISMAIEL u. PIERSON, 1990). Der synergistische Effekt beruht wahrscheinlich auf einer Reduktion der Sporen durch das Oreganoöl sowie auf einer Unterdrückung des Auskeimens der verbliebenen Sporen durch Nitrit (ISMAIEL u. PIERSON 1990). Ein ähnlicher Effekt könnte auch bei der gemeinsamen Anwendung von Carvacrol, der Hauptkomponente des ätherischen Öls von Oregano, auftreten. Ebenso wie Carvacrol ist auch Thymol den Phenolen zuzuordnen, weshalb ein ähnlicher Wirkungsmechanismus zu erwarten ist. Folglich könnte auch Thymianöl bzw. Thymol in Kombination mit Nitrit zu einer Hemmung von Cl. botulinum führen. ULTEE et al. (2000b) stellten zwischen Kochsalz, Sojasauce, Carvacrol und p-Cymen einen antagonistischen Effekt hinsichtlich der antibakteriellen Aktivität gegenüber B. cereus in Reis fest. Carvacrol und p-Cymen hemmten synergistisch das Wachstum von B. cereus, jedoch wurde dieser Effekt durch Zugabe von 1,25 g 170 5 Diskussion Kochsalz je kg Reis aufgehoben. Derselbe Effekt wurde auch bei Zugabe von Sojasauce, welche sehr salzhaltig ist, beobachtet. In Bezug auf die Ergebnisse der vorliegenden Arbeit bedeutet dies, dass die bei Kombination von Carvacrol und Linalool, 1,8-Cineol, Thymol, α-Pinen und α-Terpineol festgestellten synergistischen Effekte in Anwesenheit von Kochsalz vermindert oder aufgehoben werden könnten. Da Carvacrol in Kombination mit Thymol und in Kombination mit Linalool häufig in Thymian vorkommt, könnte auch die antimikrobielle Wirksamkeit von Thymian bzw. Thymianöl durch Zugabe von Kochsalz verschlechtert werden. 5.6.3 Gewürze und physikalische Verfahren zur Haltbarmachung Von den physikalischen Verfahren zur Verlängerung der Haltbarkeit von Lebensmitteln wirken unter anderem eine Reduktion von Sauerstoff in der Atmosphäre und Hochdruckbehandlung in Kombination mit ätherischen Ölen bzw. deren Einzelkomponenten synergistisch antimikrobiell (GOULD 1996). Die antimikrobielle Aktivität von ätherischen Ölen ist unter anderem von der Menge an verfügbarem Sauerstoff in der Atmosphäre abhängig. So stellten PASTER et al. (1990) eine stark verbesserte keimhemmende Wirksamkeit von Oregano-und Thymianöl gegenüber S. Typhimurium bei geringem Gehalt an Sauerstoff in der Atmosphäre fest. In Vakuum verpacktem Fleisch wirkte Oreganoöl deutlich stärker antimikrobiell gegenüber L. monocytogenes als unter Einfluss von Sauerstoff (TSIGARIDA et al. 2000). Zur Hemmung von L. monocytogenes müssen gewöhnlich größere Mengen Carvacrol eingesetzt werden, als für eine Hemmung von B. thermosphacta in der vorliegenden Arbeit nötig waren. Daher ist zu erwarten, dass der die Verderbnisflora von vakuumverpacktem Fleisch dominierende Keim B. thermosphacta im Vakuum bereits durch geringere als die in dieser Arbeit ermittelten Mengen an Carvacrol in seinem Vermehrung gehemmt wird. Ähnliches gilt auch für Thymol, Carvacrol und Hochdruckbehandlung. So führte eine gemeinsame Anwendung von Thymol bzw. Carvacrol und einer Hochdruckbehandlung bei 300 MPa zu einer stärkeren Hemmung des Wachstums 171 5 Diskussion von L. monocytogenes als bei alleiniger Anwendung. Ursache für den synergistischen Effekt ist anscheinend ein Vorschädigung der Zellmembran der Bakterien infolge der Druckeinwirkung (KARATZAS et al. 2001). 172 6 Schlussfolgerungen 6 Schlussfolgerungen 1. Thymol und Carvacrol sind die antimikrobiell wirksamsten Einzelkomponenten ätherischer Öle, gefolgt von Linalool, α-Pinen, 1,8-Cineol und α-Terpineol in dieser Reihenfolge. 2. Die für eine Hemmwirkung erforderlichen Konzentration einer Einzelkomponente ätherischer Öle liegen in jedem Fall deutlich über denjenigen, die bei Zusatz einer üblichen Menge des entsprechenden Gewürzes zu Lebensmitteln erreicht werden können. 3. Viele der geprüften Stoffkombinationen weisen einen synergistischen Effekt hinsichtlich ihrer antimikrobiellen Aktivität gegenüber den ausgewählten Bakterien auf, so dass die zur Keimhemmung erforderliche Konzentration eines oder beider Stoffe deutlicher niedriger liegt als bei alleiniger Anwendung der beteiligten Komponenten. Trotzdem überschreitet die zur Keimhemmung nötige Menge eines oder beider Stoffe in jedem Fall die Menge, die bei Zusatz des entsprechenden Gewürzes oder durch Kombination zweier Gewürze im Lebensmittel erreicht wird. 4. Es kann angenommen werden, dass ein hoher Gehalt von 1,8-Cineol, α-Pinen oder α-Terpineol bei gleichzeitig geringem Anteil an Thymol oder Carvacrol die Wirksamkeit des Gewürzes gegenüber B. thermosphacta vermindert. Gewürze, deren Öl einen hohen Anteil an α-Pinen und einen geringen Gehalt an Carvacol aufweist, sind möglicherweise weniger gut wirksam gegen A. hydrophila als Gewürze, deren Öl nur wenig α-Pinen enthält. 5. Gewürze, deren ätherisches Öl einen hohen Gehalt an Thymol und Carvacrol verfügt über bessere antimikrobielle Eigenschaften, als solche mit einem geringen Phenolgehalt. 6. Gewürze bzw. Gewürzmischungen, die einen hohen Anteil Thymol bzw. Carvacrol und 1,8-Cineol, Linalool, α-Pinen oder α-Terpineol besitzen vermutlich eine bessere antibakterielle Wirksamkeit gegenüber E. coli und Ps. fragi, als 173 6 Schlussfolgerungen solche mit einem geringen Anteil an diesen Stoffen. Gegenüber A. hydrophila sind Öle mit einer hohen Konzentration Thymol bzw. Carvacrol bei gleichzeitig hohem Anteil an Linalool, 1,8-Cineol oder α-Pinen gut wirksam im Vergleich zu Ölen mit geringem Gehalt an diesen Stoffen. B. thermosphacta wird möglicherweise besser gehemmt durch Gewürze, die eine große Menge Thymol bei gleichzeitig hohem Gehalt an Linalool oder 1,8-Cineol oder eine große Menge Carvacrol und Linalool aufweisen. 7. Insgesamt führt die Kombination der Einzelkomponenten gegenüber E. coli und Ps. fragi zur größten Steigerung der antimikrobiellen Wirksamkeit. Bei B. thermosphacta führten fünf der neun getesteten Stoffkombinationen zu einer Abnahme der antimikrobiellen Wirksamkeit. 8. Eine Haltbarkeitsverlängerung durch alleinigen Einsatz von Gewürzen, insbesondere Thymian, Oregano, Rosmarin, Lorbeer und Majoran in sensorisch akzeptablen Mengen erscheint wenig aussichtsreich. Auch durch Kombination von Thymian bzw. Oregano mit Rosmarin, Lorbeer und Majoran sowie durch die Kombination von Thymian und Oregano in zu Würzzwecken üblichen Mengen kann keine Haltbarkeitsverlängerung erwartet werden. Der Einsatz von Gewürzen im Rahmen des Hürdenprinzips ist jedoch denkbar 174 7 Zusammenfassung 7 Zusammenfassung Christiane Rüben: Antimikrobielle Wirksamkeit von chemischen Einzelkomponenten ätherischer Öle gegenüber ausgewählten Lebensmittelverderbniserregern Durch natürliche Zusätze konservierte Lebensmittel erfreuen sich aufgrund der kritischen Haltung des Verbrauchers gegenüber chemisch-synthetischen Lebensmittelzusätzen bei gleichzeitig wachsender Bedeutung einer möglichst langen Haltbarkeit zunehmender Beliebtheit. Da viele Gewürze und Kräuter neben ihren aromatisierenden Eigenschaften auch über eine antimikrobielle Wirksamkeit verfügen, wurden sie als Alternative zu herkömmlichen Konservierungsstoffen interessant. Das Ausmaß der antibakteriellen Aktivität der Gewürze hängt jedoch stark von der Menge und Zusammensetzung ihres ätherischen Öls ab, die zum Teil erheblichen Schwankungen unterworfen ist. Ihre keimhemmende Wirkung lässt sich daher nicht zuverlässig vorhersagen. Um die antimikrobielle Aktivität eines Gewürz nach Kenntnis der Menge und Zusammensetzung seines ätherischen Öls besser einschätzen zu können, wurden in dieser Arbeit sechs Einzelkomponenten ätherischer Öle in verschiedenen Konzentrationen hinsichtlich ihrer antibakteriellen Wirksamkeit gegenüber den Verderbniserregern B. thermosphacta, E. coli, Ps. fragi und A. hydrophila unterschiedlichen geprüft. Anschließend Konzentrationen wurden miteinander die Ölkomponenten kombiniert, um in mögliche synergistische und antagonistische Effekte entdecken zu können. Zunächst wurden Stammlösungen der einzelnen Inhaltsstoffe angefertigt, indem die Inhaltsstoffe durch Zugabe von Isopropylalkohol (Thymol, Carvacrol) oder 0,5 % Tween80 (Linalool, 1,8-Cineol, α-Pinen, α-Terpineol) in Nährbouillon gelöst wurden. Zur Überprüfung der antibakteriellen Wirksamkeit der Einzelkomponenten wurden die Wells einer Mikrotiterplatte mit Keimsuspension und der Stammlösung der jeweiligen Ölkomponente beimpft bzw. mit Keimsuspension und mit den Stammlösungen der beteiligten Inhaltsstoffe bei Prüfung der antimikrobiellen Eigenschaften einer Stoffkombination. Die Keimsuspension enthielt ca. 106 KbE/ml des ausgewählten Bakteriums. Die Stammlösungen wurden während Beimpfung der Mikrotiterplatte 175 7 Zusammenfassung durch steigende Zugabe von Nährboullion ohne Zusätze auf die gewünschte Konzentration verdünnt. Die höchste Verdünnungsstufe der Stammlösung enthielt eine solche Menge des jeweiligen Inhaltsstoffs ätherischer Öle, wie sie auch durch Zusatz einer üblichen Menge des entsprechenden Gewürzes zu Lebensmitteln erreicht werden kann. Nach erfolgter Belegung wurde die Mikrotiterplatte über einen Zeitraum von 12 Stunden (B. thermosphacta, Ps. fragi) bzw. 7 Stunden (E. coli, A. hydrophila) inkubiert. Während der Bebrütungsdauer wurde stündlich das Bakterienwachstum anhand Messung der optischen Dichte verfolgt. Nach Beendigung der Inkubation wurde von jeder geprüften Konzentration einzelner Inhaltsstoffe ätherischer Öle bzw. jeder geprüften Kombination zweier Inhaltsstoffe ätherischer Öle 100 µl des Inhalts eines Wells entnommen, dezimale Verdünnungsreihen angefertigt und die aerobe Keimzahl bei 37 °C ( E. coli), 30 °C (A. hydrophila) oder 25 °C ( B. thermosphacta, Ps. fragi) bestimmt. Die Untersuchung der keimhemmenden Eigenschaften der Einzelkomponenten gegenüber den ausgewählten Bakterien ergab in absteigender Reihenfolge ihrer Wirksamkeit diese Reihung, begonnen mit der antimikrobiell wirksamsten Ölkomponente: Thymol, Carvacrol, Linalool, α-Pinen, 1,8-Cineol und α-Terpineol. Dabei war A. hydrophila das empfindlichste Bakterium, gefolgt von B. thermosphacta und E. coli. Ps. fragi war gegenüber der antimikrobiellen Aktivität der Ölkomponenten am wenigsten empfindlich. Alle sechs Stoffe entfalteten ihre antimikrobielle Wirksamkeit erst in Konzentrationen, die mindestens um das zehnfache über denjenigen lagen, die durch Zugabe des entsprechenden Gewürzes zu Lebensmitteln erreicht werden können. Bei Kombination von Thymol und Carvacrol traten konzentrationsabhängig synergistische antimikrobielle Effekte gegenüber allen geprüften Bakterien auf. Linalool führte in Kombination mit Thymol oder Carvacrol dosisabhängig zu einem synergistischen antimikrobiellen Effekt gegenüber A. hydrophila, B. thermosphacta und E. coli. Carvacrol und Linalool hemmten das Wachstum von Ps. fragi synergistisch, die Kombination von Thymol und Linalool ließ jedoch keine wechselseitige Beeinflussung der beteiligten Komponenten erkennen. Thymol und 1,8-Cineol wirkten gegenüber A. hydrophila, E. coli und B. thermosphacta 176 7 Zusammenfassung synergistisch antimikrobiell, in ihrer Wirksamkeit gegenüber Ps. fragi beeinflussten sich die beiden Stoffe nicht. Die Kombination von Carvacrol und 1,8-Cineol wirkte synergistisch keimhemmend gegenüber A. hydrophila, E. coli und Ps. fragi. Gegenüber B. thermosphacta war ein antagonistischer Effekt feststellbar. Thymol und α-Pinen hemmten synergistisch das Wachstum von A. hydrophila und E. coli, entfalteten gegenüber B. thermosphacta in der Kombination 100 ppm Thymol mit 340 ppm α-Pinen einen antagonistischen Effekt. Hinsichtlich der keimhemmenden Eigenschaften gegenüber Ps. fragi wurde keine wechselseitige Beeinflussung beobachtet. Die Kombination von Carvacrol und α-Pinen wirkte gegenüber E. coli und Ps. fragi synergistisch antimikrobiell. Gegenüber A. hydrophila und B. thermosphacta wurde hinsichtlich der Hemmwirkung in dieser Kombination ein antagonistischer Effekt beobachtet. Die Stoffkombination Thymol und α-Terpineol sowie die Kombination Carvacrol und α-Terpineol entfaltete einen synergistischen antibakteriellen Effekt bezüglich der Wirksamkeit gegenüber A. hydrophila, E. coli und Ps. fragi. Die keimhemmende Wirkung gegenüber B. thermosphacta wurde durch Kombination von Thymol bzw. Carvacrol mit α-Terpineol jedoch reduziert. Die Ergebnisse zeigten, dass bei Kombination der Ölkomponenten die für eine Hemmwirkung erforderlichen Konzentrationen eines oder beider beteiligten Stoffe auch bei Vorliegen eines synergistischen antibakteriellen Effekts deutlich über denjenigen liegen, die in gewürzten Lebensmitteln erreicht werden können und sensorisch akzeptabel sind. Damit erscheint eine Haltbarkeitsverlängerung von Lebensmitteln durch den Einsatz von Gewürzen mit einem hohen Gehalt an Thymol, Carvacrol, Linalool, 1,8-Cineol, α-Pinen oder α-Terpineol alleine oder in Kombination miteinander wenig aussichtsreich. Ein erfolgreicher Einsatz von Gewürzen im Rahmen des Hürdenprinzips wäre allerdings denkbar. Neben ihren Hauptkomponenten enthalten Gewürzöle ca. 60 weitere Stoffe, die ihre antimikrobielle Wirksamkeit beeinflussen können. Da in vorliegender Arbeit jeweils nur zwei Komponenten ätherischer Öle miteinander kombiniert wurden, bedarf eine Einschätzung der antimikrobiellen Wirksamkeit von Gewürzen nach Kenntnis der Menge und Zusammensetzung ihres ätherischen Öls die Einbeziehung weiterer Komponenten in die Untersuchungen. 177 8 Summary 8 Summary Christiane Rüben Antimicrobial properties of several essential oil components against food spoilage bacteria. Because of the critical attitude of the consumer towards synthetic preservatives food preserved by natural additives becomes increasingly popular. At the same time a shelf-life as long as possible is asked for. Because many spices and herbs have antimicrobial properties, they became interesting as alternative for conventional preservatives. However, the antimicrobial properties of spices depend on the quantity and composition of their essential oil, which is subjected to considerable variation. In this work, six essential oil components in different concentrations were examined with regard to their antibacterial activity against A. hydrophila, B. thermosphacta, E. coli and Ps. fragi. Afterwards, the oil components were combined with each other in different concentrations with the aim of discovering possible synergistic and antagonistic effects. The results shall enable to predict the antimicrobial activity of a spice, after knowledge of the amount and composition of its essential oil. First stock broths of the single components were made by dissolving the components in nutrient broth using Isopropylalcohol (thymol, carvacrol) or 0,5 % Tween80 (linalool, 1,8-cineol, α-Pinen and α-terpineol) to increase the water solubility of the essential components. To test the antimicrobial properties of a single chemical compound the wells of a microwell plate were inoculated with bacterial suspension and stock broth of the examined oil component. To examine the antibacterial activity of a combination of essential oil components, the wells were inoculated with bacterial suspension and the stock broths of the participating essential oil compounds. The bacterial suspension inoculated contained about 106 cfu/ml. The desired concentrations of the stock broths were achieved by an increasing addition of nutrient broth without additives. The highest degree of dilution of the stock broth of the essential oil component contained 178 8 Summary the same amount of the component, which can be achieved by adding the usual amount of the corresponding spice to food. The microwell plates were covered and incubated for 12 hours (B. thermosphacta, Ps. fragi) or 7 hours (E. coli, A. hydrophila) respectively. During the time of incubation the growth of the bacteria was observed by measuring the optical density each hour. Immediately after incubation from each tested concentration of a single essential oil component or combination of essential oil components respectively, 100 µl of the content of a well was taken, decimal dilution series were made and the viable cell count at 37 °C ( E. coli), 30 °C ( A. hydrophila) or 25 °C ( B. thermosphacta, Ps. fragi) determined. The investigation of the antimicrobial properties of the single components against the chosen bacteria resulted in the following order, started with the antimicrobial most effective oil component: thymol, carvacrol, linalool, α-pinen, 1,8-cineol and α-terpineol. A. hydrophila was the most sensitive bacterium, followed by B. thermosphacta and E. coli. Ps. fragi showed the greatest resistance towards the antimicrobial activity of the oil components. All six substances exhibited antimicrobial activity only in high concentrations. These concentrations were at least the 10-fold of the concentration which can be obtained by addition of the corresponding spices to food. Synergistic antimicrobial effects against all tested bacteria arose when combining thymol and carvacrol. Depending on their concentration linalool combined with thymol or carvacrol led to a synergistic antimicrobial effect against A. hydrophila, E. coli and B. thermosphacta. Carvacrol and linalool synergistically inhibited the growth of Ps. fragi. The combination of thymol and linalool, however, did not show any mutual influence on the involved components. Thymol and 1,8-cineol had a synergistically antimicrobial effect against A. hydrophila, E. coli an B. thermosphacta. In their activity towards Ps. fragi the two substances did not influence each other. The combination of carvacrol and 1,8-cineol showed a synergistic inhibitory effect against A. hydrophila, E. coli and Ps. fragi, against B. thermosphacta an antagonistic effect was noticed. Thymol and α-pinen inhibited synergistically the growth of A. hydrophila and E. coli, but unfolded 179 an antagonistic effect against 8 Summary B. thermosphacta in the combination 100 ppm thymol with 340 ppm, α-pinen. As to the inhibitory activity against Ps. fragi no mutual influence between thymol and α-pinen was observed. The combination of carvacrol and α-pinen had a synergistic antibacterial effect against E. coli and Ps. fragi. With regard to the inhibitory effect in this combination an antagonistic effect was observed towards A. hydrophila and B. thermosphacta. The combination of thymol and α-terpineol as well as the combination of carvacrol and α-terpineol showed a synergistic antimicrobial effect against A. hydrophila, E. coli and Ps. fragi. The inhibitory effect against B. thermosphacta was reduced by the combination thymol or carvacrol respectively and with α-terpineol. The results showed that even when combined, the concentration of at least one of the participating oil component necessary for an inhibitory effect is clearly above the concentration which can be achieved in spiced food and is acceptable in taste. This proves true even if there exists an synergistic antibacterial effect. Therefore, extension of shelf-life of food by using spices with a high content of thymol, carvacrol, linalool, 1,8-cineol, α-pinen or α-terpineol alone or in combination with each other is not much promising. However, a successful use of spices within the scope of the hurdle principle might be possible. Besides the major components, essential oil contains about 60 further compounds, which can influence the antimicrobial activity of the oil. In this work only two components of essential oils were combined. Therefore the assessment of the antimicrobial activity of spices - according to the knowledge of the amount and the composition of their essential oil - needs the inclusion of further components into the investigations. 180 9 Schriftumsverzeichnis 9 Schriftumsverzeichnis ABEE, T., L. KROCKEL u. C. HILL (1996): Bacteriocins: modes of actions and potentials in food preservation and control of food poisoning. Int. J. Food Microbiol. 28, 169-185 ADAM, K., A. SIVROPOULOU, S. KOKKINI, T. LANARAS u. M. ARSENAKIS (1998): Antifungal activities of Origanum vulgare subsp. Hirtum, Mentha spicata, Lavendula angustifolia and Salvia fructicosa essential oils against human pathogenic fungi. J. Agric. Food Chem. 46, 1739-1745 ALIGIANNIS N., E. KALPOUTZAKIS, S. MITAKU u. I.B. CHINOU (2001): Composition and antimicrobial activity of the essential oils of two Origanum species. J. Agric. Food Chem. 49, 4168-4170 ANGELINI, L.G., G. CARPANESE. P.L. CIONI, I. MORELLI, M. MACCHIA u. G. FLAMINI (2003): Essential oils from Mediterranean Lamiaceae as weed germination inhibitors. J. Agric. Food Chem. 51, 6158-6164 ANGIONI A., A. BARRA, E. CERETI, D. BARILE, J.D. COISSON, M. ARLORIO, S. DESSI, V. CORONEO u. P. CABRAS (2004): Chemical composition, plant genetic differences, antimicrobial and antifungal activity investigation of the essential oil of Rosmarinus officinalis L. J. Agric. Food Chem. 52, 3530-3535 AZAZ, A.D., H.A. IRTEM, M. KURKUOĞLU u. K.H.C. BASER (2004): Composition and the in vitro antimicrobial activities of the essential oils of some Thymus species. Z. Naturforsch. 59c, 75-80 BAGAMBOULA, C.F., M. UYTTENDAELE u. J. DEBEVERE (2004): Inhibitory effect of thyme and basil essential oils, carvacrol, thymol, estragol, linalool and p-cymene towards Shigella sonnei and Shigella flexneri. Food Microbiol. 21, 33-42 BARATTA, M.T., H.J.D. DORMAN, S.G. DEANS, A.C. FIGUEIREDO, J.G. BARROSO u. G. RUBERTO (1998): Antimicrobial and antioxidant properties of some commercial essential oils. Flavour Fragr. J. 13, 235-244 181 9 Schriftumsverzeichnis BIONDI, D., P. CIANCI, C. GERACI u. G. RUBERTO (1993): Antimicrobial activity and chemical composition od essential oils from Sicilian aromatic plants. Flavour Fragr. J. 8, 331-337 BORCH, E., M.-L. KANT – MUERMANS u. Y. BLIXT (1996): Bacterial spoilage of meat and cured meat products. Int. J. Food Microbiol. 33, 103-120 BOZIN, B., N. MIMICA-DURKIC, N. SIMIN u. G. ANACKOV (2006): Characterization of the volatile composition of essential oils of some Lamiaceae spices and the antimicrobial and antioxidant activities of the entire oils. J. Agric. Food Chem. 54, 1822-1828 BRUL, S. u. P. COOTE (1999): Review-preservative agents in foods: mode of action and microbial resistance mechanisms. Int. J. Food Microbiol. 50, 1-17 BRUNO, M.E. u. T.J. MONTVILLE (1993): Common mechanistic action of bacteriocins from lactic acid bacteria. Appl. Environ. Microbiol. 59, 3003-3010 BURT, S. (2004): Essential oils: their antibacterial properties and potential application in foods a review. Int. J. Food Microbiol. 94, 223-253 BURT, S., R. VLIELANDER, H.P. HAAGSMAN u. E. J.A. VELDHUIZEN (2005): Increased activity of essential oil components carvacrol and thymol against Escherichia coli O157:H7 by addition of food stabilizers. J. Food Protect. 68, 919-926 CARSON, C.F. u. T.V. RILEY (1995): Antimicrobiel activity of the major components of the essential oil of Melaleuca alternifolia. J. Appl. Microbiol. 78, 264-269 CARSON, C.F., B.J. MEE u. T.V. RILEY (2002): Mechanisms of action Melaleuca alternifolia (tea tree) oil on Staphylococcus aureus determined by time-kill, lysis, leakage and salt tolerance assays and electron microscopy. Antimicrob. Agents Chemotherap. 46, 1914-1920 182 9 Schriftumsverzeichnis CHAI, T., C. CHEN, A. ROSEN u R.E. LEVIN (1968): Detection and incidence of specific spoilage bacteria of fish. Relative incident of Pseudomonas putrefaciens and fluorescent pseudomonads on haddock filets. Appl. Microbiol. 16, 1738-1741 CHORIANOPOULOS, N., E. KALPOUTZAKIS, N. ALIGIANNIS, S. MITAKU, G.H. NYCHAS u. S.A. HAROUTOUNIAN (2002): Essential oils of Satureja, Origanum and Thymus species: chemical composition and antibacterial activities against foodborne pathogens. J. Agric. Food Chem. 52, 8261-8267 CORMIER, F., Y. RAYMOND, C.P. CHAMPAGNE u. A. MORIN (1991): Analysis of odor-active volatiles from Pseudomonas fragi grown in milk. J. Food Protec. 40, 475-479 COSENTINO, S., C.I.G. TUBEROSO, B. PISANO, M. SATTA, V. MASCIA, E. ARZEDI u. F. PALMAS (1999): In-vitro antimicrobial activity and chemical composition of sardinia Thymus essential oils. Let. Appl. Microbiol. 29, 130-135 COWAN, M.M (1999): Plant products as antimicrobial agents. Clin. Microbiol. Rev. 12, 564-582 COX, S.D., C.M. MANN u. J.L. MARKHAM (2001): Interactions between components of the essential oil of Melaleuca alternifolia. J. Appl. Microbiol. 91, 492-497 CRAVEN, H.M. u. B.J. MACAULY (1992): Microorganisms in pasteurised milk after refrigareted storage. 1. Identification of types. Aust. J. Dairy Technol. 47, 28-45 DADALIOĞLU, I. u. G.A. EVRENDILEK (2004): Chemical composition and antibacterial effects of essential oils of Turkish oregano (Origanum minutiflorum), bay laurel (Laurus nobilis), Spanish lavender (Lavendula stoechas L.) and Fennel (Foeniculum vulgare) on common foodborne pathogens. J. Agric. Food Chem. 52, 8255-8260 DAFERERA, D.J., B.N. ZIOGAS u. M.G. POLISSIOU (2000): GC-MS analysis of essential oils from some greek aromatic plants and their fungotoxicity on Penicillium digitatum. J. Agric. Food Chem. 48, 2576-2581 183 9 Schriftumsverzeichnis DAINTY, R.H. u. B.M. MACKEY (1992): The relationship between the phenotypic properties of bacteria from chill-stored meat and spoilage process. J. Appl. Bacteriol. Symp. Suppl. 73, 103-144 DEANS, S.G. u. G. RITCHIE (1987): Antibacterial properties of plant essential oils. Int. J. Food Microbiol. 5, 165-180 DEANS, S.G. u. P.G. WATERMAN (1993): Biological activity of volatile oils. In: HAY, R.K.M. u. P.G. WATERMAN: Volatile oil crops: Their biology, biochemistry and production. Harlow, Longman Scientific & Technical, Essex (GB), p. 97-111 DELAQUIS, P.J. u. G. MAZZA (1995): Antimicrobial properties of isothiocyanates in food preservation. Food Technol. 49, 73-84 DELAQUIS, P.J., K. STANICH, B. GIRARD u. G. MAZZA (2002): Antimicrobial activity of individual and mixed fractions of dill, cilantro, coriander and eucalyptus essential oils. Int. J. Food Microbiol. 74, 101-109 DEUTSCHE VETERINÄRMEDIZINISCHE GESELLSCHAFT (DVG) (2007): Desinfektionsmittelrichtlinien 4. Aufl. Verlag DVG e.v., Gießen DIDRY, N., L. DUBREIL u. M. PINKAS (1993): Antimicrobial activity of thymol, carvacrol and cinnamaldehyd alone or in combination. Pharmazie 48, 301-304 DIMITRIJEVIĆ, S.I., K.R. MIHAJLOVSKI, D.G. ANTONOVIĆ, M.R. MILANOVIĆ u. D.Z. MIJIN (2007): A study of the synergistic antilisterial effects of a sub-lethal dose of lactid acid and essential oils from Thymus vulgaris L., Rosmarinus officinalis L. and Origanum vulgare L. Food Chem. 104, 774-782 DORMAN H.J.D., A.C. FIGUEIREDO, J.G. BARROSO u. S.G. DEANS (2000): In vitro evaluation of antioxidant activity of essential oils and their components. Flavour Fragr. J. 15, 12-16 DORMAN, H.J.D. u. S.G. DEANS (2000): Antimicrobial agents from plants: antibacterial activity of plant volatile oils. J. Appl. Microbiol. 88, 308-316 184 9 Schriftumsverzeichnis DORMAN,S.G. u. P.G. WATERMAN (1993): Biological activity of volatile oils. In: HAY, R.K.M. u. P.G. WATERMAN: Volatile oil crops: Their biology, biochemistry and production. Harlow, Longman Scientific & Technical, Essex (GB) , 97-111 FALEIRO, L. G. MIGUEL, S. GOMES, L. COSTA, F. VENANCIO, A. TEIXEIRA, A.C. FIGUEIREDO, J.G. BAROSO u. L.G. PEDRO (2005): Antibacterial and antioxidant activities of essential oils isolated from Thymbra capitata L. (Cav.) and Origanum vulgare L. J. Agric. Food Chem. 53, 8162-8168 FARAG, R.S., Z.Y. DAW, F.M. HEWEDI u. G.S.A. ELBAROLY (1989): Antimicrobial activity of some Egyptian spice essential oils. J. Food Protect. 52, 665-667 FEHLHABER, K., J. KLEER u. F. KLEY (2005): Handbuch Lebensmittelhygiene – Praxisleitfaden Grundlagen. Behr`s Verlag, Hamburg mit wissenschaftlichen FYFE, L., F. ARMSTRONG u. J. STEWART (1998): Inhibition of Listeria monocytogenes and Salmonella enteritidis by combinations of plant oils and derivatives of benzoic acid: the development of synergistic antimicrobial combinations. Int. J. Antimicrob. Agents 9, 195-199 GALINDO-CUSPINERA, V., D.C. WESTHOFF u. S.A. RANKIN (2003): Antimicrobial properties of commercial annatto extracts against selected pathogenic, lactic acid, and spoilage organisms. J. Food Protec. 66, 1074-1078 GARDNER, G.A. (1981): Brochothrix thermosphacta (Microbacterium thermosphactum) in the spoilage of meat: a review. In: Psychrotrophic microorganisms in spoilage and pathogenicity Academic Press, London, 139-173 GERHARDT, U. (1994): Gewürze in der Lebensmittelindustrie: Verwendung. Behr`s Verlag, Hamburg Eigenschaften, Technologien GILL, A.O., P.J. DELAQUIS, P. RUSSO u. R.A. HOLLEY (2002): Evaluation of antilisterial action of cilantro oil on vacuum packed ham. Int. J. Food Microbiol. 73, 83-92 185 und 9 Schriftumsverzeichnis GILL, A.O., R.A. HOLLEY (2003): Nature of E.coli O157:H7, L. monoytogenes and Lactobacillus sakei inhibition by eugenol, cinnamaldehyde and sodium lactate. Int. Assoc. Food Protect. Annual Meet., New Orleans PO156 Abstract Book, 113 GOULD, G.W. (1996): Methods for preservation and extension of shelf life. Int. J. Food Microbiol. 33, 51-64 GRAM, L, C. WEDELL-NEERGAARD u. H.H. HUSS (1990): The bacteriology of spoiling Lake Victorian Nile perch (Lates niloticus) Int. J. Food Microbiol. 10, 303-316 GRAM, L. u. P. DAALGAARD (2002): Fish spoilage bacteria-problems and solutions. Curr. Opinion Biotechnol. 13, 262-266 GRAM, L., L. RAVN, M. RASCH, J.B. BRUHN, A.B. CHRISTENSEN u. M. GIVSKOV (2002): Food spoilage - interactions between food spoilage spoilage bacteria Int. J. Food Microbiol. 78, 79-97 GRAU, F.H. (1981): Role of pH, lactate and anaerobiosis in controlling the growth of some fermentative gram-negative bacteris on beef. Appl. Envirom. Microbiol. 42, 1043-1050 HAMMER, K.A., C.F. CARSON u. T.V. RILEY (1999a): Antimicrobial activity of essential oils and other plant extracts. J. Appl. Microbiol. 86, 985-990 HAMMER, K.A., C.F. CARSON u. T.V. RILEY (1999b): Influence of organic matter, cations and surfactants on the antimicrobial activity of Melaleuca alternifolia (tea tree) oil in vitro. J. Appl. Microbiol. 86, 446-452 HAO, Y.Y., R.E. BRACKETT u. M.P. DOYLE (1998): Inhibition of Listeria monocytogenes and Aeromonas hydrophila by plant extracts in refrigerated beef. J. Food Protect. 61, 307-312 HELANDER, I.M., H.-L. ALAKOMI, K. LATVA-KALA, T. MATTILA-SANDHOLM, I. POL, E.J. SMID, L.G.M. GORRIS u. A. VON WRIGHT (1998): Characterization of the action of selected essential oil components on Gramnegative bacteria. J. Agric. Food Chem. 46, 3590-3595 186 9 Schriftumsverzeichnis HODGSON I., J. STEWART u. L. FYFE(1998): Inhibition of bacteria and yeast by oil of fennel and paraben: development of synergistic antimicrobial combinations. J. Ess. Oil Research 5, 195-199 HOLLEY, R.A. u. D. PATEL (2005): Improvement of shelf-life and savety of perishable foods by plant essential oils and smoke antimicrobials. Food Microbiol. 22, 273-292 HOLZAPFEL, W., J. BAUMGART u. W. HEESCHEN (2004): Lexikon der Lebensmittelmikrobiologie Behr`s Verlag, Hamburg HOLZAPFEL, W.H., R. GEISEN u. U. SCHILLINGER (1995): Biological preservation of foods with reference to protective cultures, bacteriocins and food-grade enzymes. Int. J. Food Microbiol. 24, 343-362 HUGAS, M. (1998): Bacteriocinogenic lactic acid bacteria for the biopreservation of meat and meat products. Meat Science 49, 139-150 HUIS IN`T VELD, J.H.J. (1996): Microbial and biochemical spoilage in foods: an overview. Int. J. Food Microbiol. 33, 1-18 ISMAIEL, A.A. u. M.D. PIERSON (1990): Effect of sodium nitrite and origanum oil on growth and toxin production of Clostridium botulinum in TYG broth and ground pork. J. Food Protect. 53, 958-960 JEREMIAH, L.E., L.L. GIBSON u. G. ARGONOSA (1995): The influences of inherent muscle quality upon the storage life of chilled pork stored in Co2 at – 1,5 °C. Food Res. Int. 28, 51-59 JUVEN, B.J., J. KANNER, F. SCHWED u. H. WEISSIOWICZ (1994): Factors that interact with the antibacterial action of thyme essential oil and ist active constituents. J. Appl. Bacteriol. 78, 626-631 KARATZAS, A.K., E.P.W. KETS, E.J. SMIDS u. M.H.J. BENNIK (2001): The combined action of carvacrol and high hydrostatic pressure Listeria monocytogenes. J. Appl. Microbiol. 90, 463-469 187 on 9 Schriftumsverzeichnis KIM, J., M.R. MARSHALL u. C. WEI (1995): Antibacterial activity of some essential oil components against five foodborne pathogens. J. Agric. Food Chem. 43, 2839-2845 KIVANÇ, M., A. AKGÜL u. A. DOĞAN (1991): Inhibitory and stimulatory effects of cumin, oregano and their essential oils on growth and acid production of Lactobacillus plantarum and Leuconostoc mesenteroides. Int. J. Food Microbiol. 13, 81-86 KNOBLOCH, K., A. PAULI u. B. IBERL (1989): Antibacterial and antifungal properties of essential oils components. J. Essent. Oil Res. 1, 119-128 KOMAITIS, M.E., N. IFANTI-PAPATRAGIANNI u. E. MELISSARI-PANAGIOTOU (1992): Composition of the essential oil of majoram (Origanum majorana L.). Food Chem. 45, 117-118 KÖPKE, U. (2002): Zusammensetzung der psychrotrophen Hackfleischmikroflora “industrieller“ Herstellung mit mikroökologischer und hygienischer Bewertung der Hauptkomponenten. Berlin, Freie Univ., Fachber. Veterinärmed., Diss. KOVACEVIC, N.N., M.D. SIMIC u. M.S. RISTIC (2007): Essential oil of Laurus nobilis of Montenegro. Chem. Natural Comp. 43, 408-412 KRAFT, K. (2000): Checkliste Phytotherapie. Georg Thieme Verlag, Stuttgart KRÄMER, J. (2007): Lebensmittelmikrobiologie. Verlag Eugen Ulmer, Stuttgart KROKER, R., R. SCHERKL, F.R. UNGEMACH (2002): Chemotherapie bakterieller Infektionen in: H.-H. FREY und W. LÖSCHER (Hrsg.): Lehrbuch der Pharmakologie und Toxikologie für die Veterinärmedizin. 2. Aufl. Verlag Enke, Stuttgart S.354 188 9 Schriftumsverzeichnis KUNZ,K., M. WEIDENBÖRNER u. B. KUNZ (1995): Die Nutzung von Gewürzen in Weizenbrot zur Kontrolle der lebensmittelrelevanten Schimmelpilze Cladosporum herbarum, Euroticum repens, Penicillium expansum und Rhizops stolifer. Chem. Microbiol. Technol. Lebensm. 17, 1-5 LACHOWICZ, K.J., G.P. JONES, D.R. BRIGGS, F.E. BIENVENU, J. WAN, A. WILCOCK u. M.J. COVENTRY (1998): The synergistic preservative effects of sweet basil (Ocimum basilicum L.) against acid tolerant food microflora. Lett. Appl. Microbial. 26, 209-214 LAMBERT, A.D., J.P. SMITH u. K.L. DODDS (1991): Shelf life extension and microbiological safety of fresh meat - a review Food Microbiol. 8, 267-297 LAMBERT, R.J.W., P.N. SKANDAMIS, P.J. COOTE u. G.-J.E. NYCHAS (2001): A study of the minimum inhibitory concentration and mode of action of oregano essential oil, thymol and carvacrol. J. Appl. Microbiol. 91, 453-462 LEISTNER, L. (1986): Hürden-Technologie für die Herstellung stabiler Fleischerzeugnisse. Fleischwirtschaft 66, 10-15 LIAO, C.-H., J. SULLIVAN, J. GRADY u. L.-J.C. WONG (1997): Biochemical characterization of pectate lyases produced by pseudomonads associated with spoilage of fresh fruits and vegetables. J. Appl. Microbiol. 83, 10-16 fluorescent LOPEZ-MALO, A., S.M. ALZAMORA u. E. PALOU (2002): Aspergillus flavus dose-response curves to selected natural and synthetic antimicrobials. Int. J. Food Microbiol. 73, 213-218 LYCZAK, J.B., C.L. CANNON u. G.B. PIER (2000): Establishment of Pseudomonas aeruginosa infection: lessons from a versatile opportunist. Microbes and Infection 9, 1051-1060 MANN, C.M. u. J.L. MARKHAM (1998): A new method for determining the minimum inhibitory concentration of essential oils. J. Appl. Microbiol. 84, 538-544 189 9 Schriftumsverzeichnis MARINO, M., C. BERSANI u. G. COMI (1999): Antimicrobial activity of the essential oil of Thymus vulgaris L. measured using a bioimpedometric method. J. Food Protect. 62, 1017-1023 MARINO, M., C. BERSANI u. G. COMI (2001): Impedance measurement to study antimicrobial activity of essential oils from Lamiaceae and compositae. Int. J. Food Microbiol. 67, 187-195 MAURELLI, A.T. u. K.A. LAMPEL (1997): Shigella species. In: DOYLE, M.P., L.R. BEUCHAT u. T.J. MONTVILLE (Hrsg.): Food microbiology: Fundamentals and frontiers. ASM Press, Washington DC MEAD, P.S, L. SLUTSKER, V. DIETZ, L.F. McCAIG, J.S. BRESEE, C. SHAPIRO, P.M. GRIFFIN u. R.V. TAUXE (1999): Food related illness and death in the United States. Emerg. Infect. Diseas. 5, 607-625 MEJLHOLM, O. u P. DAALGAARD (2002): Antimicrobial effect of essential oils on seafood spoilage Photobacterium phosphoreum in liquid media and fish products. Lett. Appl. Microbiol. 34, 27-31 microorganism MENDOZA-YEPES M.J., L.E. SANCHEZ-HIDALGO, G.MAERTENS u. F. MARININIESTA (1997): Inhibition of Listeria monocytogenes and other bacteria by plant essential oil (DMC) in Spanish soft cheese. J. Food Safety 17, 47-77 MERINO S., X. RUBIRES, S. KNOCHEL u. J.M. TOMÁS (1995): Emerging pathogens: Aeromonas spp. Int. J. Food Microbiol. 28, 157-168 MILLER, A., R.A. SCALAN, J.S. LEE u. L.M. LIBBEY (1973): Identification of the volatile components produced in sterile fish muscle (Sebastes melanops) by Pseudomonas fragi. J. Appl. Microbiol. 25, 952-955 190 9 Schriftumsverzeichnis MOSSEL, D.A.A., J.E.L. CORRY, C.B. STRUIJK u. R.M. BAIRD (1995): Essentials of the microbiology of foods: a textbook for advanced studies. Wiley, England, 175-214 NEYTS, K., G. HUYS, M. UYTTENDAELE, J. SWINGS u. J. DEBEVERE (2000): Incidence and identification of mesophilic Aeromonas spp. from retail foods. Lett. Appl. Microbiol. 31, 359-363 PANDIT, V.A. u. L.A. SHELEF (1994): Sensitivity of Listeria monocytogenes to rosemary (Rosmarinus officinalis L.) Food Microbiol. 11, 57-63 PARRY, J.W. (1953): The story of spices. Chem. Publ. Co., New York PASTER, N., B.J. JUVEN, E. SHAAYA, M. MENASHEROV, R. NITZAN, H. WEISSLOWISZ u. RAVID (1990): Inhibitory effect of oregano and thyme essential oils on moulds and foodborne bacteria. Lett. Appl. Microbiol. 11, 33-37 PENALVER, P., B. HUERTA, C. BORGE, R. ASTORGA, R. ROMERO u. A. PEREA (2005): Antimicrobial activity of five essential oils against origin strains of the Enterobacteriaceae family. APMIS 113, 1-6 PERAGIO, P.M., A. PALOP u. P.S. FERNANDEZ (2001): Combined effect of nisin, Carvacrol and Thymol on the viability of Bacillus cereus heat treated vegetative cells. Food Science Technol. Int. 7, 487-492 PINA-VAZ, C., A.G. RODRIGUES, E. PINTO, S. COSTA-DE-OLIVIERA, C. TAVARES, L. SALGUEIRO, C. CAVALEIRO, M.J. GONCALES u. J. MARTINEZDEOLIVIERA (2004): Antifungal activity of Thymus oils and their major compounds. JEADV 18, 73-78 PITT, J.I. u. A.D. HOCKING (1997): Fungi and food spoilage. 2nd ed. Blackie Academic and Professional, 596 pp. QUATTARA, B., R.E. SIMARD, R.A. HOLLEY, G. J.-P. PIETTE u. A. BEGIN (1997): Antibacterial activity of selected fatty acids and essential oils against six meat spoilage organisms. Int. J. Food Microbiol. 37, 155-162 191 9 Schriftumsverzeichnis RATTANASOMBOOM, N., S.R. BELLARA, C.L. HARDING, P.J. FRYER, C.R. THOMAS, M. AL-RUBEAI u. C.M. MCFARLANE (1999): Growth and enumeration of the meat spoilage bacterium Brochothrix thermosphacta. Int. J. Food Microbiol. 51, 145-158 RUSSO, M.T., G.C. GALETTI, P. BOCCHINI u. A. CARNACINI (1998): Essential oil composition of wild populations of Italian oregano spice (Origanum vulgare ssp. hirtum (Link) Ietswaart): aprelinary evaluation of their use in chemotaxonomy by cluster analysis. J. Agric. Food Chem. 46, 3741-3746 SACHS, M. (2003): Wahrscheinlichkeitsrechnung und Fachhochschulen. Verlag Carl Hanser, München, Wien Statistik für Ingenieurstudenten an SCHWARZ, S., A. BÖTTNER, H.M. HAFEZ, C. KEHRENBERG, M. KIETZMANN, D. KLARMANN, G. KLEIN, P. KRABISCH, T. KÜHN, G. LUHOFER, A. RICHTER, W. TREADER, K.H. WALDMANN, J. WALLMANN u. C. WERKENTHIN (2003): Antimicrobial susceptibility testing of bacteria isolated from animals: Methods for in vitro suseptibility with regard to the generation of most useful data for therapeutic application. Berl. Münch. tierärztl. Wochenschr. 116, 353-361 SHAW, B.G. u. J.M. SHEWAN (1968): Psychrophilic spoilage bacteria of fish. J. Appl. Microbiol. 31, 89-96 SHELEF, L.A. (1983): Antimicrobial effects of spices. J. Food Safety 6, 29-44 SIVROPOULOU A., E. PAPANIKOLAOU, C. NIKOLAOU, S. KOKKINI, T. LANARAS u. M. ARSENAKIS (1996): Antimicrobial and cytotoxic activities of Origanum essential oils. J. Agric. Food Chem. 44, 1202-1205 SKOVGAARD, N. (1985): Brochothrix thermosphacta: comments on its taxonomy, ecology and isolation. Int. Food Microbiol. 2, 71-79 SMITH-PALMER, A., J. STEWART, L. FYFE (1998): Antimicrobial properties of plant essential oils and essences against five important foodborne pathogens. Lett. Appl. Microbiol. 26, 118-122 192 9 Schriftumsverzeichnis SMITH-PALMER, A., J. STEWART, L. FYFE (2001): The potential application of plant essential oils as natural food preservatives in soft cheese. Food Microbiol. 18, 463-470 SOKOVIĆ, M. u. L.J.L.D. VAN GRIENSVEN (2006): Antimicrobial activity of essential oils and their components against three major pathogens of the cultivated button mushroom, Agaricus bisporus. EJPP 116, 211-224 SOLIMAN, K.M. u. R.I. BADEAA (2002): Effect of oil extracted from some medicinal plants on different mycotoxigenic fungi. Food Chem. Toxicol. 40, 1669-1675 STECCHINI, M.L., I. SARAIS u. P. GIAVEDONI (1993): Effect of essential oils on Aeromonas hydrophila in a culture medium and in cooked pork. J. Food Protect. 5, 406-409 STILES, M.E (1989): Less recognized or presumptive foodborne pathogenic bacteria. In: DOYLE, M.P. (Hrsg.): Foodborne bacterial pathogens. M. Dekker, New York, Basel S. 673-677 TAGG, J.R., A.S. DAJANI u. A.L. WANNAMAKER (1976): Bacteriocins of Gram-positive bacteria. Bacteriol. Rev. 40, 722-756 TASSOU, C., E.H. DROSINOS u. G.-J.E. NYCHAS (1995): Effects of essential oil from mint (Mentha piperita) on Salmonella enteritidis and Listeria monocytogenes in model food systems at 4 °C and 10 °C. J. Appl. Microbiol. 78, 593-600 THOMPSON, J.D., J.-C. CHALCHAT, A. MICHET, Y. B. LINHART u. B EHLERS (2003): Qualitative and quantitavive variation in monoterpene co-occurance and composition in the essential oil of Thymus vulgaris chemotypes. J. Chem. Ecology 29, 859-879 THOROSKI, J., G. BLANK u. C. BILIADERIS (1989): Eugenol induced inhibition of extracellular enzyme production by Bacillus cereus. J. Food Protect. 52, 399-403 193 9 Schriftumsverzeichnis TRUELSTROP-HANSEN, L. u. H.H. HUSS (1998): Comparism of the microflora isolated from spoiled cold-smoked salmon from three smokehouses. Food Res. Int. 31, 703-711 TSCHÄPE, H. u. J. BOCKEMÜHL (2002): Lebensmittelübertragene Salmonellose in Deutschland. Bundesgesundheitsbl. Gesundheitsforsch. Gesundheitsschutz 45, 491-496 TSIGARIDA, E., P. SKANDAMIS u. G.-J.E. NYCHAS (2000): Behaviour of Listeria monocytogenes and autochthonous flora on meat stored under aerobic conditions with or without the presence of oregano essential oil at 5 C. J. Appl. Microbiol. 89, 901-909 TYÖPPÖNNEN, S., E. PETÄJÄ u. T. MATILLA-SANDHOLM (2003): Bioprotectives and probiotics for dry sausages. Int. J. Food Microbiol. 83, 233-244 ULTEE, A., E.P.W. KETS u. E.J. SMID (1999): Mechanisms of action of carvacrol on the food borne pathogen Bacillus cereus. Appl. Environ. Microbiol. 65, 4606-4610 ULTEE, A., E.P.W. KETS, M. ALBERDA, F.A. HOEKSTRA u. E.J. SMID (2000a): Adaption of the foodborne pathogen Bacillus cereus to carvacrol Archives Microbiol. 174, 233-238 ULTEE, A., M.H.J. BENNIK u. R. MOEZELAAR (2002): The phenolic hydroxyl group of carvacrol is essential for action against the foodborne pathogen Bacillus cereus. Appl. Environ. Microbiol. 68, 1561-1568 ULTEE, A., R.A. SLUMP, G. STEGING u. E.J. SMID (2000b): Antimicrobial activity of carvacrol toward Bacillus cereus on rice. J. Food Protect. 63, 620-624 UPMANN M., P. PAULSEN, C. JAMES u. F.J.M. SMULDERS (2000a): Die Mikrobiologie von kältebehandeltem Fleisch. Fleischwirtschaft 80, 90-97 194 9 Schriftumsverzeichnis UPMANN, M., S. STIEGLER, J. NOVAK u. G. KRÜGER (2000b): Einfluß von gerebeltem Oregano, Thymian, Rosmarin und Majoran auf die Entwicklung der Verderbnisflora in Zubereitungen aus Hackfleisch. Proc. 41. Arbeitstagung des Arbeitsgebietes „Lebensmittelhygiene“, Garmisch-Partenkirchen 25. – 28.9. 2000, S. 324-329 UPMANN, M. u. J. NOVAK (2001): Antimikrobielle Wirksamkeit von gerebeltem und gemahlenen Oregano sowie Oregano-Öl in Zubereitungen aus Hackfleisch. Proc. 42. Arbeitstagung des Arbeitsgebietes „Lebensmittelhygiene“, Garmisch-Partenkirchen 25.-28.9.2001, 471-476 VAARA, M. (1992): Agents that increase the permeability of the outer membrane. Microbiol. Reviews 56, 395-411 WALSH, S.E., J.-Y. MAILLARD, A.D. RUSSELL, C.E. CATRENICH, D.L. CHARBONNEAU u. R.G. BARTOLO (2003): Activity and mechanism of action of selctive biocidal agents on Gram-positive and negative bacteria. J. Appl. Microbiol. 94, 240-247 WAN, J. A. WILCOCK u. M.J. COVENTRY (1998): The effect of essential oils of basil on the growth of Aeromonas hydrophila and Pseudomonas fluorescens. J. Appl. Microbiol. 84, 152-158 WARD, S.M., P.J. DELAQUIS, R.A. HOLLEY u. G. MAZZA (1998): Inhibition of spoilage and pathogenic bacteria on agar and pre-cooked roasted beef by volatile horseradish distillates. Food Res. Int. 31, 19-26 WENDAKOON, C.N. u M. SAKAGUCHI (1993): Combined effect of sodium chloride and clove on growth and biogenic amine formation of Enterobacter aerogenes in mackerel muscle extract. J. Food Protect. 56, 410-413 ZAIKA, L.L. (1988): Spices and herbs: their antimicrobial activity and its determination. J. Food Safety 9, 97-118 195 10 Anhang 10 Anhang 10.1 Tabellenanhang 10.1.1 Keimzahlen Einzelstoffe Anhangstabelle 83: Keimzahlen der 3 Stichproben je geprüfter Einzelstoffkonzentration, A. hydrophila Fortsetzung Anhangstabelle 83 Konzentration Thymol in ppm Kontrolle 0,4 % Isopropylalk. 400 200 100 40 4 Konzentration Carvacrol in ppm Kontrolle 1 % Isopropylalk. 200 100 50 20 2 Konzentration Linalool in ppm Kontrolle 0,5 % Tween80 1200 720 360 180 3,6 Keimzahlen in lg KbE/ml 9,00 9,90 2,00 2,00 3,00 7,95 8,90 8,85 8,95 2,00 2,00 2,85 8,30 8,00 8,95 8,78 2,00 2,00 2,90 8,30 9,28 Keimzahlen in lg KbE/ml 8,88 8,73 2,00 3,04 8,08 8,36 8,81 8,85 8,81 2,00 2,87 8,15 8,81 8,51 8,88 8,23 2,00 2,88 8,15 8,97 8,78 Keimzahlen in lg KbE/ml 8,72 8,67 3,40 5,79 7,41 8,00 8,88 196 8,72 8,67 3,26 5,81 7,41 7,97 8,72 8,81 8,69 3,20 5,77 7,43 7,94 8,76 10 Anhang Fortsetzung Anhangstabelle 83 Konzentration 1,8-Cineol in ppm Kontrolle 0,5 % Tween80 2000 1600 1400 600 360 3,6 Konzentration α-Pinen in ppm Kontrolle 0,5 % Tween80 1200 800 600 340 3,4 Konzentration α-Terpineol in ppm Kontrolle 0,5 % Tween80 800 600 400 0,8 0,008 C: Carvacrol Ci: 1,8-Cineol Te: α-Terpineol L: Linalool Keimzahlen in lg KbE/ml 8,93 8,86 6,36 7,04 7,88 8,84 8,81 8,75 8,81 8,81 6,23 7,04 7,98 8,74 8,83 8,69 8,93 8,86 6,36 6,80 8,00 8,78 8,81 8,75 Keimzahlen in lg KbE/ml 8,87 8,89 8,52 8,89 8,26 8,85 8,87 8,82 8,95 8,41 8,89 8,45 8,91 8,67 8,86 8,84 8,38 8,93 8,26 8,84 8,80 Keimzahlen in lg KbE/ml 9,00 8,99 7,85 8,59 8,76 9,04 8,95 Pi: α-Pinen 197 8,93 8,97 8,11 8,11 8,71 8,89 8,85 T: Thymol 8,85 8,89 7,48 7,93 8,65 8,90 8,65 10 Anhang Anhangstabelle 84: Keimzahlen der 3 Stichproben je geprüfter Einzelstoffkonzentration, E.coli Fortsetzung Anhangstabelle 84 Konzentration Thymol in ppm Kontrolle 0,4 % Isopropylalk. 400 200 100 40 4 Konzentration Carvacrol in ppm Kontrolle 1 % Isopropylalk. 200 100 50 20 2 Konzentration Linalool in ppm Kontrolle 0,5 % Tween80 1200 900 360 180 3,6 Konzentration 1,8-Cineol in ppm Kontrolle 0,5 % Tween80 2800 2000 600 360 3,6 Keimzahlen in lg KbE/ml 8,95 8,85 2,00 2,00 8,60 8,90 8,85 8,78 8,70 2,00 2,00 8,30 8,70 8,78 8,78 8,60 2,00 2,00 8,30 8,70 8,78 Keimzahlen in lg KbE/ml 8,88 8,93 4,04 8,68 8,81 8,94 8,85 8,43 8,82 4,26 8,52 8,75 8,90 8,93 8,96 8,94 4,15 8,73 8,84 8,79 8,83 Keimzahlen in lg KbE/ml 8,83 8,66 7,23 8,63 8,76 8,83 8,79 8,72 8,72 7,28 8,61 8,62 8,77 8,76 8,65 8,76 8,99 8,65 8,71 8,81 8,74 Keimzahlen in lg KbE/ml 8,79 8,68 8,08 8,40 8,76 8,78 8,83 198 8,66 8,74 8,11 8,65 8,65 8,68 8,67 8,74 8,79 8,08 8,28 8,61 8,62 8,81 10 Anhang Fortsetzung Anhangstabelle 84 Konzentration α-Pinen in ppm Kontrolle 0,5 % Tween80 1200 800 340 3,4 Konzentration α-Terpineol in ppm Kontrolle 0,5 % Tween80 800 600 0,8 0,008 C: Carvacrol Ci: 1,8-Cineol Te: α-Terpineol L: Linalool Keimzahlen in lg KbE/ml 8,74 8,74 8,70 8,93 8,79 8,80 8,74 8,73 8,48 8,74 8,74 8,72 8,66 8,76 8,76 8,76 8,72 8,88 Keimzahlen in lg KbE/ml 8,79 8,77 8,85 8,73 8,80 8,83 Pi: α-Pinen 8,72 8,76 8,76 8,72 8,84 8,83 8,81 8,74 8,81 8,68 8,59 8,76 T: Thymol Anhangstabelle 85: Keimzahlen der 3 Stichproben je geprüfter Einzelkonzentration, B. thermosphacta Fortsetzung Anhangstabelle 85 Konzentration Thymol in ppm Kontrolle 0,4 % Isopropylalk. 400 200 100 40 4 Konzentration Carvacrol in ppm Kontrolle 1 % Isopropylalk. 200 100 50 20 2 Keimzahlen in lg KbE/ml 8,00 7,95 2,00 2,00 5,48 7,78 8,00 8,00 8,00 2,00 2,00 5,60 7,85 8,00 8,00 7,95 2,00 2,00 5,48 7,70 8,00 Keimzahlen in lg KbE/ml 8,15 8,11 5,59 6,18 7,81 7,86 8,08 199 8,04 8,00 5,18 6,32 7,81 7,90 8,08 8,15 7,79 5,11 6,11 8,00 8,00 8,15 10 Anhang Fortsetzung Anhangstabelle 85 Konzentration Linalool in ppm Kontrolle 0,5 % Tween80 1200 720 360 3,6 Konzentration 1,8-Cineol in ppm Kontrolle 0,5 % Tween80 2800 2000 1800 1600 360 3,6 Konzentration α-Pinen in ppm Kontrolle 0,5 % Tween80 1200 800 600 400 340 3,4 Konzentration α-Terpineol in ppm Kontrolle 0,5 % Tween80 800 600 400 0,8 0,008 C: Carvacrol Ci: 1,8-Cineol Te: α-Terpineol L: Linalool Keimzahlen in lg KbE/ml 7,88 7,94 6,11 7,61 7,66 7,79 7,83 7,87 6,11 7,54 7,30 7,75 7,81 7,90 6,11 7,30 7,30 7,78 Keimzahlen in lg KbE/ml 7,93 8,04 6,26 7,32 7,82 7,90 8,11 8,08 8,00 7,99 6,18 7,28 7,76 7,88 7,95 7,95 8,04 8,00 6,28 7,36 7,73 7,82 7,98 8,15 Keimzahlen in lg KbE/ml 7,76 8,00 4,87 5,04 5,04 5,90 7,88 7,92 7,76 7,88 4,80 5,28 5,08 5,62 7,71 7,93 7,74 7,81 4,80 5,61 5,00 5,83 7,69 7,82 Keimzahlen in lg KbE/ml 7,88 7,96 7,94 7,83 8,08 7,92 8,08 Pi: α-Pinen 200 7,86 7,77 7,92 7,81 7,83 7,86 7,86 T: Thymol 7,92 7,84 7,85 7,83 7,97 7,93 7,73 10 Anhang Anhangstabelle 86: Keimzahlen der 3 Stichproben je geprüfter Einzelkonzentration, Ps. fragi Fortsetzung Anhangstabelle 86 Konzentration Thymol in ppm Kontrolle 0,4 % Isopropylalk. 400 200 100 40 4 Konzentration Carvacrol in ppm Kontrolle 1 % Isopropylalk. 200 100 50 20 2 Konzentration Linalool in ppm Kontrolle 0,5 % Tween80 1600 1200 720 360 3,6 Konzentration 1,8-Cineol in ppm Kontrolle 0,5 % Tween80 2800 2000 600 360 3,6 Keimzahlen in lg KbE/ml 8,00 7,90 7,95 7,90 7,90 7,95 2,00 2,00 2,00 6,00 6,30 6,00 7,30 7,30 7,48 8,00 7,95 8,00 8,30 8,00 8,00 Keimzahlen in lg KbE/ml 7,94 7,92 6,56 7,79 7,85 8,82 8,15 7,96 7,95 6,96 7,67 7,91 7,90 7,95 7,92 7,77 6,98 7,86 7,96 8,08 7,98 Keimzahlen in lg KbE/ml 8,04 7,86 7,57 7,73 7,68 7,79 8,04 7,95 7,90 7,40 7,74 7,84 7,72 7,95 7,93 7,81 6,96 7,67 7,81 7,74 7,98 Keimzahlen in lg KbE/ml 7,95 7,86 7,74 7,82 7,93 7,99 7,81 201 7,91 7,87 7,65 7,80 7,89 7,98 7,86 8,00 8,90 7,75 7,82 7,88 7,92 7,83 10 Anhang Fortsetzung Anhangstabelle 86 Konzentration α-Pinen in ppm Kontrolle 0,5 % Tween80 1200 800 340 3,4 Keimzahlen in lg KbE/ml 7,90 7,68 7,89 7,88 8,88 7,81 Konzentration α-Terpineol in ppm 7,89 7,81 7,82 7,82 7,74 7,74 Keimzahlen in lg KbE/ml Kontrolle 0,5 % Tween80 800 600 0,8 0,008 C: Carvacrol Ci: 1,8-Cineol Te: α-Terpineol 7,81 7,72 7,85 7,62 7,81 7,73 8,00 8,18 7,84 8,04 7,93 7,86 L: Linalool Pi: α-Pinen 7,87 7,96 7,83 7,90 7,89 7,81 7,96 7,94 7,79 7,81 7,82 7,79 T: Thymol 10.1.2 Trübungsmesswerte der Einzelstoffe Anhangstabelle 87: Messwerte der optischen Dichte von A. hydrophila unter Einfluss von Thymol Stunde Kontrolle 0 1 2 3 4 5 6 7 -3 11 12 14 51 140 314 430 0,4 % Isopropylalk. 1 11 13 21 58 134 274 421 400 200 100 40 ppm 4 ppm ppm ppm ppm Thymol Thymol Thymol Thymol Thymol -2 0 3 4 -1 4 8 14 15 9 8 8 13 17 13 5 8 10 18 21 8 8 10 25 41 2 5 5 47 142 7 4 1 98 315 6 8 8 172 412 202 10 Anhang Anhangstabelle 88: Messwerte der optischen Dichte von E. coli unter Einfluss von Thymol Stunde Kontrolle 0 1 2 3 4 5 6 7 1 12 14 28 74 157 226 255 0,4 % Isopropylalk. 2 16 16 26 67 152 230 259 400 200 100 40 ppm 4 ppm ppm ppm ppm Thymol Thymol Thymol Thymol Thymol 2 3 4 5 -3 15 15 18 13 6 12 12 16 15 9 11 12 19 27 21 7 9 27 64 69 12 10 61 135 151 6 6 118 210 219 10 9 188 239 239 Anhangstabelle 89: Messwerte der optischen Dichte von B. thermosphacta unter Einfluss von Thymol Stunde Kontrolle 0 6 7 8 9 10 11 12 0 43 59 92 126 154 168 186 0,4 % Isopropylalk. 1 33 48 76 107 133 147 162 400 200 100 40 ppm 4 ppm ppm ppm ppm Thymol Thymol Thymol Thymol Thymol -1 1 2 -7 -21 12 6 5 -2 -18 6 1 4 23 27 5 0 3 43 59 6 -1 2 63 93 5 -3 3 85 120 6 -1 2 106 136 7 -1 2 122 149 Anhangstabelle 90: Messwerte der optischen Dichte von Ps. fragi unter Einfluss vonThymol Stunde Kontrolle 0 6 7 8 9 10 11 12 4 70 90 106 138 173 197 226 0,4 % Isopropylalk. 0 52 64 78 103 137 167 198 400 200 100 40 ppm 4 ppm ppm ppm ppm Thymol Thymol Thymol Thymol Thymol -3 5 8 1 -2 1 1 2 49 61 2 2 13 64 84 -2 0 20 83 107 -2 0 33 113 138 -1 2 50 143 173 0 5 68 169 198 1 8 91 204 236 203 10 Anhang Anhangstabelle 91: Messwerte der optischen Dichte von A. hydrophila unter Einfluss von Carvacrol Stunde Kontrolle 0 1 2 3 4 5 6 7 1 12 17 31 75 178 360 426 1 % 200 ppm 100 ppm 50 ppm 20 ppm 2 ppm Isopropylalk. Carvacrol Carvacrol Carvacrol Carvacrol Carvacrol 1 8 16 29 83 181 354 435 2 9 10 13 8 7 9 13 1 10 10 10 5 6 5 11 6 16 18 20 24 56 106 167 1 11 19 30 62 136 266 318 0 4 11 22 66 167 340 405 Anhangstabelle 92: Messwerte der optischen Dichte von E. coli unter Einfluss von Carvacrol Stunde Kontrolle 0 1 2 3 4 5 6 7 -2 5 19 31 81 179 233 262 1 % 200 ppm 100 ppm 50 ppm 20 ppm 2 ppm Isopropylalk. Carvacrol Carvcrol Carvacrol Carvacrol Carvacrol 4 7 19 27 60 148 213 242 6 6 14 10 3 11 2 8 2 8 18 19 22 72 118 181 1 11 27 40 80 165 215 235 -5 -2 17 30 81 179 224 239 -10 -5 6 23 75 175 221 231 Anhangstabelle 93: Messwerte der optischen Dichte von B. thermosphacta unter Einfluss von Carvacrol Stunde Kontrolle 0 6 7 8 9 10 11 12 2 49 69 98 125 145 158 167 1% 200 ppm 100 ppm 50 ppm 20 ppm 2 ppm Isopropylalk. Carvacrol Carvcrol Carvacrol Carvacrol Carvacrol 5 36 55 80 103 119 129 139 5 7 3 3 2 2 2 1 204 7 8 8 8 9 8 11 15 3 31 48 67 87 105 117 129 2 37 59 85 110 129 141 151 -2 37 63 91 117 136 148 159 10 Anhang Anhangstabelle 94: Messwerte der optischen Dichte von Ps. fragi unter Einfluss von Carvacrol Stunde Kontrolle 0 6 7 8 9 10 11 12 1% 200 ppm 100 ppm 50 ppm 20 ppm 2 ppm Isopropylalk. Carvacrol Carvcrol Carvacrol Carvacrol Carvacrol -2 42 56 84 106 129 173 199 -1 36 48 62 79 98 125 139 4 6 4 6 8 17 21 25 7 14 28 36 48 64 85 99 0 45 58 79 99 119 154 170 -1 45 60 85 105 130 172 191 -7 34 49 77 98 124 169 194 Anhangstabelle 95: Messwerte der optischen Dichte von A. hydrophila unter Einfluss von Linalool Stunde Kontrolle 0,5 % Tween80 0 1 2 3 4 5 6 7 3 9 14 35 112 264 427 519 -2 4 5 26 104 234 394 471 1200 720 ppm 360 ppm 180 ppm 3,6 ppm ppm Linalool Linalool Linalool Linalool Linalool 1 -1 2 7 -3 7 4 2 -2 -8 8 6 2 -1 -1 13 10 8 14 27 7 7 9 56 104 9 8 15 103 243 5 7 35 205 401 1 1 60 285 499 Anhangstabelle 96: Messwerte der optischen Dichte von E. coli unter Einfluss von Linalool Stunde Kontrolle 0 1 2 3 4 5 6 7 4 10 16 21 59 137 224 252 0,5 % 1200 720 360 180 3,6 Tween80 Linalool Linalool Linalool Linalool Linalool 1 4 -1 14 10 2 7 10 6 -2 4 4 10 10 9 2 5 5 16 8 11 6 11 14 45 9 37 42 49 51 118 14 88 100 117 126 223 32 141 176 204 216 267 58 196 209 226 233 205 10 Anhang Anhangstabelle 97: Messwerte der optischen Dichte von B. thermosphacta unter Einfluss von Linalool Stunde 0 6 7 8 9 10 11 12 0,5 % Tween80 Kontrolle -2 0 15 37 67 97 122 140 1 20 32 46 63 87 111 142 1200 ppm 720 ppm 360 ppm Linalool Linalool Linalool 3 2 5 9 12 5 9 15 9 7 20 16 7 30 32 10 46 50 11 64 71 16 85 91 3,6 ppm Linalool 2 20 35 59 89 119 142 158 Anhangstabelle 98: Messwerte der optischen Dichte von Ps. fragi unter Einfluss von Linalool Stunde Kontrolle 0,5 % Tween80 0 6 7 8 9 10 11 12 8 35 65 92 115 147 165 193 2 50 89 105 124 147 169 195 1600 1200 720 ppm 360 ppm 3,6 ppm ppm ppm Linalool Linalool Linalool Linalool Linalool 2 -4 -5 5 -3 15 45 50 24 48 37 57 64 51 72 45 70 81 82 86 52 85 101 108 103 55 103 122 138 139 60 119 144 159 154 67 136 165 187 185 Anhangstabelle 99: Messwerte der optischen Dichte von A. hydrophila unter Einfluss von 1,8-Cineol Stunde Kontrolle 0,5 % Tween80 0 1 2 3 4 5 6 7 -7 4 -4 -5 65 213 382 488 -1 4 13 39 135 294 368 396 2000 1600 1400 600 360 3,6 ppm ppm ppm ppm ppm ppm Cineol Cineol Cineol Cineol Cineol Cineol 2 -1 -3 2 1 -3 8 6 4 5 5 2 9 6 4 8 6 4 5 6 2 21 24 7 12 7 4 86 116 101 13 6 3 189 264 271 12 11 11 326 377 337 17 17 25 379 439 391 206 10 Anhang Anhangstabelle 100: Stunde 0 1 2 3 4 5 6 7 Messwerte der optischen Dichte von E. coli unter Einfluss von 1,8-Cineol 0,5 % Tween80 -8 -9 -6 16 80 173 227 249 -1 4 9 25 89 175 241 267 Anhangstabelle 101: Stunde Kontrolle 0 6 7 8 9 10 11 12 0 6 7 8 9 10 11 12 3 11 5 7 17 35 79 124 2000 600 ppm 360 ppm 3,6 ppm ppm Cineol Cineol Cineol Cineol -4 -7 -5 -14 5 -6 -2 8 0 -11 -6 9 15 3 11 13 52 64 74 77 104 148 155 166 161 206 214 228 206 222 234 240 Messwerte der optischen Dichte von B. thermosphacta unter Einfluss von 1,8-Cineol 0,5 % Tween80 8 24 55 82 113 137 152 177 Anhangstabelle 102: Stunde 2800 ppm Cineol Kontrolle Kontrolle 1 54 66 72 113 149 183 215 11 27 40 62 91 123 147 166 2800 2000 1800 1600 360 3,6 ppm ppm ppm ppm ppm ppm Cineol Cineol Cineol Cineol Cineol Cineol 1 -2 1 2 -14 -6 7 7 14 15 21 0 3 7 18 20 38 24 2 11 27 31 69 55 3 23 42 45 103 89 6 42 64 67 133 113 10 63 92 92 151 127 19 76 119 118 169 140 Messwerte der optischen Dichte von Ps. fragi unter Einfluss von 1,8-Cineol 0,5 % Tween80 -2 57 83 96 121 139 165 189 2800 2000 600 360 3,6 ppm ppm ppm ppm ppm Cineol Cineol Cineol Cineol Cineol -4 -3 -1 -3 15 10 36 52 54 53 15 58 74 77 61 30 73 87 89 73 44 95 111 118 95 64 111 136 137 119 79 133 157 162 144 94 151 182 191 174 207 10 Anhang Anhangstabelle 103: Stunde Kontrolle 0 1 2 3 4 5 6 7 Messwerte der optischen Dichte von A. hydrophila unter Einfluss von α-Pinen 0,5 % Tween80 -3 2 2 15 61 177 352 471 10 -1 13 21 68 196 344 415 Anhangstabelle 104: Stunde 0 6 7 8 9 10 11 12 0,5 % Tween80 3 6 13 27 66 146 243 267 Anhangstabelle 105: Stunde Messwerte der optischen Dichte von E. coli unter Einfluss von α-Pinen Kontrolle 0 1 2 3 4 5 6 7 1200 800 600 400 340 3,4 ppm ppm ppm ppm ppm ppm Pinen Pinen Pinen Pinen Pinen Pinen 33 31 0 0 5 2 -6 -2 6 1 -7 -10 -24 -18 7 4 -8 7 -11 -22 9 15 1 -1 -15 2 37 61 52 55 20 75 107 147 158 176 91 179 213 323 321 336 206 317 333 399 380 403 Kontrolle 6 1 17 41 68 97 114 130 1200 ppm Pinen 4 11 15 25 59 141 253 281 3 11 15 25 59 132 229 263 800 ppm 340 ppm Pinen Pinen 2 4 12 22 57 129 230 259 -1 3 8 22 55 133 246 272 3,4 ppm Pinen 0 2 5 20 61 140 242 263 Messwerte der optischen Dichte von B. thermosphacta unter Einfluss von α-Pinen 0,5 % Tween80 -12 5 18 34 56 85 108 132 1200 800 600 400 340 3,4 ppm ppm ppm ppm ppm ppm Pinen Pinen Pinen Pinen Pinen Pinen -3 -21 0 6 -26 -37 -2 -23 1 0 -3 -12 -3 -18 0 2 9 8 -3 -3 -1 0 31 33 -3 2 -1 0 56 64 -3 2 -2 0 84 95 -3 -2 -2 1 101 111 19 16 -2 -1 117 127 208 10 Anhang Anhangstabelle 106: Stunde Kontrolle 0 6 7 8 9 10 11 12 -11 43 69 87 95 131 149 166 Anhangstabelle 107: Stunde Kontrolle 0 1 2 3 4 5 6 7 Anhangstabelle 108: 0 1 2 3 4 5 6 7 0,5 % 1200 ppm Tween80 Pinen -7 3 81 54 89 61 101 76 117 99 139 119 160 136 179 149 800 ppm 340 ppm Pinen Pinen -2 -4 41 53 54 65 72 81 96 104 112 127 130 144 149 160 Kontrolle 1 7 12 30 81 177 246 265 3,4 ppm Pinen -1 60 72 88 106 124 145 158 Messwerte der optischen Dichte von A. hydrophila unter Einfluss von α-Terpineol 0,5 % 800 ppm 600 ppm 400 ppm 0,8 ppm Tween80 Terpineol Terpineol Terpineol Terpineol 7 -2 6 16 58 161 327 450 Stunde Messwerte der optischen Dichte von Ps. fragi unter Einfluss von α-Pinen 20 7 -2 18 71 197 320 386 14 14 4 10 3 6 9 11 7 14 7 7 10 15 26 43 -3 15 9 13 30 72 125 190 -5 11 6 21 83 193 299 367 0,008 ppm Terpineol -9 5 0 13 71 174 314 369 Messwerte der optischen Dichte von E. coli unter Einfluss von α-Terpineol 0,5 % 800 ppm 600 ppm 0,8 ppm 0,008 ppm Tween80 Terpineol Terpineol Terpineol Terpineol 0 3 1 -4 4 7 6 8 -3 1 13 9 13 5 5 24 23 24 19 21 74 59 64 67 72 168 108 122 161 168 241 158 180 237 243 259 189 205 255 258 209 10 Anhang Anhangstabelle 109: Stunde Kontrolle 0 6 7 8 9 10 11 12 0,5 % 800 ppm 600 ppm 400 ppm 0,8 ppm Tween80 Terpineol Terpineol Terpineol Terpineol 3 36 55 81 110 134 149 163 -9 36 45 62 80 105 130 150 Anhangstabelle 110: Stunde 0 6 7 8 9 10 11 12 Messwerte der optischen Dichte von B. thermosphacta unter Einfluss von α-Terpineol Kontrolle 3 51 66 84 101 139 170 209 4 29 33 49 67 93 113 129 2 28 38 50 67 94 120 137 -1 31 39 62 87 114 136 146 3 39 53 75 98 121 145 156 0,008 ppm Terpineol 0 31 51 80 111 136 150 162 Messwerte der optischen Dichte von Ps. fragi unter Einfluss von α-Terpineol 0,5 % 800 ppm 600 ppm 0,8 ppm 0,008 ppm Tween80 Terpineol Terpineol Terpineol Terpineol -1 1 -1 1 4 69 64 65 67 48 78 71 75 79 61 89 82 88 91 74 109 98 106 111 97 132 119 126 136 122 165 144 152 162 146 192 177 185 193 169 210 10 Anhang 10.1.3 Keimzahlen Stoffkombinationen Anhangstabelle 111: Keimzahlen der 3 Stichproben je geprüfter Stoffkombinationen, A. hydrophila in lg KbE/ml Fortsetzung Anhangstabelle 111 Konzentration Thymol und Carvacrol in ppm Kontrolle Keimzahlen in lg KbE/ml 8,79 8,81 8,76 1 % Isopropylalk. 8,74 8,82 8,72 100 T + 50 C 40 T + 20 C 40 T + 2 C 4 T + 20 C 4T+2C Konzentration Thymol und Linalool in ppm Kontrolle 2,00 7,04 6,90 8,67 8,77 2,00 6,67 6,98 8,57 8,90 2,00 7,26 6,89 8,65 8,48 0,4% Isopropylalk.+ 0,5 % Tween80 40 T + 720 L 40 T + 360 L 4 T + 720 L 4 T + 360 L Konzentration Thymol und 1,8-Cineol in ppm Kontrolle 0,5 % Tween80 + 1 % Isopropylalk. 40 T + 1400 Ci 40 T + 600 Ci 4 T + 1400 Ci 4 T + 600 Ci Konzentration Thymol und α-Pinen in ppm Kontrolle 0,4% Isopropylalk.+ 0,5 % Tween80 100 T + 800 Pi 40 T + 1200 Pi 40 T + 800 Pi 4 T + 1200 Pi Keimzahlen in lg KbE/ml 8,86 8,41 8,79 8,74 8,65 8,72 2,00 7,88 2,00 8,28 2,00 7,88 2,08 8,28 2,00 7,65 2,00 8,20 Keimzahlen in lg KbE/ml 8,89 8,74 8,81 8,82 8,79 8,84 5,04 8,43 6,26 8,74 5,18 8,32 6,23 8,61 4,84 8,43 6,18 8,63 Keimzahlen in lg KbE/ml 8,81 8,93 8,81 8,78 8,98 8,74 2,00 8,60 8,97 8,88 2,00 8,40 8,73 8,41 2,00 8,51 8,66 8,66 211 10 Anhang Fortsetzung Anhangstabelle 111 Konzentration Thymol und α-Terpineol in ppm Keimzahlen in lg KbE/ml Kontrolle 0,4% Isopropylalk.+ 0,5 % Tween80 40 T + 600 Te 40 T + 400 Te 4 T + 600 Te 4 T + 400 Te Konzentration Carvacrol und 1,8-Cineol in ppm Kontrolle 8,89 8,74 8,81 0,5 % Tween80 + 1 % Isopropylalk. 8,82 8,79 8,84 4,08 8,45 5,20 8,82 4,15 7,93 5,63 8,82 4,26 8,20 5,15 8,84 50 C + 1400 Ci 50 C + 600 Ci 20 C + 1400 Ci 20 C + 600 Ci Konzentration Carvacrol und α-Pinen in ppm Kontrolle 0,5 % Tween80 + 1 % Isopropylalk. 100 C + 800 Pi 50 C + 1200 Pi 50 C + 800 Pi 20 C + 1200 Pi 20 C + 800 Pi Konzentration Carvacrol und α-Terpineol in ppm Kontrolle 8,76 8,77 8,76 8,80 8,79 8,79 6,00 6,76 8,04 8,73 6,18 6,93 7,89 8,60 5,99 6,91 8,00 8,53 Keimzahlen in lg KbE/ml Keimzahlen in lg KbE/ml 8,81 8,93 8,81 8,78 8,98 8,74 4,81 8,65 8,73 8,74 8,95 4,81 8,54 8,81 8,68 8,78 4,90 8,43 8,71 8,71 8,79 Keimzahlen in lg KbE/ml 8,76 8,77 8,76 0,5 % Tween80 + 1 % Isopropylalk. 8,80 8,79 8,79 50 C + 600 Te 50 C + 400 Te 20 C + 600 Te 20 C + 400 Te 2 C + 600 Te 2 C + 400 Te 6,70 7,43 7,92 8,48 7,89 8,79 6,53 7,11 7,81 8,58 7,78 8,74 6,72 7,34 7,85 8,61 7,76 8,66 C: Carvacrol Ci: 1,8-Cineol Te: α-Terpineol L: Linalool Pi: α-Pinen 212 T: Thymol 10 Anhang Anhangstabelle 112: Keimzahlen der 3 Stichproben je geprüfter Stoffkombinationen, E. coli in lg KbE/ml Fortsetzung Anhangstabelle 112 Konzentration Thymol und Carvacrol in ppm Kontrolle Keimzahlen in lg KbE/ml 8,88 8,81 8,78 1 % Isopropylalk. 8,86 8,75 8,77 100 T + 200 C 100 T + 100 C 100 T + 50 C 40 T + 20 C 40 T + 2 C Konzentration Thymol und Linalool in ppm Kontrolle 2,00 2,00 2,00 8,23 8,59 2,00 2,00 2,00 8,15 8,23 2,00 2,00 2,00 8,11 8,30 0,4% Isopropylalk.+ 0,5 % Tween80 100 T + 1200 L 100 T + 720 L 40 T + 1200 L 40 T + 720 L 4 T + 1200 L 4 T + 720 L Konzentration Thymol und 1,8-Cineol in ppm Kontrolle Keimzahlen in lg KbE/ml 8,77 8,72 8,68 8,76 8,79 8,74 2,00 2,00 2,00 5,90 2,00 7,82 2,00 2,00 2,00 5,89 2,00 7,67 2,00 2,00 2,00 6,00 2,00 7,66 Keimzahlen in lg KbE/ml 8,69 8,54 8,62 0,5 % Tween80 + 1 % Isopropylalk. 8,70 8,63 8,65 100 T + 2800 Ci 100 T + 2000 Ci 40 T + 2800 Ci 40 T + 2000 Ci 4,91 6,72 7,74 8,66 4,84 6,65 7,00 8,51 4,91 6,68 7,00 8,62 213 10 Anhang Fortsetzung Anhangstabelle 112 Konzentration Thymol und Pinen in ppm Kontrolle 0,4% Isopropylalk.+ 0,5 % Tween80 100 T + 1200 Pi 100 T + 800 Pi 40 T + 1200 Pi 40 T + 800 Pi Konzentration Thymol und Terpineol in ppm Kontrolle 0,4% Isopropylalk. + 0,5 % Tween80 100 T + 800 Te 100 T + 600 Te 40 T + 800 Te 40 T + 600 Te Keimzahlen in lg KbE/ml 9,08 8,92 8,76 8,95 8,88 8,78 8,04 7,72 8,81 8,79 7,82 7,65 8,76 8,65 7,93 7,76 8,76 8,81 Keimzahlen in lg KbE/ml 8,73 8,72 8,74 8,79 8,76 8,74 6,69 6,90 8,65 8,70 6,65 6,08 8,51 8,54 6,64 6,04 8,63 8,63 Konzentration Carvacrol und Linalool in ppm Keimzahlen in lg KbE/ml Kontrolle 8,77 8,72 8,68 0,5 % Tween80 + 1 % Isopropylalk. 8,76 8,79 8,74 2,00 4,83 2,00 6,74 2,00 6,71 2,00 4,76 2,00 6,59 2,00 6,74 2,00 4,75 2,00 6,66 2,00 6,66 50 C + 1200 L 50 C + 720 L 20 C + 1200 L 20 C + 720 L 2 C + 1200 L 2 C + 720 L Konzentration Carvacrol und 1,8-Cineol in ppm Kontrolle 0,5 % Tween80 + 1 % Isopropylalk. 50 C + 2800 Ci 50 C + 2000 Ci 20 C + 2800 Ci 20 C + 2000 Ci Keimzahlen in lg KbE/ml 8,69 8,54 8,62 8,70 7,36 8,00 7,15 8,61 8,63 6,91 7,98 7,11 8,66 8,65 7,15 8,00 7,04 8,56 214 10 Anhang Fortsetzung Anhangstabelle 112 Konzentration Carvacrol und α-Pinen in ppm Kontrolle 0,5 % Tween80 + 1 % Isopropylalk. 200 C + 1200 Pi 200 C + 800 Pi 100 C + 1200 Pi 100 C + 800 Pi Konzentration Carvacrol und α-Terpineol in ppm Kontrolle Keimzahlen in lg KbE/ml 9,08 8,92 8,76 8,95 8,88 8,78 2,00 2,00 8,87 8,97 2,00 2,00 8,92 8,74 2,00 2,00 8,82 8,75 Keimzahlen in lg KbE/ml 8,73 8,72 8,74 0,5 % Tween80 + 1 % Isopropylalk. 8,79 8,76 8,74 200 C + 800 Te 200 C + 600 Te 100 C + 800 Te 100 C + 600 Te 50 C + 800 Te 2,00 2,00 8,26 8,26 8,74 2,00 2,00 8,51 8,04 8,76 2,00 2,00 8,57 8,04 8,75 Pi: α-Pinen C: Carvacrol Ci: 1,8-Cineol Te: α-Terpineol L: Linalool T: Thymol Anhangstabelle 113: Keimzahlen der 3 Stichproben je geprüfter Stoffkombinationen, B. thermosphacta in lg KbE/ml Fortsetzung Anhangstabelle 113 Konzentration Thymol und Carvacrol in ppm Kontrolle Keimzahlen in lg KbE/ml 7,79 7,65 7,62 1 % Isopropylalk. 7,75 7,70 7,66 100 T + 100 C 100 T + 50 C 40 T + 20 C 40 T + 2 C 4 T + 20 C 4T+2C 2,00 2,77 7,23 7,32 7,81 7,84 2,00 2,40 7,04 7,11 7,74 7,70 2,00 2,86 7,08 7,18 7,66 7,81 215 10 Anhang Fortsetzung Anhangstabelle 113 Konzentration Thymol und Linalool in ppm Kontrolle 0,4% Isopropylalk.+ 0,5 % Tween80 100 T + 1200 L 100 T + 720 L 40 T + 1200 L 40 T + 720 L 4 T + 1200 L 4 T + 720 L Konzentration Thymol und 1,8-Cineol in ppm Kontrolle 0,5 % Tween80 + 0,4 % Isopropylalk. 100 T + 2000 Ci 100 T + 1800 Ci 40 T + 2000 Ci 40 T + 1800 Ci Konzentration Thymol und α-Pinen in ppm Kontrolle 0,4% Isopropylalk.+ 0,5 % Tween80 100 T + 400 Pi 100 T + 340 Pi 40 T + 400 Pi 40 T + 340 Pi 4T + 400 Pi Konzentration Thymol und α-Terpineol in ppm Kontrolle 0,4% Isopropylalk.+ 0,5 % Tween80 100 T + 800 Te 100 T + 600 Te 40 T + 800 Te 40 T + 600 Te Keimzahlen in lg KbE/ml 8,41 8,36 8,40 8,26 8,30 8,34 2,00 3,85 2,11 6,79 4,90 7,79 2,00 3,56 3,15 7,40 5,15 7,70 2,30 3,61 3,26 7,04 5,18 7,69 Keimzahlen in lg KbE/ml 7,89 7,81 7,90 7,91 7,81 7,86 4,76 5,64 7,81 7,70 4,87 5,83 7,66 7,72 4,98 5,76 7,80 7,65 Keimzahlen in lg KbE/ml 7,89 7,73 7,72 7,83 7,76 7,73 4,80 6,86 6,34 7,70 6,11 4,87 6,88 6,54 7,81 6,63 4,75 6,81 6,58 7,65 6,30 Keimzahlen in lg KbE/ml 8,04 7,78 7,79 8,00 7,80 7,81 7,04 6,95 8,04 7,85 6,60 7,15 7,89 7,90 6,64 6,88 7,79 7,90 216 10 Anhang Fortsetzung Anhangstabelle 113 Konzentration Carvacrol und Linalool in ppm Kontrolle 0,5 % Tween80 + 1 % Isopropylalk. 50 C + 1200 L 50 C + 720 L 20 C + 1200 L 20 C + 720 L 2 C + 1200 L Konzentration Carvacrol und 1,8-Cineol in ppm Kontrolle 0,5 % Tween80 + 1 % Isopropylalk. 100 C + 2000 Ci 100 C + 1800 Ci 50 C + 2000 Ci 50 C + 1800 Ci Konzentration Carvacrol und α-Pinen in ppm Kontrolle 0,5 % Tween80 + 1 % Isopropylalk. 100 C + 400 Pi 100 C + 340 Pi 50 C + 400 Pi 50 C + 340 Pi 20 C + 400 Pi Konzentration Carvacrol und α-Terpineol in ppm Kontrolle 0,5 % Tween80 + 1 % Isopropylalk. 100 C + 800 Te 100 C + 600 Te 50 C + 800 Te 50 C + 600 Te C: Carvacrol Ci: 1,8-Cineol Te: α-Terpineol L: Linalool Keimzahlen in lg KbE/ml 8,41 8,36 8,40 8,26 8,30 8,34 4,04 7,26 3,08 7,46 7,15 4,18 6,83 3,32 7,57 4,90 4,04 7,08 3,11 7,53 7,15 Keimzahlen in lg KbE/ml 7,89 7,81 7,90 7,91 7,81 7,86 6,49 5,92 7,80 7,76 6,26 6,18 7,71 7,66 5,94 5,88 7,63 7,69 Keimzahlen in lg KbE/ml 7,89 7,73 7,72 7,83 7,76 7,73 5,08 7,15 6,26 7,77 6,70 4,80 6,94 6,49 7,68 6,28 5,04 6,96 6,04 7,57 6,54 Keimzahlen in lg KbE/ml 8,04 7,78 7,79 8,00 7,80 7,81 7,80 7,71 7,78 7,94 7,86 7,73 7,93 7,86 7,71 7,94 7,85 7,91 Pi: α-Pinen 217 T: Thymol 10 Anhang Anhangstabelle 114: Keimzahlen der 3 Stichproben je geprüfter Stoffkombinationen, Ps. fragi in lg KbE/ml Fortsetzung Anhangstabelle 114 Konzentration Thymol und Carvacrol in ppm Kontrolle Keimzahlen in lg KbE/ml 7,92 8,00 8,00 1 % Isopropylalk. 7,86 7,83 7,93 250 T + 250 C 250 T + 125 C 100 T + 50 C 100 T + 5 C Konzentration Thymol und Linalool in ppm Kontrolle 6,64 6,96 7,88 7,90 6,63 7,08 8,00 7,84 6,79 7,11 7,83 7,82 0,4% Isopropylalk.+ 0,5 % Tween80 250 T + 3000 L 250 T + 1800 L 100 T + 3000 L 100 T + 1800 L Konzentration Thymol und 1,8-Cineol in ppm Kontrolle 0,5 % Tween80 + 0,4 % Isopropylalk. 250 T + 7000 Ci 250 T + 5000 Ci 100 T + 7000 Ci 100 T + 5000 Ci Konzentration Thymol und α-Pinen in ppm Kontrolle 0,4% Isopropylalk.+ 0,5 % Tween80 100 T + 1200 Pi 100 T + 800 Pi 40 T + 1200 Pi 40 T + 800 Pi Keimzahlen in lg KbE/ml 7,91 7,84 7,88 7,92 7,85 7,90 6,92 7,08 6,73 7,87 6,93 7,08 6,72 7,76 6,86 6,76 6,93 7,65 Keimzahlen in lg KbE/ml 7,91 7,91 7,85 7,85 7,84 7,82 7,30 7,77 7,86 7,74 7,18 7,80 7,70 7,70 7,11 7,76 7,68 7,71 Keimzahlen in lg KbE/ml 7,93 7,84 7,84 7,86 7,83 7,88 7,79 7,72 7,87 7,78 7,68 7,72 7,95 7,69 7,74 7,75 7,83 7,67 218 10 Anhang Fortsetzung Anhangstabelle 114 Konzentration Thymol und α-Terpineol in ppm Kontrolle 0,4% Isopropylalk.+ 0,5 % Tween80 100 T + 800 Te 100 T + 600 Te 40 T + 800 Te 40 T + 600 Te Konzentration Carvacrol und Linalool in ppm Kontrolle 0,5 % Tween80 + 1 % Isopropylalk. 50 C + 1200 L 50 C + 720 L 20 C + 1200 L 20 C + 720 L Konzentration Carvacrol und 1,8-Cineol in ppm Kontrolle 0,5 % Tween80 + 1 % Isopropylalk. 200 C + 2800 Ci 200 C + 2000 Ci 100 C + 2800 Ci 100 C + 2000 Ci Konzentration Carvacrol und α-Pinen in ppm Kontrolle Keimzahlen in lg KbE/ml 7,77 7,80 7,80 7,78 7,81 7,82 6,85 6,87 7,79 7,76 6,80 6,75 7,79 7,73 6,92 6,83 7,71 7,74 Keimzahlen in lg KbE/ml 7,91 7,84 7,88 7,92 7,85 7,90 6,98 7,85 7,23 7,91 6,51 7,85 7,08 7,89 7,00 7,85 7,04 7,86 Keimzahlen in lg KbE/ml 7,91 7,91 7,85 7,85 7,84 7,82 7,18 7,76 7,89 7,78 7,15 7,65 7,83 7,62 7,18 7,69 7,69 7,76 Keimzahlen in lg KbE/ml 7,93 7,84 7,84 0,5 % Tween80 + 1 % Isopropylalk. 7,86 7,83 7,88 200 C + 1200 Pi 200 C + 800 Pi 100 C + 1200 Pi 100 C + 800 Pi 4,81 4,11 7,72 7,86 4,23 4,04 7,74 7,72 4,70 4,08 7,64 7,68 219 10 Anhang Fortsetzung Anhangstabelle 114 Konzentration Carvacrol und α-Terpineol in ppm Kontrolle Keimzahlen in lg KbE/ml 7,77 7,80 7,80 0,5 % Tween80 + 1 % Isopropylalk. 7,78 7,81 7,82 100 C + 800 Te 100 C + 600 Te 50 C + 800 Te 50 C + 600 Te 7,15 7,08 7,81 7,75 6,97 6,90 7,88 7,72 7,08 6,94 7,48 7,75 C: Carvacrol Ci: 1,8-Cineol Te: α-Terpineol L: Linalool Pi: α-Pinen T: Thymol 10.1.4 Trübungsmesswerte der geprüften Stoffkombinationen Anhangstabelle 115: Messwerte der optischen Dichte der geprüften Stoffkombinationen zur Stunde 7 und Differenz der optischen Dichte der Stoffkombinationen zu der optischen Dichte der Kontrollprobe zur Stunde 7, A. hydrophila Fortsetzung Anhangstabelle 115 Kontrolle Differen z OD Stunde 7 Differen z OD Stunde 7 100 ppm 1% T+50 ppm Isopropylalk. C 40 ppm 4 ppm 4 ppm T+2 T+20 T+2 ppm C ppm C ppm C -489,5571 -480,819 473,386 168,233 76,1857 0 -20,2952 489 468 -1 8 15 Kontrolle 0, 5 %Tween 80 + 0,4 % Isopropylalk. 40 ppm T+720 ppm L 40 ppm T+360 ppm L 4 ppm T+720 ppm L 4 ppm T+ 360 ppm L 0 -6 -442 -410 -445 -279 454 448 12 44 9 175 40 ppm T+1400 ppm Ci 40 ppm T+600 ppm Ci 4 ppm T+1400 ppm Ci 4 ppm T+600 ppm Ci 0,5 % Tween80 + Kontrolle 0,4 % Isopropylalk. Differen z OD Stunde 7 40 ppm T+20 ppm C 320 412 0 -16 -441 -225 -438 -128 446 430 5 221 7 318 220 10 Anhang Fortsetzung Anhangstabelle 115 0,4 % Isopropylalk. Kontrolle + 0,5 % Tween80 Differen 0 -2 z OD 486 484 Stunde 7 0,5 % Tween80 + Kontrolle 0,4 % Isopropylalk. Differen 0 -15 z OD 462 447 Stunde 7 0, 5 % Tween80 + Kontrolle 1% Isopropylalk. Differen 0 -11 z7 OD 426 415 Stunde 7 0,5 % Tween80 + Kontrolle 1% Isopropylalk. Differen 0 -16 z OD 446 430 Stunde 7 1% Isopropylalk. Kontrolle + 0,5 % Tween80 Differen 0 -2 z OD 486 484 Stunde 7 100 ppm T+800 ppm Pi 40 ppm T+1200 ppm Pi 40 ppm T+800 ppm Pi 4 ppm T+1200 ppm Pi -479 -269 -191 -142 8 217 295 344 40 ppm T+600 ppm T 40 ppm T+400 ppm Te 4 ppm T+600 ppm Te 4 ppm T+400 ppm Te -448 -438 -398 -271 13 24 64 190 50 ppm C +720 ppm L 50 ppm C +360 ppm L -422 -397 -419 -294 -421 4 29 7 131 5 50 ppm C+1400 ppm Ci 20 ppm 20 ppm C+720 C+360 ppm L ppm L 50 ppm 20 ppm C+600 C+1400 ppm Ci ppm Ci 2 ppm C+720 ppm L 20 ppm C+600 ppm Ci -444 -284 -445 -132 2 161 1 314 100 ppm C+800 ppm Pi 50 ppm 50 ppm 20 ppm 20 ppm C+1200 C+800 C+1200 C+800 ppm Pi ppm Pi ppm Pi ppm Pi -475 -281 -156 -154 -98 12 205 330 332 388 221 10 Anhang Fortsetzung Anhangstabelle 115 0,5 % Tween80 + Kontrolle 1% Isopropylalk. Differen 0 -15 z OD 462 447 Stunde 7 C: Carvacrol Ci: 1,8-Cineol L: Linalool OD: optische Dichte Anhangstabelle 116: 50 ppm C+600 ppm Te 50 ppm C+400 ppm Te -449 -428 -435 -346 -421 12 34 27 115 41 Pi: α-Pinen 20 ppm 20 ppm 2 ppm C+600 C+400 C+600 ppm Te ppm Te ppm Te Te: α-Terpineol T: Thymol Messwerte der optischen Dichte der geprüften Stoffkombinationen zur Stunde 7 und Differenz der optischen Dichte der Stoffkombinationen zu der optischen Dichte der Kontrollprobe zur Stunde 7, E. coli Fortsetzung Anhangstabelle 116 100 100 100 1% ppm ppm ppm Kontrolle Isopropylalk. T+200 T+100 T+50 ppm C [ ppm C ppm C Differenz -21 -261 -261 -264 OD 265,3 245 4 4 2 Stunde 7 0,5 % 100 100 40 ppm Tween80 + ppm ppm Kontrolle T+1200 0,4 % T+1200 T+720 ppm L Isopropylalk. ppm L ppm L Differenz 0 -30 -218 -105 -141 OD 260 230 42 155 118 Stunde 7 0,5 % 100 Tween80 + ppm Kontrolle 0,4 % T+2800 Isopropylalk. ppm Ci Differenz OD Stunde 7 100 ppm T +2000 ppm Ci 0 12 -238 -234 252 264 13 17 222 400 ppm T+20 ppm C -123 40 ppm T+2 ppm C -65 142 200 40 4 ppm 4 ppm ppm T T+720 T+720 +1200 ppm L ppm L ppm L -256 -244 -228 4 16 32 40 ppm T 40 ppm T +2800 +2000 ppm Ci ppm Ci -215 -135 37 116 10 Anhang Fortsetzung Anhangstabelle 116 0,4 % 100 Isopropylalk. ppm T Kontrolle + 0,5 % +1200 Tween80 ppm Pi Differenz OD Stunde 7 0 2 -183 -223 272 274 89 48 0,5 % 100 Tween80 + ppm T Kontrolle 0,4 % +800 Isopropylalk. ppm Te Differenz OD Stunde 7 100 ppm T +800 ppm Pi 100 ppm T +600 ppm Te 0 21 -245 -258 278 299 32 20 40 ppm T 40 ppm T +1200 +800 ppm Pi ppm Pi -50 -38 221 234 40 ppm T 40 ppm T +800 +600 ppm Te ppm Te -83 -68 195 210 0,5 % 50 20 50 ppm 20 ppm 2 ppm Tween80 + ppm ppm Kontrolle C+1200 C+1200 C+1200 ppm 1% C+720 C+720 ppm L ppm L L Isopropylalk. ppm L ppm L Differenz 0 -30 -242 -239 -240 -238 -248 OD 260 230 18 20 20 22 11 Stunde 7 20 0,5 % 50 ppm ppm Tween80 + C+ 50 ppm C C+ 20 ppm C Kontrolle 1% 2800 +2000 ppm Ci 2800 +2000 ppm Ci Isopropylalk. ppm Ci ppm Ci Differenz 0 12 -213 -142 -210 -115 OD 252 264 38 110 41 136 Stunde 7 100 1% 200 ppm C Isopropylalk. ppm 200 ppm C 100 ppm C Kontrolle +1200 + 0,5 % C+1200 +800 ppm Pi +800 ppm Pi ppm Tween80 ppm Pi Pi Differenz 0 2 -272 -259 -47 -66 OD 272 274 -1 12 224 205 Stunde 7 223 10 Anhang Fortsetzung Anhangstabelle 116 200 0,5 % 200 100 C ppm C 100 C Tween80 + ppm C +600 50 ppm C Kontrolle +600 +800 1% +800 ppm +800 ppm Te ppm ppm Te Isopropylalk. ppm Te Te Te Differenz 0 21 -268 -270 -158 -188 -95 OD 278 299 10 8 120 90 182 Stunde 7 Pi: α-Pinen C: Carvacrol Ci: 1,8-Cineol L: Linalool OD: optische Dichte Anhangstabelle 117: T: Thymol Te: α-Terpineol Messwerte der optischen Dichte der geprüften Stoffkombinationen zur Stunde 7 und Differenz der optischen Dichte der Stoffkombinationen zu der optischen Dichte der Kontrollprobe zur Stunde 7, B. thermosphacta Fortsetzung Anhangstabelle 117 100 100 ppm 40 ppm 40 ppm 4 ppm ppm T T +50 T+20 T+2 ppm T+20 +100 ppm C ppm C C ppm C ppm C 10,89636 150,10 -151,775 -92,4989 -73,5036 -23,7132 8 1% Kontrolle Isopropyl alk. Differenz OD Stunde 12 0 158,208 169,1048 4 8,1 6,43333 65,7095 84,7047 134,495 3 2 6 2 0,5 % 100 Tween80 100 ppm 40 ppm ppm Kontrolle + 0,4 % T+720 T+1200 T+1200 Isopropyl ppm L ppm L ppm L alk. Differenz 0 -14 -171 -166 -180 OD Stunde 167 154 -4 1 -12 12 224 40 ppm T+720 ppm L 4 ppm T+1200 ppm L -128 -175 39 -8 10 Anhang Fortsetzung Anhangstabelle 117 0,5 % Tween80 Kontrolle + 0,4 % Isopropyl alk. Differenz 0 9 OD Stunde 172 181 12 0,4 % Isopropyl Kontrolle alk. + 0,5 % Tween80 Differenz 0 -7 OD 180 172 Stunde12 0,5 % Tween80 Kontrolle + 0,4 % Isopropyl alk. Differenz 0 23 OD Stunde 165 189 12 0,5 % Tween80 Kontrolle + 0,4 % Isopropyl alk. Differenz 0 -14 OD Stunde 167 154 12 0,5 % Tween80 Kontrolle + 0,1 % Isopropyl alk. Differenz 0 9 OD Stunde 172 181 12 100 100 ppm 40 ppm ppm T T +1800 T +2000 +2000 ppm Ci ppm Ci ppm Ci 40 ppm T+1800 ppm Ci -166 -171 -110 -82 7 1 62 90 100 100 ppm ppm T+ T+ 40 400 ppm Pi ppm Pi 40 ppm T +400 ppm Pi 40 ppm T +340 ppm Pi 4 ppm T +400 ppm Pi -180 -134 -172 -38 -168 1 46 8 142 12 100 100 ppm 40 ppm ppm T T +600 T +800 +800 ppm Te ppm Te ppm Te 40 ppm T + 600 ppm Te -135 -124 -26 -19 30 41 140 146 50 ppm 50 ppm C+1200 C+720 ppm L ppm L 20 ppm C +1200 ppm L 20 ppm C +720 ppm L 2 ppm C + 1200 ppm L -143 -129 -163 -105 -165 25 38 5 62 3 100 100 ppm 50 ppm ppm C C +1800 C +2000 +2000 ppm Ci ppm Ci ppm Ci 50 ppm C+1800 ppm Ci -169 -166 -35 -92 3 6 137 81 225 10 Anhang Fortsetzung Anhangstabelle 117 1% Isopropyl Kontrolle alk. + 0,5 % Tween80 Differenz 0 -7 OD 180 172 Stunde12 0,5 % Tween80 Kontrolle +1% Isopropyl alk. Differenz 0 23 OD 165 189 Stunde12 100 100 ppm ppm C C +340 +400 ppm Pi ppm Pi 50 ppm C +340 ppm Pi 20 ppm C+400 ppm Pi -181 -139 -172 -52 -173 -1 41 8 128 7 100 100 ppm ppm C C+ 600 +800 ppm Te ppm Te C: Carvacrol Ci: 1,8-Cineol L: Linalool OD: optische Dichte Anhangstabelle 118: 50 ppm C +400 ppm Pi 50 ppm C+800 ppm Te 50 ppm C+ 600 ppm Te -54 -41 -33 18 112 124 132 183 Pi: α-Pinen T: Thymol Te: α-Terpineol Messwerte der optischen Dichte der geprüften Stoffkombinationen zur Stunde 7 und Differenz der optischen Dichte der Stoffkombinationen zu der optischen Dichte der Kontrollprobe zur Stunde 7, Ps. fragi Fortsetzung Anhangstabelle 118 Kontrolle Differenz OD Stunde 12 0 168 100 1% ppm T Isopropylalk. +100 C ppm -4 -167 165 2 0,5 % 100 Tween80 + ppm T Kontrolle 0,4 % +1200 Isopropylalk. ppm L Differenz 0 -27 -150 OD Stunde 185 158 35 12 226 100 40 ppm ppm T T+20 +50 ppm C ppm C -142 -30 26 139 100 ppm T +720 ppm L -141 40 ppm T +1200 ppm L -118 44 67 40 ppm T + 2 ppm C -23 145 40 ppm T+720 ppm L -70 115 10 Anhang Fortsetzung Anhangstabelle 118 0,5 % Tween80 + Kontrolle 0,4 % Isopropylalk. Differenz 0 -26 OD Stunde 201 175 12 0,4 % Isopropylalk. Kontrolle + 0,5 % Tween80 Differenz 0 -2 OD 167 165 Stunde12 0,5 % Tween80 + Kontrolle 0,4 % Isopropylalk. Differenz 0 -20 OD Stunde 180 160 12 0,5 % Tween80 + Kontrolle 1% Isopropylalk. Differenz 0 -27 OD Stunde 185 158 12 0,5 % Tween80 + Kontrolle 1% Isopropylalk. Differenz 0 -26 OD Stunde 201 175 12 100 100 40 ppm ppm T ppm T T +2800 +2000 +2800 ppm Ci ppm Ci ppm Ci -148 -143 -105 53 100 ppm T +1200 ppm Pi -101 66 58 24 121 40 ppm T +800 ppm Pi -13 151 100 100 40 ppm ppm T ppm T T +800 +800 +600 ppm Te ppm Te ppm Te -145 -156 -25 35 -80 97 100 40 ppm ppm T T +800 +1200 ppm Pi ppm Pi -110 -16 57 40 ppm T+2000 ppm Ci 154 40 ppm T +600 ppm Te -21 155 50 ppm 50 ppm 20 ppm C+1200 C +720 C+1200 ppm L ppm L ppm L 159 20 ppm C+ 720 ppm L -127 -78 -126 -48 58 106 58 137 200 200 100 100 50 ppm ppm C ppm C ppm C ppm C C +2800 +2000 +2800 +2000 +2800 ppm Ci ppm Ci ppm Ci ppm Ci ppm Ci -199 -201 -134 -143 -84 2 227 1 67 58 117 10 Anhang Fortsetzung Anhangstabelle 118 1% Isopropylalk. Kontrolle + 0,5 % Tween80 Differenz 0 -2 OD 167 165 Stunde12 0,5 % Tween80 + Kontrolle 1% Isopropylalk. Differenz 0 -20 OD 180 160 Stunde12 C: Carvacrol Ci: 1,8-Cineol L: Linalool OD: optische Dichte 200 ppm C +1200 ppm Pi -160 200 ppm C +800 ppm Pi -165 100 ppm C +1200 ppm Pi -81 7 2 87 100 ppm C+ 800 ppm Pi -74 93 100 100 50 ppm ppm C ppm C 50 ppm C + 600 C +800 +800 +600 ppm Te ppm Te ppm Te ppm Te -134 -151 -25 -15 46 29 Pi: α-Pinen 228 155 T: Thymol 165 Te: α-Terpineo 10 Anhang 10.2 Technische Geräte und Verbrauchsmaterialien Abwägeschiffchen Carl Roth GmbH + Co. KG, Karlsruhe, Deutschland Autoklav Webeco, Bad Schwartau, Deutschland Brutschrank, 30 °C Memmert, Schwabach, Deutschl and Brutschrank, 37 °C Memmert, Schwabach, Deutschl and Brutschrank, 42 °C Memmert, Schwabach, Deutschl and Dampftopf Nr. 920909 Fritz Gössner GmbH & Co., Hamburg, Deutschland Dispensor, Fortuna®, Optimat® 2, OMNILAB, Bremen, Deutschland Nr. 4000974600501 Erlenmeyerkolben, 100 ml Schott Duran GmbH, Wertheim/Main Deutschland Faltenfilter Schleicher&Schütt GmbH, Dassel, Nr. 311656 Deutschland Gefriertruhe -80 °C, Typ 6385 GFL – Gesellschaft für Labortechnik mbH, Burgwedel, Deutschland Glaskolben, 500 ml Schott Duran GmbH, Wertheim/Main, Deutschland 229 10 Anhang Infinite 200® Tecan, Crailsheim, Deutschland Isopropylalkohol CG Chemikalien, Laatzen, Deutschland Kapsenberg-Kappen Schott Duran GmbH, Wertheim/Main, Deutschland Kühlschrank Liebherr, Ochsenhausen, Deutschland Magnetrührer C. Gerhardt GmbH & Co. KG, Königswinter, Deutschland Microbank®, 22 V 160 MO Viva Diagnostika, Diagnostische Produkte GmbH, Köln, Deutschland Mikroliter-Pipette, Reference® Eppendorf GmbH, Hamburg 1 – 10 µl Deutschland Mikroliter-Pipette, Reference® Eppendorf GmbH, Hamburg 1 – 200 µl Deutschland Mikroliter-Pipette, Reference®, Eppendorf GmbH, Hamburg, 100 - 1000 µl Deutschland Oberschalenwaage, Typ MC1 Sartorius AG, Göttingen, Deutschland Petrischalen, 90Ø ohne Nocken Ronnenberger Laborbedarf, 10-00218 Ronnenberg, Deutschland pH-Meter, Nr. 38900138 WTW GmbH, Weilheim, Deutschland 230 10 Anhang Pipettenspitzen 10 µl Sarstedt, Nümbrecht, Deutschland Pipettenspitzen 200 µl Carl Roth GmbH & Co. KG, Karlsruhe, Deutschland Pipettenspitzen 1000 µl Carl Roth GmbH & Co. KG, Karlsruhe, Deutschland QPCR-Seals, Nr. AB1170 ABgene, Hamburg, Deutschland Reagenzgläser Schott Duran GmbH, Wertheim/Main, Deutschland Rotabilo® Zentrifugenröhrchen Carl Roth GmbH & Co. KG, Karlsruhe, 15 ml, farblos, steril Deutschland Nr. 461.1 Rondoflame Fireboy eco TecNoMara Schüttler Janke & Kunkel IKA®-Werke GmbH & Co. KG, Staufen, Deutschland Sterilisator Memmert, Schwabach, Deutschland TC – Platten, 96 Well, Sarstedt, Nümbrecht, Deutschland für Suspensionszellen Nr. 83.1835.500 Tween80, Nr. A4743,1000 AppliChem, Darmstadt, Deutschland Umkehr Osmose Anlage SG Kloos Laborbedarf, Langenhagen, Deutschland 231 10 Anhang Waage 0,1 - 120 g Mettler-Toledo GmbH, Giessen, Deutschland Waage 1 - 2000 g Mettler-Toledo GmbH, Giessen, Deutschland Wasserbad Memmert, Schwabach, Deutschland 232 10 Anhang 10.3 Tabellenverzeichnis Tabelle 1: Minimale Hemmstoffkonzentrationen (MHK) von ätherischen Ölen in vitro ....................................................................................... 22 Tabelle 2: Übersicht über die verwendeten Inhaltsstoffe ätherischer Öle .......... 35 Tabelle 3: Verwendete Bakterienstämme .......................................................... 36 Tabelle 4: Gehalt an ätherischem Öl bei ausgewählten Gewürzpflanzen und Anteil des ausgewählten Inhaltsstoffs im Öl ............................... 39 Tabelle 5: Einsatzbereiche der ausgewählten Gewürzpflanzen und eingesetzte Maximalmenge je kg Lebensmittel für übliche Würzzwecke...................................................................................... 39 Tabelle 6: Untersuchte Konzentrationen von Thymol in ppm ............................ 40 Tabelle 7: Untersuchte Konzentrationen von Carvacrol in ppm ......................... 40 Tabelle 8: Untersuchte Konzentrationen von Linalool in ppm ............................ 41 Tabelle 9: Untersuchte Konzentrationen von 1,8-Cineol in ppm ........................ 41 Tabelle 10: Untersuchte Konzentrationen von α-Pinen in ppm............................ 41 Tabelle 11: Untersuchte Konzentrationen von α-Terpineol in ppm ...................... 41 Tabelle 12: Beimpfung der Mikrotiterplatte zum Erreichen der Einzelstoffkonzentrationen ................................................................ 46 Tabelle 13: Beimpfung der Mikrotiterplatte zum Erreichen der Stoffkombinationen ........................................................................... 47 Tabelle 14: An A. hydrophila getestete Kombinationen von Thymol mit Carvacrol, Linalool, 1,8-Cineol, α-Pinen und α-Terpineol in ppm ...... 53 Tabelle 15: An E. coli getestete Kombinationen von Thymol mit Carvacrol, Linalool, 1,8-Cineol, α-Pinen und α-Terpineol in ppm ....................... 53 Tabelle 16: An B. thermosphacta getestete Kombinationen von Thymol mit Carvacrol, Linalool, 1,8-Cineol, α-Pinen und α-Terpineol in ppm ...... 54 Tabelle 17: An Ps fragi getestete Kombinationen von Thymol mit Carvacrol, Linalool, 1,8-Cineol, α-Pinen und α-Terpineol in ppm ....................... 54 Tabelle 18: An A. hydrophila getestete Kombinationen von Carvacrol mit Thymol, Linalool, 1-Cineol, α-Pinen und α-Terpineol in ppm ............ 54 Tabelle 19: An E. coli getestete Kombinationen von Carvacrol mit Thymol, Linalool, 1,8-Cineol, α-Pinen und α-Terpineol in ppm ....................... 55 Tabelle 20: An B. thermosphacta getestete Kombinationen von Carvacrol mit Thymol, Linalool, 1,8-Cineol, α-Pinen und α-Terpineol in ppm ......... 55 Tabelle 21: An Ps. fragi getestete Kombinationen von Carvacrol mit Thymol , Linalool, 1,8-Cineol, α-Pinen und α-Terpineol in ppm ....................... 55 233 10 Anhang Tabelle 22: Probenanzahl, Mittelwert, Standardabweichung, untere und obere Grenze des Konfidenzintervalls der Proben ohne Zusatz von Inhaltsstoffen ätherischer Öle in lg KbE/ml................................ 59 Tabelle 23: Probenanzahl, Mittelwert, inokulierte Keimmenge, obere und untere Grenze des 95 % Konfidenzintervalls der Keimzahlen [lg KbE/ml] von A. hydrophila aus den Proben mit 0,4 % Isopropylalkohol und Thymol in unterschiedlichen Konzentrationen vor und nach der Bebrütung bei 30 °C über einen Zeitraum von 7 Stunden .......................................................... 61 Tabelle 24: Probenanzahl, Mittelwert, inokulierte Keimmenge, obere und untere Grenze des 95 %Konfidenzintervalls der Keimzahlen [lg KbE/ml] von E. coli aus den Proben mit 0,4 % Isopropylalkohol und Thymol in unterschiedlichen Konzentrationen vor und nach der Bebrütung bei 30 °C über einen Zeitraum von 7 Stunden .......................................................... 62 Tabelle 25: Probenanzahl, Mittelwert, inokulierte Keimmenge, obere und untere Grenze des 95 % Konfidenzintervalls der Keimzahlen [lg KbE/ml] von B. thermosphacta aus den Proben mit 0,4 % Isopropylalkohol und Thymol in unterschiedlichen Konzentrationen vor und nach der Bebrütung bei 25 °C über einen Zeitraum von 12 Stunden ........................................................ 64 Tabelle 26: Probenanzahl, Mittelwert, inokulierte Keimmenge, obere und untere Grenze des 95 % Konfidenzintervalls der Keimzahlen [lg KbE/ml] von Ps. fragi aus den Proben mit 0,4 % Isopropylalkohol und Thymol in unterschiedlichen Konzentrationen vor und nach der Bebrütung bei 25 °C über einen Zeitraum von 12 Stunden ........................................................ 65 Tabelle 27: Probenanzahl, Mittelwert, inokulierte Keimmenge, obere und untere Grenze des 95 % Konfidenzintervalls der Keimzahlen [lg KbE/ml] von A. hydrophila aus den Proben mit 1 % Isopropylalkohol und Carvacrol in unterschiedlichen Konzentrationen vor und nach der Bebrütung bei 30 °C über einen Zeitraum von 7 Stunden .......................................................... 67 Tabelle 28: Probenanzahl, Mittelwert, inokulierte Keimmenge, obere und untere Grenze des 95 % Konfidenzintervalls der Keimzahlen [lg KbE/ml] von E. coli aus den Proben mit 1 % Isopropylalkohol und Carvacrol in unterschiedlichen Konzentrationen vor und nach der Bebrütung bei 30 °C über einen Zeitraum vo n 7 Stunden ............................................................................................ 68 Tabelle 29: Probenanzahl, Mittelwert, inokulierte Keimmenge, obere und untere Grenze des 95 % Konfidenzintervalls der Keimzahlen [lg KbE/ml] von B. thermosphacta aus den Proben mit 1 % Isopropylalkohol und Carvacrol in unterschiedlichen 234 10 Anhang Konzentrationen vor und nach der Bebrütung bei 25 °C über einen Zeitraum von 12 Stunden ........................................................ 69 Tabelle 30: Probenanzahl, Mittelwert, inokulierte Keimmenge, obere und untere Grenze des 95 % Konfidenzintervalls der Keimzahlen [lg KbE/ml] von Ps. fragi aus den Proben mit 1 % Isopropylalkohol und Carvacrol in unterschiedlichen Konzentrationen vor und nach der Bebrütung bei 25 °C über einen Zeitraum von 12 Stunden ........................................................ 71 Tabelle 31: Probenanzahl, Mittelwert, inokulierte Keimmenge, obere und untere Grenze des 95 % Konfidenzintervalls der Keimzahlen [lg KbE/ml] von A. hydrophila aus den Proben mit 0,5 % Tween80 und Linalool in unterschiedlichen Konzentrationen vor und nach der Bebrütung bei 30 °C über einen Zeitrau m von 7 Stunden ............................................................................................ 72 Tabelle 32: Probenanzahl, Mittelwert, inokulierte Keimmenge, obere und untere Grenze des 95 % Konfidenzintervalls der Keimzahlen [lg KbE/ml] von E. coli aus den Proben mit 0,5 % Tween80 und Linalool in unterschiedlichen Konzentrationen vor und nach der Bebrütung bei 30 °C über einen Zeitraum von 7 Stund en................. 74 Tabelle 33: Probenanzahl, Mittelwert, inokulierte Keimmenge, obere und untere Grenze des 95 % Konfidenzintervalls der Keimzahlen [lg KbE/ml] von B. thermosphacta aus den Proben mit 0,5 % Tween80 und Linalool in unterschiedlichen Konzentrationen vor und nach der Bebrütung bei 25 °C über einen Zeitrau m von 12 Stunden ............................................................................................ 75 Tabelle 34: Probenanzahl, Mittelwert, inokulierte Keimmenge, obere und untere Grenze des 95 % Konfidenzintervalls der Keimzahlen [lg KbE/ml] von Ps. fragi aus den Proben mit 0,5 % Tween80 und Linalool in unterschiedlichen Konzentrationen vor und nach der Bebrütung bei 25 °C über einen Zeitraum von 12 Stun den............... 76 Tabelle 35: Probenanzahl, Mittelwert, inokulierte Keimmenge, obere und untere Grenze des 95 % Konfidenzintervalls der Keimzahlen [lg KbE/ml] von A. hydrophila aus den Proben mit 0,5 % Tween80 und 1,8-Cineol in unterschiedlichen Konzentrationen vor und nach der Bebrütung bei 30 °C über einen Zei traum von 7 Stunden ............................................................................................ 78 Tabelle 36: Probenanzahl, Mittelwert, inokulierte Keimmenge, obere und untere Grenze des 95 % Konfidenzintervalls der Keimzahlen [lg KbE/ml] von E. coli aus den Proben mit 0,5 % Tween80 und 1,8-Cineol in unterschiedlichen Konzentrationen vor und nach der Bebrütung bei 30 °C über einen Zeitraum von 7 S tunden .......... 79 Tabelle 37: Probenanzahl, Mittelwert, inokulierte Keimmenge, obere und untere Grenze des 95 % Konfidenzintervalls der Keimzahlen 235 10 Anhang [lg KbE/ml] von B. thermosphacta aus den Proben mit 0,5 % Tween80 und 1,8-Cineol in unterschiedlichen Konzentrationen vor und nach der Bebrütung bei 25 °C über einen Zei traum von 12 Stunden ....................................................................................... 81 Tabelle 38: Probenanzahl, Mittelwert, inokulierte Keimmenge, obere und untere Grenze des 95 % Konfidenzintervalls der Keimzahlen [lg KbE/ml] von Ps. fragi aus den Proben mit 0,5 % Tween80 und 1,8-Cineol in unterschiedlichen Konzentrationen vor und nach der Bebrütung bei 25 °C über einen Zeitraum von 12 Stunden ........ 82 Tabelle 39: Probenanzahl, Mittelwert, inokulierte Keimmenge, obere und untere Grenze des 95 % Konfidenzintervalls der Keimzahlen [lg KbE/ml] von A. hydrophila aus den Proben mit 0,5 % Tween80 und α-Pinen in unterschiedlichen Konzentrationen vor und nach der Bebrütung bei 30 °C über einen Zeitrau m von 7 Stunden ............................................................................................ 84 Tabelle 40: Probenanzahl, Mittelwert, inokulierte Keimmenge, obere und untere Grenze des 95% Konfidenzintervalls der Keimzahlen [lg KbE/ml] von E. coli aus den Proben mit 0,5 % Tween80 und α-Pinen in unterschiedlichen Konzentrationen vor und nach der Bebrütung bei 30 °C über einen Zeitraum von 7 Stund en................. 85 Tabelle 41: Probenanzahl, Mittelwert, inokulierte Keimmenge, obere und untere Grenze des 95% Konfidenzintervalls der Keimzahlen [lg KbE/ml] von B. thermosphacta aus den Proben mit 0,5 % Tween80 und α-Pinen in unterschiedlichen Konzentrationen vor und nach der Bebrütung bei 25 °C über einen Zeitrau m von 12 Stunden ............................................................................................ 87 Tabelle 42: Probenanzahl, Mittelwert, inokulierte Keimmenge, obere und untere Grenze des 95 % Konfidenzintervalls der Keimzahlen [lg KbE/ml] von Ps. fragi aus den Proben mit 0,5 % Tween80 und α-Pinen in unterschiedlichen Konzentrationen vor und nach der Bebrütung bei 25 °C über einen Zeitraum von 12 Stun den............... 88 Tabelle 43: Probenanzahl, Mittelwert, inokulierte Keimmenge, obere und untere Grenze des 95 % Konfidenzintervalls der Keimzahlen [lg KbE/ml] von A. hydrophila aus den Proben mit 0,5 % Tween80 und α-Terpineol in unterschiedlichen Konzentrationen vor und nach der Bebrütung bei 30 °C über einen Zei traum von 7 Stunden ............................................................................................ 89 Tabelle 44: Probenanzahl, Mittelwert, inokulierte Keimmenge, obere und untere Grenze des 95 % Konfidenzintervalls der Keimzahlen [lg KbE/ml] von E. coli aus den Proben mit 0,5 % Tween80 und α-Terpineol in unterschiedlichen Konzentrationen vor und nach der Bebrütung bei 30 °C über einen Zeitraum von 7 S tunden .......... 91 236 10 Anhang Tabelle 45: Probenanzahl, Mittelwert, inokulierte Keimmenge, obere und untere Grenze des 95 % Konfidenzintervalls der Keimzahlen [lg KbE/ml] von B. thermosphacta aus den Proben mit 0,5 % Tween80 und α-Terpineol in unterschiedlichen Konzentrationen vor und nach der Bebrütung bei 25 °C über einen Zei traum von 12 Stunden ....................................................................................... 92 Tabelle 46: Probenanzahl, Mittelwert, inokulierte Keimmenge, obere und untere Grenze des 95 % Konfidenzintervalls der Keimzahlen [lg KbE/ml] von Ps. fragi aus den Proben mit 0,5 % Tween80 und α-Terpineol in unterschiedlichen Konzentrationen vor und nach der Bebrütung bei 25 °C über einen Zeitraum von 12 Stunden ........ 93 Tabelle 47: Probenanzahl, inokulierte Keimmenge, Mittelwert, obere und untere Grenze des 95 % Konfidenzintervalls der Keimzahlen [lg KbE/ml] von A. hydrophila aus den Proben mit 1 % Isopropylalkohol und den Thymol – Carvacrol –Kombinationen in unterschiedlichen Konzentrationen vor und nach der Bebrütung bei 30 °C über einen Zeitraum von 7 Stunden ....... ........................... 95 Tabelle 48: Probenanzahl, inokulierte Keimmenge, Mittelwert, obere und untere Grenze des 95 % Konfidenzintervalls der Keimzahlen [lg KbE/ml] von E. coli aus den Proben mit 1 % Isopropylalkohol und den Thymol – Carvacrol – Kombinationen in unterschiedlichen Konzentrationen vor und nach der Bebrütung bei 30 °C über einen Zeitraum von 7 Stunden ....... ........................... 97 Tabelle 49: Probenanzahl, inokulierte Keimmenge, Mittelwert, obere und untere Grenze des 95 % Konfidenzintervalls der Keimzahlen [lg KbE/ml] von B. thermosphacta aus den Proben mit 1 % Isopropylalkohol und den Thymol –Carvacrol – Kombinationen in unterschiedlichen Konzentrationen vor und nach der Bebrütung bei 25 °C über einen Zeitraum von 12 Stunden ...... .......................... 99 Tabelle 50: Probenanzahl, inokulierte Keimmenge, Mittelwert, obere und untere Grenze des 95 % Konfidenzintervalls der Keimzahlen [lg KbE/ml] von Ps. fragi aus den Proben mit 1 % Isopropylalkohol und den Thymol – Carvacrol –Kombinationen in unterschiedlichen Konzentrationen vor und nach der Bebrütung bei 25 °C über einen Zeitraum von 12 Stunden ...... ........................ 101 Tabelle 51: Probenanzahl, inokulierte Keimmenge, Mittelwert, obere und untere Grenze des 95 % Konfidenzintervalls der Keimzahlen [lg KbE/ml] von A. hydrophila aus den Proben mit 0,4 % Isopropylalkohol und 0,5 % Tween80 sowie den Thymol – Linalool – Kombinationen in unterschiedlichen Konzentrationen vor und nach der Bebrütung bei 30 °C über einen Zei traum von 7 Stunden .......................................................................................... 103 Tabelle 52: Probenanzahl, inokulierte Keimmenge, Mittelwert, obere und untere Grenze des 95 % Konfidenzintervalls der Keimzahlen 237 10 Anhang [lg KbE/ml] von E. coli aus den Proben mit 1 % Isopropylalkohol und 0,5 % Tween80 sowie den Thymol –Linalool – Kombinationen in unterschiedlichen Konzentrationen vor und nach der Bebrütung bei 30 °C über einen Zeitraum vo n 7 Stunden .......................................................................................... 104 Tabelle 53: Probenanzahl, inokulierte Keimmenge, Mittelwert, obere und untere Grenze des 95 % Konfidenzintervalls der Keimzahlen [lg KbE/ml] von B. thermosphacta aus den Proben mit 0,4 % Isopropylalkohol und 0,5 % Tween80 sowie den Thymol – Linalool – Kombinationen in unterschiedlichen Konzentrationen vor und nach der Bebrütung bei 25 °C über einen Zei traum von 12 Stunden ..................................................................................... 105 Tabelle 54: Probenanzahl, inokulierte Keimmenge, Mittelwert, obere und untere Grenze des 95 % Konfidenzintervalls der Keimzahlen [lg KbE/ml] von Ps. fragi aus den Proben mit 0,4 % Isopropylalkohol und 0,5 % Tween80 sowie den Thymol – Linalool – Kombinationen in unterschiedlichen Konzentrationen vor und nach der Bebrütung bei 25 °C über einen Zei traum von 12 Stunden ..................................................................................... 107 Tabelle 55: Probenanzahl, inokulierte Keimmenge, Mittelwert, obere und untere Grenze des 95 % Konfidenzintervalls der Keimzahlen [lg KbE/ml] von A. hydrophila aus den Proben mit 0,4 % Isopropylalkohol und 0,5 % Tween80 sowie den Thymol - 1,8Cineol – Kombinationen in unterschiedlichen Konzentrationen vor und nach der Bebrütung bei 30 °C über einen Zei traum von 7 Stunden .......................................................................................... 108 Tabelle 56: Probenanzahl, inokulierte Keimmenge, Mittelwert, obere und untere Grenze des 95 % Konfidenzintervalls der Keimzahlen [lg KbE/ml] von E. coli aus den Proben mit 0,4 % Isopropylalkohol und 0,5 % Tween80 sowie den Thymol - 1,8-Cineol – Kombinationen in unterschiedlichen Konzentrationen vor und nach der Bebrütung bei 30 °C über einen Zeitraum von 7 Stunden ........................................................ 110 Tabelle 57: Probenanzahl, inokulierte Keimmenge, Mittelwert, obere und untere Grenze des 95 % Konfidenzintervalls der Keimzahlen [lg KbE/ml] von B. thermosphacta aus den Proben mit 0,4 % Isopropylalkohol und 0,5 % Tween80 sowie den Thymol - 1,8Cineol – Kombinationen in unterschiedlichen Konzentrationen vor und nach der Bebrütung bei 25 °C über einen Zei traum von 12 Stunden ..................................................................................... 112 Tabelle 58: Probenanzahl, inokulierte Keimmenge, Mittelwert, obere und untere Grenze des 95 % Konfidenzintervalls der Keimzahlen [lg KbE/ml] von Ps. fragi aus den Proben mit 0,4 % Isopropylalkohol und 0,5 % Tween80 sowie den 238 10 Anhang Thymol -1,8-Cineol – Kombinationen in unterschiedlichen Konzentrationen vor und nach der Bebrütung bei 25 °C über einen Zeitraum von 12 Stunden ...................................................... 113 Tabelle 59: Probenanzahl, inokulierte Keimmenge, Mittelwert, obere und untere Grenze des 95 % Konfidenzintervalls der Keimzahlen [lg KbE/ml] von A. hydrophila aus den Proben mit 0,4 % Isopropylalkohol und 0,5 % Tween80 sowie den Thymol – αPinen – Kombinationen in unterschiedlichen Konzentrationen vor und nach der Bebrütung bei 30 °C über einen Zeitrau m von 7 Stunden .......................................................................................... 115 Tabelle 60: Probenanzahl, Mittelwert, inokulierte Keimmenge, obere und untere Grenze des 95 % Konfidenzintervalls der Keimzahlen [lg KbE/ml] von E. coli aus den Proben mit 0,4 % Isopropylalkohol und 0,5 % Tween80 sowie den Thymol - α-Pinen – Kombinationen in unterschiedlichen Konzentrationen vor und nach der Bebrütung bei 30 °C über einen Zeitraum von 7 Stunden ........................................................ 116 Tabelle 61: Probenanzahl, Mittelwert, inokulierte Keimmenge, obere und untere Grenze des 95 % Konfidenzintervalls der Keimzahlen [lg KbE/ml] von B. thermosphacta aus den Proben mit 0,4 % Isopropylalkohol und 0,5 % Tween80 sowie den in unterschiedlichen Thymol - α-Pinen – Kombinationen Konzentrationen vor und nach der Bebrütung bei 25 °C über einen Zeitraum von 12 Stunden ...................................................... 118 Tabelle 62: Probenanzahl, inokulierte Keimmenge, Mittelwert, obere und untere Grenze des 95 % Konfidenzintervalls der Keimzahlen [lg KbE/ml] von Ps. fragi aus den Proben mit 0,4 % Isopropylalkohol und 0,5 % Tween80 sowie den Thymol - α-Pinen – Kombinationen in unterschiedlichen Konzentrationen vor und nach der Bebrütung bei 25 °C über einen Zeitraum von 12 Stunden ...................................................... 119 Tabelle 63: Probenanzahl, inokulierte Keimmenge, Mittelwert, obere und untere Grenze des 95 % Konfidenzintervalls der Keimzahlen [lg KbE/ml] von A. hydrophila aus den Proben mit 0,4 % Isopropylalkohol und 0,5 % Tween80 sowie den Thymol – αTerpineol – Kombinationen in unterschiedlichen Konzentrationen vor und nach der Bebrütung bei 30 °C über einen Zei traum von 7 Stunden .......................................................................................... 121 Tabelle 64: Probenanzahl, inokulierte Keimmenge, Mittelwert, obere und untere Grenze des 95 % Konfidenzintervalls der Keimzahlen [lg KbE/ml] von E. coli aus den Proben mit 0,4 % Isopropylalkohol und 0,5 % Tween80 sowie den Thymol - α-Terpineol – Kombinationen in unterschiedlichen 239 10 Anhang Konzentrationen vor und nach der Bebrütung bei 30 °C über einen Zeitraum von 7 Stunden ........................................................ 122 Tabelle 65: Probenanzahl, inokulierte Keimmenge, Mittelwert, obere und untere Grenze des 95 % Konfidenzintervalls der Keimzahlen [lg KbE/ml] von B. thermosphacta aus den Proben mit 0,4 % Isopropylalkohol und 0,5 % Tween80 sowie den in unterschiedlichen Thymol - α-Terpineol – Kombinationen Konzentrationen vor und nach der Bebrütung bei 25 °C über einen Zeitraum von 12 Stunden ...................................................... 124 Tabelle 66: Probenanzahl, inokulierte Keimmenge, Mittelwert, obere und untere Grenze des 95 % Konfidenzintervalls der Keimzahlen [lg KbE/ml] von Ps. fragi aus den Proben mit 0,4 % Isopropylalkohol und 0,5 % Tween80 sowie den Thymol - α-Terpineol – Kombinationen in unterschiedlichen Konzentrationen vor und nach der Bebrütung bei 25 °C über einen Zeitraum von 12 Stunden ...................................................... 125 Tabelle 67: Probenanzahl, inokulierte Keimmenge, Mittelwert, obere und untere Grenze des 95 % Konfidenzintervalls der Keimzahlen [lg KbE/ml] von A. hydrophila aus den Proben mit 1 % Isopropylalkohol und 0,5 % Tween80 sowie den Carvacrol – Linalool – Kombinationen in unterschiedlichen Konzentrationen vor und nach der Bebrütung bei 30 °C über einen Zei traum von 7 Stunden .......................................................................................... 127 Tabelle 68: Probenanzahl, inokulierte Keimmenge, Mittelwert, obere und untere Grenze des 95 % Konfidenzintervalls der Keimzahlen [lg KbE/ml] von E. coli aus den Proben mit 1 % Isopropylalkohol und 0,5 % Tween80 sowie den Carvacrol –Linalool – Kombinationen in unterschiedlichen Konzentrationen vor und nach der Bebrütung bei 30 °C über einen Zeitraum vo n 7 Stunden .......................................................................................... 128 Tabelle 69: Probenanzahl, inokulierte Keimmenge, Mittelwert, obere und untere Grenze des 95 % Konfidenzintervalls der Keimzahlen [lg KbE/ml] von B. thermosphacta aus den Proben mit 1 % Isopropylalkohol und 0,5 % Tween80 sowie den Carvacrol – Linalool – Kombinationen in unterschiedlichen Konzentrationen vor und nach der Bebrütung bei 25 °C über einen Zei traum von 12 Stunden ..................................................................................... 130 Tabelle 70: Probenanzahl, inokulierte Keimmenge, Mittelwert, obere und untere Grenze des 95 % Konfidenzintervalls der Keimzahlen [lg KbE/ml] von Ps. fragi aus den Proben mit 1 % Isopropylalkohol und 0,5 % Tween80 sowie den Carvacrol – Linalool – Kombinationen in unterschiedlichen Konzentrationen vor und nach der Bebrütung bei 25 °C über einen Zei traum von 12 Stunden ..................................................................................... 131 240 10 Anhang Tabelle 71: Probenanzahl, inokulierte Keimmenge, Mittelwert, obere und untere Grenze des 95 % Konfidenzintervalls der Keimzahlen [lg KbE/ml] von A. hydrophila aus den Proben mit 1 % Isopropylalkohol und 0,5 % Tween80 sowie den Carvacrol – 1,8Cineol – Kombinationen in unterschiedlichen Konzentrationen vor und nach der Bebrütung bei 30 °C über einen Zei traum von 7 Stunden .......................................................................................... 133 Tabelle 72: Probenanzahl, inokulierte Keimmenge, Mittelwert, obere und untere Grenze des 95 % Konfidenzintervalls der Keimzahlen [lg KbE/ml] von E. coli aus den Proben mit 1 % Isopropylalkohol und 0,5 % Tween80 sowie den Carvacrol –1,8-Cineol – Kombinationen in unterschiedlichen Konzentrationen vor und nach der Bebrütung bei 30 °C über einen Zeitraum vo n 7 Stunden .......................................................................................... 134 Tabelle 73: Probenanzahl, inokulierte Keimmenge, Mittelwert, obere und untere Grenze des 95 % Konfidenzintervalls der Keimzahlen [lg KbE/ml] von B. thermosphacta aus den Proben mit 1 % Isopropylalkohol und 0,5 % Tween80 sowie den Carvacrol – 1,8Cineol – Kombinationen in unterschiedlichen Konzentrationen vor und nach der Bebrütung bei 25 °C über einen Zei traum von 12 Stunden ..................................................................................... 136 Tabelle 74: Probenanzahl, inokulierte Keimmenge, Mittelwert, obere und untere Grenze des 95 % Konfidenzintervalls der Keimzahlen [lg KbE/ml] von Ps. fragi aus den Proben mit 1 % Isopropylalkohol und 0,5 % Tween80 sowie den Carvacrol – 1,8Cineol – Kombinationen in unterschiedlichen Konzentrationen vor und nach der Bebrütung bei 25 °C über einen Zei traum von 12 Stunden ..................................................................................... 137 Tabelle 75: Probenanzahl, inokulierte Keimmenge, Mittelwert, obere und untere Grenze des 95 % Konfidenzintervalls der Keimzahlen [lg KbE/ml] von A. hydrophila aus den Proben mit 1 % Isopropylalkohol und 0,5 % Tween80 sowie den Carvacrol – αPinen – Kombinationen in unterschiedlichen Konzentrationen vor und nach der Bebrütung bei 30 °C über einen Zeitrau m von 7 Stunden .......................................................................................... 139 Tabelle 76: Probenanzahl, inokulierte Keimmenge, Mittelwert, obere und untere Grenze des 95 % Konfidenzintervalls der Keimzahlen [lg KbE/ml] von E. coli aus den Proben mit 1 % Isopropylalkohol und 0,5 % Tween80 sowie den Carvacrol - α-Pinen – Kombinationen in unterschiedlichen Konzentrationen vor und nach der Bebrütung bei 30 °C über einen Zeitraum vo n 7 Stunden .......................................................................................... 140 Tabelle 77: Probenanzahl, inokulierte Keimmenge, Mittelwert, obere und untere Grenze des 95 % Konfidenzintervalls der Keimzahlen 241 10 Anhang [lg KbE/ml] von B. thermosphacta aus den Proben mit 1 % Isopropylalkohol und 0,5 % Tween80 sowie den Carvacrol - α-Pinen – Kombinationen in unterschiedlichen Konzentrationen vor und nach der Bebrütung bei 25 °C über einen Zeitraum von 12 Stunden ...................................................... 142 Tabelle 78: Probenanzahl, inokulierte Keimmenge, Mittelwert, obere und untere Grenze des 95 % Konfidenzintervalls der Keimzahlen [lg KbE/ml] von Ps. fragi aus den Proben mit 1 % Isopropylalkohol und 0,5 % Tween80 sowie den Carvacrol - α-Pinen – Kombinationen in unterschiedlichen Konzentrationen vor und nach der Bebrütung bei 25 °C über einen Zeitraum von 12 Stunden ...................................................... 143 Tabelle 79: Probenanzahl, inokulierte Keimmenge, Mittelwert, obere und untere Grenze des 95 % Konfidenzintervalls der Keimzahlen [lg KbE/ml] von A. hydrophila aus den Proben mit 1 % Isopropylalkohol und 0,5 % Tween80 sowie den Carvacrol – αTerpineol – Kombinationen in unterschiedlichen Konzentrationen vor und nach der Bebrütung bei 30 °C über einen Zei traum von 7 Stunden .......................................................................................... 145 Tabelle 80: Probenanzahl, inokulierte Keimmenge, Mittelwert, obere und untere Grenze des 95 % Konfidenzintervalls der Keimzahlen [lg KbE/ml] von E. coli aus den Proben mit 1 % Isopropylalkohol und 0,5 % Tween80 sowie den Carvacrol - α-Terpineol – Kombinationen in unterschiedlichen Konzentrationen vor und nach der Bebrütung bei 30 °C über einen Zeitraum vo n 7 Stunden .......................................................................................... 146 Tabelle 81: Probenanzahl, inokulierte Keimmenge, Mittelwert, obere und untere Grenze des 95 % Konfidenzintervalls der Keimzahlen [lg KbE/ml] von B. thermosphacta aus den Proben mit 1 % Isopropylalkohol und 0,5 % Tween80 sowie den Carvacrol - α-Terpineol – Kombinationen in unterschiedlichen Konzentrationen vor und nach der Bebrütung bei 25 °C über einen Zeitraum von 12 Stunden ...................................................... 148 Tabelle 82: Probenanzahl, inokulierte Keimmenge, Mittelwert, obere und untere Grenze des 95 % Konfidenzintervalls der Keimzahlen [lg KbE/ml] von Ps. fragi aus den Proben mit 1 % Isopropylalkohol und 0,5 % Tween80 sowie den Carvacrol - α-Terpineol – Kombinationen in unterschiedlichen Konzentrationen vor und nach der Bebrütung bei 25 °C über einen Zeitraum von 12 Stunden ...................................................... 149 Anhangstabelle 83: Keimzahlen der 3 Stichproben je geprüfter Einzelstoffkonzentration, A. hydrophila ........................................... 196 Anhangstabelle 84: Keimzahlen der 3 Stichproben je geprüfter Einzelstoffkonzentration, E.coli ....................................................... 198 242 10 Anhang Anhangstabelle 85: Keimzahlen der 3 Stichproben je geprüfter Einzelkonzentration, B. thermosphacta........................................... 199 Anhangstabelle 86: Keimzahlen der 3 Stichproben je geprüfter Einzelkonzentration, Ps. fragi.......................................................... 201 Anhangstabelle 87: Messwerte der optischen Dichte von A. hydrophila unter Einfluss von Thymol ........................................................................ 202 Anhangstabelle 88: Messwerte der optischen Dichte von E. coli unter Einfluss von Thymol ..................................................................................... 203 Anhangstabelle 89: Messwerte der optischen Dichte von B. thermosphacta unter Einfluss von Thymol ............................................................... 203 Anhangstabelle 90: Messwerte der optischen Dichte von Ps. fragi unter Einfluss vonThymol ......................................................................... 203 Anhangstabelle 91: Messwerte der optischen Dichte von A. hydrophila unter Einfluss von Carvacrol .................................................................... 204 Anhangstabelle 92: Messwerte der optischen Dichte von E. coli unter Einfluss von Carvacrol .................................................................................. 204 Anhangstabelle 93: Messwerte der optischen Dichte von B. thermosphacta unter Einfluss von Carvacrol ........................................................... 204 Anhangstabelle 94: Messwerte der optischen Dichte von Ps. fragi unter Einfluss von Carvacrol .................................................................... 205 Anhangstabelle 95: Messwerte der optischen Dichte von A. hydrophila unter Einfluss von Linalool ....................................................................... 205 Anhangstabelle 96: Messwerte der optischen Dichte von E. coli unter Einfluss von Linalool ..................................................................................... 205 Anhangstabelle 97: Messwerte der optischen Dichte von B. thermosphacta unter Einfluss von Linalool .............................................................. 206 Anhangstabelle 98: Messwerte der optischen Dichte von Ps. fragi unter Einfluss von Linalool ....................................................................... 206 Anhangstabelle 99: Messwerte der optischen Dichte von A. hydrophila unter Einfluss von 1,8-Cineol ................................................................... 206 Anhangstabelle 100: Messwerte der optischen Dichte von E. coli unter Einfluss von 1,8-Cineol ................................................................... 207 Anhangstabelle 101: Messwerte der optischen Dichte von B. thermosphacta unter Einfluss von 1,8-Cineol .......................................................... 207 Anhangstabelle 102: Messwerte der optischen Dichte von Ps. fragi unter Einfluss von 1,8-Cineol ................................................................... 207 Anhangstabelle 103: Messwerte der optischen Dichte von A. hydrophila unter Einfluss von α-Pinen ....................................................................... 208 243 10 Anhang Anhangstabelle 104: Messwerte der optischen Dichte von E. coli unter Einfluss von α-Pinen ....................................................................... 208 Anhangstabelle 105: Messwerte der optischen Dichte von B. thermosphacta unter Einfluss von α-Pinen .............................................................. 208 Anhangstabelle 106: Messwerte der optischen Dichte von Ps. fragi unter Einfluss von α-Pinen ....................................................................... 209 Anhangstabelle 107: Messwerte der optischen Dichte von A. hydrophila unter Einfluss von α-Terpineol ................................................................. 209 Anhangstabelle 108: Messwerte der optischen Dichte von E. coli unter Einfluss von α-Terpineol ................................................................. 209 Anhangstabelle 109: Messwerte der optischen Dichte von B. thermosphacta unter Einfluss von α-Terpineol ........................................................ 210 Anhangstabelle 110: Messwerte der optischen Dichte von Ps. fragi unter Einfluss von α-Terpineol ................................................................. 210 Anhangstabelle 111: Keimzahlen der 3 Stichproben je geprüfter Stoffkombinationen, A. hydrophila in lg KbE/ml ............................. 211 Anhangstabelle 112: Keimzahlen der 3 Stichproben je geprüfter Stoffkombinationen, E. coli in lg KbE/ml ........................................ 213 Anhangstabelle 113: Keimzahlen der 3 Stichproben je geprüfter Stoffkombinationen, B. thermosphacta in lg KbE/ml ...................... 215 Anhangstabelle 114: Keimzahlen der 3 Stichproben je geprüfter Stoffkombinationen, Ps. fragi in lg KbE/ml ..................................... 218 Anhangstabelle 115: Messwerte der optischen Dichte der geprüften Stoffkombinationen zur Stunde 7 und Differenz der optischen Dichte der Stoffkombinationen zu der optischen Dichte der Kontrollprobe zur Stunde 7, A. hydrophila ...................................... 220 Anhangstabelle 116: Messwerte der optischen Dichte der geprüften Stoffkombinationen zur Stunde 7 und Differenz der optischen Dichte der Stoffkombinationen zu der optischen Dichte der Kontrollprobe zur Stunde 7, E. coli.................................................. 222 Anhangstabelle 117: Messwerte der optischen Dichte der geprüften Stoffkombinationen zur Stunde 7 und Differenz der optischen Dichte der Stoffkombinationen zu der optischen Dichte der Kontrollprobe zur Stunde 7, B. thermosphacta ............................... 224 Anhangstabelle 118: Messwerte der optischen Dichte der geprüften Stoffkombinationen zur Stunde 7 und Differenz der optischen Dichte der Stoffkombinationen zu der optischen Dichte der Kontrollprobe zur Stunde 7, Ps. fragi .............................................. 226 244 10 Anhang 10.4 Abbildungsverzeichnis Abbildung 1: Entwicklung der optischen Dichte bei 490 nm von A. hydrophila – Kulturen in Nutrient broth Nr. 2 mit unterschiedlichen Konzentrationen [ppm] an Thymol über eine Inkubationsdauer von 7 h bei 30 °C (OD = optische Dichte) .......... ............................... 60 Abbildung 2: Entwicklung der optischen Dichte bei 490 nm von E. coli – Kulturen in Nutrient broth Nr. 2 mit unterschiedlichen Konzentrationen [ppm] an Thymol über eine Inkubationsdauer von 7 h bei 30 °C (OD = optische Dichte) .......... ............................... 62 Abbildung 3: Entwicklung der optischen Dichte bei 490 nm von B. thermosphacta – Kulturen in Nutrient broth Nr. 2 mit unterschiedlichen Konzentrationen [ppm] an Thymol über eine Inkubationsdauer von 12 h bei 25 °C (OD = optische Dichte) ........... 63 Abbildung 4: Entwicklung der optischen Dichte bei 490 nm von Ps. fragi – Kulturen in Nutrient broth Nr. 2 mit unterschiedlichen Konzentrationen [ppm] an Thymol über eine Inkubationsdauer von 12 h bei 25 °C (OD = optische Dichte) ......... .............................. 64 Abbildung 5: Entwicklung der optischen Dichte bei 490 nm von A. hydrophila – Kulturen in Nutrient broth Nr. 2 mit unterschiedlichen Konzentrationen [ppm] an Carvacrol über eine Inkubationsdauer von 7 h bei 30 °C (OD = optische Dichte) .......... ............................... 66 Abbildung 6: Entwicklung der optischen Dichte bei 490 nm von E. coli – Kulturen in Nutrient broth Nr. 2 mit unterschiedlichen Konzentrationen [ppm] an Carvacrol über eine Inkubationsdauer von 7 h bei 30 °C (OD = optische Dichte) .......... ............................... 67 Abbildung 7: Entwicklung der optischen Dichte bei 490 nm von B. thermosphacta – Kulturen in Nutrient broth Nr. 2 mit unterschiedlichen Konzentrationen [ppm] an Carvacrol über eine Inkubationsdauer von 12 h bei 25 °C (OD = optische Dichte) ........... 69 Abbildung 8: Entwicklung der optischen Dichte bei 490 nm von B. thermosphacta – Kulturen in Nutrient broth Nr. 2 mit unterschiedlichen Konzentrationen [ppm] an Carvacrol über eine Inkubationsdauer von 12 h bei 25 °C (OD = optische Dichte) ........... 70 Abbildung 9: Entwicklung der optischen Dichte bei 490 nm von A. hydrophila – Kulturen in Nutrient broth Nr. 2 mit unterschiedlichen Konzentrationen [ppm] an Linalool über eine Inkubationsdauer von 7 h bei 30 °C (OD = optische Dichte) .......... ............................... 72 Abbildung 10: Entwicklung der optischen Dichte bei 490 nm von A. hydrophila – Kulturen in Nutrient broth Nr. 2 mit unterschiedlichen 245 10 Anhang Konzentrationen [ppm] an Linalool über eine Inkubationsdauer von 7 h bei 30 °C (OD = optische Dichte) .......... ............................... 73 Abbildung 11: Entwicklung der optischen Dichte bei 490 nm von B. thermosphacta – Kulturen in Nutrient broth Nr. 2 mit unterschiedlichen Konzentrationen [ppm] an Linalool über eine Inkubationsdauer von 12 h bei 25 °C (OD = optische Dichte) ........... 74 Abbildung 12: Entwicklung der optischen Dichte bei 490 nm von B. thermosphacta – Kulturen in Nutrient broth Nr. 2 mit unterschiedlichen Konzentrationen [ppm] an Linalool über eine Inkubationsdauer von 12 h bei 25 °C (OD = optische Dichte) ........... 76 Abbildung 13: Entwicklung der optischen Dichte bei 490 nm von A. hydrophila – Kulturen in Nutrient broth Nr. 2 mit unterschiedlichen Konzentrationen [ppm] an 1,8-Cineol über eine Inkubationsdauer von 7 h bei 30 °C (OD = optische Dichte) .......... ............................... 77 Abbildung 14: Entwicklung der optischen Dichte bei 490 nm von E. coli – Kulturen in Nutrient broth Nr. 2 mit unterschiedlichen Konzentrationen [ppm] an 1,8-Cineol über eine Inkubationsdauer von 7 h bei 30 °C (OD = optische Dichte) .......... ............................... 79 Abbildung 15: Entwicklung der optischen Dichte bei 490 nm von B. thermosphacta – Kulturen in Nutrient broth Nr. 2 mit unterschiedlichen Konzentrationen [ppm] an 1,8-Cineol über eine Inkubationsdauer von 12 h bei 25 °C (OD = optische Dichte) ........... 80 Abbildung 16: Entwicklung der optischen Dichte bei 490 nm von Ps. fragi – Kulturen in Nutrient broth Nr. 2 mit unterschiedlichen Konzentrationen [ppm] an 1,8-Cineol über eine Inkubationsdauer von 12 h bei 25 °C (OD = optische Dichte) ......... .............................. 82 Abbildung 17: Entwicklung der optischen Dichte bei 490 nm von A. hydrophila – Kulturen in Nutrient broth Nr. 2 mit unterschiedlichen Konzentrationen [ppm] an α-Pinen über eine Inkubationsdauer von 7 h bei 30 °C (OD = optische Dichte) .......... ............................... 83 Abbildung 18: Entwicklung der optischen Dichte bei 490 nm von E. Coli – Kulturen in Nutrient broth Nr. 2 mit unterschiedlichen Konzentrationen [ppm] an α-Pinen über eine Inkubationsdauer von 7 h bei 30 °C (OD = optische Dichte) .......... ............................... 85 Abbildung 19: Entwicklung der optischen Dichte bei 490 nm von B. thermosphacta – Kulturen in Nutrient broth Nr. 2 mit unterschiedlichen Konzentrationen [ppm] an α-Pinen über eine Inkubationsdauer von 12 h bei 25 °C (OD = optische Dichte) ........... 86 Abbildung 20: Entwicklung der optischen Dichte bei 490 nm von Ps. fragi – Kulturen in Nutrient broth Nr. 2 mit unterschiedlichen Konzentrationen [ppm] an α-Pinen über eine Inkubationsdauer von 12 h bei 25 °C (OD = optische Dichte) ......... .............................. 87 246 10 Anhang Abbildung 21: Entwicklung der optischen Dichte bei 490 nm von A. hydrophila – Kulturen in Nutrient broth Nr. 2 mit unterschiedlichen Konzentrationen [ppm] an α-Terpineol über eine Inkubationsdauer von 7 h bei 30 °C (OD = optische D ichte) ............. 89 Abbildung 22: Entwicklung der optischen Dichte bei 490 nm von A. hydrophila – Kulturen in Nutrient broth Nr. 2 mit unterschiedlichen α-Terpineol über eine Konzentrationen [ppm] an Inkubationsdauer von 7 h bei 30 °C (OD = optische D ichte) ............. 90 Abbildung 23: Entwicklung der optischen Dichte bei 490 nm von B. thermosphacta – Kulturen in Nutrient broth Nr. 2 mit unterschiedlichen Konzentrationen [ppm] an α-Terpineol über eine Inkubationsdauer von 12 h bei 25 °C (OD = opti sche Dichte) ... 91 Abbildung 24: Entwicklung der optischen Dichte bei 490 nm von Ps. fragi – Kulturen in Nutrient broth Nr. 2 mit unterschiedlichen Konzentrationen [ppm] an α-Terpineol über eine Inkubationsdauer von 12 h bei 25 °C (OD = optische Dichte) ........... 93 Abbildung 25: Differenz zwischen OD der Nährlösung mit Stoffkombinationen und OD der Nährlösung ohne Zusatz (Kontrolle) nach 7 Stunden Inkubation bei 30 °C bei A. hydrophila. (OD = optische Dichte, C = Carvacrol, T = Thymol, Gehalt in ppm) ...................................... 94 Abbildung 26: Differenz zwischen OD der Nährlösung mit Stoffkombinationen und OD der Nährlösung ohne Zusatz (Kontrolle) nach 7 Stunden Inkubation bei 30 °C bei E. coli. (OD = optische Dichte, C = Carvacrol, T = Thymol, Gehalt in ppm) ...................................... 96 Abbildung 27: Differenz zwischen OD der Nährlösung mit Stoffkombinationen und OD der Nährlösung ohne Zusatz (Kontrolle) nach 12 Stunden Inkubation bei 25 °C bei B. thermosphacta. (OD = optische Dichte, C = Carvacrol, T = Thymol, Gehalt in ppm).................................................................................................. 98 Abbildung 28: Differenz zwischen OD der Nährlösung mit Stoffkombinationen und OD der Nährlösung ohne Zusatz (Kontrolle) nach 12 Stunden Inkubation bei 25 °C bei Ps. fragi (OD = optische Dichte, C = Carvacrol, T = Thymol, Gehalt in ppm)................................................................................................ 100 Abbildung 29: Differenz zwischen OD der Nährlösung mit Stoffkombinationen und OD der Nährlösung ohne Zusatz (Kontrolle) nach 7 Stunden Inkubation bei 30 °C bei A. hydrophila. (OD = optische Dichte, L = Linalool, T = Thymol, Gehalt in ppm) ........................................ 102 Abbildung 30: Differenz zwischen OD der Nährlösung mit Stoffkombinationen und OD der Nährlösung ohne Zusatz (Kontrolle) nach 7 Stunden Inkubation bei 30 °C bei E. coli. (OD = optische Dichte, L = Linalool, T = Thymol, Gehalt in ppm) ........................................ 103 247 10 Anhang Abbildung 31: Differenz zwischen OD der Nährlösung mit Stoffkombinationen und OD der Nährlösung ohne Zusatz (Kontrolle) nach 12 Stunden Inkubation bei 25 °C bei B. thermosphacta. (OD = optische Dichte, L = Linalool, T = Thymol, Gehalt in ppm) ... 105 Abbildung 32: Differenz zwischen OD der Nährlösung mit Stoffkombinationen und OD der Nährlösung ohne Zusatz (Kontrolle) nach 12 Stunden Inkubation bei 25 °C bei Ps. fragi. (OD = optische Dichte, L = Linalool, T = Thymol, Gehalt in ppm) ... 106 Abbildung 33: Differenz zwischen OD der Nährlösung mit Stoffkombinationen und OD der Nährlösung ohne Zusatz (Kontrolle) nach 7 Stunden Inkubation bei 30 °C bei A. hydrophila. (OD = optische Dichte, Ci = 1,8-Cineol, T = Thymol, Gehalt in ppm) ................................... 108 Abbildung 34: Differenz zwischen OD der Nährlösung mit Stoffkombinationen und OD der Nährlösung ohne Zusatz (Kontrolle) nach 7 Stunden Inkubation bei 30 °C bei E. coli. (OD = optische Dichte, Ci = 1,8Cineol, T = Thymol, Gehalt in ppm) ................................................ 109 Abbildung 35: Differenz zwischen OD der Nährlösung mit Stoffkombinationen und OD der Nährlösung ohne Zusatz (Kontrolle) nach 12 Stunden Inkubation bei 25 °C bei B. thermosphacta. (OD = optische Dichte, Ci = 1,8-Cineol, T = Thymol, Gehalt in ppm)................................................................................................ 111 Abbildung 36: Differenz zwischen OD der Nährlösung mit Stoffkombinationen und OD der Nährlösung ohne Zusatz (Kontrolle) nach 12 Stunden Inkubation bei 25 °C bei Ps. fragi. (OD = optische Dichte, Ci = 1,8-Cineol, T = Thymol, Gehalt in ppm)................................................................................................ 113 Abbildung 37: Differenz zwischen OD der Nährlösung mit Stoffkombinationen und OD der Nährlösung ohne Zusatz (Kontrolle) nach 7 Stunden Inkubation bei 30 °C bei A. hydrophila. (OD = optische Dichte, Pi = α-Pinen, T = Thymol, Gehalt in ppm) ....................................... 114 Abbildung 38: Differenz zwischen OD der Nährlösung mit Stoffkombinationen und OD der Nährlösung ohne Zusatz (Kontrolle) nach 7 Stunden Inkubation bei 30 °C bei E. coli. (OD = optische Dichte, Pi = αPinen, T = Thymol, Gehalt in ppm) ................................................. 116 Abbildung 39: Differenz zwischen OD der Nährlösung mit Stoffkombinationen und OD der Nährlösung ohne Zusatz (Kontrolle) nach 12 Stunden Inkubation bei 25 °C bei B. thermosphacta. (OD = optische Dichte, Pi = α-Pinen, T = Thymol, Gehalt in ppm) .. 117 Abbildung 40: Differenz zwischen OD der Nährlösung mit Stoffkombinationen und OD der Nährlösung ohne Zusatz (Kontrolle) nach 12 Stunden Inkubation bei 25 °C bei Ps. fragi. (OD = optische Dichte, Pi = α-Pinen, T = Thymol, Gehalt in ppm) .. 119 248 10 Anhang Abbildung 41: Differenz zwischen OD der Nährlösung mit Stoffkombinationen und OD der Nährlösung ohne Zusatz (Kontrolle) nach 7 Stunden Inkubation bei 30 °C bei A. hydrophila. (OD = optische Dichte, Te = α-Terpineol, T = Thymol, Gehalt in ppm) ................................ 120 Abbildung 42: Differenz zwischen OD der Nährlösung mit Stoffkombinationen und OD der Nährlösung ohne Zusatz (Kontrolle) nach 7 Stunden Inkubation bei 30 °C bei E. coli. (OD = optische Dichte, Te = αTerpineol, T = Thymol, Gehalt in ppm)............................................ 122 Abbildung 43: Differenz zwischen OD der Nährlösung mit Stoffkombinationen und OD der Nährlösung ohne Zusatz (Kontrolle) nach 12 Stunden Inkubation bei 25 °C bei B. thermosphacta. (OD = optische Dichte, Te = α-Terpineol, T = Thymol, Gehalt in ppm)................................................................................................ 123 Abbildung 44: Differenz zwischen OD der Nährlösung mit Stoffkombinationen und OD der Nährlösung ohne Zusatz (Kontrolle) nach 12 Stunden Inkubation bei 25 °C bei Ps. fragi. (OD = optische Dichte, Pi = α-Pinen, T = Thymol, Gehalt in ppm) .. 125 Abbildung 45: Differenz zwischen OD der Nährlösung mit Stoffkombinationen und OD der Nährlösung ohne Zusatz (Kontrolle) nach 7 Stunden Inkubation bei 30 °C bei A. hydrophila. (OD = optische Dichte, L = Linalool, C = Carvacrol, Gehalt in ppm) .................................... 126 Abbildung 46: Differenz zwischen OD der Nährlösung mit Stoffkombinationen und OD der Nährlösung ohne Zusatz (Kontrolle) nach 7 Stunden Inkubation bei 30 °C bei E. coli. (OD = optische Dichte, L = Linalool, C = Carvacrol, Gehalt in ppm) .................................... 128 Abbildung 47: Differenz zwischen OD der Nährlösung mit Stoffkombinationen und OD der Nährlösung ohne Zusatz (Kontrolle) nach 12 Stunden Inkubation bei 25 °C bei B. thermosphacta. (OD = optische Dichte, L = Linalool, C = Carvacrol, Gehalt in ppm)................................................................................................ 129 Abbildung 48: Differenz zwischen OD der Nährlösung mit Stoffkombinationen und OD der Nährlösung ohne Zusatz (Kontrolle) nach 12 Stunden Inkubation bei 25 °C bei Ps. fragi. (OD = optische Dichte, L = Linalool, C = Carvacrol, Gehalt in ppm)................................................................................................ 131 Abbildung 49: Differenz zwischen OD der Nährlösung mit Stoffkombinationen und OD der Nährlösung ohne Zusatz (Kontrolle) nach 7 Stunden Inkubation bei 30 °C bei A. hydrophila. (OD = optische Dichte, Ci = 1,8-Cineol, C =Carvacrol, Gehalt in ppm) ................................ 132 Abbildung 50: Differenz zwischen OD der Nährlösung mit Stoffkombinationen und OD der Nährlösung ohne Zusatz (Kontrolle) nach 7 Stunden Inkubation bei 30 °C bei E. coli. (OD = optische Dichte, Ci = 1,8Cineol, C = Carvacrol, Gehalt in ppm) ............................................ 134 249 10 Anhang Abbildung 51: Differenz zwischen OD der Nährlösung mit Stoffkombinationen und OD der Nährlösung ohne Zusatz (Kontrolle) nach 12 Stunden Inkubation bei 25 °C bei B. thermosphacta. (OD = optische Dichte, Ci = 1,8-Cineol, C = Carvacrol, Gehalt in ppm)................................................................................................ 135 Abbildung 52: Differenz zwischen OD der Nährlösung mit Stoffkombinationen und OD der Nährlösung ohne Zusatz (Kontrolle) nach 12 Stunden Inkubation bei 25 °C bei Ps. fragi. (OD = optische Dichte, Ci = 1,8-Cineol, C = Carvacrol, Gehalt in ppm)................................................................................................ 137 Abbildung 53: Differenz zwischen OD der Nährlösung mit Stoffkombinationen und OD der Nährlösung ohne Zusatz (Kontrolle) nach 7 Stunden Inkubation bei 30 °C bei A. hydrophila. (OD = optische Dichte, Pi = α-Pinen, C = Carvacrol, Gehalt in ppm) ................................... 138 Abbildung 54: Differenz zwischen OD der Nährlösung mit Stoffkombinationen und OD der Nährlösung ohne Zusatz (Kontrolle) nach 7 Stunden Inkubation bei 30 °C bei E. coli. (OD = optische Dichte, Pi = αPinen, C = Carvacrol, Gehalt in ppm) ............................................. 140 Abbildung 55: Differenz zwischen OD der Nährlösung mit Stoffkombinationen und OD der Nährlösung ohne Zusatz (Kontrolle) nach 12 Stunden Inkubation bei 25 °C bei B. thermosphacta. (OD = optische Dichte, Pi = α-Pinen, C = Carvacrol, Gehalt in ppm)................................................................................................ 141 Abbildung 56: Differenz zwischen OD der Nährlösung mit Stoffkombinationen und OD der Nährlösung ohne Zusatz (Kontrolle) nach 12 Stunden Inkubation bei 25 °C bei Ps. fragi. (OD = optische Dichte, Pi = α-Pinen, C = Carvacrol, Gehalt in ppm)................................................................................................ 143 Abbildung 57: Differenz zwischen OD der Nährlösung mit Stoffkombinationen und OD der Nährlösung ohne Zusatz (Kontrolle) nach 7 Stunden Inkubation bei 30 ° bei A. hydrophila. (OD = optische Dichte, Te = α-Terpineol, C = Carvacrol, Gehalt in ppm) ............................ 144 Abbildung 58: Differenz zwischen OD der Nährlösung mit Stoffkombinationen und OD der Nährlösung ohne Zusatz (Kontrolle) nach 7 Stunden Inkubation bei 30 °C bei E. coli. (OD = optische Dichte, Te = αTerpineol, C = Carvacrol, Gehalt in ppm)........................................ 146 Abbildung 59: Differenz zwischen OD der Nährlösung mit Stoffkombinationen und OD der Nährlösung ohne Zusatz (Kontrolle) nach 12 Stunden Inkubation bei 25 °C bei B. thermosphacta. (OD = optische Dichte, Te = α-Terpineol, C = Carvacrol, Gehalt in ppm) ............................................................................................ 147 Abbildung 60: Differenz zwischen OD der Nährlösung mit Stoffkombinationen und OD der Nährlösung ohne Zusatz (Kontrolle) nach 12 250 10 Anhang Stunden Inkubation bei 25 °C bei Ps. fragi. (OD = optische Dichte, Te = α-Terpineol, C = Carvacrol, Gehalt in ppm) ............................................................................................ 149 251 10 Anhang 10.5 Abkürzungsverzeichnis °C Aqua dest. BHI-Bouillon C C1000 C250 C500 Ci Ci1500 Ci3500 Ci4000 Ci4500 Ci5000 Ci7000 Ci900 DMSO DSMZ h KbE KS KZ L L1800 L3000 L4000 L900 lg m MHK Min. ml n NaCl Nb2 nm OD OGK Pi Pi2000 Pi3000 Pi850 ppm s Ssp Grad Celsius Aqua destillata Brain-Heart-Infusion-Bouillon Carvacrol Stammlösung mit 1000 ppm Carvacrol Stammlösung mit 500 ppm Carvacrol Stammlösung mit 500 ppm Carvacrol 1,8-Cineol Stammlösung mit 1500 ppm 1,8-Cineol Stammlösung mit 3500 ppm 1,8-Cineol Stammlösung mit 4000 ppm 1,8-Cineol Stammlösung mit 4500 ppm 1,8-Cineol Stammlösung mit 5000 ppm 1,8-Cineol Stammlösung mit 7000 ppm 1,8-Cineol Stammlösung mit 900 ppm 1,8-Cineol Dimethylsulfoxid Deutsche Sammlung von Mikroorganismen und Zellkulturen Stunde Koloniebildende Einheiten Keimsuspension Keimzahl Linalool Stammlösung mit 1800 ppm Linalool Stammlösung mit 3000 ppm Linalool Stammlösung mit 4000 ppm Linalool Stammlösung mit 900 ppm Linalool Logarithmus zur Basis 10 Mittelwert Minimale Hemmstoffkonzentration Minute Milliliter Probenanzahl Natriumchlorid Nutrient broth Nr.2 Nanometer optische Dichte obere Grenze Konfidenzintervall α-Pinen Stammlösung mit 2000 ppm α-Pinen Stammlösung mit 3000 ppm α-Pinen Stammlösung mit 850 ppm α-Pinen parts per million Standardabweichung Subspezies 252 10 Anhang T T1000 T500 Te Te1500 Te2 Te3000 TSB UGK Thymol Stammlösung mit 1000 ppmThymol Stammlösung mit 500 ppmThymol α-Terpineol Stammlösung mit 1500 ppm α-Terpineol Stammlösung mit 2 ppm α-Terpineol Stammlösung mit 2000 ppm α-Terpineol Tryptic Soy Broth untere Grenze Konfidenzintervall 253 Danksagung Danksagung Zuerst möchte ich Herrn Prof. Dr. Günter Klein für die Überlassung des interessanten Dissertationsthemas, die wissenschaftliche Betreuung und Unterstützung bei der Anfertigung dieser Arbeit danken. Herrn Dr. Matthias Upmann danke ich herzlich für die Hilfe und prompte Beantwortung aller Fragen bei der Planung und Durchführung des experimentellen Teils der Dissertation. Trotz Wechsel des Dienstortes und den damit verbundenen Überstunden fand er auch in der Endphase der Dissertation immer noch Zeit für wertvolle Anregungen und Ratschläge. Der Eberhard Lienhop Stiftung danke ich für die finanzielle Unterstützung. Insbesondere Herrn Prof. Dr. C. Gissel und Herrn Dr. D. Stanislawski möchte ich meinen persönlichen Dank aussprechen. Der Belegschaft des mikrobiologischen Labors, insbesondere Frau Birgit Führing, Frau Sabine Korff und Frau Silke Ortaeri danke ich herzlich für die positive Stimmung und die damit verbundene angenehme Arbeitsatmosphäre im Labor. Frau Manuela von Ahlen danke ich für die Einweisung in das mikrobiologische Arbeiten und die Hilfestellung während der Frühphase der Versuchsplanung. Weiterhin gilt mein Dank dem Institut für Lebensmitteltoxikologie für die Bereitstellung des Spekrophotometers. Besonders Dr. Petra Nicken, Michael Hettwer und Nicola Brauer-Dewor danke ich für die wiederholte und stets freundliche Hilfestellung in technischen Fragen. Dr. Birte Ahlfeld, Dr. Annika Boulaaba, Dr. Christian Visscher sowie meinem Vater Dr. Herbert Rüben danke ich herzlich für das fleißige Durchsuchen dieser Arbeit nach mehr oder weniger versteckten Fehlern aller Art. Meiner Mutter Beatrix Rüben-Schlesinger gilt großer Dank für ihre Unterstützung bei der Anfertigung der Summary. Der ehemaligen Belegschaft des Doktorandenzimmers im 3. Stock, insbesondere Dr. Birte Ahlfeld, Dr. Annika Boulaaba sowie Dr. Asmien Brix und allen anderen 254 Danksagung Doktoranden des LMQS danke ich für unsere zahlreichen erbaulichen Gespräche fachlicher und privater Natur während der vergangenen 3 Jahre. Besonderer Dank gilt meinen Eltern für ihre langjährige Unterstützung in allen prüfungs- und dissertationsbedingten Nöten und dafür, dass sie immer an ein glückliches Ende geglaubt haben. 255