Carnot`scher Kreisprozess
Werbung
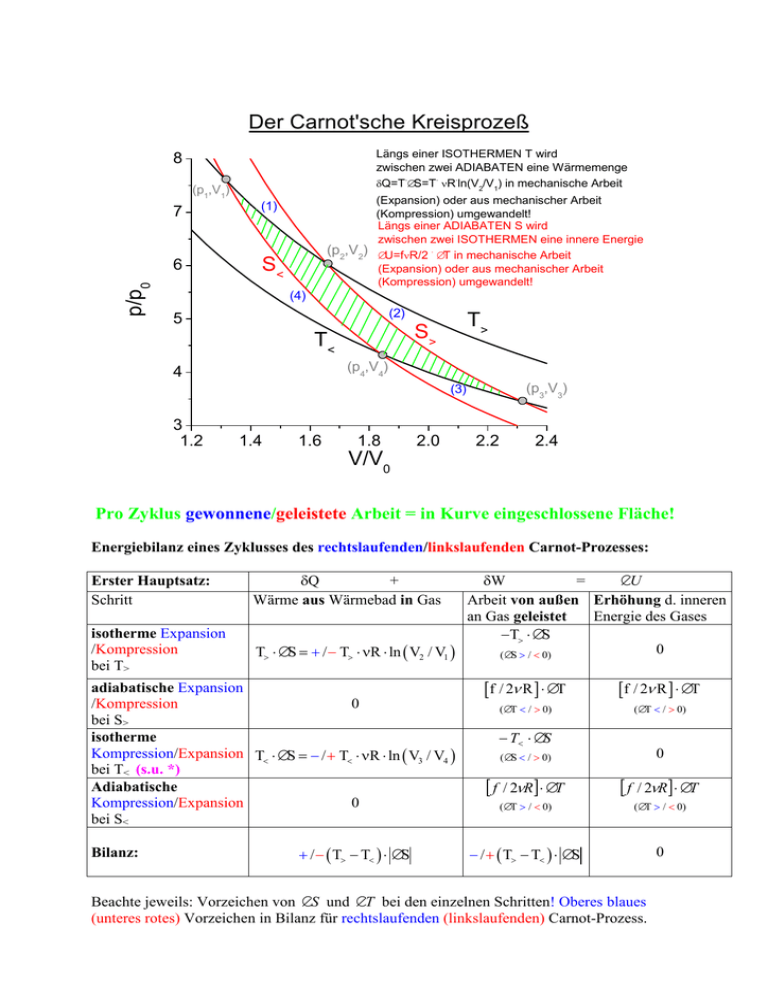
Der Carnot'sche Kreisprozeß Längs einer ISOTHERMEN T wird zwischen zwei ADIABATEN eine Wärmemenge . . . δQ=T ∆S=T νR ln(V2/V1) in mechanische Arbeit 8 (p1,V1) 7 p/p0 6 (1) (p2,V2) S< (Expansion) oder aus mechanischer Arbeit (Kompression) umgewandelt! Längs einer ADIABATEN S wird zwischen zwei ISOTHERMEN eine innere Energie . ∆U=fνR/2 ∆T in mechanische Arbeit (Expansion) oder aus mechanischer Arbeit (Kompression) umgewandelt! (4) (2) 5 T> S> T< (p4,V4) 4 (p3,V3) (3) 3 1.2 1.4 1.6 1.8 2.0 2.2 2.4 V/V0 Pro Zyklus gewonnene/geleistete Arbeit = in Kurve eingeschlossene Fläche! Energiebilanz eines Zyklusses des rechtslaufenden/linkslaufenden Carnot-Prozesses: Erster Hauptsatz: Schritt δQ + Wärme aus Wärmebad in Gas isotherme Expansion /Kompression bei T> T> ⋅ ∆S = + / − T> ⋅ νR ⋅ ln ( V2 / V1 ) adiabatische Expansion /Kompression 0 bei S> isotherme Kompression/Expansion T< ⋅ ∆S = − / + T< ⋅ νR ⋅ ln ( V3 / V4 ) bei T< (s.u. *) Adiabatische Kompression/Expansion 0 bei S< Bilanz: + / − ( T> − T< ) ⋅ ∆S δW = ∆U Arbeit von außen Erhöhung d. inneren an Gas geleistet Energie des Gases −T> ⋅ ∆S 0 ( ∆S > / < 0) [f / 2ν R ] ⋅ ∆T [f / 2ν R ] ⋅ ∆T ( ∆T < / > 0) ( ∆T < / > 0) − T< ⋅ ∆S ( ∆S < / > 0) 0 [ f / 2νR] ⋅ ∆T [ f / 2νR] ⋅ ∆T ( ∆T > / < 0) ( ∆T > / < 0) − / + ( T> − T< ) ⋅ ∆S 0 Beachte jeweils: Vorzeichen von ∆S und ∆T bei den einzelnen Schritten! Oberes blaues (unteres rotes) Vorzeichen in Bilanz für rechtslaufenden (linkslaufenden) Carnot-Prozess. Ideale Wärmekraftmaschine = rechtslaufender Carnot-Prozeß (1)→ → (2)→ →(3)→ →(4): T> Q> W Q< T< δQ< nicht nutzbar; deswegen ‚ökonomische’ Energiebilanz pro Zyklus: Netto gewonnene Arbeit (Adiabaten kompensieren sich): δW = ∆S ⋅ ( T> − T< ) Bei T> aufgenommene Wärme: δ Q > = T> ⋅ ∆S (Bei T< wieder abgegebene Wärme: (irrelevant für η) δ Q< = T< ⋅ ∆S ) Ökonomische Bilanz, Wirkungsgrad η (‚Nutzen/Preis’) η= T> − T< T> stets <1 Ideale Wärmepumpe = linkslaufender Carnot-Prozeß (3)→ →(2)→ →(1)→ →(4): T> Q> W Q< T< δQ< ist umsonst, deswegen ‚ökonomische’ Energiebilanz pro Zyklus: Netto geleistete Arbeit (Adiabaten kompensieren sich): δW = ∆S ⋅ ( T> − T< ) (Bei T< aufgenommene Wärme : (irrelevant für η): δ Q > = T> ⋅ ∆S Bei T> wieder abgegebene Wärme δ Q< = T< ⋅ ∆S Bilanz, Wirkungsgrad η (‚Nutzen/Preis’) η= T> T> − T< stets >1 Zweiter Hauptsatz der Thermodynamik und ‚perpetuum mobile zweiter Art’ Betrachte: Hintereinanderschaltung von Carnot’scher Wärmekraftmaschine und Carnot’scher Wärmepumpe mit gleichen Wärmebädern: T> T> Q> Q> W W Q< Q< T< T< Nettoresultat: kein Wärmefluß, keine Arbeit! ABER: Betrachte: Hintereinanderschaltung von hypothetischer Wärmekraftmaschine mit höherem Wirkungsgrad als dem der Carnot’schen und Carnot’scher Wärmepumpe, wieder mit gleichen Wärmebädern: T> T> Q> T> Q> W + Wextra Q< Q> W W Wextra Q< T< Q< T< T< Nettoresultat: Maschine, die lediglich durch Wärmeentnahme aus einem Wärmebad Arbeit leistet = ‚perpetuum mobile zweiter Art’ Zweiter Hauptsatz der Wärmelehre: Ein ‚perpetuum mobile zweiter Art’ kann nicht realisiert werden! Oder auch: Keine Wärmekraftmaschine kann einen höheren Wirkungsgrad als den Carnot’schen haben! * Ergänzung zum Carnot-Prozess: Streng genommen muss noch gezeigt werden, dass längs beider Isothermen tatsächlich ln ( V2 / V1 ) = ln ( V3 / V4 ) ist und damit ∆S1−> 2 = −∆S3 −> 4 . Das ist äquivalent mit dem Beweis dafür, dass die Entropie sich in einem Kreisprozess nicht ändert, also eine Zustandsgröße ist: Da die Zustandsänderungen 2 3 und 4 1 adiabatisch sind, gilt jeweils die Adiabatengleichung (s.o.): p 2 V2 γ = p3 V3 γ und p1V1γ = p 4 V4 γ ; Kombiniere mit Gasgleichung: p 2 V2 p 3 V3 = T> T< und p1V1 p 4 V4 = ; T> T< Dividiere beide Zeilen termweise: T> V2 γ−1 = T< V3 γ−1 und T> V1γ−1 = T< V4 γ−1 ; Dividiere links durch rechts: V2 V1 γ−1 γ−1 V = 3 ; Bilde Logarithmus auf beiden Seiten V4 V V ln ( V2 / V1 ) = ln ( V3 / V4 ) wie verlangt. ( γ − 1) ln 2 = ( γ − 1) ln 3 , also V1 V4











