Zum Thema Genetik und Kardiologie Dilatative Kardiomyopathien
Werbung

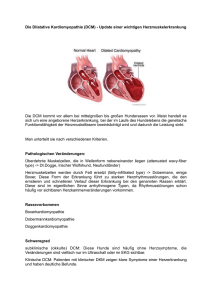
Genetik und Kardiologie Dilatative Kardiomyopathien Thomas Scheffold1, Karl Josef Osterziel2 für das „Netzwerk Myokardiale Erkrankungen“ Zum Thema 1 Klinik für Innere Medizin und Kardiologie, Herzzentrum Lahr/Baden 2 Charité, Franz0Volhard0Klinik, Humboldt Universität, Berlin0Buch Zusammenfassung Die dilatative Kardiomyopathie (DCM) ist eine Herzmuskelerkrankung mit links oder biventrikulärer Dilatation unklarer Genese und zählt neben der koronaren Herzerkrankung (KHK) zu den Hauptursachen einer Herzinsuffi zienz (HI). In ca. 25% der Fälle wird eine familiäre Häufung beobachtet, so daß bei diesen Patienten von ei ner genetischen Ursache der Erkran kung ausgegangen werden kann. Es werden außerdem virale, immunolo gische, toxische sowie andere Ursa chen als Auslöser für das auch kli nisch heterogene Bild einer DCM diskutiert. Bei den familiären Formen wurden bisher bei der autosomal do minant vererbten DCM 8 Genorte lokalisiert und ein Gen identifiziert. Für die seltene Xchromosomal ver erbte DCM sind 2 Genorte mit den entsprechenden Genen bekannt. Die Erforschung der molekularen Genetik der DCM befindet sich noch in den Anfängen. So steht für betroffene Patienten und deren Familien bis heute noch keine gezielte genetische Diagnostik zur Verfügung. Es ist je doch zu erwarten, daß in den näch sten Jahren weitere Genorte und Gene identifiziert werden. Erst die Kenntnis aller Krankheitsgene er möglicht die Entwicklung gezielter molekulargenetischer diagnostischer Verfahren, insbesondere unter Berücksichtigung der Genotyp PhänotypKorrelation. Umfassende molekulargenetische diagnostische Möglichkeiten könnten künftig helfen, bessere Behandlungs strategien der DCM zu entwickeln. Schlüsselwörter Dilatative Kardiomyopathie, DCM, familiäre Erkrankung, Genetik, Herzinsuffizienz Summary Dilated cardiomyopathy (DCM) is a disease of the heart muscle with left or biventricular dilation, and next to coronary heart disease, one of the main causes of heart failure. In about 25% a familial appearance of the disease was observed, which indicates the DCM in these patients as an inherited disease. Besides genetic/familial contribution, viral, immunological, toxic and other factors are discussed as possible causes of DCM. Using linkage analyses in families with autosomal dominant trait, 8 gene loci have been localised and one gene using sequencing technique has been identified. For the rare Xchromo somal DCM two loci have been localised and the corresponding genes were identified. The molecular genetic of DCM is still in its early stages. For patients and their families there is still no specific genetic diagnosis available. It is however to be expected that additional gene loci and genes will be identified in the next years. The identification of genes will enable the development of specific molecular genetic diagnostic procedures especially under consideration of genotypephenotype correlation. In the future, extensive molecular genetic diagnostics may help to find better strategies for the treatment of DCM. Keywords Dilated cardiomyopathy, DCM, familial, genetic, heart failure medgen 11 (1999) 257 Genetik der Kardiologie Zum Thema Tab 1 Bekannte Genorte der Familiären Dilatativen Kardiomyopathie GDB OMIM%Nr. Vererbung Locus Gen Referenz CMD1A CMD1B CMD1C CMD1D CMD1E CMD1F n.d. n.d. CMD1G CMD3A XLDC 115200 600884 601493 601494 601154 602067 102540 AD AD AD AD AD AD AD AD AD XC XC 1p10q1 9q130q22 10q210q23 1q32 3p250p22 6q23 15p14 2q14022 2q31 Xq28 Xp21 ? ? ? ? ? ? Aktin (ACTC) ? ? Tafazzin (G4.5) Dystrophin (DMD) Kass et al. (1994) Krajinovic et al. (1995) Bowles et al. (1996) Durand et al. (1995) Olson et al. (1996) Messina et al. (1997) Olson et al. (1998) Jung et al. (1998) Siu et al. (1999) D’Adamo et al. (1997) Towbin et al. (1993) 300069 302045 Abkürzungen CMD XLDC n.d. AD XC GDB OMIM Dilatative Kardiomyopathie X0chromosomale Dilatative Kardiomyopathie noch nicht definiert autosomal dominant X0chromosomal Genome database (http://www.gdb.org) Online Mendelian Inheritance in Man (http://www.ncbi.nlm.nih.gov/omim) Klinik der Dilatativen Kardiomyopathie Die Dilatative Kardiomyopathie (DCM) ist eine Erkrankung der Herzmuskula0 tur, die über eine Dilatation des linken oder beider Ventrikel zu einer progre0 dient verlaufenden Einschränkung der systolischen Pumpfunktion des Her0 zens (Herzinsuffizienz) führt. Die Ursa0 chen der Erkrankung sind äußerst he0 terogen. Geht sie von der Herzmusku0 latur selbst aus, werden genetische, vi0 rale, immunologische, toxische sowie andere, größtenteils noch unbekannte Auslöser vermutet. Ist die DCM Folge einer anderen Erkrankung (hypertensi0 ve Herzerkrankung, koronare Herzer0 krankung, Erkrankung der Herzklap0 pen, systemische Erkrankungen, meta0 bolische Erkrankungen etc.), wird die0 se als sogenannte spezifische DCM definiert (Richardson et al., 1996). Leider liegen nur wenige epidemiolo0 gische Daten über die DCM vor, so daß die Zahlen aus einer amerikani0 schen Pathologie0Studie mit einer Prävalenz von 36/100.000 und einer jährlichen Inzidenz von 8/100.000 (Codd et al., 1989) sicherlich noch nicht als endgültig zu werten sind. Die tatsächliche Prävalenz dürfte wesent0 lich höher sein, da viele asymptomati0 sche Patienten durch solche Studien nicht erfaßt werden. Nach den Daten des statistischen Bundesamtes der Bundesrepublik Deutschland wurden im Jahr 1996 na0 hezu doppelt so viele Patienten mit der Diagnose einer „Herzinsuffizienz“ (237.000 Patienten) wie mit der Dia0 gnose „akuter Herzinfarkt“ (131.000 258 medgen 11 (1999) Patienten) stationär behandelt. Daraus läßt sich ableiten, daß das vorherr0 schende Gesundheitsproblem der westlichen Industrienationen sich be0 reits von der koronaren Herzerkran0 kung weg und hin zur Herzinsuffizienz verlagert hat. Da mehr als 1/3 der Pa0 tienten mit Herzinsuffizienz an einer DCM leiden, sollte eine extensive Ur0 sachenklärung der DCM erfolgen. Konsequenzen der DCM sind neben der Herzinsuffizienz häufig Herzrhyth0 musstörungen und/oder Störungen des kardialen Reizleitungssystems so0 wie thrombembolische Komplikatio0 nen. Eine DCM wird bei den Patienten häufig zwischen dem 20. und 50. Le0 bensjahr diagnostiziert, dabei besteht oft schon ein fortgeschrittenes Stadi0 um. Anamnestische Angaben, die kli0 nische Symptomatik der Patienten und eine Vielzahl von Befunden sind für die Diagnose zwar hilfreich, jedoch nicht pathognomisch. Bei den meisten Patienten wird daher heute noch ohne Berücksichtigung auf eine mögliche Ursache die Diagnose „idiopathische DCM“ gestellt. Die Prognose der DCM ist ungünstig, die 50Jahres Überlebensrate beträgt nach Auftreten der ersten Symptome trotz therapeutischer Bemühungen über 50%. Die medikamentöse Thera0 pie ist rein symptomatisch. Eine Ver0 zögerung der Progression der Erkran0 kung und die Reduktion des plötzli0 chen Herztodes sind wichtige thera0 peutische Ziele. Dennoch beweist der meist schwere klinische Verlauf mit deutlich reduzierter Lebenserwartung die Dringlichkeit einer zuverlässigen Diagnostik zur Entwicklung gezielter präventiver und therapeutischer Ver0 fahren. Die einzige Therapieoption bei terminaler Herzinsuffizienz besteht derzeit nur in einer Herztransplantati0 on. Klinische und molekulare Genetik Bereits seit 1961 wurde in mehreren Familien eine Häufung der DCM be0 obachtet. Dennoch unterschätzte man lange Zeit die Bedeutung dieser Be0 funde als Grundlage einer möglichen genetischen Ursache. Nach neueren systematischen Untersuchungen wird heute von einer familiär/genetischen Ätiologie der DCM in 20030% aller Fälle ausgegangen (Michels et al., 1992). Der tatsächliche Anteil dürfte jedoch weit größer sein, da in Mitte0 leuropa häufig nur kleine Familien mit weniger als 2 Kindern anzutreffen sind und somit eine familiäre Häufung oft verborgen bleibt. Nach den Empfehlungen der Arbeits0 gruppe des Europäischen Projektes „Human and Capital Mobility Project on Familial Dilated Cardiomyopathy“ kann von einer familiären Form der DCM dann ausgegangen werden, wenn in einer Familie mindestens zwei Mitglieder erkrankt sind oder wenn ein dem Indexpatienten Verwandter er0 sten Grades an einem plötzlichen Herztod vor dem 35. Lebensjahr ver0 storben ist (Mestroni et al., 1999). Die Zahl von sporadisch genetisch Er0 krankten infolge von Neumutationen ist nicht bekannt. Es ist anzunehmen, daß neben der familiären Form der DCM weit mehr Fälle der Erkrankung In den meisten der bisher untersuch0 ten Familien ergaben Segregations0 analysen einen überwiegend autoso0 mal dominanten Erbgang mit einer äußerst variablen Expressivität der Er0 krankung. In nur wenigen Familien wurde ein X0chromosomaler Erbgang mit schwerem klinischen Verlauf der DCM beobachtet. Über autosomal re0 zessive Formen der DCM sowie matri0 lineare Erbgänge infolge mitochon0 drialer DNA0Defekte liegen erste Er0 gebnisse vor, die jedoch durch weite0 re Studien bestätigt werden müssen. Autosomal dominante DCM Mit Hilfe von Kopplungsanalysen konnte der erste Krankheitslocus in ei0 ner Familie mit autosomal dominan0 tem Erbgang auf Chromosom 1 loka0 lisiert werden (CMD1A=CDCD1) (Kass et al., 1994). In dieser Familie, die über mehr als 20 Jahre beobachtet wurde, begann die Erkrankung in der 2.–3. Lebensdekade mit atrioventri0 kulären Überleitungsstörungen oder mit Arrhythmien. Erst in der 4.–5. Le0 bensdekade fanden sich bei den Be0 troffenen Zeichen der progressiven Kardiomyopathie, wobei ab dem 50. Lebensjahr die typischen morphologi0 schen und funktionellen Störung des Herzens vorlagen. Weitere Genorte für diese Form der DCM fanden sich auch auf Chromosom 3 (CMD1E=CDCD2) (Olson et al., 1996) und Chromosom 6 (CMD1F=CDCD3) (Messina et al., 1997). Bei dem letztgenannten Genort war die Kardiomyopathie mit einer spät einsetzenden Myopathie des Schultergürtels assoziiert. Der erste Genort für eine DCM, bei der im wesentlichen die Dilatation mit konsekutiver Funktionseinschränkung Bei der Genanalyse des kardialen Ak0 tingens führte die Hypothese einer möglichen Assoziation zur DCM zur Identifikation von zwei Mutationen. In einer Familie wurde bei den Erkrank0 ten im Exon 5 des Aktin0Gens eine G0 A Substitution in Codon 312 (Arg312His) und in einer zweiten Fa0 milie im Exon 6 eine A0G Substitution in Codon 361 (Glu361Gly) identifiziert. Für Kopplungsanalysen waren jedoch beide Familien zu klein, so daß ledig0 lich eine Kosegregation der Mutatio0 nen mit der Erkrankung nachweisbar war. Die Möglichkeit lediglich einen Polymorphismus gefunden zu haben, wurde durch Sequenzanalyse des Ak0 tingens in einem großen Kontrollkol0 lektiv ausgeschlossen (Olson et al., 1998). Xchromosomal dominante DCM In DCM0Familien mit X0chromosoma0 lem Erbgang wurde in Kopplungsana0 lysen der kurze Arm des X0Chromo0 soms als Krankheitslocus identifiziert (Towbin et al., 1993). Im dort lokali0 sierten Dystrophingen konnten meh0 rere Mutationen gefunden werden. Unter anderem wurde eine Deletion im Promotorbereich beschrieben, die zu einer verminderten Expression von Dystrophin in der Herzmuskulatur mit konsekutiver schwerer DCM führte (Muntoni et al., 1993). Für eine ande0 re Familie mit X0chromosomaler DCM erbrachte die direkte Genanalyse eine Punktmutation in der 5’ splice site der ersten Exon0Introngrenze des Dystro0 phingens (Milasin et al., 1996). Bei den wenigen Familien mit X0chromo0 somalem Erbgang zeigten die männli0 chen Betroffenen einen Beginn der Erkrankung bereits im Kindesalter mit einer raschen Progression und fatalem Verlauf. Bei den weiblichen Betroffe0 nen charakterisierte sich die Erkran0 kung durch einen milden Verlauf mit klinischer Manifestation erst im spä0 ten Erwachsenenalter. In Analogie zur Muskeldystrophie Du0 chenne/Becker konnte in drei Famili0 en mit schwerer DCM ohne Beteili0 gung der Skelettmuskulatur eine Kopplung zum Locus des Barth0Syn0 droms etabliert werden. Für diese ebenfalls sehr seltene Variante der vererblichen DCM waren Mutationen im Taffazin0Gen (G4.5) nachweisbar (D’Adamo et al., 1997). Genetik der Kardiologie des Herzens im Vordergrund stand, konnte auf Chromosom 9 (CMD1B) (Krajinovic et al., 1995) lokalisiert wer0 den. Bei dieser „rein myokardialen“ Form der DCM lag der Beginn der Symptomatik bei den Betroffenen be0 reits in der zweiten Lebensdekade. Weitere Genorte wurden außerdem auf Chromosom 10 (CMD1C) (Bowles et al., 1996), Chromosom 1 (CMD1D) (Durand et al., 1995) und 2 Loci auf Chromosom 2 (Jung et al., 1998; Siu et al., 1999) identifiziert. Zum Thema genetisch bedingt sind. Von einer ge0 netisch determinierten DCM kann je0 doch nur durch Ausschluß vor allem der spezifischen Ursachen ausgegan0 gen werden. So wird zur Abgrenzung gegenüber der durch KHK induzierten DCM, insbesondere bei Patienten nach dem 35. Lebensjahr und bei Vor0 liegen von Gefäßrisikofaktoren, eine Koronarangiographie empfohlen. Der diagnostische Gewinn einer Myokard0 biopsie wird dagegen sehr unter0 schiedlich beurteilt und gehört nicht zum diagnostischen Standard. Ausblick Die Behandlung einer DCM gehört in0 zwischen zum klinischen Alltag. Die Erfassung der Ursachen ist jedoch nur begrenzt möglich. Daraus ergibt sich ein dringender Bedarf nach der Klärung der Ursachen, da nur so kau0 sale Therapiestrategien entwickelt und angewandt werden können. Der Iden0 tifizierung einer DCM als familiäre Er0 krankung kommt eine besondere Be0 deutung zu. Für die autosomal domi0 nant vererbte DCM liegen klinisch gut charakterisierte Familien vor, aber die bisher bekannten Loci konnten jeweils nur in einer Familie beschrieben wer0 den. Für die X0chromosomal vererbte DCM wurden Mutationen im Dystro0 phin0Gen in bereits mehreren Familien gefunden. Analog zur hypertrophi0 schen Kardiomyopathie, die als Er0 krankung des Sarkomers gilt, könnten sich aus den Dystrophinbefunden wertvolle Hinweise für die DCM als eine Erkrankung des Zytoskeletts ab0 leiten lassen. Analysen autosomaler Gene, die für zytoskelettale Gene ko0 dieren (Titin, Merosin etc.) sind bereits Gegenstand intensiver Untersuchun0 gen bei familiären und sporadischen DCM0Patienten. Zur Entwicklung der molekularen Ge0 netik der DCM müssen dringend wei0 tere Familien rekrutiert werden, um die bereits bekannten Befunde zu bestäti0 gen und um weitere Genloci mit wei0 teren Kandidatengenen zu identifizie0 ren. Die Klärung vor allem der geneti0 schen Ursachen der DCM hat erste Priorität, da darüber ein Zugang zu dem Syndrom der DCM gefunden werden kann. medgen 11 (1999) 259 Genetik der Kardiologie Zum Thema Die wenigen genetischen Befunde zur DCM bilden noch keine ausreichende Grundlage für eine gezielte Beratung von Patienten und ihren Familien. Erst die fortschreitende Ursachenauf0 klärung der DCM wird es ermöglichen, Betroffene in einem frühen noch asymptomatischen Stadium der Er0 krankung zu identifizieren. Dies ist Vorraussetzung für die Entwicklung spezifischer präventiver und thera0 peutischer Maßnahmen, mit denen die sehr ernste Prognose der DCM in Zu0 kunft hoffentlich günstig beeinflußt werden kann. Muntoni F, Cau M, Ganau A et al. (1993) Deleti0 on of the dystrophin muscle0promotor region as0 sociated with X0linked dilated cardiomyopathy. New Engl J Med 329: 9210925 Literatur D’Adamo P, Fassone L, Gedeon A, Janssen EA, et al. (1997) The X0linked gene G4.5 is respon0 sible for different infantile dilated cardiomyopa0 thies. Am J Hum Genet 61: 8620867 Siu BL, Niimura H, Osborne JA, Fatkin D, McRae C, Solomon S, Benson DW, Seidman JG, Seid0 man CE (1999) Familial dilated cardiomyopathy locus maps to chromosome 2q31. Circulation 99:102201026 Bowles KR, Gajarski R, Porter P, et al. (1996) Gene mapping of familial autosomal dominant di0 lated cardiomyopathy to chromosome 10q21023. J Clin Invest 98: 135501360 Towbin JA, Hejtmancik JF, Brink P et al. (1993) X0linked dilated cardiomyopathy: a molecular genetic evidence of linkage to the Duchenne muscular dystrophy (dystrophin) gene at the Xp21 locus. Circulation 87: 185401865 Codd MB, Sugrue DD, Gersh BJ, Melton LJ (1989) Epidemiology of idiopathic dilated and hy0 pertrophic cardiomyopathy: a population based study in Olmsted County, Minnesota, 197501984. Circulation 80: 5640572 Durand JB, Bachinski LL, Bieling LC, et al. (1995) Localization of a gene responsible for familial di0 lated cardiomyopathy to chromosome 1q32. Cir0 culation 92: 338703389 Jung M, Poepping I, Perrot AE, Reis A, Osterziel KJ (1998) A Family with Autosomal Dominant Di0 lated Cardiomyopathy Maps to a Novel Locus on Chromosome 2. Circulation 96 (Suppl.): I0246 Kass S, MacRae C, Graber HL, et al. (1994) A gene defect that causes conduction system di0 sease and dilated cardiomyopathy maps to chro0 mosome 1p101q1. Nature Genet 7: 5460551 Krajinovic M, Pinamonti B, Sinagra G, et al. (1995) Linkage of familial dilated cardiomyopathy to chromosome 9. Heart Muscle Disease Study Group. Am J Hum Genet 57: 846052 Messina DN, Speer MC, Pericak0Vance MA, McNally EM (1997) Linkage of familial dilated car0 diomyopathy with conduction defect and mus0 cular dystrophy to chromosome 6q23. Am J Hum Genet 61: 9090917 Mestroni L, Maisch B, McKenna WJ, et al. (1999) Guidelines for the study of familial dilated car0 diomyopathies. Eur Heart J 20: 930102 Michels VV, Moll PP, Miller FA, et al. (1992) The Frequency of Familial Dilated Cardiomyopathy In A Series Of Patients With Idiopathic Dilated Car0 diomyopathy. N Engl J Med 326: 77082 Milasin J, Muntoni F, Severini GM et al. ( 1996) A point mutation in the 50prime splice site of the dystrophin gene first intron responsible for X0 lin0 ked dilated cardiomyopathy. Hum Molec Genet 5: 730 79 260 medgen 11 (1999) Olson TM, Keating MT (1996) Mapping a car0 diomyopathy locus to chromosome 3p220p25. J Clin Invest 97: 528032 Olson TM, Michels VV, Thibodeau SN (1998) Ac0 tin Mutation in Dilated Cardiomyopathy a Heri0 table Form of Heart Failure. Science 280: 7500 752 Richardson P, McKenna W, Bristow M, Maisch B et al. (1996) Report of the 1995 World Health Or0 ganization/International Society and Federation of Cardiology Task Force on the Definition and Classification of Cardiomyopathies. Circulation 93: 8410842 „Netzwerk Myokardiale Erkrankungen“ Das Netzwerk wurde 1997 gegründet und umfaßt zur Zeit zehn Institutionen (Universitäts0 kliniken, Herzzentren sowie Einrichtungen der Grundlagenforschung). Ziel ist es, in überregionaler Kooperation genetische Ursachen myokardialer Erkrankun0 gen zu erforschen. Koordination Thomas Scheffold und Karl Josef Osterziel Korrespondenzadresse Dr. med. Thomas Scheffold Klinik für Innere Medizin und Kardiologie Herzzentrum Lahr/Baden Hohbergweg 2 77933 Lahr Tel. +490078210925200 Fax +490078210925203 [email protected] Women’s Health Research Series Frauengesundheitsforschung, Medizinische Fakultät Westfälische Wilhelms0Universität Münster Volume I – Number 2 – 1997 ISBN 3000000236007 Irmgard Nippert: Proceedings of the International Workshop on Cystic Fibrosis Carrier Screening Development in Europe Kennedy Institute Copenhagen–Glostrup, Denmark, November 19th – 20th, 1992 Volume II – Number I – 1998 ISBN 3000000303905 Irmgard Nippert, Hans Clausen, Petra Frets, Martinus F. Niermeijer, Michael Modell: Evaluating Cystic Fibrosis Carrier Screening Development in Northern Europe: Denmark, the Federal Republic of Germany, the Netherlands, and the United Kingdom Die Hefte können zum Selbstkosten0 preis von DM 10,— unter folgender Email0Adresse angefordert werden: [email protected]