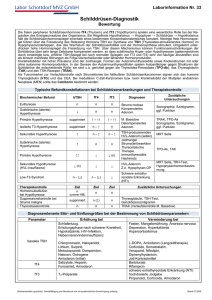
Einfluss der Thyroxindosis im Vergleich zu einer Kombination aus
Werbung

Aus der Medizinischen Universitätsklinik Abteilung Innere Medizin II Gastroenterologie, Hepatologie, Endokrinologie und Infektiologie der Albert-Ludwigs-Universität Freiburg im Breisgau Einfluss der Thyroxindosis im Vergleich zu einer Kombination aus Trijodthyronin und Thyroxin auf Kognition und Befindlichkeit bei Patienten mit sekundärer Hypothyreoseeine randomisierte, kontrollierte crossover Studie (Kurztitel: 4T-Studie-Kognition und Befindlichkeit) INAUGURAL-DISSERTATION zur Erlangung des Medizinischen Doktorgrades der Medizinischen Fakultät der Albert-Ludwigs-Universität Freiburg im Breisgau Vorgelegt 2007 von Edith Meiser geboren in Bukarest/Rumänien 2 Dekan Prof Dr. med. Christoph Peters 1. Gutachter Prof. Dr. med. Martin Reincke 2. Gutachter Prof. Dr. med. Hans-Peter Zahradnik Jahr der Promotion 2009 3 Inhaltsverzeichnis 1 Einleitung 5 1.1 Hintergrund 5 1.2 Physiologie der thyreotropen Achse 6 1.3 Die periphere Wirkung der Schilddrüsenhormone 8 1.4 Die sekundäre Hypothyreose (Pathomechanismus, Diagnostik, Klinik, Therapie) 9 1.5 Fragestellung 11 2 Studiendesign, Material und Methoden 12 2.1 Studiendesign 12 2.2 Probanden 12 2.3 Studienplan 14 2.3.1 Phasen 14 2.3.2 Visite 1 (V1) 15 2.3.3 Visite 2-4 (V2-4) 16 2.4 Studienmedikation 16 2.5 Untersuchte Parameter und Endpunkte 18 2.5.1 Klinische Sicherheitsparameter 18 2.5.2 Laboruntersuchungen 18 2.5.3 Messung der Achillessehnenreflexzeit 18 2.5.4 Zulewski Score 20 2.5.5 Kognition und Befindlichkeit 22 2.5.5.1 Testbatterie zur Aufmerksamkeitsprüfung (TAP) 22 2.5.5.2 Wechsler Memory Scale, Untertest “Zahlenspanne” 23 2.5.5.3 Visuelle Analogskala für Stimmung und körperliche Beschwerden 23 2.5.5.4 Symptomcheckliste von Derogatis (SCL-90-R) 23 2.5.5.5 SF-36 Fragebogen zum Gesundheitszustand (SF-36) 24 2.5.5.6 Gießener Beschwerdebogen (GBB-24) 24 2.5.5.7 Demenz Test nach Kessler, Untertest „Fremdbeurteilung“ 25 4 3 Ergebnisse 26 3.1 Patienten 26 3.2 Sicherheitsparameter, Nebenwirkungen und Adverse Events 28 3.2.1 Sicherheitsparameter 28 3.2.2 Adverse Events 28 3.2.3 Nebenwirkungen 29 Schilddrüsenwerte 31 3.3.1 Freies T4 (fT4) und gesamtes T4 (gT4) 31 3.3.2 Freies T3 (fT3) und gesamtes T3 (gT3) 31 3.3.4 Thyroidea stimulierendes Hormon (TSH), Thyreoglobulin (TG) 33 3.4 Achillessehnenreflexzeit (ART) 34 3.5 Zulewski Score 35 3.6 Tests zu Kognition und Befindlichkeit 36 3.6.1 Testbatterie zur Aufmerksamkeitsprüfung (TAP) 36 3.6.2 Wechsler Memory Scale, Untertest “Zahlenspanne” 37 3.3 3.6.3 Visuelle Analogskala für Stimmung und körperliche Beschwerden 38 3.7 3.6.4 Symptomcheckliste von Derogatis (SCL-90-R) 39 3.6.5 SF-36 Fragebogen zum Gesundheitszustand (SF-36) 41 3.6.6 Gießener Beschwerdebogen (GBB-24) 43 3.6.7 Demenz Test nach Kessler, Untertest „Fremdbeurteilung“ 44 Einfluss des Ausmaßes der Dosiserhöhung auf die untersuchten Zielparameter 45 4 Diskussion 46 5 Zusammenfassung 60 6 Abkürzungsverzeichnis 61 7 Tabellen- und Abbildungsverzeichnis 63 8 Literaturverzeichnis 64 9 Publikationen 73 10 Danksagung 74 11 Lebenslauf 75 5 1 Einleitung 1.1 Hintergrund Zur Therapie der Hypothyreose wurden 1891 erstmals Extrakte animalischer Schilddrüsen verwendet, welche beide Schilddrüsenhormone enthielten, Thyroxin (T4) und Trijodthyronin (T3) [57]. Es stellte sich heraus, dass diese Therapie oft zu erhöhten T3-Serumspiegeln und einigen Nebenwirkungen wie zum Beispiel Palpitationen führte. Später konnte festgestellt werden, dass T4 als das Pro-Hormon für die Entstehung des T3 angesehen werden kann, da circa 80% des extrathyroidalen T3 durch die T4-Konversion in den Zielgeweben entsteht und T3 intrazellulär weitaus potenter als T4 ist [13]. In den folgenden Jahren stand die T4-Monotherapie im Vordergrund. Auf der Suche nach der optimalen Dosierung schien die Menge von 1,6 µg/kg Körpergewicht am besten geeignet, um die physiologische Stoffwechsellage zu restituieren [80]. In den 1990er Jahren wurden von einer spanischen Arbeitsgruppe wichtige Erkenntnisse gewonnen. An thyroidektomierten Ratten stellte man fest, dass die physiologische Konzentration beider Schilddrüsenhormone in den Zielgeweben alleine mit der Kombinationstherapie aus T3 und T4 erreicht werden kann [24]. Diese Tatsache veranlasste viele Forschungsgruppen, weitere Untersuchungen über die Dosierung und die Wirkungen der Kombinationstherapie aufzunehmen. Es wurden weit überwiegend Patienten mit primärer Hypothyreose untersucht. Bei dem Krankheitsbild der sekundären (zentralen) Hypothyreose ist die Bestimmung der optimalen Substitutionstherapie jedoch deutlich schwieriger, da hier durch die Schädigung der Hypophyse das übergeordnete Hormon TSH (Thyroidea stimulierendes Hormon) nicht zur Dosistitrierung herangezogen werden kann [1, 52]. Erschwerend hinzu kommt, dass die periphere Konversion des T4 zu dem biologisch aktiven T3 durch den Mangel an TSH [9] sowie durch den meist ebenfalls vorhandenen Mangel an Wachstumshormon (GH) beeinträchtigt sein kann [38, 66]. 6 Hierdurch und ebenfalls durch den breiten Referenzbereich dieser Hormone bedingt, konnten bislang noch keine Zielwerte für die peripheren Hormonspiegel von T3 (fT3) und T4 (fT4) als Maßstab für die Therapie der sekundären Hypothyreose definiert werden. Die Ergebnisse einer vorangegangenen Querschnitt-Studie aus unserem Labor zeigten, dass die untersuchten Patienten mit sekundärer Hypothyreose zwar fT3 und fT4 Werte im mittleren Referenzbereich aufwiesen, jedoch erhöhte Lipidwerte im Vergleich zu gesunden Probanden hatten [31]. Diese Patienten wurden mit einer Substitutionsdosis von durchschnittlich 1,2 µg/kg KG behandelt, einer Menge, die deutlich tiefer liegt als die aktuelle Richtdosis von primär hypothyreoten Patienten. Diese Tatsache ließ uns im Zusammenhang mit oben genannten Hintergründen eine laborchemisch nicht feststellbare Untersubstitution dieser Patienten annehmen. 1.2 Physiologie der thyreotropen Achse Die Ausschüttung von L-Thyroxin (T4) und Trijodthyronin (T3) erfolgt in der Schilddrüse und wird von übergeordneten Organen, der Hypophyse und dem Hypothalamus, stimuliert beziehungsweise kontrolliert. Vom Hypothalamus ausgehend, erreichen spezifische stimulierende und inhibierende Hormone über die Portalgefäße des Hypophysenstiels die Adenohypophyse (Vorderlappen, HVL) und regulieren die Sekretion von trophischen Hormonen: Thyroidea stimulierendes Hormon (TSH), Adrennocorticotropes Hormon (ACTH), Luteinisierendes Hormon (LH), Wachstumshormon (GH) und Follikel stimulierendes Hormon (FSH). Diese lösen die Ausschüttung von Effekthormonen aus, welche neben ihrer peripheren hormonellen Wirkung, eine hemmende Wirkung auf Hypophyse und Hypothalamus, im Sinne eines negativen Rückkopplungsmechanismus, besitzen. Dieser geschlossene Regelkreis garantiert ein physiologisches Gleichgewicht. 7 Die threotrope Hormonachse, die in dieser Arbeit thematisiert wird, ist in Abbildung 1 schematisch dargestellt. Im Hypothalamus wird das Thyreotropin releasing Hormon (TRH) gebildet, welches im Hypophysenvorderlappen die Produktion und Sekretion von TSH stimuliert. Das TSH wiederum bewirkt, dass in der Schilddrüse L-Thyroxin (T4) und Trjodthyronin (T3) gebildet und freigesetzt werden. Diese hemmen durch negative Rückkopplung die Ausschüttung von TRH und TSH. Hypothalamus + - TRH HVL + - TSH Schilddrüse 1. Jodination 2. Jodisation (im Thyreoglobulin, TG) J2+Thyrosin=>MJT+DJT 3. Koppelung (im TG) MJT+DJT=>T3 DJT+DJT=>T4 4. Speicherung: T3+T4 im TG 5. Hormoninkretion: Proteolyse von TG; Abgabe von gebundenem T3+T4 + - proteingebundenes T3+T4 freies T3+T4 Konversion Abbildung 1: Regelkreis der Schilddrüse (nach Karhoff) T4 T3 8 1.3 Die periphere Wirkung der Schilddrüsenhormone Die gesunde Schilddrüse bildet täglich circa 100 µg T4 und 10 µg T3. Die Schilddrüsenhormone werden im Plasma zu über 99% an Plasmaproteine (Thyroxin bindendes Globulin (TBG), andere Albumine) gebunden transportiert. Biologisch wirksam sind nur die geringeren freien Anteile an T3 und T4 (fT3 und fT4), wobei das biologisch um ein Mehrfaches potentere T3 zum großen Teil peripher durch Dejodierung aus freiem T4 gebildet wird (Abbildung 1). Nukleäre Schilddrüsenrezeptoren (TR) binden unter Einfluss von fT3 oder fT4 an die Promoterregion spezifischer DNA-Sequenzen (thyroid responsive elements) und hemmen oder stimulieren somit die Transkription von Zielgenen. Insbesondere wird die Bildung der membrangebundenen Na+/K+-ATPase durch Schilddrüsenhormone stimuliert. T3 und T4 bewirken eine Steigerung des Sauerstoffgrundumsatzes und -Verbrauches, fördern das Wachstum, senken das Cholesterin, steigern die Katecholaminsensibilität der ß-Rezeptoren am Herzen, die periphere Reflexantwort und die kognitive Leistungsfähigkeit, verursachen Tremor und Nervosität. Schilddrüsenhormonen kann Depressionen auslösen [33]. Ein Mangel an 9 1.4 Die sekundäre Hypothyreose (Pathomechanismus, Diagnostik, Klinik, Therapie) Bei der sekundären Hypothyreose kann trotz intaktem Schilddrüsengewebe aufgrund einer Schädigung auf übergeordneter Ebene, im Hypothalamus oder in der Hypophyse, nicht die ausreichende Quantität an Schilddrüsenhormonen produziert werden. Die Schädigung wird in erster Linie durch Tumoren, aber auch durch entzündliche oder traumatische Prozesse verursacht. Am häufigsten treten gutartige Adenome des Hypophysenvorderlappens auf (Abbildung 2), die je nach Art und Ausdehnung operativ, medikamentös oder strahlentherapeutisch behandelt werden können, meistens jedoch ein kombiniertes Therapieregime erfordern. Die Folge dieser Erkrankung, beziehungsweise die der durchgeführten Behandlungen, ist häufig eine partielle oder eine vollständige Hypophysenvorderlappeninsuffizienz, welche eine angepasste hormonelle Substitutionstherapie mit peripheren Hormonen erfordert. Abbildung 2: MRT-Bild eines Makroadenoms der Hypophyse grüner Pfeil; (Quelle: Internet) Die Diagnose der sekundären Hypothyreose ist schwierig, da der TSH-Serumspiegel erniedrigt, normal oder sogar erhöht sein kann. Außerdem ist im Rahmen dieses Krankheitsbildes eine verminderte biologische Aktivität des TSH anzunehmen [8, 65, 70]. Hinzu kommt, dass aufgrund des breiten Referenzbereiches des freien T3 und T4 eine Unterfunktion oft erst erkannt wird, wenn sie bereits ausgeprägt ist [2, 28]. Der 10 TRH-Stimulationstest, der zur Diagnose der primären Hypothyreose verwendet wird, weist für die sekundäre Hypothyreose eine nur unzureichende Sensitivität auf [6, 69, 70]. Aus diesen Gründen kann eine subklinische Hypothyreose häufig übersehen werden. Patienten mit einer subklinischen primären Hypothyreose haben bereits ein bis zu dreifach erhöhtes Risiko unter Depressionen, Schlafstörungen, Angst, Merkfähigkeitund Gedächtnisstörungen zu leiden. Zudem ist das Demenzrisiko deutlich erhöht und leichtere kognitive Störungen reichen von einer Verlangsamung des Denkablaufs und der Wortflüssigkeit bis zu einer ausgeprägten Störung des Langzeitgedächtnisses [33, 44]. Ebenso stellt die primäre subklinische Hypothyreose einen unabhängigen Risikofaktor für eine erhöhte Inzidenz kardiovaskulärer Erkrankungen und für eine erhöhte Mortalität dar [34, 36, 39, 43, 51, 58]. Demnach wird eine adäquate Substitutionstherapie dringend empfohlen. Klinisch äußert sich die sekundäre ähnlich wie die primäre Hypothyreose durch Gewichtszunahme, Obstipation, Kälteintoleranz, Hauttrockenheit, Heiserkeit, Libidoverlust, Erschöpfungsneigung und Leistungsminderung. Die Therapie der Hypothyreose besteht in der Substitution von reinem Thyroxin (T4). Dies ist im Falle der sekundären Hypothyreose möglicherweise unzureichend, da bei diesem Krankheitsbild die periphere Umwandlung des T4 zu dem biologisch potenterem T3 durch die erniedrigte TSH-Wirkung und dem häufig assoziierten Wachstumshormonmangel eingeschränkt sein kann [38, 45]. Aktuell wird bei der primären Hypothyreose eine Dosierung von 1,6 µg/kg KG empfohlen. Die Substitutionsdosis bei der sekundären Hypothyreose wird empirisch festgelegt und im Zusammenhang mit dem gesamten klinischen Bild beurteilt. Sie ist subjektiv abhängig von dem behandelnden Arzt. 11 1.5 Fragestellung Patienten mit sekundärer Hypothyreose wurden laut einer Studie aus unserem Labor mit durchschnittlich 1,2 µg/kg KG Thyroxin therapiert [31], einer Menge, die deutlich unter der Therapieempfehlung für primär hypothyreote Patienten (1,6 µg/kg KG) liegt [29]. Zudem kann im Rahmen dieses Krankeitsbildes der Mangel an TSH und der eventuell assoziierte Mangel an GH die Konversion des T4 zu dem biologisch aktiveren T3 einschränken [9, 38], sodass angenommen werden kann, dass diese Patienten ein höher gelegenes Substitutionsniveau von T4 oder möglicherweise eine Kombinationstherapie aus T3 und T4 benötigen, um eine euthyreote Stoffwechsellage zu erreichen. Hinzu kommt, dass die laborchemische Diagnose aufgrund der geringen Aussagekraft des TSH-Spiegels und der niedrigen Sensivität des TRH-Tests in diesem Fall besonders schwierig ist und das Therapieniveau von der subjektiven Einschätzung des behandelnden Arztes abhängt. Ausgehend von diesen Tatsachen gelangten wir zu der Hypothese, dass sekundär hypothyreote Patienten mit einer unzureichender T4-Dosis therapiert werden. Es ist bekannt, dass die primäre subklinische Hypothyreose durch Beeinträchtigung des Wohlbefindens und der kognitiven Funktionen [37, 54, 86] bereits zu einer eingeschränkten Lebensqualität sowie zu ungünstigen Stoffwechselwerten führen kann [17, 18, 19, 34, 43, 51, 67, 68, 71, 79, 82]. Aus diesem Grund setzten wir uns mit der 4T-Studie zum Ziel, die optimale Substitutionsdosis und -Zusammensetzung für Patienten mit sekundärer Hypothyreose sowie geeignete Tests für den klinischen Alltag zu ermitteln, die eine Objektivierung der Hypothyreosediagnostik bei diesem Krankheitsbild möglich machen. Im Rahmen dieser Dissertation sollen für das Krankheitsbild der zentralen Hypothyreose folgende Fragen analysiert werden: Zum einen, ob die Therapie mit einer gewichtsadaptierten Dosis von 1,6 µg/kg KG Thyroxin oder mit der Kombination aus Trijodthyronin und Thyroxin im Verhältnis 1:10 gegenüber der empirisch festgelegten Thyroxinsubstitution bezüglich der durchgeführten Tests (Zulewsli Score, Achillessehnenreflexzeit-Messung, 7 Tests zur Bestimmung von Kognition und Befindlichkeit) überlegen ist. Zum anderen, ob die eingesetzten Tests dazu geeignet sind, eine subklinische sekundäre Hypothyreose aufzudecken. 12 2 Studiendesign, Material und Methoden 2.1 Studiendesign Bei der 4T Studie („Thyroxin versus Trijodthyronin plus Thyroxin bei Patienten mit sekundärer Hypothyreose“) wurde anhand definierter Endpunkte untersucht, ob Patienten mit sekundärer Hypothyreose von einer erhöhten Thyroxindosis (T4) oder von einer Kombinationstherapie aus Trijodthyronin (T3) und Thyroxin (T4) profitieren. Die Bestimmung verschiedener Laborparameter, die Messung der Achillessehnenreflexzeit, der Zulewski Score, sowie insgesamt sieben Tests zur Bestimmung der Kognition und Befindlichkeit wurden als Endpunkte zum Vergleich der drei Studienphasen festgelegt. Von den gemessenen Laborwerten werden in dieser Dissertation ausschließlich die Schilddrüsenwerte besprochen. Die Wirkungen auf den Lipidstoffwechsel wurden von Herrn Dr. med. Björn Klatwitter innerhalb dieses Projektes untersucht. Die Studie wurde als randomisierte, Placebo-kontrollierte, doppelblinde crossoverStudie durchgeführt. Probanden mit einer sekundären Hypothyreose im Rahmen einer Hypophyseninsuffizienz, die bereits eine entsprechende Substitutionstherapie erhielten, nahmen in der Studienzeit (15 Wochen) für jeweils fünf Wochen T4 in der bisherigen, empirisch festgelegten Dosierung (Placebo), T4 in einer erhöhten gewichtsadaptierten Dosierung und eine ebenfalls gewichtsadaptierte Kombination aus T3 und T4 ein. 2.2 Probanden In die Studie eingeschlossen wurden Patienten mit sekundärer Hypothyreose beiderlei Geschlechts im Alter von 18 bis 75 Jahren. Die Ätiologie der Hypophyseninsuffizienz wurde nicht berücksichtigt, allerdings wurde die Beteiligung der thyreotropen und mindestens zwei weiterer Achsen gefordert, um vergleichbare Ergebnisse erzielen zu 13 können. Der letzte therapeutische Eingriff in der Hyophysenregion musste mindestens 6 Monate zurückliegen und die eingenommene T4-Dosis mindestens in den letzten 3 Monaten stabil gewesen sein. Einschlusskriterien: • Hypophyseninsuffizienz unter Einschluss der thyreotropen Achse • Mindestens 6 Monate nach Hypophysenoperation oder Bestrahlung • Alter: 18 bis 75 Jahre • Geschlecht: männlich und weiblich • BMI (body mass index): 20–39,9 kg/m2 • Patienten mit Ausfall von mindestens zwei anderen Hypophysenachsen (somatotrope, gonadotrope oder corticotrope Achse) • Einnahme von L-Thyroxin (T4) (Dosis stabil seit drei Monaten) Von der Studie ausgeschlossen wurden Patienten mit schweren Begleiterkrankungen, Patienten mit primären Schilddrüsenerkrankungen, Schwangere, Raucher und Patienten, die bereits eine T4-Dosis >1,6 µg/kg KG einnahmen. Ausschlusskriterien: • Thyroxindosis >1,6 µg/kg KG • Rauchen • Schwere kardiale oder respiratorische Erkrankung • Knotenstruma (Schilddrüsensonografie) • Epileptische Erkrankung • Zerebrovaskuläre Insuffizienz • Schwangerschaft • Teilnahme an einer anderen Studie innerhalb der letzten zwei Monate Die Ethikkommission der Medizinischen Fakultät der Albert-Ludwigs-Universität Freiburg erteilte am 09.01.2004 mit Votum die Genehmigung zur Durchführung der Studie (Forschungsvorhaben 326/03). Die Patienten wurden über Aufbau, Ablauf und Ziel der Studie sowie über mögliche Nebenwirkungen von einem Arzt aufgeklärt und hatten mindestens 24 Stunden Bedenkzeit, um ihr schriftliches Einverständnis abzugeben. 14 2.3 Studienplan Im Rahmen dieser Studie absolvierten die Patienten 4 Visiten, eine Visite vor Studienbeginn und jeweils eine Visite nach Abschluss der drei 5-wöchigen Studienphasen. Die Visiten fanden in der endokrinologischen Ambulanz des Universitätsklinikums Freiburg statt. Während der 5-wöchigen Phasen nahmen die Patienten drei verschiedene Studienpräparate ein: Thyroxin in der bisherigen Dosierung – Phase „EMP-T4“, Thyroxin in der „optimierten“ Dosierung – Phase „KG-A-T4“ und ein Kombinationspräparat aus Trijodthyronin und Thyroxin – Phase „KG-A-T3T4“ anstelle ihrer üblichen Thyroxinmedikation ein. Die Studienmedikation wurde durch die Klinikumsapotheke individuell gewichtsadaptiert für jeden Patienten hergestellt (siehe 2.4). Mit Hilfe eines Computerprogramms erfolgte durch die pharmakologische Abteilung der Uniklinik Freiburg die Randomisierung der Studienphasen. Somit war sowohl den Patienten als auch den Untersuchern (Ärzte, Doktoranden) die aktuelle Dosierung beziehungsweise die Zusammensetzung nicht bekannt. Falls erforderlich, konnte jedoch jederzeit anhand eines versiegelten Codes die aktuelle Dosierung und Medikation festgestellt werden. Die Patienten stellten sich zu den Visiten nüchtern vor, mit Ausnahme der Schilddrüsenmedikation, die sie 2 Stunden vor dem geplanten Visitentermin eingenommen hatten. 2.3.1 Phasen Die Aufnahme der Patienten in die Studie fand bei der 1.Visite (V1) statt. Hier erhielten die Patienten die erste Studienmedikation für 5 Wochen. Bei Visite 2 und 3 (V2 und V3) erhielten die Patienten jeweils die ihnen zugeteilten Studienmedikation. Die 4.Visite (V4) stellte den Abschluss dar. Die Patienten durchliefen 3 Studienphasen: Phase EMP-T4 (empirisches Thyroxin): in der die Patienten Thyroxin in der bisherigen Dosierung erhielten (durchschnittlich 1,2 µg/kg KG). Phase KG-A-T4 (Körpergewicht-adaptiertes Thyroxin): in der die Patienten Thyroxin in einer erhöhten und an das Körpergewicht angepasste Dosierung von 1,6 µg/kg KG einnahmen. 15 Phase KG-A-T3T4 (Körpergewicht-adaptiertes Trijodthyronin und Thyroxin): in der die Patienten eine gewichtsadaptierte Dosis von insgesamt 1,6 µg/kg KG einer Kombination aus T3 und T4 im Verhältnis von 1:10 (0,16 µg T3/kg KG + 1,44 µg T4/kg KG) erhielten. Es wurden bei der Randomisierung alle 6 möglichen Kombinationen der Phasenabfolge angewendet. Damit wurde ein carry-over Effekt vermieden und die Patienten bildeten ihre eigene Kontrollgruppe im Sinne einer crossover-Studie. Die doppelte Verblindung wurde stets gewährleistet. In Abbildung 3 ist der Studienablauf schematisch dargestellt. EMP-T4 V1 KG-A-T4 EMP-T4 V2 KG-A-T3T4 KG-A-T4 EMP-T4 V3 KG-A-T3T4 KG-A-T4 V4 KG-A-T3T4 Studienzeit (Wochen) 0 5 10 15 Abbildung 3: Schema des Studienablaufs 2.3.2 Visite 1 (V1) Zum Studieneinschluss der Patienten wurde zunächst eine körperliche Untersuchung durchgeführt und Gewicht, Herzfrequenz (HF), Blutdruck (RR) gemessen. Zudem wurde eine Blutentnahme durchgeführt und ein Ruhe-Elektrokardiogramm (EKG) angefertigt. Ebenfalls erfolgte zu der ersten Visite eine Schilddrüsensonografie, um 16 eine Schilddrüsenerkrankung, insbesondere eine Schilddrüsenautonomie ausschließen zu können (siehe 2.2 Knotenstruma als Ausschlusskriterium). Die Informationsbögen, welche die Patienten nach telefonischer Absprache einige Tage vor dem geplanten Vorstellungstermin erhalten hatten wurden besprochen. Nachdem die schriftliche Einverständniserklärung und die Laborergebnisse vorlagen, wurde den Patienten die Medikation für die erste Studienphase ausgehändigt. Die erste Medikamenteneinnahme fand frühestens 24 Stunden nach schriftlicher Einwilligung in die Studie. 2.3.3 Visite 2-4 (V 2-4) Nach Ablauf der 5-wöchigen Einnahme des Studienpräparates fand jeweils bei den folgenden Visiten (V2 bis V4) die Datenerhebung statt. Jedes Mal wurden nach einer allgemeinen Befragung die Sicherheitsparameter (Vitalwerte, EKG, Labor) kontrolliert. Danach erfolgten Achillessehnenreflexzeitmessungen (siehe Abschnitt 2.5.3), die Befragung des Zulewski-Score-Bogens und eine Blutentnahme zur Bestimmung der biochemischen Zielgrößen. Zudem wurden Kognitionstests durchgeführt und Befindlichkeitsfragebögen ausgefüllt beziehungsweise zum Ausfüllen mitgegeben. 2.4 Studienmedikation Die Studienmedikation wurde von der Apotheke des Universitätsklinikums bereitgestellt. Als Bestandteile wurden jeweils die kommerziell erhältlichen Präparate L-Thyroxin Henning® für T4 und Thybon® für T3, sowie Gelatine und Fructose verwendet. Diese wurden für die einzelnen Patienten anhand der festgelegten Studienkriterien in für jede Phase identisch aussehenden Kapseln zusammengestellt. Es wurden für die drei Studienphasen (EMP-T4 mit Thyroxin in der bisherigen Dosierung, KG-A-T4 mit Thyroxin in einer gewichtsadaptierten Dosierung von 1,6 µg/kg KG und KG-A-T3T4 mit einer gewichtsadaptierten Kombination aus 0,16 µg/kg KG Trijodthyronin und 1,44 µg/kg KG Thyroxin) für die einzelnen Patienten Präparate hergestellt. Den Patienten wurde zu Visite 1, 2 und 3 jeweils die benötigte 17 Medikation für die kommende 5-Wochen-Phase in einer der 3 möglichen Zusammenstellungen (EMP-T4, KG-A-T4 oder KG-A-T3T4) ausgehändigt. Um die Pharmakokinetik des T3/T4-Kombinationspräparates zu erforschen, wurde mit 8 Patienten ein gesonderter Versuch durchgeführt. Die Probanden nahmen die KG-A-T3T4-Medikation für 6 Tage ein und stellten sich am siebten Tag nüchtern vor. Nach der ersten Blutentnahme, nahmen die Patienten die Studienmedikation ein. Darauf folgten stündlichen Blutentnahmen über 8 Stunden, um die Konzentrationen der zwei Schilddrüsenhormone im Tagesverlauf zu messen (Abbildung 4). fT3 und fT4 Kinetik 25 20 pmol/l 15 10 5 0 t=0 t=1 t=2 t=3 t=4 t=5 t=6 t=7 t=8 Messzeitpunkt fT3 (pmol/l) obere Normgrenze fT3 (6,7 pmol/l) fT4 (pmol/l) obere Normgrenze fT4 (22 pmol/l) Abbildung 4: fT3 und fT4 Kinetik, Verlauf 8 Stunden nach Einnahme; fT3 hellblau, obere Normgrenze fT3 - dunkelblau, fT4 - hellgrün, obere Normgrenze fT4 – dunkelgrün. Es zeigte sich, dass die durchschnittlichen Serumwerte der Patienten für T4 im oberen Drittel des Referenzbereiches (13-22 pmol/l) und für T3 stets über der Normgrenze (Referenzbereich 3,9-6,7 pmol/l) lagen. Ausgehend von dem ersten Serumspiegel t=0 (Zeitpunkt vor Einnahme) erreichten beide Parameter ein Maximum bei t=2 (2h nach Einnahme), wobei bei dem fT3-Spiegel ein Anstieg von 61% zu vermerken ist. Beide Spiegel lagen nach 8 Stunden nur noch geringfügig über dem Anfangswert. 18 2.5 Untersuchte Parameter und Endpunkte 2.5.1 Klinische Sicherheitsparameter, Überwachung von Nebenwirkungen Es wurden zu jeder Visite Gewicht, Herzfrequenz, Blutdruck sowie die biochemischen Sicherheitsparameter (kleines Blutbild, Kreatinin, Natrium, Kalium, Phosphat, Transaminasen, alkalische Phosphatase) gemessen und ein Ruhe-EKG angefertigt. Die Patienten wurden ausführlich über mögliche Nebenwirkungen, im Besonderen zu den häufigsten Hyperthyreosesymptomen (Unruhe, Reizbarkeit, Nervosität, Palpitationen, Schwitzen, Hitzewallungen, Durchfall, vermehrter Appetit und Durst) befragt. 2.5.2 Laboruntersuchungen Im Hormon und -Zentrallabor des Universitätsklinikums Freiburg wurden neben den biochemischen Sicherheitsparametern die Schilddrüsenparameter, Thyroidea stimulierendes Hormon (TSH), freies Trijodthyronin (fT3), freies Thyroxin (fT4), gesamtes T3 (gT3), gesamtes T4 (gT4) und Thyreoglobulin (TG) mittels tubidimetrischer Immunoassays (Roche E 170) gemessen. Ebenso wurden sekundäre Zielparameter wie Kreatinkinase, Myoglobin und Lipide (Triglyceride, Gesamtcholesterin, Low-density-Lipoprotein, Very-low-density- Lipoprotein, High-density-Lipoprotein und die Fraktionen von ß-Lipoprotein, prä-ßLipoprotein und α-Lipoprotein) bestimmt, welche Thema der Dissertation von Herrn Dr. Björn Klawitter waren und aus diesem Grund hier nur kurz erwähnt werden. 2.5.3 Messung der Achillessehnenreflexzeit (ART) Bevor laborchemisch die genaue Bestimmung der Schilddrüsenparameter möglich war, spielte die Beobachtung der Muskeleigenreflexe eine wichtige Rolle in der Schilddrüsendiagnostik. Mehrfach wurde erwiesen, dass die Achillessehnenreflexzeit (ART) eng mit dem Schilddrüsenhormonstatus korreliert [42, 46, 56, 59, 60, 61]. Bei den 4T-Patienten erfolgte die Messung der ART mit einem in der Neurophysiologie der Universität Freiburg modifizierten Nachbau einer Messapparatur, die im Kantonspital Basel ebenfalls zu Studienzwecken eingesetzt wurde. 19 Abbildung 5: Apparatur zur Messung der Achillessehnenreflexzeit Wie in Abbildung 5 dargestellt, wurde der Unterschenkel des Probanden auf eine Halterung, die an die jeweilige Körpergröße angepasst werden konnte, aufgelegt. So konnte ein entspanntes Stehen und die freie Beweglichkeit im Sprunggelenk gewährleistet werden. Anschließend wurde der Vorfuß des Probanden an den Winkelmesser befestigt. In dem Kopf des dazugehörigen Reflexhammers befand sich ein Kontaktschalter, welcher mit dem Beklopfen der Achillessehne die Messung einleitete. Die Auslenkung des Winkelmessers durch das Beklopfen beziehungsweise durch die Reflexantwort des Probanden wurde durch das Gerät aufgezeichnet. Abbildung 6: Beispiel einer Reflexkurve; Abszisse: Zeit in Sekunden, Ordinate: Winkelstellung des Sprunggelenks in Grad. 20 Für die ART-Messung relevant ist das Zeitintervall zwischen der maximalen reflektorischen Plantarflexion und dem Punkt auf halber Entspannungsstrecke (halbmaximale Relaxationszeit, Abbildung 6). Vor Beginn der Studie wurden normierte Werte ermittelt. Da wir eine Alters- und Geschlechtsabhängigkeit postulierten, untersuchten wir die ART von 104 gesunden Probanden (keine bekannten Schilddrüsenerkrankung oder Neuropathie) beiderlei Geschlechts im Alter von 18-75 Jahren (6 Messungen pro Fuß, insgesamt 12 Messungen pro Proband). Insgesamt wurden 5 gleich große Altersgruppen von jeweils 20-22 Probanden pro Geschlecht gebildet. Die Gruppen wurden folgendermaßen definiert: Gruppe 1: Probanden zwischen 18 und 30 Jahren; Gruppe 2: Probanden zwischen 31 und 40 Jahren; Gruppe 3: Probanden zwischen 41 und 50 Jahren; Gruppe 4: Probanden zwischen 51 und 60 Jahren und Gruppe 5: Probanden zwischen 61 und 75 Jahren. Die Ergebnisse der Messungen wurden statistisch ausgewertet und zeigten bei den gesunden Probanden ein Gesamtmittel für die ART von 351 ± 48 ms. Der Altersdurchschnitt lag bei 44,4 ± 14,4 Jahren. Zwischen den beiden Geschlechtern gab es keinerlei signifikante Unterschiede. Bei den Altersgruppen fanden sich zwischen der 1. und der 3., zwischen der 1. und der 4., zwischen der 1. und der 5. sowie zwischen der 2. und der 4. Gruppe signifikante Unterschiede. Die Regressionsanalyse ergab jedoch keine signifikanten Unterschiede (Koeffizient R von 0,36), sodass eine eindeutige Altersabhängigkeit nicht nachgewiesen werden konnte. Diese Daten stimmen mit früheren Ergebnissen überein (halbmaximale ART bei gesunden Testpersonen von 300-400 ms) [59, 60, 61]. Hiervon ausgehend stellt eine verlangsamte beziehungsweise beschleunigte ART ein Hinweis für Hypothyreose beziehungsweise für Hyperthyreose dar. 2.5.4 Zulewski Score Nach jeder Phase wurden die Hypothyreosezeichen anhand des klinischen Score nach Zulewski untersucht [89]. Es handelt sich hierbei um einen Fragebogen, der das Maß an Beschwerden von Patienten mit Hypothyreose quantifiziert und somit ein objektives klinisches Urteil über den Schilddrüsenstatus erlaubt. Der Bogen beinhaltet insgesamt 12 Symptome, wovon 7 erfragt und 5 untersucht werden sollen (Tabelle 1). Bei Vorhandensein des Symptoms wird ein Punkt vergeben, wodurch sich die 21 maximal erreichbare Punktzahl von 12 Punkten ergibt. Ein Punktwert von 0 bis 2 hat einen negativen prädiktiven Wert für Hypothyreose von 94,2%, ein Punktwert von 3 bis 5 stellt einen intermediären Bereich dar und ein Punktwert größer 5 hat einen positiven prädiktiven Wert für Hypothyreose von 96,9%. Tabelle 1: Zulewski Score (Bogen) Beurteilungskriterien ja nein Vermind. Schwitzen In einem warmen Raum, an einem heißen Tag 1 0 Heiserkeit Sprechstimme, Singstimme 1 0 Parasthesien Subjektive Empfindung 1 0 1 0 1 0 Symptome Trockene Haut Verstopfungsneigung Spontan bemerkte, behandlungsbedürftige Trockenheit Stuhlgepflogenheiten, Verwendung eines Laxans Hörminderung Progredienter Hörverlust 1 0 Gewichtszunahme Dokumentierte Zunahme, enge Kleidung 1 0 Patient beim Entkleiden beobachten 1 0 Verlängerung >1 SD zum Normwert 1 0 1 0 1 0 1 0 12 0 Körperliche Zeichen Langsame Bewegungen Verzögerte ART Rauhe Haut Untersuchung der Hände, Unterarme und Ellenbögen Periorbitale Kontur der Wangenknochen sollte verstrichen Aufgedunsenheit sein Kalte Haut Vergleich der Temperatur der Hände mit Untersucher Summe Zur klinischen Beurteilung wird bei Frauen unter 55 Jahren zur Summe 1 Punkt addiert. Hypothyreot >5 Punkte, euthyreot <3 Punkte, intermediär 3-5 Punkte. 22 2.5.5 Kognition und Befindlichkeit Es wurde eine Reihe von psychologischen Tests durchgeführt, um einen möglichen Einfluss der Schilddrüsenhormone auf Kognition und Befindlichkeit der Patienten in den 3 Studienphasen (EMP-T4, KG-A-T4 oder KG-A-T3T4) zu untersuchen. Diese erfolgten jeweils im Anschluss an die 5-wöchige Einnahme der Studienmedikation und wurden von den Patienten oder den Angehörigen beziehungsweise unter der Anleitung der Doktoranden durchgeführt. Es wurden zur Bestimmung der Kognition die Testbatterie zur Aufmerksamkeitsprüfung und der Untertest „Zahlenspanne“ aus dem „Wechsler Memory Scale“ - Test verwendet. Die Befindlichkeit wurde anhand von 5 weiteren Tests untersucht: visuelle Analogskala, SCL-90-R, SF-36, Gießener Beschwerdebogen und Fremdbeurteilungsbogen. Die Rohwerte der Tests wurden nach Anleitung der jeweiligen Testmanuale umgerechnet und die Ergebnisse der drei Studienphasen einander gegenübergestellt. Die Datenverarbeitung wurde durch Herrn Dipl.-Stat. Manfred Olschewski vom biomathematischen Institut der Universität Freiburg kontrolliert. 2.5.5.1 Testbatterie zur Aufmerksamkeitsprüfung (TAP) Die Testbatterie zur Aufmerksamkeitsprüfung (TAP) ist ein in der Neuropsychologie und Neurotoxikologie etabliertes, computergestütztes Verfahren, welches die Reaktionsgeschwindigkeit und die Konzentrationsfähigkeit der Probanden misst. Die aufgenommenen Werte werden in dem Programm anhand von eingegebenen Daten der Patienten (Alter, Geschlecht und Schulbildung) transformiert und die Mittel- und T-Werte berechnet. Es wurden im Rahmen dieser Studie zwei Untertests durchgeführt: „Alertness“ und „Arbeitsgedächtnis“. Bei dem „Alertness“-Test erscheint auf dem Bildschirm ein zentrales Kreuz, woraufhin der Patient eine Taste drücken muss, die mit dem Rechner gekoppelt ist. Die Geschwindigkeit seiner Reaktion kann so gemessen und in die Datenbank aufgenommen werden. Im Verlauf einer Sitzung erscheinen dem Patienten 4 Serien von jeweils 20 Kreuzen, in der 1. und 4. Serie ohne, in der 2. und 3. Serie mit vorausgehendem Warnsignal. Das „Arbeitgedächtnis“ wird anhand der Reaktionsgeschwindigkeit bei Erkennung von Zahlenwiederholungen gemessen. Es erscheint hierbei dem Probanden jeweils eine Zahl (von 1 bis 9) zentral auf dem Bildschirm; die Taste muss dann gedrückt 23 werden, wenn sich die vorletzte Zahl wiederholt. Im Testverlauf werden insgesamt 80 Zahlen gezeigt und es sind 10 Wiederholungen vorhanden [88]. 2.5.5.2 Wechsler Memory Scale, Untertest „Zahlenspanne“ Dieser Untertest besteht aus zwei Aufgabentypen: die Vorwärts- und die Rückwärtswiederholung von Zahlen. Dem Probanden werden Zahlenreihen vorgelesen, welche anschließend vorwärts beziehungsweise rückwärts wiederholt werden müssen. Bei richtiger Durchführung wurde pro Reihe jeweils 1 Punkt vergeben. Die Zahlen (von 1 bis 9) werden beim Vorwärtswiederholen in Reihen von 2 Mal 3 Zahlen bis zu 2 Mal 8 Zahlen und beim Rückwärtswiederholen in Reihen von 2 Mal 2 bis 2 Mal 7 Zahlen vorgelesen. Hierbei war es für die Durchführungsobjektivität wichtig, jede Zahl mit einer Geschwindigkeit von einer Sekunde vorzulesen. Beim Rückwärtswiederholen wurde den Patienten zunächst eine Beispielaufgabe gestellt. Insgesamt konnten für 2 Mal 12 Reihen maximal 24 Punkte erreicht werden. Die Rohwerte wurden anhand einer Tabelle in altersbezogene Äquivalenzperzentile umgewandelt [32]. 2.5.5.3 Visuelle Analogskala für Stimmung und körperliche Beschwerden Die visuelle Analogskala gehört zu den gebräuchlichsten Messverfahren zur Wirksamkeits- und Verträglichkeitsbeurteilung von Interventionen in der psychiatrischen und psychopharmakologischen Forschung. Die in 4T benutzte Version beinhaltet 8 Items für Stimmung und 7 Items für körperliche Beschwerden. Jedes Merkmal ist mit dem Gegenteil durch eine 100 mm lange Linie verbunden (links-positiv, rechts-negativ), sodass der Proband seinen Zustand durch eine Markierung auf dieser Skala ausdrücken kann. Ausgewertet wird der Abstand der Markierung durch den Patienten ausgehend von dem positiven Merkmal. 2.5.5.4 Symptom-Checkliste von Derogatis (SCL-90-R) – Deutsche Version Die Symptomcheckliste von Derogatis ist ein Selbsteinschätzungsverfahren zur Erfassung der psychischen Belastung. Es wird die subjektive Beeinträchtigung durch körperliche und psychische Symptome in einem Zeitraum von 7 Tagen gemessen. Der 24 Testbogen, bestehend aus 90 Fragen, die mit „überhaupt nicht“ bis „sehr stark“ (von 0 bis 4 Punkten) gewertet werden können, wurde jeweils am Ende der 5-wöchigen Phasen von den Patienten ausgefüllt [30]. Die 90 Items werden in den folgenden 9 Skalen zusammengefasst: Somatisierung, Zwanghaftigkeit, Unsicherheit im Sozialkontakt, Depressivität, Ängstlichkeit, Aggressivität/Feindseligkeit, Phobische Angst, Paranoides Denken und Psychotizismus. Die globalen Kennwerte geben Auskunft über das Antwortverhalten bei allen Items und ermöglichen so eine schnelle Identifizierung des Ausmaßes der psychischen Belastung. Der GSI („global severity index“) misst die psychische Belastung unabhängig von der Pathologie. Die Auswertung kann auf den 3 Ebenen erfolgen: auf der Ebene der einzelnen Items, auf der Skalenebene oder auf der Ebene der globalen Kennwerte. 2.5.5.5 SF-36 Fragebogen zum Gesundheitszustand (SF-36) Der SF-36 ist ein krankheitsübergreifendes Messinstrument zur Erfassung der gesundheitsbezogenen Lebensqualität von Patienten. Der Test umfasst 36 Items und zielt auf 8 Dimensionen: Körperliche Funktionsfähigkeit, Körperliche Rollenfunktion, Körperliche Schmerzen, Allgemeine Gesundheitswahrnehmung, Vitalität, Soziale Funktionsfähigkeit, Emotionale Rollenfunktion und Psychisches Wohlbefinden. Die Probanden haben unterschiedliche Antwortmöglichkeiten, anhand derer Rohwerte resultieren, welche nach Testanleitung in Prozentwerte transformiert werden [14]. 2.5.5.6 Gießener Beschwerdebogen (GBB-24) Es handelt sich bei dem GBB-24 um die abgekürzte Version des Gießener Beschwerdebogens, welcher das körperliche Beschwerdebild quantifiziert. Die Patienten können in einer 5-fach Skalierung von „gar nicht“ bis „stark“ (von 0 bis 4 Punkten) ankreuzen, inwiefern sie sich durch eines der 24 aufgelisteten Beschwerden belästigt fühlen. Die Items werden bei der Auswertung auf 4 Skalen verteilt: Erschöpfungsneigung, Magenbeschwerden, Gliederschmerzen und Herzbeschwerden. Diese werden im gesamten Beschwerdedruck zusammengefasst. Die erreichten Punktwerte werden zuletzt anhand einer altersgestuften Tabelle in Quartil 1 bis 4 (Q 1-4) transformiert, wobei Q1 für wenig Beschwerdedruck und Q4 für viel Beschwerdedruck steht [12]. 25 2.5.5.7 Demenz-Test nach Kessler, Untertest „Fremdbeurteilung“ Ein enger Familienangehöriger der Patienten wurde gebeten, einen Fragebogen auszufüllen, der das alltägliche Verhalten der Patienten jeweils zum Ende der 3 Phasen einschätzen sollte. Hierbei handelte es sich um den Fremdratinganteil des Demenz-Tests von Kessler et al., welcher verschiedene kognitive und nicht kognitive Domänen beurteilt [40]. Der Bogen besteht aus 40 Fragen, die mit „trifft zu“ bis „trifft nicht zu“ (1 bis 5 Punkte) zu beantworten sind. Die erreichte Gesamtpunktzahl wird in einem prozentuellen Anteil zur maximal erreichbaren Punktzahl gestellt und gewertet. 26 3 Ergebnisse 3.1 Patienten Anhand vorhandener Informationen aus den Krankenakten der endokrinologischen Ambulanz konnten zur 1.Visite 36 Patienten eingeladen werden. Nach den Untersuchungen wurden analog der festgelegten Ein- beziehungsweise Ausschlusskriterien 32 Patienten in die Studie aufgenommen (Abbildung 7). Im Verlauf brachen 3 Patienten die Studie ab. In einem Fall klagte der Patient über Symptome wie Nervosität und Unruhe, jedoch ohne nachweisbare Erhöhung der Schilddrüsenwerte. Die beiden anderen Patienten gaben persönliche Gründe an. Der Studienverlauf von Visite 1 bis zur Datenanalyse ist in Abbildung 7 dargestellt. Ein Patient nahm versehentlich in einer Phase die Studienmedikation zusätzlich zu der ursprünglichen Medikation; er blieb beschwerdefrei, jedoch wurde die entsprechende Phase nicht in die Datenanalyse miteinbezogen. Ein anderer Patient bekam bereits vor Studienbeginn eine Dosis von 1,6 µg/kg KG, sodass hier die KG-A-T4-Phase nicht in die Auswertung genommen werden konnte. V1: 36 Patienten 4 Patienten ausgeschlossen - 1 Patient lehnten die Teilnahme ab - 3 Patienten entsprachen nicht den Einschlusskriterien V2: 32 Patienten in die Studie eingeschlossen 3 Patienten brachen die Studie ab - 1 Patient mit subjektiver Hyperthyreose - 2 Patienten aus persönlichen Gründen 29 Patienten in der endgültigen Auswertung Abbildung 7: Schema zur Rekrutierung der Patienten 27 Insgesamt nahmen 29 Patienten an der Studie teil, davon 8 weibliche und 21 männliche Personen. Der Altersdurchschnitt betrug 51,5 ± 13,6 Jahre. Der durchschnittliche body mass index (BMI) beziehungsweise das Körpergewicht lagen bei 29,6 ± 3,7 kg/m2 beziehungsweise bei 84,6 ± 15,9 kg. Die durchschnittlich eingenommene Thyroxindosis (T4-Dosis) vor Studienbeginn sowie in der EMP-T4Phase betrug 85,5 ± 23,3 µg/kg Körpergewicht. Aus diesen Werten ergibt sich eine durchschnittliche gewichtsbezogene T4-Dosis von 1,02 ± 0,24 µg/kg KG (Tabelle 2). Es konnten in die Studie lediglich Patienten mit einem substitutionspflichtigen Ausfall von 3 Achsen der Hypophyse aufgenommen werden. Im Durchschnitt waren bei den Patienten 3,55 ± 0,5 Achsen ausgefallen. 12 Patienten wiesen eine Insuffizienz von 3 Hypophysenachsen auf und 16 Patienten hatten eine komplette Hypophyseninsuffizienz. Insgesamt erhielten 7 Patienten Wachstumshormon (GH), 19 Männer und 6 Frauen Testosteron- beziehungsweise Östrogenpräparate, 22 Patienten Hydrocortison und 8 Patienten Desmopressin (ADH-Substitution). Tabelle 2: Patientencharakteristika Gesamt männlich weiblich Alter 51,5 ± 13,6 52,3 ± 12,6 49,3 ± 16,7 Gewicht (kg) 85,9 ± 15,4 85,6 ± 7 78,8 ± 8,4 BMI (kg/m2) 29,6 ± 3,7 29,4 ± 2,8 30,8 ± 7 T4 (µg) 85,5 ± 23,3 89 ± 26,1 81,3 ± 17,7 T4/KG (µg/kg) 1,02 ± 0,24 1,01 ± 0,26 1,06 ± 0,19 3,6 ± 0,5 3,6 ± 0,5 3,5 ± 0,5 HVL-Achsen-Insuffizienz Als Ursache der Hypophyseninsuffizienz hatten 26 Patienten einen operierten und/ oder bestrahlten Tumor der Hypophyse (21 Patienten Z.n. OP, 3 Patienten Z.n. OP und Radiatio, 2 Patienten Z.n. Radiatio). Bei 3 Patienten fanden sich andere Ursachen (Z.n. Einblutung im Hypophysenbereich oder idiopathisch). 28 3.2 Sicherheitsparameter, Nebenwirkungen und Adverse Events 3.2.1 Sicherheitsparameter Bei jeder Visite (V1-V4) wurden zu Beginn verschiedene Parameter erhoben, um mögliche Auswirkungen auf das Herzkreislaufsystem zu untersuchen. Dazu gehörten Vitalwerte wie Herzfrequenz (HF) und Blutdruck (RR), sowie ein Elektrokardiogramm (EKG). Diese Werte dienten der Detektion von unerwünschten und für die Patienten teilweise schädlichen Nebenwirkungen, wie zum Beispiel Vorhofflimmern. Es konnten jedoch im Studienverlauf keine EKG-Veränderung festgestellt werden. Darüber hinaus gab es keinen Unterschied von Blutdruck oder Herzfrequenz zwischen den Studienphasen. 3.2.2 Adverse Events Es wurden in neun Fällen so genannte Adverse Events (AE) notiert, 5 in Phase EMPT4, 3 in Phase KG-A-T4 und 1 in Phase KG-A-T3T4. Vier Patienten gaben typische Hyperthyreosesymptome (Unruhe, Nervosität, Schlafstörungen, etc.) an: 3 Fälle in Phase EMP-T4, wo die Symptome von den Patienten gut toleriert wurden und 1 Fall in Phase KG-A-T4, nach der die betroffene Patientin die Studie abbrach. Laborchemisch konnten in allen Fällen keine erhöhten Werte nachgewiesen werden. Bei 2 Patienten wurde eine deutliche Erhöhung der Kreatinkinase von bis zu 380 U/l (Normbereich <70 U/l für Frauen und <80 für Männer) gemessen. In einem Fall wurde eine GPT von 168 U/l (Normbereich <35 U/l) festgestellt, wobei eine vorübergehende Erhöhung der Transaminasen bei Medikamentenwechsel oft beschrieben wurde und als harmlos einzustufen ist. Die weitere Abklärung blieb in diesen Fällen ergebnislos und die Werte normalisierten sich bis zur folgenden Visite. Es traten in 2 Fällen erythematöse Hautausschläge auf, vor allem im Kopfbereich, welche als Nebenwirkung bei Einnahme von Schilddrüsenhormonpräparaten erscheinen können. Allerdings klagte der eine Patient bereits bei der folgenden Visite nicht mehr darüber. Der andere Fall wurde dermatologisch abgeklärt und der Verdacht eines Demodex-Milben-Befalls geäussert. Somit ist ein wirklicher Zusammenhang des Erythems mit der Schilddrüsenmedikation fraglich. 29 Insgesamt brachen 3 Patienten die Studie vorzeitig ab, 1 Patient aufgrund subjektiver Hyperthyreosesymptomatik in Phase KG-A-T4 (siehe oben) und 2 Patienten aus persönlichen Gründen. 3.2.3 Nebenwirkungen Für Hyperthyreose typische Symptome wurden bei jeder Visite gezielt erfragt. Die in Tabelle 3 aufgelisteten Beschwerden wurden von den Patienten geäussert, wobei teilweise von einem Patienten mehrere Beschwerden angegeben wurden. Insgesamt gaben in den Phasen EMP-T4, KG-A-T4 und KG-A-T3T4 jeweils 9, 7 beziehungsweise 12 Patienten neu aufgetretene Symptome an. Die gezählte Beschwerdeanzahl von 13 nach der KG-A-T3T4 relativiert sich in Anbetracht der höheren Beschwerdeanzahl von 14, die von den Patienten nach der EMP-T4-Phase (Placebo-Phase) angegeben wurde. Es lag keine statistische Häufung möglicher Nebenwirkungen in der Gruppe der über 52-Jährigen vor. Tabelle 3: Summe der berichteten Nebenwirkungen; einige Patienten gaben mehrere Beschwerden an EMP-T4 KG-A-T4 KG-A-T3T4 Schwitzen 1 4 5 Palpitationen 3 0 3 Unruhe 2 1 4 Erschöpfungsneigung 4 3 1 Kopfschmerzen 1 1 0 Schlaflosigkeit 3 0 0 Beschwerdeanzahl 14 9 13 9 (6) 7 (3) 12 (7) Anzahl Patienten (Alter >52 Jahre) 30 Es wurde über Erschöpfungsneigung geklagt (4 Patienten in EMP-T4 vs. 3 in KG-AT4 vs. 1 in KG-A T3T4), sowie über Unruhe (2 vs. 1 vs. 4), Kopfschmerzen (1 vs. 1 vs. 0) und Schlafstörungen (3 vs. 0 vs. 0). In 10 Fällen wurde über vermehrtes Schwitzen berichtet (5 in der KG-A-T3T4-, 4 in KG-A-T4- und nur 1 Patient in EMP-T4-Phase) und bei 6 Patienten traten gelegentlich Palpitationen auf (vermehrt unter Belastung), davon 3 in Phase EMP-T4 und 3 in Phase KG-A-T3T4. 31 3.3 Schilddrüsenwerte 3.3.1 Freies T4 (fT4) und gesamtes T4 (gT4) Im Vergleich zu Phase EMP-T4 stieg fT4 (15,9 ± 3,6 pmol/l) in den Phasen KG-A-T4 (22,2 ± 3,2 pmol/l) und KG-A-T3T4 (22,8 ± 3,0 pmol/l) hochsignifikant an (p<0,0001). Zwischen den Phasen KG-A-T4 und KG-A-T3T4 konnten keine Unterschiede festgestellt werden. Im Mittel befanden sich die Werte der Patienten in der Phase EMP-T4 im unteren, die Werte in den Phasen KG-A-T4 und KG-A-T3T4 leicht oberhalb des Referenzbereiches für fT4 im Serum (13-22 pmol/l). In den Phasen KG-A-T4 und KG-A-T3T4 lagen bei 10 beziehungsweise 14 Patienten die Werte über der oberen Normgrenze (maximale Werte: 27 pmol/l in KG-A-T4 und 27,9 pmol/l in KG-A-T3T4) (Abbildung 8). Da die Blutabnahme 2 Stunden nach Tabletteneinnahme stattgefunden hat, kann angenommen werden, dass es sich bei allen Werten um die Tageshöchstwerte handelt und dass, trotz der verhältnismäßig langen T4-Halbwertszeit (7d), die Tagesmittelwerte geringer ausfallen (vgl. Abschnitt 2.4). Die Serumwerte für das gesamte T4 verhielten sich ähnlich. 3.3.2 Freies T3 (fT3) und gesamtes T3 (gT3) Hier erwiesen sich die Unterschiede zwischen allen drei Phasen als hochsignifikant (p<0,0001), wobei der Mittelwert der Patienten von EMP-T4 (4,8 ± 0,9 pmol/l) über KG-A-T4 (5,7 ± 1,1 pmol/l) nach KG-A-T3T4 (10,6 ± 2,4 pmol/l) angestiegen ist. Die mittleren fT3-Serumwerte der Patienten lagen demnach für EMP-T4 und KG-AT4 im unteren beziehungsweise im mittleren Refenzbereich (3,9-6,7 pmol/l). Nach der Phase KG-A-T3T4 zeigten die Mittelwerte der Patienten eine laborchemisch deutlich hyperthyreote Stoffwechsellage. Ebenso wie bei dem fT4-Serumspiegel ergab die nähere Analyse der Einzelwerte nach den Phasen KG-A-T4 und KG-AT3T4 keinen einzigen Wert unterhalb des Normbereichs. Die Werte lagen bei 3 von 29 Patienten nach der Phase KG-A-T4 geringfügig und bei 28 von 29 Patienten nach der Phase KG-A-T3T4 teilweise deutlich oberhalb der oberen Normgrenze (Abbildung 8). Analog verhielten sich die Werte des gesamten T3. Die Pharmakokinetik des T3-Präparates wurde aus diesem Grund gesondert untersucht (vgl. Abschnitt 2.4). 32 Abbildung 8: Übersichtsdiagramme für freies Thyroxin und freies Trijodthyronin; EMP-T4 - grün, KG-A-T4 - blau, KG-A-T3T4 - lila; * signifikant vs. EMP-T4, ° signifikant vs. KG-A-T4. Referenzbereiche für fT4 (13-22 pmol/l) und für fT3 (3,9 6,7 pmol/l) wurden mit roten und blauen Linien markiert. 33 3.3.3 Thyroidea Stimulierendes Hormon (TSH), Thyreoglobulin (TG) Bei diesen beiden Parametern wurde nach Erhöhung der Substitutionsdosis beziehungsweise Addition von Trijodthyronin und konsekutiver Suppression ein Wertabfall erwartet. Es ergab sich tatsächlich ein signifikanter Abfall von TSH in den Phasen KG-A-T4 und KG-A-T3T4 im Vergleich zu Phasen EMP-T4 (p<0,01) (Abbildung 9). Ein ähnliches Ergebnis zeigte sich für TG, wobei hier lediglich eine Signifikanz zwischen den Phasen KG-A-T3T4 und EMP-T4 (p=0,028) festgestellt werden konnte. Es gab für beide Parameter keine signifikanten Unterschiede zwischen KG-A-T4 und KG-A-T3T4. Abbildung 9: Übersichtsdiagramm für Thyroidea Stimulierendes; EMP-T4 - grün, KG-A-T4 - blau, KG-A-T3T4 - lila; * signifikant vs. EMP-T4. Blaue Linie entspricht dem unteren Normwert für TSH von 0,3 µU/l. 34 3.4 Achillessehnenreflexzeit (ART) Die Patienten hatten in der Phase EMP-T4 eine durchschnittliche Achillessehnenreflexzeit (ART) von 389 ± 41 ms. Ensprechend dem physiologischen Zusammenhang zwischen dem Schilddrüsenstatus und der ART, wurden in den beiden anderen Studienphasen niedrigere Werte erwartet, was sich auch bestätigte. In der KG-A-T4-Phase lag die durchschnittliche Zeit bei 384 ± 39 ms und in der KG-AT3T4-Phase deutlich tiefer bei 366 ± 41 ms (p<0,001 vs. EMP-T4). Die Ergebnisse der drei Phasen befanden sich im vorher errechneten Normbereich von 351 ± 48 ms. Jedoch zeichnete sich eine Näherung an den Mittelwert in Phase KG-A-T3T4 ab, wohingegen die Achillessehnenreflexzeiten der Patienten in den Phasen KG-A-T4 und EMP-T4 Werte im oberen Normbereich erreichten (p<0,001 vs. Mittelwert). In Abbildung 11 sind die in den Phasen erreichten Zeiten sowie der errechnete Normbereich für die ART dargestellt. Abbildung 10: Achillessehnenreflexzeiten der drei Phasen; EMP-T4 grün, KG-A-T4 blau, KG-A-T3T4 lila), berechneter Normbereich von 351 ± 48 ms (rote und blaue Linie); * signifikant vs. Mittelwert, ° signifikant vs. EMP-T4. 35 3.5 Zulewski Score Der Score nach Zulewski [89] wurde zur Quantifizierung der klinischen Hypothyreosesymptomatik eingesetzt. Der Aufbau des Testbogens sowie die Auswertungskriterien sind im Abschnitt 2.5.4 erläutert. Nach Zulewski werden drei Gruppen differenziert: die hypothyreote Gruppe (>5 Punkte), die intermediäre Gruppe (3–5 Punkte) und die euthyreote Gruppe (<3 Punkte). Die Tabelle 4 zeigt die erzielten Mittelwerte mit Standardabweichungen für die drei Studienphasen und die Verteilung auf die drei Gruppen als prozentualen Anteil der Patienten. Tabelle 4: Zulewski Score Friedman EMP-T4 KG-A-T4 KG-A-T3T4 3,5 ± 0,35 2,8 ± 0,3 † 2,6 ± 0,2 * p < 0,05 >5 Punkte, hypothyreot 18,5 11,5 0 p < 0,05 3–5 Punkte, intermediär 51,9 46,2 53,6 p < 0,05 <3 Punkte, euthyreot 29,6 42,3 46,4 p < 0,05 MW ± STABW. Test Chi2=8,909, p < 0,012; post hoc Wilcoxon Rang Test: * p < 0,05/3 vs. EMP-T4, † p = 0,051/3 vs. EMPT4. Die Analyse des Prozentanteils der Patienten in den 3 verschiedenen Gruppen, hypothyreote Gruppe (>5 Punkte), intermediäre Gruppe (3–5 Punkte) und euthyreote Gruppe (<3 Punkte) zeigte überall signifikante Unterschiede (Friedmans nicht-parametrischer Test), erreichte jedoch im post hoc Test kein Signifikanzniveau. Die Mittelwerte in den Phasen KG-A-T4 und KG-A-T3T4 (2,8 ± 0,3 beziehungsweise 2,6 ± 0,2 Punkte; „euthyreot“) lagen signifikant tiefer als der in der EMP-T4-Phase erzielte Wert von 3,5 ± 0,35 Punkte („intermediär“). Die Einzelwertanalyse zeigte einen eindeutigen Rücklauf des Prozentanteils der hypothyreoten Patienten von 18,5% in EMP-T4 auf 11,5% in KG-A-T4 bis auf 0% in KG-A-T3T4, der intermediäre Anteil veränderte sich nur leicht und der Anteil an euthyreoten Patienten nahm von 29,6% in EMP-T4 auf 42,3% in KG-A-T4 bis auf 46,4% in KG-A-T3T4 deutlich zu. 36 3.6 Tests zu Kognition und Befindlichkeit 3.6.1 Testbatterie zur Aufmerksamkeitsprüfung (TAP) Die zwei Teile dieses Tests dienten zur Beurteilung der Reaktionsgeschwindigkeit und des Kurzzeitgedächtnisses. Die jeweiligen T-Werte der medianen Reaktionszeiten wurden gemittelt und in Tabelle 5 dargestellt. Ein hohes T ist hier als positiv und ein niedriges T als negativ zu werten, wobei der normierte T-Mittelwert bei 50 liegt. Tabelle 5: Testbatterie zur Aufmerksamkeitsprüfung (TAP) Alertness 1 und 4 (ohne Warnton) Alertness 2 und 3 (mit Warnton) Phasische Alertnes (1-4) Arbeitsgedächtnis EMP-T4 KG-A-T4 KG-A-T3T4 p / eta2 53 ± 10,1 54,7 ± 9,5 51,7 ± 10,7 0,13/ 0,07 51,5 ± 13,2 54,2 ± 11,4 55,2 ± 9,6 0,45/ 0,03 43 ± 8,1 43,6 ± 10,3 43,3 ± 8,8 0,96/ 0,001 44,7 ± 8,9 47,3 ± 10 48,4 ± 10* * vs. EMP-T4 p<0,05; die rechte Spalte zeigt p (nominales Alpha; Signifikanz) und eta2 (Effektstärke, ein Wert >0,05 spricht für die Zuverlässigkeit des Tests) als univarianten Vergleich. A.) Alertness: Hier zeigten sich weder bei den Reaktionszeiten mit noch bei den Reaktionszeiten ohne Warnton signifikante Unterschiede zwischen den 3 Phasen. Bei dem Test ohne Warnsignal gab es Tendenzen zugunsten der KG-A-T4-Phase und bei dem Test mit Warnsignal reagierten die Patienten in der KG-A-T3T4 und in der EMP-T4-Phase etwas schneller. Es ergaben sich in der Gesamtauswertung des Tests nur minimale Unterschiede zwischen den 3 Phasen (43 ± 8,1 in EMP-T4 vs. 43,6 ± 10,3 37 in KG-A-T4 vs. 43,3 ± 8,8 in KG-A-T3T4). Da diese Werte dem allgemeinen Durchschnitt entsprechen, kann daraus geschlossen werden, dass die Reaktionsgeschwindigkeit der 4T-Patienten weder eingeschränkt war, noch dass sie durch die Studienmedikation beeinflusst worden ist. B.) Arbeitsgedächtnis: Bei diesem Untertest zeigten sich hingegen Verbesserungen der Werte in KG-A-T4 und KG-A-T3T4 gegenüber der EMP-T4-Phase (47,3 ± 10 und 48,4 ± 10 vs. 44,7 ± 8,9), wobei allein der Unterschied zwischen EMP-T4 und KG-A-T3T4 Signifikanzniveau (p<0,05) erreichte. 3.4.2 Wechsler Memory Scale, Untertest „Zahlenspanne“ Der Untertest „Zahlenspanne“ dient der Kurzzeitgedächtnisprüfung. Hier wurden die erreichten Punktwerte anhand einer altersgestuften Tabelle in Äquivalenzperzentile transformiert (Tabelle 6). Bei der Vorwärtswiederholung der vorgesprochenen Zahlen schnitten die Patienten in der KG-A-T4-Phase etwas besser ab (63 ± 29 vs. 60,1 ± 30 in EMP-T4 vs. 51,1 ± 32 in KG-A-T3T4); bei der Rückwärtswiederholung hingegen in der KG-A-T3T4-Phase (63,9 ± 29 vs. 59,6 ± 34 in KG-A-T4 vs. 54,9 ± 33 in EMP-T4). Es fanden sich hier keine signifikanten Unterschiede zwischen den Ergebnissen der drei Studienphasen. Tabelle 6: Zahlenspanne (WMS) Äquivalenzperzentile vorwärts Äquivalenzperzentile rückwärts EMP-T4 KG-A-T4 KG-A-T3T4 p / eta2 60,1 ± 30 63 ± 29 51,1 ± 32 0,23 / 0,05 54,9 ± 33 59,6 ± 34 63,9 ± 29 0,23 / 0,05 Aufgeführt sind die Mittelwerte der Äquivalenzperzentile in den 3 Phasen sowie in der rechten Spalte die p-Werte und die Effektstärken (eta2). 38 3.6.3 Visuelle Analogskala für Stimmung und körperliche Beschwerden Die Strecke bis zur Markierung der Patienten auf der 100 mm Skala wurde ausgemessen und gewertet, so dass niedrige Werte als positiv, hohe Werte als negativ anzusehen sind. Es zeigten sich weder im Gesamtmittel (19,3 in EMP-T4 vs. 22,5 in KG-A-T4 vs. 19,5 in KG-A-T3T4) noch für die einzelnen Items signifikante Unterschiede zwischen den 3 Phasen, wobei die Befindlichkeit der Patienten insgesamt als gut zu werten ist. Die Mittelwerte der 15 Einzelsymptome sind in Abbildung 11 dargestellt. Visuelle Analogskala Betrübtheit Zielstrebig Ängstlichkeit Anspannung Zorn Erschöpfung Reizbarkeit Unruhe Kältegefühl verschw. Sehen Übelkeit EMP-T4 KG-A-T4 KG-A-T3T4 Müdigkeit Schwindel Abgeschlagenheit Hitzegefühl 0 20 40 60 80 100 mm Abbildung 11: Visuelle Analogskala für Stimmung und körperliche Beschwerden; Mittelwerte nach Phasen (EMP-T4 – grün, KG-A-T4 – blau, KG-A-T3T4 – lila) verteilt auf 15 Items. 39 3.6.4 SCL-90-R Dieser Test wurde eingesetzt, um die physische und psychische Belastung in einem Zeitraum von 7 Tagen nach Selbsteinschätzung der Patienten zu quantifizieren. Er wurde zu Abschluss der jeweiligen Studienphasen ausgefüllt und von den Patienten zu den Visiten mitgebracht. Hier wurden alters- und geschlechtsspezifische T-Werte (hohe Werte positiv, niedrige Werte negativ) berechnet und für die Auswertung verwendet (Tabelle 7). Bei den untersuchten Patienten beträgt das durchschnittliche T = 50,8 ± 2,17 (Mittelwert von den 9 Items in 3 Phasen) und liegt somit allgemein im mittleren Bereich (Norm T=50). Es ließen sich bei diesem Test keine Unterschiede der Befindlichkeit zwischen den 3 Phasen feststellen. Die Schwankungen zwischen den einzelnen Patienten sind zwar groß (Standardabweichungen von bis zu 20 % der erreichten Mittelwerte), jedoch bewegten sich sämtliche Mittelwerte im gleichen Bereich. Die globalen Kennwerte zeigten ebenfalls keine signifikanten Unterschiede auf. 40 Tabelle 7: SCL-90-R EMP-T4 KG-A-T4 KG-A-T3T4 51 ± 10,5 52,2 ± 10,5 p / eta2 Items: Somatisierung 54 ± 8 0,18 / 0,06 Zwanghaftigkeit 52,8 ± 11,3 53,4 ± 10,3 54,1 ± 8,9 0,65 / 0,02 Unsicherheit im Sozialkontakt 49,5 ± 7,9 51 ± 8 49,2 ± 7,6 0,5 / 0,02 Depressivität 52,9 ± 9,3 52,9 ± 10,5 52,7 ± 7,8 0,93/ 0,003 Ängstlichkeit 50,6 ± 8,9 50,8 ± 9 51,1 ± 7,4 0,9 / 0,003 50 ± 9,3 49,6 ± 9,1 50,2 ± 7,2 0,87/ 0,004 Phobische Angst 48,1 ± 5,2 48,2 ± 6,3 47,2 ± 5,6 0,48 / 0,02 Paranoides Denken 48,6 ± 6,9 49,4 ± 7,2 48 ± 5,8 0,54 / 0,02 Psychotizismus 49,2 ± 6,6 52,3 ±7 52,3 ± 6,8 0,07 / 0,1 52 ± 6,9 0,58 / 0,02 Aggressivität/ Feindseligkeit Globale Kennwerte: Global severity index (GSI) Positive symptom distress index (PSDI) Positive symptom total (PST) 50,1 ± 10,2 51,5 ± 10,5 49,9 ± 7,9 48,4 ± 8 50,9 ± 11,4 0,86/ 0,003 50,4 ± 9,7 51,7 ± 9,9 49,6 ± 6,8 0,25 / 0,05 Dargestellt sind die gemittelten T-Werte der 3 Phasen für 9 Items und 3 globale Kennwerte; in der rechten Spalte wurden die errechneten p-Werte sowie die Effektstärken (eta2, eine Effektstärke von >0,06 spricht für Zuverlässigkeit des Tests) aufgeführt. 41 3.6.5 SF-36 SF-36 ist ein psychologischer Test, der darauf zielt, die gesundheitsbezogene Lebensqualität der Probanden zu evaluieren. Hier wurden nach den vorgegebenen standardisierten Algorhythmen die einzelnen Werte transformiert, um die Validität und Reliabilität der Testergebnisse sicherzustellen und um gleichzeitig den Vergleich mit anderen standardisierten Tests zu erlauben. Die hierbei gewonnenen Werte sind je höher umso positiver zu werten. Verbindet man die erzielten 4T-Mittelwerte der Items aus den drei Studienphasen, so entstehen drei Kurven (siehe Abbildung 12, grün für EMP-T4, blau für KG-A-T4 und lila für KG-A-T3T4). Es ist gut erkennbar, dass die 4T-Kurven sehr ähnlich verlaufen und dass es in keinem der 8 Items nennenswerte Unterschiede zwischen den 3 Phasen gibt. Zum Vergleich wurden ebenfalls die entsprechenden Kurven von gesunden Studenten (gelb), von chronisch erkrankten Hypertoniepatienten (orange) und pAVKPatienten (braun) dem Testmanual entnommen und in der gleichen Abbildung dargestellt. Interessanterweise haben die 4T-Kurven einen ähnlichen Verlauf wie die der Hypertoniepatienten, wobei die 4T-Patienten bessere Ergebnisse vor allem für die ersten 4 Items (körperliche Gesundheit) erzielten. Die 4T-Kurven nähern sich hier dem Durchschnitt der gesunden Studenten. Zum Kontrast wurden ebenfalls die niedrigeren Werte der Patienten mit peripherer arterieller Verschlusskrankheit (pAVK) dargestellt. 42 Abbildung 12: SF-36; transformierte Mittelwerte (%); Phase EMP-T4 (grün), KG-AT4 (blau) und KG-A-T3T4 (lila) im Vergleich zu gesunden Studenten (gelb), Patienten mit aHT (orange) und Patienten mit pAVK (braun). Hohe Werte sind positiv und bedeuten eine gute gesundheitsbezogene Lebensqualität. 43 3.6.6 Gießener Beschwerdebogen (GBB-24) Die erreichten Punktwerte in dem Gießener Beschwerdebogen (GBB-24) (24 Fragen mit 0 bis 4 Punkten bewertet) wurden den verschiedenen Items (Erschöpfungsneigung (E), Magenbeschwerden (M), Gliederschmerzen (G), Herzbeschwerden (H)) zugeteilt und im Beschwerdedruck (B: E+M+G+H) addiert. Das Ausmaß der Beschwerden konnte anhand einer altersnormierten Tabelle (18-60 Jahre) in 4 Stufen eingeteilt werden (Q1-4, wobei Q1 für schwache und Q4 für starke Beschwerden steht). Die erreichten Mittelwerte sind in Abbildung 14 dargestellt. Insgesamt liegen die Werte der Patienten im mittleren bis oberen Bereich, wobei eine dezente Beschwerdezunahme von Phase EMP-T4 nach KG-A-T4 nach KG-A-T3T4 (gesamter Beschwerdedruck von 2,3 ± 0,99 vs. 3,52 ± 5,53 vs. 3,64 ± 6,23) zu vermerken ist. Allerdings konnten keine signifikanten Unterschiede festgestellt werden. Abbildung 13: Gießener Beschwerdebogen; transformierte Mittelwerte mit Einteilung nach Items (Balken von li. nach re. Stehen für die Items in der unten beschriebenen Reihenfolge) und Phasen. Tabelle zeigt die erreichten Punktwerte für die 5 Items: Erschöpfungsneigung (E), Magenbeschwerden (M), Gliederschmerzen (G), Herzbeschwerden (H), Beschwerdedruck (B: E+M+G+H), wobei der Wert 1 für schwache, der Wert 4 für starke Beschwerden steht. 44 3.6.7 Demenz Test nach Kessler, Untertest „Fremdbeurteilung“ Hierbei handelte es sich um einen Fragebogen, der von dem Partner oder einem nahen Verwandten ausgefüllt werden musste. Die Fragen bezogen sich auf Bewältigung von Alltagssituationen, wie zum Beispiel häufiger Stimmungswechsel, Schlaf- oder Appetitstörungen. Die berechneten prozentuellen Anteile der erreichten Punktwerte von der maximalen Punktzahl von 120 wurden miteinander verglichen. Hierbei sind hohe Werte als positiv und niedrige Werte als negativ zu werten. Es konnten bei diesem Test jedoch keine signifikanten Unterschiede zwischen den Ergebnissen der EMP-T4-Phase, der KG-A-T4-Phase und der KG-A-T3T4-Phase festgestellt werden. Die in Abbildung 14 dargestellten Kurven für die drei Studienphasen haben einen ähnlichen Verlauf. Abbildung 14: Fremdbeurteilung; Werte der einzelnen Patienten, Angaben in %Anteile von der maximal erreichbaren Punktzah, hohe Werte positiv, niedrige Werte negativ; Vergleich der 3 Phasen EMP-T4 (grün), KG-A-T4 (blau) und KG-A-T3T4 (lila). 45 3.7 Einfluss des Ausmaßes der Dosiserhöhung auf die untersuchten Zielparameter Wie vom Studienprotokoll vorgegeben, wurde den 4T-Patienten eine gewichtsadaptierte Dosis von 1,6 µg/kg KG T4 in der KG-A-T4-Phase und eine Kombination aus 1,44 µg/kg KG T4 + 0,16 µg/kg KG T3 verabreicht. Da jedoch die Patienten vor Studienbeginn sehr unterschiedliche T4-Dosierungen einnahmen, ergab sich bezüglich der jeweiligen Dosissteigerung eine große Spannbreite (0,3-1,1 µg/kg KG), wobei eine durchschnittliche Erhöhung von 0,58 ± 0,24 µg/kg KG berechnet wurde. So stellte sich die Frage, ob das Ausmaß der Dosiserhöhung mit den Änderungen der Zielparameter korreliert. Aus diesem Grund wurden Regressionsanalysen durchgeführt. Damit konnte die Abhängigkeit der Änderungen der Zielparameter von dem Dosisunterschied von EMP-T4 nach KG-A-T4 beziehungsweise nach KG-AT3T4 untersucht werden. Es konnten allerdings keine positiven Korrelationen nachgewiesen werden. 46 4 Diskussion In der 4T-Studie wurden von Februar bis Juni 2004 insgesamt 32 Patienten mit bekannter sekundärer Hypothyreose untersucht. Es wurde anhand von klinischen und laborchemischen Parametern sowie psychometrischen Tests geprüft, ob eine intensivierte, gewichtsbezogene Thyroxintherapie von 1,6 µg/kg Körpergewicht (KGA-T4-Phase) beziehungsweise eine Kombinationstherapie aus Thyroxin und Trijodthyronin im Verhältnis 10:1 (KG-A-T3T4-Phase) der bisherigen, empirisch festgelegten Substitutionstherapie (EMP-T4-Phase, durchschnittlich 1,2 µg/kg KG) überlegen ist. Das Thema wurde aufgegriffen, nachdem widersprüchliche Ergebnisse aus Studien zur primären Hypothyreose veröffentlicht wurden. Darunter wurde teilweise von günstigen Auswirkungen einer T3/T4-Kombinationstherapie auf die Befindlichkeit und auf den Fettstoffwechsel berichtet [3, 15], was wiederrum in anderen Studien nicht bestätigt werden konnte [76, 85]. Untersuchungen an thyroidektomierten Ratten zeigten dann 1996, dass allein durch die Substitution mit dem Kombinationspräparat aus T3 und T4 eine euthyreote Stoffwechsellage in allen Zielgeweben erreicht werden konnte [23]. Darüber hinaus hat sich in großen Querschnittsstudien zur primären Hypothyreose gezeigt, dass die Prävalenz der subklinischen Hypothyreose in der Bevölkerung verhältnismäßig hoch ist [16, 68, 81]. Ebenfalls konnte nachgewiesen werden, dass bereits eine subklinische Hypothyreose zu ungünstigen Veränderungen des Lipidprofils führt [48, 49, 67] und einen unabhängigen Risikofaktor sowohl für die erhöhte Inzidenz von kardiovaskulären Erkrankungen [34, 39, 43, 58, 49, 50], als auch für eine erhöhte Mortalität darstellt [36, 51], sodass die entsprechende hormonelle Substitution dringend empfohlen wird. Da jedoch die Substitutionsdosis bei der sekundären Hypothyreose anhand der Laborparameter nur unzureichend beurteilt werden kann, wurde die 4TInterventionstudie durchgeführt, um anhand von bestimmten Endpunkten die Auswirkungen verschiedener Dosierungsmöglichkeiten zu prüfen. 47 Bislang gibt es in der Literatur keine ähnlichen Untersuchungen des Krankheitsbildes der sekundären Hypothyreose, weswegen während der folgenden Diskussion unserer Ergebnisse und des Vergleichs mit Studien anderer Arbeitsgruppen stets beachtet werden muss, dass der primären und der sekundären Hypothyreose eine unterschiedliche Krankheitsbildern Pathogenese der Mangel zugrunde an liegt. Allerdings Schilddrüsenhormon stellt den bei beiden entscheidenden Pathomechanismus dar, sodass uns der Vergleich trotzdem sinnvoll und notwendig erscheint. Ein Jahr zuvor hatte eine ebenfalls von Herrn Professor Reincke geleitete Querschnittstudie (PORSHE) einen Vergleich von Patienten mit sekundärer Hypothyreose mit gesunden Probanden angestellt [31]. Die hierbei gewonnenen Ergebnisse zeigten zum Ersten, dass die thyreotrop insuffizienten Patienten im Durchschnitt mit einer empirischen Thyroxin-Dosis von 1,2 µg/kg KG behandelt wurden, und zum Zweiten, dass diese Patienten in einigen Testbereichen deutlich schlechter abschnitten als die gesunden Probanden. Zu Beginn der 4T-Studie wurden 32 Patienten rekrutiert, die sich zur Teilnahme bereit erklärt hatten und die festgelegten Einschlusskriterien erfüllten. In Anbetracht der niedrigen Prävalenz der sekundären Hypothyreose (1:60000-1:90000) [4] sowie der Tatsache, dass es sich um eine Interventionsstudie handelte, die zudem über einen Zeitraum von 15 Wochen vier Visiten erforderte, war es eine schwierige Aufgabe, eine ausreichende Anzahl von Patienten ausfindig zu machen. Hierbei waren die positiven Erfahrungen der Patienten nach langjähriger Behandlung in der endokrinologischen Ambulanz der Universitätsklinik Freiburg wie auch nach Teilnahme an der bereits erwähnten PORSHE-Studie sehr hilfreich. Ähnlich wie bei anderen Interventionsstudien, die verschiedene Thyroxindosierungen beziehungsweise die Kombinationstherapie miteinander verglichen haben [15, 85], wurde für die 4T Studie ein randomisiertes, Placebo-kontrolliertes (durch die EMPT4-Phase), doppelblindes „crossover“ Design ausgewählt, um sowohl die Objektivität des Untersuchers als auch die des Patienten zu gewährleisten. 48 Die Kenntnis der T4-Kinetik mit einer relativ langen Halbwertszeit von 7 Tagen erforderte für die drei verschiedenen Medikationsregimes eine Phasendauer von 5 Wochen, um die Wirkungseinstellung „steady state“ der neuen Dosis zu erreichen. Etwaige Nebenwirkungen, wie z.B. Vorhoflimmern könnten aber nur durch eine längere Behandlungsdauer sicher ausgeschlossen werden. In der Arbeit von Bunevicius et al. von 1999, wurden ebenfalls 5-wöchige Therapiephasen ausgewählt und es konnten positive Veränderungen mit der T3/T4Kombinationstherapie nachgewiesen werden [15]. Im Gegensatz hierzu steht die 2004 veröffentlichte Studie von Siegmund et al. zur primären Hypothyreose, in der nach einem 4-wöchigen Vorlauf mit T4Studienmedikation zur Adaptation weitere 2 Studienperioden von jeweils 12 Wochen, ebenfalls ohne „wash out“-Zwischenperiode durchgeführt wurden. Diese Zeitspanne wurde gewählt, um den sicheren hormonellen „steady state“ zu garantieren [76]. Allerdings wurden nur 23 Patienten untersucht, 87% davon weiblichen Geschlechts, was die Representativität der Ergebnisse in Frage stellt. Das 12-wöchige Regime war bei den drei vorgesehenen Studienphasen in unserem Fall angesichts der resultierenden Dauer den Patienten gegenüber nicht vertretbar. Um beurteilen zu können, ob tatsächlich eine Optimierung der Therapie mit der erhöhten Thyroxindosis beziehungsweise mit der Kombinationstherapie erreicht werden konnte, ist es unbedingt notwendig, zunächst die Ergebnisse der Schilddrüsenparameter zu betrachten. Anders als bei den primär hypothyreoten Patienten kann bei Patienten mit sekundärer Hypothyreose der TSH Spiegel nicht zur Beurteilung der adäquaten Schilddrüsenhormonstatus herangezogen werden, da das TSH, auch bei scheinbar ausreichender Produktion, durch mangelhafte Glykosylierung eine erniedrigte biologische Aktivität aufweisen kann [27]. So können Patienten mit zentraler Hypothyreose sowohl erniedrigte als auch normale und sogar erhöhte TSH-Spiegel aufweisen. Hinzu kommt, dass die physiologische Ausschüttung von TSH pulsatil erfolgt. Eine Studie von Rose et al. zeigte, dass bei Kindern mit genetisch bedingter sekundärer Hypothyreose der TSH-Serumspiegel im Normbereich lag, die physiologische frühmorgendliche Ausschüttung von TSH jedoch ausblieb [70]. 49 Die Serumspiegel von fT4 lagen in Phase EMP-T4 im unteren Normbereich, in den Phasen KG-A-T4 und KG-A-T3T4 leicht oberhalb des Referenzbereiches. In Gegensatz dazu zeigte sich in unserer gesonderten T3T4-Kinetik-Studie 2 Stunden nach Einnahme des Kombinationspräparates ein durchschnittlicher T4-Höchstwert von 20,1 ± 2,3 pmol/l, der sich noch im oberen Drittel des Referenzbereiches von T4 befindet. Da jedoch bei der sekundären Hypothyreose die periphere Konversion von T4 zum biologisch aktiven T3 durch die TSH-abhängige Dejodinasen gestört ist [9], kann nicht ausschließlich der normale fT4-Spiegel in EMP-T4 gewertet werden. Die fT3-Spiegel lagen in Phase EMP-T4 und KG-A-T4 im unteren beziehungsweise mittleren Normbereich, in Phase KG-A-T3T4 jedoch weit oberhalb des Normbereiches. Unsere Ergebnisse für die ART sowie für den Zulewski Score zeigten jedoch eine positive Wirksamtkeit an peripheren Zielorganen bereits unter der KG-AT4-Medikation und deutlicher unter der Kombinationstherapie T3/T4, ohne klinisch und laborchemisch eine Hyperthyreose zu belegen. Zum besseren Verständnis der laborchemischen Übersubstitution muss zunächst die Pharmakokinetik des T3-Präparates näher betrachtet werden. Laut vorhandener Literatur waren eine rasche Anflutung sowie ein zügiger Abbau mit einer Halbwertszeit von 24 h des verfügbaren Trijodthyronin (Thybon®) bekannt [26]. Während der 4T-Studie erfolgte, mit dem Ziel den Spitzenspiegel zu messen die Entnahme der Blutproben jeweils 2 Stunden nach Einnahme der Studienmedikation. Die zusätzlich durchgeführte T3-Kinetikstudie belegte diese Annahme. Genau 2 Stunden nach Einnahme des T3-Präparates lagen die gemessenen fT3-Werte 61% über dem Basalwert und fielen in den folgenden 6 Stunden nahezu wieder auf den Ausgangspunkt herab. Der 24-Stunden-Durchschnittswert, der aus der area under the curve näherungsweise errechnet werden kann, liegt 27,6% niedriger als der Durchschnitt der Werte die 2 Stunden nach Tabletteneinnahme gemessen wurden und damit nur knapp oberhalb des Normbereiches. In den Untersuchungen von Sigmund et al. zur Pharmakokinetik des T3T4-Kombinationspräparates wurde ebenfalls ein fT3-Peak nach 2 Stunden erreicht [76]. Zudem muss die Wirkstärke des Trijodthyronins entsprechend seiner biologischen Aktivität beachtet werden. Diese ist laut Literatur um den Faktor 3-5 höher 50 einzustufen als die Wirkstärke von T4 [26, 47]. In mehreren Interventionsstudien bei Patienten mit primärer Hypothyreose wurde dieser Umstand berücksichtigt und in der Kombinationstherapie das T4 stärker reduziert als T3 hinzugefügt. Es zeigte sich, dass der Ersatz von jeweils 5 µg T4 durch 1 µg T3 entsprechend eines biologischen Aktivitätsverhältnisses von 1:5 zu einem TSH-Anstieg führte und als Zeichen einer zu niedrigen Substitutionsdosis gewertet werden kann [22, 72, 85]. Studien, im Rahmen derer zwischen 2,7 und 4 µg T4 für jedes hinzugefügte µg T3 abgezogen wurden, ergaben keine TSH-Veränderungen [15, 20, 74]. Wiederum eine TSH-Supression wurde nach dem Ersatz von weniger als 2 µg T4 pro hinzugefügtem µg T3 erwiesen [3, 22, 76]. Gerichtet nach der entsprechenden TSH-Antwort, sollte man für jedes hinzugefügte µg T3 jeweils circa 3 µg T4 abziehen, um ein Präparat mit gleichbleibender Wirkstärke zu erhalten. Diese Überlegungen gelten jedoch in erster Linie für das Krankheitsbild der primären Hypothyreose. In der 4T-Studie wurde eine streng körpergewichtsbezogene Dosis sowohl für T4 als auch für die Kombinationstherapie T3/T4 getestet. Diese richtete sich nach der als optimal geltenden Thyroxin-Substitutionsdosis für Patienten mit primärer Hypothreose [29]. Wird nun zusätzlich die höhere biologische Potenz des Trijodthyronins berücksichtigt, so ergibt sich für die Phase KG-A-T3T4 eine insgesamt höhere T4 Dosis, was ebenfalls eine mögliche Erklärung für die supraphysiologische fT3-Serumkonzentration bei gleich bleibender fT4 Konzentration in dieser Phase bietet. Da jedoch aus der Literatur hervorging, dass die periphere Konversion von T4 zu dem biologisch aktiveren T3 aufgrund des TSH-Mangels [9] sowie durch den meist assoziierten GH-Mangel [38] im Rahmen der sekundären Hypothyreose ebenfalls eingeschränkt sein kann, sind wir zu Beginn der Studie davon ausgegangen, dass die Wahl eines höheren T3-Substitutionsniveaus der physiologischen Restitution näher kommt. Die genaue Analyse der aufgetretenen Nebenwirkungen, Adverse Events und gemessenen Sicherheitsparameter ergibt keinen Hinweis auf klinisch nachweisbare Hyperthyreose in Phase KG-A-T3T4. Zwar nannten mehrere Patienten Symptome wie Unruhe, Nervosität, Schlafstörungen, vermehrtes Schwitzen und Palpitationen, diese Nebenwirkungen waren jedoch selten und eine Häufung konnte weder in Phase KG- 51 A-T3T4 noch in Phase KG-A-T4 festgestellt werden. Nur eines von insgesamt 9 Adverse Events wurde in Phase KG-A-T3T4 notiert und der einzige Studienabbruch aufgrund von Hyperthyreosesymptomen ereignete sich in Phase KG-A-T4. Die Sicherheitsparameter wie Herzfrequenz als empfindlicher Indikator für eine Schilddrüsenüberfunktion [10, 11], Blutdruck und Ruhe-EKG blieben zwischen den Phasen unverändert, insbesondere gab es kein Auftreten von Vorhofflimmern oder andere Herzrhythmusstörungen, die häufig im Zusammenhang mit Schilddrüsenüberfunktion beobachtet werden [5, 73]. Allerdings ist auch denkbar, dass die Studiendauer eventuell zu kurz gewählt war, um solche Nebenwirkungen statistisch aufzufinden. Inwiefern die laborchemische Übersubstitution (fT3) in Phase KG-A-T3T4 von klinischer Relevanz ist, bleibt unklar. Trotzdem ist ein dauerhaft supraphysiologischer Schilddrüsenhormonspiegel nicht tolerabel, da erwiesen ist, dass eine hyperthyreote Stoffwechsellage langfristig mit einem erhöhten kardiovaskulären Risiko und gesteigerter Mortalität einhergeht [10, 63]. Während der 4T-Studie kann jedoch analog der Kinetik-Ergebnisse davon ausgegangen werden, dass der gemessene Hormonspiegel dem Tageshöchstwert entsprach und, dass diese deutliche Erhöhung des Hormonspiegels nur wenige Stunden anhielt. Einen möglichen Lösungsansatz der Problematik könnte die Aufteilung der T3T4Tagesdosis in zwei Einzeldosen darstellen. In mehreren Studien wurde dieser Ansatz untersucht, wobei die gemessenen T3-Serumkonzentrationen innerhalb des Normbereiches lagen [3, 20, 74]. In keiner dieser Studien wurde jedoch gezielt die Pharmakokinetik untersucht. In der Arbeit von Clyde et al. fand die Blutentnahme eine Stunde nach der morgendlichen Tabletteneinnahe statt. Postuliert man einen fT3Serum-Peak 2 h nach Einnahme, erfolgte hier die Blutentnahme zu einem Zeitpunkt, an dem der T3-Peak noch nicht erreicht war [20]. Bei Sawka und Appelhof finden sich über den Abnahmezeitpunkt keine genauen Angaben [3, 74]. Eine andere Möglichkeit der Substitutionstherapie bietet ein Präparat mit verzögerter T3-Freisetzung. In einer Studie von Hennemann et al. wurde ein selbst hergestelltes 52 slow-release-T3-Präparat verwendet. Hier wurde sowohl eine verbesserte Hormonsubstitution erreicht als auch der morgendliche fT3-Gipfel verhindert [35]. Da solch ein Präparat derzeit kommerziell nicht erhältlich ist, stellt es aktuell keine realistische Alternative für die Substitutionstherapie hypothyreoter Patienten dar. Schlussfolgernd kann empfohlen werden, initial eine T4 Dosis von 1,6 ug/kg KG zu verabreichen. Anschließend sollten nach fünf Wochen Messungen der fT3- und fT4Werte vor der Medikationseinnahme zur Bestimmung des Basalspiegels erfolgen, und die T4-Dosis, mit dem Ziel fT4 Werte im oberen Normbereich zu erreichen, gegebenenfalls angepasst werden. Die Analyse der Scores nach Zulewski korreliert mit den bisher diskutierten Ergebnissen der 4T-Studie. Die genaue Betrachtung der Einzelwerte zeigte, dass 5 Patienten in der Phase EMP-T4 einen Zulewski-Score größer als 5 Punkten besaßen und dass, im Gegenteil dazu, in Phase KG-A-T3T4 kein einziger Patient als hypothyreot bewertet wurde, sodass angenommen werden kann, dass einige Patienten besonders von der Kombinationstherapie profitiert haben. Hier wurden in den Phasen KG-A-T4 und KG-A-T3T4 signifikant niedrigere („euthyreote“) Werte im Vergleich zu der EMP-T4-Phase („intermediär“) erzielt. Zwischen den Phasen KG-A-T4 und KG-A-T3T4 konnten keine Unterschiede festgestellt werden. Dies spricht sowohl für eine Untersubstitution mit der empirischen T4-Dosierung als auch für die Aufhebung dieser in den beiden anderen Studienphasen. Diese Betrachtung ist jedoch nur eingeschränkt möglich. Es muss beachtet werden, dass der erreichte Punktdurchschnitt in EMP-T4 in den von Zulewski so genannten „intermediären“ Bereich fällt und dies nicht als eindeutige Hypothyreose gewertet werden kann. Hinzu kommt, dass dieser Test eine Übersubstitution in den Phasen KG-A-T4 und KG-AT3T4 nicht sicher auszuschließen vermag, da er nur für die Hypothyreose-Diagnostik validiert ist. Um die Ergebnisse der Achillessehenenreflexzeit (ART)-Messungen interpretieren zu können, muss zunächst der vorher ermittelte Normwert betrachtet werden. Er entstand aus dem Mittel von jeweils 6 Messungen bei insgesamt 104 gesunden Probanden beiderlei Geschlechts und aus 5 definierten Altersgruppen von 18 bis 75 Jahren. Da 53 sich hierbei kein eindeutiger beziehungsweise zwischen den Unterschied Geschlechtern zwischen den Altersgruppen feststellen ließ, wurde eine halbmaximale ART von 351 ± 48 ms aus dem Durchschnitt aller Probanden gemittelt. Diese ART stimmt mit Ergebnissen früherer Studien überein [59, 60, 61]. Wenn man darüber hinaus voraussetzt, dass die ART eng mit dem Schilddrüsenstatus korreliert [41, 42, 46, 56, 59, 60, 61], so würde man gemäß der gemessenen Schilddrüsenhormonwerte in Phase EMP-T4 eine verlangsamte, in Phase KG-A-T4 eine normale und in Phase KG-A-T3T4 ein beschleunigte ART erwarten. Tatsächlich zeigt sich auch eine signifikante Beschleunigung der ART in KG-A-T3T4 (366 ± 41 ms) gegenüber einer ART in EMP-T4 (389 ± 41 ms) im oberen Normbereich. Trotz laborchemischer Übersubstitution liegt der erzielte Mittelwert in der Kombinationsphase noch etwas oberhalb des festgelegten Normmittelwerts (351 ms). In Phase KG-A-T4 wurde eine mittlere ART von 384 ± 39 ms gemessen, die signifikant verlangsamt ist gegenüber dem Normmittelwert und sich gleichzeitig nur gering von dem Ergebnis in EMP-T4 unterscheidet (liegt ebenfalls im obern Normbereich). Als mögliche Erklärung hierfür könnte zunächst die Gültigkeit der oben genannten Voraussetzungen für den ART-Normwert und dessen Korrelation mit dem Schilddrüsenhormonstatus in Frage gestellt werden. Zudem ist möglicherweise der pharmakologische Hormonersatz mit der physiologischen Hormonproduktion, zumindest was den Einfluss auf die ART betrifft, nicht gleichzustellen. Zuletzt könnte der Phasenzeitraum von 5 Wochen nicht ausreichend gewesen sein, um die vollständige hormonelle Wirkung auf den Reflexapparat zu ermöglichen. Dies würde die Annahme von Siegmund et al. einen sicheren „steady state“ für TSH erst nach einer 12-wöchigen Substitutionsphase zu erreichen, bestätigen [76]. Allerdings wurde in dieser Studie keine ART gemessen, so dass ein direkter Vergleich nicht möglich ist. Ähnlich verhielten sich die weiteren Parameter, die 2006 in der Dissertation von Herrn Dr. Björn Klawitter analysiert wurden (Lipide, CK): sie verbesserten sich bereits unter der erhöhten Thyroxintherapie (1,6 µg/kg KG) und erreichten teilweise erst optimale Werte unter der T3/T4-Kombinationstherapie. 54 Seit mehr als 200 Jahren wurde die Beziehung zwischen neuroendokrinem System und psychischen Erkrankungen, insbesondere die Korrelation des Mangels an thyroidalen Hormonen mit Befindlichkeitsstörungen, erforscht [25]. Wie in der Einleitung bereits aufgeführt, erlaubt der TSH-Mangel beziehungsweise das biologisch inaktive TSH [7, 8, 48, 55, 65] bei der sekundären Hypothyreose keine Rückschlüsse über die Höhe des Substitutionsniveaus, sodass der hormonelle Status als Richtlinie zur Dosisfindung nicht ausreichend ist. Da bereits eine primäre subklinische Hypothyreose nicht nur einen Risikofaktor für kardiovaskuläre Erkrankungen [34, 39, 43, 58] und erhöhte Mortaltät [36, 51] darstellt, sondern auch für Entstehung von Depressionen verantwortlich sein kann [33, 45], müssen auch andere Verfahren hinzugezogen werden, um eine Quantifizierung der Einschränkung von Kognition und Befindlichkeit zu ermöglichen. Aus diesem Grund wurden in der 4T-Studie zusätzlich 7 Tests eingesetzt, die in der deutschen Sprache verfügbar waren und eine hohe Reliabilität aufweisen konnten. Einige dieser Tests wurden auch in vorangegangenen Studien zum diesem Thema verwendet, sodass ein direkter Vergleich der Testwerte möglich war. Im Folgenden stehen jedoch nicht alleine die erzielten Ergebnisse zur Diskussion, die darüber Auskunft geben sollen, ob die 4T-Patienten von der T4-Dosiserhöhung beziehungsweise von der Kombinationstherapie profitiert haben, sondern auch, ob die verwendeten Tests sich dazu eignen, im klinischen Alltag eine Hypothyreose zu diagnostizieren. Die Kognition wurde anhand der Testbatterie zu Aufmerksamkeitsprüfung (TAP) und eines Untertests der Wechsler Memory Scale namens „Zahlenspanne“ gemessen. Die TAP, bestehend aus zwei Untertests, „Alertness“ und „Arbeitsgedächtnis“, ist ein in medizinpsychologischen Studien mehrfach angewandter Test und weist eine hohe Reliabilität auf [64, 88]. Im „Alertness“-Untertest, der zur Prüfung der Reaktionsgeschwindigkeit eingesetzt wurde, konnten keine relevanten Unterschiede in den gemittelten Reaktionszeiten der Patienten zwischen den drei Phasen festgestellt werden. Die Daten wiesen allein in dem „Arbeitsgedächtnis“ -Untertest Unterschiede im Sinne einer Verbesserung von Phase EMP-T4 zu KG-A-T4 und deutlicher zu KG- 55 A-T3T4 auf, letztere im Signifikanzniveau (post hoc p<0,05). Allerdings ist bei nur einem signifikanten Ergebnis die Representativität fraglich. Bei dem Untertest „Zahlenspanne“ aus der revidierten Fassung des „Wechsler Gedächtnis Test“ (WMS-R) handelt es sich um einen Kurzzeitgedächtnistest [32]. Er wurde bereits in mehreren Studien, die den Benefit eines Kombinationspräparates aus T3 und T4 bei primärer Hypothyreose untersuchten, zum Vergleich herangezogen. Die meisten vorliegenden Ergebnisse konnten jedoch keine Unterschiede zwischen den Leistungen unter Thyroxintherapie und denen unter der Kombinationstherapie T3/T4 belegen [3, 76, 85]. Eine einzige deutliche Leistungsverbesserung, allerdings nur bei der Rückwärtswiederholung, zeigte sich in den Untersuchungen von Bunevicius et al. 1999 nach Substitution eines Anteils von 50 µg T4 der Gesamtdosis durch 12,5 µg T3 [15]. Die Ergebnisse der 4T-Patienten Vorwärtswiederholung zugunsten für diesen der Test KG-A-T4 schwankten Phase, bei bei der der Rückwärtswiederholung zugunsten der KG-A-T3T4-Phase. Es konnten sich allerdings keine signifikanten Unterschiede abzeichnen. Demnach ließ sich bezüglich der Kognition der Patienten weder eine negative noch eine eindeutig positive Reaktion auf die Dosiserhöhung von Thyroxin beziehungsweise auf die T3/T4-Kombinationstherapie feststellen. Die Werte befanden sich für beide Tests im mittleren Bereich, so dass man davon ausgehen kann, dass die 4T-Patienten bereits ein „normales“ Ausgangsniveau hatten. Gleichzeitig sprechen die Ergebnisse gegen eine hyperthyreote Stoffwechsellage unter der Kombinationstherapie mit T3 und T4. Die Befindlichkeit der Patienten wurde ebenfalls zum Ende der drei Studienphasen anhand fünf weiterer Testbögen analysiert. Die visuelle Analogskala für Stimmung und körperliche Beschwerden ist ein mit der Schilddrüsensymptomatik assoziierter Test, in dem die Probanden durch entsprechende Markierungen auf 15 Skalen von jeweils 100 mm Länge ihren 56 aktuellen physischen und psychischen Zustand ausdrücken können. Bunevicius et al. berichteten 1999 von einer signifikanten Verbesserung in 10 von 15 Skalen nach Substitution mit dem T3/T4-Kombinationspräparat [15]. Im Gegensatz dazu wurde 2003 in einer Studie von Walsh et al. eine signifikante Verschlechterung der Testwerte in der visuellen Analogskala bei Substitution mit dem Kombinationspräparat im Vergleich zu der T4-Substitution beschrieben [85]. In beiden Studien wurden Patienten mit primärer Hypothyreose untersucht und von der initialen T4-Dosis wurden 50 µg T4 mit 12,5 µg beziehungsweise 10 µg substituiert. Diese Therapieregimes unterscheiden sich deutlich von der in der 4T-Studie eingesetzte gewichtsbezogene Substitution von 1,6 µg/kg KG in einem physiologischen T3:T4-Verhältnis von 1:10. Wir konnten in unserer Studie keine Unterschiede zwischen den drei Phasen feststellen. Es kristallisierten sich auch keine Tendenzen heraus. Die Mittelwerte bewegen sich um 20 mm auf einer Skala von 0 bis 100 mm, wobei eine Markierung bei 0 für keine und eine bei 100 für maximale Beschwerden steht. Daraus kann geschlossen werden, dass die Patienten einen guten Zustand unter der empirischen Sustitutionstherapie hatten, den sie sowohl unter der erhöhten Thyroxindosis als auch unter der Kombinationstherapie beibehalten haben. Des Weiteren wurde die Symptomcheckliste von Derogatis (SCL-90-R) – Deutsche Version eingesetzt. Bei diesem Test wurden die anhand representativer Normstichproben gebildeten T-Werte evaluiert. Dieses Testprofil weist für klinische Gruppen eine sehr hohe Reliabilität auf und wurde bereits in drei vergleichbaren Studien eingesetzt. Sowie in der 4T-Studie konnte in den Untersuchungen von Sawka et. al 2003 und von Siegmund et al. 2004 mit dem T3/T4-Kombinationspräparat bezüglich dieses Tests kein klarer Benefit erzielt werden [74, 76]. Bei Appelhof et al. 2005 nahm eine Gruppe die bisherige T4-Medikation ein und es wurde an zwei weitere Gruppen eine T3/T4-Kombination im Verhältnis 1:10 beziehungsweise 1:5 verabreicht. Mehrere signifikante Verbesserungen der SCL-90-R Ergebnisse konnten nach 15 Wochen Therapie allerdings in allen 3 Therapiegruppen gegenüber der Ausgangswerte festgestellt werden. Die zwei T3/T4-Kombinationsregimes (im Verhältnis 1:10 und 5:10) ergaben jedoch im Vergleich zur T4-Kontrollgruppe keine deutlichen Unterschiede [3]. 57 In der 4T-Studie wurden für 5 von 9 Items sowie für 2 von 3 globale Kennwerte tendenziell bessere Ergebnisse unter der T3/T4-Kombination erzielt. Die 4T-Patienten wiesen zudem im Mittel (TMW1-9 = 50,8 ± 2,17) durchschnittliche Normalwerte auf. Somit waren keine großen Unterschiede zum Ausgangszustand zu erwarten. Mit dem Fragebogen SF-36 konnte die subjektive Gesundheit aus der Sicht des Betroffenen unabhängig von dessen Gesundheitszustand erfasst werden. Dieser Test stellt ein krankheitsübergreifendes Verfahren dar und verfügt somit über einen höchst vielfältigen Einsatzbereich. Die psychometrische Testung mit Analysen zur Reliabilität, Validität und Responsivität des deutschen SF-36 basierte auf 8 Studienpopulationen. Im Rahmen dessen wurden 375 gesunde Studenten, 153 Hypertoniepatienten (aHT) und 308 Patienten mit peripherer arterieller Verschlusskrankheit (pAVK) untersucht [14]. Im Ergebnisteil sind mehrere Kurven dargestellt: einerseits die der 4T-Patienten in den drei Untersuchungsphasen und andererseits die dem Manual entnommenen Vergleichskurven (gesunde Studenten, aHT- und pAVK-Patienten). Der Vergleich soll veranschaulichen, dass die in der 4TStudie untersuchten Patienten mit sekundärer Hypothyreose an verhältnismäßig geringen körperlichen und psychischen Beschwerden leiden. Der Beschwerdedruck ist vergleichbar mit dem der Hypertoniepatienten, wobei die 4T-Patienten in diesem Test für mehrere Items sogar bessere Ergebnisse erzielten. Im Vergleich zu den gesunden Studenten fielen die Werte der Studienpatienten für körperliche Beschwerden bis zu 15% schlechter aus. Dieser Unterschied relativiert sich jedoch, wenn man bedenkt, dass die Studenten einen deutlich niedrigeren Altersdurchschnitt als die 4T-Patienten haben. Geht man also davon aus, dass das Alter vor allem bezüglich der körperlichen Gesundheit eine wichtige Rolle spielt, sind die 4TPatienten eindeutig im Nachteil, da die Alterskomponente bei der Auswertung des Tests nicht mitberücksichtigt wird. Diese Tatsache ist sicherlich als Schwäche des SF36 zu sehen. In der Studie von Walsh et al. wurde bei 101 Patienten mit primärer Hypothyreose die T3/T4-Kombinationstherapie der klassischen Substitutionstherapie gegenübergestellt und ebenfalls der SF-36 zum Vergleich eingesetzt. Wie auch in unserer Studie, ergaben sich jedoch keine signifikanten Unterschiede [85]. 58 Darüber hinaus wurde in der 4T-Studie die Kurzform eines sehr gängigen Tests zur Abschätzung psychosomatischen Geschehens bei organmedizinischen Patienten verwendet: der Gießener Beschwerdebogen-24 (GBB-24) [12]. Hierbei handelt es sich um einen Test, der bei Stichproben von Patienten mit genau definierten Symptomen eine hohe Extremgruppenvalidität aufweist. Die Ergebnisse zeigten positive Tendenzen nach Erhöhung der T4–Dosis und nach Zugabe von T3, wenn auch keine signifikanten Unterschiede festgestellt werden konnten. Zudem muss beachtet werden, dass die Alterseinstufung zur Testauswertung die obere Grenze schon bei 60 Jahren erreicht und 11 von 32 unserer Patienten (34,4%) bereits im Alter von über 60 Jahren waren. Aus diesem Grund könnten sich die erzielten Werte für den gesamten Beschwerdedruck als erhöht darstellen, müssten jedoch bei den durchschnittlich älteren Patienten in unserer Studie (circa 1/3 älter als 60 Jahre) als normal eingestuft werden. Zuletzt wurde die alltägliche Problembewältigung und Befindlichkeit auch von den nächsten Angehörigen der teilnehmenden Patienten begutachtet. Der dafür verwendete Test, nämlich der Fremdratinganteil des weltweit meist benutzten Demenz-Tests [40], hat auf den ersten Blick weinig gemein mit der in dieser Studie zu beurteilenden Hypothyreose. Allerdings zielen die Fragen an die Angehörigen sehr genau auf gewöhnliche Situationen des Alltags und gewähren uns somit den Blick aus einer zweiten Perspektive auf kognitive und nicht-kognitive Fähigkeiten der Patienten in den untersuchten Studienphasen. Wie in den vorherigen Tests konnten jedoch auch bei diesem Test keine signifikanten Unterschiede vermerkt werden. Folglich lassen sich über die Befindlichkeit der Patienten während der 4T-Studie zwei Aussagen treffen: Zum einen erreichten die Werte der Patienten in den durchgeführten Tests, die eine große Spannbreite der physischen und psychischen Befindlichkeit abdecken, unter der empirisch gewählten T4-Substitutionstherapie ein immer durchschnittliches und teilweise überdurchschnittliches Niveau. Dieses Ergebnis sollte zusätzlich im Hintergrund der Tatsache betrachtet werden, dass diese Tests keine oder eine nur unzureichende altersbezogene Beurteilung erlauben, da sie anhand jüngerer 59 Testpopulationen validiert wurden, was sich bei dem hohen Altersdurchschnitt der 4T-Patienten möglicherweise als nachteilig erwiesen haben könnte. Zum anderen ergaben sich in den beiden alternativen Therapien („optimierte“ Thyroxindosis beziehungsweise T3/T4-Kombinationstherapie) keine signifikanten Veränderungen. Dies kann entweder bedeuten, dass sich die Phasen KG-A-T4 und die KG-A-T3T4 auf die Befindlichkeit weder vor- noch nachteilig ausgewirkt haben oder dass die Tests, um feine Unterschiede zu beurteilen, nicht ausreichend sind. Letzteres steht im Einklang mit einem 2006 erschienenen Rewiev von Watt et al. über die krankheitsbezogene Lebensqualität bei Patienten mit Schilddrüsenerkrankungen [86]. Hier wurden die Ergebnisse von 75 Studien begutachtet. Einerseits zeigte sich, dass Patienten mit nicht therapierten Schilddrüsenerkrankungen auf den meisten Gebieten der durchgeführten Tests deutlich schlechtere Ergebnisse erzielten. Andererseits bestätigte sich, dass es bislang für die Schilddrüsensymptomatik noch keinen Test zur Auswertung der krankheitsbezogenen Lebensqualität gibt, der speziell auf dieses Krankheitsbild gerichtetet und dafür validiert ist. 60 5 Zusammenfassung In der 4T-Studie wurde erstmals die Wirkung einer Körpergewicht-adaptierten Thyroxindosis (KG-A-T4) von 1,6 µg/kg KG (Körpergewicht) gegenüber der empirisch ermittelten Thyroxindosis (EMP-T4) von durchschnittlich 1,2 µg/kg KG bei Patienten mit sekundärer Hypothyreose verglichen. Darüber hinaus sollten in einer dritten Studienphase (KG-A-T3T4) additive Wirkungen der Zugabe von Trijodthyronin im Verhältnis von 1:10 untersucht werden. Die Hypothese war, dass die „empirische Dosierung“ in einer subklinischen Hypothyreose resultiert, die sich körperlich und psychisch als nachteilig erweisen kann. In einer randomisierten, doppel-verblindeten, Placebo-kontrollierten, crossover-Studie wurde anhand diverser Laborparameter, Zulewski Score, Achillessehnenreflexzeit und 7 Tests für Kognition und Befindlichkeit untersucht, ob die gewichtsadaptierte Thyroxindosis, beziehungsweise die Kombination aus Trijodthyronin und Thyroxin der bisherigen Thyroxintherapie überlegen ist. In Phase KG-A-T4 befanden sich die Serum-Spitzenspiegel für fT3 und fT4 leicht oberhalb des Referenzbereiches, der Zulewski-Score verbesserte sich in den „euthyreoten“ Bereich Normmittelwerten an. und In die der Achillessehnenreflexzeit Phase KG-A-T3T4 näherte sich den normalisierte sich die Achillessehnenreflexzeit, der gemessene fT3-Serumspiegel lag jedoch in den Morgenstunden bei der Mehrzahl der Patienten deutlich über dem Normbereich, was langfristig zu Nebenwirkungen führen kann. Die Tests für Kognition und Befindlichkeit belegten einen guten Ausgangszustand der 4T-Patienten in EMP-T4, der sich in den beiden anderen Studienphasen kaum veränderte. Zusammenfassend ist die Substitutionstherapie der sekundären Hypothyreose mit einer gewichtsadaptierten Dosis von 1,6 µg/kg KG Thyroxin sinnvoll und der „empirischen Dosisermittlung“ - geleitet von den fT3 und fT4 Werten - überlegen. Im Verlauf sollte die Dosis mit dem Ziel, hochnormale fT4 Werte zu erreichen, individuell angepasst werden. Für das T3/T4-Kombinationspräparat ist festzustellen, dass es zusätzliche positive Effekte hat, aber wegen der ungünstigen Pharmakokinetik nicht zur Therapie empfohlen werden kann. Dies soll als Anregung für weitere Untersuchungen gelten. 61 6 Abkürzungsverzeichnis 4T Thyroxin versus Trijodthyronin plus Thyroxin ADH Antidiuretisches Hormon ACTH Adenocorticotropes Hormon AE Adverse Events ART Achillessehnenreflexzeit BMI body mass index EKG Elektrokardiogramm EMP-T4 empirisches Thyroxin eta2 Effektstärke FSH Follikel stimulierendes Hormon fT3 freies Trijodthyronin im Serum fT4 freies Thyroxin im Serum GBB Gießener Beschwerdebogen GH Wachstumshormon GSI global severity index gT3 gesamtes Trijodthyronin im Serum gT4 gesamtes Thyroxin im Serum HF Herzfrequenz HVL Hypophysenvorderlappen KG Körpergewicht KG-A-T4 Körpergewicht-adaptiertes Thyroxin KG-A-T3T4 Körpergewicht-adaptiertes Trijodthyronin und Thyroxin LH Luteinisierendes Hormon 62 MRT Magnetresonanztomographie OP Operation PSDI positive symptom distress index PST positive symptom total RR Blutdruck nach Riva-Rocci SCL-90-R Symptomcheckliste nach Derogatis - Deutsche Version SF-36 Fragebogen zum Gesundheitszustand SH Subklinische Hypothyreose STABW Standardabweichung T3 Trijodthyronin T4 Thyroxin TAP Testbatterien zur Aufmerksamkeitsprüfung TBG Thyroxin bindendes Globulin TG Thyreoglobulin TSH Thyroidea stimulierendes Hormon TRH Thyreotropin releasing Hormon V1-4 Visiten 1-4 WMS Wechsler Memory Scale Z.n. Zustand nach 63 7 Tabellen- und Abbildungsverzeichnis Tabelle 1: Zulewski Score (Bogen) Tabelle 2: Patientencharakteristika Tabelle 3: Summe der berichteten Nebenwirkungen Tabelle 4: Zulewski Score Tabelle 5: Testbatterie zur Aufmerksamkeitsprüfung (TAP) Tabelle 6: Zahlenspanne (WMS) Tabelle 7: SCL-90-R Abbildung 1: Regelkreis der Schilddrüse Abbildung 2: Makroadenom der Hypophyse (MRT) Abbildung 3: Schema des Studienablaufs Abbildung 4: fT3 und fT4 Kinetik Abbildung 5: Apparatur zur Messung der Achillessehnenreflexzeit Abbildung 6: Beispiel einer Reflexkurve Abbildung 7: Schema zur Rekrutierung der Patienten Abbildung 8: Übersichtsdiagramme für freies Thyroxin und freies Trijodthyronin Abbildung 9: Übersichtsdiagramm für Thyroidea stimulierendes Hormon Abbildung 10: Achillessehnenreflexzeiten der drei Phasen Abbildung 11: Visuelle Analogskala für Stimmung und körperliche Beschwerden Abbildung 12: SF-36 Abbildung 13: Gießener Beschwerdenbogen Abbildung 14: Fremdbeurteilung 64 8 Literaturverzeichnis 1. Alexopoulou O, Beguin C, De Nayer P, Maiter D (2004) Clinical and hormonal characteristics of central hypothyroidism at diagnosis and during follow-up in adult patients. Eur J Endocrinol. 2004;150:1-8. 2. Andersen S, Pedersen KM, Bruun NH, Laurberg P (2002) Narrow individual variations in serum T(4) and T(3) in normal subjects: a clue to the understanding of subclinical thyroid disease. J Clin Endocrinol Metab. 2002 Mar;87(3):1068-72. 3. Appelhof BC, Fliers E, Wekking EM, Schene AH, Huyser J, Tijssen JG, Endert E, van Weert HC, Wiersinga WM (2005) Combined therapy with levothyroxine and liothyronine in two ratios, compared with levothyroxine monotherapy in primary hypothyroidism: a double-blind, randomized, controlled clinical trial. J Clin Endocrinol Metab. 2005 May;90(5):2666-74. Epub 2005 Feb 10. 4. Asteria C, Persani L, Beck-Peccoz P (2000) Central hypothyroidism: Consequences in adult life. J Ped Endocrinol Metab. 2001;14(5):1263-9. 5. Auer J, Scheibner P, Mische T, Langsteger W, Eber O (2001) Subclinical hypothyroidism as a risk factor for atrial fibrillation. Am Heart J. 2001 Nov;142(5):838-42. 6. Bakiri F (1999) TSH-determination in central hypothyroidism. Ann Endocrinol (Paris). 1999 Nov;60(5):422-6. 7. Beck-Peccoz P, Amr S, Menezes-Ferreira MM, Faglia G, Weintraub BD (1985) Decreased receptor binding of biologically inactive thyrotropin in central hypothyroidism. Effect of treatment with thyrotropin-releasing hormone. N Engl J Med. 1985 Apr 25;312(17):1085-90. 8. Beck-Peccoz P, Persani L (1994) Variable biological activity of thyroid stimulating hormone. Eur J Endocrinol. 1994 Oct;131(4):331-40. 9. Bianco AC, Salvatore D, Gereben B, Berry MJ, Larsen PR (2002) Biochemistry, cellular and molecular biology and physiological roles of the iodothyronine selenodeiodinases. Endocr Rev. 2002 Feb;23(1):38-9. 65 10. Biondi B, Klein I (2004) Hypothyroidism as a risk factor for cardiovascular disease. Endocrine. 2004 Jun;24(1):1-13. 11. Biondi B, Klain M, Schlumberger M, Filetti S, Lombardi G (2005) Subclinical hypothyroidism: clinical features and treatment options. Eur J Endocrinol. 2005 Jan;152(1):1-9. 12. Brähler E, Scheer JW (1995) Gießener Beschwerdebogen (GBB). Handanweisung. 2., ergänzte und revidierte Auflage. Hogrefe Verlag. 13. Braverman LE, Ingbar SH, Sterling K (1970) Conversion of thyroxine to triiodothyronine in athyreotic human subjects. J Clin Invest. 1970;49:855-64. 14. Bullinger M, Kirchberger I (1998) SF 36 Fragebogen zum Gesundheitszustand. Handanweisung. Hargrefe Verlag für Psychologie. 15. Bunevicius R, Kazanavicius G, Zalinkevicius R, Prange AJ Jr (1999) Effects of thyroxine as compared with thyroxine plus triiodothyronine in patients with hypothyroidism. N Engl J Med. 1999 Feb 11;340(6):424-9. 16. Canaris GJ, Manowitz NR, Mayor G, Ridgway EC (2000) The Colorado thyroid disease prevalence study. Arch Intern Med. 2000 Feb 28;160(4):526-34. 17. Canturk Z, Cetinarslan B, Tarkun I, Canturk NZ, Ozden M (2003) Lipid profile and lipoprotein (a) as a risk factor for cardiovascular disease in women with subclinical hypothyroidism. Endocr Res. 2003;29:307-16. 18. Caraccio N, Ferrannini E, Monzani F (2002) Lipoprotein profile in subclinical hypothyroidism: response to levothyroxine replacement, a randomized placebo-controlled study. J Clin Endocrinol Metab. 2002;87:1533-8. 19. Case CC, Jones PH, Nelson K, O’Brien Smith E, Ballantyne CM (2002) Impact of weight loss on the metabolic syndrome. Diabetes Obes Metab. 2002 Nov; 4(6):407-14. 20. Clyde PW, Harari AE, Etka EJ, Shaker KM (2003) Combined levothyroxine and liothyronine hypothyroidism: compared a with randomized levothyroxine controlled trial. alone JAMA. in primary 2003 Dec 10;290(22):2952-8. 21. Cooper DS, Halpern R, Wood LC, Levin AA, Ridgway EC (1984) L Thyroxine therapy in subclinical hypothyroidism. A double blind, placebo controlled trial. Ann Intern Med. 1984 Jul;101(1):18-24. 66 22. Escobar-Morreale Botella HF, Botella-Carretero JI, Gomez-Bueno M, Galan JM, Barrios V, Sancho J (2005) Thyroid hormone replacement therapy in primary hypothyroidism: a randomized trial comparing L thyroxine plus liothyronine with L-thyroxine alone. Ann Intern Med. 2005 Mar 15;142(6):412-24. Summary for patients in: Ann Intern Med. 2005 Mar 15;142(6):155. 23. Escobar-Morreale HF, del Rey FE, Obregon MJ, de Escobar GM (1996) Only the combined treatment with thyroxine and triiodothyronine ensures euthyroidism in all tisues of the thyroidectomized rat. Endocrinology. 1996 Jun;137(6):2490-502. 24. Escobar-Morreale HF, Obregon MJ, Escobar del Rey F, Morreale de Escobar G (1995) Replacement therapy for hypothyroidism with thyroxine alone does not ensure euthyroidism in all tissues, as studied in thyroidectomized rats. J Clin Invest. 1995 Dec;96(6):2828-38. 25. Esposito S, Prange AJ Jr, Golden RN (1997) The thyroid axis and mood disorders: overview and future prospects. Psychopharmacol Bull. 1997 Feb;33(2):205-17. 26. Fachinformation Berlin Chemie, Trijodthyronin BC 50, Februar 2001. 27. Faglia G, Bitenski L, Pinchera A, Ferrari C, Paracchi A, Beck-Peccoz P, Ambrozi B, Spada A (1979) Thyrotropin secretion in patients with central hypothyroidism: evidence for reduced biological activity of immunoreactive thyrotropin. J Clin Endocrinol Metab. 1979 Jun;48(6):989-98 28. Ferretti E, Persani L, Jaffarain-Rea ML, Giambona S, Tamburrano G, BeckPeccoz P (1999) Evaluation of the adequacy of levothyroxine replacement therapy in patients with central hypothyroidism. J Clin Endocrinol Metab. 1999 Mar;84(3):924-9. 29. Fish LH, Schwartz HL, Cavanaugh J, Steffes MW, Bantle JP, Oppenheimer JH (1987) Replacement dose, metabolism and bioavailability of levothyroxine in the treatment of hypothyroidism. Role of triiodothyronine in pituary feedback in humans. N Engl J Med. 1987 Mar 26;316(13):764-70. 30. Franke G (2002) SCL 90R. Symptom-Checkliste von L.R. Derogatis. Deutsche Version. Handanweisung, 2. ed. Beltz Test GmbH. 67 31. Göller K, Waibel F, Borm K, Slawik M, Reincke M (2004) Central hypothyroidism: a cross sectional study evaluating cognitive and metabolic effects of thyroxin replacement Therapy. Exp Clin Endocrino Supp.1. 32. Härting C, Markowitsch H, Neufeld H, Calabrese P, Deisinger K, Kessler J (2000) Wechsler Gedächtnis Test – Revidierte Fassung (WMS-R). Hogrefe, Göttingen. 33. Haggerty JJ Jr, Stern RA, Mason GA, Beckwith G, Morey CE, Prange AJ Jr (1994) Subclinical hypothyroidism: a modifiable risk factor for depression? Am J Psychiatry. 1994 Mar;151(3):453-4. 34. Hak AE, Pols HA, Visser TJ, Drexhage HA, Hofman A, Witteman JC (2000) Subclinical hypothyroidism is an independent risk factor for artherosklerosis and myocardial infarction in elderly woman: the Rotterdam Study. Ann Intern Med. 2000 Feb 15;132(4):270-8. 35. Hennemann G, Docter R, Visser TJ, Postema PT, Krenning EP (2004) Thyroxine plus low-dose, slow-release triiodothyronine replacement in hypothyroidism: proof of principle. Thyroid. 2004 Apr;24(4):271-5. 36. Imaizumi M, Akahoshi M, Ichimaru S, Nakashima E, Hida A, Soda M, Usa T, Ashizawa K, Yokohama N, Maeda R, Nagataki S, Eguchi K (2004) Risk for ischemic heart disease and all-cause mortality in subclinical hypothyroidism. J Clin Endocrinol Metab. 2004 Jul;89(7):3365-70. 37. Jorde R, Waterloo K, Storhaug H, Nyrnes A, Sundsfjord J, Jenssen TG (2006) Neuropsychological function and symptoms in subjects with subclinical hypothyroidism and the effect of thyroxine treatment. J Clin Endocrinol Metab 2006 Jan1;91(1):145-153. 38. Jorgensen JO, Moller J, Laursen T, Orskov H, Christiansen JS, Weeke J (1994) Growth hormone administration stimulates energy expenditure and extrathyroidal conversion of thyroxine to triiodothyronine in a dose-dependent manner and suppresses circadian thyrotropin levels: studies in GH-deficient adults. Clin Endocrinol (Oxf). 1994 Nov;41(5):609-14. 39. Jublanc C, Bruckert E (2004) Hypothyroidism and cardiovascular disease: role of new risk factors and coagulation parameters. Semin Vasc Med. 2004 May;4(2):145-51. 40. Kessler J, Denzler P, Markowitsch HJ (1999) Demenz-Test, 2. ed. Hogrefe, Göttingen. 68 41. Khaleeli AA, Griffith DG, Edwards RH (1983) The clinical presentation of hypothyroid myopathy and its relationship to abnormalities in structure and function of skeletal muscle. Clin Endocrinol (Oxf). 1983 Sep;19(3):365-76. 42. Khurana AK, Sinha RS, Ghorai BK, Bihari N (1990) Ankle reflex photomotogramm in thyroid disfunctions. J Assoc Physicians India. 1990 Mar;38(3):210-3. 43. Kventy J, Heldgaard PE, Bladbjerg EM, Gram J (2004) Subclinical hypothyroidism is associated with a low-grade inflammation, increased triglyceride levels and predicts cardiovascular disease in males below 50 years. Clin Endocrinol (Oxf). 2004 Aug;61(2):232-8. 44. Lauer M, Fallgatter A, Zielasek J (2005) Subclinical Hypothyroidism: The psychatric dimension. Der Nuklearmediziner. Schilddrüsen-update (Originaltext auf deutsch) 2005;28:89-91. 45. Laurberg P, Jakobsen PE, Hoeck HC, Vestergaard P (1994) Growth hormone and thyroid function: is secondary thyroid failure underdiagnosed in growth hormone deficient patients? Thyroidology. 1994 Dec;6(3):73-9. Review. 46. Lawson JD (1958) The free Achilles reflex in hypothyroidism and hyperthyroidism. N Engl J Med. 1958 Oct 16;259(16):761-4. 47. Le Boff MS, Kaplan Mm, Silva JE, Larsen PR (1982) Bioavailability of thyroid hormones from oral replacement preparations. Metabolism. 1982 Sep;31(9):900-5. 48. Lee KO, Persani L, Tan M, Sundram FX, Beck-Peccoz P (1995) Thyrotropin with decreased biological activity, a delayed consequence of cranial irradiation for nasopharyngeal carcinoma. J Endocrinol Invest. 1995 Nov;18(10):800-5. 49. Leitlinien der Deutschen Gesellschaft für Kardiologie zur Primärprävention kardiovaskulärer Erkrankungen 2005, Zeitschrift für Kardiologie, Band 94, Supplement 3. 50. Luboshitzki R, Aviv A, Herer P, Lavie L (2002) Risk factors for cardiovascular disease in women with subclinical hypothyroidism. Thyroid. 2002 May;12(5):421-5. 51. Meier C, Staub JJ, Roth CB, Gugliemetti M, Miserez AR, Drewe J, Huber P, Herzog R, Muller B (2001) TSH-controlled L-thyroxine therapy reduces cholesterol levels and clinical symptoms in subclinical hypothyroidism: a 69 double blind, placebo-controlled trial (Basel Thyroid Study). J Clin Endocrinol Metab. 2001 Oct; 86(10):4860-6. 52. Minniti G, Esposito V, Piccirilli M, Fratticci A, Santoro A, Jaffrain-Rea ML (2005) Diagnosis and management of pituitary tumors in the elderly: a revive based on personal experience and evidence of literature. Hormone replacement in hypopituitarism. Eur J Endocrinol. 2005;153:723-35. 53. Monzani F, Carccio N, Siciliano G, Manca L, Ferrannini E (1997) Clinical and biochemical features of muscle dysfunction in subclinical hypothyroidism. J Clin Endocrinol Metab. 1997 Oct;82(10):3315-8. 54. Monzani F, Del Guerra P, Caraccio N, Pruneti CA, Pucci E, Luisi M, Baschieri L (1993) Subclinical hypothyroidism: neurobehavioral features and beneficial effect of L-thyroxine treatment. Clin Investig. 1993 May;71(5):367 71. 55. Moreley JE (1981) Neuroendocrine control of thyrotropin secretion. Endocr Rev. 1981 Fall;2(4):396-436. 56. Mucklow JC, Baker DJ (1970) Ankle reflex timing as a screening procedure for the detection of hypothyroidism. Br J Prev Soc Med. 1970 Feb;2481):16-7. 57. Murray GM (1891) Note on the treatment of myxedema by hypodermic injections of an extract of the thyroid gland of a sheep. Br Med J. 1891;2:796 7. 58. Mya MM, Aronow WS (2002) Subclinical hypothyroidism is associated with coronary artery disease in older persons. J Gerontol A Biol Sci Med Sci. 2002 Oct;57(10):M658-9. 59. Nordyke RA, Gilbert FI Jr (1967) Mass screening for hypothyroidism by the Achilles reflex time. Arch Environ Health. 1967 Jun;14(6):827-31. 60. Nuki G, Bayliss RI (1968) The Achilles tendon reflex as an index of thyroid function. Postgrad Med J. 1968 Jan;44(507):97-102. 61. Ooi TC, Withlock RM, Frengley PA, Ibbertson HK (1980) Systolic time intervals and ankle reflex time in patients with minimalserum TSH elevation: response to triiodothyronine therapy. Clin Endocrinol (Oxf). 1980 Dec;13(6):621-7. 62. Oppenheimer JH, Braverman LA, Toft A, Jackson IM, Ladenson PW (1995) Thyroid hormone treatment: When and wath? A therapeutic controversy. J Clin Endocrinol Metab. 1995 Oct;(80)10:2873-6. 70 63. Parle JV, Maisonneuve P, Sheppard MC, Boyle P, Franklin JA (2001) Prediction of all-cause and cardiovascular mortality in elderly people from one low serum thyrotropin result: a 10-year cohort study. Lancet. 2001 Sep15;358(9285):861-5. 64. Peper M, Klett M, Morgenstern R (2005) Neurophysiological effects of chronic low-dose exposure to polychlorinated biphenyls (PCBs): a cross sectional study. Environ Health 4. 65. Persani L, Ferretti E, Borgato S, Faglia G, Beck-Peccoz P (2000) Circulating thyrotropin bioactivity in sporadic central hypothyroidism. J Clin Endocrinol Metab. 2000 Oct;85(10):3631-5. 66. Porretti S, Giavoli C, Ronchi C, Lombardi G, Zaccaria M, Valle D, Arosio M, Beck-Peccoz P (2002) Recombinant human GH replacement therapy and thyroid function in a large group of adult GH-deficient patients: when does LT(4) therapy become mandatory? J Clin Endocrinol Metab. 2002;87:2042-5. 67. Rassoul F, Richter V, Kuhlmann E, Heberling HJ, Homann M, Zuck U, Rotzsch W, Lohmann D (1988) Lipoprotein metabolism in patients with disordered thyroid gland function before and following therapy. Dtsch Z Verdau Stoffwechselerkr. 1988;48(2):104-11. (Originalartikel auf deutsch). 68. Razvi S, Ingoe LE, McMillan CV, Weaver JU (2005) Health status in patients with sub-clinical hypothyroidism. Eur J Endocrinol. 2005 May 1;152(5):713717. 69. Rose SR, Lusig RH, Pitukcheewanont P, Broome DC, Burghen GA, Li H, Hudson MM, Kun LE, Heideman RL (1999) Diagnosis of hidden central hypothyroidism in survivors of childhood cancer. J Clin Endocrinol Metab. 1999 Dec;84(12):4472-9. 70. Rose SR, Manasco PK, Pearce S, Nisula BC (1990) Hypothyroidism and deficiency of the nocturnal thyrotropin surge in children with hypothalamic pituitary disorders. J Clin Endocrinol Metab. 1990 Jun;70(6):1750-5. 71. Salter AM, Hayashi R, al-Seeni M, Brown NF, Bruce J, Sorensen O, Atkinson EA, Middelton B, Bleackley RC, Brindley DN (1991) Effects of hypopituitarism and high-fat feeding on mRNA concentrations for the low density-lipoprotein receptor and on acyl-CoA: cholesterol acyltranferase activities in rat liver. Biochem J. 1991 Jun 15;276(Pt3):825-32. 71 72. Saravannan P, Simmons DJ, Greenwood R, Peters TJ, Dayan CM (2005) Partial substitution of thyroxine (T4) with tri-iodothyronine in patients on T4 replacement therapy: results of a large community-based randomized controlled trial. J Clin Endocrinol Metab. 2005 Feb;90(2):805-12. Epub 2004 Dec 7. 73. Sawin CT, Geller A, Wolf PA, Belanger AJ, Bacharach P, Wilson PW, Benjamin EJ, D’Agostion RB (1994) Low serum thyrotropin concentrations as a risk factor for atrial fibrillation in older persons. N Engl J Med. 1994 Nov10;331(19):1249-52. 74. Sawka AM, Gerstein HC, Marriott MJ, MacQueen GM, Joffe RT (2003) Does a combination regimen of thyroxine (T4) and 3,5,3’-triiodothyronine improve depressive symptoms better than T4 alone in patients with hypothyroidism? Results of a double-blind, randomized, controlled trial. J Clin Endocrinol Metab. 2003 Oct;88(10):4551-5. 75. Serter R, Demibras B, Korukluoglu B, Culha C, Cakal E, Aral Y (2004) The effect of L-thyroxine replacement therapy on lipid based cardiovascular risk in subclinical hypothyroidism. J Endocrinol Invest. 2004 Nov;27(10):897-903. 76. Siegmund W, Spieker K, Weike AI, Giessmann T, Modess C, Dabers T, Kirsch G, Sanger E, Engel G, Hamm AO, Nauck M, Meng W (2004) Replacement therapy with levothyroxine plus triiodothyronine (bioavailable molar ration 14:1) is not superior to thyroxine alone to improve well-being and cognitive performance in hypothyroidism. Clin Endocrinol (Oxf). 2004 Jun;60(6):750-7. 77. Shimon I, Cohen O, Lubetsky A, Olchovski D (2002) Thyrotropin suppression by thyroid hormone replacement is correlated with thyroxine level normalization in central hypothyroidism. Thyroid. 2002;12:823-7. 78. Smith JC (2004) Hormone replacement therapy in hypopituitarism. Expert Opin Pharmacother. 2005;5:1023-31. 79. Staub JJ, Althaus BU, Engler H, Ryff AS, Trabucco P, Marquart K, Burckhardt D, Girard J, Weintraub BD (1992) Spectrum of subclinical and overt hypothyroidism: effect on thyrotropin, prolactin, and thyroid reserve, and metabolic impact on peripheral target tissues. Am J Med. 1992 Jun;92(6):631-42. 72 80. Stock JM, Surks MI, Oppenheimer JH (1974) Replacement dosage of L thyroxine in hypothyroidism: a re-evaluation. N Engl J Med. 1974;290:52933. 81. Surks MI, Oritz E, Daniels GH, Sawin CT, Col NF, Cobin RH, Franklin JA, Hershman JM, Burman KD, Denke MA, Gorman C, Cooper RS, Weissman NJ (2004) Subclinical thyroid disease: scientific review and guidelines for diagnosis and management. JAMA. 2004 Jan 14;291(2):228-38. 82. Tigas S, Idiculla J, Beckett G, Toft A (2000) Is exessive weight gain after ablative treatment of hyperthyroidism due to the inadequate thyroid hormone therapy? Thyroid. 2000 Dec;10(12):1107-11. 83. Toft AD (1999) Thyroid hormone replacement—one hormone or two? N Engl J Med. 1999;340:469-70. 84. Tomlinson JW, Holden N, Hills RK, Wheatly K, Clayton RN, Bates AS, Sheppard MC, Stewart PM (2001) Association between premature mortality and hypopituitarism. West Milands Prospective Hypopituitary Study Group. Lancet. 2001 Feb 10;357(9254):425-31. 85. Walsh JP, Shiels L, Lim EM, Bhagat CI, Ward LC, Stuckey BG, Dhaliwal SS, Chew GT, Bhagat MC, Cusson AJ (2003) Combined thyroxine/liothyronine treatment does not improve well-being, quality of life, or cognitive function compared to thyroxine alone: a randomized controlled trial in patients with primary hypothyroidism. J Clin Endocrinol Metab. 2003 Oct;88(10)4543-50. 86. Watt T, Groenvold M, Rasmussen AK, Bonnema SJ, Hegedus L, Bjorner JB, Feldt-Rasmussen U (2006) Quality of life in patients with benign thyroid disorders. A review. Eur J Endocrinol 2006 Apr;154(4):501-510. 87. Wechsler D (1945) A standardized memory scale for clinical use. J Psychol. 1945:37-95. 88. Zimmermann MP, Fimm B (2000) Testbatterie zur Aufmerksamkeitsprüfung (TAP), Herzogenrath. 89. Zulewski H, Muller B, Exer P, Miserez AR, Staub JJ (1997) Estimation of tissue hypothyroidism by a new clinical score: evaluation of patients with various grades of hypothyroidism and controls. J Clin Endocrinol Metab. 1997 M;82(3):771-6. 73 9 Publikationen Originalarbeit: Slawik M, Klawitter B*, Meiser E*, Schories M, Zwermann O, Borm K,Peper M, Lubrich B, Hug MJ, Nauck M, Olschewski M, Beuschlein F, Reincke M (2007) Towards better understanding of optimal thyroid hormone replacement in central hypothyroidism: A randomized controlled trial comparing two doses of thyroxine with a combination of thyroxine and triiodothyronine. J Clin Endo Metab. 2007 (im Druck). Kongressbeitrag: Slawik M, Klawitter B*, Meiser E*, Borm K, Zwermann O, Beuschlein, Schories M, Reincke M (2005). Triiodothyronine supplementation improves lipid parameters in central hypothyroidism: a randomized controlled trial (“4T-study”). Exp Clin Endocrinol Diabetes. 2005; 113(S1):V6_54. *gleichwertige Autorenschaft. 74 10 Danksagung Allen Personen, die mich bei der Entstehung dieser Arbeit unterstützt haben, möchte ich von Herzen danken: Dr. Marc Slawik für die freundschaftliche und kompetente Betreuung, für die Geduld, die Hilfe und den Optimismus. Tausend Dank!!! Prof. Dr. Martin Reincke für die vertrauensvolle Überlassung dieses Themas und der großen Unterstützung seither. Prof. Dr. Hans-Peter Zahradnik für die freundliche Übernahme des Koreferats. Prof. Dr. Felix Beuschlein, Dr. Katrin Borm, Dr. Marcus Schories, Dr. Oliver Zwermann für die Betreuung in der Ausführung und Interpretation. Dr. Björn Klawitter für die faire Zusammenarbeit und das gute Vorbild. Marlies Eichler, Elsbeth Peper, Jasmin Ménard, Nicole Rombach, Simone Hohler, Andreas Rynk, Uwe Bochning und Timm Stahl für die freundliche Hilfe bei der Betreuung der Patienten und im Labor. Clara Martinez für die stetige Aufmunterung. PD Dr. Markus Nauck, Dr. Armin Buchwald, Dr. Alexandra Göbel und Dr. Beate Lubrich für die kollegiale Zusammenarbeit in Zentrallabor und Klinikapotheke. Prof. Dr. Martin Peper für die gute Beratung psychologischem Gebiet. Herrn Dipl.-Stat. Manfred Olschewski für die statistische Betreuung. Den 4T-Patienten für die vertrauensvolle Bereitschaft an dieser Studie teilzunehmen, für die uns geopferte Kraft und Zeit, für die Geduld und die gute Zusammenarbeit. Meiner ganzen Familie, die mich auf meinem Weg stets unterstützte und mir Liebe, Kraft und Hoffnung gab, insbesondere meinen Eltern, die diesen Weg ermöglichten. Frederik dafür, dass Du an meiner Seite bist. Johannes und Lara für die große Freude. 75 11 Lebenslauf PERSÖNLICHE DATEN 3. April 1977 Geboren in Bukarest/ Rumänien Familienstand Verheiratet, zwei Kinder SCHUL- UND HOCHSCHULAUSBILDUNG 1983-1990 Besuch der deutsch-rumänischen Schule in Bukarest Juli 1997 Abitur am Alexander von Humboldt Gymnasium Konstanz Oktober 1997 Beginn des Studiums der Humanmedizin an der Universität des Saarlandes 17.September 1999 Ärztliche Vorprüfung März 2000 Famulatur in der Neurochirurgie in Kreuzlingen/Schweiz August 2000 Famulatur in der Inneren Medizin in Bukarest/Rumänien Oktober 2000 - Erasmusaufenthalt in Nancy/Frankreich, Praktika in der Juli 2001 Inneren Medizin, Allgemeinchirurgie und Kinderchirurgie 22.März 2000 Erstes Staatsexamen Juli/August 2001 Praxisfamulatur in der Orthopädie in Konstanz Oktober 2001 - Erasmusaufenthalt in Coimbra/Portugal, Famulatur in der Juli 2002 Gynäkologie 31.März 2003 Zweites Staatsexamen Mai-August 2003 PJ-Tertial Chirurgie an der Universitätsklinik Homburg-Saar Oktober 2003 - Teilzeit-PJ-Tertial Innere Medizin an der Mai 2004 Universitätsklinik Freiburg, Beginn der Promotionsarbeit Mai-August 2004 PJ-Tertial Urologie an der Uniklinik Freiburg 12.November 2004 Drittes Staatsexamen BERUFLICHE AUSBILDUNG Januar 2005 - Assistenzärztin in der chirurgischen Abteilung der Helios- Sepember 2006 Klinik Herbolzheim Aktuell Assistenzärztin in der chirurgischen Abteilung des Kreiskrankenhauses Emmendingen