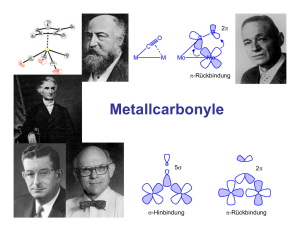
Aufgabenblatt 6.2
Werbung

Seminar „Anorganische Chemie“ für Lehramtskandidaten Aufgaben 6.2: Übergangsmetalle – Koordinative Bindung 1. Bestimmen Sie die Valenzelektronenzahlen in folgenden Komplexen: a) [Fe(PF3)5] b) [V(CO)6]c) [PtF6] d) [Co(H2O)6]2+ e) [Os(Cl)6]2- f) [W(CN)8]4- g) [V(C2O4)3]3- h) [Ni(CNR)4] 2. Berechnen Sie die Größe des magnetischen Momentes in Bohrschen Magnetonen für folgende Komplexe: a) [CrCl6]3- b) [FeCl4]- c) [Co(en)3]3+ d) [MnF6]33. Entscheiden und begründen Sie, welches der Ionen die stärkste Kationensäure ist: a) Ce3+ vs. Ce4+ b) Fe2+, Co2+, Ni2+ 4. Beschreiben Sie die Bindungsverhältnisse in folgenden Komplexen mit der VB-Methode: a) [Mn(CN)6]4- (1 ungepaartes Elektron) b) [Co(OH2)6]2+ (3 ungepaarte Elektronen) c) [Co(NH3)6]2+ (1 ungepaartes Elektron) d) [PtCl4] 2- (0 ungepaarte Elektronen) 5. Von folgenden Paaren ist ein Komplex high spin einer low spin. Was ist was? a) [Co(NH3)6]2+, [Co(NH3)6]3+ b) [Fe(CN)6]3-, [FeCl4]6. Erklären Sie die unterschiedlichen Ligandenfeldaufspaltungen (10 Dq) für folgende Cobaltammin-Komplexe: a) [Co(NH3)6]3+: 22900 cm-1 b) [Co(NH3)6]2+: 10200 cm-1 c) [Co(NH3)4]2+: 5900 cm-1 7. Berechnen Sie die Kristallfeldstabilisierungsenergie in Einheiten von Dq für folgende Komplexe: a) [Ti(OH2)6]3+ b) high-spin [Mn(OH2)4]2+ 2+ c) low-spin [Fe(edta)] d) [ZnCl4]2e) [MoF6]3f) [CoCl4]28. Mit phen bezeichnet man den zweizähnigen Liganden 1,10-Phenantrolin, C8H6N2. Erklären Sie, warum [Fe(phen)3]2+ diamagnetisch ist, während sich [Fe(phen)2(OH2)2]2+ paramagnetisch verhält. N 9. Der Nickelkomplex Ni(PPh3)2Cl2 ist paramagnetisch, während der analoge Palladiumkomplex diamagnetisch ist. a) Geben Sie eine Erklärung für diese Beobachtung. b) Wie viele Isomere würden Sie jeweils erwarten? 10. Nebenstehend sind die Hydratationsenthalpien für die sechsfach koordinierte Dikationen der ersten Übergangsreihe gezeigt. Machen Sie sich zunächst klar, wie der gezeigte Verlauf zustande kommt. Wie sollte folglich die Kurve in folgenden Fällen aussehen: a) für die 2. Übergangsreihe. H0X M2+ (aq) + 6 H2O (l) X X N phen [M(OH2)6]2+ (aq) X X b) für die dreifach geladenen Ionen der ersten Ca Sc Ti V Cr Übergangsreihe. c) für die tetraedrisch koordinierten Dikationen der ersten Übergangsreihe. X X Mn Fe Co X X Ni Cu 11. Berechnen Sie die Kristallfeldstabilisierungsenergie für folgende Ionen aus den Energien ihrer Ligandenfeldbanden: a) [Cu(OH2)6] 2+: 13000 cm-1 b) [V(OH2)6] 3+: 18000 cm-1 c) [Co(OH2)6] 2+: 10000 cm-1 d) [Co(CN)6] 3-: 33500 cm-1. (1 cm-1 entspricht 11.96 J/mol) X Zn