Zeitschrift für Klinische Chemie
Werbung

Zeitschrift für Klinische Chemie
Herausgegeben von J o a c h i m B r u g s c h , Berlin-Dahlem, und E r n s t S c h ü t t e , Berlin-Dahlem
1. Jahrgang
August 1963
Heft 4 (S. 97—128)
StofFwechselwkkungen körperfremder Chelatbildner
Von
P. SIEGMUND
Aus dem Physiologisch-chemischen Institut der Freien Universität Berlin, Berlin-Dahlem
(Direktor: Prof. Dr. Dr. Ernst Schütte)
(Der Schriftleitung zugegangen am 8. Dezember 1962)
Die Gesetzmäßigkeiten der Chemie der Metallchelatverbindungen, die die Grundlage für das Verständnis der biologischen Wirkungen von Chelatbildnern sind, werden im ersten Abschnitt besprochen. Die folgenden Abschnitte
behandeln den Einfluß von Chelatbildnern auf den Stoffwechsel von Calcium, Zink, Kupfer und Eisen. Bestimmend
für diese Stoffwechselwirkungen sind einerseits die Konkurrenzreaktionen der Biometalle um die zugeführten Chelatbildner und andererseits die Stabilität der biogenen Metallkomplexe. Da sich der erste Faktor durch Auswahl der
Chelatbildner verändern läßt, ist es möglich die Wirkung auf ein bestimmtes Metall in den Vordergrund zu stellen.
The rules of metal chelation which serve as the basis for our understanding of the biological action of chelating
agents are discussed in the first section. The following sections deal with the effect of chelating agents on the
metabolism of calcium, zinc, copper and iron. The influence on metabolism is determined by competition between
the bio-metal ions for the chelating agent, and by the stability of the biological metal complexes. Since the first
factor can be controlled by the choice of complexing agents, it is possible to selectively chelate any one metal.
Die Bedeutung der Wechselbeziehungen zwischen
organischen Substanzen und Metallen für die chemischen
Umsetzungen in der belebten Natur wurde bei der Erforschung von Wirkungen der Komplexbildner Kohlenoxyd und Blausäure auf die Atmung erkannt (WARBURG,
1). Bei den Komplexbildnern zeichnen sich diejenigen,
die mehrere Bindungen mit einem Metallion unter
Bildung von Chelatringen eingehen können, durch eine
besondere Stabilität ihrer Metallverbindungen aus.
Wohlbegründete Vorstellungen über den Zusammenhang zwischen Stabilität und Struktur der Komplexe
und genaue Kenntnisse über Ausmaß und Bedingungen
der Komplexbildung vermitteln ein Verständnis ihrer
biologischen Wirkungen. Für diese sind chemische
Gleichgewichte maßgebend, die sich, wie bei anderen
lonenreaktionen, meist schnell einstellen.
Indessen gibt es Ausnahmen, insbesondere bei den
extrem stabilen Chelaten mit Porphyrinstruktur. — Es
ist nicht möglich, im Rahmen dieser Arbeit das umfangreiche Gebiet vollständig abzuhandeln. Über die
Chemie der Chelate gibt es Monographien (2—6); ihre
Bedeutung für Biologie und Medizin wird in drei
Symposien (7—9) besonders berücksichtigt.
Z. klin. Chem. / 1. Jahrg. 1963 / Heft 4
Definitionen
Chelate sind Komplexverbindungen, in denen ein
Metallkation an mehrere funktionelle Gruppen des
Chelatbildners oder Liganden koordinativ gebunden ist,
d. h. bei der Komplexbildung entstehen ein oder mehrere
Ringe. Die Atome oder Atomgruppen des Liganden,
die sich koordinativ mit dem Metallion verbinden,
nennt man Donatoren^ denn sie liefern die Bindungselektronen für diese Bindung. Die erste richtige Strukturformel für ein Metallchelat, und zwar die des Chelats
von Platin mit Acetylaceton, wurde von WERNER im
Jahre 1901 aufgestellt (10). Der Name „Chelat" für
solche Verbindungen wurde 1920 von MORGAN und
DREW (11) geprägt. Die Stabilitäts-, Bildungs- oder
Assoziationskonstante eines Chelats wird definiert als
rM
"MZ -
[MZ]
[M]
. [ZJ ·
wobei [MZ] die Konzentration des Chelats, [M] die
Metallionen-Konzentration und [Z] die Konzentration
des nichtprotonierten Liganden, der also weder mit
Metall- noch mit Wasserstoffionen assoziiert ist, bedeutet.
13
Siegmund: Stoffwechselwirkungen körperfremder Chelatbildner
98
Bestimmung von Stabilitätskonstanten
pH-Abhängigkeit der Komplexbildung
und
Für die Berechnung einer Gleichgewichtskonstanten
muß neben der Bruttozusammensetzung einer Lösung
(Gesamtkonzentrationen von Metall und Chelatbildner)
mindestens eine Gleichgewichtskonzentration bekannt
sein. Ihre unmittelbare Messung ist bei vielen Metallen
und Chelatbildnern nicht möglich. Die Bildung von
Komplexen oder Chelaten ist aber in bestimmten pHBereichen von der Acidität der Lösung abhängig,, da
Wasserstoff- und Metallionen um die gleichen Stellen
im Molekül des Liganden konkurrieren. BJERRUM (12)
benutzte diesen Effekt 1941 zur Bestimmung der Komplexbildungskonstanten einiger Schwermetallammoniakate. Bei dieser Methode mißt man die Gleichgewichtskonzentrationen der Wasserstoffionen bei den Reaktionen
NHL
Me
ii
(1)
Me(NH3)
und
NH4
NH3
+ H+
(2)
und berechnet aus den hieraus zu erhaltenden Gleichgewichtskonstanten dieser Reaktionen die Konstante
für die Reaktion
NH3 + Me
Me(NH3)
die als Stabilitätskonstante des Komplexes definiert ist.
Bei einzahiiigen Liganden wie NH3 ist die rechnerische
Auswertung kompliziert, da die Komplexbildung bis
zur maximalen Koordinationszahl stufenweise erfolgt
und für jede Stufe eine eigene Gleichgewichts konstante
gilt. Bei den vielzahnigen Chelatbildnern ist in verdünnten wäßrigen Lösungen dagegen oft nur die
Bildung eines einzigen Komplexes zu berücksichtigen,
und der Zusammenhang zwischen Wasserstoffionenkonzentrationen und Stabilitätskonstanten ist einfacher.
Es war daher ein Wendepunkt in der Chelatchemie
als SCHWARZENBACH und Mitarbeiter (13, 14) in den
Jahren 1945—1947 das Prinzip dieses Verfahrens zur Ermittlung der Stabilitätskonstanten von Erdalkalikomplexen der Äthylendiamintetraessigsäure („AeDTE")
(HOOCCH2)2NCH2CH2N(CH2COOH)2 und der Nitrilotriessigsäure („
") N(CH2COOH)3 benutzten. Sie
bestimmten die pH-Titrationskurven von
und
AeDTE in Abwesenheit und in Gegenwart eines
15 fachen Überschusses von Erdalkali-Ionen (Abb. 1).
Die Auswertung der Kurven ergab für die Stabilitätskonstante des Ca-NTE-Chelats den Wert 106*41, für
das Ca-AeDTE-Chelat den Wert 1010·70. Unter den
Versuchsbedingungen ist bei
nur die Bildung
eines einzigen Chekts zu berücksichtigen, dem die
Strukturformel gemäß Formel l zuzuschreiben ist. Das
Bestehen koordinativer Bindungen zu sämtlichen drei
Carboxylgruppen folgt aus dem Vergleich mit der
Stabilitätskonstanten des Ca-Chelats der Methyliminodiessigsäure CH3N(CH2COOH)2; das Fehlen einer Carboxylgruppe verringert die Konstante um 2,66 Zehnerpotenzen. Noch ausgeprägter ist die Abnahme der
KOH/AeOTE
Abb. l
pH-Titrationskurve von AeDTE in Abwesenheit bzw. Gegenwart
eines 15-fachen Überschusses von Calcium-Ionen
(nach SCHWARZENBACH)
Komplexbildung, wenn das Stickstoffätom quaternär
wird und somit für eine koordinative Bindung der
Metallionen nicht mehr zur Verfügung steht. Da
nur 4 der 6 koordinativen Valenzen des Ca-Ions beansprucht, sind zwei hydratisiert. Die Struktur des
Ca-AeDTE-Chelats (Formel 2) ergibt sich aus ent-
Formel l
Calcium-Chelat von Nitrilotriessigsäure „
"
co
Formel 2
Calcium-Chelat von Äthylendiamintetraessigsäure „AeDTE"
sprechenden Vergleichen. Bei AeDTE besteht im
mittleren pH-Bereich auch das einfach protonierte
Chelat (Hydrogenkomplex) bei dem ein N-Atom an Ca
und das andere an Wasserstoff koordinativ gebunden
ist. Die Stabilitätskonstante des Hydrogenkomplexes
ist um 7 Zehnerpotenzen kleiner als die des nichtprotonierten Chelats.
Z. klin. Chem. /1. Jahrg. 1963 / Heft 4
Siegmund: Stoffwechselwirkungen körperfremder Chelatbildner
Die pH-Abhängigkeit der Chelatbildung ist für die
Beurteilung der Metallbindung unter physiologischen
Bedingungen oft entscheidend, denn nur bei wenigen
Chelatbildnern ist die Assoziation mit -Ionen bei
neutraler Reaktion zu vernachlässigen. Bei Kenntnis
der Aciditätskonstanten der Chelatbildner kann man die
pH-Abhängigkeit der Komplexbildung berechnen.
WEITZEL und Mitarbeiter (15) nennen die für einen
pH-Wert von 7,2 gültige „Stabilitätskonstante" die
„physiologische Bindungskonstante" (Berechnung s.
4, 15). Die für diesen pH-Wert erforderliche Korrektur
ist bei verschiedenen Chelatbildnern sehr unterschiedlich; für Aminosäuren gelten bei neutraler Reaktion
meist Stabilitätskonstanten, die 2 bis 3 Zehnerpotenzen
kleiner sind als bei stark alkalischer Reaktion. Bei
Adenosinphosphaten und Phosphorsäureestern beträgt
die Korrektur nur etwa 10%, bei Oxysäuren, z. B.
Citronensäure ist keine Korrektur erforderlich.
Stabilitätskonstanten und Struktur des Chelatbildners (Chelateffekt)
Die Gliederzahl der Chelatringe besitzt einen entscheidenden Einfluß auf die Stabilität der Chelate.
SCHWARZENBACH (16, 17) hat diesen Zusammenhang
bei der in Formel 3 dargestellten Reaktion untersucht.
Hier unterscheidet sich das entstehende Chelat nur
durch den (mit Fettdruck hervorgehobenen) Chelatring
vom Ausgangsprodukt; dessen Bildungstendenz bestimmt also ausschließlich die Gleichgewichtslage. Die
Konstante für dieses Gleichgewicht ist der Quotient
der Stabilitätskonstanten des entstandenen und des
gespaltenen Chelats. In der Tabelle sind die Logarithmen
99
molekülen bevorzugt. Das entspricht dem ZiEGLERschen
Verdünnungsprinzip bei der Herstellung vielgliedriger
Kohlenstoffringe, und folgt auch aus den Gleichgewichtskonstanten, in die die Konzentrationen der 6zahnigen Liganden in der ersten, die des 3-zahnigen in
der zweiten Potenz eingehen. — Die Zunahme der
Komplexstabilität durch Bildung von Chelatringen bezeichnet man nach SCHWARZENBACH als „Cbelateffekt"'*}.
Er hat diesen Effekt so erklärt, daß nach Ausbildung
der ersten koordinativen Bindung die noch freien
Donatorgruppen sich nur noch in einem begrenzten
Raum um das Metallion bewegen können; dadurch
wird ihre Bindung an das Metallion viel wahrscheinlicher als die eines zweiten Moleküls. Das primäre
Reaktionsprodukt mit nur einer koordinativen Bindung
wird so aus dem Gleichgewicht entfernt und die Reaktion im Sinne einer vermehrten Komplexbildung verschoben. Je kleiner die Gliederzahl des entstehenden
Chelatringes ist, um so kleiner muß auch der Bewegungsraum für die noch freie Donatorgruppe sein und um so
größer ist die Wahrscheinlichkeit der Bildung des
Chelatringes. Der maximale Chelateffekt tritt indessen
bei 5-gliedrigen Ringen auf, denn bei kleineren Ringen
wirken auftretende Spannungen entgegengesetzt.
Chelate der Diaminocyclohexantetraessigsäure (Formel4)
besitzen größere Stabilitätskonstanten als die analogen
CH
Gliederzahl d e s Chelatringes
log K = Chelateffekt
5
5,2
6
1,7
7
0,1
8
/
—0,8
dieser Konstanten für verschiedene Größen der Chelatringe angegeben. Ein 5-gliedriger Chelatring erhöht die
Stabilitätskonstante um über 5 Zehnerpotenzen, beim
6-gliedrigen ist diese Erhöhung schon geringer, und
große Chelatringe tragen nicht mehr zur Stabilitätserhöhung bei. Indessen ist auch die Ausbildung großer
Chelatringe in sehr verdünnten Lösungen gegenüber
der Bildung von Komplexen mit mehreren Ligand-
+
xCH^
\:H2COOH
Formel 4
Diaminocyclohexantetraessigsäure
*) Gleichgewichtskonstanten stehen stets in einer einfachen Beziehung zur freien Normal-Enthalpie der Reaktion. Man kann
den Chelateffekt also auch in einem Energiemaß angeben. Im
angeführten Beispiel wird bei der Bildung eines 5-gliedrigen
Chelatringes pro Mol eine freie Enthalpie von etwa 7000 cal. verfügbar. Das ist die gleiche Größenordnung wie bei der hydrolytischen Spaltung einer sogenannten energiereichen Phosphatbindung.
CH2COOI "CHjCOCT
CH^COCT
Formel 3
Bestimmung des Chelateffektes
Z. klin. Chem. / 1. Jahrg. 1963 / Heft 4
13*
100
Sicgmund: Stoffwcchselwirkungen körperfremder Chelatbildner
Chelate von AeDTE (18). Beim Calcium-Chelat beträgt
der Unterschied fast 2 Zehnerpotenzen, obwohl Zahl
und Art der Chelatringe bei beiden Verbindungen
identisch sind. Die Deutung dieses Effekts ist analog
und wird durch Formel 5 veranschaulicht. Hier wird
eines Liganden auf die Stabilität der Chelate ist seiner
Natur nach unspezifisch und wirkt sich bei den meisten
Metallionen gleichartig aus. Es handelt sich um einen
Verstärkereffekt, der die Art der Bindungen nicht verändert, sondern durch die gegenseitige Anordnung der
Donatorgruppen die Komplexbildung begünstigt. In
bestimmten Fällen kann aber seine Größe von den
Metallionen abhängen, wenn nämlich unterschiedliche
Koordinationszahlen, verschiedene räumliche. Anordnung der koordinativen Valenzen oder erhebliche
Größenunterschiede bestehen.
Stabilitätskonstanten bei verschiedenen Donatorgruppen
Formel 5
Der Einfluß eines angegliederten Cyclohexanringes auf
den Chelateffekt
die Komplexbildung von Äthylendiamin und 1,2-Diaminocyclohexan verglichen. Die Kugeln geben den
Bewegungsraum für das zweite Stickstoffatom an, wenn
das erste an das Metallkation gebunden ist. Die Relation
der Kugelradien wurde am Kalottenmodell nach STUART
und BRIEGLEB gewonnen. Eine Ringangliederung erhöht
also die Wahrscheinlichkeit der Chelatbildung durch eine
Einschränkung der „Gegeneinanderbeweglichkeit" der
Atomgruppen des Chelatbildner s. Dieses Prinzip ist bei
den Porphyrinen besonders augenfällig. Hier sind vier
Donatoratome durch Ringangliederung zu einem starren
System zusammengefügt, das in Aufbau und Größe der
Koordinationssphäre vieler Kationen entspricht. Hinzu
kommt noch eine Resonanzstabilisierung. Den Nachweis einer solchen bei einer Chelatbildung haben
CALVIN und Mitarbeiter (19) bei Kupferchelaten von
Acetylaceton und Salizylaldehyd erbringen können. Bei
Acetylaceton (a) besitzt das Chelat zwei Grenzstrukturen
(Formel 6), bei Salizylaldehyd (b) ist durch den ange-
Abb. 2
Die Veränderung von Stabilitätskonstanten verschiedener MetallChelate bei der Variation einer Donatorgruppe.
HCL
HC
JC
0
H,C
X
Verschiedene Donatorgruppen besitzen einen von den
Metallionen abhängigen Einfluß auf die Stabilität von
Chelaten. Für die biologisch wichtigsten zweiwertigen
Metallkationen ist dieser Einfluß bei gleichbleibender
Struktur des Chelats in Abbildung 2 angegeben. Die
Chelatbildner
R · N (CH2COO-)2 · Rx = —CHg—CH2N (CH3)3;
;0
,
R5 = —CH2—CN2NH2;
N
NH2
Rg = —CH2—CH2S~" '9
= —CH2—CH2QH;
R4 = —CH2—COO-;
V
= 0+
Formel 6
a) Kupfer-Chelat von Acetylaceton (log K = 17,4)
b) Kupfer-Chelat von Salicylaldehyd (log K = 13,0)
gliederten Benzolring eine entsprechende Mesomerie
unterdrückt worden. Der Vergleich der Stabilitätskonstanten zeigt eine Verringerung um vier Zehnerpotenzen.
— Der vorstehend besprochene Einfluß der Struktur
R7 = —CH2—CH2SCH3.
Konstanten nach (20—23)
Ordinaten zeigen die Änderung der Stabilitätskonstanten in Zehnerpotenzen, wenn in Methyliminodiessigsäure eine weitere Donatorgruppe so eingeführt
wird, daß sich ein neuer 5-gliedriger Chelatring bilden
kann. Quaternärer Stickstoff ist nicht zur Ausbildung
koordinativer Bindungen mit dem Metallion befähigt,
seine positive Ladung verursacht aus elektrostatischen
Gründen bei allen Metallen eine Verminderung der
Stabilität. Auch die Amidgruppe trägt nicht zur StabiliZ. klin. Chem. /1. Jahrg. 1963 / Heft 4
Siegmund: Stoffwechselwirkungen körperfremder Chelatbildner
tat bei, entsprechendes gilt, für die in der Tabelle nicht
angeführte Peptidgruppe. Man kann ihr also keine
Bedeutung für biologische Eiweiß-Metall-Verbindungen
zusprechen. (Bei extrem hohen pH-Werten, bei denen
durch Abspaltung eines Protons eine Ionisierung der
Peptidbindung erfolgt, kann diese aber, wie bei der
Biuretreaktion, zur Chelatbildung beitragen.) Der Einfluß der alkoholischen Hydroxylgruppe und der Carboxylgruppe ist bei allen Metallen positiv und ähnlich.
Erhebliche Unterschiede treten bei der Einführung von
Aminstickstoff auf. Hier werden Schwermetalle, besonders Kupfer gegenüber den Erdalkalimetallen erheblich
bevorzugt; bei der Sulfhydrylgruppe ist das noch ausgeprägter, jedoch ist wegen der Oxydation von SH
durch Cu11 dieser Wert nicht verfügbar. Selektiv wirkt
auch die Thioäthergruppe.
Calchtm und Magnesium
Die einzigen mehrwertigen Metalle, deren freie bzw.
hydratisierte Ionen in den Körperflüssigkeiten eine beachtliche Konzentration besitzen, sind Calcium und
Magnesium. Obgleich Schwermetallchelate immer viel
stabiler sind, tritt mit vielen körperfremden Chelatbildnern vorzugsweise eine Bildung von CalciumChelaten ein, während die Bildung von MagnesiumChelaten, trotz vergleichbarer Konzentrationen der
freien Ionen im Plasma, bei den bisher gebräuchlichen
Chelatbildnern zurücktritt. Das liegt an der meist
größeren Stabilität der Calcium-Chelate. Beim AeDTE
ist die Stabilitätskonstante des Calcium-Chelats um 2
Zehnerpotenzen größer als die des Magnesium-Chelats,
daher beträgt nach einer AeDTE-Zufuhr das Konzentrationsverhältnis dieser Chelate im Serum etwa 100
zu 1. Chelatbildner vom AeDTE-Typ werden im Verdauungstrakt nur unzureichend resorbiert (24, 25), und
beim Studium ihrer Wirkungen auf den Stoffwechsel
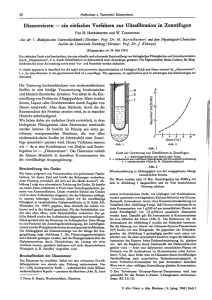
ist eine parenterale Zufuhr angezeigt. Abbildung 3 zeigt
die Wirkung einer intravenösen AeDTE-Gabe auf das
Plasma-Calcium (26, 27). 2 g Äthylendiamintetraessigsäure, die maximal 216 mg Calcium als Chelat binden
können, wurden als Natrium-Salz während 40 Min.
10,0
2,0
2
k
B B 10 12 K 1S 18 20 22 2k SMrt.
Abb. 3
Fraktionen von Plasmacalcium nach der intravenösen Injektion
von AeDTE (nach SPENCER)
Z. klin. Chem. / 1. Jahrg. 1963 / Heft 4
101
infundiert. Freie und an Plasma-Eiweiß gebundene
Calcium-Ionen sind unmittelbar mit Oxalat fällbar, das
Calcium des AeDTE-Chelats erst nach vollständiger
Veraschung. Die Differenz dieser Bestimmungen entspricht daher der Konzentration des Chelats. Im Verlauf
der Injektion wird das Gesamt-Plasmacalcium vermehrt,
das mit Oxalat fällbare geringfügig vermindert. Das
infundierte AeDTE wird im Urin als Calcium-Chelat
verhältnismäßig rasch ausgeschieden, die vermehrte
Calcium-Ausscheidung ist aber der infundierten AeDTEMenge nicht völlig äquivalent. Die Erhöhung der
Plasmacalcium-Werte und die vermehrte renale CalciumAusscheidung muß auf einer Mobilisierung von CalciumReserven (des Knochens) beruhen. Sie ist hier geringfügig (3 mg Calcium/kg Körpergewicht), unter anderen
Versuchsbedingungen kann sie aber erheblich werden.
Bei Hähnen, deren Plasmacalcium-Werte durch vorangehende Östrongaben auf 60—80 mg% erhöht
waren, wird das mit AeDTE-titrierbare Plasmacalcium,
was dem mit Oxalat fällbaren Calcium im Versuch von
SPENCER entspricht, nach AeDTE-Injektionen zunächst
erheblich vermindert erreicht aber in etwa 2 Stunden
wieder seinen Ausgangs wer t (28).
Bei diesem in Abbildung 4 dargestellten Versuch wurden
etwa 100mg Calcium/kg Körpergewicht, was etwa
Wirkung einer AeDTE-Injektion auf das titrierbare Plasmacalcium
bei einem Hahn nach Östrongaben
500 mg Knochen entspricht, innerhalb von 2 Stdn.
mobilisiert. Die infundierte AeDTE-Menge (2,1 g) war
hier dem gesamten zirkulierendem Calcium äquivalent.
Trotzdem ist auch unmittelbar nach der Injektion der
kleinste Wert für das mit AeDTE titrierbare Calcium
noch 50 mg%. Das diesem Wert entsprechende Calcium
ist also bereits während der Injektion (20 Min.) mobilisiert worden, vermutlich auf Grund des sich rasch einstellenden Lösungsgleichgewichts Knochen-Mineral/
Plasma. Diesem Gleichgewicht entspricht hier der hohe
Plasmacalcium-Wert von etwa 50 mg%, da durch
vorangehenden Östrongaben das Calcium bindende
Plasma-Eiweiß erheblich vermehrt wird. Der dann
folgende langsame Anstieg bis zum Ausgangswert, der
etwa 2 Stdn. dauert, muß auf eine spezifische Leistung
102
Siegmund: Stoffwechselwirkungen körperfremder Chelatbildner
(H-Ionensekretion) der Knochenzelle zurückgeführt
werden. Über Wirkungen wiederholter parenteraler
Gaben von AeDTE auf das Skelett bei Ratten berichtet
REMAGEN (29, 30). Bei stark negativen Calcium-Bilanzen
erfolgt ein intensiver Abbau des Knochens, der mit
einer Osteoklasten-Vermehrung einhergeht. Die Calcium-Mobilisierung muß daher auch unter diesen Versuchsbedingungen z. T. auf eine vermehrte Ausschüttung von Parathormon zurückgeführt werden, die
ihrerseits durch die vorübergehend erniedrigten Werte
für ionisiertes Plasmacalcium verursacht wird. Über die
Auflösung pathologischer Verkalkungen nach parenteralen AeDTE-Gaben berichten zusammenfassend
BOYLE und Mitarbeiter (31). Bei einer Gesamtgabe von
120 g AeDTE während 60 Versuchstagen verlor ein
Patient 27 g Calcium und 4,22 g Magnesium, während
die dem AeDTE äquivalente Calcium-Menge nur 12,9 g
betragen hätte. Auch dieses Ergebnis zeigt die Beteiligung zellulärer Leistungen bei der Calcium-Mobilisierung. Die Vorgänge bei der Auflösung der pathologischen Verkalkungeil sind aber im einzelnen nicht
geklärt. — Umgekehrt ist versucht worden, das CalciumChelat von AeDTE nach einem Vorschlag von BERSIN
(32) zur parenteralen Calcium-Zufuhr zu benutzen.
HOFSTETTER berichtete im Jahre 1953 (33) über günstige
Erfahrungen mit einem solchen Präparat. In der neutralen wäßrigen Lösung von AeDTE-Calcium beträgt
die Konzentration der freien Calcium-Ionen 10~7 bis
10~8 *, während sie im Plasma mit 10-%, um 4 bis
5 Zehnerpotenzen größer ist. Daher kann durch AeDTECalcium die Konzentration der freien Calcium-Ionen im
Plasma nicht erhöht werden. Dennoch wird das injizierte Calcium nur zu etwa 80% (75—100%) im Urin
wiedergefunden (26, 34), während Untersuchungen mit
14
C-markiertem AeDTE ergaben, daß dieses zu 100%
im Urin erscheint (26, 35, 36). Die Calcium-Retention
läßt sich dadurch erklären, daß die Chelatstabilität bei
niedrigen pH-Werten im Nephron so weit abnimmt,
daß Calcium-Ionen für die Rückresorption zur Verfügung stehen. RUBIN und Mitarbeiter (37) haben die
Bedeutung der Harnreaktion für die Retention von
AeDTE-Calcium nachweisen können: die Vorbehandlung der Versuchtstiere mit Azetazolamid, das im Urin
alkalische Reaktion verursacht, verhinderte die Retention vollständig. Dieser Versuch läßt die widersprechenden Meinungen über den Wert einer parenteralen
Calcium-Zufuhr mit Calcium-AeDTE verständlich er^
scheinen (33, 38, 39, 40). Bei Calcium-Chelaten mit
kleineren Stabilitätskonstanten kann die CalciumRetention entsprechend größer sein.(41, 42). — Für
eine selektive Bindung von extrazellulärem Calcium ist"
der Unterschied der Stabilitäten der Calcium- und
Magnesium-Chelate von AeDTE ausreichend, da hier
die Konzentrationen der freien Calcium- und Magnesium-Ionen annähernd gleich sind. Intrazellulär wird
aber die Konzentration der freien Magnesium-Ionen im
allgemeinen viel größer als die der freien CalciumIonen sein (44—47). Wenn daher bei Umsetzungen mit
Organ-Homogenaten oder reinen Fermenten die Wir-
kung einer stark verminderten Calcium-Ionen-Konzentration, bei Magnesium-Ionen-Konzentrationen, die dem
Milieu in der Zelle entsprechen, untersucht werden soll,
ist die Anwendung von AeDTE begrenzt. Es gelingt
zwar durch AeDTE, bei gleichzeitigem Zusatz von ionisierten Magnesium-Salzen, den Stoffwechsel von Homogeüateii und Mitochondriensuspensionen zu stabilisieren, was wahrscheinlich auf der Maskierung von
Calcium-Ionen der extrazellulären Flüssigkeit beruht
(45—48). RAAFLAUB (48) hat berechnet, daß bei dem
üblichen Zusatz von 10~% AeDTE und 3.10-3 ? Magnesium das vorhandene Calcium nur zu 97,5% maskiert
wird. Eine erheblich weitergehende Maskierung kann
mit Äthylenglykol-bis-/?-aminoäthyläther-N,N'-tetraessigsäure („GlAeDTE"),(HOOC · CH2)2N-CH2CH2OCH2CH20-CH2CH2N(CH2COOH)2 erreicht werden.
Die Stabilitätskonstante ihres Calcium-Chelats (10n>°)
ist zwar nur unwesentlich größer als bei AeDTE, aber
die ihres Magnesium-Chelats (lO 5 » 2 ) erheblich kleiner
(2, 49). Mit diesem Chelatbildner kann man daher bei
praktisch unveränderten Magnesium-Werten die Calcium-Ionen-Konzentration auf extrem niedrige Werte
herabsetzen. RAAFLAUB (48) zeigte, daß auf diese Weise
der oxydative Stoffwechsel von Lebermitochondrien
gesteigert und stabilisiert wird, und BRENNER-HOLZACH
und Mitarbeiter (50) haben mit diesem Chelatbildner
die spezifische Aktivierung der enzymatischen Oxydation von -Ketoglutärsäure durch Calcium-Ionen nachweisen können. In Nierenhomogenaten wird bei Pyruvat- und Fumaratzusatz durch eine solche Verminderung
der Calcium-Ionen-Konzentration die Citratansammlung
erheblich vermehrt (51).
Die Stabilitätskonstanten der biogenen Chelate von Calcium und
Magnesium erreichen höchstens die Größenordnung von l O4.
Beim ATP beträgt die Stabilitätskonstante des MagnesiumKomplexes 104, die des Calcium-Komplexes 103,6 (52). Koordinative Bindungen bestehen vermutlich nur zu den Phosphatgnippen (Formel?), da die entsprechenden Komplexe von an-
Adenosin-'-O—l
Formel 7
Magnesium-Chelat von ATP
organischem Tripolyphosphat sogar größere Stabilitätskonstanten
besitzen (52). Bei ATP findet NANNINGA für den MagnesiumKomplex einen Wert von 10M (53). Über die zum Teil widerspruchsvollen Angaben zu der Stabilität dieser Komplexe vgl. (54).
2,3-Diphosphoglycerinsäure, der Hauptbestandteil des säurelöslichen Phosphats in den Erythrocyten der meisten Säugetiere,
bildet mit Calcium und Magnesium Komplexe, deren Stabilitätskonstanten die gleiche Größenordnung wie bei den ATP-Komplexen besitzen (51). Das ist insofern bemerkenswert, als sich hier
nur große Chelatringe ausbilden können und daher die relativ
hohe Stabilität dieser Komplexe nicht durch den üblichen Chelateffekt erklärt werden kann. Eine Größenordnung kleiner sind die
Stabilitätskonstanten der entsprechenden ADP-Chelate (52).
Z. klin. Chem. / 1. Jahrg. 1963 / Heft 4
Siegmund: Stoffwechsel Wirkungen körperfremder Chelatbildner
Andere phosphorylierte Verbindungen, wie AMP, Glucose- und
Fructosephosphat (55) bilden mit Magnesium und Calcium ebenfalls Komplexe, deren Stabilitätskonstanten aber unter 102 liegen,
so daß bei den Konzentrationsverhältnissen der Körperflüssigkeiten nur wenige Prozente dieser Verbindungen als Magnesiumoder Calcium-Komplexe vorliegen können. — Alle bisher bekannt
gewordenen biogenen Brdalkalikomplexe sind wesentlich weniger
stabil als die von AeDTE und werden in dessen Gegenwart daher
gespalten. Die schnelle Bindung von AeDTE durch extrazelluläre
Ionen und ein ungenügendes Eindringen in die Zellen verhindert
vermutlich, eine solche Reaktion in vivo. Es sei noch erwähnt,
daß Versuche über eine selektive Bindung von Magnesium mit
synthetischen Chelatbildnern bisher nicht beschrieben wurden,
obgleich hierzu geeignete Chelatbildner bekannt sind.
Schwermetalle
Für die Vorhersage der Wirkung eines Chelatbildners
auf den Stoffwechsel eines Schwermetalls, insbesondere
seine renale Ausscheidung, ist in erster Näherung das
Verhältnis der Stabilitätskonstanten des betreffenden
Metallchelats und des Calcium-Chelats maßgebend, da
die Konzentration der freien Calcium-Ionen im Serum
die aller Schwermetallionen um Größenordnungen
übersteigt. Indessen zeigte CATSCH (56—59), daß dieses
Verhältnis der Konstanten durchaus nicht immer zuverlässige Voraussagen über die Wirkung eines Chelatbildners auf den Stoffwechsel eines Metalls erlaubt.
Die Abbildung 5 zeigt die Wirkung von AeDTE auf
fr
wo
jj 90
l70
\ 80
ö SO
$ fyQ
U
-*
8
10
12
Abb. 5
Die Wirkung von AeDTE auf die Retention verschiedener Radionuclide im Knochen in % der Retention des Kontrollversuches
(nach CATSCH)
die Retention verschiedener Radionuklide im Knochen,
aufgetragen gegen den Logarithmus des Quotienten der
betreffenden Stabilitätskonstanten. Während bei ^Sr,
144
Ce, 91Y und 2*°Pb die Reihenfolge der Wirksamkeit
diesem Quotienten entspricht, hat AeDTE auf die
Retention von 203Hg keine Wirkung, obwohl hier der
Quotient den größten Wert besitzt. Diese Abweichung
läßt sich durch die unterschiedliche Stabilität der
Hydroxokomplexe erklären (60). Allgemein sind also
nicht nur die Konkurrenzreaktionen der Metalle um
Z. klin. Chem. / 1. Jahrg. 1963 / Heft 4
103
den zugeführten Chelatbildner, sondern auch die Konkurrenzreaktionen von Bestandteilen des Organismus
mit den verschiedenen Metallen zu berücksichtigen.
Besonders bei den Biometallen ist daher in erster Linie
die Stabilität ihrer biogenen Komplexe für die Wirkung
eines zugeführten Chelatbildners maßgebend.
Zink
Im Vergleich mit den Erdalkalien ist die Konzentration der freien Zink-Ionen in Serum und Zellen sehr
gering. Zink ist im Serum, zumindest zum Teil,
nur relativ lose an Albumin gebunden, seine Werte
werden mit 100—200 §%, entsprechend 2—3 · 10~%,
angegeben (61).
Für die Zink-Bindung biogener Stoffe kommen Tryptophan und
Cystein in Betracht (WEITZEL (62)). Die Zink-Bindung an SerumAlbumin wird vermutlich nur durch eine einfache komplexe
Bindung an den Imidazolstickstoff von Histidin bewirkt. Diese
Annahme steht nach den Untersuchungen von GURD (63) mit der
Stabilität des Zink-Albumins im Einklang. — Das Zink-Bindungsvermögen von Insulin wurde im Jahre 1934 von SCOTT (64) beobachtet. Auch hier erfolgt die Bindung durch Imidazolstickstoff.
Die Versuche von WEITZEL und Mitarbeitern (65) ergaben, daß
Insulin auch im Inselgewebe als Zink-Verbindung vorliegt. Sie
konnten zeigen, daß dieses Gewebe bei Knochenfischen, bei denen
es als isoliertes Organ vorliegt, mit 500—1000 //g Zink/g Frischgewebe 10—40 mal mehr Zink enthält als andere Organe. Dieser
hohe Zink-Gehalt beruht auch auf der Zink-Bindung an Glukagon,
denn auch die -Zellen sind sehr Zink-reich (62). Beim Glukagon
steht am Aminoende ein Histidinrest; hier kann Zink unter Ausbildung eines Chelatringes an Imidazol- und Amino-N koordinativ gebunden werden. Über die Stabilität der Zink-Verbindung
solcher Peptide berichten WEITZEL und Mitarbeiter (66). Eine
weitere biogene Zink-Verbindung ist das Zink-Cystein im tapetum
lucidum der Carnivoren (67). Auf diese Substanz ist das Augenleuchten dieser Tiere zurückzuführen. — Das stabilste ZinkProteid ist wohl die Carboanhydrase, bei der es erst MALMSTRÖM
(68) gelungen ist, ohne Zerstörung des Proteins, das Zink reversibel zu entfernen. Er mußte hierzu extreme Bedingungen anwenden, nämlich die Dialyse bei pH = 5 gegen 10~3 m o-Phenantrolin während 30 Tagen. Eine Wirkung von Chelatbildnern
auf dieses Zink-Proteid in vivo ist demnach auszuschließen. (Über
weitere Zink-haltige Fermente vgl. (62, 68, 69).)
Die Stabilitätskonstante von Zink-AeDTE ist mit l O16·5
um 6 Zehnerpotenzen größer als die von CalciumAeDTE, und bei der relativ lockeren Bindung von
Zink im Serum ist bei AeDTE-Injektionen eine gewisse
Bildung des Zink-Chelats zu erwarten. In Übereinstimmung damit findet PERRY (70, 71) bei Hypercholesterinämie-Patienten, daß bei parenteralen Gaben
von l-r-3 g AeDTE das Urin-Zink von etwa 0,25 mg//
auf etwa 2—3 mg Zink// ansteigt. Nach PERRY ist dies
die ausgeprägteste Stoffwechselwirkung nach intravenösen Gaben von Calcium-AeDTE. Die gleichzeitig
eintretende Erniedrigung erhöhter Serum-CholesterinWerte führt er daher auf die Zink-Diurese zurück.
Indessen fehlen überzeugende Versuche, die die Gleichzeitigkeit dieser Veränderungen ursächlich miteinander
verknüpfen. FOREMAN (72) hat andererseits gezeigt, daß
bei intravenösen Gaben von Zink-AeDTE bei Ratten
nach 45 Stdn. praktisch alles zugeführte Zink wieder
ausgeschieden ist, während unter gleichen Versuchsbedingungen nichtkomplexe Zinksalze zu 60% retiniert
104
Sicgmund: Stoffwechselwirkungen körperfremder Chelatbildner
werden. MELTZER und Mitarbeiter (73) berichten, daß
AeDTE bei mit Insulin behandelten Diabetikern eine
Hypoglykämie hervorrief, und daß tägliche AeDTEInjektionen den Insulinbedarf der Diabetiker herabsetzten. Der Mechanismus dieser Wirkung ist nicht klar,
möglicherweise besteht hier ein Zusammenhang mit der
Zink-Bindung an Insulin und Glukagon.
Anders als AeDTE wirken die Chelatbildner o-Oxychinolin und Dithizon auf biogene Zink-Komplexe. —
ALBERT (75) nimmt zur Erklärung der bakteriziden
Wirkung von o-Oxychinolin an, daß dieses sich an die
freien koordinativen Valenzen von Zink in seinen
biogenen Komplexen anlagert, wobei die Komplexe
nicht gespalten werden. Die biologische Auswirkung
einer solchen Reaktion ist natürlich eine andere, als
wenn die Chelatbildner mit freien Zink-Ionen reagieren
und so eine Spaltung von biogenen Komplexen verursachen. Ähnliche Überlegungen gelten vermutlich für
den Einfluß von o-Oxychinolin und Dithizon auf das
Inselgewebe; hier ist vermutlich noch eine cy to toxische
Komponente maßgebend (74, 76, 77). KADOTA und
Mitarbeiter (78) konnten zeigen, daß Dithizon und oOxychinolin die Inselzellen schädigen und diabetogen
wirken. WEITZEL (79) fand, daß Zink-Cystein im
tapetum lucidum der Carnivoren gegen Dithizon noch
erheblich empfindlicher ist als Inselgewebe. Bereits
10—15 Minuten nach der Injektion von 100 mg/kg
Dithizon konnten sie bei Hunden die rot-violette Farbe
des Zink-Dithizons im Azp£////*-Bezirk beobachten;
nach einigen Stunden trat Netzhautablösung und
Erblindung ein.
Kupfer
Plasma enthält etwa 100/jg% Kupfer; dieses ist im wesentlichen
an ein spezielles Kupfer-bindendes Protein, das Cerulo-Plasmin
gebunden und nur ein relativ kleiner Anteil soll lose an Albumin
gebunden sein. Das zweiwertige Kupfer ist im Ceruloplasmin
sehr fest gebunden; bei pH > 4 ist es nicht dialysierbar (80).
Nach der Reduktion mit Ascorbinsäure ist eine reversible KupferAbspaltung möglich (81). Insgesamt sind bisher 9 Kupfer-Proteide,
darunter Tyrosinase und Cytochrom-C-Oxydase, als Bestandteil
des Organismus isoliert und charakterisiert worden. Die Festigkeit
ihrer Kupferbindung ist, soweit bisher untersucht, ähnlich wie
bei Ceruloplasmin (80). Die Funktion des Kupfers besteht bei
Tyrosinase und Cytochrom-C-Oxydase in einem Valenzwechsel.
Das Fehlen von Tyrosinase soll die Ursache des Albinismus sein
(82). Bei Cytochrom-C-Oxydase konnten BEINERT und Mitarbeiter
(83) zeigen, daß der Valenzwechsel des Kupfers mit der Enzymfunktion zusammenhängt.
Obwohl auch parenterale AeDTE- und BAL-Gaben
(84) die renale Kupferausscheidung erhöhen, ist das
auch oral wirksame D-Penicillamin hierzu am besten
geeignet. Penicillamin ist chemisch |8,/?-Dimethylcystein; seine D-Form entsteht bei der Hydrolyse von
Penicillin. Die Erhöhung der renaleii· Kupferausscheidung nach Penicillamin-Gaben wurde von WALSHE
(86, 85) beobachtet. Er fand hierbei eine Steigerung
der renalen Kupferausscheidung auf etwa das 10—20fache des Normalwertes. Diese Wirkung ist zur Behandlung von Morbus Wilson benutzt worden. Bei
dieser Krankheit kann der Kupfergehalt der Organe
bis zum Hundertfachen der Norm betragen (SCHEINBERG 87). Die renale Kupferausscheidung in 24 Stunden
erreicht hier bei oralen Gaben von l—2 g D-Penicillamin
Werte von 8 mg; Patienten, die insgesamt 200—2000 g
Penicillamin erhielten, schieden im Verlauf der Behandlung zwischen 400 und 950mg Kupfer aus (88);
das ist ein Mehrfaches des gesamten Kupfer-Bestandes
beim gesunden Erwachsenen, der mit 75—150 mg angegeben wird (80). Bei langdauernden Behandlungen
sinken die Plasma-Kupfer-Werte bis 10 % ab (LANGE
(89)).
Über die klinische Beurteilung dieser Behandlung vgl.
(8, 90). Cystein, das sich nur durch das Fehlen von zwei
Methylgruppen von Penicillamin unterscheidet, erhöht
die renale Kupferausscheidung nicht (85). WALSHE vermutete, daß dieser Unterschied weniger auf der verschiedenen Stabilität der Kupfer-Komplexe beruhe, als
auf einem geringeren Umsatz von Penicillamin im
Stoffwechsel. APOSHIAN (91) konnte dies experimentell
nachweisen; er fand, daß Penicillamin mit Aminosäureoxydasen und Cysteindesulfhydrase sehr viel langsamer umgesetzt wird als Cystein. Bei oralen Penicillamingaben wird aber doch ein hoher Prozentsatz im
Stoffwechsel verändert. In einem Selbstversuch fand
DULCE (92), daß nur 10% einer oralen Penicillamingabe
im Urin wiedergefunden wird. L-Penicillamin hat zwar
eine vergleichbare Wirkung auf die renale Kupferausscheidung, wirkt jedoch gleiqhzeitig als Antivitamin-B6
(93). Nach DU VIGNEAUD (94) beruht diese Wirkung
auf einer Reaktion mit Pyridoxalphosphat. Indessen
reagieren D- und L-Penicillamin mit Pyridoxalphosphat
mit gleicher Geschwindigkeit (95), während eine
AntivitammrB6-Wirkung bei D-Penicillamin in vivo
nie beobachtet wurde. Zuverlässige Daten über die
Stabilität der Kupfer-Penicillarnin-Komplexe sind nicht
verfügbar. KUCHINSKAS und Mitarbeiter (96) geben
Werte für die Stabilitätskonstanten der Kupfer-IIKomplexe an. Diese beruhen auf pH-Titrationskurven
von Penicillamin in Gegenwart von Kupfer-II-Ionen,
wobei die Autoren übersehen haben, daß die SHGruppen im Penicillamin durch Kupfer-II oxydiert
werden, was ebenfalls mit einer Herabsetzung der pHWerte verbunden ist. Man kann aber den Wert für den
Kupfer-I-Cystein-Komplex (1:1), den STRICKS und
Mitarbeiter (97) polarographisch zu 1019>2 bestimmten,
heranziehen. Die Stabilitätskonstante des Kupfer-IPenicillamin-Komplexes liegt sicher in der gleichen
Größenordnung. Indessen ist bei Penicillamin die
Korrektur für das Metallbindungsvermögen bei physiologischen pH-Werten geringer, denn sein pKg-Wert ist
•mit 7,97 (96) deutlich niedriger als bei Cystein, 8,48 (98).
Eine direkte Reaktion von Penicillamin mit SerumKupfer hat WALSHE (99) nachgewiesen. Mit 0,02 m
PeniciUamin werden nach l Std. bei 37° 29^37% des
Serum-Kupfers ultrafiltrierbar bzw. dialysierbar. Bei
Plasma von Patienten mit Wilsonsyndrom sind es
77—87%. Die Wirkung von AeDTE in einem analogen
Versuch soll sehr viel geringer sein. Bei der Zugabe
von Penicillamin zu gereinigtem Ceruloplasmin ver2. klin. Chem. /1. Jahrg. 1963 / Heft 4
Siegmund: Stoffwechselwirkungen körperfremder Chelatbildner
105
HOOCCH,
C
^x + X
H-N
CH,
CH,
.CH-CH,
^>N—CH
H-N+—CH 2 COO~
CH,
CH,
H-N f
HOOCCH?
Formel 8
Äthylendiamin-N,N'-di-o-oxy-phenylessigsäure und ihr Eisen-Chelat (nach KROLL)
schwindet die charakteristische blaue Farbe. Bei diesen
Versuchen ist eine Reduktion zum einwertigen Kupfer
anzunehmen, deshalb erlauben sie-keine Rückschlüsse
auf die Komplexstabilität von Cerulöplasmin. Penicillamin ist kein spezifischer Chelatbildner für Kupfer,
sondern gibt mit zahlreichen Schwermetallen recht
stabile Chelate (96). So ist es auch mit Erfolg bei
Quecksilbervergiftungen angewendet worden. Eine
Acetylierung der NH2-Gruppe im Penicillamin hebt
seine Wirkung auf den Kupfer-Stoffwechsel auf, nicht
aber seine Schutzwirkung bei Quecksilbervergiftungen.
Die Stabilitätskonstante von Quecksilberpenicillamin
beträgt l O16»5, die von Quecksilber-AeDTE l O21'8.
Trotzdem ist Penicillamin ein wirkungsvolles Mittel bei
einer Quecksilbervergiftung, während QuecksilberAeDTE dieselbe Toxizität wie nichtkomplexe Quecksilbersalze besitzt (60), und die Anwendung von AeDTE
bei Quecksilbervergiftungen dementsprechend sinnlos
ist. Entscheidend für dieses unterschiedliche Verhalten
ist vermutlich die fehlende Calcium-Konkurrenz beim
Penicillamin.
Eisen
Das AeDTE-Chelat des dreiwertigen Eisens besitzt eine
Stabilitätskonstante, die um 14 Zehnerpotenzen größer ^
ist als die des Calcium-Chelats. Die Werte für SerumEisen liegen in der Größenordnung von 100 %
(2 · 10^%), d. h. sie sind nur 2 Zehnerpotenzen kleiner
als für Serum^Calcium. Dennoch kommt es nach
AeDTE-Injektionen zu keiner bedeutenden Vermehrung
der renalen Eisenausscheidung (102). Das Eisen-Chelat
von AeDTE kann im Gegenteil zur Eisenzufuhr benutzt
werden, bei seiner intravenösen Injektion werden über ·
80% des Eisens retiniert (103). Die Metallabgabe ist
also trotz der ungleich größeren Stabilität viel ausgeprägter als beim Calcium-Chelat, bei dem die Retention. 0—20% beträgt (s. o.). Dies liegt an der unterschiedlichen Stabilität der biogenen Komplexe.
Bei den biogenen Eisenkomplexen überwiegen mengenmäßig
und funktionell die Porphyrinkomplexe. Ein unmittelbarer Eisenentzug aus diesen Komplexen mit Chelatbildnern ist nicht bekannt und dürfte bei neutraler Reaktion mit den heute bekannten
Chelatbildnern auch nicht möglich sein. Das ist sowohl durch
die extrem hohe Stabilität der Porphyrin-Chelate, wie auch durch
ihre Reaktionsträgheit beim Ein- und Ausbau des zentralen MetallZ. klin. Chem. / 1. Jahrg. 1963 / Heft 4
CH2COO"
Formel 9
Diäthylentriaminpentaessigsäure
atoms bedingt. Wegen der Starrheit des Moleküls können die
vier Bindungen an das Metallatom nur gleichzeitig gelöst oder
gebildet werden. Ein solches Ereignis tritt nur selten ein, und die
Reaktion verläuft daher sehr langsam (17, 104, 105). Die Einführung von zwei weitigem Eisen in metallfreies Protoporphyrin
wurde präparativ von FISCHER und Mitarbeitern (106) durchgeführt. Bei pH = 6 und 37° ist diese Reaktion auch in Gegenwart von Lösungsvermittlern sehr träge (107). Beim Kupfer
konnte die entsprechende Reaktion durch o-Oxychinolin um das
200—2000-fache beschleunigt werden (108). Hier reagiert das
Porphyrin offenbar mit dem Kupfer-Oxychinolinkomplex (1:1).
In vivo erfolgt die Hämbildung vermutlich aus dreiwertigem
Eisen und Porphyrin unter der Wirkung der Eisen-Chelatase;
das Ferment ist Eisen-spezifisch (109). Diese Spezifität und der
träge Metallaustausch läßt verständlich erscheinen, daß sich die
Biometalle nicht im Verhältnis ihrer Konzentrationen und Komplexstabilitäten mit den Porphyrinen vereinigen. Bei Porphyrie
können aber unphysiologische Metallporphyrine im Urin auftreten (110, 111, 112).
Auch die anderen biogenen Eisenkomplexe sind sehr
stabil, und für die „Enteisenung" dieser Verbindungen
sind wirkungsvolle selektive Chelatbildner notwendig.
Geeignet sind hier Äthylendiamin-N,N'-di-o-Oxyphenylessigsäure, ein Phenolanaloges von AeDTE (Formel 8),
Diäthylentriaminpentaessigsäure (Formel 9) und Desferrioxamin B, dessen Eisen-Chelat ein Stoffwechselprodukt der Actinomyceten ist (Formel 10). Die
5
1 II "I
HO 0
0
HO
HO 0
Formel 10
a) Ferrioxamin B und b) Desferrioxamin B (nach BICKEL)
14
106
Siegmund: Stoffwechselwirkungen körperfremder Chelatbildner
phenolischen Hydroxyle erhöhen selektiv die Stabilitätskonstante des Eisen-III-Chelats, während die des
Calcium-Chelats kleiner geworden ist. Bei Diäthylentriaminpentaessigsäure hat die Vermehrung der Donatorgruppen gegenüber AeDTE die Stabilität des CalciumChelats kaum verändert, die des Eisen-III-Chelats um
3 Zehnerpotenzen vergrößert. Im Desferrioxamin B erfolgt die Eisenbindung durch Hydroxamsäuregruppen.
Über die Begründung der Strukturformel dieses interessanten Chelats und die möglichen diastereomeren
Konfigurationen vgl. BICKEL und Mitarbeiter (114). —
Über die Reaktion von Transferrin-Eisen mit Äthylendiamin-NjN'-di-o-Oxy-phenylessigsäure in vitro berichtet KORMAN (115). Er konnte die Reaktion optisch verfolgen, da das entstehende Eisen-Chelat stark rot gefärbt ist. Transferrin (90proz. Eisensättigung) gab bei
pH = 7,4 während der ersten 15 Minuten 45% seines
Eisens an den synthetischen Chelatbildner ab. Die
weitere Reaktion war sehr langsam und nach 24 Stdn.
das Gleichgewicht noch nicht erreicht. Nach 4 Tagen
waren insgesamt 75% des Eisens abgespalten. Diese
Reaktionsträgheit ist aus den komplexchemischen
Daten verständlich, denn bei der Reaktion sind vermutlich die freien Eisen-Ionen ein notwendiges Zwischenprodukt, ihre Konzentration ist aber wegen der
hohen Stabilität dieser Eisen-Komplexe extrem niedrig.
In Gegenwart von Bikarbonat (0,02 #?), daß die Eisenbindung im Transferrin entscheidend beeinflußt (116),
konnte KORMAN (115) keine Reaktion feststellen. Über
entsprechende Versuche mit Desferrioxamin B berichtet
WÖHLER (117). Er findet einen Eisenentzug bei Transferrin-Eisen, Ferritin und Hämosiderin. Nach Zusatz
des Chelatbildners sind durch 6-stdg. Dialyse gegen
Wasser erhebliche Eisenmengen zu entfernen, beim
Transferrin 90%. Der Einfluß von pH-Wert und
Bikarbonat auf die Reaktion wurde nicht untersucht.
Ein Vergleich mit den Ergebnissen von KORMAN ist
daher nicht möglich. — Die Stabilitätskonstanten der
Eisen-III-Chelate der oben besprochenen Chelatbildner
liegen zwischen l O29 und l O32. Indessen ist die pHAbhängigkeit der Chelatbildung groß, da die Protonenaffinität der Donatorgruppen erheblich ist. Beim EisenChelat von Äthylendiamin-N,N'-di-o-Oxy-phenylessigsäure fand KORMAN mit optischen Messungen, daß es
bei einem pH-Wert von etwa 1,5 zu 50% dissoziiert
war. Bei Ferrioxamin B ist das schon bei pH = 3,5 der
Fall, wie polarographische Untersuchungen von BICKEL
und Mitarbeitern (114) ergaben. — Infusionen von
Diäthylentriaminpentaessigsäure (113) und Desferrioxamin (116) können die renale Eisenausscheidung beträchtlich erhöhen. Bei gesunden Versuchspersonen
findet WÖHLER (117) nach 2 mal 400 mg Desferrioxamin
i. v. l—3 mg Eisen im 24 Stdn.-Urin; gleichzeitig kam
es zur Erhöhung der Serum-Eisen-Werte. Sowohl
Diäthylentriaminpentaessigsäure wie Desferrioxamin B
sind bei der Behandlung der Eisenspeicherkrankheit
(Hämochromatose) benutzt worden. WÖHLER (118)
berichtet hierbei über renale Eisenausscheidungen bis
80 mg/24 Stdn. und über eine Gesamteisenelimination
bis zu 18 g innerhalb eines Jahres. Das ist mehr als der
gesamte Eisenbestand des gesunden Erwachsenen.
Schlußbetrachtung
Obwohl es keine streng spezifischen Chelatbildner gibt,
ist es möglich die Eliminierung eines bestimmten Metalls
durch Variation von Chelatbildnern und Versuchsbedingungen in den Vordergrund zu stellen. So wirkt Na2AeDTE vorzugsweise auf Calcium, CaAeDTE auf
Zink, Penicillamin auf Kupfer, Desferrioxamin B auf
Eisen und Acetylpenicillamin auf Quecksilber.
Die renale Ausscheidung nach der Zufuhr von Chelatbildnern erlaubt manchmal eine Schätzung der Bindungsfestigkeit der Metalle im Organismus bzw. der Konzentration ihrer freien Ionen. Wenn man voraussetzt,
daß diese Ausscheidung dem Konzentrationsverhältnis
der Chelate im Plasma entspricht, berechnet man mit
Hilfe der Stabilitätskonstanten für die Konzentration
der freien Zink-Ionen im Serum aus den Versuchsdaten
von PERRY (71) einen Wert von lO-11/^, für die der
dreiwertigen Eisen-Ionen, wenn man Versuche mit
Diäthylentriaminpentaessigsäure zugrunde legt (118)
-22—10-23 *. Vergleicht man diesen Wert mit der
Loschmidtschen Zahl, so sieht man, daß nur einzelne
freie Eisen-III-Ionen im Liter vorhanden sein können.
Und dennoch ist dieser Wert vermutlich zu hoch, denn
aus der Stabilitätskonstanten für Eisen-Transferrin errechnet man eine um Zehnerpotenzen geringere Größe.
Der Unterschied liegt vermutlich an der Rolle des
Wertigkeitswechsels von Eisen bei der Abspaltung aus
seinen biogenen Komplexen. Indessen zeigen diese
Zahlen die Leistungsfähigkeit synthetischer Chelatbildner, die auch in diesen extrem verdünnten Lösungen
mit den Metallionen reagieren und damit in den Stoffwechsel dieser Metalle eingreifen.
Literatur
1. WARBÜRG, O., Schwermetalle als Wirkungsgruppen von Fermenten, W. Saenger, Berlin (1946). — 2. SCHWARZENBACH, G.,
Die komplexometrische Titration, F. Encke, Stuttgart (1960). —
3. MARTELL, A. E. und M. CALVIN, Die Chemie der Metallchelatverbindungen, Verlag Chemie GmbH, Weinheim/Bergstr. (1958).
— 4. CHABEREK, ST. und A. E. MARTELL, Organic Sequestring
Agents, John Wiley & Sons, Inc. Publishers, New York (1959). —
5. WILLIAMS, R. J. P., The Enzymes, Bd. I, S. 391 Acad. Press,
Inc. Publishers, New York (1959). — 6. SCHÄFER, H. L., Komplexbildung in Lösung, Springer-Verlag, Berlin (1961). — 7.
Chelation Phenomena (Symposion), Ann. N. Y. Acad. Sc. 88, 281
(1960). — 8. Metalbinding in Medicine (Symposion), J. B. Lippincott Comp., Philadelphia und Montreal (1960). — 9. Biological
Aspects of Metalbinding (Symposion), Federat. Proc. 20, l (1961).
— 10. WERNER, A., Ber, dtsch. ehem. Ges. ^,.2584 (1901). —
11. MORGAN, G. T. und H. D. K. DREWS, J. ehem. Soc. (London)
2. klin. Chem. /1. Jahrg. 1963 / Heft 4
Siegmund: Stoffwechselwirkungen k rperfremder Chelatbildner
117, 1456 (1920). — 12. BJERRUM, J., Metal Amine Formation in
Aqueous Solution, Diss., Kopenhagen (1941). — 13. SCHWARZENBACII, G., E. KAPITSCH und R. STEINER, Helv. chim. Acta 28,
828 (1945). — 14. SCHWARZENBACH, G. und H.ACKERMANN,
Helv. chjm. Acta 30, 1798 (1947). — 15. WEITZEL, G., J. ENGELMANN und A. M. FRETZDORFF, Hoppe-Seyler's Z. physiol. Chem.
315, 236 (1959). — 16. SCHWARZENBACH, G. und H. ACKERMANN,
Helv. chim. Acta 31, 1029 (1948). — 17. SCHWARZENBACH, G.,
Helv. chim. Acta 35, 2344 (1952). — 18. SCHWARZENBACH, G.
und H. ACKERMANN, Helv. chim. Acta 32, 1682 (1949). —
19. CALVIN, M. und K. M. WILSON, J. Amer. ehem. Soc. 67, 2003
(1945). — 20. SCHWARZENBACH, G. und E. FREITAG, Helv. chim.
Acta 34, 1492 (1951). — 21. SCHWARZENBACH, G. und J. HELLER,
Helv. chim. Acta 34, 1889 (1951). — 22. SCHWARZENBACH, G.,
G. ANDEREGG, W. SCHNEIDER und H. SENN, Helv. chim. Acta
38, 1147 (1955). — 23. ANDEREGG, G. und G. SCHWARZENBACH,
Helv. chim. Acta 38,1940 (1955). — 24. WEINER, M., Ann. N. Y.
Acad. Sc. 88, 426 (1960). — 25. FOREMAN, H., Metalbinding in
Medicine, S. 82, J. B. Lippincott Comp., Philadelphia und Montreal
(1960). — 26. SPENCER, H., Ann. N. Y. Acad. Sc. 88,435 (1960). —
27. SPENCER, H., J. GREENBERG, E. BERGER, H. PERRONE und
D. LASZLO, J. Laborat. Clin. Med., S. Louis 47, 29 (1956). —
28. SIEGM ND, P., F. K RBER und H.-J. DULCE, Naunyn-Schmicdebergs Arch. exp. Pathol. Pharmakol. 240, 327 (1961). — 29.
REMAGEN, W., Virchows Arch. path. Anat. 332, 153 (1959). —
30. REMAGEN, W., S. K. HILLER und C. M. LANZ, ArzneimittelForsch., Aulendorf //, 1907 (1961). — 31. BoYLE,A.J., N.E.
CLARKE, R. E. MOSHER und D. S. McCANN, Federat. Proc. 20,
243 (1961). — 32. BERSIN, TH., Schweiz, med. Wschr. 83, 608
(1953). _ 33. HOFSTETTER, H. J., Schweiz, med. Wschr. 83, 611
(1953). — 34. BERSIN, TH. und H. SCHWARZ, Schweiz, med. Wschr.
83,765 (1953). — 35. FOREMAN, H. und T. T. TRUJILLO, J. Laborat.
Clin. Med., S. Louis 43, 566 (1954). — 36. FOREMAN, H., M. VIER
und M. MAGEE, J. biol. Chemistry 203,1049 (1953). — 37. RUBIN,
M., R. ALEXANDER und G. LINDENBLAD, Ann. N. Y. Sc. 88, 474
(1960). — 38. HUNZINGER, A. W. und G. A. ORTELLI, Schweiz,
med. Wschr. 84, 1339 (1954). — 39. ROTHMN, E., M. TAESCHLER
und A. CERLETTI, Schweiz, med. Wschr. 84, 1286 (1954). — 40.
HAUSCHILD, F. und G. DENTZER, Klin. Wschr. 33, 495 (1955). —
41. ORZELL, R., Masters Thesis, Georgetown University, Washington (1957). — 42. SWANTKO, J. Masters Thesis, Georgetown
University, Washington (1957). — 43. KAISER, W. und W. PONSOLD, Vortrag Dtsch. Pharmakol. Ges., Mainz (1960). — 44.
GRISWOLD, R. L. und N. PACE, Exp. Cell. Res. //, 362 (1956). —
45. SLATER, E. C. und K. W. CLELAND, Nature (London) 170, 118
(1952). — 46. NANNINGA, L. B., Biochim. biophysica Acta
(Amsterdam) 54, 338 (1961). — 47. RAAFLAUB, J., Heiv. physiol.
pharmacol. Acta 14, 304 (1956). — 48. RAAFLAUB, J., Helv. chim.
Acta 38,27 (1955). — 49. SENN, H., Dissertation, Z rich (1954). —
50. BRENNER-HOLZBACH, O. und J. RAAFLAUB, J. Helv. chim.
Acta 39, 863 (1956). — 51. SIEGMUND, P., Habilitationsschrift,
Freie Universit t Berlin (1962). — 52. MARTELL,A. E. und
G. SCHWARZENBACH, Helv. chim. Acta 39, 653 (1956). — 53.
NANNINGA, L. B., Biochim biophysica Acta (Amsterdam) 54, 330
(1961). — 54. BOCK, R. M., The Enzymes, Bd. Π, Acad. Press,
Inc. Publishers, New York (1960). — 55. SCHWARZENBACH, G.
und G. ANDEREGG, Helv. chim. Acta 40, 1229 (1957). — 56.
CATSCH, A. und D. K. L£, Strahlentherapie 107, 494 (1957). —
57. CATSCH, A. und H. MELCHINGER, Strahlentherapie 107, 437
(1958). — 58. CATSCH, A. und H. MELCHINGER, Strahlentherapie
108, 63 (1959). — 59. CATSCH, A., Federat. Proc. 20,206 (1961). —
60. SCHUBERT, J., Federat. Proc. 20, 219 (1961). — 61. WOLFF, H.,
Dtsch. Arch. klin. Med. 197, 263 (1950). — 62. WEITZEL, G., Angew. Chem. 68, 566 (1956). — 63. GURD, F. R. W. und D. S.
GOODMAN, Amer. ehem. Soc. 74, 670 (1952). — 64. SCOTT, D. A.,
Z. klin. Chem. / 1. Jahrg. 1963 / Heft 4
107
Biochem. J. 28, 1592 (1934). — 65. WEITZEL, G., F. J. STRECKER,
U. ROESTER, A. M. FRETZDORFF und E. BUDDECKE, HoppeSeyler's Z. physiol. Chem. 295, 83 (1953). — 66. WEITZEL, G.,
W. SCHEEG und F.SCHNEIDER, Liebigs Ann. Chem. 632, 124
(1960). — 67. WEITZEL, G., F.J.STRECKER, U. ROESTER, E.
BUDDECKE und A. M. FRETZDORFF, Hoppe-Seyler's Z. physiol.
Chem. 296, 19 (1954). — 68. MALMSTR M, R. G., Federat. Proc.
20, 60 (1961). — 69. VALLEE, B. L., Federat. Proc. 20, 71 (1961). —
70. PERRY, A. M. und H. A. SCHR DER, J. Chron. Dis. 2, 520
(1955). — 71. PERRY, A. M., Federat. Proc. 20, 254 (1961). —
72. FOREMAN, H., Metalbinding in Medicine, J. B. Lippincott
Comp., Philadelphia und Montreal (1960). — 73. MELTZER, L. E.,
J.R. KITCHELL und F. PALMON jr., Amer. J. Med. Sc. 242, 11
(1961). — 74. OKAMOTO, K., Tohoku J. Exper. Med. 61,
Suppl. III (1955). — 75. ALBERT, H., S. D. RUBBO, R. I. GOLDACER
und W. G. BALFOUR, Brit. J. Exper. Path. 28, 69 (1947). —
76. OKAMOTO, K., Acta Scholae med. Univ. Kioto 27,42 (1949). —
77. KADOTA, J., J. Laborat. Clin. Med. 35, 658 (1950). — 78.
KADOTA, J., O. MIDORI κ AWA, J. Laborat. Clin. Med., S.Louis
38, 671 (1951). — 79. WEITZEL, G., E. BUDDECKE, A. M. FRETZDORFF, F. J. STRECKER und U. ROESTER, Hoppe-Seyler's Z. physiol.
Chem. 304, l (1956). -— 80. SCHEINBERG, I. H. und A. G. MORELL,
J. Clin."" In vest. 36, 1193 (1957). — 81. SCHEINBERG, I. H. und
J. STERNLIEB, J. Pharmacol. Rcv. 12,355 (1960). — 82. HARRIS, H.,
Human Biochemical Senetics, Cambridge (1959). — 83. BEINERT,
H., D.E.GRIFFITH, D. C. WARTON und R.H.SANDS, J. biol.
Chemistry 237, 2337 (1962). — 84. UZMAN, L. L., Metalbinding
in Medicine, J. B. Lippincott Comp., Philadelphia und Montreal
(1960). —85. WALSHE, J.M., LANCET, London /, 25 (1956). —
86. WALSHE, J. M., Amer. J. Med. 21, 487 (1956). — 87. SCHEINBERG, I. H., Wilson's Disease, Blackwell, Oxford (1961). — 88.
SCHEINBERG, I. H. und I. STERNLIEB, Metalbinding in Medicine,
J. B. Lippincott Comp., Philadelphia und Montreal (1960). —
89. LANGE,!., Wilson's Disease, Blackwell, Oxford (1961). —
90. Wilson's Disease (Symposion), Blackwell, Oxford (1961);
Metalbinding in Medicine (Symposion), J. B. Lippincott Comp.,
Philadelphia und Montreal (1960). — 91. APOSHIAN, H. V. und
L. S. BRADHAM, Biochem. Pharmacol 3, 38 (1959). — 92. DULCE,
H.-J., Pers nliche Mitteilung. — 93. KUCHINSKAS, E. J. und
V. DU VIGNEAUD, Arch. Biochem. Biophysics 669 l (1957). —
94. DU VIGNEAUD, V., E. J. KUCHINSKAS und A. HORVATH, Arch.
Biochem. Biophysics 69, 130 (1957). — 95. SIEGMUND, P., In
Vorbereitung. — 96. KUCHINSKAS, E. J. und Y. ROSEN, Arch.
Biochem. Biophysics 97, 370 (1962). — 97. STRICKS, W. und
J. M. KOLTHOFF, Amer. ehem. Soc. 73, 1723 (1951). — 98.
STRICKS, W., J. M. KOLTHOFF, Amer. ehem. Soc. 73, 4511 (1951).
— 99. WALSHE, I. M., Wilson's Disease, Blackwell, Oxford (1961);
Metalbinding in Medicine, J. B. Lippincott Comp., Philadelphia
und Montreal (1960). — 100. APOSHIAN, H. V. und M. M. APOSHIAN, J. Pharmacol. exp. Therapeut. 126, 131 (1959). — 101.
WALSHE, I. M., Ann. Int. Med. 53,1090 (1960). —102. FIGUEROA,
W. G., Metalbinding in Medicine, J. B. Lippincott Comp., Philadelphia und Montreal S. 146 (1960). — 103. FOREMAN, H., Metalbinding in Medicine, J. B. Lippincott Comp., Philadelphia und
Montreal S. 82 (1960). — 104. R BEN, S., M. D. KAMEN, M. B.
ALLEN und P. NAHINSKY, J. Amer. ehem. Soc. 64, 2297 (1942). —
105. ATKINS, D. C. und C. S. GARNER, J. Amer. ehem. Soc. 74,3527
(1952). — 106. FISCHER, H., A. TREIBS und K. ZEILE, HoppeSeyler's Z. physiol. Chem. 195, l (1931). — 107. HEIKEL, G.,
W. H. LOCKWOOD und U. C. WINNINGTON, Nature (London) 182,
313 (1958). — 108. LOEW, M. B. und J. N. PHILIPS, Nature (London) 190, 262 (1961). — 109. ΥΟΝΕΥΑΜΑ,Υ., Η. ΟΗΓΑΜΑ,
Y. SUGITA und H. YOSHIKAWA, Biochim. biophysica Acta (Amsterdam) 62, 261 (1962). — 110. G NTHER, H., Erg. allg. Path. 20,
608 (1922). — 111. WATSON, C. J. und S. SCHWARTZ, J. Clin.
14*
108
Bfezina: Polarographische Methoden in der klinischen Chemie
Invest. 20, 440 (1941). — 112. WATSON, C. J. und E. A. LARSON,
Physiol. Rev. 27, 478 (1947). — 113. KROLL, .,
. KNELL,
J. POWERS und J. SIMONIAN, J. Amer. ehem. Soc. 79, 2024 (1957).
—- 114. BICKEL, H., G.E.HALL, W. KELLER-$CHIERLEIN, V.
PRELOG, E. VISCHER und A. WETTSTEIN, Helv. chim. Acta 43
2129 (1960). — 115. KORMAN, S., Ann. N. Y. Acad. Sc. 889 460
(1960). — 116. WARNER, R. C., Trans. N. Y. Acad. Sc., Ser. II
16,182 (1953). —117. WÖHLER, F., Med. Klin. 57,1370 (1962). —
118. WÖHLER, F. Verh. B, Kongr. Europ. Ges. Hämatolog., Wien
1961, Basel (1962).
Dozent Dr. rer. nat. Peter Siegmund
Physiologisch-Chemisches Institut der
Freien Universität Berlin
l Berlin 33, Arnimallee 22
Polarographische Methoden in der klinischen Chemie
Von
M. BREZINA
Aus dem Polarographischen Institut der Tschechoslowakischen Akademie der Wissenschaften^ Prag
(Direktor-. Prof. Dr. J. Heyrovsfy}
(Der Schriftleitung zugegangen am 2. April 1963)
Im Referat werden die Grundlagen der Polarographie und ihre Vorzüge kurz dargelegt. Im weiteren befaßt es sich
mit der Vorbereitung des biologischen Materials zur polarographischen Analyse. Unter den Bestimmungen der
anorganischen Bestandteile wird besonders der des Sauerstoffes große Aufmerksamkeit gewidmet. Bei den organischen Verbindungen werden neben den einfachen Verbindungen, wie Chinone, Aldehyde und Ketone, insbesondere die Bestimmungen verschiedener Alkaloide, Vitamine, Hormone und Enzyme erörtert. Abschließend
wird die Bedeutung der Polarographie für die Bestimmung der Sulfhydrylstoffe und der Proteine, z. B. mit Hilfe
der Brdicka-Reaktion, hervorgehoben.
The principles of polarography and its advantages are briefly presented. The preparation of biological material for
polarographic analysis is described. Determination of inorganic components is discussed and special reference
made to oxygen. Special mention is made of the determination of alkaloids, vitamins, hormones and enzymes,
besides the simple organic compounds like quinones, aldehydes and ketones. Finally, the significance of polarography in the determination of sulphydryl compounds and proteins, e. g., with the aid of the Brdicka reaction, is
discussed.
Die Polarographie ist eine elektrochemische Methode,
bei der die Abhängigkeit des durch die Untersuchungslösung fließenden Stromes von der an die Elektroden
angelegten Spannung verfolgt wird. Aus den so gewonnenen polarographischen Kurven kann man Auskunft sowohl über die qualitative als auch vor allem
über die quantitative Zusammensetzung der analysierten
Lösung gewinnen. Wegen ihrer Empfindlichkeit, Schnelligkeit und ausreichenden Genauigkeit wird die Polarographie des öfteren zur Analyse von biologischem Material herangezogen (1).
Die Meßelektrode muß in der Polarographie vollkommen
polarisierbar sein, d. h. ihr Potential soll der angelegten
Spannung genau entsprechen. Am häufigsten benutzt
man zu diesem Zweck die Quecksilbertropfelektrode.
Es war eben das Studium der elektrochemischen Vorgänge an dieser Elektrode, das J. HEYROVSKY im Jahre
1922 zur Entdeckung der polarographischen Methode
führte und für die ihm im Jahre 1959 der Nobelpreis
für Chemie verliehen wurde. — Die Quecksilbertropfelektrode besteht im wesentlichen aus einer Glaskapillare von 0,03—0,08 mm innerem Durchmesser
und etwa 10-—15 cm Länge, die durch einen Gummioder Kunststoffschlauch mit einem Quecksilberbehälter verbunden ist (Abb. 1). Das Quecksilber tropft aus
der Kapillare in konstanten Zeitintervallen in die
Analysenlösung ein. Die Länge dieser Zeitintervalle
(3—4 Sekunden) kann durch entsprechende Höhe des
Quecksilberbehälters reguliert werden. Die Oberfläche
der Quecksilbertropfelektrode wird immerfort erneuert,
so daß der Elektrodenvörgang an jedem weiteren
Quecksilbertropfen unter genau gleichen Bedingungen
wie am vorangehenden abläuft. Ein großer Vorteil der
Quecksilberelektrode liegt darin, daß die Wasserstoffionen, die in jeder sauren Lösung in großem Vorrat
vorhanden sind, an ihr bei viel negativerem Potential
reduziert werden als an Elektroden aus anderem
Material. In einigen Fällen, z. B. bei langdauernden
Z. klin, Chem. / 1. Jahrg. 1963 / Heft 4
Bfczina: Polarographische Methoden in der klinischen Chemie
109
sind zwei der geläufigsten in den Abbildungen 2 und 3
als Beispiel angeführt. Die Bezugselektrode kann man
durch einen Hahn oder durch eine Fritte von der zu
analysierenden Lösung abtrennen, doch muß man dabei
stets darauf achten, <daß der Widerstand des Gefäßes
mit der Untersuchungslösung nicht zu groß wird
(<500ß).
Abb. l
Prinzip der klassischen polarographischen Schaltung
M: Quecksilberbchälter; C: polarographisches Gefäß mit Kapillare und mit Platinkontakt; G: Galvanometer; E: Potentiometerdraht; S: Schleifkontakt; B: Akkumulator; A: Holzblock, I und II: Halteringe
Analysen, in biologischem Milieu, in welchem das
Quecksilber dem untersuchten System gegenüber als
Gift wirkt, muß man nach starren Meßelektroden greifen.
Als Material kommen hier Platin, Silber, Gold, Graphit
und mitunter auch einige Verbindungen in Frage. Diese
starren Elektroden können auch eine Bewegung ausführen, z. B. rotieren oder vibrieren, wodurch sie
wenigstens zum Teil von den abgelagerten Elektrolyseprodukten befreit werden. Gleichzeitig wird dadurch
auch die Konzentration des an der Elektrodenreaktion
teilnehmenden Stoffes annähernd auf den gleichen Wert
in der unmittelbaren Elektrodenumgebung wie im
Inneren der Untersuchungslösung gehalten.
Die wichtigste Eigenschaft der Be^tigselektrode muß ihre
Fähigkeit sein, während der polarographischen Analyse
ein möglichst konstantes Potential zu behalten. Bei rein
analytischen Arbeiten kommt es auf Abweichung von
einigen Zehnteln Volt nicht so sehr an, und man begnügt sich hier oft mit dem sog. Bodenquecksilber als
Bezugselektrode. Ihr Potential hängt von der Zusammensetzung des Grundelektrolyten ab. In Lösungen
von Chloriden kann man auch einen Silberdraht oder
eine Silberspirale als Bezugselektrode verwenden. Soll
aber das Potential, bei welchem der untersuchte Stoff
reduziert oder oxydiert wird, genauer ermittelt werden,
so muß man eine getrennte Kalomel- oder QuecksilberII-Sulfatelektrode als Bezugselektrode benutzen.
Das polarographische Gefäß wählt man je nachdem, wieviel Untersuchungslösung 2ur Verfügung steht, ob der
Luftsauerstoff aus der Lösung durch Stickstoff bzw.
Wasserstoff vertrieben werden muß oder nach anderen
speziellen Forderungen. Am häufigsten werden 0,5—S m/,
in Extremfallen auch 0,05 m/ Lösungen analysiert. Von
der großen Zahl der hierfür vorgeschlagenen Gefäße
2. klin. Chem. / 1. Jahrg. 1963 / Heft 4
Abb. 2
Semimikrogefäß (0,1—2 m/)
Abb. 3
Gefäß nach KALOUSEK
mit getrennter Bezugselektrode
Der Polarograph, d. h. das Gerät, das mit hinreichender
Genauigkeit und automatisch eine kontinuierlich wachsende Spannung an die Elektroden anlegt und die
gesuchten polarographischen Stromspannungskurven
selbsttätig aufzeichnet, ist im Laufe der Jahre wiederholt modifiziert worden. Heute wird er in vielen
Ländern von verschiedenen Herstellern fabrikmäßig
erzeugt. Für analytische Zwecke eignen sich am besten
die Tintenschreiber-Polarographen
(z. B. der Fa.
Laboratorni pfistroje, Prag — oder der Fa. Radiometer Kopenhagen), die die ursprünglichen Polarographentypen mit photographischer Registrierung
verdrängen. Die eigentliche polarographische Registrierung dauert etwa 3 Minuten. In manchen Fällen konnte
diese Registrierzeit durch Anwendung der oszillo-
Spannung
Abb. 4
Polarographische Stufen von Thallium, Cadmium, Zink und
Mangan in ammoniakalischer Lösung. Bestimmung der Halbstufenpotentiale. Messung der Grenzströme
Bfezina: Polarographische Methoden in der klinischen Chemie
110
graphischen Technik noch weiter verkürzt werden (2).
Die gesamte polarographische Kurve kann hier augenblicklich auf dem Leuchtschirm des Oszillographen
beobachtet werden.
Die polarographlscben Kurven zeigen sog. „Stufen"
(Abb. 4 und 5). Die einzelnen Stufen entsprechen
02 V
die Stufen haben, wenn die Lösung nicht bewegt wird,
die Form von spitzen Maxima, die „peaks" genannt
werden. Stromspitzen erhalten wir auch bei der Anwendung einer Quecksilberelektrode mit ruhender
Oberfläche und im wesentlichen auch bei der oszillographischen Technik, bei der die Spannung in einem
zeitlich viel kürzerem Impuls an die Elektroden
angelegt wird, als es die Tropfzeit ist (Abb. 6). —
Abb. 5
Anodische Stufe der Chloridionen und kathodische Stufe der
Thalliumionen. Eichpolarogramm
1.) 10 ml 0,1 n H2SO4 mit 0,1 m/ 0,5 proz. Gelatine im Gefäß
nach Kalousek mit Mercurosulfatbezugselektrode; 2—5.) jeweils
stets 0,5 ml 0,005 «-TICl-Lösung zugegeben, 200 mV/Abszisse,
Empfindlichkeit 1:50
der Reduktion oder mitunter auch der Oxydation verschiedener Lösungskomponenten an der Elektrode. Im
ersten Fall bezeichnet man sie als „kathodische Stufen",
im zweiten als „anodische". Aus der Höhe der Stufen
können wir die Menge der betreffenden Stoffe quantitativ
beurteilen und das Potential, bei welchem sie reduziert
oder oxydiert werden, gibt uns über die qualitativen
Eigenschaften Auskunft. Die jeweiligen Stufen werden
dabei stets durch das Potential an dem Ort charakterisiert, in welchem sie ihre halbe Höhe erreichen,
d. h. durch das „Halbstufenpotential" (Abb. 4). Enthält die Lösung mehrere polarographisch aktive
Stoffe, so können wir sie immer dann nebeneinander
bestimmen, wenn sich die Halbstufenpotentiale ihrer
Stufen genügend unterscheiden. Der polarographischen
Analyse liegt die Regel zugrunde, daß die Höhe der
Stufe mit zunehmender Konzentration des polarographisch aktiven Stoffes wächst (Abb. 6), und zwar in
vielen Fällen linear. Die Menge des gesuchten Stoffes
ermitteln wir durch Vergleich der Höhen seiner
in der Untersuchungslösung und in einer Standardlösung erhaltenen Stufen. Wenn wir nicht sicher
sind, daß die Konzentrationsabhängigkeit der Stufenhöhe linear ist, stellen wir aus mehreren Standardlösungen eine Eichkurve auf. Die polarographische
Kurve, die die elektrochemischen Vorgänge an der
Quecksilbertropfelektrode widerspiegelt, weist regelmäßige Zacken auf, die durch das wiederholte Anwachsen und Abfallen der Tropfen verursacht sind.
Während der Lebensdauer eines jeden Tropfens wächst
an ihm der Strom von Null auf ein Maximum an; der
Polarograph registriert aber nur kleine Stromänderungen
um den sog. mittleren Strom. Für analytische Zwecke
mißt man in der Regel die Mitte dieser Stromoszillationen. — Mit starren Elektroden erhält man begreiflicherweise zackenlose polarographische Kurven und
Abb. 6
Stromspitzen der Cadiumionen bei der Polarisation der tropfenden
Quecksilberelektrode mit dreieckigem Spannungspuls (0,8 V/sec.)
~·
Einer der großen Vorteile der Polarographie ist ihre
Empfindlichkeit. Polarographisch vermag man Stoffmengen bis hinab zu Konzentrationen von 100 §%
zu bestimmen, in einigen speziellen Fällen sogar noch
niedrigere.
Die Größe der polarographischen Stromes ist im wesentlichen
durch die Gesamtzahl der Elektronen bestimmt, die bei der
Elektrodenumwandlung des untersuchten Stoffes umgesetzt
werden. Demzufolge hängt sie davon ab, auf welche Weise die
unmittelbare Elektrodenumgebung mit dem polarographisch
aktiven Stoff versorgt wird. Für die Menge des Stoffes, der aus
dem Lösungsinneren zur Elektrode herankommen kann, um
dort Elektionen abzugeben oder aufzunehmen, ist im einfachsten
Fall seine Diffusion maßgebend. Der Grenzstrom, d. h. der Strom
bei dem Potential, bei dem die Höhe der polarographischen
Stufe einen bestimmten maximalen Grenzwert erteicht, wird in
diesem Fall Diffusionsgrenzstrom genannt. ILKOVIC hat für die
polarographischen Diffusionsströme eine Gleichung abgeleitet,
nach der ihre Größe der Konzentration des polarographisch
aktiven Stoffes proportional ist (Abb. 6). Mitunter wird die
Größe des Grenzstromes aber durch die Geschwindigkeit einer
chemischen Reaktion bestimmt, durch die der polarographisch
aktive Stoff gebildet wird. Einen solchen Strom nennt man einen
kinetischen Strom. In speziellen Fällen, bei denen die Reduktion
oder Oxydation einer Substanz durch den von uns unteisuchten
Stoff katalysiert wird, bezeichnet man sie als katalytische Ströme.
Hier muß man für die Analyse stets eine Eichkurve aufstellen, da
diese Grensztröme nicht immer linear mit der Konzentration des
zu bestimmenden Stoffes wachsen: unter gewissen Bedingungen
nähert sich die Eichkurve einem bestimmten Grenzwert. Manchmal können die polarographischen Ströme auch durch die Adsorption des polarographisch aktiven Stoffes bzw. auch anderer
Bestandteile der Lösung beeinflußt sein. — Eine etwas eigenartige Erscheinung sind die auf den polarographischen Kurven
auftretenden Maxima. Sie sind meist durch eine Strömung der
Lösung in der Umgebung der Tropfelektrode verursacht, durch
die mehr Teilchen an ihre Oberfläche herangebracht werden, als
sonst herandiffundieren könnten. Sofern diese Maxima die Messung
Z. klin. Chem. /1. Jahrg. 1963 / Heft 4
Brezina: Polarographische Methoden in der klinischen Chemie
der polarographischen Stufen stören, entfernt man sie durch
Zugabe grenzflächenaktiver Substanzen in die zu polarographierende Lösung, z. B. von 0,005% Gelatine. Größere Konzentrationen grenzflächenaktiver Stoffe können jedoch die Höhe der
polarographischen Stufen herabsetzen und ihre Gestalt beeinflussen.
Der erste Schritt bei der Anwendung der Polarographie
zur Analyse biologischen Materials ist dessen Vorbereitung bzw. Auflösung. Nicht selten genügt es, die
Probe nur mit dem Grundelektrolyten zu verdünnen.
Der Grundelektrolyt (von etwa 0,1 m Konzentration)
sorgt für eine hinreichende Leitfähigkeit der zu untersuchenden Lösung und verhindert praktisch die durch
den elektrischen Strom verursachte Wanderung des
polarographisch aktiven Stoffes zur Elektrode. Außerdem schafft er ein bestimmtes und konstantes Milieu
für den Ablauf der Elektrodenreaktionen, ohne welches
man manchmal keine reproduzierbaren und gut ausgebildeten polarographischen Kurven erhielte. Die
Komponenten des Grundelektrolyten dürfen aber nicht
leichter als der zu bestimmende Stoff reduziert bzw.
oxydiert werden.
Will man anorganische Stoffe im biologischen Material
bestimmen, so muß man diese zuerst auf trockenem
oder naßem Wege mineralisieren. Im ersten Fall verascht man die Probe in einem Ofen bei 500° und löst
den Rückstand in Salpeter- oder Salzsäure auf. Häufiger
schlägt man den zweiten Weg ein und mineralisiert das
organische Material in siedender Schwefelsäure, Salpetersäure und Perchlorsäure. In manchen Fällen reicht
für die Mineralisierung auf nassem Wege ein Gemisch
von Salpetersäure und Wasserstoffperoxyd aus. Für die
Wahl des Grundelektrolyten läßt sich keine allgemeine
Regel aufstellen. Es kommt vor allem darauf an, ob
anorganische Bestandteile anwesend sind, deren polarographische Aktivität die Bestimmung des von uns gesuchten Stoffes stören. In solchen Fällen wählt man einen
Grundelektrolyten mit KomplexbÜdnereigenschaften,
durch den die störenden Stoffe beseitigt werden. Je
fester der zwischen dem polarographisch aktiven Stoff
und einer der Komponenten des Grundelektrolyten gebildete Komplex ist, um so negativer ist das Potential,
bei dem er reduziert wird.
Sollen organische Verbindungen im biologischen Material
bestimmt werden, so kann man begreiflicherweise nicht
so drastische Methoden zur Vorbereitung der Probe
benutzen wie bei der Bestimmung anorganischer Bestandteile. Man wendet schonendere Mittel an," wie
Extraktion, Destillation, Dialyse, Chromatographie,
Elektrophorese u. ä. Manche organische Stoffe lösen
sich nur schwer in Wasser und hier müssen dann als
Lösungsmittel Alkohol, Dioxan, Aceton u. a. eingesetzt
werden. So wie bei den anorganischen Stoffen das
Komplexbildungsvermögen des Grundelektrolyten eine
große Rolle spielt, kommt es beim Polarographieren
organischer Verbindungen auf den pH-Wert der Lösung
an. pH-Änderungen beeinflussen nicht nur ihr Halbstufenpotential, sondern auch die Form und die Zahl
ihrer Stufen.
Z. klin'. Chem. / 1. Jahrg. 1963 / Heft 4
111
Von den anorganischen Stoffen können fast alle Elemente
in ihren verschiedenen Oxydationsstufen polarographisch bestimmt werden. In der Toxikologie bewährt
sich die Polarographie vor allem zur Bestimmung von
Blei, Thallium und Arsen. Nach der Verabreichung von
Arzneimitteln, die Gold (3, 4), Wismut oder Antimon enthalten, konnte die Ausscheidung dieser Metalle im
Harn verfolgt werden (Abb. 7). Bei der Bestimmung
/0ml 2.N KOH
Abb. 7
Goldbestimmung im Harn
geringfügiger Mengen von Metallen, die ein Amalgam
mit Quecksilber bilden, läßt sich die Empfindlichkeit der
Polarographie noch durch die Anwendung einer speziellen Elektrode in . Form eines hängenden Quecksilbertropfens, z. B. in der Anordnung nach VOGEL,
erhöhen (5). Man kann hier das gesuchte Metall eine
Zeit lang bei konstantem Potential in die Elektrode
abscheiden und es dann aus der Stufe der Auflösung
des gebildeten Amalgams bestimmen. — Unter den
nichtmetallischen Stoffen können vor allem die Chloride
leicht polarographisch gefaßt werden. Im klinischen
Laboratorium bewährt sich diese sehr einfache Methode
besonders zu ihrer Bestimmung in Harn, Serum oder
anderem biologischem Material. Bei der Harn- oder
Serumanalyse genügt es, die Probe nur mit 0,1 n H2SO4
zu verdünnen, wonach man sie sofort polarographieren
kann (Abb. 8). — Besonders vorteilhaft ist die Polarographie zur Bestimmung von Sauerstoff in verschiedenen Körperflüssigkeiten und in der Luft. Der
Blutsauerstoff, der an das Hämoglobin gebunden ist,
wird am besten nach seiner Freisetzung durch Cyano-
112
Bfezina: Polarographische Methoden in der klinischen Chemie
Atmosphäre wurden polarographische Daueranalysatoren konstruiert (7).
Zu den leicht bestimmbaren organischen Verbindungen
gehören vor allem die Chinone. Sie geben eine sehr gut
entwickelte Reduktionsstufe. Nach der chemischen
Reduktion der Chinone entstehen ebensogut entwickelte
Oxydationsstufen der Hydrochinorie. Als Beispiel
können wir hier die Bestimmung der Homogentisinsäure (7) im Serum und Harn anführen (Abb. 10). —
diluted urine
with 0,1\\ HgSOi
Abb. 8
Chloridbestimmung im Harn. Der Harn wurde 1000 mal bzw.
40 mal (in Bild = x) mit 0,1 n H2SO4 verdünnt und polarographiert
ferrat (III) bestimmt. Man polarographiert dazu zuerst
die Grundlösung, die aus 5m/ 0,004 * K3Fe(CN)6,
0,05 m Na2B4O7, 0,05 m KC1, 0,1% Saponin und 0,1%
Gelatine besteht. Als Bezugselektrode benutzt man
einen Silberdraht. Dann überschichtet man den Grundelektrolyten mit einer etwa 5 mm hohen Paraf finölschicht
und setzt der Lösung 0,05 bis 0,25 m/ des zu untersuchenden Blutes zu (je nach dem Sauerstofigehalt).
Nachdem man die Lösung vorsichtig gerührt und etwa
5 Minuten abgewartet hat, nimmt man nochmals das
Polarogramm auf. Der Sauerstoffgehalt wird dann aus
der Differenz zwischen den Summen der Höhen
beider Sauerstoffstufen in der Lösung mit und ohne
Blut ermittelt (Abb. 9). — Zum Studium der experimentellen Atherosklerose hat sich der Sauerstoff-Daueranalysator nach SERA bewährt (6). Das Gewebe, z. B.
ein Stück Gefäßwand, wird auf eine von Nährlösung
umspülte Cellophanmembrane gelegt. Polarographisch
wird dann mehrere Tage lang die Abnahme des Sauerstoffes in der Nährlösung kontinuierlich verfolgt, den
das überlebende Gewebe verbraucht. — Auch zur Bestimmung von Koblenmonoxyd und Schwefeldioxyd in der
Abb. 10
Homogentisinsäurebestirnrniing in alkaptonurischem Harn
1) AcetatpufFer pH = 4,7;
2) 2 · 10 ~4 Mol Homogentisinsäure zugegeben;
3—5) drei Harnproben von einem Patienten
Weniger typische und manchmal auch schlechter ablesbare Stufen liefern dagegen die Halogenverbindmgen
und die ungesättigten Kohlenwasserstoffe. Unter den Halogenderivaten konnten vor allem Insektizide, Thyroxin
und 3,5-Dijodtyrosin bestimmt werden. — Von den
Aldehyden sind fast sämtliche polarographisch aktiv.
Insbesondere die ungesättigten und die aromatischen
Aldehyde geben gut entwickelte Stufen. Zu den komplizierten Aldehyden, die polarographisch bestimmt
wurden, gehört z. B. Streptomycin. — Kef one sind nur
dann polarographisch bestimmbar, wenn sie eine
Doppelbindung in -Stellung zur Ketogruppe enthalten.
Alle übrigen Ketone müssen vorher in die Imine,
Semicarbazone oder Hydrazone überführt werden. —
Sehr vorteilhaft ist die Polarographie zur Analyse von
biologischem Material auf seinen Gehalt an Nitrokörpern
bzw. an Verbindungen, die sich leicht nitrieren lassen.
So konnte man im Blut, Harn, im Atem und in der
Atmosphäre eine Reihe von Nitroverbindungen sowie
Benzol und dessen Homologe bestimmen. — Unter
öden Alkaloiden können diejenigen polarographisch geAbb. 9
faßt werden, die einen Chinolin-, jsochinolin- oder
Bestimmung des chemisch gebundenen Sauerstoffes im Blut
Pyridinring enthalten (Abb. 11), und weiter jene, die in
nach Freimachung mit Hexacyanoferrat (III)
der Seitenkette eine leicht reduzierbare Gruppe tragen,
1 = Grundlösung 0,004 m Hexacyanoferrat ( ), 0,05 »-Na2B4O7,
wie
z. B. eine Aldehydgruppe oder eine mit einer
% 0,05 w-KCl, 0,1% Saponin, 0,1% Gelatine;
Doppelbindung
konjugierte Ketogruppe. Einige Alka2 =-mit arteriellem Blut (20,5 Vol % Sauerstoff);
loide,
z.
B.
die
der Morphingruppe, sind als Nitro3 = mit luftgesättigtem Blut (21,3 Vol % Sauerstoff)
derivate
bestimmbar.
— Die Vitamine wurden fast alle
Kurven von 0,0 V angefangen (gegen AgCl-Elektrode), 200 mV/
polarographisch
untersucht.
Analytisch am besten beAbszisse, Empfindlichkeit 1:100
Z. klin. Chemf / 1. Jahrg. 1963 /'Heft 4
Polarographische Methoden in der klinischen Chemie
113
Verbrauch an Titrotionsmitfel {ml)
Abb. 11
Eichpolarogramm des Chinins. Zu 10 m/ 0,2 -LiOH wurden
jeweils 0,1 m/ 0,003 Mol Chininlösung zugegeben. Die erste
Stufe hat einen Adsorptionscharakter. Von 0,6V angefangen,
200 mV/Abszisse, Empfindlichkeit 1:20
Polarometrische Titrationskurve. Diagramm für den Fall, daß
der titrierte Stoff bei der gewählten Spannung keinen polarographischen Strom liefert, sondern nur das Titrationsmittel
währt haben sich die Methoden zur Bestimmung von
Vitamin C, B2> K und E. — Von den Steroidhormonen
konnten die S-Keto-^J-S-steroide nach ihrer Extraktion
aus Harn, Blut und anderem biologischem Material
polarographisch direkt bestimmt werden (z. B. Testosteron, Progesteron). Androsteron und die übrigen
Ketosteroide, die keine zur Doppelbindung konjugierte Ketogruppe enthalten, müssen vor dem Polarographieren im sauren Milieu (konz. Essigsäure) mit
Girard-Reagens (Betainylhydrazid oder Dimethylglycylhydrazid) auf dem Wasserbad etwa 3 Minuten gesiedet werden, um die Ketone in die Hydrazone zu
überführen. Die polarographische Analyse wird dann
am besten bei einem pH-Wert von etwa 4,5 durchgeführt. — Einige En-^jme enthalten selbst eine polarographisch aktive Gruppe (so die Enzyme mit Porphyrinkern); andere bestimmt man auf Grund ihrer Wirkung
auf ein polarographisch aktives Substrat (z. B. Aldehydoxydase, Proteinasen). —=- In den letzten Jahren wurden
den Sulfhydrylverbindungen in der Polarographie große
Aufmerksamkeit gewidmet. Einige einfache SH-Verbindungen (z. B. Cystein, Cystamin, Glutathion) können mit Hilfe ihrer anodischen Stufen bestimmt werden,
Disulfidverbindungen (z. B. Cystin, Cystamin) mit Hilfe
ihrer kathodischen Wellen. Sehr oft wird zur Bestin>
mung der Sulfhydrylgruppe^ auch in komplizierten
Eiweißkörpern, die sog. polarometrische (amperometrische) Titration angewandt (9). Die Sulfhydrylgruppen bilden mit manchen Stoffen, meist mit MetallIonen, feste Komplexe. Demzufolge beobachtet man
in Lösungen von Sulfhydrylverbindungen die polarographischen Stufen dieser Komplexbildner erst dann,
wenn sie im Überschuß vorliegen. Bei den polarometrischen Titrationen braucht man nicht die gesamte polarographische Kurve aufzunehmen, sondern es genügt,
den durch die Lösung fließenden Strom bei einem
bestimmten Potential zu messen, bei dem in Abwesenheit der Sulfhydrylverbiridung der Reduktionsgrenzstrom des Titriermittels erreicht wäre. Aus zwei Punkten
vor und zwei Punkten nach dem Überschreiten der
Äquivalenzkonzentration des zugesetzten Titriermittels
konstruiert man das Titrationsdiagramm (Abb. 12).
Aus diesem kann man leicht die Menge des Komplexbildners ermitteln, die zur Bildung des Komplexes erforderlich-ist. Bei dem von uns angelegten Potential
ist dieser Komplex nicht polarographisch aktiv. Als
Titriermittel gebraucht man am häufigsten Silber- oder
Quecksilber(I)-salze, als Meßelektrode eine rotierende
Platinelektrode. Sehr kleine Konzentrationen (bis zu
\
%) einiger Sulfhydrylverbindungen (z. B. Cystein)
und Proteine mit Sulfhydrylgruppen können mit Hilfe
der sog. katalytischen BaDiCKA-Stufen bestimmt werden
(10, 11). Sie entwickeln sich am besten in gut gepufferten ammoniakalischen Kobalt- oder Nickellösungen
(pH ~ 9). Es handelt sich hier im wesentlichen um die
Stufen der Wasserstoffionen, deren Reduktion aus dem
Puffer durch einen zwischen dem katalytisch aktiven
Stoff und dem Kobalt bzw. dem Nickel ausgebildeten
Komplex katalysiert wird. Zur analytischen Bestimmung
von Cystein und einfacheren SH-Verbindungen benutzt
man als Grundlösung 0,001 m CoCl2, 0,1 n NH3, NH4C1,
zur Bestimmung von Proteinen dagegen 0,001 Co(NH3)6C13, 0,1 m oder l m NH3, 0,1 n NH4C1. Cystein
und ähnliche niedermolekulare Sulfhydrylverbindungen
geben nämlich in. Lösungen von dreiwertigem Kobalt
einen weitaus niedrigeren katalytischen Effekt als in
Lösungen von zweiwertigem Kobalt. — Mit Hilfe dieser
katalytischen Wellen vermag man den Cystingehalt in
den verschiedensten biologischen Substanzen zu bestimmen, und zwar entweder als freies Cystin oder nach
Hydrolyse der Proteine. Da einige der anwesenden
Aminosäuren das Cystin aus dem polarographisch
aktiven Komplex verdrängen könnten, bereitet man die
Standardlösung am besten so, daß man der zu untersuchenden Lösung eine bekannte Cystin-Lösung zusetzt.
Auch zur Bestimmung der Ehveißstoffe wurden oft ihre
katalytischen BRDiCKA-Stufen herangezogen, so bei der
Analyse von Blut, Rückenmarkflüssigkeit, Speichel,
Milch und Harn. Mit Hilfe dieser Methode vermag man
jedoch die einzelnen, polarographisch aktiven Eiweißarten nicht zu unterscheiden. Man muß sich aber vor
Z. klin. Chem. / 1. Jahrg. 1963 / Heft 4
Abb. 12
15
114
Bfezina: Polarographische Methoden in der klinischen Chemie
Augen halten, daß auch verschiedene Proteine bei
gleicher Gewichtskon2entration verschieden hohe katalytische Wellen geben können. Vor der polarographischen Analyse kann man die Eiweißstoffe durch Papierelektrophorese trennen. Auf jeden Fall muß die Polar ographie der Eiweißstoffe als eine besondere Art der
Analyse angesehen werden, die man nicht ohne weiteres
mit den übrigen Bestimmungsverfahren vergleichen
kann. Da uns die polarographische Methode aber vor
allem ein Bild über die Menge der Sulfhydrylgruppen
gibt, die in den Proteinen oft eine erstrangige Rolle
spielen, sind die polarographisch gewonnenen Ergebnisse nicht selten aufschlußreicher als die mit anderen
Methoden erhaltenen Werte. — Das Wesen der sog.
BRDiCKA-Filtratreaktion ist die polarographische Analyse
des Filtrates des alkalisch denaturierten und mit Sulfosalicylsäure enteiweißten Serums. Bei an Krebs und
Entzündungen Erkrankten und besonders bei Personen,
die Verbrennungen erlitten haben, konnte im Sulfosalicyl-Filtrat des Serums eine wesentliche Vermehrung
der polarographisch aktiven Eiweißstoffe beobachtet
werden. Im Serum von Personen, die an Hepatitis
erkrankt sind, ist dagegen die BRDiCKA-Filtratreaktion
wesentlich niedriger als in dem von Gesunden. Die
BRDiCKA-Filtratreaktion wurde auch zur Analyse des
Harns angewandt (12). Sie ist hier ebenfalls bei Personen,
die an Krebs und Entzündungen erkrankt sind, positiv.
Besondere Aufmerksamkeit wurde der polarographischen Analyse des mit Sulfosalicylsäure bzw. Wolframsäure entweißten Harns von Personen gewidmet,
die Verbrennungen erlitten haben. Bei diesen Erkrankten steigt der Gehalt an polarographisch aktiven Stoffen
in dem mit Sulfosalicylsäure bzw. Wolframsäure entweißten Harn am stärksten in den ersten fünf bis
zehn Tagen nach dem Unfall (Abb. 13). Der Anstieg
f
I
t
I
\\
\
1
1
1
1
***** -5 *#* J *·**
/
!1 'f
\
\
h·
{·
\(
I
}
1
1
I
V \'
J3 V,
*tt#*
1
·*
I
I
1 J
\ »? ' "
1
1
1
I
1
##»
W
M
'»
<
'\y
\
I
1
^
l
,v
I
J
.
4
ww^ WyWM*
Abb. 13
Analyse der Sulfosalicylsäure-Deproteinate des Harns am 3., 4., 7.,
8., 9. Tage (Kurven 2—6) nach der Verbrennung (III. Grad,
27%). Kurve l: Kobalt (III)-Testlösung nach BRDICKA ohne Harn
der polarographischen Aktivität hängt vom Ausmaß
und vom Grad der Verbrennung ab; sie wächst auch
nach Operation und klinischer Behandlung (13).
Begreiflicherweise ist auch die polarographische Methode, so wie alle anderen, nicht universell. Man wird
sie also nur dort anwenden, wo ihre Vorteile zur Geltung
kommen. Zum Schluß möchte ich noch auf den Beitrag
hinweisen, den die Polarographie in der Grundlagenforschung der biologischen Reaktionen bringen kann.
Da der Begründer der Polarographie, HEYROVSKY, und
seine Schule mit BRDICKA an der Spitze vor allem
Physikochemiker waren und die ersten Arbeiten im
Institut für physikalische Chemie der Prager KarlsUniversität geschaffen wurden, blieb die Polarographie
nicht nur eine analytische Methode, sondern wandte
sich auch dem physikalisch-chemischen Studium der in
der Untersuchungslösung ablaufenden Reaktionen und
Elektroderivorgängen zu.
Literatur
1. BREZINA, M. und P. ZUMAN, Die Polarographie in der Medizin,
Biochemie und Pharmazie, AVG-Leipzig (1956). — 2. VOGEL, J.,
Progress in Polarography, Vol. 2, S. 429, Interscience Publ.,
New York (1962). — 3. LINHART, F., Chem. Listy 55, 552 (1961);
Cas. lek. öesk. 47, 1298 (1953). — 4. KASSOWITZ, J. und M. KuTOVA, Fysiatr. vSstnik 39, 165 (1961). — 5. ÄIHA, J., Progress in
Polarography, Vol. 2, S. 383, Interscience Publ., New York
(1962). — 6. §ERAK, L., Advances in Polarography, Vol. 3, S. 1057,
Pergamon Press, London (1960). — 7.
, J. V. A., Progress
in Polarography, Vol. 2, S. 569, Interscience Publ., New York
(1962). — 8. JIRKA, M. und Mitarb., Collect, czechoslov. ehem.
Commun. 20, 1131 (1955); Cas. lek. £esk. 97, 237 (1958). — 9.
KOLTHOFF, I. M., Analytica chim. Acta 2, 606 (1948). — 10.
BRDICKA, R., Z. physik. Chem. (Leipzig), Sonderheft, S. 165
(1958). — 11. BREZINA, M., Mber. dtsch. Akad. Wiss. Berlin
(1963). Im Druck. — 12. BREZINA, M., Rev. of Polarography
//, 27 (1963). — 13. SAFRÄNKOVA, B. und M. BREZINA, Acta
chir. plasticae 4, l (1962).
Dr. M. Brezina
Polarographisches Institut der
Tschechoslowakischen Akademie
der Wissenschaften
Prag l, Opletalova 25
Z. klin. Chem. /1. Jahrg. 1963 / Heft 4